|
|
||||||||||
|
химерные антибиотики на основе азитромицина и гликопептидных антибиотиков, обладающие антибактериальной активностью, и способ их получения. Патент антибиотикНовый антибиотик имбрицин
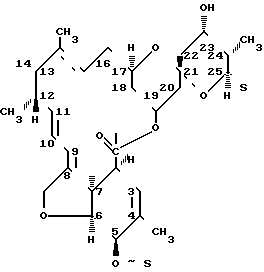
В фЯ.„ В вн. - т нефф (ОП ИСАНИЕ ИЗОБРЕТЕН ИЯ Союз Советскнн Социалнстккесккв Респубпкк 420258 К АВЕОРСКОМУ СВИДЕТЕЛЬСТВУ (б1) Зависимое от авт. свидетельства— (22) Заявлено24. ОЯ,7$ (21)Я 96373/3Я (И) M. Кл. Е Гасуднрстаенны и наннтет Саввтв Мнннстрав СССР аа делам нзааретеннй н аткрытнй (32) Приоритет— ОпубликованоП5, $$,ßÁþëëåòåíü ¹ .ф дата опубликования описания 5 2 74 (>) дк 615 779. .937(088.H) А.П.Башкович, Е.С.Эимнухова, А.В.Прокопович (72) АвтоРы Д A ть,ган q ульб х т И т(Ц A g, ф И.А.Острая и Л.Я.Петрова (7() Заявитель ЛЕНИНГрадсКИй НауЧНО-ИССЛЕдОВатЕЛЬСКИй ИНСтитут антибиотиков СПОСОБ ВЫДЕЛЕНИЯ ИМБРИЦИНА Изобретение относится к антйбиотикям. Способ получения иибрицина в патентной литературе не описан. Цель настоящего изобретения— создание способа выделения, очистки и модификации нового антибйотика имбрицина, позволяющего получать антибиотические препараты высокой степени чистоты с удовлетворительным выходом, а также получать водорастворимйе формы антибиотика. Поставленная циль достигает- ь ся тевы, что мицелий отмывают теплой водой, экстрагируют водным ацетоном, осветляют экстракт активированнйм углем, отгоняют ацетон, экстрагируют н-бутанолом, частичфо 20 упаривают экстракт, отделяют выпавшие при охлаждении примеси и выделяют целевой продукт осаждением ацетоном в свободном виде или в виде комплексов с поливинилпирролидо- ю 2 ном или солью Рейнеке. Пример . Вццеленж имбрицина из мицелия - е т . - с-с - - с Получают 72 кг мицелрт с активностью А-I6,0 ед/мг. Мицелий дважды промывают водопроводной водой, подогретой до S50c, в соотношений Х:2 в течение ЗО мйн. Затем мицелий отделяют от промывных вод на друкильтре и передают на экстракцкю. кстракцию прово ят 2ХО мл 8(g-го водного ацетона в соотношении Х:3 / в течение О мин. К отфильтрованному от мицелия ацетоновому экстракт добавляют активированный уголь ОУ вЂ” марки А; Х,53 объема., экстракта, перемешивают в течение 47 мин, Отфильтровывают на нутч-филь тре, после фильтрации получают светло-желтый раствор. Осветленный ацетоновый экстракт вжаривают под вакуумом при температуре обогрсваюФей воды 40 С до прекращения отгона ацетона. Оставшийся водный слой экс420258 Составитель T ОЛОВИНа техред Б Ориица корректоры: РелеИСелеВ®, Редактор BДмельянова Заказ ЯЯф Изд. уй Я Тираж Ô 6 11одписиое ЦНИИПИ Государствениого комитета Совета Министров СССР по делам изобретений и открытий Москва, 113035, Раушская иаб., 4 11рсдприятие «Патент», Москва, Г-59, Бережковская иаб., 24 трагируют .1.ОО л н-бутанола в соотно- ногО имбриЦнна с поливинилпиЩ)б ШЕНИИ 1:1 В т8ЧВНИ8 Х5 МИНее ЛИДОНОМе ° После расслаиванйщ нижний О 54 r преперата с активносслой отделяют и отбрасывак}т,верх- тью ЯЙ ед/мг растворяют В I2 мл ний слой упаривают под В ом 5, диметилфо а, раствор нагре1В 5 раз до концентрации 5О- ОООО вают до 6 ОО на водяной. бане и 18д/мл. затем концентрат охлаждают при перемешивании добавляют Х,Л г В холодильнике до 4ус; выпавший ноливинилпирролидона, перемешивают осадок отфильтровывают и отбрасы- при нагревании 30 мий. Затем раствт, и медленно Блат zoHU8HT- 1О вор сада и осадют poro мкаелвя получают 480 г по- 1 ВОЛе растворяют в палачества оомг ошка с биологической активностъю /мл. Выход 75Ф. 6О ед/мг. Выход от мицелия 4ОЯ. ПРЕЛ@ ИЗОБрЕРЕщд ката имбрицина. Пример Q o oПолучение рейне, способ В елени О 6,6ã.àíòèáèîòèêà с активностью О т л и ч а ю шийся тем,что, 64 ед/мг растворяют в 30 мл ме- — и „ „ „ и с ™р и зкстрагируют Водным ацетоном, ос аждают с рным ы углем, отгоняют ацетон, экстрагиФЩ"Щ "Ф ж POOBBmmmmT ВЫСУ - ру Й бу..ЛОМ, Чаотв О у р акуум сушильном @у при вают экстракт отделяют выпавшие комнатной температуре. Получают 8 5 r препарата с активностью ЯО ед/ р ц(@ Р, Цел8вой продукт Осаждением ацетО30 нем В свободном виде или В Виде КОмпл8кс ОВ с поливинилпирролидоПример 3. Пощ чение производ- ном или солью Рейнеке. www.findpatent.ru химерные антибиотики на основе азитромицина и гликопептидных антибиотиков, обладающие антибактериальной активностью, и способ их получения - патент РФ 2578604Изобретение относится к новым производным азитромицина и способу их получения, которые могут найти применение в фармацевтической промышленности и медицине. Предложены соединения, соответствующие формуле 2 , где n=1-10, a R - остаток ванкомицина, эремомицина или агликона тейкопланина. Способ получения соединений формулы 2 включает проведение реакции ацилирования 11-O-( -аминоалкилкарбамоил)азитромицина (6) гликопептидным антибиотиком (эремомицином, или ванкомицином, или агликоном тейкопланина) в присутствии конденсирующего агента. 2 н.п. ф-лы, 4 ил., 2 пр., 2 табл. Рисунки к патенту РФ 2578604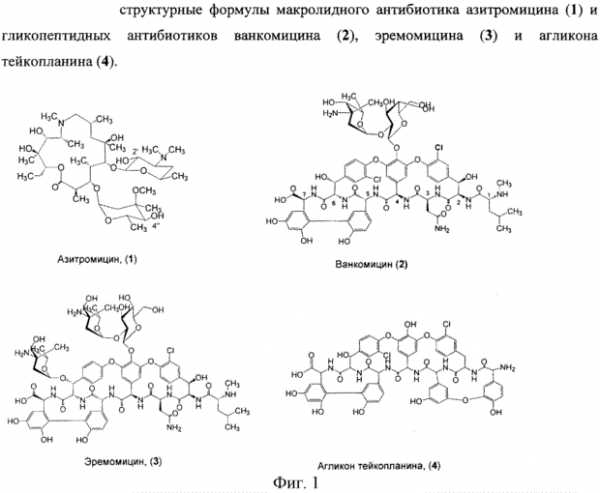 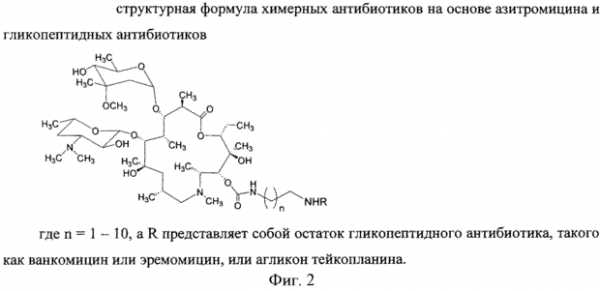 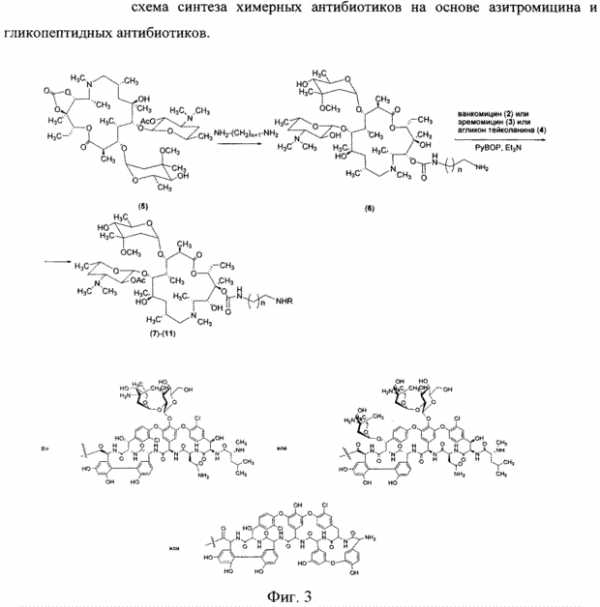 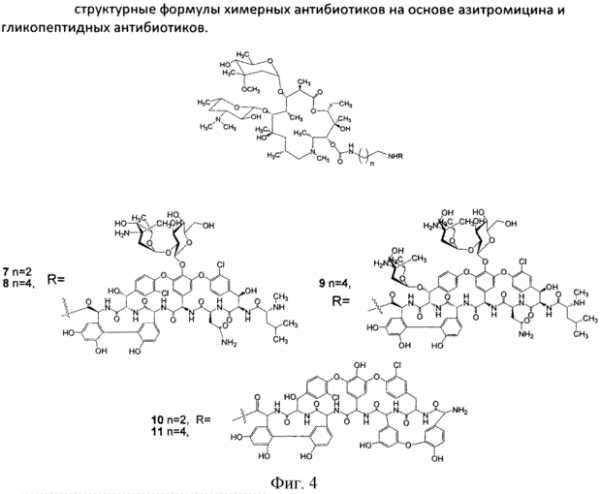 Изобретение относится к фармацевтической промышленности и касается новых производных на основе антибиотика азитромицина и гликопептидных антибиотиков, и способа их получения. Азитромицин (1) (Фигура 1) является полусинтетическим антибиотиком, первым представителем подкласса азалидов, несколько отличающихся по структуре от классических макролидов, основу химической структуры которых составляет макроциклическое лактонное кольцо. Получен модификацией 14-членных макролидов путем включения атома азота в лактонное кольцо между 9 и 10 атомами углерода, кольцо при этом превращается в 15-членное. Данная структурная перестройка обусловливает значительное повышение кислотоустойчивости препарата - в 300 раз по сравнению с эритромицином. Антибиотик широкого спектра действия действует бактериостатически. Связываясь с 50S-субъединицей рибосом, угнетает пептидтранслоказу на стадии трансляции, подавляет синтез белка, замедляет рост и размножение бактерий, в высоких концентрациях оказывает бактерицидный эффект. Действует на вне- и внутриклеточных возбудителей. Неактивен в отношении грамположительных бактерий, устойчивых к эритромицину. Обладает уникальной по сравнению с другими макролидами способностью накапливаться в органах и тканях. Азитромицин активно поглощается разными клетками, включая лейкоциты, фибробласты, макрофаги и фагоциты, и вместе с ними транспортируется к месту инфекции (воспаления) [Lalak N.J., Morris D.L., Azithromycin Clinical Pharmacokinetics, Clinical Pharmacokinetics, 1993, V. 25, P. 370-374; Gladue R.P, Bright G.M., Isaacson R.E., Newborg M.F. In vitro and in vivo uptake of azithromycin (CP-62,993) by phagocytic cells: possible mechanism of delivery and release at sites of infection. Antimicrobial Agents Chemotherapy, 1990, V. 34, P. 1056-1060]. Азитромицин относится к тканевым антибиотикам, так как его концентрации в сыворотке крови значительно ниже тканевых. Он хорошо распределяется в организме, создавая высокие концентрации в различных тканях и органах (в том числе в предстательной железе), особенно при воспалении. При этом азитромицин проникает внутрь клеток и создает высокие внутриклеточные концентрации. Метаболизируется в печени при участии микросомальной системы цитохрома Р-450, метаболиты выводятся преимущественно с желчью. Период полувыведения азитромицина 55 ч. При почечной недостаточности этот параметр не изменяется [Практическое руководство по антиинфекционной химиотерапии. НИИАХ СГМА. 2007. Под редакцией Л.С. Страчунского, Ю.Б. Белоусова, C.H. Козлова]. Ванкомицин (2) представляет собой трициклический гептапептид, к которому присоединен дисахарид, состоящий из аминодезоксисахара (ванкозамина) и D-глюкозы (формула 1) [Sztaricskai F., Pelyva s-Ferenczik I.. Chemistry of carbohydrate components. In Glycopeptide Antibiotics, 1st edn (Ed. Nagarajan R.), 1994, Marcel Dekker, New York, NY, USA.]. Эремомицин (3) - оригинальный отечественный антибиотик, агликон которого отличается от агликона ванкомицина отсутствием атома хлора в боковом ароматическом радикале аминокислоты 6, структурой дисахаридной цепи (2-(O-( -L-эремозаминил)- -D-глюкопиранозил) и наличием третьего углеводного остатка (L-эремозаминил) в боковом радикале аминокислоты 6 (формула 1) [Gause G.F., Brazhnikova M.G., Lomakina N.N., Berdnikova T.F., Fedorova G.B., Tokareva N.L., Borisova V.N., Batta G. Eremomycin - new glycopeptide antibiotics. Chemical properties and structure. J. Antibiotics, 1989, V. 42, P. 1790-1799]. Агликон тейкопланина (4) представляет собой гептапептид, в котором в отличие от агликонов ваномицина и эремомицина, боковые радикалы аминокислот 1 и 3 являются ароматическими и соединены между собой эфирной связью (формула 1). Ванкомицин применяется в клинической практике с 1958 г., тейкопланин - с середины 80-х годов. В последнее время интерес к гликопептидам возрос в связи с увеличением частоты нозокомиальных инфекций грамположительными микроорганизмами. Гликопептиды активны в отношении грамположительных аэробных и анаэробных микроорганизмов, включая метициллин-устойчивые Staphylococcus aureus (MSRA), метициллин-устойчивые Staphylococcus epidermidis (MRSE), стрептококков, пневмококков (включая АРП), энтерококков, включая резистентных к ампицилину и аминогликозидам, пептострептококков, листерий, коринебактерий, клостридий (включая С. difficile). Грамотрицательные микроорганизмы устойчивы к гликопептидам. Гликопептиды нарушают синтез клеточной стенки бактерий. Оказывают бактерицидное действие, однако в отношении энтерококков, некоторых стрептококков и коагулазонегативных стафилококков действуют бактериостатически. Гликопептиды практически не всасываются при приеме внутрь. Биодоступность тейкопланина при внутримышечном введении составляет около 90%. Гликопептиды не метаболизируются, выводятся почками в неизмененном виде, поэтому при почечной недостаточности требуется коррекция доз. Препараты не удаляются при гемодиализе. Период полувыведения ванкомицина при нормальной функции почек составляет 6-8 ч, тейкопланина - от 40 ч до 70 ч. Длительный период полувыведения тейкопланина дает возможность назначать его один раз в сутки [Практическое руководство по антиинфекционной химиотерапии. НИИАХ СГМА. 2007. Под редакцией Л.С. Страчунского, Ю.Б. Белоусова, C.H. Козлова]. По спектру антимикробной активности ванкомицин и тейкопланин сходны, однако имеются некоторые различия в уровне природной активности и приобретенной резистентности. Их успешное применение в клинике поставлено под угрозу распространением устойчивых к ванкомицину грамположительных бактерий: энтерококков (VRE) и ванкомицин-резистентных Staphilococcus aureus (VRSA) [Mendez-Alvarez S., Perez-Hernandez X., Claverie-Martin F. Glycopeptide resistance in enterococci // Internat. Microbiol. - 2000. - V. 3. - P. 71-80; Cetinkaya Y., Falk P., Mayhall C.G. Vancomycin-resistant Enterococci // Clin. Microboil. Rev. - 2000. - V. 13. - P. 686-707]. Штаммы VRE, и в особенности VRSA, устойчивы к подавляющему большинству применяемых антибиотиков, и поэтому распространение таких микроорганизмов представляет очень серьезную проблему. Широкое распространение резистентности к антибиотикам среди возбудителей заболеваний привело к утрате клинической значимости ряда лекарственных препаратов и послужило стимулом для поиска новых эффективных антимикробных агентов. Одной из перспективных стратегий, направленной на создание препаратов, активных в отношении резистентных микроорганизмов, является создание антибиотиков двойного действия - «химерных» антибиотиков. Они состоят из молекул разных антибиотиков, связанных между собой различными способами через так называемые «спейсеры». Они обладают расширенным спектром действия по сравнению с исходными антибиотиками и замедляют развитие антибиотикорезистентности. Настоящее изобретение призвано получить антибиотики двойного действия на основе макролидного антибиотика азитромицина и гликопептидных антибиотиков, обладающие антибактериальной активностью. Объединение в одной молекуле азитромицина с другим антибактериальным агентом потенциально может расширить спектр действия полученного химерного антибиотика по сравнению со спектрами действия исходных антибиотиков. Фармакокинетические свойства такого химерного антибиотика могут превосходить фармакокинетические свойства второго антибактериального агента, использованного для его синтеза. Гликопептидные антибиотики выбраны в качестве второго антибактериального агента при синтезе химерных антибиотиков на основе азитромицина, поскольку они активны в отношении грамположительных аэробных и анаэробных микроорганизмов и являются препаратами выбора при инфекциях, вызванных широко распространенными в клиниках резистентными грамположительными бактериями. Изобретение включает соединения, соответствующие структурной формуле, изображенной на фигуре 2, где n=1-10, a R представляет собой остаток гликопептидного антибиотика, такого как ванкомицин, или эремомицин, или агликон тейкопланина. Изобретение также включает в себя способ получения антибиотиков на основе азитромицина и гликопептидных антибиотиков (Фигура 1), заключающийся в проведении реакции ацилирования 11-O-( -аминоалкилкарбамоил)азитромицина (6) гликопептидным антибиотиком (эремомицином (2), или ванкомицином (3), или агликоном тейкопланина (4)) в присутствии конденсирующего агента (Фигура 3). 11-O-( -Аминоалкилкарбамоил)азитромицин (6) получен из 2 -O-ацетил-11,12-циклического карбоната азитромицина (5) методом, аналогичным описанному в литературе [X. Li, S. Ma, M. Yan, Y. Wang, S Ma. Synthesis and antibacterial evaluation of novel 11,4 -disubstituted azithromycin analogs with greatly improved activity against erythromycin-resistant bacteria. European Journal of Medicinal Chemistry, 2013, V. 59, pp 209-217]. В этой работе описано получение 11,4 -дизамещенных производных азитромицина - производных 11-O-(аминофенилкарбамоил)-4 -O-(амино)карбамоилазитромицина, которые показали высокую активность в отношении эритромицин-чувствительных штаммов S. pneumoniae и значительно улучшенную активность в отношении эритромицин-резистентных штаммов S. pneumonia (МПК 2÷16 мкг/мл против 256 мкг/мл). Реакцию ацилирования 11-O-( -аминоалкилкарбамоил)азитромицина (6) (Фиг. 3, Схема 1) гликопептидным антибиотиком с получением соединения формулы 2 проводят в присутствии конденсирующих агентов, известных из уровня техники и применяемых для образования амидной связи, например бензотриазол-1-ил-окси-триспирролидинофосфоний гексафторфосфата (РуВОР) или O-(бензотриазол-1-ил)-N,N,N ,N -бис(тетраметилен)) гексафторфосфат мочевины (HBPyU). Реакцию ацилирования 11-O-( -аминоалкилкарбамоил)азитромицина (6) (Фигура 3) гликопептидным антибиотиком с получением соединения структурной формулы, изображенной на фигуре 2, и показанного на фигуре 4, проводят в растворителе, выбираемом из метанола, этанола, , -диметилформамида или диметилсульфоксида. Соединения структурной формулы, изображенной на фигуре 2, обладают выраженной антибактериальной активностью, в том числе в отношении штаммов, устойчивых к ванкомицину (см. Пример 2) и могут быть использованы для лечения инфекционных заболеваний. Вспомогательные средства Эремомицин сульфат получен на опытной установке НИИ по изысканию новых антибиотиков им. Г.Ф. Гаузе РАМН. Ванкомицин гидрохлорид был коммерческим продуктом фирмы Aldrich (США). Агликон тейкопланина был получен от фирмы Lepetit Research Center (Gerenzano (Varese), Италия). Бензотриазол-1-ил-окси-триспирролидинофосфоний гексафторфосфат (РуВОР), O-(бензотриазол-1-ил)-N,N,N ,N -бис(тетраметилен)) гексафторфосфат мочевины (HBPyU) были коммерческими продуктами фирмы Acros. Все растворы высушивали над сульфатом натрия и упаривали при температуре не выше 40°C. Тонкослойную хроматографию осуществляли на пластинках с силикагелем G60 (Merck) в смеси растворителей: система (A) AcOEt-nPrOH-Nh5OH, 1:1:2. Для препаративной очистки использовали колоночную хроматографию на силанизированном силикагеле Merck с размером частиц 0.040-0.063 µм. Аналитическую ВЭЖХ осуществляли на хроматографе LC-10 (Shimadzu, Япония) с использованием УФ-детектора и колонки Kromasil 100-С18 4×250 мм, размер частиц 6 мкм (АО БиоХимМак СТ, РФ). Подвижной фазой служили системы, состоящие из двух компонентов А и Б: Система (В): А (0.2% HCOONh5 рН 4.5) и Б (MeCN), изократический режим 8% ацетонитрила от 0 до 5 минут, затем линейный градиент концентрации ацетонитрила 8 70% от 5 до 40 мин, скорость потока 1.0 мл/мин. ИК-спектры снимали в таблетке KBr на спектрофотометре DTGS. Температуры плавления получены на приборе Buchi SMP-20. Масс-спектры при ионизации электрораспылением (ESI) получали на приборе Finnigan MAT 900S (Германия). Примеры получения производных на основе азитромицина и гликопептидных антибиотиков по настоящему изобретению и изучение их антибактериальной активности: Пример 1. Общая методика получения химерных антибиотиков на основе остатков азитромицина и гликопептидного антибиотика. 2 -O-ацетил-11,12-циклического карбоната азитромицина (5). К раствору азитромицина (5 г, 3.27 ммоль) в 24 мл этилацетата добавляли K2CO3 (0.64 г, 4.63 ммоль), нагревали смесь до кипения и затем медленно, в течение 20 мин при кипячении добавляли 1.6 г (18.2 ммоль) этиленкарбоната. Далее смесь кипятили 24 ч, затем этилацетат упаривали. Остаток растворяли в дихлорметане (30 мл) при комнатной температуре, затем добавляли уксусный ангидрид (0.61 мл, 4.37 ммоль) и триэтиламин (1.8 мл, 13 ммоль), реакционную массу премешивали 24 ч при комнатной температуре. К реакционной смеси добавляли 5% водный раствор NaHCO3 (30 мл), и водный раствор экстагировали дихлорметаном (3×10 мл). Объединенные слои дихлорметана высушивали безводным Na2SO4 и высушивали в вакууме. Далее остаток растворяли в хлороформе и наносили на хроматографическую колонку (45×1.5 см) с силикагелем Merck, уравновешенную хлороформом, затем элюировали хлороформом (40 мл), затем смесью хлороформ-метанол (10:1). Фракции, содержащие целевое вещество, упаривали и высушивали в вакууме. 11-O-( -Аминоалкилкарбамоил)азитромицин (6). 2 -O-ацетил-11,12-циклического карбоната азитромицина (5) растворяли в минимальном объеме , -диаминоалкана и перемешивали при комнатной температуре 48 ч. Далее в реакционную смесь добавляли CHCl3 (20 мл) и воду (20 мл), смесь встряхивали. Органический слой отделяли и промывали водой 6 раз. Органические слои объединяли и далее добавляли воду и 0.5 n HCl, встряхивая слои так, чтобы рН водного слоя составил 8. Органический слой отделяли, добавляли Na 2SO4, выдерживали 1 ч, осадок Na2 SO4 отфильтровывали, промывая хлороформом. Органический слой упаривали и высушивали в вакууме. Общая методика проведения реакции ацилирования 11-O-( -аминоалкилкарбамоил)азитромицина (6) гликопептидными антибиотиками (ванкомицином или эремомицином или аглконом тейкопланина), отщепления ацетильной группы и очистки. К раствору гликопептидного антибиотика (0.47 ммоль) в ДМСО (7 мл) добавляли 11-O-( -аминоалкилкарбамоил)азитромицина (6) (0.5 экв., 0.235 ммоль), значение рН реакционной смеси доводили до ~7.5 добавлением Et3N. Порциями в течение 1 ч добавляли РуВОР (1.1 экв., 0.26 ммоль), поддерживая рН реакционной смеси ~7.5 добавлением Et3N. Реакционную смесь перемешивали в течение 20 часов при комнатной температуре, затем добавляли пятикратный объем диэтилового эфира. Полученную смесь интенсивно перемешивали, затем эфирный слой удаляли. Процедуру повторяли дважды, до получения вязкого масла, затем добавляли метанол (0.5 мл), ацетон (2 мл) и избыток диэтилового эфира, выпавший осадок отфильтровывали, промывали диэтиловым эфиром и высушивали. Продукт далее очищали методом колоночной хроматографии на силинизированном силикагеле. Вещество растворяли в 30% водном растворе МеОН, добавляли 1 см 3 силанизированного силикагеля и высушивали эту смесь в вакууме, далее наносили ее на колонку с силанизированным силикагелем, уравновешенную водой. Элюцию осуществляли сначала водой (100 мл), затем 0.05 M раствором Ch4COOH, затем системой МеОН-0.05 M Ch4COOH (30:70) (100 мл) для соединений 7-9 или системой МеОН-0.05 M Ch4COOH (30:70) (100 мл) для соединений 10-11. Фракции, содержащее целевое вещество, объединяли, упаривали в роторном испарителе с добавлением n-BuOH, к остатку добавляли ацетон и диэтиловый эфир. Выпавший осадок отфильтровывали, промывали ацетоном и высушивали в вакууме. Физико-химические данные для производных 7-11 (Фигура 4) представлены в Таблице 1.
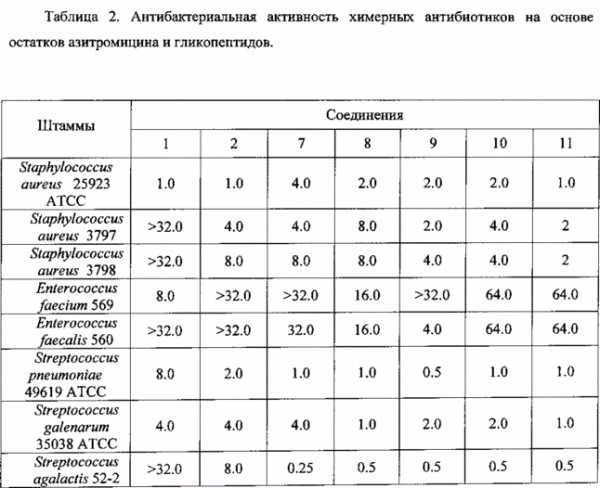
Пример 2. Изучение антибактериальной активности антибиотиков на основе азитромицина и гликопептидных антибиотиков Антибактериальная активность производных 7-11 в сравнении с азитромицином (1) и ванкомицином (2) изучена на панели штаммов грамположительных и грамотрицательных бактерий (Таблица 2). Полученные данные свидетельствуют, что все синтезированные химерные антибиотики на основе азитромицина и гликопептидов 7-11 не уступали или превосходили азитромицин и ванкомицин по антибактериальной активности в отношении всех изученных штаммов грамположительных бактерий. Ценной является высокая активность производных (выше, чем у азитромицина и ванкомицина) в отношении пневмокков, являющихся причиной большинства случаев менингитов, внебольничных пневмоний и ряда гнойно-септических инфекций. Производные на основе эремомицина и азитромицина оказались активны в отношении штаммов Enterococcus faecium и Enterococcus faecalis, устойчивых к ванкомицину. Таким образом, предложенный способ получения антибиотиков на основе азитромицина и гликопептидных антибиотиков позволяет получать новые соединения, обладающие высокой антибактериальной активностью, в том числе, в отношении ряда штаммов Enterococcus, устойчивых к ванкомицину. ФОРМУЛА ИЗОБРЕТЕНИЯ1. Соединения, соответствующие формуле 2 ,где n=1-10, a R представляет собой остаток гликопептидного антибиотика, такого как ванкомицин, или эремомицин, или агликон тейкопланина. 2. Способ получения антибиотиков на основе азитромицина и гликопептидных антибиотиков по п. 1, заключающийся в проведении реакции ацилирования 11-O-( -аминоалкилкарбамоил)азитромицина (6) гликопептидным антибиотиком (эремомицином, или ванкомицином, или агликоном тейкопланина) в присутствии конденсирующего агента. www.freepatent.ru Способ повышения эффективности антибиотикотерапии
Изобретение относится к области ветеринарии, а именно частной патологии и терапии животных, и может найти применение при проведении лечения заболеваний антибиотиками. Способ заключается в совместном введении антибиотика и тетрагидрофуранола-З. Способ обеспечивает повышение эффективности применения антибиотиков за счет увеличения времени экспозиции антибиотика из мышечной ткани и его антибактериальных свойств, а также исключение постинъекционных инфильтратов и нагноений. 3 табл. Изобретение относится к области ветеринарии, а именно частной патологии и терапии животных, и может найти применение при проведении лечения заболеваний антибиотиками. Известны способы повышения эффективности антибиотикотерапии путем дополнительного облучения кровезаменителя рентгеновским излучением, вводимого одновременно с антибиотиками (патент РФ N 2009664 "Способ лечения бактериальных инфекций"), сочетанного применения антибиотика и сорбента СУМС-1 (патент РФ N 2083211 "Способ лечения острых воспалительных заболеваний матки"), дополнительного подкожного введения гормонального препарата маммофизин (патент РФ N 1334421 "Способ профилактики послеродового эндометрита у песцов и лисиц"), а также применение гипериммунной антигистаминной сыворотки (патент РФ N 2129013 "Способ лечения крупного рогатого скота с септическими воспалительными заболеваниями"). Недостатками данных способов являют зависимость эффективности антибиотикотерапии от состояния больного, уровня обменных процессов, резистентности организма, что существенно снижает результаты терапии. Известен способ антибиотикотерапии, основанный на использовании антибиотика и вспомогательного лекарственного вещества оксиарил - или оксиаралкилкарбоновая кислота или ее производные (патент ЕПВ (ЕЕ) N 0035770). Недостатком его является пероральный путь введения. Этих недостатков лишен способ, при котором повышение активности антибиотиков осуществляют добавлением к ним косвенна диметилтоцианина или пиронина (международная заявка N 82/00003). Недостатком этого способа является ограниченный перечень антибиотиков (флеомизин, блеомицин, таллисомицин). Наиболее близким способом, принятым за прототип, является использование в качестве вспомогательного вещества 0,1% адреналина, добавляемого в количестве 0,05 мл на одну инъекцию антибиотика (патент РФ N 2048811 "Способ повышения эффективности атнибиотикотерапии"), который поддерживает уровень антибиотика в крови, за счет замедления всасывания антибиотика из мышц в результате спазма местных сосудов, тем самым способствует медленному и равномерному его поступлению в кровь и созданию в ней максимальной концентрации антибиотика. К недостаткам данного способа относятся недостаточно высокая эффективность антибиотикотерапии и образование крупноочаговых некрозов мышечной ткани в месте, где вводился антибиотик с адреналином, что приводит к появлению постинъекционных инфильтратов и нагноений. Техническим результатом изобретения является повышение эффективности применения антибиотиков за счет увеличения времени экспозиции антибиотика из мышечной ткани и его антибактериальных свойств, а также исключение постинъекционных инфильтратов и нагноений. Технический результат антибиотикотерапии достигается путем совместного введения антибиотика и тетрагидрофуранола-3. Тетрагидрофуранол-3 используется для подкожного, внутримышечного, внутривенного, трансдермального, интравагинального, внутриматочного, эпидурального и интерцистерального введения антибиотиков. Изобретением решается задача повышения эффективности применения антибиотиков путем пролонгации действия антибиотика и стабилизации его уровня в организме в результате равномерного и продолжительного распределения тетрагидрофуранола-3 на биомолекулярном покрове мембран клеток, что препятствует быстрому всасыванию антибиотика и тетрагидрофуранола-3, а также равномерному их поступлению в кровь и созданию в крови максимальной концентрации. Сущность способа поясняется следующим примером. Проводились экспериментальные исследования совместимости и стабильности тетрагидрофуранола-3 с антибиотиками. Лабораторные исследования тетрагидрофуранола-3 в сочетании с антибиотиками на его стабильность по основным физико-химическим характеристикам и содержанию основного действующего вещества в процессе хранения проводились в следующей периодичности: в момент приготовления раствора, через 3, 6, 12 и 18 месяцев (табл. 1). Исследование проводилось общепринятыми методами, рекомендованными ГФХ: pH, плотность, стерильность, содержание в препарате тетрагидрофуранол-3. Каждое исследование проводилось не менее чем в 6-ти повторностях. Установлено, что за время наблюдений раствор оставался прозрачным, pH 5.35 0.08, плотность 1.005 0.008 г/см3. Полученные в результате исследования данные по содержанию активно-действующего вещества в растворе свидетельствуют, что он сохраняется в необходимых количествах в течение 18 месяцев после изготовления. С целью определения совместимости 2,5% раствора тетрагидрофуранола-3 с антибиотиками провели серию опытов, где испытывали действие ряда антибиотиков с испытуемым веществом и без него на музейных штаммах сальмонеллы и стрептококков (табл. 2). Таким образом, установлено, что тетрагидрофуранол-3 не подавляет антибактериальные свойства антибиотиков, а в ряде случаев даже усиливает их действие. Проводились также исследования тетрагидрофуранола-3 по определению его антисептических свойств. Бактерицидные свойства определялись в двух сериях опытов на различных микробных группах при различной концентрации тетрарофуранола-3 в сравнении с 70, 50 и 40% спиртом. В результате опытов было установлено, что тетрагидрофуранол-3 в 70, 50 и 40%-ной концентрации как антисептик не уступает 70% спирту, а на сальмонеллы и колибактерии оказывает более выраженное антимикробное действие по сравнению с 40 и 50%-ным спиртом. В производственных условиях проведены испытания антибиотика гентамицина в растворе тетрагидрофуранола-3 в общей схеме лечения послеродового катарально-гнойного эндометрита у 65 коров (табл. 3). Из приведенных данных следует, что разведение антибиотиков в 2.5%-ном растворе тетрагидрофуранола-3 способствует более эффективному использованию антибиотиков в терапии воспалительных процессов у животных, что выражается в благоприятных отдаленных последствиях влияния на организм животных. Применяемая последовательность разбавления антибиотиков 2,5%-ным раствором тетрагидрофуранола-3 позволила направленно сохранить и повысить антибактериальные свойства антибиотиков, что привело к сокращению сроков выздоровления животных. В частности, при производственных испытаниях растворителя антибиотиков сроки лечения заболеваний у животных в среднем сократились на 5,3 дня. Использование предлагаемого способа обеспечивает следующие преимущества по сравнению с известными способами: а) сокращение сроков лечения, повышение эффективности антибиотиков; б) простота, надежность и доступность способа позволяет дополнительно повысить эффективность применения антибиотиков. Способ повышения эффективности антибиотикотерапии, заключающийся в совместном введении антибиотика и его пролонгатора, отличающийся тем, что в качестве пролонгатора вводят тетрагидрофуранол-3. Рисунок 1, Рисунок 2, Рисунок 3, Рисунок 4 www.findpatent.ru Способ получения антибиотика | Банк патентовИспользование: биотехнология, ветеринария. Сущность: культивируют не менее 2-х дней один из штаммов микроорганизма Streptomyces thermoarchaensis NCIB 12015, 12111, 12112, 12113 или 12114 в аэробных условиях при 20 - 50°С и рН 5,5 - 8,5. Из культуральной жидкости выделяют антибиотик формулы, приведенный в описании изобретения. При необходимости его очищают хроматографией. Целевой продукт обладает антигельминтозной активностью.Изобретение относится к новым соединениям антибиотика и способам их получения. В описании патента Великобритании 2166436 описано получение антибиотиков 541, которые можно выделить из продукта ферментации вида Streptomyces. Антибиотики S541 представляют собой группу родственных соединений, имеющих неполную форму
Формула изобретенияСПОСОБ ПОЛУЧЕНИЯ АНТИБИОТИКА формулы
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе Дата прекращения действия патента: 27.02.2004 Извещение опубликовано: 10.05.2005 БИ: 13/2005 bankpatentov.ru фармацевтическая композиция антибиотиков и пребиотиков (варианты) для профилактики и лечения дисбиозов в процессе антибактериальной терапии - патент РФ 2325187По первому варианту фармацевтическая композиция содержит антибиотик и пребиотик - олигосахарид, выбранный из группы: фруктоолигосахариды, галактоолигосахариды, ксилоолигосахариды, мальтоолигосахариды и изомальтоолигосахариды со степенью полимеризации от 2 до 10, с размером частиц до 0,3 мм и чистотой не менее 95%, а антибиотик - с размерами частиц от 20 до 200 мкм; антибиотик и олигосахарид включены в массовом соотношении от 1:1 до 1:100 соответственно; по второму варианту фармацевтическая композиция содержит антибиотик в виде порошка с размерами частиц от 20 до 200 мкм, выбранный из группы: бета-лактамы, включая комбинации бета-лактамов с ингибиторами бактериальных беталактамаз; азалиды, фторхинолоны, амфениколы, гликопептиды, ансамицины, нитрофураны, производные фосфоновой кислоты, циклосерин, триметоприм, а в качестве пребиотика - олигосахарид в виде порошка со степенью полимеризации от 2 до 10, с размером частиц до 0,3 мм, чистотой не менее 95%; при этом антибиотик и олигосахарид включены в состав композиции в массовом соотношении от 1:1 до 1:100 соответственно; указанные композиции используют для профилактики дисбиоза кишечника в процессе проведения антибиотикотерапии, которые вводят перорально. Композиции по изобретению оказывают стимулирующий эффект на лактобациллы и бифидобактерии кишечника, ингибируя при этом рост и размножение посторонней или патогенной микрофлоры. 3 н. и 2 з.п. ф-лы. Изобретение относится к медицине, а именно к фармацевтике и созданию композиций лекарственных препаратов, содержащих антибиотики и пребиотики, для коррекции состава микрофлоры кишечника в процессе антибиотикотерапии. Лечебное действие антибиотиков широкого спектра действия, как правило, сопровождается расстройствами со стороны желудочно-кишечного тракта, связанными с негативным воздействием антибиотика на микрофлору толстого кишечника. При этом антибиотики сильно и отрицательно влияют на проницаемость биологических мембран для ионов аммония в толстом кишечнике. В результате антибиотики подавляют не только патогенную, но и полезную микрофлору пищеварительного тракта, приводят к нарушению гомеостаза и способствуют развитию дисбиозов и аллергий. Нарушенное равновесие в микробиоценозе кишечника в ряде случаев ведет к нарушениям со стороны иммунной системы и активному размножению одноклеточных грибов, которые колонизируют кишечник. Нормальная микрофлора кишечника является необходимым условием переваривания пищи и усвоения питательных веществ, а также барьером на пути экзогенной инфекции, участвует в обезвреживании токсических метаболитов, ограничивая размножение патогенных и условно-патогенных штаммов микроорганизмов, попадающих в кишечник. Наиболее благоприятные условия для жизнедеятельности микрофлоры возникают уже в дистальных отделах тонкой кишки, куда не попадают секреты желудка и протеазы поджелудочной железы, а также компоненты желчи, бактериостатические и бактерицидные эффекты которых ослабевают по мере приближения к толстому кишечнику. На фоне дисбиоза попавшие в организм патогенные возбудители кишечных инфекций или условно-патогенные микроорганизмы быстро колонизируют слизистую оболочку тонкой и толстой кишки, разрушая эпителиальные клетки и проявляя выраженный антагонизм по отношению к индигенной микрофлоре. Развивается воспаление, которое ведет к снижению выработки короткоцепочечных жирных кислот, ингибирующих рост патогенных микроорганизмов. Это происходит в процессе антибиотикотерапии препаратами широкого спектра действия. Даже частичная потеря собственной кишечной микрофлоры приводит к тяжелым последствиям для организма и требует самостоятельного лечения. Такое лечение может осуществляться, в частности, путем назначения разнообразных пробиотиков, которые не всегда совместимы с представителями нормофлоры и в течение нескольких дней могут элиминировать из кишечника. Что касается развития нежелательных эффектов при использовании этих препаратов, то они относятся прежде всего к способности пробиотиков модулировать иммунное воспаление. Например, известно, что у 10% работников фабрик по производству бактерийных и иммунобиологических препаратов (пробиотиков) через несколько лет работы развивается аллергические заболевания. Более физиологическим путем поддержания активного состояния нормальной микрофлоры кишечника является прием пребиотиков. К пребиотикам относятся неперевариваемые ингредиенты пищи, способствующие улучшению здоровья за счет избирательной стимуляции роста и/или метаболической активности одной или нескольких групп бактерий, обитающих в толстой кишке. Пребиотики в отличие от пробиотиков в желудке не перевариваются и доходят до толстого отдела кишечника в неизменном виде, так как имеют в структуре бета-гликозидные связи, которые в организме человека не гидролизуются из-за отсутствия бета-гликозидаз. Пребиотики способны избирательно стимулировать рост и размножение лактобацилл и бифидобактерий, т.е. видов, доминирующих в составе нормофлоры кишечника человека. Назначение комплексной терапии с включением пребиотиков направлено на устранение атрофических процессов в слизистой оболочке толстой кишки и дистрофических изменений эпителиального покрова с восстановлением его функциональной способности. Однако разделенный во времени прием антибиотиков и пребиотиков не менее чем в половине случаев не может исключить поражения микрофлоры кишечника антибиотиками. Чаще всего к пребиотикам прибегают уже после появления симптомов дисбиоза в виде диареи и метеоризма. В результате к началу приема пребиотиков после проведенной антибиотикотерапии полезная микрофлора оказывается подорванной или практически нежизнеспособной. В связи с этим целесообразно обеспечение селективных преимуществ полезной микрофлоре перед патогенными или условно-патогенными видами бактерий в процессе лечения антибиотиками. Поэтому делаются попытки обеспечить защиту индигенной микрофлоры кишечника за счет одновременного приема антибиотика и пребиотика в виде единой фармацевтической композиции. Известна фармацевтическая композиция, способ ее приготовления и способ применения, содержащая пребиотик лактулозу и антибиотик из группы: пенициллинов, цефалоспоринов, тетрациклинов, линкозамидов, макролидов (RU 2284832 от 10.10.2006; прототип). Недостатком данной композиции является то, что лактулоза содержит значительное количество примесей (лактоза, галактоза, фруктоза), которые стимулируют рост патогенных и условно-патогенных видов микроорганизмов, паразитирующих в кишечнике. Отрицательным является слабительное действие лактулозы, которое укорачивает время прохождения химуса и снижает всасывание и усвоение питательных веществ, а кроме того, слабительный эффект лактулозы в комбинации с антибиотиками может клинически расцениваться как признак дисбактериоза. Кроме того, известно, что сухая лактулоза чрезвычайно гигроскопична, а это создает серьезные технические трудности при производстве композиций, упаковке и хранении готовых лекарственных препаратов, содержащих лактулозу. Известна лекарственная форма - фармацевтическая композиция, способ ее приготовления и способ применения, содержащая антибиотик и пребиотик фруктан, которая дополнительно к антибактериальному действию и к некоторому, более медленно развивающемуся поддержанию микрофлоры кишечника повышает абсорбцию кальция и минерализацию костей (ЕР 1166800 от 2002, прототип). Недостатками этой композиции являются узость диапазона применения, низкая специфичность стимулирующего действия на основные виды индигенной микрофлоры, неоптимальное массовое соотношение (несбалансированность) антибиотика и фруктана, неоптимальная дисперсность (размер частиц), неоптимальная степень полимеризации пребиотика, при которых снижается уровень ферментации сахаридов и антибактериальное действие продукта. При этом снижается лечебно-профилактический эффект от приема композиции, а также абсорбция кальция и минерализации костей. Кроме того, указанную композицию отличает сложность процесса приготовления и недостаточная эффективность применения. Недостатки этой композиции обусловлены в значительной степени высокой полимеризаций и низкой чистотой фруктана, которая затрудняет процесс ферментации полисахарида лактобациллами и бифидобактериями и требует увеличения количества пребиотика в составе композиции. Отрицательным является наличие в лактулозе большинства отечественных производителей примесей (до 40%), стимулирующих рост патогенных и условно-патогенных бактерий кишечной группы, наличие побочного действия на систему свертывания крови (преимущественно удлинение частичного протромбинового времени и снижение уровня фибриногена), значительная частота аллергических реакций. Технической задачей группы изобретений, связанных единым изобретательским замыслом, является создание эффективной фармацевтической композиции и способа профилактики дисбиозов и расширение арсенала фармацевтических композиций и способов профилактики дисбиозов. Технический результат, обеспечивающий решение поставленной задачи, состоит в том, что расширен диапазон применения композиции пребиотиков и антибиотиков за счет включения в состав композиции наиболее эффективных антибактериальных препаратов для приема внутрь (фторхинолоны и ансамицины) и устранения побочных явлений. Кроме того, обеспечена эффективная утилизация пребиотического компонента композиции в кишечнике за счет введения олигосахаридов оптимальной степени полимеризации и оптимального соотношения компонентов с необходимой диперсностью (размеров частиц). Сущность изобретения в части фармацевтической композиции для перорального применения по первому варианту состоит в том, что фармацевтическая композиция содержит антибиотик и пребиотик, причем в качестве пребиотика - олигосахарид со степенью полимеризации от 2 до 10 из группы природных или синтетических не перевариваемых олигосахаридов, выбранный из группы: фруктоолигосахаридов, галактоолигосахаридов, ксилоолигосахаридов, мальтоолигосахаридов и изомальтоолигосахаридов, при этом антибиотик и олигосахарид в фиксированной композиции взяты в массовом соотношении от 1:1 до 1:100. Заявленная композиция содержит олигосахарид в виде порошка с размером частиц до 0,3 мм, чистотой не менее 95%, а антибиотик - в виде порошка с размером частиц 20-200 мкм, а также фармацевтически приемлемые количества вспомогательных веществ, улучшающих органолептические и потребительские свойства, выбранные из группы: наполнители, корректоры вкуса, ароматизаторы, отдушки. Заявленная фармацевтическая композиция может быть выполнена в лекарственной форме, пригодной для орального применения, выбранная из группы: капсулы, таблетки, порошки, пилюли, драже, гранулы, саше, гели, пасты, сиропы, эмульсии, суспензии, растворы. Сущность изобретения в части фармацевтической композиции для перорального применения по второму варианту состоит в том, что фармацевтическая композиция содержит антибиотик и пребиотик, причем она содержит антибиотик, выбранный из группы: бета-лактамов, включая комбинации бета-лактамов с ингибиторами бактериальных беталактамаз, макролидов, азалидов, фторхинолонов, амфениколов, линкозамидов, гликопептидов, ансамицинов, нитрофуранов, производных фосфоновой кислоты, циклосерина и сульфаниламидных препаратов (триметоприма), а в качестве пребиотика - олигосахарид со степенью полимеризации от 2 до 10, при этом антибиотик и олигосахарид содержатся в составе фиксированной композиции в массовом соотношении от 1:1 до 1:100 соответственно. Заявленная композиция содержит олигосахарид в виде порошка с размером частиц до 0,3 мм, чистотой не менее 95%, а антибиотик - в виде порошка с размером частиц от 20 до 200 мкм, а также фармацевтически приемлемые количества вспомогательных веществ, улучшающих органолептические и потребительские свойства, выбранные из группы: наполнители, корректоры вкуса, ароматизаторы, отдушки. Заявленная фармацевтическая композиция может быть выполнена в лекарственной форме, пригодной для орального применения, выбранная из группы: капсулы, таблетки, порошки, пилюли, драже, гранулы, саше, гели, пасты, сиропы, эмульсии, суспензии, растворы. Сущность изобретения в части способа профилактики состоит в том, что способ профилактики дисбиозов при антибактериальной терапии антибиотиками и/или сульфаниламидными препаратами предусматривает прием пребиотика с антибиотиком или с сульфаниламидным препаратом (соответственно) в составе единой фармацевтической композиции, содержащей в качестве пребиотика олигосахарид со степенью полимеризации от 2 до 10, при массовом соотношении содержания антибиотика и олигосахарида от 1:1 до 1:100 соответственно. Заявленная композиция содержит олигосахарид в виде порошка с размером частиц до 0,3 мм, чистотой не менее 95%, а антибиотик - в виде порошка с размером частиц от 20 до 200 мкм, а также фармацевтически приемлемые количества вспомогательных веществ, улучшающих органолептические и потребительские свойства, выбранные из группы: наполнители, корректоры вкуса, ароматизаторы, отдушки. Фармацевтическая композиция может приниматься в лекарственной форме, пригодной для орального применения, из группы: капсул, таблеток, порошков, пилюль, драже, гранул, саше, гелей, паст, сиропов, эмульсий, суспензий, растворов. Заявленная композиция антибиотика и олигосахарида, кроме всего прочего, существенно увеличивает абсорбцию кальция и повышает минерализацию костей пациентов. В свою очередь, олигосахариды, используемые в заявленной композиции: фруктоолигосахариды, галактоолигосахариды, ксилоолигосахариды, мальтоолигосахариды и изомальтоолигосахариды не только создают условия роста полезных бактерий, но и эффективно улучшают состав крови, состояние сердечно-сосудистой и иммунной систем. При этом учитывается, что организм человека представляет собой полиорганную систему, клеточные элементы которой специализированы для выполнения различных функций. Взаимодействие внутри организма осуществляется сложными регулирующими, координирующими и коррелирующими механизмами с участием нейрогуморальных и других факторов. Множество отдельных механизмов, регулирующих внутри- и межклеточные взаимодействия, выполняют разнонаправленные функции, уравновешивая друг друга. Это приводит к установлению в организме подвижного физиологического баланса и позволяет системе в целом поддерживать относительное динамическое равновесие, несмотря на изменения в окружающей среде и сдвиги, возникающие в процессе жизнедеятельности организма. Нарушение физиологического баланса, в том числе и связанное с нарушением равновесия в микробиоценозах, может проявляться в виде заболеваний различных органов. Заявляемая композиция и способ применения направлены на профилактику или эффективное снижение отклонений физиологического баланса в части состояния микробиоценоза кишечника под влиянием "возмущающего" фактора в виде антибиотиков. Олигосахариды - углеводы, молекулы которых образованы не более чем 10-ю остатками моносахаридов. Соответственно, различают дисахариды, трисахариды и т.п. В организмах олигосахариды образуются при ферментативном расщеплении полисахаридов. Микроорганизмы кишечника утилизируют олигосахариды с помощью гликозидаз, и введение олигосахаридов приводит к увеличению продукции и усилению сахаролитической активности этих ферментов. Так как пребиотик - олигосахарид, в форме, установленной согласно настоящему изобретению, поступает в заявляемой композиции одновременно с антибиотиком и в необходимом массовом соотношении, то при подавлении антибиотиком патогенных бактерий собственная микрофлора толстой кишки не погибает, а синхронно с поступлением олигосахарида гидролизует (сбраживает) последний с образованием эффективного количества кислот: молочной, частично муравьиной и уксусной. При этом в толстой кишке повышается осмотическое давление до 6,6-8,0 атм и снижается значение показателя кислотности ниже рН 5,0, т.е. в сторону повышения кислотности, что приводит к надежному поддержанию нормальной избирательной проницаемости биологических мембран кишечника и удержанию в нем ионов аммония, удалению аммиака из крови в кишечник и его ионизации и тем самым создает в просвете толстого кишечника совершенно неблагоприятные условия для развития других видов бактерий, например сальмонелл. Образовавшиеся кислые продукты и другие метаболиты подавляют развитие широкого спектра гнилостной микрофлоры. В результате в просвете кишечника уменьшается количество патогенных бактерий и токсичных метаболитов (аммиака, скатола, индола и др). На фоне эффективного поддержания гомеостаза беспрепятственно обеспечивается достаточное размножение и стимуляция роста сохраняемой естественной полезной микрофлоры кишечника. При нарастании кислотности среды кислота вступает в реакцию с аминогруппами белка и при этом, путем отнятия ОН-ионов способствует возникновению электроположительного белка, подавляющего воспалительные процессы, которые могли бы возникнуть в кишечнике в силу внешних причин и как осложнение основного заболевания. Любая неживая и живая материя: организм, система, орган, ткань, клетка, клеточные органеллы и субстраты и т.п., имеет свой спектр электромагнитных колебаний в широком диапазоне от сотых герца (Гц) до кило-, мегагерца и более сложных гармоник. В норме эти колебания называются гармоническими (или физиологическими), при патологии - дисгармоническими колебаниями (или патологическими). Олигосахариды как растительные компоненты имеют энергетические составляющие, инициирующие сверхслабые электромагнитные колебания, которые накладываются на дисгармонические колебания, вносимые антибиотиками, и при выбранном массовом соотношении ингредиентов происходит как бы "стирание" этой потенциально патологической информации. Это действие олигосахаридов, очевидно, связано с иммуностимулирующим эффектом, который повышает неспецифическую резистентность организма к инфекциям и сохраняет "биологическое равновесие". При этом происходит восстановление процессов саморегуляции и усиление гармонических колебаний, стимулирующих процессы регенерации слизистой оболочки кишечника. Процесс приготовления заявляемой композиции предусматривает подготовку заданных количеств порошкообразных антибиотика и пребиотика с гарантированной поставщиком степенью чистоты не менее 95%, подсушку до 2-3% влажности и смешивание в соотношении, предусмотренном настоящим изобретением. В смесь также вводят добавки против слеживания, ароматизаторы, вкусовые корректоры и производится снятие статических электрических зарядов. Далее, в соответствии с дозировкой и лекарственной формой производят фасовку готового продукта. Были приготовлены композиции со следующими сочетаниями ингредиентов: 1. ФОС с одним из амфениколов, причем ФОС в виде порошка с размером частиц от 0,1 до 0,3 мм со степенью полимеризации от 2 до 6, а антибиотик - в виде порошка с размером частиц от 130 до 200 мкм, при этом антибиотик и ФОС взяты в массовом соотношении 1:1,5 соответственно. 2. ФОС с одним из фторхинолонов, причем ФОС в виде порошка с размером частиц от 0,1 до 0,3 мм со степенью полимеризации от 2 до 6, а антибиотик - в виде порошка с размером частиц от 30 до 120 мкм, при этом антибиотик и ФОС взяты в массовом соотношении 1:2 соответственно. 3. ФОС с одним из гликопептидов, причем ФОС в виде порошка с размером частиц от 0,1 до 0,3 мм со степенью полимеризации от 2 до 6, а антибиотик - в виде порошка с размером частиц от 20 до 90 мкм, при этом антибиотик и ФОС взяты в массовом соотношении 1:4 соответственно. 4. ФОС с одним из ансамицинов, причем ФОС в виде порошка с размером частиц от 0,1 до 0,3 мм со степенью полимеризации от 4 до 10, а антибиотик - в виде порошка с размером частиц от 20 до 140 мкм, при этом антибиотик и ФОС взяты в массовом соотношении 1:15 соответственно. 5. ФОС с одним из амфениколов, причем ФОС в виде порошка с размером частиц от 0,1 до 0,3 мм со степенью полимеризации от 2 до 6, а антибиотик - в виде порошка с размером частиц от 20 до 90 мкм, при этом антибиотик и ФОС взяты в массовом соотношении 1:30 соответственно. 6. ФОС с одним из нитрофуранов, причем ФОС в виде порошка с размером частиц от 0,1 до 0,3 мм со степенью полимеризации от 2 до 8, а антибиотик - в виде порошка с размером частиц от 20 до 120 мкм, при этом антибиотик и ФОС взяты в массовом соотношении 1:70 соответственно. 7. ФОС с одним из сульфаниламидных препаратов (бисептол), причем ФОС в виде порошка с размером частиц от 0,2 до 0,3 мм со степенью полимеризации от 2 до 6, а антибиотик - в виде порошка с размером частиц от 20 до 120 мкм, при этом антибиотик и ФОС взяты в массовом соотношении 1:100 соответственно. 8. Галактоолигосахарид (ГОС) с одним из амфениколов, причем ГОС в виде порошка с размером частиц от 0,1 до 0,3 мм со степенью полимеризации от 5 до 15, а антибиотик - в виде порошка с размером частиц от 50 до 150 мкм, при этом антибиотик и ГОС взяты в массовом соотношении 1:2 соответственно. 9. ГОС с одним из фторхинолонов, причем ГОС в виде порошка с размером частиц от 0,1 до 0,3 мм со степенью полимеризации от 4 до 12, а антибиотик - в виде порошка с размером частиц от 20 до 90 мкм, при этом антибиотик и ГОС взяты в массовом соотношении 1:3 соответственно. 10. ГОС с одним из гликопептидов, причем ГОС в виде порошка с размером частиц от 0,1 до 0,3 мм со степенью полимеризации от 5 до 15, а антибиотик - в виде порошка с размером частиц от 30 до 100 мкм, при этом антибиотик и ГОС взяты в массовом соотношении 1:40 соответственно. 11. ГОС с одним из ансамицинов, причем ГОС в виде порошка с размером частиц от 0,1 до 0,3 мм со степенью полимеризации от 3 до 10, а антибиотик - в виде порошка с размером частиц от 20 до 110 мкм, при этом антибиотик и ГОС взяты в массовом соотношении 1:60 соответственно. 12. ГОС с одним из производных фосфоновой кислоты (фосфомицин), причем ГОС в виде порошка с размером частиц от 0,1 до 0,3 мм со степенью полимеризации от 4 до 12, а антибиотик - в виде порошка с размером частиц от 20 до 90 мкм, при этом антибиотик и ГОС взяты в массовом соотношении 1:90 соответственно. 13. ГОС с одним из нитрофуранов, причем ГОС в виде порошка с размером частиц от 0,1 до 0,3 мм со степенью полимеризации от 3 до 10, а антибиотик - в виде порошка с размером частиц от 90 до 200 мкм, при этом антибиотик и ГОС взяты в массовом соотношении 1:55 соответственно. 14. ГОС с одним из сульфаниламидных препаратов (стрептоцид), причем ГОС в виде порошка с размером частиц от 0,2 до 0,3 мм со степенью полимеризации от 2 до 6, а антибиотик - в виде порошка с размером частиц от 40 до 150 мкм, при этом антибиотик и ГОС взяты в массовом соотношении 1:45 соответственно. 15. Ксилоолигосахарид (КОС) с одним из амфениколов, причем КОС в виде порошка с размером частиц от 0,2 до 0,3 мм со степенью полимеризации от 2 до 6, а антибиотик - в виде порошка с размером частиц от 20 до 120 мкм, при этом антибиотик и КОС взяты в массовом соотношении 1:45 соответственно. 16. КОС с одним из фторхинолонов, причем КОС виде порошка с размером частиц от 0,1 до 0,3 мм со степенью полимеризации от 2 до 8, а антибиотик - в виде порошка с размером частиц от 20 до 120 мкм; при этом антибиотик и КОС взяты в массовом соотношении 1:80 соответственно. 17. КОС с одним из гликопептидов, причем КОС в виде порошка с размером частиц от 0,2 до 0,3 мм со степенью полимеризации от 4 до 10, а антибиотик - в виде порошка с размером частиц от 160 до 200 мкм; при этом антибиотик и КОС взяты в массовом соотношении 1:100 соответственно. 18. КОС с одним из ансамицинов, причем КОС в виде порошка с размером частиц от 0,1 до 0,3 мм со степенью полимеризации от 2 до 8, а антибиотик - в виде порошка с размером частиц от 20 до 100 мкм; при этом антибиотик и КОС взяты в массовом соотношении 1:65 соответственно. 19. КОС с одним из производных фосфоновой кислоты (фосфомицин), причем КОС в виде порошка с размером частиц от 0,2 до 0,3 мм со степенью полимеризации от 4 до 10, а антибиотик - в виде порошка с размером частиц от 20 до 100 мкм; при этом антибиотик и КОС взяты в массовом соотношении 1:5,5 соответственно. 20. КОС с одним из нитрофуранов, причем КОС в виде порошка с размером частиц от 0,1 до 0,3 мм со степенью полимеризации от 2 до 6, а антибиотик - в виде порошка с размером частиц от 30 до 120 мкм, при этом антибиотик и КОС взяты в массовом соотношении 1:3,5 соответственно. 21. КОС с одним из сульфаниламидных препаратов, причем КОС в виде порошка с размером частиц от 0,1 до 0,3 мм, со степенью полимеризации от 2 до 6, а антибиотик - в виде порошка с размером частиц от 20 до 90 мкм, при этом антибиотик и КОС взяты в массовом соотношении 1:2 соответственно. 22. Мальтоолигосахарид (МОС) с одним из амфениколов, причем МОС в виде порошка с размером частиц от 0,1 до 0,3 мм со степенью полимеризации от 2 до 6, а антибиотик - в виде порошка с размером частиц от 120 до 180 мкм, при этом антибиотик и МОС взяты в массовом соотношении 1:1 соответственно. 23. МОС с одним из фторхинолонов, причем МОС в виде порошка с размером частиц от 0,2 до 0,3 мм со степенью полимеризации от 2 до 6, а антибиотик - в виде порошка с размером частиц от 20 до 120 мкм, при этом антибиотик и МОС взяты в массовом соотношении 1:6 соответственно. 24. МОС с одним из гликопептидов, причем МОС в виде порошка с размером частиц от 0,1 до 0,3 мм со степенью полимеризации от 2 до 6, а антибиотик - в виде порошка с размером частиц от 20 до 90 мкм, при этом антибиотик и МОС взяты в массовом соотношении 1:25 соответственно. 25. МОС с одним из производных фосфоновой кислоты (фосфомицин), причем МОС в виде порошка с размером частиц от 0,1 до 0,3 мм со степенью полимеризации от 2 до 8, а антибиотик - в виде порошка с размером частиц от 20 до 120 мкм, при этом антибиотик и МОС взяты в массовом соотношении 1:60 соответственно. 26. МОС с одним из ансамицинов, причем МОС в виде порошка с размером частиц от 0,1 до 0,3 мм со степенью полимеризации от 5 до 15, а антибиотик - в виде порошка с размером частиц от 20 до 90 мкм, при этом антибиотик и МОС взяты в массовом соотношении 1:70 соответственно. 27. МОС с одним из монобактамов, причем МОС в виде порошка с размером частиц от 0,1 до 0,3 мм со степенью полимеризации от 4 до 12, а антибиотик - в виде порошка с размером частиц от 40 до 140 мкм, при этом антибиотик и олигосахарид взяты в массовом соотношении 1:100 соответственно. 28. МОС с одним из сульфаниламидных препаратов, причем МОС в виде порошка с размером частиц от 0,1 до 0,3 мм со степенью полимеризации от 2 до 8, а антибиотик - в виде порошка с размером частиц от 20 до 120 мкм, при этом антибиотик и МОС взяты в массовом соотношении 1:6 соответственно. Заявленная фармацевтическая композиция представлена в лекарственных формах, пригодных для орального применения, в частности в виде капсул, таблеток, порошков, пилюль, драже, гранул, саше, геля, пасты, сиропа, эмульсии, суспензии, раствора. В состав композиций вводятся фармацевтически приемлемые количества вспомогательных веществ, улучшающих органолептические и потребительские свойства, в частности наполнители, корректоры вкуса, ароматизаторы. Возможность осуществления заявленного изобретения может быть проиллюстрирована нижеследующими примерами:
Порошок растворяют в 5,0 мл охлажденной до комнатной температуры кипяченой воды непосредственно перед применением.
Пример 9. Для изучения действия полученных препаратов и подтверждения их пригодности в качестве профилактических и терапевтических лекарственных средств проводили исследования их влияния на состояние организма больных различными инфекционными заболеваниями. Для чего оценивали действие препаратов на общее состояние организма, физическую активность, сон, аппетит, прогрессирование атеросклероза, неврологический статус и течение соматических хронических заболеваний (сахарный диабет). В составе опытной группы под наблюдением находились 157 пациентов в возрасте от 19 до 70 лет, мужчин - 67, женщин - 82. Из них: с диагнозом язвенная болезнь желудка - 48 пациентов, с диагнозом хронический бронхит и бронхоэктатическая болезнь - 45 пациентов, с диагнозом острая или хроническая пневмония - 40 человек, с гинекологическими диагнозами - 24 женщины. Диагноз устанавливался при амбулаторном обследовании на основании общего врачебного осмотра, а также, в частности, кольпоскопии, данных дополнительного обследования, включающих, в частности, лабораторные, биохимические, цитологические исследования, данные инструментальных методов исследования (ЭКГ, эхокардиография, рентгеноскопия, эзофагогастродуоденоскопия (ЭГДС)). Все пациенты были разделены по нозологии на три группы: I (48 человек) - с заболеваниями органов желудочно-кишечного тракта: язвенная болезнь желудка; II (85 человек) - с заболеваниями нижних дыхательных путей: хронический бронхит, бронхоэктатическая болезнь, острая и хроническая пневмония; III (24 человека) - с заболеваниями репродуктивной системы: эрозии шейки матки, дисбиоз влагалища. Практически все пациенты (как следует из анамнеза) в течение длительного времени имели симптомы нарушений со стороны желудочно-кишечного тракта: колит, энтероколит, дисбактериоз, синдром раздраженного кишечника (СРК), обусловленные применением (в предыдущем лечении) антибиотиков из группы: пенициллинов, цефалоспоринов, тетрациклинов, линкозамидов, макролидов, которые практически не оказывали ожидаемого эффекта и, как правило, вызывали различные аллергические реакции. Всем больным до начала приема заявленной композиции исследовали кровь: общий анализ, биохимические показатели: ACT, АЛТ, креатинин, глюкозу, кальций, общий билирубин, белок, сывороточное железо, ОЖСС, натрий, калий, холестерин, мочевую кислоту, мочевину, альбумин, щелочную фосфотазу, ГГТ, триглицериды, -липопротеиды; мочу: общий анализ; содержимое кишечника: микробилогический анализ содержимого кишечника и копрограмму; пациентам с заболеваниями органов желудочно-кишечного тракта дополнительно проводили ЭГДС, а у женщин, до начала и после окончания лечения, проводили диагностические процедуры: кольпоскопию с последующей биопсией слизистой оболочки шейки матки для цитологического исследования и брали мазок из цервикального канала и вагины для микробиологического обследования содержимого. В каждой нозологической группе были выделены: одна опытная и две контрольные группы. Так, пациенты I группы были разделены следующим образом: 1-я группа пациентов (опытная) - 6 человек, принимала фармацевтическую композицию в виде гранул, включающую нифурател и КОС, по 2-3 раза в день после приема пищи, в течение 7-10 дней. 2-я группа пациентов (контроль) - 18 человек, принимала нифурател в дозе 500,0 мг и КОС в дозе 400,0 мг раздельно, в течение 7-10 дней. 3-я группа (контроль) - 24 человек, принимала нифурател в дозе 500,0 мг и плацебо в дозе 400,0 мг (вместо КОС) в течение 7-10 дней. Контрольные исследования проводили в течение 2 месяцев через каждые 10-14 дней. Резюме: улучшение общего состояния было зарегистрировано у большинства пациентов опытной группы (5 человек) после 5-6 дней приема заявленной композиции. Пациенты с язвенной болезнью желудка и двенадцатиперстной кишки (ДПК) отмечали исчезновение болевых ощущений в области желудка, ДПК и кишечника, а в анализах кишечного содержимого отмечено увеличение содержания лактобацилл и бифидобактерий; через 14 дней после начала лечения (во время проведения контрольной ЭГДС) у них было отмечено значительное уменьшение гиперемии и отека слизистой желудка и ДПК и появление первых признаков эпителизации язвенных дефектов. Через 6-9 дней после начала лечения состояние пациентов контрольных групп также улучшилось, однако в первой группе (у 9 пациентов - 50%), а во второй группе (у 18 пациентов - 75%) отчетливо проявились симптомы воздействия антибиотиков на кишечную микрофлору в виде дискомфорта в области живота, слабых болей по ходу толстого кишечника, метеоризма и диареи (дисбиоз кишечника). У 2 пациентов этих двух групп дисбиоз кишечника привел к снижению аппетита и нарушению сна. Пациенты II группы (с заболеваниями нижних дыхательных путей) также были разделены на три группы: 1-я группа пациентов (опытная) - 12 человек, принимала заявленную композицию в таблетированной форме, азитромицин с МОС, по 1 разу в день, во время или после приема пищи в течение 3 дней; курсовая доза азитромицина соответствовала количеству, определенному инструкцией по применению азитромицина в стандартных схемах лечения конкретных заболеваний нижних дыхательных путей и, как правило, не превышала 1,5 грамма; 2-я группа пациентов (контрольная) - 36 человек, принимала азитромицин в дозе 500,0 мг и МОС в дозе 1500,0 мг раздельно, 1 раз в день с интервалом в 2-2,5 часа, в течение 3 дней; 3-я группа пациентов (контрольная) - 37 человек, принимала азитромицин в дозе 500,0 мг и плацебо в дозе 1500,0 мг (вместо МОС) 1 раз в день с интервалом в 2 - 2, 5 часа, в течение 3 дней. В каждой группе пациенты были сравнимы по возрасту, длительности и тяжести заболевания, а также по сопутствующей патологии. Контрольные исследования проводили в течение 2 месяцев через каждые 8-10 дней. Резюме: улучшение общего состояния было зарегистрировано у всех 6 пациентов опытной группы после 3-х дней приема композиции. Во время проведения рентгеноскопии легких отмечено уменьшение перибронхиального и внутрибронхиального воспаления, увеличение прозрачности легких, увеличение подвижности диафрагмы, улучшение дренажной функции бронхов. У пациентов обеих контрольных групп в первые дни приема композиции состояние оценивали как неудовлетворительное: отмечалось повышение температуры тела, слабость, депрессия, метеоризм, запоры или диарея. Через 5 дней после начала лечения состояние больных контрольной группы также улучшилось, однако в первой группе у 9 (50%) во второй группе у 28 (75%) пациентов отчетливо проявились симптомы отрицательного воздействия антибиотиков на кишечную микрофлору в виде дискомфорта в области живота, слабых болей по ходу толстого кишечника, метеоризма и диареи. Пациенты III группы также были условно разделены на 3 группы: 1-я группа пациентов (опытная) - 6 человек, принимала заявленную фармацевтическую композицию в виде капсул, содержащих моксифлоксацин в дозе 400,0 мг и ФОС в дозе 800,0 мг, 2 раза в день, во время или после приема пищи в течение 7-10 дней; 2-я группа пациентов (контрольная) - 9 человек, принимала моксифлоксацин в дозе 400,0 мг и ФОС в дозе 800,0 мг раздельно, двукратно, с промежутком в 2 - 2,5 часа, в течение 7-10 дней; 3-я группа пациентов (контрольная), 9 человек, принимала моксифлоксацин в дозе 400,0 мг и плацебо в дозе 800,0 (вместо ФОС) двукратно, после еды в течение 7-10 дней. Резюме: улучшение общего состояния было зарегистрировано у 9 пациентов опытной группы после 5-8 дней приема композиции. Во время проведения кольпоскопии через 21 день от начала лечения было отмечено появление первых признаков краевой эпителизации эрозий и появление в микробиоценозах влагалища лактобацилл и бифидобактерий; значительно уменьшились выделения и полностью исчезли болевые ощущения. Данные цитологического исследования после окончания приема препарата свидетельствовали о практически полном замещении цилиндрического эпителия плоским эпителием, а мазки свидетельствовали о снижении явлений воспаления. У пациентов всех контрольных групп в первые дни приема композиции состояние оценивали как неудовлетворительное: отмечалось повышение температуры тела, слабость, депрессия, метеоризм, запоры или диарея. Через 6-9 дней после начала лечения состояние больных контрольных групп улучшилось, однако в первой группе у 5 и во второй группе у 6 пациенток отчетливо проявились симптомы отрицательного воздействия антибиотиков на кишечную микрофлору: в виде дискомфорта в области живота, слабых болей по ходу толстого кишечника, метеоризма и диареи. Практически у всех пациентов опытных групп (с учетом деления по нозологии) функциональное состояние желудочно-кишечного тракта нормализовалась, количество мышечных волокон, жира, жирных кислот, не переваренной клетчатки в копрограмме было в пределах нормы. Анализ динамики ряда биохимических показателей показал, что имеет место значимое снижение билирубина, -липопротеидов, триглицеридов, АЛТ, ACT. Структурно-функциональные изменения белков плазмы демонстрируют усиление связывающей способности альбумина, возрастание активности антител и белков системы комплемента. Результаты биохимического исследования и клеточного состава периферической крови также свидетельствуют о позитивной динамике процесса. Одновременно возросло количество синтезируемой мочевины, что свидетельствует об улучшении процессов переаминирования и трансаминирования аминокислот в печени, т.е. о нормализации обменных дезинтоксикационных процессов в печени. Практически все пациенты опытных групп отмечали улучшение качества жизни за счет увеличения физической активности, улучшения настроения и сна, нормализации аппетита и работы кишечника. Отрицательные побочные последствия приема композиций с антибиотиками никак не проявлялись ни в процессе лечения, ни при последующем наблюдении. В контрольных группах у пациентов, получавших антибиотик и олигосахарид раздельно, показатели внутрикишечного гомеостаза приближались к показателям опытной группы только в 53% случаев. В контрольных группах у пациентов, получавших антибиотик с плацебо, независимо от снижения выраженности симптомов основного заболевания под влиянием антибиотика, показатели внутрикишечного гомеостаза в 87% случаев не имели отчетливой тенденции к улучшению. Наблюдение за состоянием большинства пациентов опытных групп, получавших заявляемый препарат (с учетом тяжести основного заболевания), продолжалось в последующие 18 месяцев и подтвердило снижение уровня заболеваемости острыми респираторными вирусными заболеваниями, повышение работоспособности, нормализацию сна, снижение частоты рецидивов основного заболевания и стабильное улучшение качества жизни, в частности эвакуаторной деятельности кишечника. При сравнении со средними возрастными показателями заболеваемости у пациентов опытных групп установлено также снижение заболеваемости онкологическими заболеваниями, сердечно-сосудистыми заболеваниями, заболеваниями опорно-двигательного аппарата, а также сокращение сроков восстановления при мелких травмах связок, костей и суставов. С учетом всего вышеизложенного можно сделать обоснованный вывод о том, что заявляемая композиция является эффективным и безопасным средством лечения заболеваний, вызванных инфекционными агентами, при этом композиция оказывает стимулирующий эффект на лактобациллы и бифидобактерии, ингибируя при этом рост и размножение посторонней микрофлоры, оказывая тем самым выраженное профилактическое действие. Таким образом, в результате созданы варианты эффективной фармацевтической композиции и эффективный способ профилактики дисбиозов, расширены арсеналы фармацевтических композиций и способов профилактики дисбиозов. При этом расширен диапазон применения композиции пребиотиков и антибиотиков за счет включения в состав композиции наиболее эффективных антибактериальных препаратов для приема внутрь (например, фторхинолоны и ансамицины) и устранения побочных явлений. Кроме того, обеспечена эффективная утилизация пребиотического компонента композиции в кишечнике за счет введения олигосахаридов оптимальной степени полимеризации и оптимального соотношения компонентов с необходимой диперсностью (размеров частиц). ФОРМУЛА ИЗОБРЕТЕНИЯ1. Фармацевтическая композиция для профилактики дисбиоза кишечника в процессе антибиотикотерапии, предназначенная для перорального применения, содержащая антибиотик и пребиотик, отличающаяся тем, что антибиотик и пребиотик включены в виде порошка, при этом в качестве пребиотика включен олигосахарид, выбранный из группы: фруктоолигосахариды, галактоолигосахариды, ксилоолигосахариды, мальтоолигосахариды и изомальтоолигосахариды со степенью полимеризации от 2 до 10, с размером частиц до 0,3 мм и чистотой не менее 95%, а антибиотик - с размерами частиц от 20 до 200 мкм; антибиотик и олигосахарид включены в массовом соотношении от 1:1 до 1:100 соответственно. 2. Фармацевтическая композиция для профилактики дисбиоза кишечника в процессе антибиотикотерапии, предназначенная для перорального применения, содержащая антибиотик и пребиотик, отличающаяся тем, что антибиотик и пребиотик включены в виде порошка, при этом антибиотик, выбранный из группы: бета-лактамы, включая комбинации бета-лактамов с ингибиторами бактериальных беталактамаз; азалиды, фторхинолоны, амфениколы, гликопептиды, ансамицины, нитрофураны, производные фосфоновой кислоты, циклосерин, триметоприм, включен с размерами частиц от 20 до 200 мкм, а в качестве пребиотика включен олигосахарид со степенью полимеризации от 2 до 10, с размером частиц до 0,3 мм, чистотой не менее 95%; при этом антибиотик и олигосахарид включены в состав композиции в массовом соотношении от 1:1 до 1:100 соответственно. 3. Фармацевтическая композиция по любому из пп.1 и 2, отличающаяся тем, что она содержит фармацевтически приемлемые количества вспомогательных веществ, улучшающих органолептические и потребительские свойства, выбранные из группы: наполнители, корректоры вкуса, ароматизаторы, отдушки. 4. Фармацевтическая композиция по любому из пп.1 и 2, отличающаяся тем, что она выполнена в лекарственной форме, пригодной для перорального применения, выбранной из группы: капсулы, таблетки, порошки, пилюли, драже, гранулы, саше, гели, пасты, сиропы, эмульсии, суспензии, растворы. 5. Способ профилактики дисбиоза кишечника в процессе проведения антибиотикотерапии, предусматривающий прием фармацевтической композиции по п.1 или 2, которую вводят перорально. www.freepatent.ru способ повышения активности антибиотика стрептомицина в отношении устойчивых к нему м. tuberculosis - патент РФ 2405834Изобретение относится к микробиологии, биотехнологии и фтизиатрии и может быть использовано при лечении больных лекарственно устойчивым туберкулезом легких. Способ повышения активности антибиотика стрептомицина в отношении устойчивых к нему M.tuberculosis заключается в полимеризации и детоксикации стрептомицина путем обработки 0,15±0,05% раствором формалина при 40,0±2,0°С в течение 5-7 суток. Использование препаратов антибиотика стрептомицина, полученного способом по изобретению, позволяет, не изменяя концентрации антибиотика, уменьшить концентрацию формалина в лиофилизированном виде до 0,01%, в результате повышается эффективность лечения туберкулеза, вызванного устойчивыми к стрептомицину M.tuberculosis. 1 табл. Изобретение относится к микробиологии, биотехнологии и фтизиатрии и может быть использовано при лечении больных лекарственно устойчивым туберкулезом легких. При заболевании туберкулезом основным видом лечения является антибактериальная терапия, одним из основных антибиотиков используется стрептомицин. Однако при заболевании туберкулезом и массивной микробной популяции или вследствие нерационального использования антибиотика могут путем селекции или адаптации развиваться устойчивые к нему М.tuberculosis. В последнее время выделение М.tuberculosis, устойчивых к стрептомицину, отмечается у до 20% впервые выявленных больных (М.В.Шилова. Туберкулез в России в 2006 году. - Воронеж, 2007. - 150 с.). Развитие лекарственно устойчивых форм туберкулеза требует изменения режимов лечения и использования более токсичных и дорогостоящих препаратов резервного ряда (канамицин, фторхинолоны). При развитии полирезистентности возбудителя снижается эффективность лечения и ухудшается эпидемическая ситуация, что приводит к снижению качества жизни человека и экономическим потерям общества. Основным механизмом формирования устойчивости к аминогликозидам, в том числе и стрептомицину, является ферментативная инактивация антибиотика путем модификации, в результате чего препарат не может связываться с рибосомами микроорганизма и подавлять синтез белка в ядре последнего (С.В.Сидоренко и М.В.Эйдельштейн. Механизмы резистентности микроорганизмов // Практическое руководство по антиинфекционной химиотерапии. Под ред. Л.С.Страчунского, Ю.Б.Белоусова, С.Н.Козлова. Смоленск: МАКМАХ, 2007. - 464 с). С целью повышения активности антибиотиков в отношении устойчивых к ним микроорганизмов используются, в основном, методы введения в состав антибиотика ингибиторов. В настоящее время наиболее близким к заявляемому изобретению является получение антибиотика амоксициллин/клавуланат, когда с целью повышения активности препарата для воздействия на устойчивые к нему микроорганизмы в состав введен ингибитор b-лактамаз - клавулановая кислота (С.В.Сидоренко, С.Н.Козлов. Группа пенициллинов // Практическое руководство по антиинфекционной химиотерапии. Под ред. Л.С.Страчунского, Ю.Б.Белоусова, С.Н.Козлова. Смоленск: МАКМАХ, 2007. - 464 с). К недостаткам прототипа можно отнести то, что полученный этим способом препарат не действует на М.tuberculosis. Цель изобретения - повышение активности антибиотика стрептомицина в отношении устойчивых к нему М.tuberculosis. В результате будет повышена эффективность лечения туберкулеза, вызванного устойчивыми к стрептомицину М.tuberculosis. Поставленная цель достигается полимеризацией и детоксикацией антибиотика раствором формалина с концентрацией не более 0,15±0,05 при температуре 40,0±2,0°С в течение 5-7 суток. При таком способе обработки исходная концентрация антибиотика не изменяется, а концентрация формалина в лиофилизированном виде снижается до 0,01%. Пример осуществления способа. Было использовано 40 флаконов лиофилизированного стрептомицина, в которое с помощью шприца внесли по 5,0 мл 0,2% раствора формалина для детоксикации и полимеризации при 42°С в течении 7 суток. При проведении исследований по повышению эффективности антибиотика стрептомицина путем его полимеризации и обработки формалином были получены следующие результаты. У десяти больных туберкулезом различной продолжительности и с различными клиническими формами были выделены из мокроты М.tuberculosis, путем разведений определена их чувствительность к антибактериальным препаратам, в том числе и к стрептомицину. Анамнестически и с учетом режима проводимой терапии у четырех больных определена вторичная (приобретенная) и у шести - первичная лекарственная устойчивость микобактерий (ЛУ МБТ) к стрептомицину и другим антибактериальным препаратам (АБП). Выделенные культуры были посеяны на классические среды Левенштейна, одна из которых содержала обычный стандартный стрептомицин (субстанция), а вторая, опытная - модифицированный антибиотик стрептомицин, обработанный по заявляемому способу. Исследуемые препараты антибиотика вносили в среду в виде водных растворов из расчета 10 ЕД на 1 мл среды. Учет результатов роста проводили последовательно каждые десять дней в течение 45 дней. Результаты представлены в таблице.
Таким образом, положительный результат роста МБТ получен на двух культурах, которые были выделены у больных с далеко зашедшими формами туберкулеза органов дыхания как с первичной, так и вторичной ЛУ МБТ, при этом в обоих случаях - с полирезистентными штаммами М.tuberculosis. Однако получены отрицательные результаты роста МБТ и по полирезистентным штаммам М.tuberculosis с первичной и вторичной ЛУ МБТ, но не более чем к двум антибактериальным препаратам. ФОРМУЛА ИЗОБРЕТЕНИЯСпособ повышения активности антибиотика стрептомицина в отношении устойчивых к нему M.tuberculosis, отличающийся тем, что проводят его полимеризацию и детоксикацию путем обработки 0,15±0,05%-ным раствором формалина при 40,0±2,0°С в течение 5-7 суток. www.freepatent.ru Способ преодоления резистентности микроорганизмов к антибиотикамИзобретение относится к микробиологии. Может быть использовано для ингибирования роста микроорганизмов, в том числе при стерилизации различных сред. Способ включает воздействие на микроорганизмы композиции, содержащей антибиотик, поверхностно-активное вещество и растворитель. В композиции используют соотношение компонентов, обеспечивающее образование ассоциатов поверхностно-активного вещества, включающих антибиотик. Антибиотик выбирают из группы окситетрациклин, левомицетин, пенициллин. Количество антибиотика берут по отношению к ПАВ в мольном отношении (0,2-0,3):1. Способ обеспечивает повышение эффективности использования антибиотиков для ингибирования или инактивации микроорганизмов. 1 з.п. ф-лы.ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ПАТЕНТУИзобретение относится к области микробиологии, в частности к способам угнетения роста микроорганизмов, в том числе при стерилизации различных сред, дезинфекции и т.д. Известно использование антибиотиков для угнетения микроорганизмов (SU, авторское свидетельство 1816451, А 61 К 31/43, 1993). Согласно известному способу антибиотик вводят в жидкую среду, содержащую микроорганизмы, и выдерживают определенное время, достаточное для гибели микроорганизмов. Недостатком этого способа можно признать то, что к большинству известных, промышленно выпускаемых и дешевых антибиотиков у микроорганизмов выработался иммунитет. Известно одновременное использование антибиотиков и поверхностно-активных веществ для лечения колибактериоза у телят (SU, авторское свидетельство 1629062, А 61 К 31/00, 1991), состоящее в одновременном использовании, т.е. воздействии на микроорганизмы, находящиеся в теле биологического объекта, антибиотика и поверхностно-активного вещества. Недостатком способа является использование поверхностно-активных веществ в неоптимальном соотношении с антибиотиком, что не позволяет получить синергический эффект, приводящий к усиленному действию антибиотика, и не мешает вырабатывать иммунитет у микроорганизмов к антибиотикам. Следовательно, при реализации известного способа невозможно использовать традиционные антибиотики. Известно, что разработка и производство новых высокоэффективных антибиотиков является трудоемким и затратным процессом. По этой причине коммерчески предлагаемые новые антибиотики имеют высокую себестоимость и соответственно высокую коммерческую стоимость. По сравнению с разработкой новых антибиотиков более предпочтительным является направление разработки способа введения антибиотиков в организм человека или животного, или использование их для стерилизации, не позволяющее микроорганизмам опознавать вводимый антибиотик и вырабатывать против него защиту. Техническая задача, решаемая настоящим изобретением, заключается в разработке способа преодоления резистентности микроорганизмов к антибиотикам, приводящего по меньшей мере к ингибированию их роста или к их инактивации. Технический результат, получаемый в результате реализации изобретения, состоит в повышении эффективности использования антибиотиков для ингибирования или инактивации микроорганизмов. Указанный технический результат достигается за счет воздействия на микроорганизмы композиции, содержащей антибиотик, поверхностно-активное вещество и растворитель, причем в используемой композиции соотношение антибиотика, растворителя и поверхностно-активного вещества выбирают исходя из условия обеспечения образования ассоциатов поверхностно-активных веществ, в которые введены молекулы антибиотика. В качестве антибиотиков преимущественно могут быть использованы пенициллин, окситетрациклин или левомицитин. Преимущественно концентрация антибиотика в композиции составляет 20-30% мольн./ПАВ. Преимущественно концентрация поверхностно-активного вещества составляет (1-5)х10-3 М. При этом при использовании различных антибиотиков и поверхностно-активных веществ конкретные соотношения различны и их подбирают экспериментально. Указанные интервалы используемых концентраций поверхностно-активных веществ и антибиотика предпочтительны и концентрации конкретных пар: антибиотик - поверхностно-активное вещество, предпочтительно подбирать в указанных пределах. В качестве растворителя предпочтительно использовать воду для инъекций. В предлагаемой композиции за счет использования определенных соотношений антибиотика, поверхностно-активного вещества и растворителя происходит образование ассоциатов поверхностно-активного вещества, которые включают антибиотик. Экспериментально доказано, что использование антибиотика в таком виде не позволяет распознать его микроорганизмами, т.е. не приводит к выработке иммунитета у микроорганизмов. Любой антибиотик при использовании его в таком виде выполняет характерную для него функцию, а именно ингибирует процесс роста микроорганизмов. Следовательно, для ингибирования роста микроорганизмов по предлагаемому способу можно использовать традиционные антибиотики, широко выпускаемые микробиологической промышленностью, к которым при применении их с использованием традиционных способов выработался у микроорганизмов иммунитет. Предлагаемый способ можно проиллюстрировать на следующих примерах. Пример 1. Готовили раствор, содержащий 1,8х10-3 М калиевой соли додецилового полуэфира итаконовой кислоты, левомицитин в количестве 20% мольн./ПАВ и воду (остальное). Испытания проводили на грамположительных и грамотрицательных бактериях (E. coli, S., albus, Sulmonella) при предварительном посеве бактерий на питательной среде, в качестве которой использовали кровяной агар, с последующим культивирование при 37oС в течение 24 часов. Полученную культуру обрабатывали приготовленной композицией. Было установлено, что в течение первых суток рост микроорганизмов был подавлен в значительной степени или отмечалось полное уничтожение микроорганизмов. Пример 2. Готовили раствор, содержащий то же поверхностно-активное вещество в такой же концентрации, но в качестве антибиотика использовали окситетрациклин в количестве 22% мольн./ПАВ. Микроорганизмы культивировали аналогично примеру 1. В результате установили, что ингибирование роста микроорганизмов идет в большей степени. Полное уничтожение микроорганизмов наступает через 52 часа при предварительной выдержке культуры до посева. Использование в качестве антибиотика левомицитина при условии соблюдения концентраций, приводящих к образованию ассоциатов поверхностно-активного вещества, включающего молекулы левомицитина, позволило получить результаты, аналогичные приведенным в примерах 1 и 2. Использование любого из указанных выше антибиотиков в сочетании с поверхностно-активным веществом, взятых в соотношениях значительно ниже или значительно выше указанных, не привело к получению указанного технического результата. Обработка микроорганизмов этими растворами приводит к незначительному увеличению эффективности антибиотиков. Из приведенных примеров следует, что при использовании концентраций, указанных в описании, для каждой конкретной пары: поверхностно-активное вещество - антибиотик, следует подбирать более точное соотношение концентраций для получения максимального эффекта. Использование изобретения позволит повысить эффективность использования традиционно выпускаемых антибиотиков с относительно низкой себестоимостью.ФОРМУЛА ИЗОБРЕТЕНИЯ1. Способ преодоления резистентности микроорганизмов к антибиотикам, включающий воздействие на микроорганизмы композиции, содержащей антибиотик, поверхностно-активное вещество и растворитель, отличающийся тем, что в композиции используют соотношение компонентов, обеспечивающее образование ассоциатов поверхностно-активного вещества, включающих антибиотик, выбранный из группы окситетрациклин, левомицетин, пенициллин, при этом количество антибиотика берут по отношению к ПАВ в мольном отношении (0,2-0,3): 1. 2. Способ по п. 1, отличающийся тем, что концентрация поверхностно-активного вещества составляет (1-5)•10-3М.bankpatentov.ru |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
г.Самара, ул. Димитрова 131 [email protected] |
 |