|
|
||||||||||
|
способ повышения эффективности антибиотикотерапии. Антибиотик патентКонъюгат антибиотика и антибактериальное лекарственное средство на его основеКонъюгат антибиотика с полианионным полисахаридом, содержащим карбоксильные, сульфатные, карбонильные, альдегидные, хлоридные или другие отрицательно заряженные группы, и с полимерным носителем имеет молекулярную массу (ММ) 25-110 кДа. Конъюгат антибиотика получают облучением в потоке ускоренных электронов или гамма-излучения в дозах 1,0-4,5 Мрад. В качестве антибиотика используют изониазид, моксифлоксацин или пириметамин. В качестве полисахарида используют сульфатированный дестран с ММ 20-60 кДа, карбоксиметилированный глюкан с ММ 60-100 кДа. В качестве полимерного носителя используют полиэтиленоксид с ММ 2-10 кДа или полиэтиленвинилацетат, коллаген, желатин, полиуретан или их смесь с ММ каждого из указанных полимерных носителей 2-10 кДа. Антибактериальное лекарственное средство включает указанный конъюгат антибиотика и может дополнительно включать фармацевтически приемлемые аддитивы. Технический результат - конъюгат антибиотика обладает более высокой скоростью избирательного накопления в макрофагах путем скэвинжер-рецептор-зависимого эндоцитоза, повышенной терапевтической эффективностью при использовании меньших доз, большей пролонгацией действия и сниженной общей токсичностью. 2 н. и 8 з.п. ф-лы, 4 ил., 9 табл.
Изобретение относится к фармакологии и медицине, в частности к новому конъюгату антибиотика и антибактериальному лекарственному средству на его основе, пригодному для лечения хронических инфекционных заболеваний, таких как туберкулез, токсоплазмоз, сибирская язва, лейшманиоз и других, связанных с инфицированием макрофагов бактериями, одноклеточными паразитами и вирусами. Многие облигатные паразиты, такие как токсоплазмы, бактерии туберкулеза, сибирской язвы, бруцеллеза, вирусы гепатита и СПИДа, персистируют в макрофагах человека и именно эти клетки участвуют в диссеминации инфекционного процесса. Внутриклеточная локализация инфекционных агентов делает их устойчивыми к проводимой терапии антибиотиками и антивирусными препаратами вследствие их ограниченного поступления в макрофаги, что ведет к длительному лечению, увеличению доз токсичных препаратов и приводит к серьезным побочным эффектам. Эта проблема может быть решена при использовании конъюгатов антибиотиков с лигандами к скэвинжер-рецепторам класса А, расположенных преимущественно на поверхности макрофагов и обеспечивающих быстрый эндоцитоз крупных полианионных молекул (отрицательно заряженных полисахаридов и белков). Техническое решение данного вопроса позволит резко уменьшить дозу применяемых лекарств и увеличить их терапевтическую эффективность. Известны лекарственные средства, состоящие из липосом, содержащих антибиотики рифампицин и гентамицин, повышающих эффективность лечения гнойно-воспалительных заболеваний легких (патент RU (11) 2063770 (13) C1 (51) 6 A61K47/00, A61K31/71 от 20.07.1996) и лечения туберкулеза (патент, БP N 5614 от 24.06.2003). Существенным недостатком липосомальных препаратов, наряду с трудоемкой и дорогостоящей технологией изготовления и хранения, является использование в качестве компонентов липосом фосфолипидов, которые подвергаются окислению в условиях производства и становятся нестабильными. Кроме того, применение липосом в клинических условиях значительно ограничено вследствие возможности развития у больных эмболии сосудов, так как фосфолипиды обладают большой гидрофобностью и в кровотоке наблюдается их агрегация. Наиболее близким аналогом настоящего изобретения является конъюгат изониазида на декстране пролонгированного действия (патент РФ 2192865, кл. А61К31/715, опубл. 20.11.02; патент РФ 2163120, кл. А61К31/455, опубл. 20.02.01). Указанный конъюгат получают следующим образом. Раствор смеси коммерческого плазмозамещающего лекарственного препарата "Реополиглюкин" декстрана с молекулярной массой 30-60 кДа и изониазида подвергают действию ионизирующего излучения. В этих условиях на декстране иммобилизуется 50% изониазида. Данный препарат, в силу лизосомотропности использованной матрицы, накапливается в лизосомах макрофагов (в том числе и в инфицированных микобактериями туберкулеза макрофагах гранулем). В лизосомах происходит гидролиз пролонгированного препарата с высвобождением изониазида в активной форме и созданием вследствие этого на длительный период высоких концентраций изониазида в микроокружении микобактерий туберкулеза. Этим и объясняется увеличение терапевтической эффективности данного препарата и снижение его токсичности по сравнению со свободным изониазидом. Недостатком прототипа является использование в качестве компонента конъюгата неполярного декстрана, который неспособен проникать в макрофаги через специфические рецепторы, а захватывается не специфически эндоцитозом различными типами клеток, что существенно ограничивает его накопление именно в инфицированных макрофагах. Декстран быстро деградирует внутри лизосом, что также ограничивает время пролонгации антибиотика. Эти недостатки ограничивают повышение терапевтической эффективности данного препарата. Несмотря на целый ряд положительных свойств данного препарата, дальнейшие исследования показали, что возможно создание препарата, положительные свойства которого могут быть усилены по сравнению с прототипом. Задачей настоящего изобретения является создание новых конъюгатов антибиотиков с полимерным носителем и полианионным модифицированным полисахаридом, а также лекарственного средства, пригодного для лечения хронических внутримакрофагальных инфекций. Поставленная задача достигается настоящим конъюгатом антибиотика с полимерным носителем, выбранным из полиэтиленоксида (ПЭО) с ММ 2-10 кДа, полиэтиленвинилацетата, коллагена, желатины, полиуретана или их смеси c молекулярными массами 2-10 кДа, и полианионным модифицированным полисахаридом, таким как декстран или глюкан, имеющим карбоксильные, карбонильные, альдегидные, сульфатные, хлоридные или другие отрицательно заряженные группы, при соотношении компонентов полисахарид: полимерный носитель антибиотик, равном 1-10:10-20:1-5. Причем конъюгат получен облучением смеси полимерного носителя, модифицированного полисахарида и антибиотика в потоке ускоренных электронов или гамма-излучения в дозах 1,0-4.5 Мрад. Конъюгат антибиотика настоящего изобретения отличается от конъюгата прототипа тем, что имеет в своем составе полимерный носитель - полиэтиленоксид ММ 2-10 кДa, полиэтиленвинилацетат, коллаген, желатин, полиуретан или их смесь, предпочтительно, полиэтиленоксид ММ 2-10 кДa, и отрицательно заряженный полисахарид, причем молекулярная масса (MM) конъюгата составляет 25-110 кДа. Предложенный конъюгат по сравнению с прототипом обладает более высокой скоростью избирательного накопления в макрофагах путем скэвинжер-рецептор-зависимого эндоцитоза, повышенной терапевтической эффективностью при использовании меньших доз, большей пролонгацией действия и сниженной общей токсичностью. Изобретение также относится к антибактериальному лекарственному средству, включающему конъюгат антибиотика, полимерный носитель и модифицированный отрицательно заряженный полисахарид, пригодному для лечения хронических инфекционных заболеваний, таких как туберкулез, токсоплазмоз, сибирская язва, лейшманиоз и других, связанных с инфицированием макрофагов бактериями, одноклеточными паразитами и вирусами. Конъюгат по изобретению может per se использоваться как лекарственное средство, но в случае необходимости, в зависимости от пути введения, использоваться в комбинации с фармацевтически приемлемыми аддитивами, которые тщательно смешивают с эффективным количеством конъюгата по изобретению и формулируют в форму, предназначенную для введения (таблетки, пилюли, растворы и т.д.). После составления композиции с соответствующим фармацевтически приемлемым носителем в желательной дозировке фармацевтическую композицию данного изобретения можно ввести людям и животным перорально, парентерально, местно (в виде порошков, мазей или капель), буккально, в виде орального или назального аэрозоля или подобными им путями, в зависимости от тяжести подвергаемой лечению инфекции. В некоторых вариантах реализации соединения изобретения можно вводить при уровнях дозировки от около 0,001 мг/кг до около 50 мг/кг, от около 0,01 мг/кг до около 25 мг/кг или от около 0,1 мг/кг до около 10 мг/кг массы тела индивидуума в 1 день, 1 или более раз/день, для получения желательного терапевтического эффекта. В некоторых вариантах реализации соединения вводят перорально или парентерально. Жидкие лекарственные формы для перорального введения включают, но не ограничиваются, фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к активным соединениям, жидкие лекарственные формы могут содержать инертные разбавители, обычно используемые в данной области, такие как, например, вода или другие растворители, солюбилизирующие агенты и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности, масло семян хлопка, арахисовое, кукурузное, семенное, оливковое, касторовое и кунжутное), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот сорбитана и их смеси. Кроме инертных разбавителей, пероральные композиции могут также включать адъюванты, такие как смачивающие агенты, эмульгирующие и суспендирующие агенты, подслащивающие, ароматизирующие агенты и отдушки. Твердые лекарственные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых лекарственных формах активное соединение смешано, по меньшей мере, с одним инертным, фармацевтически приемлемым эксципиентом или носителем, таким как цитрат натрия или дикальцийфосфат, и/или а) наполнители или агенты для увеличения объема, такие как крахмалы, лактоза, сахароза, глюкоза, маннит и кремневая кислота, b) связывающие агенты, такие как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и акация, с) увлажнители, такие как глицерин, d) разрыхляющие агенты, такие как агар-агар, карбонат кальция, крахмал картофеля или тапиоки, альгиновая кислота, некоторые силикаты и карбонат натрия, е) агенты, замедляющие растворение, такие как парафин, f) ускорители всасывания, такие как соединения четвертичного аммония, g) смачивающие агенты, такие как, например, цетиловый спирт и моностеарат глицерина, h) поглотители, такие как каолин и бентонитовая глина, и i) смазывающие агенты, такие как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смеси. В случае капсул, таблеток и пилюль лекарственные формы могут также включать агенты, придающие буферные свойства. Твердые композиции аналогичного типа можно также использовать в качестве наполнителей в мягких и твердых заполненных желатиновых капсулах с использованием таких эксципиентов, как лактоза или молочный сахар, а также полиэтиленгликоли с высокой молекулярной массой и им подобные. Твердые лекарственные формы таблеток, драже, капсул, пилюль и гранул можно получить с покрытиями и оболочками, такими как растворяющиеся в кишечнике покрытия и другие покрытия, хорошо известные в области составления фармацевтических композиций. Они могут необязательно содержать агенты, придающие непрозрачность, и могут также состоять только из композиции, которая высвобождает активный ингредиент (ингредиенты), или, предпочтительно, в определенной части кишечного тракта, необязательно отсроченным образом. Примеры внедренных в носитель композиций, которые можно использовать, включают полимерные вещества и воски. Твердые композиции аналогичного типа можно также использовать в качестве наполнителей в мягких и твердых заполненных желатиновых капсулах с использованием таких эксципиентов, как лактоза или молочный сахар, а также полиэтиленгликоли с высокой молекулярной массой и им подобные. Изобретение иллюстрируется следующими примерами получения конъюгатов моксифлоксацина, изониазида и пириметамина, скэвинжер-рецептор-зависимого накопления конъюгатов этих антибиотиков в макрофагах и терапевтической активности полученных конъюгатов моксифлоксацина, изониазида и пириметамина в сравнении со свободными формами антибиотиков и прототипом на экспериментальных моделях туберкулеза и токсоплазмоза. 1.Получение конъюгатов антибиотиков Конъюгаты антибиотиков получают облучением смеси соответствующих полимерного носителя (полиэтиленоксид, полиэтиленвинилацетат, коллаген, желатин, полиуретан или их смесь), отрицательно заряженного полисахарида и антибиотика при их мас.% соотношении, равном 1-10:10-20:1-5 в потоке ускоренных электронов или гамма-излучения в дозах 1,0-4,5 Мрад, что демонстрируется следующими примерами. Пример 1 К 90 мл водного раствора, содержащего 5% полиэтиленоксид ММ 2-10 кДа, 10% карбоксиметилированный глюкан ММ 60 кДа, 50 мМ фосфатный буфер и 0,9% NaCl вносят 10 мл 20% раствора моксифлоксацина до конечной концентрации 20 мг в 1 мл (% соотношение полиэтиленоксид:карбоксилированный глюкан:антибиотик соответствует 5:10:2). Смесь перемешивают 15 мин и облучают потоком ускоренных электронов в дозе 2,5-3,5 Мрад на ускорителе электронов ЭЛВ-6. Получают конъюгат моксифлоксацина с карбоксиметилированным глюканом и полиэтиленоксидом в виде слегка опалесцирующего раствора и удаляют не связанный с полисахаридом и полиэтиленоксидом антибиотика хроматографическими методами. Полученный раствор лиофилизируют. Выход готового продукта составляет 99%. Пример 2 Аналогично получают конъюгат изониазида, используя вместо моксифлоксацина изониазид, соотношение полиэтиленоксид: карбоксилированный глюкан:антибиотик равно 1:10:2. Пример 3 Аналогично получают конъюгат пириметамина, используя вместо моксифлоксацина пириметамин, соотношение полиэтиленоксид:карбоксилированный глюкан:антибиотик равно 5:20:2. Пример 4 К 90 мл водного раствора, содержащего 5% полиэтиленоксид ММ 2-10 кДа, 10% сульфатированный дестран ММ 20-60 кДа, 50 мМ фосфатный буфер и 0,9% NaCl вносят 10 мл раствора 20% моксифлоксацина до конечной концентрации 20 мг в 1 мл (мас.% соотношения полиэтиленоксид:сульфатированный декстран:антибиотик соответствует 5:10:2). Смесь перемешивают 15 мин и облучают потоком ускоренных электронов в дозе 2,5-4,5 Мрад на ускорителе электронов ЭЛВ-6. Получают конъюгат моксифлоксацина с сульфатированным декстраном ММ 30-60 кДа и полиэтиленоксидом в виде прозрачного раствора. Полученный раствор лиофилизируют. Выход готового продукта составляет 99%. Пример 5 Аналогично получают конъюгат изониазида, используя вместо моксифлоксацина изониазид, соотношение полиэтиленоксид:полисахарид:антибиотик равно 10:20:5. Пример 6 Аналогично получают конъюгат пириметамина, используя вместо моксифлоксацина пириметамин, соотношение полиэтиленоксид:полисахарид:антибиотик равно 5:20:1. Пример 7 К 90 мл водного раствора, содержащего 5% полиэтиленоксида ММ 2-10 кДа, 20% карбоксиметилированный глюкан ММ 100 кДа, 50 мМ фосфатный буфер и 0,9% NaCl вносят 10 мл раствора 20% моксифлоксацина до конечной концентрации 20 мг в 1 мл (% соотношение полиэтиленоксид:карбоксилированный глюкан:антибиотик соответствует 5:20:2). Смесь перемешивают 15 мин и облучают потоком ускоренных электронов в дозе 4,5 Мрад на ускорителе электронов ЭЛВ-6. Получают конъюгат моксифлоксацина с карбоксиметилированным глюканом и полиэтиленоксидом в виде слегка опалесцирующего раствора. Полученный раствор лиофилизируют. Выход готового продукта составляет 99%. Пример 8 Аналогично получают конъюгат изониазида, используя вместо моксифлоксацина изониазид, а в качестве полимерного носителя используют полиэтиленвинилацетат, соотношение полимерный носитель:карбоксилированный глюкан:антибиотик равно 5:20:1. Пример 9 Аналогично получают конъюгат пириметамина, используя вместо моксифлоксацина пириметамин, а в качестве полимерного носителя - коллаген, соотношение полимерный носитель:полисахарид:антибиотик равно 5:20:2. Аналогичными способами получены конъюгаты указанных антибиотиков с другими полимерными носителями, такими как желатин или полиуретан, а также конъюгаты других антибиотиков, в частности итромидазола и амфотерицина В. Все они обладают очень близкими биологическими свойствами, которые демонстрируются ниже. 2.Сведения, подтверждающие быстрое и эффективное скэвинжер-рецептор-зависимое накопление конъюгатов в макрофагах in vitro и in vivo. 2.1.Сведения о накоплении конъюгатов, полученные в опытах in vitro Изучение скэвинжер-рецептор-зависимого накопления конъюгатов моксифлоксацина (таблица 1), пириметамина (таблица 2) с полиэтиленоксидом (ММ 2-10 кДа) и карбоксиметилированным глюканом (ММ 20-60 кДа), а также конъюгатов изониазида (таблица 3) с полиэтиленоксидом (ММ 10 КДа) и сульфатированным декстраном (ММ 60 кДа) проводилось параллельно с исследованием неконъюгированных форм моксифлоксацина, пириметамина, изониазида, а также конъюгата изониазида с немодифицированным декстраном (ММ 60 кДа) (таблица 4) в опытах на культуре перитонеальных макрофагов мыши. Конъюгаты указанных антибиотиков, полученные методом облучения в потоке ускоренных электронов (см. пример 1-9), содержащие 10 мг моксифлоксацина, или изониазида, или пириметамина на 100 мг конъюгата и неконъюгированные моксифлоксацин, или изониазид, или пириметамин вносили в культуральную среду в конечной концентрации антибиотика в среде инкубации клеток 1-10 мкг/ мл среды. С целью выявления скэвинжер-рецептор-зависимого захвата препаратов макрофагами использовали метод конкуренции избыточных концентраций лигандов этих рецепторов карбоксиметилированного глюкана или сульфатированного декстрана, внося их среду инкубации одновременно с конъюгатами антибиотиков. После инкубации макрофагов в течение 2 ч клетки гомогенизировали, экстрагировали соответствующие антибиотики и определяли концентрацию моксифлоксацина, или изониазида, или пириметамина методом жидкостной хроматографии высокого давления на колонке с Нуклеосилом С 18 с флуорометрической или спектрофотометрической детекцией. Как видно из результатов, представленных в таблицах 1-3, внутриклеточная концентрация моксифлоксацина (таблица 1), изониазида (таблица 3) и пириметамина (таблица 2) в макрофагах при инкубации макрофагов с конъюгатами моксифлоксацина, изониазида и пириметамина была выше в 10-15 раз, чем при инкубации клеток с неконъюгированными формами соответствующих антибиотиков. Дозозависимое накопление моксифлоксацина (таблица 1), изониазида (таблица 3) или пириметамина (таблица 2) в макрофагах в зависимости от концентрации конъюгатов моксифлоксацина, или изониазида, или пириметамина имеет сходный характер и проявляет признаки рецептор-зависимого захвата конъюгатов данных антибиотиков. При внеклеточной концентрации конъюгатов моксифлоксацина, или изониазида, или пириметамина 5 мкг/мл внутриклеточное накопление соответствующих антибиотиков достигает насыщения, характерного для рецептор-зависимого захвата. Накопление неконъюгированных моксифлоксацина, или изониазида, или пириметамина в макрофагах происходит пропорционально их концентрации в среде, что свидетельствует о неспецифическом рецептор-независимом диффузионном процессе проникновения неконъюгированных антибиотиков в клетки. Добавление в среду избыточной концентрации лигандов скэвинжер-рецепторов карбоксиметилглюкана или декстрансульфата полностью блокирует рецептор-опосредованный захват конъюгатов моксифлоксацина, изониазида или пириметамина клетками, но не влияет на захват соответствующих неконъюгированных антибиотиков. Сравнительное исследование захвата клетками конъюгата изониазида с полиэтиленоксидом и сульфатированной формой декстрана и прототипа данного изобретения - конъюгата изониазида с немодифицированным декстраном показывают (таблица 4), что конъюгат в соответствии с прототипом значительно медленнее накапливается в клетках и его накопление не зависит от взаимодействия со скэвинжер-рецепторами макрофагов. Полученные результаты показали, что в отличие от неконъюгированных форм антибиотиков и в отличие от препарата прототипа изониазида, конъюгированного с незаряженной формой декстрана (прототип), конъюгаты антибиотиков по изобретению значительно быстрее и в больших концентрациях накапливаются в макрофагах и их накопление опосредовано скэвинжэр-рецептор-зависимым эндоцитозом.
2.2.Сведения о накоплении конъюгата антибиотиков, полученные в опытах in vivo Данные о накоплении конъюгата антибиотиков in vivo демонстрируются на примере конъюгата моксифлоксацина. На чертеже представлены результаты световой (фото слева) и флуоресцентной микроскопии (фото справа) макрофагов легких (фиг. 1А и 2Б) и селезенки (фиг. 2А и Б), полученных при внутривенном ретроарбитальном введении мышам конъюгата моксифлоксацина (фиг. 1Б и 2Б) и неконъюгированного моксифлоксацина (фиг. 1А и 1Б) в концентрации моксифлоксацина 10 мг/кг массы тела животным. Как видно на чертеже-фотографии, полученной с помощью флуоресцентного микроскопа, в макрофагах, выделенных из легочного лаважа и селезенки мышей после введения конъюгата моксифлоксацина, но не свободного моксифлоксацина, наблюдается характерное для моксифлоксацина свечение, отражающее его накопление в клетках. Наблюдаемая при введении конъюгата моксифлоксацина величина интенсивности эмиссии легочных макрофагов в 60 раз, а макрофагов селезенки в 130 раз выше, чем при введении неконъюгированного моксифлоксацина. Полученные результаты показывают, что конъюгаты моксифлоксацина уже через 10-15 минут после внутривенного введения животным избирательно накапливаются в макрофагах легких и селезенки, что проявляется появлением специфической флуоресценции клеток с высокой интенсивностью эмиссии, характерной для моксифлоксацина. При введении неконъюгированных форм моксифлоксацина в аналогичных концентрациях величина флуоресценции клеток оставалась сходной с контрольным уровнем. На фиг.1 дана световая (слева) и флуоресцентная микроскопия легочных макрофагов и макрофагов селезенки (фиг.2), полученных после введения неконъюгированного моксифлоксацина (фиг.1А и 2А) и конъюгата моксифлоксацина (фиг.1Б и фиг.2Б) мышам. 3.Сведения о терапевтической эффективности конъюгатов антибиотиков, полученные в опытах in vivo Терапевтическая эффективность конъюгатов антибиотиков исследована на экспериментальных моделях туберкулеза и токсоплазмоза у мышей. Исследования конъюгатов антибиотиков проводились параллельно с исследованием их неконъюгированных аналогов. Дополнительно проводились исследования конъюгатов изониазида (по изобретению) в сравнении с прототипом изобретения конъюгатом немодифицированного декстрана и изониазида. 3.1.Сведения о антимикобактериальной активности конъюгатов изониазида и моксифлоксацина Антимикобактериальный эффект конъюгатов моксифлоксацина или изониазида оценивали на модели развития острого генерализованного туберкулеза при заражении мышей M. tuberculosis линии Erdman. На 7 день после инфицирования внутривенно вводили моксифлоксацин, изониазид, конъюгат моксифлоксацина в дозах 5-200 мкг/массы тела или конъюгат изониазида в дозах 1-10 мг/кг массы тела в концентрациях, эквивалентных концентрациям неконъюгированного моксифлоксацина или неконъюгированного изониазида. Антимикобактериальную активность оценивали по числу бактериальных колоний в гомогенатах печени, селезенки и легких на 21 сутки после инфицирования животных. Как видно из данных таблицы 5, конъюгат моксифлоксацина (по изобретению) в 20 раз более эффективно подавлял рост микобактерий в печени, селезенке и легких, чем свободный моксифлоксацин. Наибольший терапевтический эффект конъюгат моксифлоксацина проявлялся в селезенке, органе относительно богатом макрофагами. Терапевтический эффект дозы конъюгата моксифлоксацина 5 мкг/кг массы тела сопоставим с дозой 200 мкг/кг массы тела моксифлоксацина. При исследовании конъюгата изониазида с полиэтиленоксидом и сульфатированным декстраном (по изобретению) (таблица 6) было показано, что его антимикобактериальная активность приблизительно в 5 раз превосходит активность неконъюгированного изониазида и в 3 раза превосходит активность прототипа изобретения конъюгата изониазида с немодифицированным декстраном. Полученные данные свидетельствуют, что конъюгаты изониазида и моксифлоксацина по изобретению оказывают в несколько раз более выраженный антимикобактериальный эффект в сравнении с препаратами в соответствии с прототипом и неконъюгированными формами изониазида и моксифлоксацина, что позволяет существенно снизить их терапевтическую дозу.
3.2.Сведения о антитоксоплазмозной активности конъюгатов пиромитамина по изобретению Антитоксоплазмозный эффект конъюгата пиромитамина оценивали на модели развития токсоплазмоза при заражении мышей Toxoplasma gondii. Через сутки после инфицирования цистами Toxoplasma gondii внутрибрюшинно вводили неконъюгированный пиромитамин или конъюгат пиромитамина по изобретению в эквивалентных концентрациях (10-40 мг/массы тела). Антимикобактериальную активность оценивали по % выживаемости мышей в течение 30 суток наблюдения. Как видно из данных таблицы 7, конъюгат пиромитамина уже в концентрации 10 мг/кг массы в 5-7,5 раз более эффективно, чем неконъюгированный пиромитамин сокращал % смертности животных от токсоплазмоза. В концентрации 20 мг/кг массы конъюгат пиромитамина полностью предотвращал гибель животных на 10 и 20 сутки и проявлял в 12 раз более эффективную защиту на 30 сутки, чем неконъюгированный пиромитамин. Наибольший терапевтический эффект конъюгата пиромитамина отмечался в концентрации 30 мг/кг массы, при которой в отличие от неконъюгированного пиромитамина смертность животных была равна 0. Проведенные исследования показали, что конъюгат пиромитамина по изобретению обладает значительно большей по сравнению с неконъюгированной формой пиромитамина терапевтической эффективностью, которая проявляется в значительном снижении % смертности животных при развитии токсоплазмоза.
4.Сведения о пролонгированном действии предлагаемых конъюгатов антибиотиков по изобретению Изучение пролонгированного действия конъюгатов антибиотиков демонстрируется на примере исследования конъюгата моксифлоксацина по изобретению, проводимого в сравнении с неконъюгированной формой моксифлоксацина. Фармакокинетические данные были получены при внутривенном введении мышам неконъюгированного моксифлоксацина или конъюгата моксифлоксацина в дозе 3,3 мг моксифлоксацина на кг массы тела мыши с последующим определением концентрации моксифлоксацина в крови (таблица 8) и в печени (таблица 9) методом жидкостной хроматографии высокого давления. Фармакологические параметры подсчитывались, используя программу SCI of Prophylactic Medicine, Moscow. Как видно из таблицы 8, кривая «концентрация-время» в полулогарифмических координатах для конъюгата моксифлоксацина нелинейна, в то время как для моксифлоксацина она имеет линейный характер. Фаза α и величина kα у конъюгата моксифлоксацина значительно выше, чем у моксифлоксацина. Фармакокинетические параметры крови свидетельствуют о значительно более быстром перераспределении конъюгата моксифлоксацина из крови в печень, чем моксифлоксацина. В то же время данные таблицы 9 свидетельствуют, что по сравнению с неконъюгированным моксифлоксацином конъюгат моксифлоксацина значительно медленнее выводится из печени, что демонстрирует пролонгированную персистенцию конъюгата моксифлоксацина по изобретению в сравнении с неконъюгированным моксифлоксацином. Результаты исследования показывают, что конъюгат моксифлоксацина характеризуется увеличенным пролонгированным действием по сравнению с неконъюгированным моксифлоксацином. Период полувыведения неконъюгированного моксифлоксацина составляет 12 часов, а предлагаемого препарата 7,5 суток.
5.Сведения об общей токсичности терапевтических доз конъюгатов антибиотиков по изобретению Предлагаемые конъюгаты моксифлоксацина, изониазида и пириметамина в 25-30 раз менее токсичны, чем неконъюгированные моксифлоксацин, изониазид и пириметамин; а конъюгат изониазида по изобретению в 1,8 раза менее токсичен, чем его конъюгат с немодифицированным декстраном по прототипу. Таким образом, предлагаемые конъюгаты антибиотиков по изобретению выгодно отличаются от неконъюгированных форм антибиотиков и от прототипа изониазид-немодифицированный декстран по ряду параметров - быстрому и избирательному накоплению антибиотиков в макрофагах, пролонгированным действием и по уровню общей токсичности. 1. Конъюгат антибиотика с полианионным полисахаридом и полимерным носителем, причем молекулярная масса конъюгата составляет 25-110 кДа. 2. Конъюгат антибиотика по п.1, где полианионный полисахарид представляет собой полисахарид, содержащий карбоксильные, сульфатные, карбонильные, альдегидные или хлоридные отрицательно-заряженные группы. 3. Конъюгат антибиотика по п.1, полученный облучением в потоке ускоренных электронов или гамма-излучения в дозах 1,0-4,5 Мрад. 4. Конъюгат антибиотика по п.1, отличающийся тем, что в качестве антибиотика используют изониазид, моксифлоксацин или пириметамин. 5. Конъюгат антибиотика по п.1, отличающийся тем, что в качестве полисахарида используют сульфатированный декстран с молекулярной массой 20-60 кДа. 6. Конъюгат антибиотика по п.1, отличающийся тем, что в качестве полисахарида используют карбоксиметилированный глюкан с молекулярной массой 60-100 кДа. 7. Конъюгат антибиотика по п.1, отличающийся тем, что в качестве полимерного носителя используют полиэтиленоксид с молекулярной массой 2-10 кДа. 8. Конъюгат антибиотика по п.1, отличающийся тем, что в качестве полимерного носителя используют полиэтиленвинилацетат, коллаген, желатин, полиуретан или их смесь с молекулярной массой каждого из указанных полимерных носителей 2-10 кДа. 9. Антибактериальное лекарственное средство, включающее конъюгат антибиотика с полианионным полисахаридом и полимерным носителем, имеющий молекулярную массу 25-110 кДа по п.1. 10. Лекарственное средство по п.9, дополнительно включающее фармацевтически приемлемые аддитивы. www.findpatent.ru способ повышения эффективности антибиотиков - патент РФ 2400218Изобретение относится к производству антибиотиков. Способ повышения эффективности антибиотиков включает детоксикацию и полимеризацию антибиотиков 0,15±0,05% раствором формалина при 40,0±2,0°С в течение 5-7 суток с последующим выпуском препаратов в жидком или лиофилизированном виде. Способ по изобретению позволяет повысить эффективность антибиотиков на 50±10% с одновременным снижением их токсичности и аллергенности, что позволяет использовать антибиотические препараты в лечебном диапазоне с более высоким терапевтическим эффектом на фоне снижения противопоказаний. 1 табл. Изобретение относится к микробиологии и биотехнологии, в частности к производству антибиотиков, в том числе бета-лактамовых. Известно, что постоянно увеличивается число бактерий, продуцирующих ферменты бета-лактамозы, расщепляющие антибиотики. Многолетнее применение противомикробных средств и воздействие физических и химических мутагенов привело к появлению микроорганизмов, устойчивых к антибиотикам. Ферментативное расщепление антибиотика обеспечивает более 80% бактериальной резистентности. Для повышения эффективности антибиотиков вводят в их химическую структуру фтор, пиперазиновый радикал или комбинируют с другими антибиотиками: суббактам с ампициллином, янтарной, лимонной, фумаровой и другими органическими кислотами и их солями - сукцинатами, пробиотиками (Андреева Н.Л., Войтенко В.Д. Повышение эффективности химиопрепаратов с помощью органических кислот // Международный вестник ветеринарии. - 2004. - № 1. - С.55-58.) Наибольший антибактериальный эффект получен комбинацией антибиотиков с клавулановой кислотой, полученной в 1976 г. из продукта метаболизма гриба Streptomyces clavuligeris. Несмотря на то, что клавулановая кислота сама по себе слабый антибиотик, она оказалась активным ингибитором бета-лактамаз в результате проникновения в структуру бета-лактамазы и блокирования ее активности (Коротяев А.И., Бабичев С.А. Медицинская микробиология, иммунология и вирусология. / Учебник для вузов. - Спб.: Специальная литература, 1998. - С.135-142). За прототип взят способ комбинации амоксициллина и клавулановой кислоты (Покровский В.И., Поздеев O.K. Медицинская микробиология. - М.: Изд-во ГЭОТАР, 1999. - С.148-151). Недостатками указанного способа являются дороговизна и дефицитность препарата, токсичность для печени, почек, способность аллергизировать организм, появление лекарственно-устойчивых микроорганизмов, чувствительность к кислой среде, создание в желудочно-кишечном тракте дисбиоза. Для устранения указанных недостатков, для повышения эффективности антибиотиков, снижения их токсичности и аллергизации организма, повышения устойчивости к расщепляющему действию бактериальных ферментов, создания стабильной структуры антибиотиков предлагается полимеризация и детоксикация ряда антибиотиков с помощью 0,15±0,05% раствора формалина при 40±2,0°С в течение 5-7 суток. Правомерность использования формалина для полимеризации и детоксикации антибиотиков - продукта метаболизма и деструкции грибов - обоснована производством и применением анатоксинов, толерогенов (аллергоидов), анатоксин-вакцин, инактивированных вирусных вакцин и т.д. Однако использование формалина для детоксикации, полимеризации структуры и повышения эффективности антибиотиков не проводилось. Целью предлагаемого изобретения является повышение эффективности антибиотиков в отношении резистентных микроорганизмов, приобретение устойчивости к ферментативному действию бактериальных ферментов, снижение токсичности и аллергенности для организма. Поставленная цель достигается полимеризацией и детоксикацией антибиотиков 0,15±0,05% раствором формалина при 40,0±2,0°С в течение 5-7 суток. При этом исходная концентрация формалина снижается до 0,05% в жидком растворе, а в лиофилизированном виде - до 0,01% концентрации. Полученные антибиотики приобретают повышенную эффективность в отношении лекарственно-резистентных микроорганизмов, устойчивость к бактериальным ферментам на фоне снижения токсичности и аллергенности для организма. В патентной и научно-технической литературе не выявлены технические решения, аналогичные заявленному. Использование 0,15±0,05% раствора формалина позволяет достичь стабильной полноты детоксикации, полимеризации всего комплекса антибиотиков и получения безвредных препаратов, обладающих повышенным бактериостатическим и бактерицидным действием в отношении лекарственно-устойчивых микроорганизмов, т.е. получить технический результат. Установленная возможность 0,15±0,05% раствора формалина при 40,0±2,0°С в течение 5-7 суток обеспечить полимеризацию, детоксикацию, стабильность структуры, снижение токсичности и аллергенности, и повышение на 50±10% эффективности антибиотиков в отношении лекарственно-устойчивых микроорганизмов позволила предложить рациональную технологию изготовления эффективных безвредных для человека и животных антибиотиков. Под действием раствора формалина с концентрацией 0,15±0,05% происходит процесс полимеризации структуры антибиотиков, вследствие чего повышается их устойчивость к ферментативному действию бактериальных ферментов. Формалин также обеспечивает полную детоксикацию антибиотиков. Указанная концентрация 0,15±0,05% формалина и температурный режим обработки являются оптимальными для обеспечения стабильной полимеризации и детоксикации антибиотиков. В результате указанной обработки модифицированные антибиотики проявили повышенную на 50±10% бактерицидную активность по отношению к исследованным микроорганизмам, а также безвредность за счет снижения токсичности антибиотиков. Аналогичное действие формалина на процессы детоксикации токсинов микроорганизмов было положено в основу изготовления модифицированных антибиотиков. Предлагаемое изобретение иллюстрируется следующими примерами. Пример 1. Способ детоксикации и полимеризации антибиотиков 0,15±0,05% раствором формалина. В работе использовано по 60 флаконов лиофилизированных пенициллина, эритромицина, канамицина, тетрациклина, гентамицина, полимиксина, неомицина, амоксиклава, в которые с помощью шприца внесли по 5,0 мл 0,2% раствора формалина для детоксикации и полимеризации при 42°С в течение 7 суток. По окончании детоксикации и полимеризации половина флаконов каждого антибиотика оставлена для исследований в жидком виде, а вторую часть подвергли лиофилизации. Пример 2. Определение остаточного содержания формалина в растворах антибиотиков до и после лиофилизации. Методом титрования с раствором йода, едкого натрия, серной кислоты и гипосульфита установлено, что в жидких растворах антибиотиков произошло снижение содержания формалина с 0,2% до 0,05%, а после лиофилизации содержание формалина составило 0,01% вместо 0,2% («Фармакопейная статья» - Физико-химические и иммунно-биологические методы контроля препаратов. Издание официальное МЗ РФ. - М. 2000 г. - С.51-56). Пример 3. Определение безвредности модифицированных антибиотиков. Испытание проведено на 10 белых мышах, 6 морских свинках, 20 телятах и 22 поросятах. После подкожного введения 5 белым мышам модифицированного пенициллина и 5 мышам - полимиксина по 0,2-0,3 мл препаратов трехкратно, у животных не было отмечено выраженных токсических явлений и гибели при наблюдении в течение 12 суток. При пятикратном с интервалом в 1 сутки подкожном введении 5 телятам пенициллина, 5 телятам гентамицина, 5 телятам тетрациклина и 5 телятам полимиксина все животные остались живыми, на месте введения препаратов не отмечено гнойно-некротических поражений в течение 20 суток (срок наблюдения). Подкожное введение 6 морским свинкам модифицированного пенициллина в объеме 2-3 мл трехкратно с интервалом 24 часа также не вызвало образования гнойных абсцессов на месте введения и гибели животных при наблюдении в течение 15 суток. Пример 4. Определение эффективности полученных антибиотиков определяли методом серийных разведении препаратов. Полученные антибиотики, обозначенные буквой М (модифицированные) сравнивали с соответствующими им коммерческими препаратами. Бактерицидные свойства антибиотиков определяли в отношении эшерихий, стафилококков, сальмонелл, Вас.Subtilis и протея. Полученные результаты представлены в таблице.
Из данных, представленных в таблице, следует, что растворы антибиотиков, подвергнутые детоксикации, полимеризации 0,2% раствором формалина при 42°С в течение 7 суток проявили повышенное на 50±10% бактерицидное действие на E.coli, S.aureus, S.dublin, Вас. Subtilis и Pr. Vulgaris в сравнении с контрольными антибиотиками. ФОРМУЛА ИЗОБРЕТЕНИЯСпособ повышения эффективности антибиотиков, отличающийся тем, что проводят полимеризацию и детоксикацию антибиотиков обработкой 0,15±0,05%-ным раствором формалина при 40,0±2,0°С в течение 5-7 сут и применяют их в жидком или лиофилизированном состоянии. www.freepatent.ru способ повышения эффективности антибиотикотерапии - патент РФ 2167654Изобретение относится к области ветеринарии, а именно частной патологии и терапии животных, и может найти применение при проведении лечения заболеваний антибиотиками. Способ заключается в совместном введении антибиотика и тетрагидрофуранола-З. Способ обеспечивает повышение эффективности применения антибиотиков за счет увеличения времени экспозиции антибиотика из мышечной ткани и его антибактериальных свойств, а также исключение постинъекционных инфильтратов и нагноений. 3 табл. Изобретение относится к области ветеринарии, а именно частной патологии и терапии животных, и может найти применение при проведении лечения заболеваний антибиотиками. Известны способы повышения эффективности антибиотикотерапии путем дополнительного облучения кровезаменителя рентгеновским излучением, вводимого одновременно с антибиотиками (патент РФ N 2009664 "Способ лечения бактериальных инфекций"), сочетанного применения антибиотика и сорбента СУМС-1 (патент РФ N 2083211 "Способ лечения острых воспалительных заболеваний матки"), дополнительного подкожного введения гормонального препарата маммофизин (патент РФ N 1334421 "Способ профилактики послеродового эндометрита у песцов и лисиц"), а также применение гипериммунной антигистаминной сыворотки (патент РФ N 2129013 "Способ лечения крупного рогатого скота с септическими воспалительными заболеваниями"). Недостатками данных способов являют зависимость эффективности антибиотикотерапии от состояния больного, уровня обменных процессов, резистентности организма, что существенно снижает результаты терапии. Известен способ антибиотикотерапии, основанный на использовании антибиотика и вспомогательного лекарственного вещества оксиарил - или оксиаралкилкарбоновая кислота или ее производные (патент ЕПВ (ЕЕ) N 0035770). Недостатком его является пероральный путь введения. Этих недостатков лишен способ, при котором повышение активности антибиотиков осуществляют добавлением к ним косвенна диметилтоцианина или пиронина (международная заявка N 82/00003). Недостатком этого способа является ограниченный перечень антибиотиков (флеомизин, блеомицин, таллисомицин). Наиболее близким способом, принятым за прототип, является использование в качестве вспомогательного вещества 0,1% адреналина, добавляемого в количестве 0,05 мл на одну инъекцию антибиотика (патент РФ N 2048811 "Способ повышения эффективности атнибиотикотерапии"), который поддерживает уровень антибиотика в крови, за счет замедления всасывания антибиотика из мышц в результате спазма местных сосудов, тем самым способствует медленному и равномерному его поступлению в кровь и созданию в ней максимальной концентрации антибиотика. К недостаткам данного способа относятся недостаточно высокая эффективность антибиотикотерапии и образование крупноочаговых некрозов мышечной ткани в месте, где вводился антибиотик с адреналином, что приводит к появлению постинъекционных инфильтратов и нагноений. Техническим результатом изобретения является повышение эффективности применения антибиотиков за счет увеличения времени экспозиции антибиотика из мышечной ткани и его антибактериальных свойств, а также исключение постинъекционных инфильтратов и нагноений. Технический результат антибиотикотерапии достигается путем совместного введения антибиотика и тетрагидрофуранола-3. Тетрагидрофуранол-3 используется для подкожного, внутримышечного, внутривенного, трансдермального, интравагинального, внутриматочного, эпидурального и интерцистерального введения антибиотиков. Изобретением решается задача повышения эффективности применения антибиотиков путем пролонгации действия антибиотика и стабилизации его уровня в организме в результате равномерного и продолжительного распределения тетрагидрофуранола-3 на биомолекулярном покрове мембран клеток, что препятствует быстрому всасыванию антибиотика и тетрагидрофуранола-3, а также равномерному их поступлению в кровь и созданию в крови максимальной концентрации. Сущность способа поясняется следующим примером. Проводились экспериментальные исследования совместимости и стабильности тетрагидрофуранола-3 с антибиотиками. Лабораторные исследования тетрагидрофуранола-3 в сочетании с антибиотиками на его стабильность по основным физико-химическим характеристикам и содержанию основного действующего вещества в процессе хранения проводились в следующей периодичности: в момент приготовления раствора, через 3, 6, 12 и 18 месяцев (табл. 1). Исследование проводилось общепринятыми методами, рекомендованными ГФХ: pH, плотность, стерильность, содержание в препарате тетрагидрофуранол-3. Каждое исследование проводилось не менее чем в 6-ти повторностях. Установлено, что за время наблюдений раствор оставался прозрачным, pH 5.35 0.08, плотность 1.005 0.008 г/см3. Полученные в результате исследования данные по содержанию активно-действующего вещества в растворе свидетельствуют, что он сохраняется в необходимых количествах в течение 18 месяцев после изготовления. С целью определения совместимости 2,5% раствора тетрагидрофуранола-3 с антибиотиками провели серию опытов, где испытывали действие ряда антибиотиков с испытуемым веществом и без него на музейных штаммах сальмонеллы и стрептококков (табл. 2). Таким образом, установлено, что тетрагидрофуранол-3 не подавляет антибактериальные свойства антибиотиков, а в ряде случаев даже усиливает их действие. Проводились также исследования тетрагидрофуранола-3 по определению его антисептических свойств. Бактерицидные свойства определялись в двух сериях опытов на различных микробных группах при различной концентрации тетрарофуранола-3 в сравнении с 70, 50 и 40% спиртом. В результате опытов было установлено, что тетрагидрофуранол-3 в 70, 50 и 40%-ной концентрации как антисептик не уступает 70% спирту, а на сальмонеллы и колибактерии оказывает более выраженное антимикробное действие по сравнению с 40 и 50%-ным спиртом. В производственных условиях проведены испытания антибиотика гентамицина в растворе тетрагидрофуранола-3 в общей схеме лечения послеродового катарально-гнойного эндометрита у 65 коров (табл. 3). Из приведенных данных следует, что разведение антибиотиков в 2.5%-ном растворе тетрагидрофуранола-3 способствует более эффективному использованию антибиотиков в терапии воспалительных процессов у животных, что выражается в благоприятных отдаленных последствиях влияния на организм животных. Применяемая последовательность разбавления антибиотиков 2,5%-ным раствором тетрагидрофуранола-3 позволила направленно сохранить и повысить антибактериальные свойства антибиотиков, что привело к сокращению сроков выздоровления животных. В частности, при производственных испытаниях растворителя антибиотиков сроки лечения заболеваний у животных в среднем сократились на 5,3 дня. Использование предлагаемого способа обеспечивает следующие преимущества по сравнению с известными способами: а) сокращение сроков лечения, повышение эффективности антибиотиков; б) простота, надежность и доступность способа позволяет дополнительно повысить эффективность применения антибиотиков.ФОРМУЛА ИЗОБРЕТЕНИЯСпособ повышения эффективности антибиотикотерапии, заключающийся в совместном введении антибиотика и его пролонгатора, отличающийся тем, что в качестве пролонгатора вводят тетрагидрофуранол-3.www.freepatent.ru способ повышения эффективности антибиотиков - патент РФ 2425668Изобретение относится к микробиологии и биотехнологии, в частности к производству антибиотиков. Способ повышения эффективности антибиотиков, заключающийся в том, что проводят детоксикацию и полимеризацию антибиотиков обработкой сначала раствором формалина, а затем раствором этония при определенных условиях, и применяют их в жидком или лиофилизированном состоянии. Вышеописанный способ повышает эффективность антибиотиков. 2 з.п. ф-лы, 2 табл. Изобретение относится к микробиологии и биотехнологии, в частности к производству антибиотиков, в том числе бета-лактамовых. В результате исследований выявлено, что снижение эффективности антибиотиков связано с их инактивацией бактериальными ферментами - бета-лактамазами, продуцируемыми бактериальными клетками (стафилококками и др.), повышением выведения антибиотиков из клетки, мутациями рибосомальных белков и соответственно подавлением синтеза бактериальных белков и в целом торможения взаимодействия т-РНК с рибосомами (Никитин А.В. Титециклин: антимикробное действие и химиотерапевтическая эффективность // Антибиотики и химиотерапия, 2009, 54; 1-2. С.63-65; Соколова Г.Б., Краснов В.А. Новый противотуберкулезный препарат Рифалекс // Антибиотики и химиотерапия, 2009, 54; 1-2. С.38-41). Повышение химиотерапевтической активности антибиотиков проводится комбинацией разных групп антибиотиков, в том числе с клавулановой кислотой (антибиотик, полученный в 1976 году из продукта метаболизма гриба Streptomyces clavuligerus), а также введением в их химическую структуру фтора, пиперазинового радикала и совместное применение с лимонной, янтарной и изоянтарной кислотами и их солями - сукцинатами, а также пробиотиками (Андреева Н.Л., Войтенко В.Д. Повышение эффективности химиопрепаратов с помощью органических кислот // Международный вестник ветеринарии, 2004, № 1. - С.55-58; Шевелева М.А., Раменская Г.В. Современные представления о применении пробиотических средств при антибиотикотерапии // Антибиотики и химиотерапия, 2009, 54; 3-4. - С.61-64). Однако на фоне снижения бактериальной резистентности, повышения токсичности и особенно нефротоксичности антибиотиков арсенал использования средств антибактериальной терапии резко сужается. В России пока не выявлены патогены, резистентные к метициллину, ванкомицину, линезолиду, но в Западной Европе выделено до 20%, а в США - до 55% устойчивых к указанным антибиотикам микроорганизмов. Поэтому появление резистентных микроорганизмов в других регионах мира и в России является вопросом времени. Современные подходы совершенствования изготовления антибиотиков нуждаются в иных направлениях, так как существующий потенциал разработки инновационных антибактериальных препаратов ограничен, и принципиально новых антибиотиков создать не удается. Создание новых лекарственных форм и комбинаций антибиотиков не обеспечивает качественного прорыва и снижения токсичности в фармокинетике антимикробных препаратов. Известен способ создания более эффективного антибиотика комбинацией амоксициллина с клавуланатом (Карпов О.И. Флемоклавсолютат - новая лекарственная форма амоксициллина/клавуланата // Клиническая фармакология и терапия. - 2006. - 15. - № 4. - С.1-4). Несмотря на замену ампициллина на амоксициллин, обладающий более эффективным бактерицидным действием и проникновением в ткани и жидкости организма, и последующее создание ряда комбинированных антибиотиков - аугментина, сулациллина и т.д., основные недостатки, присущие антибиотикам, сохранились. Это - токсичность, появление лекарственноустойчивых видов микроорганизмов, депрессивное их воздействие на иммунную систему организма, дороговизна и дефицитность из-за прекращения изготовления в РФ антибиотиков (Медуницын Н.В. Биопрепараты. 2006, № 4. С.2-3). Для устранения указанных недостатков, для повышения бактерицидной эффективности антибиотиков, снижения их токсичности и аллергизации организма, повышения их устойчивости к действию бактериальных ферментов за счет создания у них стабильной структуры предлагается полимеризация и детоксикация антибиотиков двумя детоксикаторами - вначале 0,15±0,05% раствором формалина при 40,0±2,0°С в течение 3-5 суток, а затем 0,15±0,05% раствором этония (бисчетвертичного аммониевого соединения) при 40,0±2,0°С в течение 3-5 суток из расчета 100-150 мг/мл антибиотика. Правомерность использования формалина и этония для полимеризации и детоксикации антибиотиков основана на производстве и применении анатоксинов, толерогенов (аллергоидов), инактивированных вирусных вакцин. Однако сведений об использовании этих соединений при изготовлении антибиотиков в патентной и научной литературе не обнаружено. Использование этония в качестве полимеризатора и детоксикатора доказало свою эффективность при получении ряда инактивированных вакцин, разработанных авторами заявляемого способа (RU 2360697, 2371197, 2372937, 2377013, 2377014, 2377016). Этоний обладает инактивирующим действием на токсины ряда микроорганизмов и стимулирует заживление ран, поэтому используется при лечении трофических язв, маститов, стоматитов, кератитов и т.д. (Покровский В.И. Медицинская микробиология, 1999. С.138). При этом этоний менее токсичен и не обладает канцерогенными свойствами в отличие от формалина. При получении вакцин формалин и этоний практически подавляют индукцию экзотоксинов и обеспечивают их детоксикацию. Изучение действия формалина и этония на антибиотики показало их эффективность в усилении бактерицидного действия антибиотиков, повышении их резистентности к ферментам, вырабатываемым патогенными микроорганизмами, снижении токсичности самих антибиотиков. На основании изученных свойств был разработан режим полимеризации и детоксикации, дозировка формалина и этония и предложен способ повышения эффективности антибиотиков. Цель изобретения - повышение эффективности антибиотиков на основе усиления их бактерицидных свойств, снижения токсичности, усиления резистентности антибиотиков к бета-лактамным ферментам бактерий. В результате повысится эффективность терапии инфекционных болезней животных. Поставленная цель достигается полимеризацией и детоксикацией антибиотиков вначале 0,15±0,05% раствором формалина при 40,0±2,0°С в течение 3-5 суток, а затем 0,15±0,05% раствором этония при 40,0±2,0°С в течение 3-5 суток из расчета 100-150 мг/мл антибиотика. При таком способе детоксикации и полимеризации концентрация антибиотика сохраняется, а содержание формалина и этония снижается в 10 и более раз, а при изготовлении лиофилизированных препаратов полностью утрачивается. Способ заключается в том, что эффективность антибиотиков повышают полимеризацией и детоксикацией при 42°С в течение 3-5 суток сначала раствором формалина, а затем в том же режиме раствором этония. При этом в антибиотики поочередно вводят 0,2% растворы формалина и этония и применяют их в жидком состоянии. При использования 0,1% растворов формалина и этония после полимеризации и детоксикации антибиотики подвергают лиофилизации. Теоретическое обоснование и экспериментальное подтверждение обеспечения стабильной и полной детоксикации и полимеризации антибиотиков и получения в результате безвредных препаратов, обладающих бактерицидным действием в отношении лекарственноустойчивых микроорганизмов позволило предложить рациональный и экономически выгодный способ изготовления и повышения эффективности антибиотиков, то есть получить технико-биологический эффект. Полученные результаты иллюстрированы следующими примерами и таблицами. Пример 1. Осуществление способа. Во флаконы с лиофилизированным антибиотиком (пенициллин, метициллин, эритромицин, амоксициллин, амоксиклав, стрептомицин, тетрациклин, энфроксацин и др.) с помощью шприца внесли по 5,0 мл 0,2% раствора формалина для детоксикации и полимеризации при 42°С в течение 3-5 суток, а затем во флаконы с растворенным в 0,2% растворе формалина антибиотиком ввели с помощью шприца 5,0 мл 0,2% раствора этония для продолжения детоксикации и полимеризации в термостате при 42°С в течение 3-5 суток. Полученные растворы антибиотиков при комнатной температуре сохраняли прозрачность, бактерицидную активность в течение 1 года (срок наблюдения). Для изготовления препаратов в лиофилизированном виде детоксикацию и полимеризацию антибиотиков проводили в уменьшенном вдвое объеме формалина и этония. При этом лиофилизированный тюбик с антибиотиком сохранял свою исходную форму в течение 1 года (срок наблюдения). Пример 2. Испытание ряда модифицированных антибиотиков на токсичность. В исследованиях использовали 24 белых мышей массой 18-20 г и 24 цыплят-бройлеров 20-суточного возраста, которых разделили на 4 группы по 6 голов в каждой. Испытание на токсичность проводили ежедневно в течение трех суток путем подкожного введения по 0,5 мл модифицированного пенициллина, тетрациклина, амоксициллина и энфроксацина (байтрила). При этом на месте введения модифицированных антибиотиков не было гнойных или некротических поражений, а все животные (мыши и бройлеры) остались живыми в течение 15 суток (срок наблюдения). Пример 3. Сравнительная оценка бактерицидной эффективности коммерческих и модифицированных антибиотиков. Для оценки бактерицидной эффективности модифицированных антибиотиков использовали бумажные диски, пропитанные антибиотиками, результаты исследования представлены в таблице 1.
Учитывая, что показатели эффективности антибиотиков по диаметрам задержки роста микроорганизмов по бумажным дискам являются относительными, для более точной оценки использовали мясопептонный глицериновый бульон (МПГБ) с определенной концентрацией микроорганизмов и антибиотиков. Полученные результаты представлены в таблице 2.
Из данных, представленных в таблице 1, следует, что диаметры подавления роста микроорганизмов по бумажным дискам на агаре Хоттингера у модифицированных антибиотиков превышают показатели для известных коммерческих препаратов практически вдвое. Идентичные показатели бактерицидной активности у модифицированных антибиотиков получены в сравнении с коммерческими препаратами в отношении 10 тысяч в 1 мл МПГП указанных микроорганизмов (табл.2). ФОРМУЛА ИЗОБРЕТЕНИЯ1. Способ повышения эффективности антибиотиков, заключающийся в том, что проводят детоксикацию и полимеризацию антибиотиков обработкой сначала 0,1-0,2%-ным раствором формалина при 42°С в течение 3-5 суток, а затем 0,1-0,2%-ным раствором этония при 42°С в течение 3-5 суток и применяют их в жидком или лиофилизированном состоянии. 2. Способ по п.1, заключающийся в том, что антибиотики обрабатывают 0,2%-ным раствором формалина и 0,2%-ным раствором этония и применяют в жидком состоянии. 3. Способ по п.1, заключающийся в том, что антибиотики обрабатывают 0,1%-ным раствором формалина и 0,1%-ным раствором этония, а затем подвергают их лиофилизации. www.freepatent.ru Способ получения антибиотика
Использование: биотехнология, ветеринария. Сущность: культивируют не менее 2-х дней один из штаммов микроорганизма Streptomyces thermoarchaensis NCIB 12015, 12111, 12112, 12113 или 12114 в аэробных условиях при 20 - 50°С и рН 5,5 - 8,5. Из культуральной жидкости выделяют антибиотик формулы, приведенный в описании изобретения. При необходимости его очищают хроматографией. Целевой продукт обладает антигельминтозной активностью. Изобретение относится к новым соединениям антибиотика и способам их получения. В описании патента Великобритании 2166436 описано получение антибиотиков 541, которые можно выделить из продукта ферментации вида Streptomyces. Антибиотики S541 представляют собой группу родственных соединений, имеющих неполную форму Предлагаемые соединения представляют собой 23-кетон, аналоги антибиотиков S541. Таким образом, в одном варианте настоящего изобретения предлагаются, в частности, соединения формулы (II) В указанных соединениях формулы (II) R1 является изопропильной группой. Особенно важными активными соединениями предлагаемого изобретения являются соединения формулы (II), в которых R1 является изопропильной группой и OR4 представляет гидроксильную группу. Соединения предлагаемого изобретения могут применяться в качестве антибиотиков и/или как промежуточные соединения для получения других активных соединений и/или при выделении и очистке соединений антибиотиков S541. Предлагаемые соединения обладают антибиотической активностью, например антигельминтной активностью, против нематодов, в частности анти-эндопаразитарной и анти-эктопаразитарной активностью. Эктопаразиты и эндопаразиты заражают людей и целый ряд животных, особенно имеют широкое распространение среди сельскохозяйственных животных, таких как свиней, овец, крупного рогатого скота, коз и домашней птицы, лошадей и домашних животных, например собак и кошек. Паразитатная инфекция домашнего скота, приводящая к анемии, недостаточности питания и потере веса, является основной причиной экономических потерь во всем мире. К представителям эндопаразитов, заражающих указанных животных и/или людей, относятся Ancelostoma, Ascaridia, Ascaris, Aspicularis, Brugia, Bunostomum, Copillar Chabortia, Cooperia, Dictyocaulus, Pirofilaria, Dracunculus, Enterobius, Haemonehus, Acterakis, Loa hecator, Nematodirus, Nematospiroides, Heligomoroidis, Nippostrongylus, Oesophagostomun, Onchocerca, Ostertagia, Oxyuris, Parascaris, Strongylus, Strongyloides, Syphacia, Foxascacis, Toxocara, Trichonema, Trichostrongylus, Trichinella, Trichuris, Uncinaria и Wuchareria. Примерами эктопаразитов, заражающих животных и/или людей, являющимся членистоногие энтопаразиты, например жалящие насекомые, падальная муха, блоки, вши, клещи, сосущие насекомые, искодовые клещи и другие двукрылые насекомые-вредители. К примерам такого рода октопаразитов, заражающих животных и/или людей, относятся Ambylomma, Boophilus Chorioptes, Calliphore, Demodex, Demallenia, Dermatobia Gastrophilus, Haematobia, Haematopinus, Haemophysalis, Hyalomma, Hyperderma, Ixodes, Linognathus, Lucilia, Melophagus, Oestrus, Otobius, Otodectes, Psorergates, Rhipicephal Sarcoptes, Stomoxys и Tabanus. Обнаружено, что предлагаемые соединения эффективно действуют как in vitro, так и in vivo, против широкого ряда эндопаразитов и эктопаразитов. В частности, обнаружено, что предлагаемые соединения активно действуют против нематодов, таких как Haemonchus contortus, Ostertagicircu mcincta, Irichostrongglus colubiformis, Dicty caulus Viviparis, Cooperia oncophera, ostertagia ostertagi, Hematospi roides dufius и Nippostrongylus brazililusis, и паразитарных клещей, например Sarcoptes sp. и Psoroptes sp. Таким образом предлагаемые соединения применяются при лечении животных и людей с эндопаразитарной и/или эктопаразитарной инфекциями. Виды паразитов меняются в соответствии с хозяином (животным) и доминирующим местонахождением инфекции. Следовательно, например, возбудители Haemonchus contortus, Ostertagia circumcincta и Trichostrongylus colubifornus обычно поражают овец и преимущественно локализуются в желудке и тонкой кишке, в то время как Dictyocaulus, Viviparus, Cooperia oncophora и Ostertagia ostertagi обычно поражают крупный рогатый скот и локализованы в легких, кишечнике или желудке соответственно. Антибиотическая активность предлагаемых соединений может быть продемонстрирована, например, своей активностью in vitro против свободно живущих нематодов, например Cacnorhabiditis elegans. Кроме того заявленные соединения имеют применение в качестве противогрибковых веществ, например, против штаммов Candida, как например, Candida albicans и Candida glabrata, и против дрожжей, таких как Saccharomyces carlsbergensis. Предлагаемые соединения имеют применение в борьбе с вредителями-насекомыми, клещами и нематодами в сельском хозяйстве, садоводстве, лесоводстве, здравоохранении и хранении продуктов. Ими можно успешно обрабатывать вредителей почвы и сельскохозяйственных культур, включая хлебные злаки (например, пшеницу, ячмень, маис, рис), овощи (например, сою), фрукты (например, яблоки, виноград и цитрусовые), корнеплоды (например, сахарную свеклу, картофель). Характерными примерами таких вредителей являются фруктовые клещи и тля, например Aphis fabae, Aulacorthum circumflexum, Myzus persical, Nephotettix cincticeps, Hilparvate lugens, Panonychus ulmi, Phorodon humuli, Phyllocoptruta oleivora, Tetranychus urtical и представители рода Trialeuroides, нематоды, например представители рода Aphelencondes, Olobodera, Heterodes Miloidogyne и Panagrellus, чешуйчатые, например Helioth Plutella и Spodeptera, долгоносик-каландрина, например Anthonomus grandis и Sitophlus granarius, хрущаки мучные, например Tribolium castaneu, мухи, например Musca domestica, муравьи Рихтера; моли-минеры узкокрылые; Pear psylla трипсы табачные; таракановые, например Blatella germanica и Pesiplaneta amerilna, москитные, например Aedes algypti. Предложены соединение формулы (II), которые могут быть использованы в качестве антибиотиков. В частности, их можно использовать при лечении животных и людей, пораженных эндопаразитарной, эктопаразитарной и/или грибковой инфекциями и в качестве пестицидов для борьбы с вредителями-насекомыми, клещами и нематодами, в сельском хозяйстве, садоводстве или лесном хозяйстве, в качестве пестицидов для борьбы с вредителями-насекомыми, клещами и нематодами, в сельском хозяйстве, садоводстве или лесном хозяйстве, в качестве пестицидов и других обстоятельствах, например в хранилищах, зданиях или других общественных местах или местах локализации сельскохозяйственных вредителей. Предлагаемые соединения могут быть применены либо к хозяину (животному или человеку), либо к культурным растениям или другой растительности, либо к самим вредителям или месту их расположения. Предлагаемые соединения могут быть сформулированы для приема в любой удобной форме при использовании в ветеринарии или практической медицине. Таким образом, предлагаемое изобретение содержит в пределах своего объема фармацевтические композиции, содержащие соединение, пригодное для применения в ветеринарии или терапии. Такие композиции могут быть представлены при использовании в традиционной форме с помощью одного или нескольких подходящих носителей или наполнителей. Предлагаемые композиции содержат составы в форме, особенно пригодной для парентерального (в том числе, введение внутрь молочной железы), орального, ректального, местного применения в виде имплaнтанта, для применения при глазных, ушных или заболеваниях мочеполовой системы, подходящими способами и агентами для приготовления состава предлагаемых соединений пригодных для использования в ветеринарии или терапии, являются способы, которые описаны в патенте Южной Африки N 85/7049 для соединений антибиотиков S541. Предлагаемые соединения можно применять в комбинации с другими фармацевтически активными ингредиентами. Суммарная суточная доза предлагаемых соединений с применением как в ветеринарии, так и в терапии, будет соответственно в интервале 1-2000 мг/кг веса тела, предпочтительно 50-1000 мг/кг, причем указанные дозировки можно принимать в дробных дозах, например 1-4 раза в день. Предлагаемые соединения можно составлять в любой удобной форме, пригодной для земледелия или садоводства. Таким образом предлагаемое изобретение включает в пределах своего объема составы, содержащие соединение, предназначенное для применения в земледелии или садоводстве. Такие рецептуры включают сухие или жидкие формы, например дусты, включая пылевидные субстраты или концентраты, порошки, в том числе растворимые или смачиваемые порошки, гранулы, включая микрогранулы и диспергируемые гранулы, таблетки, текучие вещества, эмульсии, например, разбавленные эмульсии или эмульгируемые концентраты, пропиточные составы, например, составы для пропитки корней и семян, протравливатели семян, семенные гранулы, масляные концентраты, масляные растворы, инъекции, например инъекции в ствол, растворы или опрыскивания, дымы и туманы. Подходящие способы и агенты для составления рецептуры предлагаемых соединений для применения в садоводстве или земледелии включают те, которые раскрыты в патенте Южной Африки N 85/7049 для антибиотиков S541. При составлении рецептуры концентрация активного вещества обычно составляет от 0,01 до 99 мас.% и более предпочтительно от 0,01-40 мас.%. Промышленные (товарные) продукты обычно приготовлены в виде концентрированны композиций, которые при использовании разбавляют до требуемой концентрации, например от 0,001 до 0,0001 мас.%. При использовании в ветеринарии или в садоводстве и земледелии и в случае, когда предлагаемые соединения являются продуктами, образуемыми посредством ферментации, желательно использовать весь бродильный бульон в качестве источника активных соединений. Кроме того, может быть пригодно использование обезвоженного бульона (содержащего мицелий) или мицелия, отделенного из бульона и пастеризованного или более предпочтительно высушенного. При желании указанный бульон или мицелий могут быть сформированы в композиции, как указывалось выше, включающие традиционные инертные носители, наполнители или разбавители. Антибиотические соединения предлагаемого изобретения могут вводиться и применяться в комбинации с другими активными ингредиентами. В частности, предлагаемые соединения антибиотика могут использоваться вместе с соединениями антибиотиков S541 или с другими антибиотическими соединениями, в случае, когда неочищенные продукты брожения взаимодействуют без предшествующего или последующего отделения; при использовании соединений в земледелии, где важно обеспечить (сохранить) низкую себестоимость продукции. Предлагается способ получения соединений формулы (II), включающий стадию культивирования микроорганизма Steptomyces, способного образовывать хотя бы одно из предлагаемых соединений и при желании выделять из него указанное соединение. Микроорганизмами, способными образовывать вышеуказанные вещества, являются штаммы нового вида рода Streptomyces, которые называются Streptomyces thermoarohaensis - образец указанного микроорганизма, который является почвенной культурой, помещен на хранение в постоянную коллекцию национального собрания промышленных и морских бактерий Torry Resear Station, Aberdeen, United Kingtom с присвоением ему регистрационного номера NCYB 121015, Мутанты штамма Streptomyces thermoarchaensis NCIB 12015 могут также быть преимущественно использованы, и в постоянную коллекцию культур Национального собрания промышленных и морских бактерий сданы в депозитарное хранение (26.06.1985 г) 4 штамма мутантов, которым были присвоены регистрационные номера NCIB 12111, NCIB 12112, NCIB 12113 и NCIB 12114. Получение предлагаемых соединений посредством ферментации подходящего вида Streptomyces может быть достигнуто общепринятыми методами, например путем выращивания микроорганизма Streptomyces в присутствии способных к ассимиляции источников углерода, азота и минеральных солей, способные к ассимиляции источники углерода могут быть при наличии азота и минералов либо простых или комплексных питательных веществ. Источники углерода обычно включают глюкозу, мальтозу, крахмал, глицерин, кормовую патоку, декстрин, лактозу, сахарозу, фруктозу, карбоксильные кислоты, аминокислоты, глицериды, спирты, алканы и растительные масла. Источники углерода обычно содержат 0,5-10 мас.% сбраживаемой среды. Источники азота включают бобово-соевую муку, настойку пшеницы, растворы, перегонки, дрожжевые экстракты, муку из семян хлопка, пептоны, муку из земляного ореха, содовый экстракт, черную патоку, казеин, смеси аминокислот, аммоний (газообразный или раствор), соли аммония и нитраты. Кроме того можно использовать мочевину и другие амиды. Источники азота обычно содержат 0,1-10 мас.% сбраживаемой среды. Питательные минеральные соли, которые могут быть включены в культуральную среду, содержат применяемые соли, имеющие способность отдавать ионы натрия, калия, аммония, железа, магния, цинка, никеля, кобальта, марганца, ванадия, хрома, кальция, меди, молибдена, бора, фосфата, сульфата, хлорида и карбоната. Культивирование Streptomyces стрептомицеты обычно проводится при температуре в интервале 20-50оС, предпочтительно 25-40оС, более предпочтительно около 34оС, причем желательно сопровождать ее аэрацией и взбалтыванием, например встряхиванием или интенсивным перемешиванием. Среда может быть первоначально инокулирована небольшим количеством спорулированных взвесей микроорганизмов, но для избежания задержки роста можно приготовить растительный посевной материал микроорганизма путем инокуляции небольшого количества культуральной среды спорообразной формой указанного организма, при этом растительный инокулянт, который получен, может быть перенесен в сбраживаемую среду или в одну или более стадий посева, где возникает дополнительный рост перед переносом в основную ферментационную среду. Процесс ферментации обычно проводят при рН в интервале 5,5-8,5, предпочтительнее 5,5-7,5. Ферментацию можно проводить в течение 2-10 дней, например около 5 дней. В том случае, когда желательно отделить материал, содержащий соединения предлагаемого изобретения из всего бродильного бульона или выделить любое из отдельных соединений, указанное можно осуществлять посредством общепринятой методики выделения и отделения веществ. Предлагаемые соединения содержатся в мицелиях клеток, но их также можно обнаружить в бродильном бульоне, таким образом техника выделения может также быть применена к бродильному бульону после очистки. Методика выделения веществ может иметь широкое разнообразие. Предлагаемые соединения могут быть выделены и отделены посредством разнообразных методов фракционирования, например элюированием, осаждением, фракционной кристаллизацией, экстракцией растворителем, которые можно комбинировать различными способами. Выявлено, что экстракция растворителем и хроматография наиболее подходящих для выделения и отделения предлагаемых соединений. После ферментации мицелий может быть собран традиционными методами, например фильтрацией или нейтрифугированием. После этого, например, соединения могут быть экстрагированы из мицелия соответствующими органическими растворителями, такими как кетоны, например ацетоном, метилэтилкетоном или метилизобутилкетоном: углеводородом, например гексаном; галогензамещенным углеводородом, например хлороформом, карбонтетрахлоридом или метиленхлоридом; спиртами, например метанолом или этанолом; или сложными эфирами, например метилацетатом или этилацетатом. Если мицелий содержит значительное количество воды, нужно использовать водорастворимые растворители. Для достижения оптимального извлечения соединений желательно проводить более одной экстракции. Первую экстракцию надо выполнять с использованием смешивающегося с водой растворителя, например метанола или ацетона. Антибиотики можно извлечь как неочищенный экстракт путем удаления растворителя. Экстракты растворителя могут далее быть экстрагированы после уменьшения объема растворителя, например, выпариванием. На этой стадии предпочтительно использовать несмешивающийся с водой растворитель, например гексан, хлороформ, метиленхлорид или этилацетат, или их смеси, при этом для достижения хорошего разделения соединений антибиотика вводится достаточное количество воды. При удалении водонерастворимой фазы получают продукт, содержащий одно или более предлагаемых соединений, возможно вместе с соединениями антибиотика S541. Очистку и/или отделение предлагаемых соединений можно осуществлять традиционными методами, например хроматографией (включая высокоэффективную жидкостную хроматографию на соответствующей подложке, такой как двуокись кремния, нефункциональная макросетчатая адсорбционная смола, например, поперечно-сшитые полистирольные смолы, такие как смолы Amberlite XAL-2 XAD-4 или XAD-1180 (Rohm Haus Ltd), или смола S112 (Kusteel Ltd), или поперечно-сшитый декстран, смешивающийся с органическим растворителем, например Sephadex LH 20 (Pharmacia UK Lud), или в случае высокоэффективной жидкостной хроматографии на подложках с обратной фазой, таких как углеводород, нанесенный на двуокись кремния, например С18, сшитая двуокись кремния. Подложка может быть в виде слоя с насадкой. В случае использования нефункциональных макросетчатых смол, например XAD - 1180 или S112, для элюирования можно использовать смеси органических растворителей, например ацетонитрила с водой. Раствор указанных соединений в соответствующем растворителе загружают в хроматографическую колонку из двуокиси кремния или Sephadex после первого уменьшения объема растворителя. Колонку могут по выбору промыть, а затем вымыть растворителем подходящей полярности. При применении колонок из Sephad и двуокиси кремния в качестве растворителей можно использовать спирты, например метанол; углеводороды, например гексан, ацетонитрил; галогензамещенные углеводороды, например хлороформ или метиленхлорид; или сложные эфиры, например этилацетаты. Элюирование и разделение (очистку соединений) можно регулировать тонкослойной хроматографией и высокоэффективной жидкостной хроматографией, используя свойства соединений. Предлагаемые соединения могут первоначально быть очищены хроматографией на двуокиси кремния, используя элюат, такой как хлороформ, этилацетат с последующей высокоэффективной жидкостной хроматографией. Полученный таким образом очищенный продукт может быть затем подвергнут хроматографии на сефадексовых колонках с использованием элюата, например ацтонитрила, а затем предлагаемые соединения могут быть выделены жидкостной хроматографией с высокой характеристикой. Используя подходящие комбинации, соединения формулы (II) выделены как твердые вещества в почти чистом виде. Последовательность, при которой осуществляют стадии очистки, выбор тех, которые используют, и степень достигаемой очистки могут очень отличаться. Указанные соединения могут применяться при степени чистоты, соответствующей их предназначению. При использовании их в медицине желательно иметь степень чистоты хотя бы 90%, предпочтительно более 95%. Для ветеринарии и другого применения достаточна более низкая степень чистоты, например 30% или ниже. Все температуры приведены при 0оС. Соединения обозначены со ссылкой на источник "Факторы", которые представляют собой перечисленные ниже соединения формулы П р и м е р 1. 23-кето Фактор А. 0,41 мл спорообразной суспензии Steptomyces thermard lusis NCIB 12015 в 10%-ном глицерине используют для инокуляции в 250 мл колбе Erlenmyez, содержащей 50 мл культуральной среды, состоящей из D-глюкозы 15,0 gl-1, глицерина 15,0 gl-1, соевого пептона 15,0 gl-1, NaCl 3,0 gl-1 и CaCO3 1,0 gl, добавлено до нормы дистиллированной воды. Перед помещением в автоклав рН доведена до 7,0 водным раствором АОН. Колбу инкубируют при 28оС в течение 2 дней на круговой качалке, работающей при скорости 250 об/мин с 50 мм в диаметре движением по орбите, 4 мл порции используют затем для инокуляции каждого из четырех двухлитровых флаконов с широким горлышком, содержащих каждый по 200 мл одной и той же среды перед инкубированием в тех же самых условиях в течение 2 дней. Содержимое указанных 4 флаконов далее используют для инокуляции 70-литрового ферментатора, содержащего 40 л той же культуральной среды с добавлением пропиленгликоля 2000 (0,06%). Полипропиленгликоль 2000 вводится в течение всего процесса ферментации для регулирования пенообразованием. Ферментацию проводят при 28оС с энергичным перемешиванием и аэрацией, достаточной для поддержания уровня растворенного кислорода больше 30% насыщения. Через 24 ч процесса брожения 800 мл и 9-литровые порции переносят в 70-литровый ферментатор, содержащий 40 л культуральной среды и 700-литровый ферментатор, содержащий 450 л культуральной среды соответственно. Оба ферментатора содержат культуральную среду, состоящую из D-глюкозы 2,5 gl-1 Malt, декстрина (М D30E) 25,0 gl-1, Arkasoy 50 12,5 gl-1, Beet Molasses 1,5 gl-1, K2HPO4 0,125 gl-1, CaCO3 (Ar) 1,25 gl-1 и силикона 1520 (Dow Corning) 0,6 gl-1, приведенную к норме дистиллированной водой. Перед стерилизацией рН доводят до 6,5 водным раствором h3SO4. Указанные процессы ферментации выполняют при 34оС при энергичном размешивании и аэрации, достаточной для сохранения уровня растворенного кислорода больше, чем 30% насыщения. При необходимости добавляют антивспениватели из полипропиленгликоля 2000. Через 24 ч рН в каждом из ферментаторов доводят до 7,2 путем введения водного раствора h3SO4. Продукты ферментации собирают и объединяют через 4 дня. Мицелий (10 кг) из собранной жидкой среды (423 л) выбирают в центрифуге Sparples PS 16AY. Мицелий интенсивно перемешивают в метаноле (5 л) в течение 40 мин и затем отфильтровывают. Остаток повторно суспендируют в метаноле (15л) и вновь фильтруют. Соединившиеся фильтраты (55 л) смешивают с водой (27 л) и 60-80 петролейным эфиром (предел кипения 60-80оС) (30 л) и перемешивают в течение 20 мин. Полученные фазы отделяют в центрифуге Westfalia MEM12, а метанольную фазу (75 л) смешивают снова с водой (38 л) и 60-30 петролейным эфиром (30 л). Через 20 мин фазы вновь отделяют в центрифуге, причем в фазу петролейного эфира, чтобы разрушить полученную эмульсию, вводят ацетон (2,0 л). Метанольную фазу (110 л) смешивают с водой (38 л) и 60-80 петролейным эфиром (30 л) в третий раз, фазы отделяют как раньше. Ацетон (3 л) добавляют снова к петролейной эфирной фазе для разрушения полученной эмульсии. Три фазы гексана объединяют (90 л) и концентрируют при низком давлении (температура выпарки 25оС). Концентрат (9,8 л) высушивают сульфатом натрия (3 кг) и выпаривают до масла. Полученное масло растворяют в дихлорметане (0,5 л) и фильтруют через Дукалит 478. Раствор (0,9 л) загружают в хроматографическую колонну (150х10 см) на двуокиси кремния (Merck) при загрузке 6 л/ч, промывают дихлорметаном (4 л) и элюируют смесью хлороформа с этилацетатом (3:1). Фракции, элюирующие между 14,6 и 33,3 л, концентрируют до твердого вещества и растворяют в смеси хлороформа с ацетоном (3:1). Полученный раствор повторно хроматографируют на колонке двуокиси кремния с тем же самым растворителем. Фракции, элюирующие между 14,5 и 31,5 л, высушивают до твердого вещества и растворяют в смеси хлороформа с этилацетатом (3: 1). Полученный раствор вновь хроматографируют на двуокиси кремния при тех же условиях, что и раньше, затем фракции элюирования между 14 л высушивают до твердого вещества. Твердое вещество растворяют в 70%-ном ацетонитриле в воде (1,23 л) с достаточным количеством метанола, добавляемого для получения светлого раствора. Указанный раствор хроматографируют в 5 мл порциях на колонке Sperisorb ODS2. Содержимое колонны элюируют с помощью 70%-ного ацетонитрила при скорости течения, которая возрастает от 20 до 34 мл/мин через 24 мин. Фракции из каждой порции, которые элюированы между 12,4 и 16, были собраны вместе и разбавлены равным объемом воды. Полученный раствор затем загружают в колонку Mortedison на полистироле с сетчатой структурой (2 л). Колонку промывают 35%-ным раствором ацетонитрила и элюируют ацетоном. Фракции, элюирующие между 0,5 и 1,25 л, высушивают до твердого вещества. Твердое вещество растворяют в ацетонитриле (20 мл) и хроматографируют на колонке из Sephades Lh30 в том же растворителе. Фракции, элюирующие между 1,08 и 1,26, собирают и высушивают до твердого вещества. Твердое вещество растворяют в 60%-ном ацетонитриле (10 мл) с достаточным количеством метанола, добавляемого для получения чистого раствора. Раствор хроматографируют в 2 мл порциях еще раз на колонке из Spherisorb OD92 и элюируют с помощью 60%-ного ацетонитрила при 25 мл/мин. Фракции, элюирующие между 0,95 и 1,08 л, собирают вместе и высушивают до твердого вещества. Полученное твердое вещество повторно растворяют в хлороформе (5 мл) и хроматографируют на колонке из силикагеля Merch 60. Раствор элюируют хлороформом при 10 мл/мин, и фракции, элюирующие между 400 и 790 мл, высушивают с получением названного соединения (33 мг) в виде твердого вещества, HNR-спектр соответствует содержащемуся 23-кето фактору А. Е.1-масс-спектроскопия дала ион молекулы при 610 и характеристические фрагменты при 592, 549, 498, 482, 370, 263 и 151. Образец представлен, чтобы сравнить 23-кето фактор А, полученный при высокоэффективной жидкостной хроматографии с аналогичным кетоном, образуемым при химическом окислении фактора А. СПОСОБ ПОЛУЧЕНИЯ АНТИБИОТИКА формулы www.findpatent.ru способ получения липосом, содержащих антибиотики - патент РФ 2099087Использование: лечение больных с инфекционными заболеваниями, медицинская биотехнология для повышения биодоступности антибиотиков. Сущность изобретения: готовятся липосомальные варианты антибиотиков, в которые добавляется диметилсульфоксид. Антимикробное действие приготовленного по предлагаемому способу антибиотика возрастает в 1,5-2 раза в сравнении с чистым препаратом. Липосомы готовятся на основе жидких глицеридов из подкожного тюленьего жира, что способствует повышению биодоступности инкапсулированного антибиотика в присутствии сильного проникающего агента -диметилсульфоксида. 6 табл. Изобретение относится к области медицины, в частности к лечению больных с инфекционными заболеваниями, и к медицинской биотехнологии, в частности к способу повышения эффективности биодоступности ординарного лекарственного препарата. В условиях лекарственного дефицита и перехода к рыночной экономике, ведущей к удорожанию лекарственных средств, а также с учетом выраженной сенсибилизации населения лекарственными препаратами возникла настоятельная необходимость в повышении их эффективности, сокращении количественного и финансового расхода без ущерба для их лечебно-профилактической надежности. В настоящее время антибиотики являются самыми распространенными лекарственными средствами. В 1979 году на их долю приходилось до 15% всех вырабатываемых в мире препаратов. Однако антибиотики чаще других химиотерапевтических препаратов вызывают побочные действия в виде аллергических реакций, токсических явлений (с реакцией обострения), дисбактериоза, суперинфекции (Черномордик А.В. Применение антибиотиков и других химиотерапевтических препаратов. Справочник, 1988, 320 с.). Бензилпенициллина натриевая соль, бензилпенициллина калиевая соль широко применяются в лечебной практике. К действию препаратов пенициллина чувствительны многие аэробные и анаэробные бактерии, преимущественно грамположительные: стрептококк, стафилококк, некоторые штаммы энтерококка, клостридии газовой гангрены, столбняка, ботулизма, возбудители дифтерии, сибирской язвы, листериоза, эризипелоиза, а из грамотрицательных бактерий менингококк, гонококк, некоторые штаммы протея и спирохеты. Препараты пенициллина действуют на чувствительные микроорганизмы бактерицидно. Они действуют только на активно размножающиеся бактерии, не влияя на клетки, находящиеся в покое. Основным положительным свойством бензилпенициллина является бактерицидное действие на чувствительные микроорганизмы в очень малых концентрациях при полном отсутствии токсического действия больного (М.Д.Машковский. Лекарственные средства). Однако аллергические реакции являются наиболее частым побочным действием пенициллинтерапии. По данным ВОЗ (1979) частота аллергических реакций на пенициллин колеблется в различных странах от 0,7 до 10% Особенно часто наблюдается крапивница, отек Квинке, сывороточная болезнь, эозинофилия, тромбоцитопания, в редких случаях возможно развитие анафилактического шока (А.В.Черномордик, 1988, 320 с.). В амбулаторной практике широко используется эритромицин препарат из группы антибиотиков-макролидов. Спектр действия эритромицина напоминает спектр пенициллина, но кроме того, действует на устойчивые к пенициллину возбудители коклюша, бруцеллеза, микоплазмы, пневмонии, риккетсии, некоторые простейшие (лямблии, амебы и др.) и хламидии. Эритромицин действует бактериостатически. Препараты эритромицина очень малотоксичны, они не оказывают кумулятивного действия. Однако при приеме внутрь через рот наблюдается диспепсическое явление, что объясняется раздражающим действием на слизистые оболочки желудка и тонкой кишки. Наблюдается усиление перистальтики кишок, в особенности при значительных дозах, снижаются ферментативные функции и общее количество желудочного сока (А.В.Черномордик, 1988, 320 с.). Тетрациклина гидрохлорид (из группы тетрациклических антибиотиков) - препарат широкого спектра антимикробного действия, охватывающий многие виды грамположительных и грамотрицательных бактерий, спирохеты, лептоспиры, риккетсии, многие штаммы микоплазмы хламидии и некоторых простейших. На чувствительные микроорганизмы оказывает бактериостатическое действие. Из побочных эффектов препарата чаще наблюдаются диспептические явления: отсутствие аппетита, тошнота, рвота, понос и др. Они не только вызываются прямым токсическим действием на слизистые оболочки желудка и кишок, но связаны и с ферментативной недостаточностью в пищеварительном канале, наблюдаемой почти у всех больных, получающих этот препарат. Уменьшается количество протеолитических и других пищеварительных ферментов, часто отмечается снижение секреции желудка, поджелудочной железы и печени. Тетрациклина гидрохлорид вызывает уменьшение всасывания в кишечнике жиров, углеводов и некоторых других веществ. Из других токсических явлений отмечаются различные нарушения функции печени. В некоторых случаях в результате применения тетрациклина развивается повышенная чувствительность кожи к действию солнечного света, имеющая фототоксический эффект. Сравнительно редко отмечаются аллергические осложнения (А.В.Черномордик, 1988, 320 с.). В последнее время широкое применение в лечебной практике находит новый бактериальный препарат для перорального применения таривид (эфлоксацин). Таривид представляет собой антибактериальный препарат широкого спектра действия (из группы фторированных хинолонов), обладает бактерицидным действием на грамположительных и грамотрицательных возбудителей. Побочные эффекты при лечении таривидом проявляются редко, в виде аллергической сыпи, фотодерматоза, аллергического отека лица или глотки, затруднения дыхания. В редких случаях наблюдаются нарушения со стороны центральной нервной системы (головные боли, головокружение, нарушение сна, мышечной координации). Отмечаются нарушения желудочно-кишечного тракта (абдоминальные боли, потеря аппетита, тошнота, рвота или понос) (Таривид. Научная монография, 1987. 60 с.). Таким образом, применяемые в лечебной практике в настоящее время антибиотики, например пенициллин, эритомицин, таривид, обладают в большей или меньшей степени побочным действием, которое может усиливаться при увеличении доз этих препаратов с целью увеличения их концентрации в каком-либо органе. Эти недостатки могут быть устранены включением антибиотиков в липосомы. Получение липосом описано в ряде источников. Наиболее близким по технической сущности является способ, описанный в работе Л.Б.Морголиса, Д.Д.Боргельсона. Липосомы и их взаимодействие с клетками. М. Наука, 1986, с. 7-33. Техническим результатом предложения являются повышение стабильности липосом, степени включения антибиотиков в сравнении с липосомами из фасфолипидов куриного желтка, повышение антибактериальной активности антибиотиков. Технический результат достигается тем, что приготавливают липосомальные варианты препаратов антибиотиков, способные, не рассеивая лекарственные вещества по организму больного, прицельно поступать к микроорганизмам, находящимся в определенной ткани. Эта способность связана с тканевым тропизмом липоидных компонентов, из которых приготовлены липосомы. В качестве основы для приготовления липосом нами был использован подкожный жир морского зверя тюленя ларги. Липосомы готовили традиционным способом. Размер получаемых липосомальных частиц в виде многослойных мембран (шариков) был от 350 до 1500 нм. Контроль размера липосом велся электронно-микроскопическим способом. Липидная основа для мембран получалась из тюленьего жира после удаления твердых глицеридов. Основным биологически активным компонентом явились жирные кислоты олеиновая, линолевая, арахидоновая. Смесь жирнокислотной основы в 0,85%-ном растворе хлорида натрия и фосфатном буфере pH 6,8 диспергировали ультразвуком в течение 20-40 с и получали стабильную липосому. pH фосфатного буфера 6,8 выбран с целью глубокого проникновения антибиотика в кожу (поверхность кожи pH 3-5, роговой слой pH 5-6, зернистый и верхняя половина шиповатого слоя pH 6,7-6,9) (А.М.Чернух с соавт. 1982, 336 с. Муравьев И.А. Кононихина Н.Ф. 1990). Для включения в липосомы антибиотиков, например пенициллина, используют метод замораживания-оттаивания в трех-шести повторностях по В.Г.Будуеру с соавт. 1987, с целью включения в липосомальный препарат как можно большего количества исходного лекарственного вещества. После этого в липосомы инкапсулировали различные концентрации антибиотика, понижающиеся по отношению к его минимальной лечебной дозе. Диметилсульфоксид обладает высокой проникающей способностью, поэтому выполняет функции переносчика лекарственных веществ через биологические мембраны (Родионова Г.С. канд. дисс. 1972). Липосомы получали следующим образом. 1 кг свежего подкожного жира морского млекопитающего, например тюленя, ларги, гомогенизируют и обрабатывают 10-15%-ным раствором хлорида натрия при температуре 40-50oC, затем фракционируют на центрифуге при 500 об/мин в течение 30 мин, верхний жидкий слой сливают, в осадке общие фосфолипиды. В осадке определяют общие фосфолипиды по Васьковскому В.Е. с соавт. (1975). Осадок фосфолипидов трижды промывают 0,85%-ным раствора хлорида натрия. Фосфолипиды растворяют в этаноле. Готовят раствор фосфолипидов в этаноле от 30-50 мг фосфолипидов на 100 мл этанола. Введение антибиотика в липидную фазу. Растворяют амфифильный антибиотик в этаноле, 30 мг/мл, и добавляют к этанольному раствору фосфолипидов. Вводят стеориаламин (для создания положительного заряда, 1 мг/мл и диметилсульфоксид, транспортный агент, 1 мг/мл). На роторном испарителе при 20oC ведут упаривание. Получают тонкую прозрачную пленку, равномерную. Для уничтожения следов воды и этанола продувают в течение 1 ч азот, предварительно очищенный по стандартной методике, сушат пленку липидов в вакууме 10-2 мм рт. ст. в течение 4 ч на лиофильной сушке. Предварительно измельченный антибиотик суспензируют (антибиотики - производные оксихинолонкарбоновой кислоты, обладающие ограниченной растворимостью, при pH 6,7-6,9 в смеси забуферного изотонического раствора) 0,05 моль и 0,10 моль NaCl, концентрации таривида 1-10 мг/мг. Вносят в колбу 1 мл забуферного антибиотиксодержащего изотонического раствора (на стеночку колбы, осторожно). Образование молочного цвета суспензии признак получения целебного продукта. Доводят суспензию до 100 мл при постоянном перемешивании магнитной мешалкой, зашитой в инертный полиэтилен. Получены мультиламаллярные липосомы, размер 500-800 нм. Суспензию антибиотиксодержащих липосом отделяют от водной среды, если это необходимо, центрифугированием при 1000 об/мин в течение 15 мин. К осадку липосом, содержащих антибиотики, добавляют вновь забуферный изотонический раствор. Осадок липосом лиофилизовали и хранили без изменений в течение 3,5 мес. Характеристика получаемого по предлагаемому способу целебного продукта, позволяющая его идентифицировать, приведена в табл.1. Физико-химические показатели эффективности липидного носителя и стабильности получаемых липосом приведены в табл.2. Степень включения в липосомы антибиотика определялась на приборе КФК-2 (фотоэлектроколориметрическим методом: Егоров Н.С. Основы учения об антибиотиках. М. Высшая школа, 1979, 1979, с.176-178; Гров Д.С. Рендаля В.А. Руководство по лабораторным методам исследования антибиотиков. М. 1958). Концентрация антибиотиков определялась в водной среде, степень включения рассчитывалась по разнице между нагруженным и невключающимся в липосому. Степень включения антибиотика и стабильность инкапсулированной формы приведены в табл.3. Таким образом, предлагаемый способ получения липосом, содержащих антибиотики (производные оксихинолонкарбоновой кислоты), обладает рядом преимуществ: повышением эффективности за счет органотропности липидного носителя, более высокой степенью включения амфифильного антибиотика за счет инкапсулирования его как в липидную, так и в водную фазу, удешевлением источника липидного носителя за счет применения неутилизируемого пищевой и фармацевтической промышленностью фосфолипидов подкожного жира морских млекопитающих, отсутствием в процедуре токсичных растворителей, таких как хлороформ или метанол или, эфир, повышением транспортных возможностей липосом за счет введения транспортного агента диметилсульфоксида, повышением биодоступности за счет отобранного значения pH. Токсических эффектов в экспериментах 1n y1y0 на белых беспородных мышах в концентрациях, указанных в данном ответе, мы не наблюдали. Действие препаратов проверено на грамотрицательной и грамположительной микрофлоре. Для этого использовали мясо-пептонный агар, на который сплошным газоном высеивали индикаторную тест-культуру, наносили стандартный стерильный диск фильтровальной бумаги с липосомальным препаратом с определенной концентрацией антибиотиков. Вокруг диска с препаратом наблюдалась зона задержки роста или стерильная зона. Минимальная концентрация липосомального препарата с антибиотиком, дающая стерильную зону, равную обеспеченной чистым антибиотиком, принимали за лечебную. Таким образом проверено 4 наиболее часто употребляемых с лечебной целью антибактериальных препарата. Результаты проведенных исследований на примере суммированы в табл.4 и 5. Для сравнения бактерицидных свойств компонентов липосомального варианта таривида изучали размеры зон задержки роста у ДМСО (диметилсульфоксида) и липидной основы липосом (эмульсии на ПНЖК + фосфатный буфер (pH 6,8) + 0,85% -ный раствор натрия хлорида). Чистая эмульсия не давала зоны задержки роста бактерий, а у диметилсульфоксида зона составляла всего 13 мм, то есть ниже стандартной зоны (14-15 мм). Как видно, наиболее высокой зоной задержки роста бактерий обладает из низких концентраций липосомальный вариант с концентрацией 0,27% Для подтверждения повышения биодоступности антибиотиков аналогичные исследования были проведены еще с тремя антибиотиками пенициллином, эритромицином, тетрациклином. Результаты исследования помещены в табл.5. В табл.6 представлены данные об антимикробной активности липосомальной и традиционной форм антибиотиков. Таким образом, положительный эффект предполагаемого изобретения достигается рядом его преимуществ, суть которых состоит в повышении эффективности способа лечения, что достигается путем увеличения биодоступности. К увеличению биодоступности антибиотика приводит включение его в липосому, носитель которой состоял из органотропных, обеспечивающих специфичность доставки лекарств фосфолипидов подкожного жира млекопитающих. Липосомальный носитель состоял из биологически активных полиненасыщенных жирных кислот, что в свою очередь положительно влияло на эффективность способа лечения кожных заболеваний, сопровождающихся пиодермией. Кроме того, липофильный антибиотик таривид концентрировался и в липосомальном носителе, что в свою очередь позволило снизить лечебную дозу употребляемого антибиотика и его побочное действие. Предлагаемый способ обладает и экономическим эффектом, т.к. он дешевле способа лечения кожных заболеваний, предложенных в качестве аналогов, в 40 раз.ФОРМУЛА ИЗОБРЕТЕНИЯСпособ получения липосом, содержащих антибиотики, включающий приготовление растворов фосфолипидов и антибиотиков, их контактирование с последующей лиофилизацией целевого продукта, отличающийся тем, что используют фосфолипиды из подкожного жира морского млекопитающего, введение антибиотика осуществляют в липидную фазу и в свободный объем липосомы, для чего концентрируют антибиотик в фосфолипиде носителя в присутствии диметилсульфоксида, а затем лиофильно высушенный продукт контактируют с суспензией антибиотика, имеющий рН 6,7 6,9.www.freepatent.ru антибактериальный препарат и способ его получения - патент РФ 2089183Использование: в ветеринарии. Сущность изобретения: препарат состоит из поливинилпирролидона медицинского, полиэтиленоксида синтетического высокомолекулярного, анестезиружего средства, например новокаина, левомицетина, антибиотика тетрациклиновой группы и эритромицина основания, растворителя димексида, скомплексованных в форме гидрофильно-адсорбционного сплава при следующем соотношении компонентов, мас.%: поливинилпирролидон 2-6, полиэтиленоксид 10-20, новокаин или другое анестезирующее средство 0,5-1,5, левомицетин 2-6, окситетрациклин или другой тетрациклиновый антибиотик 1-З, эритромицин основание 2-6 и димексид до 100. Препарат получают в реакторе или другом пригодном аппарате путем растворения компонентов в горячем димексиде последовательно: поливинилпирролидон, полиэтиленоксид, анестетик, левомицетин, тетрациклин гидрохлорид /или другой тетрациклиновый антибиотик/, эритромицин основание. Растворение ведут при снижающемся температурном режиме. 2 с.п. ф-лы, 8 табл. Изобретение относится к ветеринарии и может быть использовано для лечения и профилактики болезней животных. Известны комбинированные лекарственные препараты: трициллин, мастицид, мастисан, мастисан А, мастисан Б, мастисан Е, мастин, дипасфен, оксикан, ФД илкоциллин, дипель N 1, дипель N 2, неофур, эндомицин, калиокс, сульфобиотик, биосулфаксан, экзутер, септиметрин, лефуран и др. состоящие из антибиотиков, сульфаниламидов, нитрофуранов. Их выпускают в форме порошков, таблеток, масляных растворов, суспензий, многие из них перед применением растворяют, смешивают. Комплексные препараты имеют преимущества перед монопрепаратами, особенно при лечении полиэтиологичных болезней. Зарубежные фармацевтические фирмы, в последние 7-10 лет и отечественная фарминдустрия в создании лекарственных форм антибактериальных и других средств используют с целью стабилизации, пролонгации, неводные органические растворители и полимерные наполнители, позволяющие повысить стабильность лекарственных препаратов. Наиболее близким по технической сущности к заявленному предложению является препарат антибактериальный "Левоэритроциклин". Это комплексный препарат, содержащий три антибиотика широкого спектра действия левомицетин, эритромицин, тетрациклин, поливинилпирролидон, аскорбиновая кислота и пропиленгликоль -растворитель. ( 1 ). Способ получения антибактериального препарата "Левоэритроциклин" включает растворение в многоатомном алифатическом спирте антибиотиков, поливинилпирролидона и аскорбиновой кислоты, отличающийся тем, что в качестве алифатического спирта используют пропиленгликоль, который перед растворением в нем компонентов препарата предварительно стерилизуют и при температуре 90-95oC в нем вначале растворяют поливинилпирролидон и антибиотик левомицетин, а затем температуру пропиленгликоля снижают до 70-75oC и растворяют антибиотики эритромицин, тетрациклин и аскорбиновую кислоту. Левоэритроциклин выпускают в форме раствора, содержащего в 1 мл: левомицетина 40 мг, эритромицина 40 мг, тетрациклина 20 мг, аскорбиновой кислоты 1 мг, поливинилпирролидона 40 мг, пропиленгликоля до 1 мл. Препарат применяют с лечебной и лечебно-профилактической целью при болезнях животных. Один компонент, используемый для изготовления эритромицина, приобретали по импорту. Был предложен аналог-заменитель. Эритромицин, изготовленный с использованием отечественного компонента заменителя в составе левоэритроциклина оказался недостаточно стабильным и левоэритроциклин не выдерживал 12-месячный срок годности, согласно ТУ. Цель изобретения обеспечение более стабильного и эффективного препарата. Поставленная цель достигается тем, что в качестве растворителя компонентов используют димексид, а в качестве стабилизатора антибиотиков синтетический высокомолекулярный полиэтиленоксид. Препарат получают в форме гидрофильно-адсорбционного сплава путем последовательного растворения компонентов в горячем димексиде при снижающемся температурном режиме: поливинилпирролидон и полиэтиленоксид при 110.100oC, новокаин или другое анестезирующее средство и левомицетин- 95.90oC, тетрациклин или другой антибиотик тетрациклиновой группы - 65.62oC, эритромицин основание 62.60oC. Отличие от прототипа. 1). Растворитель компонентов димексид (ДМСО) вместо пропиленгликоля. 2). Стабилизатор антибиотиков эритромицина-синтетический высокомолекулярный полиэтиленоксид вместо аскорбиновой кислоты. 3). Препарат в форме гидроксильно-адсорбционного сплава при температуре 10. 15oC меняет агрегатное состояние переходит из жидкого в полутвердое /мазеподобное/, которое по мере снижения температуры уплотняется, при этом снижается физико-химическое взаимодействие компонентов продлевается стабильность эритромицина. Соотношение компонентов, мас. Поливинилпирролидон 2-6 Полиэтиленоксид 10-20 Новокаин или другое анестезирующее средство 0,5 1,5 Левомицетин 2-6 Окситетрациклин или другой тетрациклиновый антибиотик 1-3 Эритромицин основание 2 6 Димексид До 100 Примеры на соотношение компонентов в препарате приведены в табл.1 3. Пример 1: минимальный вариант. Пример 2: оптимальный вариант. Пример 3: максимальный вариант. Исходным сырьем для изготовления антибактериального препарата служат антибиотики в форме порошка: левомицетин, эритромицин основание, тетрациклиновые антибиотики окситетрациклин или: тетрациклин гидрохлорид, тетрациклин основание, хлортетрациклин гидрохлорид и др. а также поливинилпирролидон медицинский мол.м. 1.14 тыс. полиэтиленоксид марок от 1000 до 6000 (мол. 950 до 7000), новокаин или другое анестезирующее средство (целновокаин, тримекаин, лидокаин, анестезин), выпускаемое фармацевтической промышленностью. В спецификациях заводов-изготовителей указаны активность, безвредность и другие показатели, предусмотренные Государственной фармакопеей СССР изд. X, XI и другой нормативно-технической документацией. Антибиотики, полимер, димексид и другие лекарственные вещества, необходимые для изготовления препарата, хранятся в сухом помещении в соответствии с условиями, сроками годности, указанными в паспорте завода-изготовителя. Технология препарата состоит из следующих операций: подготовка помещения для работы, подготовка инструментов и посуды, подготовка составных компонентов, приготовление препарата, фасовка препарата и его контроль. Левоэритроциклин готовят в специальном помещении или боксе, оборудованном приточно-вытяжной вентиляцией, обеспечивающей подачу стерильного воздуха. Для обеззараживания воздуха в боксах включают бактерицидные лампы БУВ 15 или БУВ 30 на 2 ч в соответствии с инструкцией по их эксплуатации. По окончании работ в помещении производят влажную уборку. Пол, стены, столы протирают дезраствором 2%-ным водным раствором хлорамина. Бактериологический контроль воздуха в помещении проводят не реже одного раза в неделю. Один раз в месяц помещение и боксы обрабатывают формалином из расчета 50 мл 40%-ного формальдегида на 1 м3 объема. Формалин вливают в кюветы и подогревают до испарения. Пары формалина нейтрализуют 5% -ным водным раствором аммиака, который наливают в бактериологические чашки из расчета 10 мл на 1 м3 помещения. Подготовка оборудования, инструментов и посуды проводят с соблюдением требований регламента. Реакторы стерилизуют при 120oC в течение 1 ч в день приготовления препарата или не ранее чем за 24 ч. Флаконы для розлива препарата (емкость согласно ТУ) укладывают в биксы или металлические кассеты горлышком вниз. Кассеты закрывают марлей, медицинской клеенкой и закрепляют их шнуром из пеньки или синтетического материала. Флаконы стерилизуют в автоклаве при 120oC или в сушильном шкафу при 160-180oC в течение 1 ч. Резиновые пробки для флаконов и металлические колпачки укладывают в коробки и стерилизуют в автоклаве в том же режиме, что и флаконы. Пинцеты, воронки, халаты, колпаки, маски, рукавицы, чехлы для обуви завертывают в пергаментную бумагу и автоклавируют при одной атмосфере 1 ч. Резиновые перчатки обрабатывают 2-4%-ным раствором хлорамина. Весь простерилизованный инвентарь вносят в бокс за 12-24 ч до розлива готового препарата и включают бактерицидные лампы на 1 ч. Персонал, занятый приготовлением препарата, перед работой тщательно моет руки водой с мылом, вытирает полотенцем, протирает спиртом, надевает стерильную спецодежду. Подготовка составных компонентов. Для приготовления левоэритроциклина-2 отвешивают необходимое количество компонентов в полиэтиленовые мешочки. При расчете массы тетрациклиновых антибиотиков, эритромицина основания учитывают их фактическую миллиграммовую активность, которая указана в паспорте завода-изготовителя. Например, на 40 л готовой продукции (для реактора объемом 50 л) требуется окситетрациклина гидрохлорида с товарной активностью 860 мкг/мг- 930 г /800000 г: 860= 930/ вместо 863 г при теоретической активности 927 мкг/мг / 800000: 927= 863. Или тетрациклина гидрохлорида с товарной активностью 975 мкг/мг-820 г /800000:975=820/ вместо 739 при теоретической активности 1082 мкг/мг /800000:1082=739/; эритромицина основания с товарной активностью 910 ЕД/мг-1758 г /1600000910=1758/ вместо 1600 г при теоретической активности 1000 ЕД/мг /1600000:1000=1600/. Активность товарных серий левомицетина близка к 1000 мкг/мг /от 985 до 1000 мкг/мг/ пересчет по этому антибиотику не производят. В табл. 4 масса тетрациклиновых антибиотиков и эритромицина основания пересчитана на среднюю активность товарных серий. Стерилизация растворителя. Димексид, поливинилпирролидон и полиэтиленоксид в рассчитанном количестве (см. табл. 4) вносят в реактор, нагревают при включенной мешалке (60. 70oC) до растворения полимеров и стерилизуют при 120oС 1 ч. Если реактор не подключен к парообразователю, димексид с добавленными в него полимерами стерилизуют в закрытых десятилитровых бидонах в автоклаве при том же режиме. Бидоны закрывают пергаментом, металлическими крышками и сверху закрывают медицинской клеенкой, которую закрепляют шнуром. Растворение компонентов. Препарат готовят в реакторе объемом от 20 до 200 л, с тем, чтобы обеспечить лучшее перемешивание и растворение компонентов, в реакторе готовят в один прием соответственно его объема на 10-15% меньше. В табл. 4 указаны потребность в составных компонентах левоэритроциклина-2, последовательность внесения их в реактор и температурный режим растворения каждого из них. После стерилизации растворителя /димексид с растворенными в нем поливинилпирролидоном и полиэтиленоксидом/ через рубашку реактора пропускают холодную воду при включенной мешалке, снижают температуру растворителя до 95oC и в реактор через большую воронку с широким выходным отверстием вносят небольшими порциями составные компоненты в той последовательности, как они перечислены в таблице. Каждый компонент вносят после растворения предыдущего. Растворимость их контролируют визуально путем взятия пробы в стерильный химический стакан или в мензурку в объеме 300-500 мл. При наличии в пробе нерастворимых компонентов, соблюдая стерильность, пробу выливают в реактор и продолжают размешивать. Указанное в табл. 4 время, необходимое для растворения каждого компонента, колеблется в зависимости от объема серии: при большем объеме серии требуется больше времени для растворения. Розлив препарата проводят при включенной мешалке при температуре 60.55oC. Фасовка препарата. Готовый левоэритроциклин, соблюдая стерильность, с помощью дозатора разливают в стерильные флаконы. Первые порции препарата (3-5 л) разливают через лавсановый фильтр (при отсутствии лавсана используют марлю медицинскую). С этой целью на канюлю дозатора после обработки ее спиртовым факелом, резиновым кольцом закрепляют стерильную четырехслойную лавсановую ткань. Флаконы закрывают с помощью пинцета в пламени горелки стерильными резиновыми пробками и закатывают металлическими колпачками и ставят на донышко (не кантовать). Допускается погрешность при расфасовке 5. а). Стабильность физико-химических свойств препарата. Определяли однородность, цветность, прозрачность, появление неразбивающегося /при Тo 40.50oC/ при встряхивании осадка, разложение на фракции /при Тo 20.50oC/. Критерии оценки физико-химических свойств сравнивали с исходными через 1, 6, 12 мес. В табл. 5 приведены результаты: в пределах срока годности препарат стабильный. б). Безвредность (токсичность) проверяли в соответствии со статьей "Испытание на токсичность" по ГФХ1, с. 182, а также по методу Кербера. На мышах устанавливали: максимально переносимую дозу, ЛД50, ЛД100 препарат вводили подкожно в области спины. В дозе 0,05 мл левоэритроциклина-2, разбавленного стерильным изотоническим раствором (0,9%) натрия хлорида до объема 0,5 мл, токсического действия не установлено. Тест-доза левоэритроциклина-2 0,05 мл 5 тыс.мкг /мышь/. При разработке НТД на левоэритроциклин: ТУ, регламента на изготовление и наставления по применению следует учитывать результаты испытания на токсичность. Данные приведены в табл. 6. В). Стерильность. Контролировали на бактерийную и грибную контаминацию в соответствии с требованиями ГФХ1, с. 187 "Испытание на стерильность" путем высева на МПБ, МПА и среду Сабуро. В табл. 7 приведены результаты, свидетельствующие о стерильности левоэритроциклина-2. Тетрациклиновые антибиотики контролировали микробиологическим методом диффузии в агар с тест-культурой Бациллюс субтилис Л2 (споры) по общепринятой методике (ГФХ1, в 2, с. 187 "Методы микробиологического контроля лекарственных средств". Массовую долю (содержание и стабильность) левомицетина контролировали методом нитритометрии (ГФХ1, с. ). Содержание эритромицина в левоэритроциклине-2 определяли микробиологическим методом диффузии в агар- с тест-культурой Бациллюс субтилис Л2. Метод основан на сравнении величин зон угнетения роста тест-культуры, определенными разведениями левоэритроциклина-2 и аналогичными концентрациями стандарта эритромицина. Результаты испытания приведены в табл. 8. Предлагаемый антибактериальный препарат и способ его получения позволяет продлить срок использования препарата до 12 мес без снижения его эффективности по сравнению с прототипом Ветеринарная практика снова имеет возможность использовать высокоэффективный антибактериальный препарат при многих болезнях сельхоз. животных.ФОРМУЛА ИЗОБРЕТЕНИЯ1. Актибактериальный препарат, содержащий левомицетин, эритромицин, антибиотик тетрациклинового ряда, поливинилпирролидон и растворитель, отличающийся тем, что в качестве растворителя препарат содержит димексид и дополнительно полиэтиленоксид с молекулярной массой 3000 6000 и новокаин или другое анестезирующее средство при следующем соотношении компонентов, мас. Поливинлпирролидон 2 6 Полиэтиленоксид с молекулярной массой 3000 6000 10 20 Новокаин или другое анестезирующее средство 0,5 1,5 Левомицетин 2 6 Окситетрациклин или другой тетрациклиновый антибиотик 1 3 Эритромицин 2 6 Димексид До 100 2. Способ получения антибактериального препарата путем растворения левомицетина, эритромицина, антибиотика, тетрациклинового ряда и поливинилпирролидона в растворителе, отличающийся тем, что в качестве растворителя используют димексид и дополнительно полиэтиленоксид и новокаин или другое анестезирующее средство при следующем соотношении компонентов, мас. Поливинилпирролидон 2 6 Полиэтиленоксид 10 20 Новокаин или другое анестезирующее средство 2 6 Левомицетин 2 6 Окситетрациклин или другой антибиотик тетрациклинового ряда 1 3 Эритромицин 2 6 Димексид До 100 причем сначала в димексиде растворяют поливинилпирролидон и полиэтиленоксид и стерилизуют паровым методом, а затем последовательно растворяют при температуре 90 95oС новокаин или другое анестезирующее средство и левомицетин, а затем при снижении температуры до 62 65oС - окситетрациклин или другой антибиотик тетрациклинового ряда, при температуре 60 62oС эритромицин.www.freepatent.ru |
г.Самара, ул. Димитрова 131 [email protected] |
 |

 Выявлена дополнительная группа соединений, обладающих антибиотической активностью, которые можно получить посредством выделения их из культуры микроорганизмов рода Sterptomyces. Новые соединения предлагаемого изобретения обладают антибиотической активностью и/или применяются как промежуточные продукты при получении других активных соединений, и/или при выделении или очистке соединений антибиотиков S541.
Выявлена дополнительная группа соединений, обладающих антибиотической активностью, которые можно получить посредством выделения их из культуры микроорганизмов рода Sterptomyces. Новые соединения предлагаемого изобретения обладают антибиотической активностью и/или применяются как промежуточные продукты при получении других активных соединений, и/или при выделении или очистке соединений антибиотиков S541. где R1 представляет метильную, этильную или изопропильную группу OR4, является гидроксильной группой или метоксигруппой.
где R1 представляет метильную, этильную или изопропильную группу OR4, является гидроксильной группой или метоксигруппой. Фактор R R1 A -H -CH(Ch4)2 B -Ch4 -Ch4 C -H -Ch4 D -H -Ch3Ch4 E -Ch4 -Ch3Ch4 F -Ch4 -CH(Ch4)2 Факторы A,B,C, D, E,F можно получить способом, который описан в патенте Великобритании N 2166436.
Фактор R R1 A -H -CH(Ch4)2 B -Ch4 -Ch4 C -H -Ch4 D -H -Ch3Ch4 E -Ch4 -Ch3Ch4 F -Ch4 -CH(Ch4)2 Факторы A,B,C, D, E,F можно получить способом, который описан в патенте Великобритании N 2166436.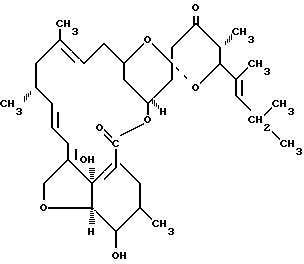 заключающийся в том, что культивируют штамм микроорганизма Streptomyces thermoarchaensis N CIB 12015 или один из его мутантов Streptomyces thermoarchaensis N CIB 12111, Streptomyces thermoarchaensis N CIB 12112, Streptomyces thermoarchaensis N CIB 12113 или Streptomyces thermoarchaensis N CIB 12114 в аэробных условиях в присутствии усваиваемых источников углерода, азота и минеральных солей при 20 - 50oС и pH 5,5 - 8,5 в течение по меньшей мере двух дней, целевой продукт выделяют из культуральной жидкости и при необходимости получения его в чистом виде очищают хроматографией.
заключающийся в том, что культивируют штамм микроорганизма Streptomyces thermoarchaensis N CIB 12015 или один из его мутантов Streptomyces thermoarchaensis N CIB 12111, Streptomyces thermoarchaensis N CIB 12112, Streptomyces thermoarchaensis N CIB 12113 или Streptomyces thermoarchaensis N CIB 12114 в аэробных условиях в присутствии усваиваемых источников углерода, азота и минеральных солей при 20 - 50oС и pH 5,5 - 8,5 в течение по меньшей мере двух дней, целевой продукт выделяют из культуральной жидкости и при необходимости получения его в чистом виде очищают хроматографией.