|
|
||||||||||
|
Эра антибиотиков закончилась. И что теперь? Эра антибиотиковЭра антибиотиков закончилась. И что теперь? | Самые свежие новостиКогда Александр Флеминг вернулся из отпуска летом 1928 года, и обнаружил в своей лондонской лаборатории стол, заражённый плесенью Penicillium notatum, он начал новую эру превосходства науки над природой. С тех пор антибиотики, как открытые им лично, так и множество других, открытых благодаря его работам, спасли миллионы жизней и избавили огромное количество людей от страданий. Но с самого начала этой эры учёным было известно, что ей придёт конец. Они просто не знали, когда именно. Сопротивляемость бактерий антибиотикам естественна и неизбежна. По воле случая у нескольких бактерий окажутся гены, способные защитить их от лекарств, они передадут эти гены дальше – и не только своему потомству, но иногда и соседям. Специалисты по вычислительной эпидемиологии наконец получают нужные данные и обрабатывают их для моделирования этого явления. Но никто не пытается использовать эти инструменты, чтобы предсказать конец эры антибиотиков – он уже наступил. Они концентрируются на том, чтобы понять, как скоро стойкие бактерии окажутся в большинстве и что доктора смогут с ними сделать – если это вообще возможно. В 2013 году тогдашний директор Центров по контролю и предотвращению заболеваний (CDC) Том Фриден сказал журналистам: «Если мы не будем вести себя осторожно, вскоре мы окажемся в постантибиотической эпохе». Сегодня, всего лишь четыре года спустя, это агентство утверждает, что мы в ней оказались. «Мы говорим это потому, что универсально стойкая бактерия появилась», – говорит Джин Пател [Jean Patel], руководящая отделением CDC по стратегии и координации использования антибиотиков. «Люди умирают из-за отсутствия антибиотиков, способных лечить их инфекции – инфекции, которые не так давно было очень легко излечивать». В прошлом августе женщина возрастом за 70 попала в госпиталь в Рено, шт. Невада, с бактериальной инфекцией бедра. Бактерия принадлежала к классу особенно упорных микробов, известных, как карбапенем-устойчивые энтеробактерии (CRE). Но эту бактерию не брали ни карбапенемы, ни тетрациклин, ни колистин, и вообще никакой антибактериальный аппарат из 26-и имеющихся в продаже. Через несколько недель она умерла от септического шока. Для чиновников из области здравоохранения, к коим принадлежит и Пател, этот случай отмечает конец эры и начало новой. Вопрос в следующем: как быстро эта универсальная стойкость сможет распространиться? «Когда мы дойдём до ситуации, в которой инфекцию чаще будет невозможно вылечить, чем возможно? – говорит Пател. – Это будет очень сложно предсказать». Ей это точно известно, потому что она уже пыталась. В 2002 году первый стафилококк, устойчивый к ванкомицину, проявил себя у 40-летнего мужчины из Мичигана с хронической язвой ноги. Ситуация казалась весьма печальной: стафилококк – одна из самых распространённых инфекций у людей, а ванкомицин – самый распространённый антибиотик для его лечения. Кроме того, резистивный ген был расположен на плазмиде – свободно перемещающемся колечке ДНК, что позволяло ему легко передвигаться. Эпидемиологи из CDC работали совместно с микробиологами, такими, как Пател, над созданием модели, предсказывающей как далеко и как быстро он сможет распространиться. Пател не помнит точных цифр, но она вспоминает, что результаты получились пугающими. «Мы очень сильно озаботились этим вопросом», – говорит она. К счастью, в данном случае модели ошиблись. С 2002 года было зафиксировано только 13 случаев появления стафилококка, устойчивого к ванкомицину, и все пациенты выжили. Такая ошибка весьма озадачила команды. Но в биологии иногда бывают такие сложности. «Я работала с этой бактерией в лабораториях, где она прекрасно растёт, но от человека к человеку, судя по всему, не распространяется», – говорит Пател. И хотя они ещё не знают, почему, одна из гипотез говорит о том, что появление этого резистентного гена не проходит для бактерии бесследно. Он сделал стафилококк невосприимчивым к его заклятому врагу, одновременно усложняя процесс выживания вне человеческого тела. Больничные правила, время года, география также могут влиять на распространение. Это похоже на попытки предсказания погоды. «Не получится сделать такие предсказания на бумаге или путём пристальных размышлений, – говорит Брюс Ли [Bruce Lee], исследователь общественного здравоохранения в институте Джона Хопкинса. Он работает с организациями, занимающимися здравоохранением в Чикаго и округе Ориндж, предсказывая наиболее вероятные пути распространения CRE – бактерий того типа, что убила женщину в Неваде – в случае их появления в больницах. В прошлом такие модели были основаны исключительно на математике – так Пател пыталась строить свои предсказания. Да, их уравнения были сложными, но не настолько, чтобы принять во внимание такие вещи, как человеческое поведение, биология бактерий и их взаимодействие с окружающей средой. „В нашей области люди всё больше начинают понимать, что для того, чтобы разобраться с распространением устойчивых к антибиотикам бактерий с достаточной степенью детализации, необходимо работать с моделями на основе данных, в которых можно просматривать миллионы различных сценариев – так, как это делают метеорологи“, – говорит Ли. В исследовании, опубликованном Ли в прошлом году, он описывает вероятность распространения CRE в 28 больницах и 74 частных лечебницах округа Ориндж. В этой модели у каждой виртуальной больницы было прописано количество коек, совпадающих с количеством коек в реальных учреждениях, а также вся информация по поводу связности учреждений. В модели каждый пациент был вычислительной единицей, которая в любой определённый день либо переносит, либо не переносит CRE. Эти единицы двигались по экосистеме здравоохранения, взаимодействовали с врачами, медсёстрами, койками, стульями, дверьми по сотне миллионов раз, причём с каждой новой симуляцией эти параметры немного подстраивались. Он обнаружил, что без усиления мер по контролю, например, регулярной проверки пациентов на сопротивляемость и карантине переносчиков, CRE станет эндемическим заболеванием — постоянно присутствующим – практически во всех больницах округа Ориндж через десять лет. А после того, как CRE проникнет в систему здравоохранения, от него будет сложно избавиться. „Это как пытаться прогнать из дома термитов, – говорит Ли. – Как только они пробираются туда, где всё связано со всем, они становятся трудноизлечимой частью экосистемы“. Так что, если доктора и сёстры смогут быстро идентифицировать людей, способных распространять CRE, он смогут хотя бы изолировать угрозу. Даже если самим пациентам они ничего предложить не сумеют. Пока хорошие новости заключаются в том, что единственные случаи передачи от человека к человеку на 100% стойкой бактерии происходят только в суперкомпьютере у Ли. В реальном мире таких случаев не зафиксировано. Но именно их и ищут Пател и CDC. Это и продвинет ситуацию на следующий уровень, говорит Пател. Чтобы держать руку на пульсе, в прошлом году агентство потратило $14,4 млн на создание сети из семи местных лабораторий, способных проводить генетическое тестирование бактериальных проб, взятых из больниц. Сейчас они претворяют в жизнь программу, которая когда-нибудь сможет связать все больницы в США с системой слежения CDC напрямую, чтобы автоматически отмечать каждое произошедшее в США событие, связанное со стойкими к антибиотикам бактериями, в реальном времени. Параллельно Пател, и, с переменным успехом, остальной мир, следит за разработкой антибиотиков. В этой области тоже не всё гладко. На прошлой неделе Всемирная организация здравоохранения выпустила отчёт с анализом всех находящихся в разработке антибактериальных лекарств. Выводы мрачные: недостаточно лекарств, недостаточно инноваций. На каждое новое лекарство из 51 варианта уже можно найти заранее устойчивые к нему микроорганизмы. Исследователи, такие, как Пател и Ли, надеются, что их работа позволить минимизировать существующие угрозы, обнаружить новые по мере их появления, и дать фармакологическим компаниям время на разработку новых лекарств. Эра антибиотиков, возможно, и закончилась – но с наступающей новой эрой ещё многое можно сделать. ]]>Источник]]> www.kramola.info Эра антибиотиков. Популярная история медициныЭра антибиотиков История открытия препарата, способного мощно подавлять воздействие болезнетворных микроорганизмов, относится к деятельности нескольких ученых. Удивительное свойство одних организмов влиять на жизнедеятельность других отметил И. И. Мечников, предложивший методику использования молочнокислых бактерий простокваши против гнилостных бактерий микрофлоры кишечника. После него неоднократно предпринимались попытки подавлять воспалительный процесс пеницилловыми грибками, выделенными из зеленой плесени. Грибковые плесени использовались на Востоке еще в доисторические времена. О целебных свойствах плесени догадывались медики Эллады и Древнего Рима. Французский биолог Эрнст Дюшен в 1897 году защитил диссертацию на тему «Жизненная конкуренция микроорганизмов», на которую затем ссылались создатели антибиотиков. В 1929 году английский микробиолог Александер Флеминг (1881–1955 годы) получил первое антибактериальное вещество — пенициллин. Десятью годами позже сотрудник Рокфеллеровского института медицинских исследований Рене Жюль Дюбо (1901–1982 годы) выделил из почвенной бактерии вещество, обладавшее противомикробным действием, назвав его тиротрицином. Американский микробиолог определил химический состав препарата и сумел наладить первое в мире производство антибиотика. Однако вскоре выяснилась его сильная токсичность, поэтому тиротрицин не нашел широкого применения на практике. Дальнейшие работы талантливого ученого посвящены изучению иммунитета, туберкулеза, кишечной флоры. Рене Дюбо является автором книги «Такое человечное животное» (1968), где рассматривается связь человека с окружающим миром. В начале 1930-х годов немецкий биохимик Эрнст Борис Чейн (1906–1979 годы), работая над диссертацией в Кембридже, доказал, что токсин змеиного яда является пищеварительным ферментом. Труд получил признание, а молодой диссертант был приглашен в Оксфорд на кафедру патологии, возглавляемую профессором Ховардом Уолтером Флори (1898–1968 годы). Руководитель предложил Чейну заняться усовершенствованием пенициллина, открытого, но не доработанного Флемингом. Сам автор препарата был настроен весьма скептически, однажды заявив, что «этим не стоит заниматься», так как не удалось выделить достаточно стабильный экстракт. Это получилось у воспитанника Флори, который проводил исследования на 35 фунтов стерлингов, полученных из фондов правительства. В мае 1940 года Чейн завершил проверку действия антибиотика на микробах и провел первый тест на мышах. Испытания прошли успешно, показав эффективное антибактериальное действие пенициллина. Открытие оказалось как нельзя кстати. В Европе уже больше года шла война, а раненые, которым посчастливилось уцелеть под пулями, умирали от сепсиса на больничных койках. Вскоре результативность нового препарата подтвердили врачи одной из клиник Оксфорда. Местный полицейский обратился с жалобой на небольшой гнойник в углу рта. Позже выяснилось, что рана была заражена золотистым стафилококком, и через два месяца инфекция охватила все лицо мужчины, шею, перекинулась на руку, поразив легкое. С разрешения ученых медики начали лечение пенициллином. В течение месяца больной чувствовал себя хорошо, но препарат закончился, и полицейский умер. Несмотря на неудачный опыт, почти никто не сомневался в надежности пенициллина. Чейн потребовал от руководителя оформить патент на открытие, но тот отказался, ссылаясь на неэтичность юридических преград в условиях военного времени. Тем не менее было решено добиваться санкции на массовое производство пенициллина, что представлялось возможным только в США. Одновременно с англичанами пенициллином занимались американские биологи. Финансировала работу крупная фармацевтическая компания «Мерк» (Рауэй, штат Нью-Джерси), а возглавлял группу американский микробиолог Зельман Ваксман (1888–1973 годы) из университета Руттерса. Он начал исследования в 1939 году, успешно их завершил и даже опубликовал результаты в солидном лондонском издании. Собственно термин «антибиотик» (от анти… и греч. bios — «жизнь») предложил именно Ваксман, открывший новый вид антибактериального вещества — стрептомицин. Пребывание Флори в США началось с небольшого скандала. «Американцы украли пенициллин у британцев», — гласили заголовки газет, но справедливо замечали, что Англия не готова к промышленному производству антибиотиков, хотя сильно в этом нуждается. Пока оппоненты оспаривали друг у друга первенство открытия, фронтовые медики успешно лечили пенициллином американских и британских солдат. На вручении Нобелевской премии по медицине за 1945 год жюри отметило, что лауреаты Флеминг, Чейн и Флори «сделали для победы над фашизмом больше, чем 25 дивизий». Первый опыт применения антибиотика в США закончился столь же драматично, как и в Англии: пациент скончался в отсутствие нужного количества лекарства. Тогда компания «Мерк» откомандировала в Оксфорд своего эксперта Н. Хетли, который на месте смог убедиться в действенности пенициллина. Таким образом, к весне 1942 года ученые «Мерка» имели собственные открытия по пенициллину, в частности — разработали технологию «глубинных культур» в гигантских ферментах. Первой подопечной американских микробиологов стала 33-летняя Анна Миллер, мать троих детей, супруга администратора Йельского университета. Заразившись от сына стрептококковой ангиной, молодая женщина с высокой температурой была доставлена в главный госпиталь Нью-Хейвена штата Нью-Джерси. Диагноз «стрептококковый сепсис» в то время означал скорую смерть: в миллилитре крови больной бактериологи насчитали 25 колоний микроба. Учитывая сложность ситуации, медики решились на применение пенициллина, предварительно получив согласие компании «Мерк». Контейнер с антибиотиком прибыл в госпиталь Нью-Хейвена в сопровождении полиции. После инъекции 850 единиц препарата Анне вкололи еще 3,5 тысячи, и через несколько часов температура у нее пришла в норму. В мае Анна Миллер выписалась из больницы, а ближе к осени ее навестил Флеминг, совершавший деловую поездку по Америке. В 1990 году живая и вполне здоровая старушка Анна Миллер стала объектом внимания на торжестве, проходившем в музее Смитсоновского института (Вашингтон). В тот день американцы отмечали 50-летний юбилей открытия пенициллина. В ноябре 1942 года позитивное действие пенициллина испытали на себе 500 человек, пострадавшие на пожаре в ночном клубе Бостона. Современные ученые называют антибиотиками органические вещества, образуемые живыми организмами и обладающие способностью подавлять развитие микроорганизмов и задерживать рост опухолевых клеток. Антибиотики используются как лекарственные препараты для подавления бактерий, поражающих внутренние органы человека. Природные антибиотики образуется бактериями: противомикробные вещества выделяют лишайники, морские животные (моллюски, губки), высшие растения. До настоящего времени не выяснена роль антибиотиков в жизни всех этих организмов. Возможно, микроскопические вещества помогают растениям в борьбе за существование или являются регуляторами обмена веществ. Однако вполне вероятно, что они представляют собой примитивные продукты жизнедеятельности. Большинство антибиотиков получают искусственным путем, выращивая в специальной питательной среде. На сегодняшний день описано более 4000 природных антибиотиков, но только 60 из них нашли применение в медицине. Природные антибиотики, не пригодные для использования в лечебных целях, подвергаются химической и биологической модификации: таким образом получаются полусинтетические антибиотики. Однако из них также далеко не все обладают ценными медицинскими свойствами. Для некоторых видов антибиотиков были разработаны методы полного химического синтеза, но такой путь оказался очень сложным и дорогостоящим. В конце столетия наряду с традиционными способами, в борьбе с инфекциями получили распространение методы генной инженерии. При длительном применении некоторые антибиотики могут оказывать токсическое действие на центральную нервную систему человека, подавлять его иммунитет, вызывать аллергические реакции. Однако по выраженности побочных явлений они не превосходят другие лекарственные средства. Знание биохимических и генетических механизмов, обеспечивающих устойчивость бактерий к антибиотикам, позволяет рационально их использовать, вести направленный поиск новых лекарственных препаратов. Поделитесь на страничкеСледующая глава > info.wikireading.ru Эра антибиотиков закончилась. И что теперь? :: NoNaMe Когда Александр Флеминг вернулся из отпуска летом 1928 года, и обнаружил в своей лондонской лаборатории стол, заражённый плесенью Penicillium notatum, он начал новую эру превосходства науки над природой. С тех пор антибиотики, как открытые им лично, так и множество других, открытых благодаря его работам, спасли миллионы жизней и избавили огромное количество людей от страданий. Но с самого начала этой эры учёным было известно, что ей придёт конец. Они просто не знали, когда именно. Когда Александр Флеминг вернулся из отпуска летом 1928 года, и обнаружил в своей лондонской лаборатории стол, заражённый плесенью Penicillium notatum, он начал новую эру превосходства науки над природой. С тех пор антибиотики, как открытые им лично, так и множество других, открытых благодаря его работам, спасли миллионы жизней и избавили огромное количество людей от страданий. Но с самого начала этой эры учёным было известно, что ей придёт конец. Они просто не знали, когда именно.----------------------<cut>---------------------- Сопротивляемость бактерий антибиотикам естественна и неизбежна. По воле случая у нескольких бактерий окажутся гены, способные защитить их от лекарств, они передадут эти гены дальше – и не только своему потомству, но иногда и соседям. Специалисты по вычислительной эпидемиологии наконец получают нужные данные и обрабатывают их для моделирования этого явления. Но никто не пытается использовать эти инструменты, чтобы предсказать конец эры антибиотиков – он уже наступил. Они концентрируются на том, чтобы понять, как скоро стойкие бактерии окажутся в большинстве и что доктора смогут с ними сделать – если это вообще возможно. В 2013 году тогдашний директор Центров по контролю и предотвращению заболеваний (CDC) Том Фриден сказал журналистам: «Если мы не будем вести себя осторожно, вскоре мы окажемся в постантибиотической эпохе». Сегодня, всего лишь четыре года спустя, это агентство утверждает, что мы в ней оказались. «Мы говорим это потому, что универсально стойкая бактерия появилась», – говорит Джин Пател [Jean Patel], руководящая отделением CDC по стратегии и координации использования антибиотиков. «Люди умирают из-за отсутствия антибиотиков, способных лечить их инфекции – инфекции, которые не так давно было очень легко излечивать». В прошлом августе женщина возрастом за 70 попала в госпиталь в Рено, шт. Невада, с бактериальной инфекцией бедра. Бактерия принадлежала к классу особенно упорных микробов, известных, как карбапенем-устойчивые энтеробактерии (CRE). Но эту бактерию не брали ни карбапенемы, ни тетрациклин, ни колистин, и вообще никакой антибактериальный аппарат из 26-и имеющихся в продаже. Через несколько недель она умерла от септического шока. Для чиновников из области здравоохранения, к коим принадлежит и Пател, этот случай отмечает конец эры и начало новой. Вопрос в следующем: как быстро эта универсальная стойкость сможет распространиться? «Когда мы дойдём до ситуации, в которой инфекцию чаще будет невозможно вылечить, чем возможно? – говорит Пател. – Это будет очень сложно предсказать». Ей это точно известно, потому что она уже пыталась. В 2002 году первый стафилококк, устойчивый к ванкомицину, проявил себя у 40-летнего мужчины из Мичигана с хронической язвой ноги. Ситуация казалась весьма печальной: стафилококк – одна из самых распространённых инфекций у людей, а ванкомицин – самый распространённый антибиотик для его лечения. Кроме того, резистивный ген был расположен на плазмиде – свободно перемещающемся колечке ДНК, что позволяло ему легко передвигаться. Эпидемиологи из CDC работали совместно с микробиологами, такими, как Пател, над созданием модели, предсказывающей как далеко и как быстро он сможет распространиться. Пател не помнит точных цифр, но она вспоминает, что результаты получились пугающими. «Мы очень сильно озаботились этим вопросом», – говорит она. К счастью, в данном случае модели ошиблись. С 2002 года было зафиксировано только 13 случаев появления стафилококка, устойчивого к ванкомицину, и все пациенты выжили. Такая ошибка весьма озадачила команды. Но в биологии иногда бывают такие сложности. «Я работала с этой бактерией в лабораториях, где она прекрасно растёт, но от человека к человеку, судя по всему, не распространяется», – говорит Пател. И хотя они ещё не знают, почему, одна из гипотез говорит о том, что появление этого резистентного гена не проходит для бактерии бесследно. Он сделал стафилококк невосприимчивым к его заклятому врагу, одновременно усложняя процесс выживания вне человеческого тела. Больничные правила, время года, география также могут влиять на распространение. Это похоже на попытки предсказания погоды. «Не получится сделать такие предсказания на бумаге или путём пристальных размышлений, – говорит Брюс Ли [Bruce Lee], исследователь общественного здравоохранения в институте Джона Хопкинса. Он работает с организациями, занимающимися здравоохранением в Чикаго и округе Ориндж, предсказывая наиболее вероятные пути распространения CRE – бактерий того типа, что убила женщину в Неваде – в случае их появления в больницах. В прошлом такие модели были основаны исключительно на математике – так Пател пыталась строить свои предсказания. Да, их уравнения были сложными, но не настолько, чтобы принять во внимание такие вещи, как человеческое поведение, биология бактерий и их взаимодействие с окружающей средой. „В нашей области люди всё больше начинают понимать, что для того, чтобы разобраться с распространением устойчивых к антибиотикам бактерий с достаточной степенью детализации, необходимо работать с моделями на основе данных, в которых можно просматривать миллионы различных сценариев – так, как это делают метеорологи“, – говорит Ли. В исследовании, опубликованном Ли в прошлом году, он описывает вероятность распространения CRE в 28 больницах и 74 частных лечебницах округа Ориндж. В этой модели у каждой виртуальной больницы было прописано количество коек, совпадающих с количеством коек в реальных учреждениях, а также вся информация по поводу связности учреждений. В модели каждый пациент был вычислительной единицей, которая в любой определённый день либо переносит, либо не переносит CRE. Эти единицы двигались по экосистеме здравоохранения, взаимодействовали с врачами, медсёстрами, койками, стульями, дверьми по сотне миллионов раз, причём с каждой новой симуляцией эти параметры немного подстраивались. Он обнаружил, что без усиления мер по контролю, например, регулярной проверки пациентов на сопротивляемость и карантине переносчиков, CRE станет эндемическим заболеванием — постоянно присутствующим – практически во всех больницах округа Ориндж через десять лет. А после того, как CRE проникнет в систему здравоохранения, от него будет сложно избавиться. „Это как пытаться прогнать из дома термитов, – говорит Ли. – Как только они пробираются туда, где всё связано со всем, они становятся трудноизлечимой частью экосистемы“. Так что, если доктора и сёстры смогут быстро идентифицировать людей, способных распространять CRE, он смогут хотя бы изолировать угрозу. Даже если самим пациентам они ничего предложить не сумеют. Пока хорошие новости заключаются в том, что единственные случаи передачи от человека к человеку на 100% стойкой бактерии происходят только в суперкомпьютере у Ли. В реальном мире таких случаев не зафиксировано. Но именно их и ищут Пател и CDC. Это и продвинет ситуацию на следующий уровень, говорит Пател. Чтобы держать руку на пульсе, в прошлом году агентство потратило $14,4 млн на создание сети из семи местных лабораторий, способных проводить генетическое тестирование бактериальных проб, взятых из больниц. Сейчас они претворяют в жизнь программу, которая когда-нибудь сможет связать все больницы в США с системой слежения CDC напрямую, чтобы автоматически отмечать каждое произошедшее в США событие, связанное со стойкими к антибиотикам бактериями, в реальном времени. Параллельно Пател, и, с переменным успехом, остальной мир, следит за разработкой антибиотиков. В этой области тоже не всё гладко. На прошлой неделе Всемирная организация здравоохранения выпустила отчёт с анализом всех находящихся в разработке антибактериальных лекарств. Выводы мрачные: недостаточно лекарств, недостаточно инноваций. На каждое новое лекарство из 51 варианта уже можно найти заранее устойчивые к нему микроорганизмы. Исследователи, такие, как Пател и Ли, надеются, что их работа позволить минимизировать существующие угрозы, обнаружить новые по мере их появления, и дать фармакологическим компаниям время на разработку новых лекарств. Эра антибиотиков, возможно, и закончилась – но с наступающей новой эрой ещё многое можно сделать. mynnm.ru Эра антибиотиков подошла к концу? — Паранормальный альманахВ мире каждый год умирает порядка 700 тысяч человек от инфекций, вызванных разного рода бактериями, устойчивыми к существующим на данный момент антибиотикам. Вот несколько примеров: в результате открытого перелома женщина получила инфекцию бедренной кости. Для лечения была применена антибиотикотерапия, однако она оказалась безрезультатной, и пациентка умерла от септического шока. Как было установлено позже, патогенном была клебсиелла, бактерия нормальной флоры человека, которая обладает устойчивостью ко всем 26 зарегистрированным в Соединенных Штатах Америки антибиотикам. Каждый год около 23 тысяч человек в США, 25 тысяч человек в Европе и около 700 тысяч человек во всем мире умирает от инфекционных заболеваний, вызванных устойчивыми к антибиотикам бактериями. По оценкам специалистов, примерно через три десятилетия смертность от таких бактерий будет достигать 10 миллионов человек ежегодно. Однако финансирование новых разработок антибиотиков сокращается. Так почему же бактерии становятся агрессивными и приобретают устойчивость к лекарственным препаратам? И почему в таком случае разработка новых антибиотиков является невыгодной? Как известно, антибиотики были открыты совершенно случайно. Александр Флеминг отличался неряшливостью, которая вовсе не красит ученого, и тем более бактериолога. В 1922 году, после того, как слизь из его носа попала на колонию бактерий, ученый случайно открыл такой фермент, как лизоцим. А спустя 6 лет, в 1928 году он точно так же случайно занес в культуру стафилококка споры плесени и заметил, что все бактерии вокруг выросшего гриба погибли. Ученый пришел к выводу, что благодаря плесени происходит синтез бактерицидного вещества за счет вытеснения бактерий, конкурирующих за питательную среду. Флеминг выделил из плесени пенициллин, который оказался более эффективным, нежели те наружные антисептики, которые применялись в то время в хирургии. Пенициллин, в отличие от антисептических препаратов, можно ввести внутрь человеческого организма, и там он борется в различных тканях и органах с инфекциями. Более того, даже после того, как препарат был разведен 800 раз, его антибактериальная активность сохранялась.
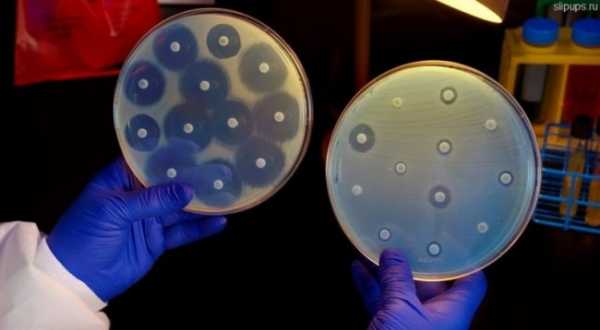
Позже высокую активность небольших доз препарата удалось объяснить благодаря определению механизма действия пенициллина. В случае применения антисептиков в больших концентрациях происходит разрушение стенок клеток бактерий. Пенициллин же проникает внутрь клетки, где блокирует образование биополимера, который необходим для роста клеточных стенок бактерий. Впрочем, довольно скоро Флемингу удалось установить, что если ввести слишком небольшую дозу пенициллина или вводить его на протяжении небольшого периода времени, то колонии бактерий, которым удалось выжить, приобретают устойчивость к тем дозам препарата, которые были эффективными ранее. А еще позже ученые определили, что у стафилококков имеется врожденная способность синтезировать фермент, который разрушает пенициллин. Это в определенной степени антидот. В настоящее время учеными достоверно установлено, что такого рода противостояния характерны не только в природных условиях между бактериями и грибами, но и между видами бактерий одного рода, поскольку в таком случае у них одинаковые субстрат и ниша, за которые необходимо бороться. Так, к примеру, в настоящее время различные виды стафилококков ведут борьбу за слизистую рта человека, в то же время вырабатывая антидоты и бактерицидные вещества. Впрочем, в этом противостоянии нет ни победителей, ни побежденных, поскольку за миллионы лет такая эволюционная борьба множества видов микроорганизмов человеческой микрофлоры обернулась балансом, ставшим бесценным приобретением для организма в целом. Численность каждого вида строго ограничена бактерицидной активность других видов бактерий, размерами занимаемой ниши и иммунитетом организма. В частности, популяция золотистого стафилококка, который вызывает гнойные инфекции, может достигать численности до 10 тысяч бактерий в мл среды без вреда для человеческого организма, а бактерия клебсиелла может присутствовать в кишечнике или на коже здорового человека, и не причинять вред человеку, если численность популяции будет составлять не более 10 тысяч бактерий на грамм фекалий. Ответить на вопрос, почему бактерии приобретают суперустойчивость к антибиотикам, поможет простой пример. В частности, можно представить себе, что в одном из небольших африканских государств происходит конфликт и одна из сторон получила оружие массового поражения. Если говорить о бактериях, то таким оружием массового поражения станут антибиотики, но не природного происхождения, а современные синтетические вещества, которые применяются в больших концентрациях. После применения таких антибиотиков, за счет видов бактерий, наиболее чувствительных к препарату, произойдет сокращение видового разнообразия. Ниши, которые в результате освободятся, довольно быстро будут заняты теми видами бактерий, которые обладают способностью синтезировать антидоты. Таким образом, эволюционное преимущество получат колонии тех бактерий, которые обладают устойчивостью к антибиотикам, и в результате внутри одного вида генетическое разнообразие уменьшится. Следовательно, применяя антибиотики, человек неосознанно создает положительные условия для наиболее устойчивых штаммов бактерий. Именно по этой причине беспорядочное применение антибиотиков зачастую приводит к развитию хронических заболеваний, спровоцированных увеличением патогенной микрофлоры. Человек, который является носителем такого рода бактерий, станет распространителем, передавая их своим родным, друзьям и знакомым, которые со временем начнут применять другие антибиотики. Таким образом, естественный отбор будет продолжаться, и бактерии, которые были устойчивы к одному виду антибиотиков, постепенно приобретут так называемую полирезистентность, то есть, устойчивость к различным видам антибиотиков. Именно такие патогены и получили название супербактерий. Помимо этого, многие виды бактерий обладают способностью обмениваться при помощи плазмиды (горизонтального переноса генетических элементов, находящихся вне хромосомы) обмениваться генами резистентности. Большая опасность заключается в том, что устойчивость к большому количеству видов антибиотиков приобретают бактерии-анаэробы, для которых характерным является бескислородный метаболизм. Если человек получит травму, такие бактерии могут попасть в кровь, вызвав тяжелое заражение. Именно это и произошло в описанном выше случае, когда бактерии проникли в костную ткань. В попытках спасти женщину, врачи применили почти полтора десятка антибиотиков, и еще дюжина препаратов была протестирована на выделенной из очага инфекции культуре, однако все эти антибиотики оказались неэффективными. Еще большая опасность состоит в том, что резистентность к антибиотикам могут приобретать разного рода патогенные бактерии, в частности, те, которые являются возбудителями сибирской язвы, сальмонеллеза и дизентерии. Даже несмотря на то, что все эти инфекции практически не распространены, возбудители их достаточно легко могут получить устойчивость к антибиотикам от бактерий нормальной микрофлоры за счет горизонтального переноса генов в плазмидах. Помимо того, довольно часто носителями опасных инфекций являются сельскохозяйственные животные. Необходимо отметить, что в данном случае резистентные бактерии в них распространены гораздо шире, нежели у людей. По словам специалистов, это объясняется тем, что в сельском хозяйстве антибиотики добавляют в корм для профилактики разного рода инфекций. Такие дозировки не приводят к уничтожению бактерий, а только не дают им размножаться. Но ведь еще Флеминг говорил о том, что использование малых доз антибиотиков приводит к снижению чувствительности к препаратам. Группой исследователей Гарварда был проведен очень интересный эксперимент, в котором было показано, как растет число устойчивых штаммов бактерий в случае постепенного увеличения концентрации антибиотиков от минимума до тысячекратной. Таким образом, антибиотики необходимо принимать только согласно предписания врачей и только в рекомендованных дозах. В то же время, необходимо помнить, что если бактерия, которая спровоцировала заболевание, уже обладает устойчивостью к антибиотику, то даже прием препарата в больших концентрациях на протяжении длительного времени может оказаться неэффективным. В таком случае необходимо определить в лабораторных условиях чувствительность бактерии к препарату. С этой целью вместе с посевом бактерий на питательную среду укладывают бумажные диски, которые пропитаны разными видами антибиотиков. При появлении вокруг дисков прозрачных колец можно говорить об отсутствии роста культуры бактерий. Иными словами – она чувствительна к данному антибиотику. В случае отсутствия прозрачного кольца – можно говорить о наличии резистентности. Благодаря результатам подобного исследования врачи уже смогут назначить один из антибиотиков узкого спектра действия, подавив патоген без ущерба для всей микрофлоры. Впрочем, подобного рода исследование стоит достаточно дорого и требует несколько дней. По этой причине, чтобы не терять время, врачи, как правило, не дожидаясь результатов исследования, назначают антибиотики. В большинстве случаев такой анализ не проводится вообще, и назначение антибиотика проводится без определения типа патогена. Таким образом, используется антибиотик широкого спектра действия. Это может иметь положительный эффект в некоторых случаях, однако в масштабах человечества подобная практика способствует тому, что проблема резистентности бактерий к антибиотикам лишь усугубляется. Если говорить о разработках и испытаниях новых видов антибиотиков, то необходимо отметить, что данный процесс очень трудоемкий и дорогостоящий. На его реализацию необходимо порядка миллиарда долларов инвестиций и более десяти лет. Кроме того, антибиотики в большинстве случаев применяют короткими курсами, иногда всего несколько раз за всю жизнь. Если говорить о жаропонижающих, обезболивающих или гормональных препаратах, то они используются гораздо чаще и шире. А это, в свою очередь, делает их более привлекательными для инвестиций. За счет этого новые антибиотики внедряются в практику все реже. Нежелание инвесторов вкладывать деньги в разработки новых препаратов вызваны еще и тем, что резистентность бактерий последних поколений все больше возрастает. В современной терапии врачи воздерживаются от широкого использования новых антибиотиков, применяя их лишь в крайних случаях в виде резерва. А это снижает спрос на эти препараты и лишает прибыли. Таким образом, получается, что резистентность бактерий, которая вызвана антибиотиками, тормозит разработки новых препаратов. Бесспорно, открытие и активное применение в терапии антибиотиков стало настоящим прорывом в медицине. В момента своего появления, благодаря антибиотикам удалось спасти миллионы человеческих жизней. Но в настоящее время необходимо искать новые решения, которые помогут снизить зависимость медицины от применения антибиотиков. (Visited 157 times, 1 visits today) ЕЩЕ СТАТЬИ ПО ТЕМЕ:virtoo.ru Эра антибиотиков закончилась. И что теперь? Когда Александр Флеминг вернулся из отпуска летом 1928 года, и обнаружил в своей лондонской лаборатории стол, заражённый плесенью Penicillium notatum, он начал новую эру превосходства науки над природой. С тех пор антибиотики, как открытые им лично, так и множество других, открытых благодаря его работам, спасли миллионы жизней и избавили огромное количество людей от страданий. Но с самого начала этой эры учёным было известно, что ей придёт конец. Они просто не знали, когда именно. Сопротивляемость бактерий антибиотикам естественна и неизбежна. По воле случая у нескольких бактерий окажутся гены, способные защитить их от лекарств, они передадут эти гены дальше – и не только своему потомству, но иногда и соседям. Специалисты по вычислительной эпидемиологии наконец получают нужные данные и обрабатывают их для моделирования этого явления. Но никто не пытается использовать эти инструменты, чтобы предсказать конец эры антибиотиков – он уже наступил. Они концентрируются на том, чтобы понять, как скоро стойкие бактерии окажутся в большинстве и что доктора смогут с ними сделать – если это вообще возможно. В 2013 году тогдашний директор Центров по контролю и предотвращению заболеваний (CDC) Том Фриден сказал журналистам: «Если мы не будем вести себя осторожно, вскоре мы окажемся в постантибиотической эпохе». Сегодня, всего лишь четыре года спустя, это агентство утверждает, что мы в ней оказались. «Мы говорим это потому, что универсально стойкая бактерия появилась», – говорит Джин Пател [Jean Patel], руководящая отделением CDC по стратегии и координации использования антибиотиков. «Люди умирают из-за отсутствия антибиотиков, способных лечить их инфекции – инфекции, которые не так давно было очень легко излечивать». В прошлом августе женщина возрастом за 70 попала в госпиталь в Рено, шт. Невада, с бактериальной инфекцией бедра. Бактерия принадлежала к классу особенно упорных микробов, известных, как карбапенем-устойчивые энтеробактерии (CRE). Но эту бактерию не брали ни карбапенемы, ни тетрациклин, ни колистин, и вообще никакой антибактериальный аппарат из 26-и имеющихся в продаже. Через несколько недель она умерла от септического шока. Для чиновников из области здравоохранения, к коим принадлежит и Пател, этот случай отмечает конец эры и начало новой. Вопрос в следующем: как быстро эта универсальная стойкость сможет распространиться? «Когда мы дойдём до ситуации, в которой инфекцию чаще будет невозможно вылечить, чем возможно? – говорит Пател. – Это будет очень сложно предсказать». Ей это точно известно, потому что она уже пыталась. В 2002 году первый стафилококк, устойчивый к ванкомицину, проявил себя у 40-летнего мужчины из Мичигана с хронической язвой ноги. Ситуация казалась весьма печальной: стафилококк – одна из самых распространённых инфекций у людей, а ванкомицин – самый распространённый антибиотик для его лечения. Кроме того, резистивный ген был расположен на плазмиде – свободно перемещающемся колечке ДНК, что позволяло ему легко передвигаться. Эпидемиологи из CDC работали совместно с микробиологами, такими, как Пател, над созданием модели, предсказывающей как далеко и как быстро он сможет распространиться. Пател не помнит точных цифр, но она вспоминает, что результаты получились пугающими. «Мы очень сильно озаботились этим вопросом», – говорит она. К счастью, в данном случае модели ошиблись. С 2002 года было зафиксировано только 13 случаев появления стафилококка, устойчивого к ванкомицину, и все пациенты выжили. Такая ошибка весьма озадачила команды. Но в биологии иногда бывают такие сложности. «Я работала с этой бактерией в лабораториях, где она прекрасно растёт, но от человека к человеку, судя по всему, не распространяется», – говорит Пател. И хотя они ещё не знают, почему, одна из гипотез говорит о том, что появление этого резистентного гена не проходит для бактерии бесследно. Он сделал стафилококк невосприимчивым к его заклятому врагу, одновременно усложняя процесс выживания вне человеческого тела. Больничные правила, время года, география также могут влиять на распространение. Это похоже на попытки предсказания погоды. «Не получится сделать такие предсказания на бумаге или путём пристальных размышлений, – говорит Брюс Ли [Bruce Lee], исследователь общественного здравоохранения в институте Джона Хопкинса. Он работает с организациями, занимающимися здравоохранением в Чикаго и округе Ориндж, предсказывая наиболее вероятные пути распространения CRE – бактерий того типа, что убила женщину в Неваде – в случае их появления в больницах. В прошлом такие модели были основаны исключительно на математике – так Пател пыталась строить свои предсказания. Да, их уравнения были сложными, но не настолько, чтобы принять во внимание такие вещи, как человеческое поведение, биология бактерий и их взаимодействие с окружающей средой. „В нашей области люди всё больше начинают понимать, что для того, чтобы разобраться с распространением устойчивых к антибиотикам бактерий с достаточной степенью детализации, необходимо работать с моделями на основе данных, в которых можно просматривать миллионы различных сценариев – так, как это делают метеорологи“, – говорит Ли. В исследовании, опубликованном Ли в прошлом году, он описывает вероятность распространения CRE в 28 больницах и 74 частных лечебницах округа Ориндж. В этой модели у каждой виртуальной больницы было прописано количество коек, совпадающих с количеством коек в реальных учреждениях, а также вся информация по поводу связности учреждений. В модели каждый пациент был вычислительной единицей, которая в любой определённый день либо переносит, либо не переносит CRE. Эти единицы двигались по экосистеме здравоохранения, взаимодействовали с врачами, медсёстрами, койками, стульями, дверьми по сотне миллионов раз, причём с каждой новой симуляцией эти параметры немного подстраивались. Он обнаружил, что без усиления мер по контролю, например, регулярной проверки пациентов на сопротивляемость и карантине переносчиков, CRE станет эндемическим заболеванием — постоянно присутствующим – практически во всех больницах округа Ориндж через десять лет. А после того, как CRE проникнет в систему здравоохранения, от него будет сложно избавиться. „Это как пытаться прогнать из дома термитов, – говорит Ли. – Как только они пробираются туда, где всё связано со всем, они становятся трудноизлечимой частью экосистемы“. Так что, если доктора и сёстры смогут быстро идентифицировать людей, способных распространять CRE, он смогут хотя бы изолировать угрозу. Даже если самим пациентам они ничего предложить не сумеют. Пока хорошие новости заключаются в том, что единственные случаи передачи от человека к человеку на 100% стойкой бактерии происходят только в суперкомпьютере у Ли. В реальном мире таких случаев не зафиксировано. Но именно их и ищут Пател и CDC. Это и продвинет ситуацию на следующий уровень, говорит Пател. Чтобы держать руку на пульсе, в прошлом году агентство потратило $14,4 млн на создание сети из семи местных лабораторий, способных проводить генетическое тестирование бактериальных проб, взятых из больниц. Сейчас они претворяют в жизнь программу, которая когда-нибудь сможет связать все больницы в США с системой слежения CDC напрямую, чтобы автоматически отмечать каждое произошедшее в США событие, связанное со стойкими к антибиотикам бактериями, в реальном времени. Параллельно Пател, и, с переменным успехом, остальной мир, следит за разработкой антибиотиков. В этой области тоже не всё гладко. На прошлой неделе Всемирная организация здравоохранения выпустила отчёт с анализом всех находящихся в разработке антибактериальных лекарств. Выводы мрачные: недостаточно лекарств, недостаточно инноваций. На каждое новое лекарство из 51 варианта уже можно найти заранее устойчивые к нему микроорганизмы. Исследователи, такие, как Пател и Ли, надеются, что их работа позволить минимизировать существующие угрозы, обнаружить новые по мере их появления, и дать фармакологическим компаниям время на разработку новых лекарств. Эра антибиотиков, возможно, и закончилась – но с наступающей новой эрой ещё многое можно сделать. Когда Александр Флеминг вернулся из отпуска летом 1928 года, и обнаружил в своей лондонской лаборатории стол, заражённый плесенью Penicillium notatum, он начал новую эру превосходства науки над природой. С тех пор антибиотики, как открытые им лично, так и множество других, открытых благодаря его работам, спасли миллионы жизней и избавили огромное количество людей от страданий. Но с самого начала этой эры учёным было известно, что ей придёт конец. Они просто не знали, когда именно. Сопротивляемость бактерий антибиотикам естественна и неизбежна. По воле случая у нескольких бактерий окажутся гены, способные защитить их от лекарств, они передадут эти гены дальше – и не только своему потомству, но иногда и соседям. Специалисты по вычислительной эпидемиологии наконец получают нужные данные и обрабатывают их для моделирования этого явления. Но никто не пытается использовать эти инструменты, чтобы предсказать конец эры антибиотиков – он уже наступил. Они концентрируются на том, чтобы понять, как скоро стойкие бактерии окажутся в большинстве и что доктора смогут с ними сделать – если это вообще возможно. В 2013 году тогдашний директор Центров по контролю и предотвращению заболеваний (CDC) Том Фриден сказал журналистам: «Если мы не будем вести себя осторожно, вскоре мы окажемся в постантибиотической эпохе». Сегодня, всего лишь четыре года спустя, это агентство утверждает, что мы в ней оказались. «Мы говорим это потому, что универсально стойкая бактерия появилась», – говорит Джин Пател [Jean Patel], руководящая отделением CDC по стратегии и координации использования антибиотиков. «Люди умирают из-за отсутствия антибиотиков, способных лечить их инфекции – инфекции, которые не так давно было очень легко излечивать». В прошлом августе женщина возрастом за 70 попала в госпиталь в Рено, шт. Невада, с бактериальной инфекцией бедра. Бактерия принадлежала к классу особенно упорных микробов, известных, как карбапенем-устойчивые энтеробактерии (CRE). Но эту бактерию не брали ни карбапенемы, ни тетрациклин, ни колистин, и вообще никакой антибактериальный аппарат из 26-и имеющихся в продаже. Через несколько недель она умерла от септического шока. Для чиновников из области здравоохранения, к коим принадлежит и Пател, этот случай отмечает конец эры и начало новой. Вопрос в следующем: как быстро эта универсальная стойкость сможет распространиться? «Когда мы дойдём до ситуации, в которой инфекцию чаще будет невозможно вылечить, чем возможно? – говорит Пател. – Это будет очень сложно предсказать». Ей это точно известно, потому что она уже пыталась. В 2002 году первый стафилококк, устойчивый к ванкомицину, проявил себя у 40-летнего мужчины из Мичигана с хронической язвой ноги. Ситуация казалась весьма печальной: стафилококк – одна из самых распространённых инфекций у людей, а ванкомицин – самый распространённый антибиотик для его лечения. Кроме того, резистивный ген был расположен на плазмиде – свободно перемещающемся колечке ДНК, что позволяло ему легко передвигаться. Эпидемиологи из CDC работали совместно с микробиологами, такими, как Пател, над созданием модели, предсказывающей как далеко и как быстро он сможет распространиться. Пател не помнит точных цифр, но она вспоминает, что результаты получились пугающими. «Мы очень сильно озаботились этим вопросом», – говорит она. К счастью, в данном случае модели ошиблись. С 2002 года было зафиксировано только 13 случаев появления стафилококка, устойчивого к ванкомицину, и все пациенты выжили. Такая ошибка весьма озадачила команды. Но в биологии иногда бывают такие сложности. «Я работала с этой бактерией в лабораториях, где она прекрасно растёт, но от человека к человеку, судя по всему, не распространяется», – говорит Пател. И хотя они ещё не знают, почему, одна из гипотез говорит о том, что появление этого резистентного гена не проходит для бактерии бесследно. Он сделал стафилококк невосприимчивым к его заклятому врагу, одновременно усложняя процесс выживания вне человеческого тела. Больничные правила, время года, география также могут влиять на распространение. Это похоже на попытки предсказания погоды. «Не получится сделать такие предсказания на бумаге или путём пристальных размышлений, – говорит Брюс Ли [Bruce Lee], исследователь общественного здравоохранения в институте Джона Хопкинса. Он работает с организациями, занимающимися здравоохранением в Чикаго и округе Ориндж, предсказывая наиболее вероятные пути распространения CRE – бактерий того типа, что убила женщину в Неваде – в случае их появления в больницах. В прошлом такие модели были основаны исключительно на математике – так Пател пыталась строить свои предсказания. Да, их уравнения были сложными, но не настолько, чтобы принять во внимание такие вещи, как человеческое поведение, биология бактерий и их взаимодействие с окружающей средой. „В нашей области люди всё больше начинают понимать, что для того, чтобы разобраться с распространением устойчивых к антибиотикам бактерий с достаточной степенью детализации, необходимо работать с моделями на основе данных, в которых можно просматривать миллионы различных сценариев – так, как это делают метеорологи“, – говорит Ли. В исследовании, опубликованном Ли в прошлом году, он описывает вероятность распространения CRE в 28 больницах и 74 частных лечебницах округа Ориндж. В этой модели у каждой виртуальной больницы было прописано количество коек, совпадающих с количеством коек в реальных учреждениях, а также вся информация по поводу связности учреждений. В модели каждый пациент был вычислительной единицей, которая в любой определённый день либо переносит, либо не переносит CRE. Эти единицы двигались по экосистеме здравоохранения, взаимодействовали с врачами, медсёстрами, койками, стульями, дверьми по сотне миллионов раз, причём с каждой новой симуляцией эти параметры немного подстраивались. Он обнаружил, что без усиления мер по контролю, например, регулярной проверки пациентов на сопротивляемость и карантине переносчиков, CRE станет эндемическим заболеванием — постоянно присутствующим – практически во всех больницах округа Ориндж через десять лет. А после того, как CRE проникнет в систему здравоохранения, от него будет сложно избавиться. „Это как пытаться прогнать из дома термитов, – говорит Ли. – Как только они пробираются туда, где всё связано со всем, они становятся трудноизлечимой частью экосистемы“. Так что, если доктора и сёстры смогут быстро идентифицировать людей, способных распространять CRE, он смогут хотя бы изолировать угрозу. Даже если самим пациентам они ничего предложить не сумеют. Пока хорошие новости заключаются в том, что единственные случаи передачи от человека к человеку на 100% стойкой бактерии происходят только в суперкомпьютере у Ли. В реальном мире таких случаев не зафиксировано. Но именно их и ищут Пател и CDC. Это и продвинет ситуацию на следующий уровень, говорит Пател. Чтобы держать руку на пульсе, в прошлом году агентство потратило $14,4 млн на создание сети из семи местных лабораторий, способных проводить генетическое тестирование бактериальных проб, взятых из больниц. Сейчас они претворяют в жизнь программу, которая когда-нибудь сможет связать все больницы в США с системой слежения CDC напрямую, чтобы автоматически отмечать каждое произошедшее в США событие, связанное со стойкими к антибиотикам бактериями, в реальном времени. Параллельно Пател, и, с переменным успехом, остальной мир, следит за разработкой антибиотиков. В этой области тоже не всё гладко. На прошлой неделе Всемирная организация здравоохранения выпустила отчёт с анализом всех находящихся в разработке антибактериальных лекарств. Выводы мрачные: недостаточно лекарств, недостаточно инноваций. На каждое новое лекарство из 51 варианта уже можно найти заранее устойчивые к нему микроорганизмы. Исследователи, такие, как Пател и Ли, надеются, что их работа позволить минимизировать существующие угрозы, обнаружить новые по мере их появления, и дать фармакологическим компаниям время на разработку новых лекарств. Эра антибиотиков, возможно, и закончилась – но с наступающей новой эрой ещё многое можно сделать. Источник sethealth.ru Эра антибиотиков подошла к концу?
В мире каждый год умирает порядка 700 тысяч человек от инфекций, вызванных разного рода бактериями, устойчивыми к существующим на данный момент антибиотикам. Вот несколько примеров: в результате открытого перелома женщина получила инфекцию бедренной кости. Для лечения была применена антибиотикотерапия, однако она оказалась безрезультатной, и пациентка умерла от септического шока. Как было установлено позже, патогенном была клебсиелла, бактерия нормальной флоры человека, которая обладает устойчивостью ко всем 26 зарегистрированным в Соединенных Штатах Америки антибиотикам. Каждый год около 23 тысяч человек в США, 25 тысяч человек в Европе и около 700 тысяч человек во всем мире умирает от инфекционных заболеваний, вызванных устойчивыми к антибиотикам бактериями. По оценкам специалистов, примерно через три десятилетия смертность от таких бактерий будет достигать 10 миллионов человек ежегодно. Однако финансирование новых разработок антибиотиков сокращается. Так почему же бактерии становятся агрессивными и приобретают устойчивость к лекарственным препаратам? И почему в таком случае разработка новых антибиотиков является невыгодной? Как известно, антибиотики были открыты совершенно случайно. Александр Флеминг отличался неряшливостью, которая вовсе не красит ученого, и тем более бактериолога. В 1922 году, после того, как слизь из его носа попала на колонию бактерий, ученый случайно открыл такой фермент, как лизоцим. А спустя 6 лет, в 1928 году он точно так же случайно занес в культуру стафилококка споры плесени и заметил, что все бактерии вокруг выросшего гриба погибли. Ученый пришел к выводу, что благодаря плесени происходит синтез бактерицидного вещества за счет вытеснения бактерий, конкурирующих за питательную среду. Флеминг выделил из плесени пенициллин, который оказался более эффективным, нежели те наружные антисептики, которые применялись в то время в хирургии. Пенициллин, в отличие от антисептических препаратов, можно ввести внутрь человеческого организма, и там он борется в различных тканях и органах с инфекциями. Более того, даже после того, как препарат был разведен 800 раз, его антибактериальная активность сохранялась. Позже высокую активность небольших доз препарата удалось объяснить благодаря определению механизма действия пенициллина. В случае применения антисептиков в больших концентрациях происходит разрушение стенок клеток бактерий. Пенициллин же проникает внутрь клетки, где блокирует образование биополимера, который необходим для роста клеточных стенок бактерий. Впрочем, довольно скоро Флемингу удалось установить, что если ввести слишком небольшую дозу пенициллина или вводить его на протяжении небольшого периода времени, то колонии бактерий, которым удалось выжить, приобретают устойчивость к тем дозам препарата, которые были эффективными ранее. А еще позже ученые определили, что у стафилококков имеется врожденная способность синтезировать фермент, который разрушает пенициллин. Это в определенной степени антидот. В настоящее время учеными достоверно установлено, что такого рода противостояния характерны не только в природных условиях между бактериями и грибами, но и между видами бактерий одного рода, поскольку в таком случае у них одинаковые субстрат и ниша, за которые необходимо бороться. Так, к примеру, в настоящее время различные виды стафилококков ведут борьбу за слизистую рта человека, в то же время вырабатывая антидоты и бактерицидные вещества. Впрочем, в этом противостоянии нет ни победителей, ни побежденных, поскольку за миллионы лет такая эволюционная борьба множества видов микроорганизмов человеческой микрофлоры обернулась балансом, ставшим бесценным приобретением для организма в целом. Численность каждого вида строго ограничена бактерицидной активность других видов бактерий, размерами занимаемой ниши и иммунитетом организма. В частности, популяция золотистого стафилококка, который вызывает гнойные инфекции, может достигать численности до 10 тысяч бактерий в мл среды без вреда для человеческого организма, а бактерия клебсиелла может присутствовать в кишечнике или на коже здорового человека, и не причинять вред человеку, если численность популяции будет составлять не более 10 тысяч бактерий на грамм фекалий. Ответить на вопрос, почему бактерии приобретают суперустойчивость к антибиотикам, поможет простой пример. В частности, можно представить себе, что в одном из небольших африканских государств происходит конфликт и одна из сторон получила оружие массового поражения. Если говорить о бактериях, то таким оружием массового поражения станут антибиотики, но не природного происхождения, а современные синтетические вещества, которые применяются в больших концентрациях. После применения таких антибиотиков, за счет видов бактерий, наиболее чувствительных к препарату, произойдет сокращение видового разнообразия. Ниши, которые в результате освободятся, довольно быстро будут заняты теми видами бактерий, которые обладают способностью синтезировать антидоты. Таким образом, эволюционное преимущество получат колонии тех бактерий, которые обладают устойчивостью к антибиотикам, и в результате внутри одного вида генетическое разнообразие уменьшится. Следовательно, применяя антибиотики, человек неосознанно создает положительные условия для наиболее устойчивых штаммов бактерий. Именно по этой причине беспорядочное применение антибиотиков зачастую приводит к развитию хронических заболеваний, спровоцированных увеличением патогенной микрофлоры. Человек, который является носителем такого рода бактерий, станет распространителем, передавая их своим родным, друзьям и знакомым, которые со временем начнут применять другие антибиотики. Таким образом, естественный отбор будет продолжаться, и бактерии, которые были устойчивы к одному виду антибиотиков, постепенно приобретут так называемую полирезистентность, то есть, устойчивость к различным видам антибиотиков. Именно такие патогены и получили название супербактерий. Помимо этого, многие виды бактерий обладают способностью обмениваться при помощи плазмиды (горизонтального переноса генетических элементов, находящихся вне хромосомы) обмениваться генами резистентности. Большая опасность заключается в том, что устойчивость к большому количеству видов антибиотиков приобретают бактерии-анаэробы, для которых характерным является бескислородный метаболизм. Если человек получит травму, такие бактерии могут попасть в кровь, вызвав тяжелое заражение. Именно это и произошло в описанном выше случае, когда бактерии проникли в костную ткань. В попытках спасти женщину, врачи применили почти полтора десятка антибиотиков, и еще дюжина препаратов была протестирована на выделенной из очага инфекции культуре, однако все эти антибиотики оказались неэффективными. Еще большая опасность состоит в том, что резистентность к антибиотикам могут приобретать разного рода патогенные бактерии, в частности, те, которые являются возбудителями сибирской язвы, сальмонеллеза и дизентерии. Даже несмотря на то, что все эти инфекции практически не распространены, возбудители их достаточно легко могут получить устойчивость к антибиотикам от бактерий нормальной микрофлоры за счет горизонтального переноса генов в плазмидах. Помимо того, довольно часто носителями опасных инфекций являются сельскохозяйственные животные. Необходимо отметить, что в данном случае резистентные бактерии в них распространены гораздо шире, нежели у людей. По словам специалистов, это объясняется тем, что в сельском хозяйстве антибиотики добавляют в корм для профилактики разного рода инфекций. Такие дозировки не приводят к уничтожению бактерий, а только не дают им размножаться. Но ведь еще Флеминг говорил о том, что использование малых доз антибиотиков приводит к снижению чувствительности к препаратам. Группой исследователей Гарварда был проведен очень интересный эксперимент, в котором было показано, как растет число устойчивых штаммов бактерий в случае постепенного увеличения концентрации антибиотиков от минимума до тысячекратной. Таким образом, антибиотики необходимо принимать только согласно предписания врачей и только в рекомендованных дозах. В то же время, необходимо помнить, что если бактерия, которая спровоцировала заболевание, уже обладает устойчивостью к антибиотику, то даже прием препарата в больших концентрациях на протяжении длительного времени может оказаться неэффективным. В таком случае необходимо определить в лабораторных условиях чувствительность бактерии к препарату. С этой целью вместе с посевом бактерий на питательную среду укладывают бумажные диски, которые пропитаны разными видами антибиотиков. При появлении вокруг дисков прозрачных колец можно говорить об отсутствии роста культуры бактерий. Иными словами – она чувствительна к данному антибиотику. В случае отсутствия прозрачного кольца – можно говорить о наличии резистентности. Благодаря результатам подобного исследования врачи уже смогут назначить один из антибиотиков узкого спектра действия, подавив патоген без ущерба для всей микрофлоры. Впрочем, подобного рода исследование стоит достаточно дорого и требует несколько дней. По этой причине, чтобы не терять время, врачи, как правило, не дожидаясь результатов исследования, назначают антибиотики. В большинстве случаев такой анализ не проводится вообще, и назначение антибиотика проводится без определения типа патогена. Таким образом, используется антибиотик широкого спектра действия. Это может иметь положительный эффект в некоторых случаях, однако в масштабах человечества подобная практика способствует тому, что проблема резистентности бактерий к антибиотикам лишь усугубляется. Если говорить о разработках и испытаниях новых видов антибиотиков, то необходимо отметить, что данный процесс очень трудоемкий и дорогостоящий. На его реализацию необходимо порядка миллиарда долларов инвестиций и более десяти лет. Кроме того, антибиотики в большинстве случаев применяют короткими курсами, иногда всего несколько раз за всю жизнь. Если говорить о жаропонижающих, обезболивающих или гормональных препаратах, то они используются гораздо чаще и шире. А это, в свою очередь, делает их более привлекательными для инвестиций. За счет этого новые антибиотики внедряются в практику все реже. Нежелание инвесторов вкладывать деньги в разработки новых препаратов вызваны еще и тем, что резистентность бактерий последних поколений все больше возрастает. В современной терапии врачи воздерживаются от широкого использования новых антибиотиков, применяя их лишь в крайних случаях в виде резерва. А это снижает спрос на эти препараты и лишает прибыли. Таким образом, получается, что резистентность бактерий, которая вызвана антибиотиками, тормозит разработки новых препаратов. Бесспорно, открытие и активное применение в терапии антибиотиков стало настоящим прорывом в медицине. В момента своего появления, благодаря антибиотикам удалось спасти миллионы человеческих жизней. Но в настоящее время необходимо искать новые решения, которые помогут снизить зависимость медицины от применения антибиотиков. tainav.mirtesen.ru Эра антибиотиков подошла к концу?В мире каждый год умирает порядка 700 тысяч человек от инфекций, вызванных разного рода бактериями, устойчивыми к существующим на данный момент антибиотикам. Вот несколько примеров: в результате открытого перелома женщина получила инфекцию бедренной кости. Для лечения была применена антибиотикотерапия, однако она оказалась безрезультатной, и пациентка умерла от септического шока. Как было установлено позже, патогенном была клебсиелла, бактерия нормальной флоры человека, которая обладает устойчивостью ко всем 26 зарегистрированным в Соединенных Штатах Америки антибиотикам. Каждый год около 23 тысяч человек в США, 25 тысяч человек в Европе и около 700 тысяч человек во всем мире умирает от инфекционных заболеваний, вызванных устойчивыми к антибиотикам бактериями. По оценкам специалистов, примерно через три десятилетия смертность от таких бактерий будет достигать 10 миллионов человек ежегодно. Однако финансирование новых разработок антибиотиков сокращается. Так почему же бактерии становятся агрессивными и приобретают устойчивость к лекарственным препаратам? И почему в таком случае разработка новых антибиотиков является невыгодной? Как известно, антибиотики были открыты совершенно случайно. Александр Флеминг отличался неряшливостью, которая вовсе не красит ученого, и тем более бактериолога. В 1922 году, после того, как слизь из его носа попала на колонию бактерий, ученый случайно открыл такой фермент, как лизоцим. А спустя 6 лет, в 1928 году он точно так же случайно занес в культуру стафилококка споры плесени и заметил, что все бактерии вокруг выросшего гриба погибли. Ученый пришел к выводу, что благодаря плесени происходит синтез бактерицидного вещества за счет вытеснения бактерий, конкурирующих за питательную среду. Флеминг выделил из плесени пенициллин, который оказался более эффективным, нежели те наружные антисептики, которые применялись в то время в хирургии. Пенициллин, в отличие от антисептических препаратов, можно ввести внутрь человеческого организма, и там он борется в различных тканях и органах с инфекциями. Более того, даже после того, как препарат был разведен 800 раз, его антибактериальная активность сохранялась. Позже высокую активность небольших доз препарата удалось объяснить благодаря определению механизма действия пенициллина. В случае применения антисептиков в больших концентрациях происходит разрушение стенок клеток бактерий. Пенициллин же проникает внутрь клетки, где блокирует образование биополимера, который необходим для роста клеточных стенок бактерий. Впрочем, довольно скоро Флемингу удалось установить, что если ввести слишком небольшую дозу пенициллина или вводить его на протяжении небольшого периода времени, то колонии бактерий, которым удалось выжить, приобретают устойчивость к тем дозам препарата, которые были эффективными ранее. А еще позже ученые определили, что у стафилококков имеется врожденная способность синтезировать фермент, который разрушает пенициллин. Это в определенной степени антидот. В настоящее время учеными достоверно установлено, что такого рода противостояния характерны не только в природных условиях между бактериями и грибами, но и между видами бактерий одного рода, поскольку в таком случае у них одинаковые субстрат и ниша, за которые необходимо бороться. Так, к примеру, в настоящее время различные виды стафилококков ведут борьбу за слизистую рта человека, в то же время вырабатывая антидоты и бактерицидные вещества. Впрочем, в этом противостоянии нет ни победителей, ни побежденных, поскольку за миллионы лет такая эволюционная борьба множества видов микроорганизмов человеческой микрофлоры обернулась балансом, ставшим бесценным приобретением для организма в целом. Численность каждого вида строго ограничена бактерицидной активность других видов бактерий, размерами занимаемой ниши и иммунитетом организма. В частности, популяция золотистого стафилококка, который вызывает гнойные инфекции, может достигать численности до 10 тысяч бактерий в мл среды без вреда для человеческого организма, а бактерия клебсиелла может присутствовать в кишечнике или на коже здорового человека, и не причинять вред человеку, если численность популяции будет составлять не более 10 тысяч бактерий на грамм фекалий. Ответить на вопрос, почему бактерии приобретают суперустойчивость к антибиотикам, поможет простой пример. В частности, можно представить себе, что в одном из небольших африканских государств происходит конфликт и одна из сторон получила оружие массового поражения. Если говорить о бактериях, то таким оружием массового поражения станут антибиотики, но не природного происхождения, а современные синтетические вещества, которые применяются в больших концентрациях. После применения таких антибиотиков, за счет видов бактерий, наиболее чувствительных к препарату, произойдет сокращение видового разнообразия. Ниши, которые в результате освободятся, довольно быстро будут заняты теми видами бактерий, которые обладают способностью синтезировать антидоты. Таким образом, эволюционное преимущество получат колонии тех бактерий, которые обладают устойчивостью к антибиотикам, и в результате внутри одного вида генетическое разнообразие уменьшится. Следовательно, применяя антибиотики, человек неосознанно создает положительные условия для наиболее устойчивых штаммов бактерий. Именно по этой причине беспорядочное применение антибиотиков зачастую приводит к развитию хронических заболеваний, спровоцированных увеличением патогенной микрофлоры. Человек, который является носителем такого рода бактерий, станет распространителем, передавая их своим родным, друзьям и знакомым, которые со временем начнут применять другие антибиотики. Таким образом, естественный отбор будет продолжаться, и бактерии, которые были устойчивы к одному виду антибиотиков, постепенно приобретут так называемую полирезистентность, то есть, устойчивость к различным видам антибиотиков. Именно такие патогены и получили название супербактерий. Помимо этого, многие виды бактерий обладают способностью обмениваться при помощи плазмиды (горизонтального переноса генетических элементов, находящихся вне хромосомы) обмениваться генами резистентности. Большая опасность заключается в том, что устойчивость к большому количеству видов антибиотиков приобретают бактерии-анаэробы, для которых характерным является бескислородный метаболизм. Если человек получит травму, такие бактерии могут попасть в кровь, вызвав тяжелое заражение. Именно это и произошло в описанном выше случае, когда бактерии проникли в костную ткань. В попытках спасти женщину, врачи применили почти полтора десятка антибиотиков, и еще дюжина препаратов была протестирована на выделенной из очага инфекции культуре, однако все эти антибиотики оказались неэффективными. Еще большая опасность состоит в том, что резистентность к антибиотикам могут приобретать разного рода патогенные бактерии, в частности, те, которые являются возбудителями сибирской язвы, сальмонеллеза и дизентерии. Даже несмотря на то, что все эти инфекции практически не распространены, возбудители их достаточно легко могут получить устойчивость к антибиотикам от бактерий нормальной микрофлоры за счет горизонтального переноса генов в плазмидах. Помимо того, довольно часто носителями опасных инфекций являются сельскохозяйственные животные. Необходимо отметить, что в данном случае резистентные бактерии в них распространены гораздо шире, нежели у людей. По словам специалистов, это объясняется тем, что в сельском хозяйстве антибиотики добавляют в корм для профилактики разного рода инфекций. Такие дозировки не приводят к уничтожению бактерий, а только не дают им размножаться. Но ведь еще Флеминг говорил о том, что использование малых доз антибиотиков приводит к снижению чувствительности к препаратам. Группой исследователей Гарварда был проведен очень интересный эксперимент, в котором было показано, как растет число устойчивых штаммов бактерий в случае постепенного увеличения концентрации антибиотиков от минимума до тысячекратной. Таким образом, антибиотики необходимо принимать только согласно предписания врачей и только в рекомендованных дозах. В то же время, необходимо помнить, что если бактерия, которая спровоцировала заболевание, уже обладает устойчивостью к антибиотику, то даже прием препарата в больших концентрациях на протяжении длительного времени может оказаться неэффективным. В таком случае необходимо определить в лабораторных условиях чувствительность бактерии к препарату. С этой целью вместе с посевом бактерий на питательную среду укладывают бумажные диски, которые пропитаны разными видами антибиотиков. При появлении вокруг дисков прозрачных колец можно говорить об отсутствии роста культуры бактерий. Иными словами – она чувствительна к данному антибиотику. В случае отсутствия прозрачного кольца – можно говорить о наличии резистентности. Благодаря результатам подобного исследования врачи уже смогут назначить один из антибиотиков узкого спектра действия, подавив патоген без ущерба для всей микрофлоры. Впрочем, подобного рода исследование стоит достаточно дорого и требует несколько дней. По этой причине, чтобы не терять время, врачи, как правило, не дожидаясь результатов исследования, назначают антибиотики. В большинстве случаев такой анализ не проводится вообще, и назначение антибиотика проводится без определения типа патогена. Таким образом, используется антибиотик широкого спектра действия. Это может иметь положительный эффект в некоторых случаях, однако в масштабах человечества подобная практика способствует тому, что проблема резистентности бактерий к антибиотикам лишь усугубляется. Если говорить о разработках и испытаниях новых видов антибиотиков, то необходимо отметить, что данный процесс очень трудоемкий и дорогостоящий. На его реализацию необходимо порядка миллиарда долларов инвестиций и более десяти лет. Кроме того, антибиотики в большинстве случаев применяют короткими курсами, иногда всего несколько раз за всю жизнь. Если говорить о жаропонижающих, обезболивающих или гормональных препаратах, то они используются гораздо чаще и шире. А это, в свою очередь, делает их более привлекательными для инвестиций. За счет этого новые антибиотики внедряются в практику все реже. Нежелание инвесторов вкладывать деньги в разработки новых препаратов вызваны еще и тем, что резистентность бактерий последних поколений все больше возрастает. В современной терапии врачи воздерживаются от широкого использования новых антибиотиков, применяя их лишь в крайних случаях в виде резерва. А это снижает спрос на эти препараты и лишает прибыли. Таким образом, получается, что резистентность бактерий, которая вызвана антибиотиками, тормозит разработки новых препаратов. Бесспорно, открытие и активное применение в терапии антибиотиков стало настоящим прорывом в медицине. В момента своего появления, благодаря антибиотикам удалось спасти миллионы человеческих жизней. Но в настоящее время необходимо искать новые решения, которые помогут снизить зависимость медицины от применения антибиотиков. No related links foundtainy.net |
г.Самара, ул. Димитрова 131 [email protected] |
 |