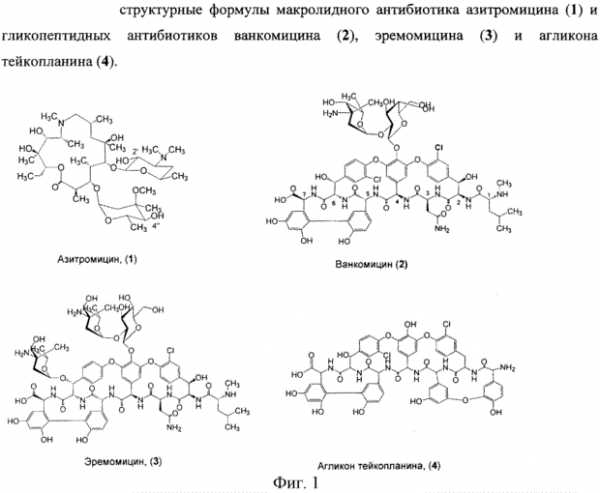
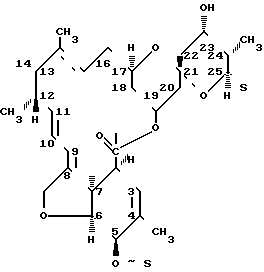
|
|
||||||||||
|
183. Клеточный цикл. Митоз. Митоз антибиотикМитоз | Info-Farm.RUМитоз, митозис (реже: кариокинез или непрямое деление) (от греч. Mitos — нить) — самый распространенный способ деления ядра, при котором клетка распределяет два идентичных набора хромосом, образованные в результате репликации ДНК, каждый к новому ядра. Биологическое значение митоза заключается в сохранении постоянства кариотипа многоклеточного организма и вида в целом во время бесполого размножения. Митоз — процесс деления ядра клетки на два дочерних ядра, каждое из которых имеет тот же набор генов, что и материнская клетка. История открытияВ 1874 И. Д. Чистяков описал ряд стадий (фаз) митоза в спорах плаунов, еще не ясно представляя себе их последовательность. Детальные исследования по морфологии митоза впервые были выполнены Э. Страсбургером на растениях (1876-1879). Митоз у животных впервые независимо описали Вальтер Флемминг, В. Шляйхер и Петр Перемежко Фазы митозаМитоз — лишь одна из частей клеточного цикла, но он достаточно сложен, чтобы в его составе, в свою очередь, было выделено четыре фазы: профаза, метафаза, анафаза и телофаза. Удвоение хромосом происходит еще в ходе интерфазы. В результате этого, в митоз хромосомы вступают уже удвоенными, напоминающими букву «X» (идентичные копии материнской хромосомы соединены друг с другом в области центромеры). Интерфаза это период жизни клетки между двумя делениями. Интерфаза делится на несколько периодов:
Продолжительность митоза в среднем 1-2 ч., Различна для разных видов клеток. Процесс зависит также и от условий внешней среды (температуры, светового режима и других показателей). Варианты митозаСледует отметить, что в разных группах живых организмов митоз протекает несколько по-разному. Описанный выше вариант митоза называется открытый ортомитоз (ядерная оболочка разрушается, веретено деления прямое, поскольку продукты деления клеточного центра размещены на противоположных полюсах ядра). Характерный для многоклеточных животных, многоклеточных растений и ряда простейших. В некоторых группах простейших продукты деления клеточного центра в анафазе не достигают противоположных сторон ядра, в результате чего микротрубочки веретена деления располагаются под углом, напоминая букву V (такой вариант деления получил название плевромитоз). В ряде случаев митоз происходит без разрушения ядерной оболочки (закрытый митоз). Наконец, клеточный центр может содержать центриоли (например, у животных) или не содержать их (например, у цветковых растений). Соответственно, различают также центриолярний и ацентриолярний митоз. Биологическое значение митозаБиологическое значение митоза заключается в строго одинаковом распределении редуплицированных хромосом между дочерними клетками, что обеспечивает образование генетически равноценных клеток и сохраняет преемственность в ряду клеточных поколений. Изображения по темеinfo-farm.ru Митоз | БиологияМитоз — это наиболее распространенный способ деления эукариотических клеток. При митозе геномы каждой из двух образовавшихся клеток идентичны между собой и совпадают с геномом исходной клетки. Митоз является последним и обычно самым коротким по времени этапом клеточного цикла. С его окончанием жизненный цикл клетки заканчивается и начинаются циклы двух новообразовавшихся. 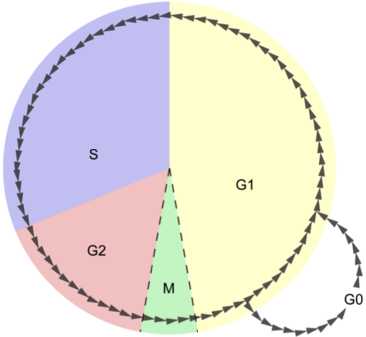 Диаграмма иллюстрирует длительность этапов клеточного цикла. Буквой M — обозначен митоз. Наибольшая скорость митоза наблюдается в зародышевых клетках, наименьшая — в тканях с высокой степенью дифференциации, если их клетки вообще делятся. Хотя митоз рассматривают независимо от интерфазы, состоящей из периодов G1, S и G2, подготовка к нему происходит именно в ней. Самым важным моментом является репликация ДНК, происходящая в синтетическом (S) периоде. После репликации каждая хромосома состоит уже из двух идентичных хроматид. Они сближены по всей своей длине и соединены в области центромеры хромосомы. В интерфазе хромосомы находятся в ядре и представляют собой клубок тонких очень длинных хроматиновых нитей, которые видны лишь под электронным микроскопом. В митозе выделяют ряд последовательных фаз, которые также могут называться стадиями или периодами. При классическом упрощенном варианте рассмотрения выделяют четыре фазы. Это профаза, метафаза, анафаза и телофаза. Часто выделяют больше фаз: прометафазу (между профазой и метафазой), препрофазу (характерна для растительных клеток, предшествует профазе). С митозом связан другой процесс – цитокинез, который протекает в основном в период телофазы. Можно сказать, что цитокинез является как бы составной частью телофазы, или оба процесса идут параллельно. Под цитокинезом понимают разделение цитоплазмы (но не ядра!) родительской клетки. Деление ядра называют кариокинезом, и оно предшествует цитокинезу. Однако при митозе как такового деления ядра не происходит, т. к. сначала распадается одно – родительское, потом образуются два новых – дочерних. Бывают случаи, когда кариокинез происходит, а цитокинез — нет. В таких случаях образуются многоядерные клетки. Длительность самого митоза и его фаз индивидуальна, зависит от типа клеток. Обычно профаза и метафаза является самыми длительными периодами. 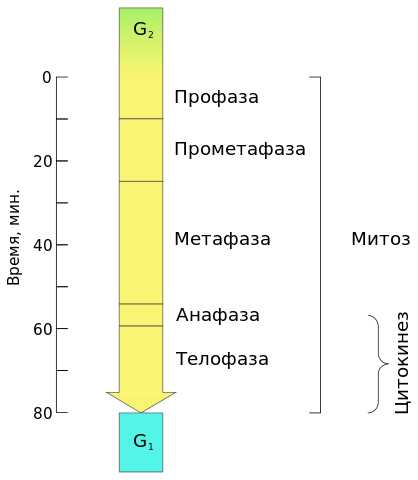 Средняя продолжительность митоза около двух часов. Животные клетки обычно делятся быстрее, чем клетки растений. При делении клеток эукариот обязательно образуется двухполюсное веретено деления, состоящее из микротрубочек и связанных с ними белков. Благодаря ему происходит равное распределение наследственного материала между дочерними клетками. Ниже будет дано описание процессов, которые происходят в клетке в различные фазы митоза. Переход в каждую следующую фазу контролируется в клетке специальными биохимическими контрольными точками, в которых «проверяется», все ли необходимые процессы были правильно завершены. В случае наличия ошибок деление может остановиться, а может — и нет. В последнем случае возникают аномальные клетки. Фазы митозаПрофазаВ профазе происходят следующие процессы (в основном параллельно):
Митоз начинается с укорочения хромосом. Составляющие их пары хроматид спирализуются, в результате чего хромосомы сильно укорачиваются и утолщаются. К концу профазы их можно увидеть в световой микроскоп. Ядрышки исчезают, т. к. образующие их части хромосом (ядрышковые организаторы) находятся уже в спирализованном виде, следовательно, неактивны и не взаимодействуют между собой. Кроме того распадаются ядрышковые белки. В клетках животных и низших растений центриоли клеточного центра расходятся по полюсам клетки и выступают центрами организации микротрубочек. Хотя у высших растений центриолей нет, микротрубочки также образуются. От каждого центра организации начинают расходиться короткие (астральные) микротрубочки. Формируется структура похожая на звезду. У растений она не образуется. Их полюса деления более широкие, микротрубочки выходят не из малой, а из относительно широкой области. Распад ядерной оболочки на мелкие вакуоли знаменует конец профазы. 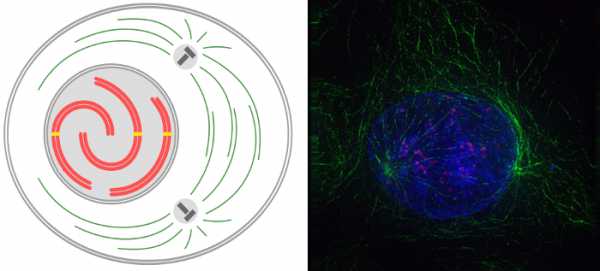 Справа на микрофотографии зеленым цветом подсвечены микротрубочки, синим — хромосомы, красным – центромеры хромосом. Также следует отметить, что в период профазы митоза происходи фрагментация ЭПС, она распадается на мелкие вакуоли; аппарат Гольджи распадается на отдельные диктиосомы. ПрометафазаКлючевые процессы прометафазы идут большей часть последовательно:
Хромосомы оказываются в цитоплазме, они беспорядочно двигаются. Оказавшись на полюсах, у них больше шансов скрепиться с плюс-концом микротрубочки. В конце концов нить прикрепляется к кинетохоре. 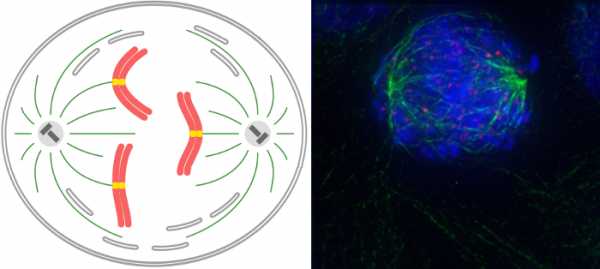 Такая кинетохорная микротрубочка начинает нарастать, чем отдаляют хромосому от полюса. В какой-то момент к кинетохоре сестринской хроматиды крепится другая микротрубочка, нарастающая с другого полюса деления. Она тоже начинает толкать хромосому, но уже в противоположном направлении. В результате хромосома становится на экваторе. Кинетохоры представляют собой белковые образования на центромерах хромосом. Каждая сестринская хроматида имеет свой кинетохор, который «созревает» в профазе. Кроме астральных и кинетохорных микротрубочек есть те, которые идут от одного полюса к другому, как бы распирают клетку в перпендикулярном экватору направлении. МетафазаПризнаком начала метафазы является расположение хромосом по экватору, образуется так называемая метафазная, или экваториальная, пластинка. В метафазу хорошо видны количество хромосом, их отличия и то, что они состоят из двух сестринских хроматид, соединенных в районе центромеры. Хромосомы удерживаются за счет сбалансированных сил натяжения микротрубочек разных полюсов. 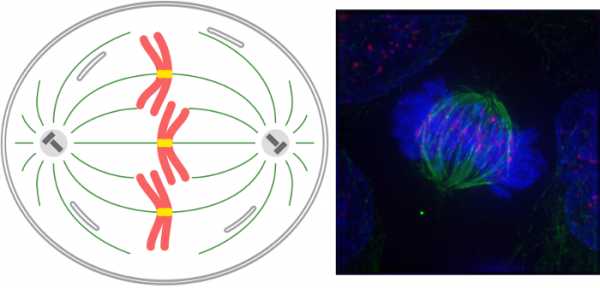 Анафаза
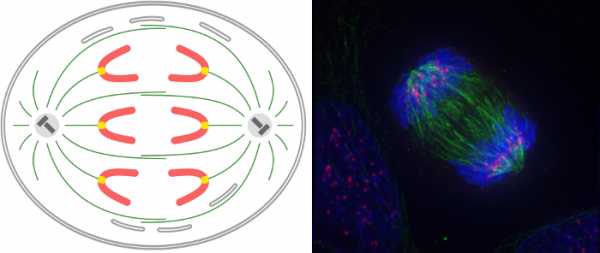 Анафаза самая короткая фаза митоза. Она начинается, когда центромеры хромосом разделяются на две части. В результате каждая хроматида становится самостоятельной хромосомой и оказывается прикреплена к микротрубочке одного полюса. Нити «тянут» хроматиды к противоположным полюсам. На самом деле микротрубочки разбираются (деполимеризуются), т. е. укорачиваются. В анафазе животных клеток двигаются не только дочерние хромосомы, но и сами полюса. За счет других микротрубочек они расталкиваются, астральные микротрубочки прикрепляются к мембранам и тоже «тянут». Телофаза
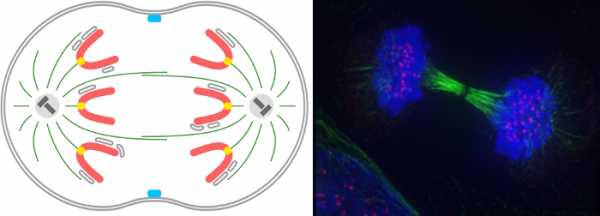 Телофаза начинается, когда хромосомы перестают двигаться, остановившись у полюсов. Они деспирализуются, становятся длинными и нитевидными. Микротрубочки веретена деления разрушаются от полюсов к экватору, т. е. со стороны своих минус-концов. Вокруг хромосом образуется ядерная оболочка путем слияния мембранных пузырьков, на которые в профазе распалось материнское ядро и ЭПС. На каждом полюсе формируется свое дочернее ядро. Поскольку хромосомы деспирализуются, ядрышковые организаторы становятся активными и появляются ядрышки. Возобновляется синтез РНК. Если на полюсах центриоли еще не парные, то около каждой достраивается парная ей. Таким образом на каждом полюсе воссоздается свой клеточный центр, который отойдет в дочернюю клетку. Обычно телофаза заканчивается разделением цитоплазмы, т. е. цитокинезом. ЦитокинезЦитокинез может начаться еще в анафазе. К началу цитокинеза клеточные органеллы распределяются относительно равномерно по полюсам. Разделение цитоплазмы растительных и животных клеток происходит по-разному. У животных клеток благодаря эластичности цитоплазматическая мембрана в экваториальной части клетки начинает впячиваться во внутрь. Образуется борозда, которая в конце концов смыкается. Другими словами, материнская клетка делится перешнуровкой. В растительных клетках в телофазе нити веретена не исчезают в области экватора. Они сдвигаются ближе к цитоплазматической мембране, их количество увеличивается, и они образуют фрагмопласт. Он состоит из коротких микротрубочек, микрофиламентов, частей ЭПС. Сюда перемещаются рибосомы, митохондрии, комплекс Гольджи. Пузырьки Гольджи и их содержимое на экваторе образуют срединную клеточную пластинку, клеточные стенки и мембрану дочерних клеток. Значение и функции митозаБлагодаря митозу обеспечивается генетическая стабильность: точное воспроизводство генетического материала в ряду поколений. Ядра новых клеток содержат столько же хромосом, сколько их содержала родительская клетка, и эти хромосомы являются точными копиями родительских (если, конечно, не возникли мутации). Другими словами, дочерние клетки генетически идентичны материнской. Однако митоз выполняет и ряд других немаловажных функций:
biology.su Цитогенетические эффекты бета-лактамных антибиотиков в стратегии их использования: ~ ^ А п 1 шоп т На правах рукописи ГУРОВА Оксана Петровна ЦИТОГЕНЕТИЧЕСКИЕ ЭФФЕКТЫ БЕТА-ЛАКТАМНЫХ АНТИБИОТИКОВ В СТРАТЕГИИ ИХ ИСПОЛЬЗОВАНИЯ 14.00.16 — патологическая физиология 14.00.25 — фармакология Автореферат диссертации на соискание ученой степени кандидата медицинских наук ОМСК 1997 Работа выполнена в Омской государственной медицинской академии Научный руководитель: академик МАН ВШ, доктор'медицинских наук, профессор Редыаш Ю.В, Официальные оппоненты; 1. Доктор медицинских наук, профессор Конван В Д. 2. Доктор медицинских наук, профессор Сысолятша Н.А. Ведущая организация ■ НИИ фармакологии ТНЦ РАМН Защита диссертации состоится "_"__1997 г. в_часов на заседании диссертационного совета К 084.30.02 Омской государственной медицинской акадешш Адрес: 644099, г. Омск, ул. Ленина, 12 С диссертацией можно ознакомиться в библиотеке Омской государственной медицинской акадгмш Автореферат разослан 10 " ЛСиЛ-_1997 Г. Ученый секретарь диссертационного совета ^Костерина Л Д. Общая характеристика 'работы Актуальность (¡pou.'1;;--.:).,!. Б свете концепции "экологии тела", предложенной Р.В.Петровым (Petrov R.V., ¡994), особую актуальность приобретает проблема ксено биотической нагрузки медикаментозными средствами на организм матери в период беременности. Известно, что из 5 ООО ООО, насчитываемых в настоящее время лекарственных препаратов и других ксенобиотиков, в опытах на беременных животных изучено действие лишь около 1 600 (Маркова И.В.; Шабалов Н.П., 1993). Поэтому, на наш взгляд, становится особенно очевидна необходимость детального анализа неблагоприятного действия лекарственных препаратов на человеческий зародыш и плод. Из многочисленных фармакологических средств, применяемых в период беременности, нередко прибегают к назначению ß-лактамных антибиотиков, в частности бензилпенициллина (БП) иклафорана (КФ). Это связано с возрастанием роли условно-патогенных грам-отрицательных бактерий в этиологии гнойно-воспалительных заболеваний в акушерстве, где, наряду с пенищшлинами, перспективным является применение цефа-лоспоринов, к которым эти микроорганизмы пока высоко чувствительны (Агасирская A.C. с соавт., 1984; Наваппш С.М., 1997). До последнего времени считалось, что ß-лактамные антибиотики, в связи с избирательностью их механизма действия, не способны оказывать неблагоприятные воздействия на клетки животных, высших растений, грибов и простейших (Егоров Н.С., !994). Длительный клинический опыт применения пени-циллинов и цефалоспоринов, свидетельствующий о видимой безопасности данных антибиотиков для плода, заставил забыть сообщения, предполагающие наличие связи между введением БП беременным и возникновением самопроизвольного аборта, преждевременных родов, случаями смерти новорожденных (Auby М.А., 1966; Hirch H.A., 1971; Ericson M., Catz С., 1973; Forrest J.M., 1976; Matsuda S., 1980), a также исследования, свидетельствующие о способности этого антибиотика вызывать пороки развитая конечностей и пальцев у животных (Кьюмерле Х.П., Брен-дел К., 1987; Barrons R. et al., 1992). Остались без внимания сообщения, указывающие на мутагенный эффект БП в тесте с использованием бактерий (Граблева Г.Н., 1975), на эмбриотоксичность в тестах in vitro (Кирющенков А.П., 1970), а также на способность различных доз этого препарата измененять процессы пролиферации и дифференцировки стволовых полипотентных клеток (Редькин Ю.В. с соавт., 1996). Однако исследования, проведенные в последнее десятилетие, с высокой степенью вероятности позволяют предположить возможность проникновения ß-лахтамных антибиотиков в клетки эмбриона и плода с последующим нарушением в них нормального течения митоза (Elak Е. et al„ 1972; Таисова A.C. с соавт., 1989). Результатом этого могут быть не только органические пороки развития, но и функциональные отклонения со стороны раз- личных систем гомеостаза, проявляющиеся на протяжении всей жгопп ребенка (Абрамченко В.В., 1994). Несмотря на актуальность проблемы, не существует универсального метода, позволяющего однозначно оценить способность препарата оказывать нежелательное действие на организм будущего потомства. Поэтому в настоящее время используют комплекс методов, выполненных на различных тест-системах (Золотарева Г.Н., 1990; Jelinck R. et al., 1981; Dayan A., 1991; Sasaki K. et al., 1991; Koch H. et al., 1993). В связи с изложенным целью исследования явилось обоснование возможности и неблагоприятных последствий цитогенетического влияния Р-лактамных антибиотиков на организм экспериментальных животных в период внутриутробного развития. Для достижения доставленной цели предстояло решить следующие задачи: 1. Изучить мутагенную активность различных доз БП и КФ в реко-меидовашялх ВОЗ тестах на индукцию хромосомных аберраций в клетках костного мозга половозрелых самцов-мышей и на выявление повреждения митотичеезеих хромосом в клетках корневой меристемы высших растений. 2. Изучить изменения митотического режима клеток костного мозга потомства крыс после введения различных доз БП н КФ животным в первый, второй и третий сроки беременности. 3. Оценить функциональную активность важнейших систем гомеостаза (иммунной и эритрона) у потомства крыс после воздействия БП и КФ в различные периоды антенатального развития. 4. Определить степень и характер корреляционной взаимосвязи показателей митотического режима клеток костного мозга, системы иммунитета и эритрона. Научная новизна работы. Впервые исследована возможность изменений митотического режима в животной и растительной клетках под влиянием БП и КФ. Установлено, что изученные антибиотики не только нарушают биосинтез основного полимера клеточной стенки бактерий, но и способны, проникая в активно пролиферирующие клетки животных и высших растений, изменять нормальное течение процессов деления. Это особенно актуально в свете возможного неблагоприятного действия БП и КФ в период антенатального развития. Кроме того, впервые экспериментально установлено, что введение различных доз БП и КФ крысам, независимо от срока беременности, приводит к повышению уровня патологических митозов (ПМ) в клетках костного мозга потомства с преимущественной стимуляцией их пролиферативной активности. Впервые изучены последствия изменений митотического режима клеток костного мозга потомства после антенатального воздействия различных доз р-лактамных антибиотиков. Установлены нарушения со стороны системы иммунитета и эрщрона, проявляющиеся развитием анемии, вследствие неэффективного эритропоэза и изменением функцио- нальной активности клеток системы иммунитета. Показано, что возможным потенциальным фактором патогенеза описанных патологических процессов в системе эритрона и длительного снижения активности клеток системы иммунитета является обнаруженное нарушение течения митоза в клетках костного мозга. Впервые с помощью математических приемов проведен анализ функциональных взаимодействий между исследуемыми показателями системы иммунитета, эритрона и мнтотического режима клеток костного мозга. Показано, что при увеличении вводимых доз БГ1 и КФ животным в различные сроки беременности происходит усложнение связей и усиление их крепости (особенно при инъецировании КФ), отражающее повышение степени интегрированноети различных функциональных систем организма и мобилизацию их внутренних ресурсов. *' Теоретическое и практическое значение. Полученные данные позволяют расширить представления о фармакодинамических аспектах действия р-лактамных антибиотиков. Подтверждено положение генетической токсикологии об отсутствии универсального метода, позволяющего оценить весь спектр возможных генетических повреждений в половых и соматических клетках. Установлено, что метод учета хромосомных аберраций в клетках костного мозга мышей не позволяет полностью исключить возможность неблагоприятного действия лекарств в отношении структур, ответственных за передачу наследственной информации в соматических клетках. Результаты настоящей работы свидетельствуют, что стратегия в отношении изучения неблагоприятного действия лекарств для будущего потомства должна основываться не только на определении морфологических изменений, но и на комплексном изучении возможных функциональных нарушений важнейших систем гомеостаза на тканевом и клеточном уровнях. Выяснение возможных механизмов повреждения системы иммунитета и эритрона имеет общебиологическое и медицинское значение, дополняя существующие знания о нарушениях клеточного деления при антенатальном воздействии лекарственных средств и, в частности, р-лактамных антибиотиков. Новые данные о фармакодинамических аспектах действия р-лактамных антибиотиков внедрены в учебный процесс на кафедре фармакологии при освоении раздела " Антибиотики", на кафедре акушерства и гинекологии при изучении темы " Экстрагенитальные заболевания и беременность", на кафедре поликлинической педиатрии при освоении разделов "Диспансерное наблюдение за новорожденными. Группы риска", "Диспансерное наблюдение за недоношенными". Положении диссертации выносимые на защиту. I. Бета - лактамные антибиотики (БП и КФ) при антенатальном воздействии изменяют митотический режим клеток костного мозга крыс, а также клеток корневой меристемы растительного тест - объекта. < 2. Изменения митотического режима клеток костного мозга крыс после антенатального воздействия различных доз БП и КФ приводят к развитию анемии и изменению функциональной активности клеток системы иммунитета. Апробация. Материалы доложены и обсуждены на XII Международном научном студенческом конгрессе (Стамбул, 1996), юбилейных конференциях (Томск, 1994; Барнаул. 1996), I съезде Российского научного общества фармакологов (Волгохрад, 1995), научной сессии, посвященной 75-летшо ОГМА (Омск, 1995), II Российском национальном конгрессе "Человек и лекарство" (Москва, 1995), III Российском национальном конгрессе "Человек и лекарство" (Москва, 1996), I Российском конгрессе по патофизиологии с международным участием (Москва, 1996), совместном заседании кафедр фармакологии и патофизиологии ОГМА (Омск, 1997). Публикации. По теме диссертации опубликовано 13 научных работ. Объем н структура работы. Диссертация изложена на 167 страницах машинописи, включая 31 таблицу и 5 рисунков. Работа состоит из введения, обзора литературы, главы "Материал и методы", 5-ти глав собственных исследований, заключения, выводов и списка литературы, который содержит 245 источников, из них 78 - зарубежных. Материал и методы исследования В эксперименте бьшо использовано 97 крыс линии Вистар массой 180,0 - 250,0 с датированной беременностью и 219 особей потомства массой 25,0 - 35,0 в возрасте 1 месяц. Животные были получены из Новосибирского института цитологии и генетики, прошли месячный карантин и содержались на обычном рационе вивария (Лоскутова З.Ф., 1983). Руководствуясь данными литературы и учитывая рекомендации по определению эмбриотоксической опасности лекарственных средств, (3-лактамные антибиотики изучали в трех дозах (Штенберг А.И. с соавт., 1983; Уйтгазы Э. с соавт., 1994). Препарат бензилпенициллина натриевой соли вводил!* в дозах: 25 000: 125 000; 1 000 000 ЕД/кг/сутки в течении 7 дней (175 000; 875 000; 7 000 000 ЕД/кг/курс). Дозы 25 000 и 125 000 ЕД/кг/ /сутки эквивалентны средним эффективным разовой и суточной дозам в клинике для человека (Кукес В.Г. с соавт., 1991). Препарат клафорана (цефотаксима натриевая соль) использовали в дозах: 30; 300; 600 мг/кг/сутки (210; 2 100; 4 200 мг/кт/курс). Доза 30 мг/кг/ /сутки соответствует средней эффективной суточной дозе для человека. Учитывая стремительное нарастание резистентности микроорганизмов к аитибиоппсам (Шабалов И.П., Маркова И.В., 1993) и, как следствие этого, постоянное повышение вводимых доз в клинике, в данной работе также было изучено действие р-лактамиых антибиотиков в дозах в 10 (БГ1 -1 000 000 ЕД/кг/сутки; КФ - 300 мг/кг/сутки) и в 20 раз (КФ - 600 мг/кг/сутки) выше средне"! эффективной суточной дозы для человека. Препараты непосредственно перед применением растворяли в стерильном физиологическом растворе и вводили однократно внутримышечно, ежедневно в первом, втором и третьем сроках беременности. Первый срок беременности, соответствующий периоду с 1 по 7 сутки после оплодотворения, как известно, включает в себя последовательность изменений эмбриона с момента возникновения зиготы и до внедрения бласто-цисты в слизистую матки, то есть до имплантации. Второй срок беременности (с 8 по 14 сутки) соответствует периоду органогенеза. В течение третьего срока (с 15 по 21 сутки), отражающего фетогенез, происходит интенсивный рост и развитие плода (Дыбан В.Ф. с соавт., 1975; Скосыре-ва A.M., Кпрмщенков A.IL, 1983). В качестве контроля использовали две группы животных. Первой в указанные сроки вводили плацебо - физиологический растаор в количестве, соответствующем объему вводимого антибиотика. Второй группой служили ннгакхные животные с датированной беременностью. Спустя месяц после рождения потомство крыс декагштировали под эфирным рауш-наркозом. С целью выявления цитогенетического действия БП и КФ определяли уровень ПМ в клетках костного мозга трубчатых костей животных (Аристов В.И. с соавт., 1981). В каждом препарате с помощью микроскопа МБИ-6 (* 640) просматривали 6 ООО - 8 ООО делящихся клеток, причем учитывали число клеток, находящихся на различных стадиях митоза. Частоту ПМ определяли отношением числа ПМ к общему числу клеток. Учитывали следующие разновидности ПМ, связанные с повреждением хромосом: фрагментация и пульверизация хромосом, хромосомные и хроматидные мосты, отставание хромосом в метакинезе и при расхождении к полюсам, микроядра; а также ПМ, связанные с повреждением ми-тотического аппарата: К-митоз, рассеивание хромосом в метафазе, многополюсный митоз, ассиметричный митоз, полая метафаза (Алов И.А., 1976). Пролиферагивную активность оценивали по величине- митотиче-ского индекса (МИ), который определяли отношением числа делящихся клеток к их общему числу (Рябов С.И., 1971). Для изучения состояния костномозгового кроветворения материал для исследования добывали из грудины по стандартной метод;псе (Алексеев Г.И., Глебович О.В., 1952). Подсчет форменных элементов костного мозга производили в 100 больших квадратах камеры Горяева. В приготовленных по методу Нохта-Максимова мазках подсчитывали мие-лограммы, идентифицируя 500-800 миелокариоцитов в различных участках препарата (Гольдберг Д.И. с соавт., 1989; Базарный М.А., 199,1). Показатели периферической крови экспериментальных крыс исследовали стандартными гематологическими методами (Кост Е.А., Смирнова Л.Г., 1976). Для характеристики процессов, происходящих в тимико-лимфати-ческой системе под действием р-лактамных антибиотиков, подсчитывали число ядросодержащих клеток в I мг ткани селезенки и тимуса (Фримель X., 1979) и в 1 л костного мозга. Также расчитывали относительную массу (отношение массы органа в мг к массе тела животного в г) селезенки и тимуса. Оценку фагоцитарной активности лейкоцитов проводили общепринятым способом со штаммом стафилококка 209Р (Меньшиков В.В., 1987). Степень интенсивности иммунного ответа на модельный антиген (эритроциты барана), оценивали по результатам реакции гемагглютина-ции, которую проводили по общепринятой методике. (Кэбот Е., Мейер М., 1968). Материалом дая исследования служила сыворотка крови крыс, взятая на пятые сутки после иммунизации взвесью эритроцитов барана (109/л), вводимой внутрибрюшинно. Результаты реакции выражали в log: обратного титра гемагглютининов. Для оценки мутагенного влияния бета-лактамных антибиотиков на генетические структуры клеток в условиях живого организма использован метод учета хромосомных аберраций в клетках костного мозга мышей. Исследования выполнены под руководством д.м.н., профессора А .Д. Дурнева в лаборатории фармакогенетики НИИ фармакологии РАМН. С этой целью были использованы 85 мышей самцов линии С57В1/6 массой 18-22 г, в возрасте 8-12 недель (питомник "Столбовая" РАМН). Препараты вводили внутрибрюшинно (БП в дозах 85 700; 857 ООО ЕД/кг; КФ - 28; 280 мг/кг). Дозы 85 700 ЕД/кг БП и 28 мг/кг КФ соответствуют средней эффективной суточной дозе для человека, а дозы 857 000 ЕД/кг БП и 280 мг/кг КФ - в 10 раз превышают ее. Экспозиция в организме животных составляла 1 сутки и 5 суток. Цитогенетические препараты готовили по Ford u Hamerton (1956). Цитогенетический анализ проводили по А.М.Малашенко с соавт. (1977). Учитывали ахроматические пробелы (гепы), одиночные и двойные фрагменты, перестройки обменного типа и клетки с множественными (более 5) повреждениями хромосом. С помощью широкопольного микроскопа Fisher scientific (10 х 100) в каждом опыте исследовали 500 метафаз (по 100 клеток от каждых 5 мышей). Для изучения цитогенстического действия ß-лактамных антибиотиков на клетки высших растений проведен анализ пролиферативной активности и учет ПМ на стадии ана-тслофазы в клелках корневой меристемы пшеницы (ВОЗ, 1989). Исследования выполнены под руководством к.с-х.н., доцента В.И. Нахаевой в лаборатории генетики каф. общей биологии Ом ГПУ. В качестве тест-культуры использовали семена яровой пшеницы сорта 0мская-20 урожая 1992 года, выращенного па полях СибНИИСХоза без внесения минеральных удобрений, пестицидов, гербицидов (ИЛ N 115 - 91). Предварительными трехлетними исследованиями, проведенными в лаборатории кафедры общей биологии ОмГПУ, было установлено, что данным сорт, обладающий высокой генотшической способностью к естественному мутированию, является достаточно отзыв- чиным и пригодным для выявления цптогенстических эффектов лекарственных средств (Тгоионниковл Е.Г., 1994). Для визуального изучения митотических хромосом использоналп клетки апикальной меристемы, так как данная тест-система является наиболее применимой для скрининга водорастворимых соединений (ВОЗ, 1989). Препарат БП исследовали в концентрациях 2; 4; 8; 40; 200 ЕД/мл в среде проращивания, что соответствует концентрациям, определяемым в плазме крови больных при внутримышечном введении 200 000; 400 000; 800 000; 4 000 000; 20 ООО 000 ЕД антибиотика (Кукес В.Г. с соавт., 1991). Препарат КФ использовали в концентрациях 0,05; 0,15; 0,30; 0,60; 1,20 мг/\ш в среде проращивания. Концентрация 0,15 мг/мл примерно соответствует содержанию препарата в плазме крови больных при внутримышечном введении срсднстерапевтической дозы антибиотика (Кукес В.Г. с соавт., 1991). Семена пшеницы выдерживали в растворе, содержащем исследуемый антибиотик в названных концентрациях (опыт), или в дистиллированной воде (контроль). Длительность экспозиции для БП составила 24; 48 и 72 часа. Раствор БП каждые сутки меняли на свежеприготовленный. Поскольку не было установлено существенного влияния экспозиции на степень цитогенетического влияния БП, КФ изучали только при суточной экспозиции. Количество зерен в каждой опытной и контрольной группах составляло 100 штук. После обработки семена промывали в течение 20 мин. проточной водой и проращивали в чашках Петри при температуре 24°С по стандартной методике. Непосредственно перед микроскопирова-ннем готовили давленные препараты по общепринятой методике (Майсурян H.A., 1960). С помощью микроскопа МБИ-6 * 640 проводили учет числа клеток на разных стадиях митоза. Для оценки цитогенетических эффектов исследуемых лекарственных препаратов изучали в каждой опытной и контрольной группах 1 000 клеток, находящихся в ана- и телофазе. Частоту ПМ определяли отношением патологических ана-телофаз к их общему числу и выражали в процентах. Учитывали следующие разновидности ПМ, связанные с повреждением хромосом: фрагментация, хромосомные мосты, отставание при расхождении к полюсам. Оценку влияния антибиотиков на пролиферативную активность проростков пшеницы проводили по показателю МИ. Для установления причинно-следственных взаимоотношений между изучаемыми признаками, характеризующими митотический режим клеток костного мозга и состояние системы иммунитета и эритрона, применяли корреляционный анализ (Лакин Г.В., 1980), а также одну из его разновидностей - метод корреляционных плеяд (Терентьев Н.П., 1960). Предварительно, для изучаемых признаков высчитывали попарно корреляционный показатель (г). При обработке экспериментальных данных исследовали форму распределения значений лабораторных показателей с последующей оценкой степени их вариабельности (Гублер Е.В., 1978). Достоверность различий определяли с помощью критерия Стьюдента (Лакин Г.В., 1980). Результаты исследования н их обсуждение Одним из проблемных положений генетической токсикологии является отсутствие универсального метода, позволяющего оценить весь спектр возможных генетических повреждений в половых и соматических клетках (Фонштейн Д.М., Ревазова Ю.А.. 1976). В нашей работе был использован тест на индукцию хромосомных аберраций в клетках костного мозга млекопитающих (Методические рекомендации фармакологического комитета МЗ СССР, 1990), который не дал положительного ответа о наличии мутагенного эффекта у бензилпенициллина и клафорана. Вместе с тем, некоторые авторы (Граблева Г.Н., 1975) обнаруживали мутагенное действие БП в тестах с использованием бактерий. Таким образом, несмотря на авторитетные свидетельства того, что наиболее адекватным тестом, позволяющим прогнозировать канцерогенную опасность химических соединений, является тест по учету хромосомных аберраций в клетках костного мозга млекопитающих (Radmen М., 1988). можно предположить, что этот метод не позволяет полностью исключить возможность неблагоприятного действия лекарств в отношении структур, ответственных за передачу наследственной информации. Поэтому нами был проведен эксперимент по определению повреждений митотических хромосом в клетках еще одного тест-объекта, а именно: корневой меристемы высших растений (ВОЗ, 1989). Установлено, что БП и КФ во всех изученных концентрациях и сроках экспозиции изменяли митотический режим клеток корневой меристемы пшеницы путем влияния на индукцию ПМ и проли-феративную активность (табл. 1; 2). При этом БП оказывал преимущественно митогенное действие (МИ возрастал на 0,56-0,83 % по сравнению с контролем, р < 0,05), а КФ оказывал митостатическое влияние на про-лиферативные процессы клеток корневой меристемы (МИ снижался на 1,2- 3,37 % по сравнению с контролем, р < 0,001) (табл.2). Характер патологии митоза, связанной с повреждением хромосом в ана- и телофазе (мосты, фрагменты, отставание хромосом и сочетанные нарушения), свидетельствовал о том, что БП и КФ вызывали либо повреждение молекулы ДНК, либо хромосомальных белков, а, возможно, и обоих компонентов хромосомы в различных ее участках. При этом следует подчеркнуть, что КФ в меньшей степени (в 2 раза по сравнению с контролем) повышал частоту ПМ, чем БП, который увеличивал этот показатель в 3 раза. Это могло быть связано с тем, что последний, стимулируя пролиферацию клеток указанной тест-культуры, ускорял клеточный цикл и тем самым повышал вероятность "ошибок" в проигссе удвоения генетического материала. Однако не исключено, что повышение пролиферативнои активности - это компенсаторная реакция в ответ на патологию митоза, веду- и щую к гибели клеток. Поскольку, согласно полученным нами данным, КФ, в отличие от БГ1, вызывал повреждение не только хромосом, но и митотичсского аппарата клетки, то есть более "грубую" патологию митоза, можно предположить,'что в результате этого значительная часть клеток гибла на различных стадиях деления. Поэтому мы регистрировали снижение как общего количества клеток, находящихся в митозе (снижение показателя МИ), так и количества клеток с патологией митоза (табл.1). Иными словами, мы полагаем, что механизм индукции ПМ клафораном отличается от такового у БП наличием большего числа "точек приложения", что может приводить либо к гибели клеток в процессе митоза, либо к накоплению и сохранению грубой сочетаиной патологии на завершающих стадиях деления. 1 Таблица 1 Влияние БП «а митотический ре;;,-им клеток корневой _меристемы проростков пшеницы (М ± т) Экспозиция, час Концентрация, ЕД/мл Частота ПМ, % МИ, % 2 74.30 ± 1,83** 99,16 ± 0,17 4 64,40 ± 0,78** 99,88 ± 0,07* 24 8 75,80 ¿0,84** 99,73 ±0,11* 40 80,20 ±0,86** 100,00 ± 0* 200 71,40 = 0,81** 99,77 ±0,10* 0 26,60 ±0,51 99,17 ±0,21 Таблица 2 Влишше КФ на митотический режим клеток корневой меристемы проростков пшеницы (М ± га) Экспозиция, час. Концентрация, мг/мл Частота ПМ, % МИ, % 0,05 73,90 ± 1,39** 95,42 ±0,38* 0,15 68,10 ± 1,47** 93,65 ±0,43** 24 0,30 69,80 ± 1,45** 95,06 ± 0,34* 0,60 70,80 ± 1,44** 95,80 ±0,27* 1,20 70,40 ± 1,44** 95,82 ±0,32* 1 0 1 34,10 ± 1,50 97,02 ± 0,25 Примечание; * - р < 0,05; ** - р < 0,01 Таким образом, полученные данные свидетельствуют о том, что изученные Р-лактамные антибиотики, в частности БП и КФ, способны проникать в активно пролиферирующие клетки высших растений и изменять скорость вступления их в митоз и нормальное течение процессов деления. Это, с одной стороны, позволяет предположить, что механизм антибактериального действия р-лактамных антибиотиков не ограничивается только влиянием на биосинтез клеточной стенки. Однако с другой стороны, закономерно возникает вопрос о том, проникают ли БП и КФ в клетки животных, и к каким последствиям для целостного организма может привести вмешательство этих антибиотиков в процессы деления отдельных клеток? Таблица 3 Митогический режим клеток костного мозга потомства крыс после антенатального воздействия БП и КФ в различных дозах (М ± т) Срок беременности Доза БП, ЕД/кг ПМ,%> МИ, %о Доза КФ, мг/кг ГШ, %о МИ,«. I 25000 2,21 ± 0,22 5,42 ±0,94 30 10,08 ±! ,77*** 14,75 ±2,54** 125000 1,09 ±0,28** 7,88 ±1,67 300 7,80 ±0,82*** 11,20 ±1,07*** юооооо- 4,32 ±0,60* 7,93± 1,10 600 13,07 ±1,76*** 19,67 ±3,04*** II 25000 4.51± 0,35 10,41 ±1,09 30 12,07 ±1,02*** ¡7,66 ±1,62 125000 3,20 ±0,37 8,18 ±1,02* 300 12,85 ±1,22*** 19,95 ±2,35 ЮООООО 5,13 ± 1,38** 23,S7±2,12 600 8,20 ±0,74*** 12,61 ± 1,11 III 25000 3,45 ±0,51 7,48 ±1,37 30 8,50 ±1,93** 15,72 ± 1,96*** 125000 3,32±0,44 8,60 ±0,64** 300' 8,70 ±0,99*** 13,16 ±1,10*** ЮООООО 11,60 ± 1,20*** 19,26 ± 1,45*** 600 9,10 ±0,73*** 16,52±1,33*** I ФР'* 2,65 ±0,45 5,94 ± 0,82 ФР 2,65 ±0,45 5,94 ±0,82 II 3,75 ±1,20 16,19±3,62* 3,75 ±1,20 16,19±3,62* III 2,41 ±0,29 6,28 ± 0,69 2,41 ±0,29 6,28 ±0,69 0 (иягактные) 2,61 ±0,43 6,42 ±1,03 0 2,61 ±0,43 6,42 ±1,03 Примечание: *-р < 0,05; **-!>< 0,01; *** - р < 0,001 В результате изучения последствий антенатального воздействия различных доз БП и КФ установлено, что инъецирование исследуемых антибиотиков экспериментальным животным в различные сроки беременности вызывает у потомства изменения митотичсского режима про-лиферирующнх клеток костного мозга (табл. 3). Эти изменения регистрировали у крысят даже спустя ■.'-'чц после рождения, что примерно соот- ветствуст серйдипс периода полового созревания. При этом названные антибиотики оказывали преимущественно мнтогенное действие, в большей степени выраженное у КФ, который повышал МИ в среднем в 2-3 раза (р< 0,001). Полученные результаты согласуются с данными литературы о влиянии изучаемых антибиотиков на пролнферативные процессы в растущих тканях (Климов А.И., Зазеров Е.Г., 1960; Александров Н.П., Екимовский А.П., 1964; Капгаш К.П., Караев З.О., 1984). Оба антибиотика при антенатальном воздействии повышали уровень ГШ в клетках костного мозга потомства, причем КФ в большей степени, чем БП (КФ - в 5-6 раз, БП - в 2-3 раза, р < 0,01; р < 0,001). При воздействии БП во все периоды внутриутробного развития и,КФ в период фетогенеза (третий срок) отмечали четкую дозозависнмость, заключающуюся в том, что при увеличении вводимой дозы антибиотика частота ПМ возрастала и характеризовалась патологией, связанной с повреждением хромосом и митотического аппарата. Так, БП в дозе 125 000 ЕД/кг/сутки (875 000 ЕД/кг/курс) не вызывал повышение уровня ПМ в клетках костного мозга, тогда как при использовании дозы 1 000 000 ЕД/кг/сутки (7 000 000 ЕД/кг/курс) отмечен рост ПМ в 2-5 раз (р < 0,001), при этом частота повреждения митотического аппарата возрастала, в среднем, в 2-3 раза (р < 0,001). При воздействии КФ в первом и втором сроках антенатального развития четкого дозозависимого эффекта не выявлено, однако при использовании названного препарата в дозах 300 мг/кг/сутки (2 100 иг/кг/курс) и 600 мг/кг/сутки (4 200 мг/кг/курс) регистрировали максимальное увеличение числа патологических митозов по сравнению с контролем (в 3 и в 5 раз соответственно, р < 0,001). Вышеперечисленные данные о влиянии БП и КФ на митотический режим клеток костного мозга потомства крыс и соматических клеток высших растений свидетельствуют о том, что изучаемые антибиотики проникают внутрь клеток активно пролиферирующих тканей 'млекопитающих и высших растений. Это согласуются с данными литературы о возможности трансмембранного проникновения ß-лактамных антибиотиков через бислойные липидные мембраны бактериальных и растительных фосфолипидов (Таисова A.C. с соавт., 1989). Поскольку эта модель универсальна (фосфолипиды играют основную структурную роль в ли-пидных биослоях клеточных мембран как бактериальных, так и животных клеток), не удивительно, что наши исследования подтверждают цитируемые данные не только в отношении растительных, но и животных клеток. Кроме того, результаты наших исследований, а также данные литературы (Александров Н.П., Екимовский А.П., 1964) о влиянии БП я КФ на процессы пролиферации клеток высших растений и животных свидетельствуют о том, что названные антибиотики могут нарушать потенциальную возможность отдельно взятой клетки к росту и размножению. Это, в свою очередь, может быт? связано с нарушением синтеза ДНК и * (или) неспособностью клетки провести подготовительный период митоза и завершить его продукцией полноценных дочерних клеток (Рябов С.И., Шостка Г.Д., 1973). Очевидно поэтому мы обнаружили значительное (в 45 раз по сравнению с контролем, р < 0,001) повышение уровня ПМ в клетках костного мозга крысят, подвергшихся антенатальному воздействию изучаемых антибиотиков. При этом отмечено 2-х - 3-х 1фатное повышение МИ, коррелирующее с ростом числа ПМ (г > 0,9; р < 0,05), что согласуется с данными литературы о тесной взаимосвязи изменений про-лиферативной способности ткани и нарушений механизмов, ответственных за сохранность генетической информации (Алов И.А., 1972). По нашему мнению, повышение пролиферативной активности является компенсаторной реакцией в ответ на снижение (вследствие неблагоприятного действия антибиотиков) количества функционально полноценных зрелых клеток. Последнее предположение было проверено в ходе изучения некоторых морфологических и функциональных показателей важнейших систем гомеостаза - иммунной и эритрона (табл. 4; 5; 6). Установлено, что антенатальное воздействие БП и КФ в изучаемых дозах, повышая уровень ПМ, нарушает равновесное состояние популяции клеток костного мозга и, в частности, системы эритрона у потомства (табл. 4). Так, при введении беременным животным БП в дозе 25 000 ЕД/кг/суткн (175 000 ЕД/кг/курс) в третьем сроке, 125 000 ЕД/кг/сутки (S75 000 ЕД/кг/курс) в первом и третьем, КФ в дозе 30 мг/кг/сутки (210 мг/кг/курс) во втором и третьем, а БП в дозе 1 000 000 ЕД/кг/суткн (7000000 ЕД/кг/курс) и КФ в дозах 300 и 600 мг/кг/сутки (2 100 и 4 200 мг/кг/курс), независимо от срока, у потомства в костном мозге отмечалось 1,5-2-х кратное уменьшение количества эритрокариоцитов по сравнению с контрольной группой (р < 0,001). Угнетение эршроидного ростка костномозгового кроветворения происходило преимущественно за счет пула созревающих клеток, о чем свидетельствовало достоверное (р < 0,01; р < 0,001) снижение, в 1,5-2 раза по сравнению с контрольной группой, числа оксифнльных нормоцитов (при воздействии БП в дозах 25 000; 1 000 000 ЕД/кг/сутки.и КФ в дозах 30; 300 мг/кг/сутки в третьем сроке), а также полихроматофильных нормоцитов при воздействии БП в вышеуказанном сроке в дозах 25 000 п 1 000 000 ЕД/кг/сутки (в 1,5 раза по сравнению с контролем, р < 0,05) (табл. 5). Последнее приводило к развитию анемии на фоне неэффективного эритропоэза, характеризующегося резким возрастанием костномозгового гемолиза. Компенсаторной реакцией на развитие анемий являлось повышение пролиферативной активности, в том числе и зритроидного ростка костномозгового кроветворения, о чем косвенно свидетельствовало наличие тесной связи между обидам количеством миелокариоцитов и эритроид-ным ростком костного мозга (г > 0,7). Развитие анемии на фоне повышенного уровня пролиферативной активности можно объяснить гибелью клеток, в том числе эритроидлых, на различных стадиях созревания. По Таблица 4 Показатели эритропоэза у потомства крыс после антенатального воздействия БП и КФ в различных дозах (М ± ш) и й с ° О 5 ¡и Р. и ю Доза БП, ЕД/хг Периферическая кровь Костный мозг Доза КФ, | мг/кг Периферическая кровь Костный мозг эритроциты, 10'2/я гемоглобин, г/л эршрокарио-щпы, 10'/л эритроциты, 10п/л гемоглобин, г/л эритрокарпо-циты, Ю6/л 1 25000 5,94 ±0,13*** 126,80 ± 6,32* 55,46 ± 4,89 30 6,29 ± 0,32 143,00 ± 3,70 54,35 ± 4,66 II 4,28 ±0,38*** 75,80 ± 5,14*** 44,13 ±3,05 6,21 ± 0,32* 132,94 ±4,14* 18,34 ± 2,05**+ III 5,16 ±0,63*** 96,83 ± 10,74*** 32,14 ± 1,98*** 5,93 ± 0,37 131,33 ±7,84 38,23 ± 2,26 I 125000 5,16 ±0,35*** 113,38 ±3,50*** 24,03 ± 2,81*** 300 6,22 ± 0,36 132,29 ± 3,12** 23,57 ± 2,96*** И 4,44 ± 0,49*** 77,17 ± 7,79*** 48,81 ± 3,05 6,73 ±0,31 141,44 ±4,65 24,55 ± 2,28*** ЛИ 4,63 ±0,19*** 86,50 ± 4,06*** 28,51 ± 1,06*** 7,32 ± 0,21 145,40 ± 3,22 30,75 ± 2,09*** I 1000000 7,23 ±0,11 150,00 ±2,89 20,50 ± 2,70*** 600 4,72 ± 0,53*** 118,13 ±7,91* 23,30 ± 2,81**+ И 4,81 ± 0,24*** 109,63 ± 3,74*** 12,90 ± 1,65*** 5,84 ± 0,46* 131,43 ± 3,17*** 22,85 ± 2,09*** III 5,14 + 0,38** 110,80 + 3,09*** 33,81 ± 1,17** 4,99 ± 0,29*** 125,50 ±4,59*** 14,52 ± 1,96*** I ФР 6,89 ±0,30 143,50 ± 2,70 49,09 ± 3,80 ФР 6,89 ± 0,30 143,50 ± 2,70 49,09 ± 3,80 1 1 II 7,17 ±0,35 144,43 ± 2,65 44,77 ± 3,86 7,17 ±0,35 144,43 ± 2,65 , 44,77 ± 3,86 ! III 6,78 ± 0,40 142,80 ± 3,50 39,27 ±2,14 6,78 ± 0,40 142,80 ± 3,50 39,27 ± 2,14 | 0 (интактные) 6,24 ± 0,33 147,50 ± 4,64 48,77 ± 3,49 0 6,24 ±0,33 147,50 ± 4,64 48,77 ± 3,49 Примечание: *-р<0,05; ** -р < 0,01; *** -р < 0,001 данным ряда авторов (Рябов С.И., Шоетка Г.Д., 1973), деструкция эритроидных предшественников возможна на любой стадии зрелости, однако на этапе денуклеацни клеток или выброса их в периферическую кровь указанный процесс наиболее выражен. В нашем эксперименте скорость эритроидной деструкции не соот-ветстввала скорости пролиферации ядерных эритроидных клеток, что объясняется, по-видимому, тем, что пролиферация присуща молодым эритро-идным предшественникам, в которых синтез гемоглобина и белков стромы выражен слабо (Рябов С.И., 1971). Деструкция элементов эритропоэза наступала на более поздних этапах формирования эритроидных клеток (уменьшение пула созревающих клеток в среднем в 1,5-2 раза по сравнению с контролем, р < 0,01) (табл. 5). Учитывая повышение уровня ПМ в клетках костного мозга после антенатального воздействия БП и КФ, можно предположить, что в костном мозге в подавляющем большинстве случаев разрушаются маложизнеспособные эритровдные клетки, находящиеся на стадии денуклеации. Таблица 5 Изменения количества ядерных эритроидных предшественников в костном мозге потомства после введения различных доз БП и КФ крысам в третьем сроке беременности (М ± ш) Препарат, доза Отделы эритрона Пул пролиферирующих. и созревающих клеток, 10% Пул созревающих клеток, 10«/л эрнтро-бласш пронормо-бласга Ёазофильные нормоциты поянхромато-фильные НОРМОПИТЫ оксяфияьные нормощгш КФ, 30 мг/кг 0,98 ± 0,29 1,20 ±0,29 14,50 ± 1,45 15,99 ± 1,49 2,56 ± 0,35*** КФ, 300 мг/кг 0,29 ±0,15 1,44 ±0,38 9,17 ± 1,15 16,23 ± 1,50 3,62 ± 0,42** БП, 25 000 ЕДОсг 0,31 ±0,15 1,18 ±0,27 10,75 ± 1,18 13,62 ± 1,48* 3,14 ±0,40*** БП, 1 000 000 ЕД/кг 0,39 ±0,17 1,26 ±0,18 11,58 ± 1,20 14,50 ± 1,51* 3,04 ± 0,50** ФР 0,35 ±0,16 1,25 ± 0,36 11,68 ± 1,27 20,59 ± 1,69 5,39 ± 0,65 Примечание: *-р <0,05;**-р < 0,01; *** -р < 0,001. Таким образом, введение БП и КФ животным в период беременности, повышая уровень ПМ, способно нарушать равновесное состояние популяции клеток костного мозга и, в частности, системы эритрона у потомства и приводить к развитию анемии на фоне неэффективного эритропоэза или, возможно, к снижению функциональной активности эритроцитов, решающая роль которых состоит в обеспечении полноценной ок-сигенации тканей и создании условий для роста и развития потомства. Согласно данным литературы, анемия может быть фактором развития вторичного иммунодефицита, что может проявляться, в частности, снижением функциональной активности нешрофилов периферической крови (Китов М.Г., Ханзеева P.M., 1987). Это положение нашло подтверждение в нашей работе. Полученный экспериментальный материал свидетельствует о том, что антенатальное воздействие изучаемых антибиотиков, в результате нарушения деления клеток, сопровождается количественно-функциональными изменениями не только со стороны эритрона, но и со стороны системы иммунитета у потомства. Это проявляется ингибирующим действием изучаемых доз БП и КФ на фагоцитарную активность нейтрофи-лов и антителообразующую функцию лимфоцитов (табл. 6). Так, при . воздействии БП в дозах 25 ООО и 125 ООО ЕД/кг/сутки (175 ООО и 875 ООО ЕД/кг/курс) во втором и третьем сроках; БП в дозе 1 ООО ООО ЕД/кг/сутки (7 ООО ООО ЕД/кг/курс) и КФ во всех изученных дозах, независимо от срока антенатального развития, отмечалось 1,5-2-х кратное (р <0,01) снижение фагоцитарного числа (ФЧзо) и фагоцитарного индекса (ФИзо) по сравнению с контрольной группой. В 1,5-2 раза (р < 0,01) был снижен титр гемагглютининов при воздействии БП в дозе 1 ООО ООО ЕД/кг/сутки (7 ООО ООО ЕД/кг/курс) во все периоды антенатального развития и в 2,5-8 раз (р < 0,01) по сравнению с контролем - при воздействии КФ в изученных дозах в первом и третьем сроках. Исключение составляло стимулирующее влияние среднетерапевтических доз БП (25 ООО и 125 ООО ЕД/кг/сутки), вводимых в предимгагантационный период (ФИзо возрастал на 4,5-6 %, а титр гемагглютининов - в 1,6-1,9 раз по сравнению с контролем, р < 0,01), что согласуется с данными литературы о стимулирующем влиянии низких доз БП на факторы гуморального иммунитета (Никитин А.В., 1997). Кроме того, обращает на себя внимание тот факт, что при длительном воздействииии БП и КФ в антенатальном периоде (в течение семи дней) у потомства крыс, даже спустя месяц после рождения, наблюдалось угнетение иммуногенеза. Возможно это связано с тем, что часть лимфоидных костно-мозговых клеток-предшественников мигрирует в центральные и периферические органы иммуногенеза, где они проходят дальнейшую дафференцировку, а часть остается в костном мозге (Берист Ф.М., 1971). В этой связи, время, через которое происходит реализация генетического дефекта, приобретенного в результате ПМ, очень широко варьирует (от нескольких часов до нескольких лет). В том случае, если клетки приобрели дефицитный геном на более ранних этапах пролиферации, время, через которое сказывается этот дефект, удлиняется (Петров Р.В., 1983). Следует обратить внимание на тот факт, что у млекопитающих клсткн-предшествениики впервые появляются в эмбриональном периоде в кровяных островках желточного мешка. Они генерируют из стаоловых клеток, затем заселяют печень плода, а позднее и костный мозг (Йегер Л., Тяб.тггна 6 Показатели фагоцитарной активности нсйтрофмлов и шгтителообразующей функции лимфоцитов периферический крови потомства крыс после антенатального воздействия БП и КФ п различных дозах (М ± и) Срок беременности Доза БП, ЕДЛсг Изучаемые показатели Титр гемаггдютн- ЯШ05, - 1о£2 Доза КФ, мг/кг Изучаемые показатели Титр гемаггшоти- Ш1ИОВ, -10Е2 ФЧ !0 ФИзо.% ФЧ зо ФИзо,% 1 25000 4,72 ± 1,02 • 97,60 ±1,17*** 5,20 ±0,33** 30 1,83 ±0,25*** 57,00 ±3,01*** 0,25 ±0,09*** 125000 5,47 ± 0,46 96,25 ± 0,86*** 4,33 ±0,52*** 300 1,94 ±0,26*** 63,00 ± 4,58*** 1,00 ±0,23** 1000000 2,91 ±0,29*** 59,00 ±2,18*** 1,50 ±0,10** 600 2,67 ±0,35*** 55,30 ±4,46*** 0,33 ±0,10** II 25000 4,68 ± 0,4 [ 84,78 ± 2,48 2,81 ±0,45 30 1,60 ±0,10*** 55,60 ± 6,31** 2,79 ±0,26 125000 4,30 ± 0,31*** 92,30 ±0,61 2,17 ±0,31 300 1,56 ±0,16*** 52,00 ±4,62*** 2,60 ±0,87 1000000 2,07 ± 0,55*** 55,75 ±4,28** 1,60 ±0,28* 600 1,53 ±0,20*** 54,70 ± 4,67** 2,29 ±0,29 I Ш 25000 4,38*0,32'* 86,70 ±2,58 2,67 ± 0,33 30 3,11 ±0,45*** 58,00 ±8,00*** 2,58 ±0,33 125000 4,65 ±0,12** 86,80 ± 2,87 2,43 ± 0,53 300 1,72 ±0,18*** 58,00 х !,85*** 0,90 ±0,21* 1000000 2,61 ±0,32*** 57,25 ± 2,64*** 1,58 ±0,17*** 600 2,21 ±0,30*** 59,30 ±2,81*** 0,80 ±0,22** I ФР 5,44 ± 0,13 91,71 ±1,46 2,71 ±0,57 ФР 5,44 ±0,13 91,71 ± 1.46 2,71 ±0,57 II 5,20 ±0,15 81,50 ±8,66 2,68 ±0,46 5,20 ±0,15 81,50 ±8,66 2,68 ±0,46 III 5,16 ±0,18 88,00 ± 1,10 2,17 ±0,36 5,16 ±0,18 88,00 ± 1,10 2,17 ±0,36 0 (интактные) 4,54 ±0,64 88,50 ± 2,57 2,57 ± 0,57 • 0 4,54 ±0,64 88,50 ± 2,57 2,57 ± 0.57 Примечание: * - р < 0,05; ** -р < 0,01; *** - р < 0,001 1990). Перечисленные этапы онтогенеза лимфоцитов в организме плода совершаются во втором и третьем сроках антенатального развития. Таким образом, обнаруженное стимулирующее влияние БП на клетки системы иммунитета потомства, возникшее после антенатального воздействия вышеуказанных доз (25 ООО и 125 ООО ЕД/кг/сутки) препарата в первом сроке, развилось, по-видимому, в результате опосредованного влияния БП • через организм матери, а не прямого действия на закладывающуюся систему иммунитета плода. Снижение показателей фагоцитоза, обнаруженное нами, вероятно, обусловлено патологией митоза, связанной с повреждением митотическо-го аппарата клетки, состоящего из мнкротрубочек, микрофиламентов и центриолей. Эти структуры, помимо обеспечения движения хромосом в митозе, участвуют в выполнении еще целого ряда функций: секреции, адгезии, хемотаксиса (Аспиз М.Е., 1976). В нейтрофилах они задействованы в фагоцитозе, обеспечивая освобождение гидролазы из лизосом, движение гранул внутри клетки и слияние их с фагосомой (Чернух A.M., 1979). По-видимому, антенатальное воздействие БП и КФ, повышая уровень ПМ, связанных с повреждением митотического аппарата, нарушает структуру и функцию мнкротрубочек и микрофиламентов в исследуемых клетках. Выявленное снижение функциональной активности нсйтрофилов и лимфоцитов, ответственных за уничтожение клеток с цитогенетически-ми нарушениями, ведет к сниженной элиминации клеток с аберрантным геномом (Зимин Ю.И., 1983). Не исключено, что последнее является одной кз причин обнаруженного нами повышения МИ и числа ПМ. Таким образом, одной из сторон иммунотропного антенатального действия БП и КФ может быть подавление ими иммунной реактивности организма. В этом плане следует принять во внимание данные литературы о том, что ß-лактамные антибиотики оказывают существенное влияние на метаболическую активность клеток организма. Так, при исследовании влияния БП на изменение оксидазной активности гранулоцитов было установлено, что БП в дозах 17 142 и 8 571 ЕД/кг (в 1,5 и 3 раза ниже минимальной изучаемой дозы в нашем эксперименте) при длительном введении крысам вызывает снижение интенсивности окислительных процессов в клетках, что связано, в частности, с ингибированием синтеза окислительных ферментов (Иваненко А.Ю., 1967). Кроме того, при длительном введении животным БП в дозе 5 ООО ЕД/кг отмечено подавление активности гидролитических (кислой фосфатазы, щелочной фосфатазы) и окислительных (сукцинатдегидрогеназы) ферментов в лимфоидной ткани (Гусейнова С.Ю. с соавт., 1973). Приведенные данные позволяют считать, что в механизме действия ß-лактамных антибиотиков на иммуногенез существенную роль играют изменения обменных процессов лимфоидной ткани, которые, вероятно, напрямую связаны с нарушением нормального течении митоза в клетках костного мозга. Важно подчеркнуть, что, согласно данным литературы, ß-лактамные антибиотики, помимо снижения активности гидролитических и окислительных фермеито,'! в клетках лим-фоидной ткани и периферической крошг, подавшиот рост и развитие плазмоклеточных элементов (Караев З.О., ]978). Обращает на себя внимание тот факт, что между изменениями, происходящими под влиянием р-лактамных антибиотиков, со стороны биохимических показателей лимфоидной ткани, с одной стороны, и показателями иммунореактивности, с другой, выявляется четкий параллелизм (Кашкин К.П., Караев З.О., 1984). При этом авторы отмечают, что угнетение метаболической активности в структурах иммунологически активных клеток проявляется раньше, чем сдвиги иммунологических показателей. Это указывает на зависимость изменений иммунологических процессов от метаболической активности лимфоидной ткани, которая, в свою очередь, напрямую связана с процессами репродукции и, в частности, митотического деления в костном мозге, как одном из центральных органов иммуногенеза. Все это свидетельствует о возможной роли нарушений процессов передачи генетической информации и, вследствии этого, изменений метаболизма иммунологически активных клеток в механизме антенатального воздействия Р-лактамных антибиотиков на систему иммунитета потомства. Тем более, что, как показали наши исследования, БП и КФ, при определенных условиях, способны оказывать повреждающее действие на молекулу ДНК, нарушать синтез белков, участвующих в функционировании митотического аппарата. Все это может привести к гибели или нарушению функциональной активности дочерних клеток. . Сопоставление полученных результатов с данными литературы позволяет предположить универсальность общих механизмов неблагоприятного действия изучаемых антибиотиков, заключающуюся в нарушении процессов митотического деления и равномерного распределения генетической информации дочерним, клеткам в костном мозге, следствием чего является продукция клеток со сниженной функциональной активностью. Последнее подтверждается данными корреляционного анализа, свидетельствующими о наличии обратной связи (г > 0,7; р < 0,05) между уровнем ПМ в клетках костного мозга крыс, подвергнутых антенатальному воздействию БП и КФ во всех изученных дозах, и показателями фагоцитарных реакций нейтрофилов (ФИзо; ФЧзо). Кроме того, важно отметить, что после антенатального воздействия КФ в различных дозах и БП в дозе 1 ООО ООО ЕД/кг/сутки (7 ООО ООО ЕД/кг/курс) между ФЧзо, ФИзо' и титрои гемагглютининов образуются прямые связи (г > 0,7; р < 0,05), которые подтверждают единство и тесную взаимосвязь клеток системы иммунитета. Следует отметить, что, как показал корреляционный анализ, антенатальное воздействие БП и КФ в различных дозах провоцирует разрушение систем взаимосвязей, существующих в обычных условиях жизни. При этом, с увеличением дозы, выраженность разрушений нарастает. Од- нако в результате активации приспособительных процессов формируются лабильные, гетерогенные по составу корреляционные структуры, по крепости даже превосходящие параметры контрольной группы. Таким образом, согласно полученным данным, несмотря на то, что с помошью теста на индукцию хромосомных аберраций в клетках костного мозга мышей не удается выявить мутагенный эффект БП и КФ, данные антибиотики в определенных условиях, в частности при антенатальном воздействии, способны вмешиваться в процессы митотического деления клеток, что проявляется ростом числа патологических митозов с параллельным повышением пролиферативной активности. Это приводит, согласно полученным данным, к развитию анемии, вследствие нарушенного кровеобразования, к ингибированию антнтелогенеза, вследствии снижения числа клеток или их функциональной активности, а также к угнетению фагоцитарной активности нейтрофилов периферической крови. Поскольку костный мозг является местом рождения и дифференци-ровки многих клеточных элементов крови, а специфической функцией митоза является передача генетической информации, есть основание считать, что потенциальным звеном патогенеза описанных патологических процессов в системе эритрона и длительного снижения активности клеток системы иммунитета является установленное нарушение течения митоза в клетках костного мозга. Выводы 1. Бензилпенициллин в дозе 1 ООО ООО ЕД/кг/сутки (7 ООО ООО ЕД/кг/ /курс) и клафоран в дозах 30: 300; 600 ыг/кг/сутки (210; 2 100; 4 200 мг/кг/курс) при вщтримышечном введении крысам, независимо от срока беременности, достоверно (р < 0,01; р < 0,001) повышают уровень патологических митозов в клетках костного мозга потомства. При этом патология митозов обусловлена повреждением хромосом, а в ряде случаев - и митотического аппарата клеток. 2. Бензилпенициллин в дозах 125 000; 1000 000 ЕД/кг/сутки (875 000; 7 000 000 ЕД/кг/курс) при внутримышечном введении крысам в третьем сроке беременности и клафоран в дозах 30; 300; 600 мг/кг/сутки (210; 2100; 4 200 мг/кг/курс) - в первом и третьем сроках достоверно (р < 0,001) повышают иитотический индекс клеток костного мозга потомства. 3. Повышение уровня патологических митозов коррелирует с повышением митотического индекса (г = 0,979; р < 0,05) в клетках кос inoro мозга потомства крыс, подвергшихся воздействию бензилпенициллина в дозе 1 000 ООО ЕД/кг/сутки (7 000 000 ЕД/кг/курс) и клафорана в дозах 30; 300; 600 ыг/кг/сутки (210; 2 100; 4 200 мг/кт/курс), независимо от сроков беременности. 4. Бензилпенициллин в дозе 1 000 000 ПД/кг/сутки (7 000 000 ЕД/кг/ /курс) п клафоран в дозах 300; 600 иг/кт/суткн (2 100; 4 200 мг/кг/курс) при внутримышечном введении крысам, независимо от срока беременности, достоверно (р < 0,001) способствуют развитию анемии у потомства. 5. Введение бензилпенициллина в дозах 25 ООО ЕД/кг/сутки (175 ООО ЕД/кг/курс) и 125 ООО ЕД/кг/сутки (875 ООО ЕД/кгЛсурс) крысам в первом сроке беременности (предимплантационный период) приводит к повыше-шпо фагоцитарной активности иейтрофилов периферической крови (р < 0,01) и антителообразующей функции лимфоцитов (р < 0,001) у потомства. 6. Введение бензилпенициллина в дозах 25 000 ЕД/кг/сутки (175 000 ЕД/кг/курс) и 125 000 ЕД/кг/сутки (875 000 ЕД/кг/курс) крысам во втором и третьем сроках беременности (период плацентации, органогенеза и фе-тогенеза), а также бензилпенициллина в дозе 1 000 000 ЕД/кг/сутки (7000000 ЕД/кг/курс) и клафорана во всех изученных дозах; независимо от сроков беременности, вызывает у потомства снижение фагоцитарной активности нешрофилов периферической крови (р < 0,01) и антителообразующей функции лимфоцитов (р < 0,001). 7. Бензилпенициллин в концентрациях 2; 4; 8; 40; 200 ЕД/мл, а кла-форан в концентрациях 0,05; 0,15; 0,30; 0,60; 1,20 мг/мл в среде проращивания достоверно (р < 0,001) повышают уровень патологических митозов в клетках растительного тест-объекта. При этом БП достоверно (р < 0,05) повышает, а КФ - снижает (р < 0,001) митотический индекс активно про-лиферирующей ткани (корневой меристемы) проростков пшеницы. 8. Метод учета изменений митотического режима клеток костного мозга крыс, включающий определение митотического индекса, а также числа и характера патологических митозов, целесообразно использовать как скрининговый тест в комплексном изучении возможных нарушений, возникающих под действием лекарственных средств, со стороны важнейших систем гомеостаза на тканевом и клеточном уровнях. Перечень работ, опубликованных по теме диссертации: 1. Перспективы и возможности антибактериальной химиотерапии бета-лактамньши антибиотиками / Редькин Ю.В., Скальский C.B., Стопина Н.И., Пеньевская H.A., Лисникова- В.Е., Чернышев Г.П., Костанян А.М., Горбачевский Н.В., Винокуров A.B., Гурова О.П. // Материалы юбилейной конференции "Актуальные проблемы фармакологии и поиска новых лекарственных препаратов" - Томск, 1994. - С. 99-100. 2. Влияние бензилпенициллина на митотический режим клеток костного мозга крыс линии Вистар / Пеньевская H.A., Гурова О.П., Редькин Ю.В. и др. // Материалы науч. сессиии пед. ф-та, посвященной 75-летию Омской мед. академии / Под ред. Н.В. Собатюка. - Омск: ОГМА, 1995. - С. 69-72. 3. Иммунотропная активность бета-лактамных антибиотиков и экосистема "Мать - плод" / Редькин Ю.В., Степина Н.И., Пеньевская H.A., Лисникова В.Е., Гурова О.П. // Материалы юбилейной научной сессии / Под ред. В.В. Семченко. - Омск: ОГМА, 1995. - С. 71-72. 4. Иммунореактивные свойства бста-лактамных антибиотиков и экосистема "Мать - плод" / Редькин Ю.В., Степина Н.И., Пеньевская H.A., Листникова В.Е., Гурова О.П. и др. // Сб. тез. докл. II Российского национального конгресса "Человек и лекарство". - М., 1995. - С. 164. 5. Иммунотропные эффекты бета-лактамных антибиотиков / Редькин Ю.В., Степина H.H., Пеньевская H.A., Гурова О.П. и др. // Фундаментальные исследования как основа создания лекарственных средств: Сб. тез. I съезда Рос. науч. общ. фармакологов. - М., 1995. - С. 356. 6. Цитогенотоксические эффекты бензилпенициллина в клетках растительного тест-объекта / Редькин Ю.В., Пеньевская H.A., Гурова О.П. и др. // Материалы науч. сессиии пед. ф-та, посвященной 75-летию Омской мед. академии / Под ред. Н.В. Собатюка. - Омск: ОГМА, 1995. - С. 65-68. 7. Цитогенетические эффекты бета-лактамных антибиотиков / Гурова О.П., Пеньевская H.A., Щербакова О.В. и др. // Фундаментальные исследования как основа создания лекарственных средств: Сб. тез. I съезда Рос. науч. общ. фармакологов. - М., 1995. - С. 131. 8. Введение бензилпеницишшна и иммунореактивность организма беременных крыс, их плодов и потомства / Редькин Ю.В., Степина Н.И., Пеньевская H.A., Гурова О.П. //Сб. тез. докл. III Российского национального конгресса "Человек и лекарство". - М., 1996. - С. 193. 9. Клеточно-гуморальные реакции системы иммунитета у беременных крыс и их потомства при введении ацетилсалициловой кислоты / Редькин Ю.В., Степина Н.И., Пеньевская H.A., Гурова О.П. // Актуальные проблемы экспериментальной и клинической фармакологии Сибирского региона: Сб. тез. докл. науч. конф. посвящ. 40-летию кафедры фармакологии Алтайского гос. мед. ун-та. - Барнаул, 1996. - С. 41-42. 10. Реакции гиперчувствительности замедленного типа (ГЗТ) и неспецифические факторы защиты при введении бензилпенициллина у беременных крыс, их плод,ов и потомства / Редькин Ю.В., Степина Н.И., Пеньевская H.A., Гурова О.П. // Патофизиология органов и систем. Типовые патологические процессы (экспериментальные и клинические аспекты): Тез. докл. I Рос.Конгресса по патофизиологии с междунар. участием. - М., 1996. - С. 157. 11. Система крови крыс линии Вистар при введении различных доз бета-лактамных антибиотиков / Редькин Ю.В., Гурова О.ТТ., Пеньевская H.A. и др. // Патофизиология органов и систем. Типовые патологические процессы (экспериментальные и клинические аспекты): Тез. докл. I Рос. Конгресса по патофизиологии с междунар. участием. - М., 1996. - С. 350. 12. Цитогенотоксические эффекты бета-лактнмных антибиотиков / Редькин Ю.В., Иеньевская Н.А., Гурова О.П. и др. // Ученые записки биологического факультета Ом ГПУ. - Омск, 1996. - С. 16-2S. 13. Influence of benzylpenicillinum injections on delayed hypersesitivity reactions (DHR) investigated on pregnant rats, their fetuses and descendants / Redkina V., Stepina N.I., Penyevskaya N.A., Giirova O.P. et al. // 12-"' International Medical Sciences Student Congress. - Istambul, Turkey, 1996. - P. 109. Сдано в печгть 15.Go.97. iop.\:a? 3Qxo4 I/I6. Бум.тип. Л 3. Печать офсетная. Уч.-изд.л. 1,П. Тяреа I0G экз. Ззказ 80. Типография издательства ОмГАУ, Омск-о, Сибаковская, 4 medical-diss.com 183. Клеточный цикл. Митоз.В ходе митоза делятся ядро(кариокинез) и цитоплазма(цитокинез). Митоз делится на фазы: профаза, прометафаза, метафаза, анафаза, телофаза. Профаза. Хромосомы конденсируются, хроматиновые нити образуют клубок (материнский клубок). Каждая хромосома представлена двумя тесно прилегающими друг к другу дочерними(сестринскими) хроматидами. Ядрышко реорганизуется. Ядерная оболочка распадается на мембранные пузырьки. В цитоплазме уменьшается количество структур гранулярной эндоплазматической сети и число полисом. Комплекс Гольджи распадается на везикулы. В клетке прекращается синтез РНК и белка. Центриоли двумя парами(диплосомы) расходятся к полюсам клетки, происходит формирование митотического(пролиферативного) аппарата, в который входят центриоли и веретено деления, состоящие из микротрубочек. Прометафаза. Завершается формирование веретена деления. Хромосомы направляются к экватору деления. Метафаза. Максимально конденсированные хромосомы выстраиваются в полости экватора клетки(метафазная пластинка или материнская звезда). К концу фазы хроматиды сохраняют лишь кажущуюся связь в области центромер. Их плечи располагаются параллельно друг другу с хорошо различимой щелью между ними. Специальным образом приготовленные препараты метафазных хромосом цитогенетики используют для исследования кариотипа. Анафаза. Наиболее короткая по продолжительности фаза митоза. Хромосомы становятся похожими на шпильки. Дочерние(сестринские) хроматиды в качестве уже самостоятельных хромосом, будучи ориентированными центромерными участками к одному из полюсов, а теломерными(концевыми)-к экватору клетка, перемещаются к клеточным полюсам. Расхождение хромосом вдоль микротрубочек обеспечивается моторным белком(динеином). По завершении движения на полюсах собирается два равноценных набора хромосом(дочерние звезды), предназначенных для дочерних клеток. Телофаза. Завершающую фазу митоза делят на раннюю и позднюю телофазу. Важнейшее событие ранней телофазы-реконструкция ядер будущих дочерних клеток. К важным событиям телофазы относятся также деконденсация хромосом, образование ядрышка, разрушение веретена деления. Итогом поздней телофазы является разделение тела материнской клетки. 184. Канцерогены и тератогены. Принцип действия. ПримерыКанцерогены — химические вещества, излучения, способные при попадании в организм человека или животных приводить к образованию злокачественных новообразований (опухолей). Наиболее известный физический канцероген — ионизирующие излучения. Среди химических канцерогенов чаще всего называют следующие: Нитраты, нитриты. Поступают в организм с переудобренными азотом овощами, например парниковыми. В желудочно-кишечном тракте нитраты могут превращаться в нитриты. Нитриты, вступая в реакцию с аминами, образуют канцерогенные натрозамины. Нитриты добавляют также в колбасы и консервы. Защиту от нитратов и нитритов обеспечивает витамин С. Бензопирены. Образуются при жарке и приготовлении пищи на гриле. Их много в табачном дыме. Продукты белкового пиролиза образуются при длительном нагреве мяса в духовке. Пероксиды. Образуются в прогорклых жирах и при сильном нагреве растительных масел. Афлатоксины. Продукты обмена плесневых грибов. В заплесневелом хлебе и орехах, во влажных помещениях. Диоксины. Хлорорганические соединения, образующиеся при сжигании бытового мусора. Образуются при хлорировании загрязнённой органикой воды. Тератогены - химические вещества или физические факторы, вызывающие при воздействии на организм возникновение уродств и других аномалий развития. Тератогенный эффект развивается при действии токсиканта в определенной дозе, на чувствительный орган, в определенный период его формирования. Генерация мутаций (мутагенез) - явление модификации токсикантом последовательности нуклеотидов в молекуле ДНК. Изменение наследственного кода сопровождается синтезом дефектных белков (ферментов, структурных протеинов), что в свою очередь приводит к функциональным нарушениям, часто не совместимым с жизнью. Повреждение хромосом - явление разрыва хромосом или их слияния. Причинами эффекта, помимо химических воздействий, могут быть вирусные инфекции и действие ионизирующих излучений. Повреждение механизмов репарации. Нарушение свойств генетического аппарата клетки может быть следствием угнетения активности ферментов, обеспечивающих репарацию спонтанно трансформирующихся молекул ДНК. Нарушения митоза. Многие токсиканты, действуя на специальный клеточный аппарат обеспечения нормального митоза, вызывают нарушения процесса. Нарушение биосинтеза жизненно важных молекул может стать следствием действия токсикантов. Многие вещества способны нарушать синтез белка, блокируя процессы репликации (синтез ДНК), транскрипции (синтез РНК) и трансляции (собственно синтез белка). К числу таких веществ относятся многие цитостатики и некоторые антибиотики. По большей части, действие этих веществ приводит к гибели плода; уродства отмечаются значительно реже. Вещества, затрудняющие поступление в организм матери необходимых для пластического обмена молекул-предшественников и субстратов, являются тератогенами. Нарушения диеты - дефицит в рационе витаминов, минералов, вызывает замедление роста плода, его гибель, приводит к тератогенезу. При этом изменения плода проявляются раньше, чем нарушения здоровья матери. Наиболее известным примером является эндемический кретинизм, характеризующийся замедлением физического и умственного развития в регионах с низким содержанием йода в воде и почве. Дефицитные состояния могут развиться при поступлении в организм веществ-аналогов или антагонистов витаминов, аминокислот, нуклеиновых кислот и т.д. Некоторые вещества блокируют поступление необходимых элементов в организм матери и плода. Так, хроническая интоксикация цинком сопровождается существенным снижением поступления в организм меди. Вещества, способные угнетать активность энзимов пластического обмена в клетках плода, нарушают его развитие. Нарушение энергетического обмена может привести к тератогенезу или гибели плода. Повреждение клеточных мембран. Таким образом, в основе тератогенеза могут лежать практически все известные механизмы токсического действия ксенобиотиков Примеры: никотин, алкоголь, наркотики. studfiles.net |
г.Самара, ул. Димитрова 131 [email protected] |
 |