|
|
||||||||||
|
Белорусская вакцина от рака не может выпутаться из сетей бюрократии. Ресан вакцинаВАКЦИНА РЕСАНРак груди // Вакцина РЕСАН ВАКЦИНА РЕСАНФормирование клеточного противоопухолевого иммунитета Ученые ведут разработку вакцины против рака. Вакцина против рака молочной железы может состоять из смеси антигенов, которые представляют собой ослабленные или мертвые элементы клеток рака. Они свою очередь стимулируют иммунный ответ организма в виде выработки специфичных антител. Вакцинация - наиболее частый способ усиления иммунной системы организма против инфекций. Такая вакцина может быть сделана из Ваших собственных деактивированных клеток рака либо из экстракта раковых клеток молочной железы, культивированных в лабораторных условиях. В настоящее время идея иммунизации организма женщины от рака молочной железы пока что находится на стадии клинической разработки. Иммунная система – очень важная часть нашего организма. Она защищает его не только от инфекционных агентов, но также и от возникших аномальных клеток. Иммунная система обладает одним уникальным свойством – памятью. Ее клетки могут долгое время помнить, как «выглядит» та или иная инфекция, а также как с ней бороться. Это явление называется иммунитет. Идея использования явления иммунитета в борьбе с раком появилась не так давно. Одним из представителей таких «антираковых» вакцин являются, например, Neuvenge и РЕСАН (препарат, разработанный белорусскими учеными). Эффект этих вакцин направлен на стимулирование иммунной системы в борьбе с метастазами рака. Стоит отметить, что данные вакцины эффективны при HER2-позитивных опухолях. Это такие опухоли, во время метаболизма которых образуется особый белок - HER2. Отмечено, что такой рак молочной железы более агрессивен по сравнению с HER2-негативными опухолями.Вакцина РЕСАН формирует клеточный противоопухолевый иммунитет, который способствует полному уничтожению различных злокачественных и доброкачественных опухолей. Она обладает широким спектром противоопухолевой активности благодаря тому, что в её состав входят имитаторы более 40 разновидностей опухолевых антигенов. Антигены, которые имитированы препаратом, присутствуют на клетках наиболее распространённых злокачественных и доброкачественных опухолей, содержащих фиброзную и железистую ткань. При введении вакцины в организм происходит образование многочисленных клонов противоопухолевых лимфоцитов. В случаях, когда удаётся достичь полного уничтожения опухоли системой иммунитета рецидивов не отмечается благодаря формированию иммунологической «памяти». Принцип действия противораковых вакцин Принцип действия противораковых вакцин основан на явлении иммунологической памяти. При этом в составе вакцины находятся так называемые имитаторы опухолевых антигенов. Эти антигены обычно бывают на поверхности раковых клеток. Сами имитаторы таких антигенов абсолютно безопасны для организма. Однако иммунная система «запоминает» их и как их нейтрализовать, что способствует саморегуляции организма при возникновении реальных раковых клеток. Показания к вакцинации противораковыми вакцинами Использование препарата как вакцины для предотвращения возникновения опухолей из соединительной, эпителиальной и железистой ткани у здоровых людей и людей с наследственной предрасположенностью. Сюда относится вакцинация группы риска, т. е. тех пациентов, когда опухоль ещё не визуализируется, но уже повышены уровни опухолевых маркеров. Профилактика возникновения рецидива злокачественных опухолей после радикального хирургического лечения. Использование как антиметастатического средства в сочетании с хирургическим удалением первичной опухоли позволяет уничтожить оставшиеся после операции метастазы общим объёмом до 10 – 50 см3. Рекомендуется введение препарата за 7-12 дней до операции. Использование препарата для иммунотерапии доброкачественных опухолей общим объёмом до 10-70 см3, содержащих фиброзную ткань (фибром, фиброаденом, фибромиом) и железистую ткань (аденом, железистых полипов), а также для предотвращения малигнизации доброкачественных опухолей. Лечение мастопатий (дисгормональных гиперплазий молочной железы), эндометриоза и миом матки у женщин. Введение вакцины в данных случаях необходимо проводить за 2 недели до предполагаемых месячных. Лечение доброкачественных гиперплазий предстательной железы, аутоиммунного тиреоидита и диффузного зоба. Однако кроме положительных эффектов, следует обратить внимание на ряд следующих фактов. Данные вакцины находятся пока что в стадии клинической разработки. Результаты первой фазы исследований показали эффективность вакцины Neuvenge в лечении HER2-позитивных опухолей, однако необходимо дальнейшее изучение эффекта этих препаратов для того, чтобы считать этот препарат достаточно безопасным. Применение имитаторов опухолевых антигенов помогает: предотвратить возникновение злокачественных опухолей у многих людей, особенно у людей, родственники которых страдали онкологическими заболеваниями, т.е. генетически предрасположенных; предотвратить малигнизацию (перерождение в злокачественную опухоль) и избежать оперативного лечения при ряде доброкачественных опухолей; уничтожить небольшие метастазы и предотвратить рецидивы после оперативного лечения злокачественных опухолей; разрушить неоперабельные злокачественные образования (стадии рака Т3-Т4) в составе комплексной терапии; улучшить качество жизни больных с прогрессирующим раком, уменьшив болевой синдром, что позволит им обходиться без применения обезболивающих препаратов во многих случаях. (495) 51-722-51 - лечение рака груди в Москве и за рубежом ОФОРМИТЬ ЗАЯВКУ на ЛЕЧЕНИЕ breastcancer.su РЕСАН это АНТИРАКОВАЯ ВАКЦИНА | Гинеколог Беркенгейм Михаил ЛеонидовичФормирование клеточного противоопухолевого иммунитета Маммология — Болезни молочной железы — Mammalogy.su В настоящее время идея иммунизации организма женщины от рака молочной железы пока что находится на стадии клинической разработки. Иммунная система – очень важная часть нашего организма. Она защищает его не только от инфекционных агентов, но также и от возникших аномальных клеток. Иммунная система обладает одним уникальным свойством – памятью. Ее клетки могут долгое время помнить, как «выглядит» та или иная инфекция, а также как с ней бороться. Это явление называется иммунитет. Идея использования явления иммунитета в борьбе с раком появилась не так давно. Одним из представителей таких «антираковых» вакцин являются, например, Neuvenge и РЕСАН (препарат, разработанный белорусскими учеными). Эффект этих вакцин направлен на стимулирование иммунной системы в борьбе с метастазами рака. Стоит отметить, что данные вакцины эффективны при HER2-позитивных опухолях. Это такие опухоли, во время метаболизма которых образуется особый белок — HER2. Отмечено, что такой рак молочной железы более агрессивен по сравнению с HER2-негативными опухолями. Ученые ведут разработку вакцины против рака. Вакцина против рака молочной железы может состоять из смеси антигенов, которые представляют собой ослабленные или мертвые элементы клеток рака. Они свою очередь стимулируют иммунный ответ организма в виде выработки специфичных антител. Вакцинация — наиболее частый способ усиления иммунной системы организма против инфекций. Такая вакцина может быть сделана из Ваших собственных деактивированных клеток рака либо из экстракта раковых клеток молочной железы, культивированных в лабораторных условиях. Вакцина РЕСАН формирует клеточный противоопухолевый иммунитет, который способствует полному уничтожению различных злокачественных и доброкачественных опухолей. Она обладает широким спектром противоопухолевой активности благодаря тому, что в её состав входят имитаторы более 40 разновидностей опухолевых антигенов. Антигены, которые имитированы препаратом, присутствуют на клетках наиболее распространённых злокачественных и доброкачественных опухолей, содержащих фиброзную и железистую ткань. При введении вакцины в организм происходит образование многочисленных клонов противоопухолевых лимфоцитов. В случаях, когда удаётся достичь полного уничтожения опухоли системой иммунитета рецидивов не отмечается благодаря формированию иммунологической «памяти». Принцип действия противораковых вакцин основан на явлении иммунологической памяти. При этом в составе вакцины находятся так называемые имитаторы опухолевых антигенов. Эти антигены обычно бывают на поверхности раковых клеток. Сами имитаторы таких антигенов абсолютно безопасны для организма. Однако иммунная система «запоминает» их и как их нейтрализовать, что способствует саморегуляции организма при возникновении реальных раковых клеток. Показания к вакцинации противораковыми вакцинами: * Использование препарата как вакцины для предотвращения возникновения опухолей из соединительной, эпителиальной и железистой ткани у здоровых людей и людей с наследственной предрасположенностью. Сюда относится вакцинация группы риска, т. е. тех пациентов, когда опухоль ещё не визуализируется, но уже повышены уровни опухолевых маркеров. * Профилактика возникновения рецидива злокачественных опухолей после радикального хирургического лечения. * Использование как антиметастатического средства в сочетании с хирургическим удалением первичной опухоли позволяет уничтожить оставшиеся после операции метастазы общим объёмом до 10 – 50 см3. Рекомендуется введение препарата за 7-12 дней до операции. * Использование препарата для иммунотерапии доброкачественных опухолей общим объёмом до 10-70 см3, содержащих фиброзную ткань (фибром, фиброаденом, фибромиом) и железистую ткань (аденом, железистых полипов), а также для предотвращения малигнизации доброкачественных опухолей. * Лечение мастопатий (дисгормональных гиперплазий молочной железы), эндометриоза и миом матки у женщин. Введение вакцины в данных случаях необходимо проводить за 2 недели до предполагаемых месячных. * Лечение доброкачественных гиперплазий предстательной железы, аутоиммунного тиреоидита и диффузного зоба. Однако кроме положительных эффектов, следует обратить внимание на ряд следующих фактов. Данные вакцины находятся пока что в стадии клинической разработки. Результаты первой фазы исследований показали эффективность вакцины Neuvenge в лечении HER2-позитивных опухолей, однако необходимо дальнейшее изучение эффекта этих препаратов для того, чтобы считать этот препарат достаточно безопасным. Применение имитаторов опухолевых антигенов помогает: предотвратить возникновение злокачественных опухолей у многих людей, особенно у людей, родственники которых страдали онкологическими заболеваниями, т.е. генетически предрасположенных; предотвратить малигнизацию (перерождение в злокачественную опухоль) и избежать оперативного лечения при ряде доброкачественных опухолей; уничтожить небольшие метастазы и предотвратить рецидивы после оперативного лечения злокачественных опухолей; разрушить неоперабельные злокачественные образования (стадии рака Т3-Т4) в составе комплексной терапии; улучшить качество жизни больных с прогрессирующим раком, уменьшив болевой синдром, что позволит им обходиться без применения обезболивающих препаратов во многих случаях.
About Беркегейм МихаилЯ родился 23 ноября 1945 года в Москве. Учился в школе 612. до 8 класса. Мама учитель химии. Папа инженер. Я очень увлекался химией и радиоэлектроникой. Из химии меня очень увлекала пиротехника. После взрыва нескольких помоек , я уже был на учете в детской комнате милиции. У меня была кличка Миша – химик. Из за этого после 8 класса дед отвел меня в 19 мед училище. Где меня не знали. Мой отчим был известный врач гинеколог. В 1968 году я поступил на вечерний факультет медицинского института. Мой отчим определил мою профессию. Но увлечение электроникой не прошло, и я получил вторую специальность по электронике. Когда я стал работать врачом гинекологом в медицинском центре «Брак и Семья» в 1980 году, я понял., что важнейшим моментом в лечении бесплодия является совмещение по времени секса и овуляции. Мне было известно, что овуляция может быть в любое время и несколько раз в месяц. И самое главное, что часто бывают все признаки овуляции. Но ее не происходит. Это называется псевдоовуляция. Меня посетила идея создать прибор надежно определяющий овуляцию. На это ушло около 20 лет. Две мои жены меня не поняли. Я мало времени уделял семье. Третья жена уже терпит 18 лет. В итоге прибор получился. Этот прибор помог вылечить бесплодие у очень многих женщин…gynecolog.net Белорусская вакцина от рака не может выпутаться из сетей бюрократии
В США появилась первая в мире вакцина от рака простаты, с помощью которой можно вылечить этот вид рака на поздних стадиях. Основной недостаток вакцины — дороговизна. В Беларуси также существует противораковая вакцина «Ресан», которая находится в стадии регистрации. Правда, излечение стопроцентным не назовешь. Традиционная химиотерапия обычно откладывает смерть лишь на три месяца, Provenge же, как показали тесты, может прибавить к жизни больных на месяц больше. Provenge разработан для лечения рака предстательной железы на поздних стадиях, когда злокачественные образования у больного уже не реагируют на прием гормональных препаратов. Лекарство Provenge является представителем нового класса активных клеточных иммунологических препаратов, разрабатываемых персонально для каждого конкретного больного. Для создания лекарства у пациента берутся клетки иммунной системы, которые активируются после контакта с белками пораженных раком клеток простаты. Поскольку вакцина должна быть адаптирована для каждого больного индивидуально, ее стоимость составит около 69 тысяч долларов. Препарат уже лицензирован для использования в США. Новое лекарство от рака предстательной железы успешно прошло расширенный этап клинических исследований в 2009 году. В результате исследования, в котором участвовали 512 мужчин со злокачественными новообразованиями простаты, препарат Provenge доказал свою эффективность. Предыдущее исследование Provenge показало, что у пациентов, принимавших препарат, продолжительность жизни была в среднем на четыре с половиной месяца больше. Из 127 больных раком простаты после трех лет в живых остались 34% мужчин, принимавших лекарство, и 11% получавших плацебо. В Беларуси, по данным Минздрава, ежегодно выявляется более 1000 мужчин, заболевших раком предстательной железы. Рак простаты входит в шестерку самых распространенных типов рака во всем мире. Увеличение случаев этого заболевания отмечается в Беларуси, как и во всем мире. Риск заболевания раком предстательной железы возрастает с возрастом, и, как правило, эта болезнь чаще начинается у мужчин после 50 лет. Всем мужчинам этого возраста специалисты рекомендуют ежегодное обследование у уролога, включающее ректальное пальцевое исследование. Раннее выявление опухоли помогает вовремя начать лечение с хорошим последующим эффектом. Начать клинические испытания отечественной вакцины против рака препарата «Ресан» планировалось еще в 2007 году. Вакцина формирует клеточный противоопухолевый иммунитет, который способствует полному уничтожению различных злокачественных и доброкачественных опухолей. «Ресан» обладает широким спектром противоопухолевой активности благодаря тому, что в его состав входят имитаторы более 40 разновидностей опухолевых антигенов. Антигены, которые имитированы препаратом, присутствуют на клетках наиболее распространенных злокачественных (перечень указан здесь) и доброкачественных опухолей, содержащих фиброзную и железистую ткань. Как рассказал «Белорусским новостям» директор научно-исследовательского предприятия «Ресан» Андрей Янченко, важное свойство препарата — профилактика рецидивов онкологических заболеваний, вероятность которых весьма значительна после оперативного вмешательства. Препарат не оказывает токсического действия на нормальные клетки организма, не обладает мутагенным и тератогенным действием, не содержит никаких клеток и тканей опухолей. Андрей Янченко большой надежды на скорую регистрацию препарата не возлагает: «Нет пророков в своем отечестве. Не исключено, что скорее, чем в Беларуси, регистрация «Ресана» случится в соседних государствах, а затем — лет через 20, в Беларуси. Препарат запатентован — зарегистрирован в государственном реестре изобретений, но патент на изобретение препарата в Беларуси имеет срок действия 20 лет и закончится в 2017 году». Противоопухолевая активность препарата исследована и доказывалась в течение 18 лет. Доклинические испытания на животных были утверждены еще в 2005 году. К слову, Андрей Янченко рассказал, что доклинические испытания были проведены не только в Беларуси, но и за рубежом. Там «Ресан» доказал свою эффективность в отношении гинекологического заболевания эндометриоза в качестве профилактического средства в 90% случаев, в терапии — 62%. Доклинические испытания были признаны, однако в ходе бюрократических проволочек «Ресану» предписано проверить препарат еще и на насекомых. Это условие считается необходимым для того, чтобы предприятие могло начать клинические испытания (на людях). В результате клинические испытания не начинаются. Андрей Янченко говорит о различных сложных движениях вокруг регистрации препарата и сожалеет: «Порой кажется, что кроме нас и больных это никому не надо, вот и затягивается процесс». Характерно, говорит он, что если клинические испытания начнутся сегодня, результат будет известен уже через полтора года. Правда, из-за того, что «Ресан» лечит несколько видов патологий, процесс может растянуться до бесконечности. naviny.by Иммунотерапия в лечении рака груди и мастопатии. Вакцина РЕСАН.
МастопатияСогласно определению ВОЗ (1984), мастопатия — это фиброзно-кистозная болезнь (ФКБ), характеризующаяся нарушением соотношений эпителиального и соединительно-тканного компонентов, широким спектром пролиферативных и регрессивных изменений тканей молочной железы. По данным гистологических исследований молочных желез женщин возраста 20-40 лет, умерших по различным причинам, дисгормональные изменения обнаруживаются в 60-80% случаев. В 30-40% случаев мастопатия (дисгормональная гиперплазия молочной железы) обнаруживается при пальпации молочных желез. ФКБ является доброкачественным заболеванием. Однако в ряде случаев данная патология может явиться промежуточной стадией в развитии злокачественного процесса. Поскольку доброкачественные заболевания и рак молочных желез имеют много общего в этиологических факторах и патогенетических механизмах, факторы риска развития мастопатий и рака молочных желез во многом идентичны. На сегодняшний день не выявлено ни одного специфического фактора риска развития этой патологии, поскольку мастопатия — мультифакторное заболевание, связанное как с генетическими факторами, так и с факторами окружающей среды. В возникновении и развитии дисгормональных заболеваний молочных желез огромную роль играет состояние гипоталамо-гипофизарной системы. Нарушение нейрогуморальной составляющей репродуктивного цикла ведет к активации пролиферативных процессов в гормональнозависимых органах, в том числе и в тканях молочных желез, которые являются мишенью для стероидных гормонов яичников, пролактина, плацентарных гормонов и опосредованно гормонов других эндокринных желез организма. Эстрогены в большей степени влияют на пролиферацию эпителия ацинусов, дольковых и междольковых протоков, тогда как андрогены в большей степени влияют на степень выраженности фиброза [1, 2]. Большинство женщин не придают мастопатии большого значения, т.к. это заболевание не кажется им достаточно серьезным. На самом деле дисгормональная гиперплазия способна нанести здоровью женщины значительный урон, и во многих случаях при отсутствии должного лечения фиброзные узлы могут стать злокачественными (Рис. 1). Неизмененная ткань молочной железы
Важность атипической гиперплазии как биологического маркера повышенного риска развития инвазивного рака груди была подтверждена в многоцентровом исследовании с участием более 280 000женщин [3]. Хотя мастопатия (mastos – молочная железа, pathy - заболевание) – это собирательный термин, охватывающий все патологические изменения в молочной железе, мы рассматриваем здесь главным образом дисгормональную гиперплазию молочной железы (фиброкистозные изменения). Это одно из наиболее распространенных доброкачественных заболеваний: примерно у 50% женщин при пальпации можно обнаружить неоднородность груди, циклические боли и болезненность при пальпации. Фиброкистозные изменения наблюдаются в виде трех различных форм: 1.Гиперплазия протоков и формирование кист.2.Аденоз (дольковая гиперплазия) и склерозирующий аденоз.3.Фиброз. На основании этих структурных изменений дисгормональная гиперплазия молочных желез классифицируется следующим образом [3, 4]: 1. Узловатая форма.А) Аденофибромы.Б) Фиброаденомы. 2. Диффузная форма.А) Аденозы.Б) Аденофиброматозы.В) Фиброаденоматозы:1) дольковый,2) протоковый,3) фиброзный,4) кистозный,5) пролиферативный:а) аденоматозного характера,б) папиллярного характера,в) солидного характера. Рак молочной железыРак молочной железы развивается, когда клетки молочной железы приобретают способность к бесконтрольному росту и проникают в близлежащие ткани или распространяются по всему телу. Теоретически рак может развиться из каждого вида ткани молочной железы, но обычно в патологический процесс вовлекаются либо протоки, либо железистая ткань. Рак груди среди всех злокачественных опухолей у женщин встречается наиболее часто. Первый пик заболеваемости приходится на репродуктивный период от 30 до 40 лет. По данным статистики, число заболевших за этот период составляет 80-100 на100 000женщин. В последующие годы жизни отмечается увеличение частоты рака молочных желез, в частности, если в 50 лет регистрируется 180 случаев, то после 65 лет – 250 случаев на100 000 женщин. По данным ВОЗ, раком молочных желез ежегодно заболевает около 750 тыс. женщин, и именно это заболевание является главной причиной смертности женщин в возрасте от 40 до 55 лет [5]. Основными факторами риска развития рака груди являются семейный анамнез рака груди для родственников первой степени, наличие в анамнезе доброкачественных заболеваний молочной железы, возраст старше 40 лет, поздний возраст при рождении первого ребенка или бездетность. Заместительная терапия эстрогенами или прием гормональных таблетированных контрацептивов также в некоторой степени увеличивает риск развития рака груди, как и радиоактивное облучение и употребление алкогольных напитков. Курение увеличивает риск метастазов рака молочной железы в легкие [6, 7]. В настоящее время общепризнанно, что рак молочной железы встречается в 3-5 раз чаще на фоне доброкачественных заболеваний молочных желез и в 30-40 раз чаще при узловых формах мастопатии с явлениями пролиферации эпителия молочных желез. Считается, что 10-15% случаев рака груди являются наследственными [8]. Изменения от обычной клетки до канцероматозной происходят под влиянием определенных генных мутаций. Эти изменения наиболее часто обнаруживают в генах BRCA1 и BRCA2 (BReast CAncer Gene 1 – ген рака груди 1 и BReast CAncer Gene 2 – ген рака груди 2) (Рис. 2).
Рис. 2. Гены, в которых обнаруживают мутации при раке груди Мутации в BRCA1 обнаруживают примерно в 45% случаях наследственного рака, а BRCA2 – еще в 35%. Эти гены присутствуют как у мужчин, так и у женщин, поэтому изменения могут передаваться по наследству как от матери, так и от отца. Мужчины-носители BRCA2 также относятся к группе повышенного риска развития рака груди [9]. Классификация рака груди, предложенная Американским комитетом по злокачественным опухолям: Стадия 0: самый ранний рак молочной железы. Раковая опухоль не распространяется за пределы протоков (дуктальная карцинома in situ) или долек (лобулярная карцинома in situ или лобулярная неоплазия). Стадия I: размер опухоли не более 2 см в диаметре при отсутствии поражения лимфатических узлов или каких-либо других тканей. Стадия II: размер опухоли от 2 до 5 см в диаметре и/или метастазыобнаруживают в 1-3-х подмышечных лимфатических узлах на стороне поражения груди. Этой стадии также соответствует опухоль размером более 5 см в диаметре без поражения лимфатических узлов. Стадия III: опухоль менее 5 см в диаметре и поражение от 4 до 9 подмышечных лимфоузлов, или опухоль более 5 см в диаметре и поражение от 1 до 9 подмышечных лимфоузлов, или локальное распространение опухоли (на близлежащие органы и ткани), обычно с вовлечением кожи или грудной стенки и поражение от 0 до 9 подмышечных лимфоузлов. При стадии 3 метастазы в отдаленные органы и лимфоузлы отсутствуют. Стадия IV: опухоль вне зависимости от её размеров метастазирует в отдаленные органы, часто поражая кости, легкие, печень или мозг; поражаются и отдаленные лимфоузлы. Воспалительный рак молочной железы – разновидность инфильтративной дуктальной карциномы. Название дано в соответствии с типичной клинической картиной. Появляется припухлость груди и ее покраснение, кожа становится теплой на ощупь и уплотняется, т. е. молочная железа выглядит инфицированной. Это происходит из-за быстрого роста раковой опухоли и блокады лимфатических протоков молочной железы. В 90% случаев в момент диагностики воспалительного рака молочной железы злокачественные клетки уже начали распространяться по лимфатическим путям. Прогноз для этой разновидности рака груди наименее благоприятный, но и встречается он относительно редко. Обследование по поводу узловых образований груди должно включать физикальный (врачебный) осмотр, маммографию, аспирационную биопсию и некоторые специфические лабораторные исследования (определение рецепторов к эстрогенам и прогестерону, гиперэкспрессии HER2). Для ранней диагностики мастопатии и рака молочной железы обычно достаточно следующих скрининговых методов: регулярной пальпации женщиной своих молочных желез, ежегодных маммографии и осмотра гинеколога.  Традиционные методы лечения Общепринятые методы лечения мастопатииЕдиного алгоритма, пригодного для лечения всех случаев мастопатии, не существует. В каждом конкретном случае лечение должно быть строго индивидуальным, хотя можно выделить основные направления: - Гормональные методы лечения.- Негормональные консервативные методы лечения.- Хирургические методы лечения. Гормональные методы леченияКак было указано выше, рост и пролиферация различных тканей молочной железы находятся под контролем эстрогенов, прогестерона, пролактина, гормона роста, андрогенов, тироксина и т.д. Однако гормональная терапия направлена главным образом на коррекцию влияния на ткани молочной железы эстрогенов [10, 11]. Антиэстрогены – тамоксифен [12], торемифен, ингибиторы ароматазы – наиболее часто применяемые препараты, эффективные как в отношении лечения мастопатии, так и снижающие риск развития рака [11, 13, 14]. Пероральные контрацептивы – при приеме этих препаратов достигается не только контроль за овуляцией, но и уменьшение синтеза эндометрием рецепторов к эстрогенам и достижение баланса между резкими гормональными изменениями в течение менструального цикла. Выбранный контрацептивный препарат должен иметь низкое содержание эстрогенов и высокое – гестагенов. Отрицательным моментом назначения пероральных контрацептивов является то, что клинический эффект в отношении мастопатии развивается нескоро – через 1-2 года после начала приема. Лечение мастопатии гестагенами оказывается эффективным в двух случаях из трех. Производные тестостерона (линестринол, норгестрил, даназол) применяются чаще, чем производные прогестерона (медроксипрогестерона ацетат). Ингибиторы секреции пролактина – препараты, подобные бромкриптину – эффективны в лечении мастопатий у пациенток с повышенным уровнем тиротропин-релизинг гормона. Агонисты релизинг-фактора лютеинизирующего гормона (luteinizing hormone-releasing hormone – LHRH). Эти препараты вызывают торможение действия сывороточных эстрогена и тестостерона. В связи с выраженными побочными эффектами аналоги LHRH назначают в основном пациенткам с наиболее тяжелыми формами мастопатии, при выраженной мастодинии (боли в груди), когда отсутствует эффект от лечения другими гормонами. Важное замечание: При развитии мастопатии на фоне заместительной гормональной терапии дополнительное назначение гормонов может ухудшить течение заболевания. Следует учитывать, что пролиферативные формы фиброаденоматоза, а также фиброзно-кистозные или фиброматозные мастопатии плохо поддаются гормональной терапии, которая в то же время сопровождается выраженными побочными эффектами. Негормональные консервативные методы лечения Кроме гормонального дисбаланса, у пациенток, страдающих мастопатией, отмечены патологические изменения со стороны лимбической системы, ретикулярной формации и метаболических процессов. Таким образом, имеет смысл вводить в состав комплексной терапии витамины (A, C, E и B), седативные и психотропные средства, диуретики, периферические вазодилататоры, нестероидные противовоспалительные препараты. Следует также обратить внимание на характер питания и выбирать удобные бюстгалтеры. К сожалению, традиционный консервативный путь лечения мастопатии не решает самой важной проблемы — профилактики рака груди, так как далеко не всегда даже при тщательном наблюдении врачам удается вовремя заметить перерождение мастопатии в рак, а за полгода – год процесс нередко становится необратимым. Хирургическое лечениеТонкоигольная аспирация – наиболее щадящий метод: внутрь кисты вводят иглу и отсасывают ее содержимое. Часто эту манипуляцию выполняют в диагностических целях, но для больших кист она приобретает лечебное значение. Чаще всего выполняют иссечение узлов по мере их обнаружения. Однако последнее время к оперативному лечению мастопатии стали относиться осторожнее, поскольку операция не устраняет причину заболевания. У многих женщин, перенесших по10-15 операций, после каждого оперативного вмешательства узлы появлялись вновь, располагаясь вдоль хирургического шва, как гроздья винограда. Общепринятые методы лечения рака молочной железы В настоящее время существует ряд общепринятых методов лечения рака молочной железы: хирургический, химиотерапия, лучевая терапия и гормональное лечение [11, 13, 14, 15, 16]. Хирургическое лечение в зависимости от стадии заболевания заключается в частичной или радикальной мастэктомии, причем часто операцию необходимо комбинировать с химиотерапией или лучевой терапией. В рамках гормональной терапии применяют тамоксифен (при сохраненном нормальном эстрогенном фоне) и ингибиторы ароматазы (в период менопаузы). Выбор того или иного метода лечения зависит от стадии заболевания и гистологической характеристики опухоли.  Необходимость нового подхода к лечению мастопатии и рака молочной железыПриведенные выше общепринятые методы лечения мастопатий и злокачественных опухолей молочной железы эффективны далеко не во всех случаях, к тому же их применение часто сопровождается существенными отрицательными побочными эффектами. Даже оперативное лечение, которое является наиболее радикальным методом, сопровождаясь обычным хирургическим риском и оставляя после себя косметический дефект, не способно полностью победить болезнь – процент послеоперационных рецидивов достаточно высок. Проблема метастазирования и рецидивирования не может быть решена традиционными методами. Гормональное лечение патологии молочной железы также имеет свои недостатки. Прием наиболее часто назначаемого препарата – такмоксифена – вызывает уменьшение размеров новообразований и снижает риск развития их рецидивов, но при этом повышается вероятность гиперплазии и рака эндометрия, венозной тромбоэмболии, катаракты, а в некоторых случаях – такмоксифен-зависимых форм рака молочной железы. В настоящее время проводятся клинические испытания селективных модуляторов эстрогеновых рецепторов (selective estrogen receptor modulators - SERM), такие как ралоксифен, лишенных побочных эффектов тамоксифена. Одним из ярких представителей новаторских препаратов является герцептин (трастузумаб). Герцептин уникален тем, что его действие избирательно направлено на подавление рецептора HER2, который часто присутствует на поверхности клеток рака молочной железы [17]. Герцептин – моноклональные антитела, которые находят эти рецепторы на клетках и блокируют их. После того как герцептин заблокировал HER2-рецепторы на поверхности раковой клетки, ее дальнейший рост прекращается, а в ряде случаев наблюдается уменьшение опухоли. Кроме того, герцептин обладает дополнительным механизмом противоопухолевого действия, поскольку является мощным медиатором антител-зависимой цитотоксичности. К сожалению, герцептин потенциально может быть эффективен лишь в 25% случаев рака груди (именно такова частота злокачественных опухолей молочной железы, гиперэкспрессирующих протеин HER2). Кроме того, препарат обусловливает многочисленные побочные эффекты, включая кардиотоксичность и возникающую вследствие этого сердечную недостаточность. Другим новаторским препаратом является кселода (капецитабин). Кселода сама по себе не обладает способностью убивать раковые клетки, сначала это соединение должно пройти три этапа превращений в организме человека (18). Последний этап превращений, в результате которого и образуется конечный продукт с цитотоксической активностью, проходит в раковой опухоли. Таким образом, раковая опухоль превращается в "фабрику" по производству яда против самой себя. Это не только увеличивает эффективность действия препарата, но и снижает общее неблагоприятное воздействие на организм в целом. Эти уникальные качества кселоды позволяют говорить о совершенно новом классе противораковых препаратов, которым дано название "туморактивируемых". В настоящее время кселода является первым и пока единственным представителем этого прогрессивного класса лекарств. В последнее время все больше онкологов приходит к выводу, что именно коррекция нарушений со стороны системы иммунитета является ключевым моментом в успешной борьбе с раком [19, 20, 21, 22, 23, 24]. При раке молочной железы повышен уровень гиперэкспрессии маммаглобина А, причем экспрессия ограничена эпителием молочной железы и метастатическими опухолями груди. Таким образом, специфическая иммунотерапия, направленная против маммоглобина А, может стать важным направлением в лечении и предотвращении рака груди [25, 26]. Иммунный надзор над злокачественными клетками может осуществляться путем взаимодействия компонентов системы иммунитета с экспрессированным на поверхности клеток рака груди антигеном MHC II, в норме отсутствующим [27]. С помощью нового метода – проточной цитометрии – было изучено влияние противоопулевой вакцинации на антигенспецифичный Т-клеточный иммунитет у пациенток со злокачественными опухолями груди [28]. Полученные данные свидетельствуют об эффективности противоопухолевой вакцинации. Таким образом, очевидно, что идеальное средство для лечения патологических состояний молочной железы, особенно мастопатий и злокачественных опухолей, должно обладать следующими свойствами: - способностью предотвращать развитие заболеваний;- возможностью решить проблемы метастазирования и рецидивирования;- не вызвать существенных побочных эффектов. Противоопухолевые вакцины – новое направление в лечении злокачественных заболеваний, клинические испытания которых демонстрируют многообещающие результаты как в профилактике, так и в лечении рака груди [29, 30, 31, 32]. Противоопухолевая вакцина РЕСАН – один из этих новых препаратов.  Действие вакцины РЕСАН при патологических состояниях молочной железыВ состав вакцины входят гликопротеины, которые сходны с фрагментами опухольассоциированных антигенов, связанных с клетками рака молочной железы: 1. Ovarian carcinoma antigen CA125 (1A1-3B) (KIAA0049)2. MUCIN 1 (TUMOR-ASSOCIATED MUCIN)3. BREAST CARCINOMA- ASSOCIATED ANTIGEN DF3.4. Cancer associated surface antigen.5. Adenocarcinoma antigen ART1.6. Serologically defined breast cancer antigen NY-BR-15.7. Serologically defined breast cancer antigen NY-BR-16.8. CA 19-9 Гликопротеины, входящие в состав вакцины, имитируют от 6 до 50 фрагментов (длиной 7-30 аминокислотных остатков) каждого из указанных опухолевых антигенов. По данным ряда авторов, такие онкомаркеры, как раково-эмбриональный антиген (РЭА), высокомолекулярные антигены СА 125 и СА 19-9, муциноподобный раково-ассоциированный антиген (МРА) позволяют осуществлять мониторинг эффективности проводимого лечения [33, 34]. Таким образом, РЕСАН – противоопухолевая вакцина, которая благодаря своим ксеногенным свойствам способствует формированию адекватного специфического противоопухолевого иммунного ответа, являясь эффективным средством профилактики и лечения мастопатий и злокачественных опухолей молочной железы.  ЗаключениеНесмотря на огромное количество исследований, проводимых в этой области, во всем мире по-прежнему наблюдается рост заболеваемости раком груди. Одной из наиболее распространенных болезней, потенциально опасных в отношении развития рака груди, является дисгормональная гиперплазия молочных желез. Общепринятых средств для профилактики этих заболеваний в настоящее время не существует, а традиционные методы лечения, к сожалению, недостаточно эффективны. В то же время применение вакцины РЕСАН с её широким спектром противоопухолевого действия демонстрирует очевидные преимущества по сравнению со стандартными методами лечения: 1. РЕСАН можно использовать для предотвращения указанных заболеваний, особенно при наличии наследственной предрасположенности (рака груди у родственниц), или для профилактики озлокачествления доброкачественных образований молочной железы. 2. Вакцину можно использовать в сочетании с хирургическими методами лечения (см. Наиболее рациональное применение вакцины РЕСАН при лечении злокачественных опухолей) для уничтожения метастазов небольших размеров и предотвращения рецидивов рака груди после оперативного вмешательства, что может привести к полному излечению опухоли. 3. Вакцинотерапию можно комбинировать с гормональной терапией или биотерапией (например, герцептином) для увеличения суммарного терапевтического эффекта, сведения к минимуму побочных эффектов и снижения дозы гормональных препаратов. 4. Применение РЕСАНа может значительно уменьшить болевой синдром и общее состояние у пациенток с поздними стадиями рака груди и наиболее агрессивными злокачественными опухолями. 5. Вакцинотерапия РЕСАН не сопровождается существенными побочными эффектами. Вакцина РЕСАН способна изменить устоявшиеся представления врачей и пациентов о лечении рака, которое до сих пор ассоциируется с выпадением волос, угнетением функции кроветворной системы и связанными с этим другими осложнениями.  Информационные источники1.Grio R., Cellura A., Germao R. et al. // Minerva Girncolegica. 1998. Vol. 50 N3. P. 101-103. 2.Kotller M. L., Stwrzec A., Carre M. C. et al. // Int J Cancer. 1997. Vol. 71. N 4. P. 595-599. 3.Online management of breast diseases, Benign Breast Lesions. TransMed Network 4.Диагностика заболеваний молочных желез В. Н. Серов, Т. Т. Тагиева, В. Н. Прилепская Научный центр акушерства, гинекологии и перинатологии (дир.-акад. РАМН В. И. Кулаков). Интерактивно. 5.Сидоренко Л. Н. Молочная железа. Как уберечь себя от рака. 1998. 6.Armstrong, K., Eisen, A., & Weber, B. (2000) Primary Care: Assessing the Risk of Breast Cancer. The New England Journal of Medicine, 342(8), 564-571. Goldhirsch, A., Glick, J.H., Gelber, R.D., Coates, A.S., Senn, H-J. (2001) 7.Breast Cancer Risk Factors. Интерактивно. 8.Weiss MC, Fowble BL, Solin LJ, et al.: Outcome of conservative therapy for invasive breast cancer by histologic subtype. Int J Radiat Oncol Biol Phys 23 (5): 941-7, 1992. [PUBMED Abstract] 9.Wazer DE, Schmidt-Ullrich RK, Schmid CH, et al.: The value of breast lumpectomy margin assessment as a predictor of residual tumor burden. Int J Radiat Oncol Biol Phys 38 (2): 291-9, 1997. [PUBMED Abstract] 10.Консервативное лечение фиброзно-кистозной болезни молочной железы (мастопатии)Д. Балтиня, А. Сребный Латвийский научно-исследовательский институт клинической и экспериментальной медицины, Рига (Латвия). 11.Keshelava V.V. // New treatment and diagnostic means in oncology. International Medical Journal 5' 2000 p. 457-459. 12.The use of Tamoxifen (Breast Cancer Drug) is Questioned in Dutch Study because of a higher incidence of Endometrial Cancer. By Denise Grady не находит страницу 13.Selective estrogen receptor modulation: the search for an ideal hormonal therapy for breast cancer. Dhingra K.Hoffmann-La Roche, Inc., Nutley, New Jersey 07110, USA. Cancer Invest 2001;19(6):649-59 14.Oncolinks. Breast Cancer: The Basics. Christopher Dolinsky, MSIV The University of Pennsylvania Cancer Center, May 29, 2002. 15.Meeting Highlights: International Consensus Panel on the Treatment of Primary Breast Cancer. Journal of Clinical Oncology, 19(18), 3817-3827. 16.Hortobagyi, G.N., (1998) Drug Therapy: Treatment of Breast Cancer. The New England Journal of Medicine, 339(14), 974-984. 17.Herceptin® (Trastuzumab). Genentech, Inc.1 DNA Way South San Francisco, CA 94080-4990 18.XELODA® (capecitabine). Mechanism of Action. 19.Kruger, W. et al. Reverse transcriptase/polymerase chain reaction detection of cytokeratin-19 mRNA in bone marrow and blood of breast cancer patients. / J. Cancer Res. Clin. Oncol. 1996, 122 (11), 679-686. 16. Ethier, S. P. et al. 20.Differential isolation of normal luminal mammary epithelial cells and breast cancer cells from primary and metastatic sites using selective media. / Cancer Res. 1993, 53 (3), 627-635. 21.Immunogenicity and immune response in breast cancer. Carasevici E. Department of Immunology, Faculty of Medicine, Gr. T. Popa University of Medicine and Pharmacy, Iasi, Romania. Roum Arch Microbiol Immunol 2001 Oct-Dec;60(4):285-96 22.Natural anti-Gal antibody as a universal augmenter of autologous tumor vaccine immunogenicity. Immunology Today. vol.18, No. 6, june 1997, pp. 281-285. Uri Galili and Denise C. LaTempl. 23.Tumor antigens recognized by T cells. Immunology Today. Thierry Boon, Pierre G. Coulie and Benoit Van den eyde. vol.18, No. 6, june 1997, pp. 267-268. 24.Analysis of endogenous peptides bound by soluble MHC class I molecules: a novel approach for identifying tumor-specific antigens. Eur J Immunol 2002 Jan;32(1):213-22. Barnea E, Beer I, Patoka R, Ziv T, Kessler O, Tzehoval E, Eisenbach L, Zavazava N, Admon A.The Smoler Protein Center, Department of Biology, Technion, Haifa, Israel. 25.Stress, coping, and immune function in breast cancer. Luecken LJ, Compas BE. Department of Psychology, Arizona State University, Tempe 85287, USA. Ann Behav Med 2002 Fall; 24(4):336-44. 26.Identification of HLA-A3-restricted CD8+ T cell epitopes derived from mammaglobin-A, a tumor-associated antigen of human breast cancer. Jaramillo A, Majumder K, Manna PP, Fleming TP, Doherty G, Dipersio JF, Mohanakumar T. Department of Surgery, Washington University School of Medicine, St. Louis, MO, USA. Int J Cancer 2002 Dec 10;102(5):499-506. 27.Major histocompatibility complex class II antigen and costimulatory molecule expression on the surface of breast cancer cells. Fan P, Wang S, Liu X, Zhen L, Wu Z. Department of General Surgery, First Hospital, Nanjing Medical University, Nanjing 210029, China. Zhonghua Zhong Liu Za Zhi 2002 Jul;24(4):327-30. 28.Impact of high-dose chemotherapy on antigen-specific T cell immunity in breast cancer patients. Application of new flow cytometric method. Svane IM, Nikolajsen K, Hansen SW, Kamby C, Nielsen DL, Johnsen HE. Department of Oncology, Herlev Hospital/University of Copenhagen, DK-2730 Herlev, Denmark. Bone Marrow Transplant 2002 Apr;29(8):659-66. 29.Pantel, K. et al. / Establishment of micrometastatic carcinoma cell lines: a novel source of tumor cell vaccines. / J. Natl. Cancer Inst. 1995, 87 (15), 1162-1168. 15. 30.The most important part in defeating cancer is a well working immune system... Интерактивно. 31.The present and future of cancer vaccines – a measured perspective... Интерактивно. 32.How to find current cancer vaccine clinical trials? 33.Vecchione A. New and old in prognosis determination. 1993, Nov-Dec, 7 (6B0. p.623-636). 34.Yasasever V., Karaloglu D., Erturk N. Diagnostic value of the tumor marcers in breast cancer. Eur. J. Gynaecol Oncol. 1994, 15(1), p. 33-36. www.anticancer.net Оптимальный подход к лечению злокачественных опухолей вакциной РЕСАНЧтобы оптимально использовать резервы системы иммунитета для достижения полного выздоровления при лечении следующих злокачественных опухолей, необходимо выполнение всех указанных ниже рекомендаций:
1. Начальное состояние иммунной системы Для возникновения необходимого иммунного ответа уровень лейкоцитов периферической крови натощак должен быть не менее 4,5·109 в литре, а лимфоцитов должно быть не менее 18%. Если в течение последнего времени больной получал или получает химиотерапевтические средства, лучевую терапию, иммуносупрессивные лекарства, то оптимальный иммунный ответ может не развиться, т. к. нарушается функционирование системы иммунитета, в этом случае требуется время (около 3-6 месяцев) для её восстановления или назначение специальных препаратов (неостим; лейкостим, филграстим, нейпоген, граноцит; дезоксинат, деринат).
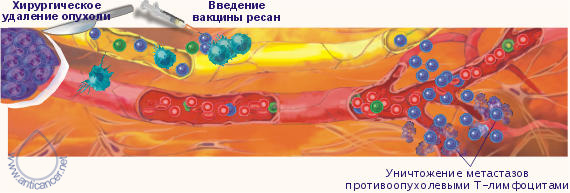
Рис. 1. Опухоль диагностирована 2. Хирургическое удаление опухоли и применение вакцины РЕСАН Хирургическое удаление первичной опухоли и всех видимых метастазов, введение препарата РЕСАН за 7-10 дней до проведения данной операции. Препарат вводится в течение 1-го дня (упаковка 9 флаконов по 200 мг). Если вакцину не удалось ввести до операции, её можно применить и в послеоперационном периоде. В этом случае введение вакцины следует проводить через 2 недели после операции. Вакцину можно вводить и после этого срока, но чем раньше применена вакцина, тем выше эффективность лечения.
Рис. 2. Оперативное лечение и иммунотерапия 3. Применение L-тироксина После введения вакцины РЕСАН необходимо принимать L-тироксин в дозе 25 мкг, ежедневно утром под язык, после завтрака, в течение 4-х месяцев. Тироксин – гормон щитовидной железы, улучшающий работу системы иммунитета. Он стимулирует обмен белков, увеличивает число и функциональную активность естественных киллеров (NK-клеток). 4. Введение γ-интерферона Схема введения γ-интерферона выбирается индивидуально. γ-Интерферон начинают вводить на 7-14 день после окончания инъекций РЕСАН.Синонимы лекарственной формы γ-интерферона: ингарон, имукин, актиммун (ingaron, imukin, actimmune). 5. Соблюдение аглютеновой диеты В тех случаях, когда у пациента имеется повреждение ворсинок тонкого кишечника, необходимым условием достижения результатов иммунотерапии является соблюдение аглютеновой диеты. При повреждении ворсинок тонкого кишечника нарушается обмен веществ, а в крови пациентов обнаруживают антитела к глиадину, трансглютаминазе и ретикулину (Gliadin Antibodies, IgA и IgG; Endomysial Antibody, IgA; Reticulin Antibody, IgA). Пациентам, которым планируется применение вакцины РЕСАН, желательно произвести исследование сыворотки крови на наличие этих антител, а при обнаружении их повышенных титров необходимо строгое соблюдение аглютеновой диеты для развития полноценного ответа на введение вакцины РЕСАН. Если возможность обследования на указанные выше антитела отсутствует, то для улучшения результатов иммунотерапии вакциной РЕСАН за 10 дней до вакцинации следует назначать аглютеновую диету, которую больной должен соблюдать, как минимум, 2 месяца после вакцинации (оптимально 1 год). Больные с глютеновой энтеропатией (целиакией) должны соблюдать аглютеновую диету постоянно. Для соблюдения аглютеновой диеты необходимо исключить из рациона употребление продуктов из пшеницы, ржи, ячменя, овса. Можно употреблять гречку, просо, рис, картофель, кукурузу, сою, фасоль, горох и другие продукты. 6. Ревакцинация Первая ревакцинация проводится через 6 месяцев после введения вакцины РЕСАН, вторая ревакцинация через – 1,5 года, в дальнейшем ревакцинация необходима каждые 3 года (однократное введение 400-800 мг вакцины РЕСАН по специальной схеме).
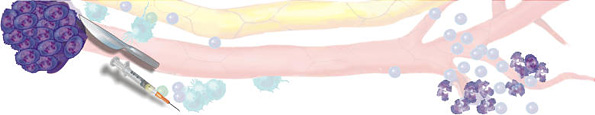
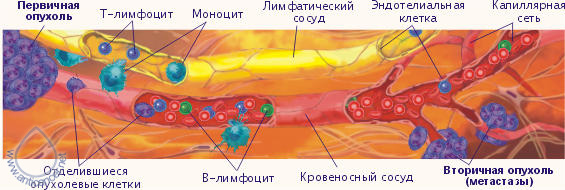
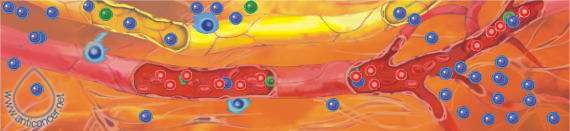
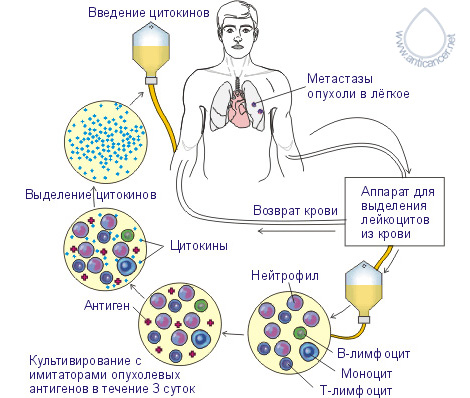
Рис. 3. Иммунокомпетентные клетки патрулируют отвоёванную территорию www.anticancer.net Иммунотерапия в лечении рака поздней стадииК сожалению, у большого количества пациентов рак диагностируют в поздних стадиях, когда появляются очевидные клинические признаки. К этому времени, как правило, уже имеются видимые или невидимые метастазы, которые являются главными причинами неудач в лечении, развития рецидивов, распространения опухоли и резкого сокращению продолжительности жизни. Даже у пациентов с раком, выявленным на ранних стадиях, стандартная жёсткая схема традиционного лечения с использованием химио- и/или лучевой терапии не может решить главную проблему онкологии – предотвращение рецидивов. Поэтому в течение последних десятилетий Национальный Институт Рака США (NCI) и другие авторитетные учреждения и учёные ищут новые методы, которые могли бы решить эти проблемы. В противораковой борьбе своими многообещающими результатами выделяется иммунотерапия (главным образом, применение противораковых вакцин). Единственная вещь, сдерживающая распространение иммунотерапии – фактор времени. Требуется минимум 10-15 лет, прежде чем любая новая вакцина и метод лечения может появиться на фармацевтическом рынке как средство стандартной терапии. Противоопухолевая вакцина РЕСАН может быть использована для воздействия на раковые образования поздних стадий, мобилизуя противораковый иммунотерапевтический потенциал. Для этого мы разработали два главных подхода, включающие самые последние иммунотерапевтические методы – экстракорпоральная активация противораковых иммунокомпетентных клеток (EAAIC) и комплексная иммунотерапия рака.  Комплексная иммунотерапия злокачественных опухолей В организме существует сетевая иммунологическая защита, то есть функции одних иммунокомпетентных клеток частично перекрываются другими, благодаря чему система работает устойчиво. Развитие злокачественной опухоли указывает на прорыв сетевой защиты. Поэтому для лечения злокачественных опухолей необходимо использовать комплексную иммунотерапию. Она включает:1) максимальное удаление первичной опухоли и видимых метастазов;2) применение противораковой вакцины;3) использование цитокинов;4) использование тироксина;5) дезинтоксикационную терапию. Вакцина вводится за 7-12 дней до операции, что наиболее предпочтительно, или через 7-14 дней после операции. Если в эти сроки ввести вакцину не удалось, её можно вводить и позже, но чем раньше введена вакцина, тем лучше результаты иммунотерапии. Важным условием успешного применения вакцины является состояние системы иммунитета больного. Если ориентироваться на общий анализ крови, то вакцину целесообразно применять тогда, когда уровень лейкоцитов в периферической крови натощак не ниже 4,5X109 в л, а процент лимфоцитов – не менее 18. Если ориентироваться на результаты иммунного статуса, то количество CD4 лимфоцитов должно быть не менее 350 в 1 мкл, а количество CD8 лимфоцитов не менее 280 в 1 мкл периферической крови. Важным этапом комплексной иммунотерапии является применение цитокинов. Дозы и кратность введения цитокинов зависят от состояния системы иммунитета и времени применения вакцины. Интерлейкин-1α (ИЛ-1α) усиливает сниженный противоопухолевый иммунитет, замедляет рост опухоли и снижает её метастатический потенциал. ИЛ-1α необходимо применять до введения вакцины, если CD4 ИЛ-1α в данном случае необходимо вводить ежедневно, 5 дней, внутривенно, капельно в течение 30-40 минут, в дозе 15 нг на кг веса. Изменение иммунного статуса после курса ИЛ-1α
После улучшения показателей иммунного статуса вводят вакцину. После введения вакцины проводят курсы поддерживающей иммунотерапии ИЛ-1α в течение 6-12 месяцев. Поддерживающий курс проводят 1 раз в 2 месяца, он состоит из двух ежедневных введений в дозе 15 нг на кг веса, даже если количество CD4>350, а CD8>280. Если количество лимфоцитов снизилось ниже указанных границ (CD4 Интерлейкин-2 (ИЛ-2) применяют через 10-14 суток после введения вакцины в дозе 100000-125000 МЕ на м2 поверхности тела в день, внутривенно капельно, в течение 4 часов. Курс лечения состоит из 15-60 введений. Затем проводят поддерживающую иммунотерапию ИЛ-2 в течение 6-12 месяцев, с интервалом 2 месяца. ИЛ-2 вводят ежедневно, 4 дня, в дозе 125000 МЕ на м2. Гамма-интерферон (ИФН-γ) применяется по следующей схеме: внутримышечное введение 1000000 МЕ ИФН-γ через день – 1 месяц, затем 2 месяца – 1 раз в неделю. Гамма-интерферон начинают вводить через день после инъекций вакцины РЕСАН. Если есть возможность во время основного курса иммунотерапии доставлять ИЛ-2 и ИФН-γ непосредственно к опухоли, то это наиболее предпочтительный вариант. Обязательным условием комплексной иммунотерапии является применение L-тироксина. Его принимают по 25 мкг, под язык, утром, ежедневно в течение 4-6 месяцев. Затем его медленно отменяют, снимая по 25 мкг (один приём) в неделю. Дезинтоксикационную терапию проводят с использованием энтеральных, а при необходимости и парэнтеральных препаратов. Часто иммунотерапию приходится проводить после курсов химио и лучевой терапии, когда система иммунитета находится в подавленном состоянии. В этом случае необходимо использовать ДЕЗОКСИНАТ. Дезоксинат может применяться и профилактически перед началом цикла химио и лучевого лечения, особенно повторного, в ходе его или после его окончания. Показанием для профилактического применения препарата является наличие лейкопенического и тромбоцитопенического фона до начала химио- или лучевой терапии (лейкоциты менее 3,5·109/л, тромбоциты менее 150·109/л, соответственно), выраженная лейко и тромбоцитопения, развившаяся при предыдущем цикле химио или лучевой терапии (2,5·109/л и 100·109/л, соответственно). В случае лейкопении и/или тромбоцитопении, возникших в период проведения курса химио и лучевой терапии или после его окончания, показаниями к назначению дезоксината служит снижение содержания лейкоцитов в периферической крови до 2,0·109/л, тромбоцитов - 100·109/л и менее. Сначала применяют однократное введение 0,5% раствора, внутримышечно или подкожно, в объёме 15 мл (лучше вводить в 3 точки по 5 мл). Затем дезоксинат вводят по 5 мл 1 раз в 3 дня, делая 10 таких инъекций. После этого - перерыв 1 месяц, а далее вводят дезоксинат по 5 мл 1 раз в неделю, делая 7 таких инъекций.  Предупреждение и лечение кахексии При наблюдении за онкологическим больным необходимо проводить регулярное взвешивание (1 раз в 2 месяца), так как у 50-80% больных с прогрессирущим раком развивается кахексия. На неё указывает потеря более 5% веса от исходного (преморбидного - premorbid), в пределах шестимесячного периода. Кахексия – слово греческого происхождения, состоящее из двух слов: "kakos" – плохой и "hexis"– состояние. Развитие кахексии указывает на неблагоприятный прогноз и значительное ухудшение качества жизни. Кахексия является главной причиной смерти больных раком. Она является следствим гиперметаболизма, характерного для многих больных раком. Клиническими проявлениями гиперметаболизма могут быть усталость, апатия (apathy), депрессия. Изменения затрагивают белковый, жировой, углеводный и энергетический обмен. Для предотвращения развития и лечения кахексии назначают: 1) перитол (Cyproheptadinum) по 4 мг 4 раза в день, ежедневно, постоянно. 2) дексаметазон (Dexamethasonum) по 4 мг 1 раз в день, ежедневно, в течение 1 недели. Предпочтительнее принимать дексаметазон утром во время завтрака. Если отмечается улучшение аппетита, то дексаметазон принимают постоянно, а если аппетит не улучшился, дексаметазон отменяют и назначают Medroxyprogesterone в дозе 500 мг 2 раза в день. Если Medroxyprogesterone отсутствует, можно назначить Megestrol acetate по 40 мг 4 раза в день. При отсутствии эффекта дозу препарата увеличивают в 2 раза (по 80 мг 4 раза в день), при отсутствии эффекта от такой дозы переходят на приём препарата по 100 мг 4 раза в день. Если аппетит не улучшается, назначают Megestrol acetate по 200 мг 4 раза в день. 3) ибупрофен (Ibuprofenum) по 400 мг, 3 раза в день, ежедневно или индометацин (Indomethacinum) по 50 мг, 2 раза в день, ежедневно. 4) альмагель по 1 чайной ложке за 30-20 минут до приёма ибупрофена или индометацина. 5) активированный уголь по 2 грамма на ночь, ежедневно. 6) рыбий жир по 1 чайной ложке в неделю.  Снижение болевого синдрома Применение вакцины РЕСАН приводит к стойкому, длительному повышению функциональной активности натуральных киллеров – CD56-позитивных лимфоцитов. Увеличивается их цитотоксическая активность и продукция β-эндорфина. β-эндорфин обладает выраженным обезболивающим и седативным действиями, повышение его уровня после вакцинации предотвращает развитие болевого синдрома или замедляет прогрессирование боли у большинства пациентов.  Экстракорпоральная активация противораковых иммунокомпетентных клеток Перспективным направлением иммунотерапии поздних стадий раковых образований является экстракорпоральная (вне организма) активация вакциной РЕСАН иммунокомпетентных клеток крови и использование продуктов этой активации для лечения. В результате активации лейкоцитов можно получать собственные цитокины ранней фазы иммунного ответа конкретного пациента и возвращать их обратно в оптимальных, физиологически сбалансированных соотношениях. Благодаря тому, что эти цитокины собственные и они не являются чужеродными, против них не образуются антитела, в отличие от введения рекомбинантных цитокинов, и поэтому активность собственных цитокинов сохраняется постоянно высокой, повышая эффективность проводимой иммунотерапии. Получение цитокинов ранней фазы иммунного ответа
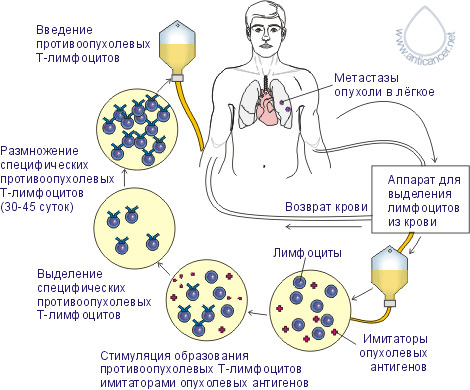
Рис. 1 Используя вакцину для экстракорпоральной активации лимфоцитов, можно провести селекцию клонов лимфоцитов, активных против конкретной опухоли пациента. Затем эти высокоактивные лимфоциты размножают и возвращают их обратно пациенту, значительно повысив тем самым противоопухолевый иммунный ответ. Эти два метода можно использовать как самостоятельно, так и вместе. Они могут проводиться только в клиниках, оснащённых специальным оборудованием для сепарации клеток крови и работы с культурой клеток. Получение противоопухолевых Т-лимфоцитов
Рис. 2  www.anticancer.net |
г.Самара, ул. Димитрова 131 [email protected] |
 |

 Разработанный учеными США препарат Provenge заставляет иммунную систему пациента бороться со злокачественными опухолями, сообщает «Медлинкс». Как известно, традиционные вакцины защищают здоровых людей, а созданная в США вылечивает уже больных.
Разработанный учеными США препарат Provenge заставляет иммунную систему пациента бороться со злокачественными опухолями, сообщает «Медлинкс». Как известно, традиционные вакцины защищают здоровых людей, а созданная в США вылечивает уже больных.  Что такое мастопатия и рак груди?
Что такое мастопатия и рак груди? Гиперплазия (увеличение количества клеток)
Гиперплазия (увеличение количества клеток) Рис. 1. Различные стадии патологических изменений молочной железы
Рис. 1. Различные стадии патологических изменений молочной железы