|
|
||||||||||
|
Котримоксазол (триметоприм и сульфаметоксазол). Триметоприм группа антибиотиковТриметоприм | Info-Farm.RUТриметоприм — синтетический антибиотик, который является производным диаминопиримидину, который применяется перорально и парентерально. Фармакологические свойстваТриметоприм — синтетический антибактериальный препарат, по химическому строению является производным диаминопиримидину, что применяется перорально и парентерально. Триметоприм бактериостатическое действие. По механизму действия препарат относится к ингибиторам дигидрофолатредуктазы. Триметоприм ингибирует метаболизм бактерий и простейших, нарушая синтез фолиевой кислоты путем блокирования фермента дифолатредуктазы. К препарату чувствительны являются следующие возбудители: стафилококки, стрептококки, клебсиеллы, Escherichia coli, сальмонеллы, шиґелы, нейссерии, Proteus spp., Листерии, Enterobacter spp., Bacillus spp., Citrobacter spp., Serratia spp., Haemophilus spp., Morganella morganii , Nocardia spp., а также некоторые простейшие — токсоплазмы, пневмоцисты. Нечувствительными к препарату является Enterococcus spp., Pseudomonas spp. и большинство анаэробных бактерий. ФармакологическиеТриметоприм быстро всасывается из желудочно-кишечного тракта, максимальная концентрация в крови препарата достигается в течение 1-2 часов. Биодоступность триметоприма при пероральном применении составляет 90-100%, при внутривенном применении составляет 100%. Препарат хорошо связывается с белками плазмы (на 45%). Препарат создает высокие концентрации в большинстве тканей и жидкостей организма, особенно в печени, почках и жидкостях организма. Триметоприм хорошо проходит через гематоэнцефалический барьер. Препарат проходит через плацентарный барьер и выделяется в грудное молоко. Триметоприм частично метаболизируется в печени с образованием активных метаболитов. Период полувыведения составляет 9-13 часов. Выводится триметоприм из организма преимущественно почками в неизмененном виде, частично почками в виде активных метаболитов, частично с калом и желчью. При почечной недостаточности период полувыведения может возрастать до 50 часов, у новорожденных это время составляет 19 часов. Показания к применениюТриметоприм как самостоятельный препарат применяют для лечения инфекций мочевыводящих путей. В сочетании с сульфаметоксазол или другими сульфаниламидными препаратами триметоприм применяют для лечения при остром отите, пневмоцистной пневмонии, дизентерии, токсоплазмоз, нокардиозе, диареи путешественников. Препарат может применяться в комбинации с дапсоном для лечения пневмоцистной пневмонии. Побочное действиеПри применении триметоприма самостоятельно побочные эффекты препарата не очень частыми. Наблюдаются чаще высыпания на коже, синдром Стивенса-Джонсона, диарея, тошнота, рвота, ухудшение аппетита, боли в животе, нефропатия, головная боль, асептический менингит, метгемоглобинемия, агранулоцитоз, лейкопения, тромбоцитопения, анемия. При применении триметоприма совместно с сульфаметоксазол или другими сульфаниламидами побочные явления наблюдаются значительно чаще, возможно возникновение следующих побочных эффектов:
У больных СПИДом частота побочных реакций, особенно лихорадки, сыпи на коже, лейкопений и увеличение активности аминотрансфераз, значительно повышается. ПротивопоказанияТриметоприм противопоказан при повышенной чувствительности к препарату, мегалобластной анемии, детям раннего возраста, при тяжелой печеночной и почечной недостаточности, беременности и кормлении грудью, дефицит глюкозо-6-фосфатдегидрогеназы. Формы выпускаТриметоприм выпускается в виде таблеток по 0,1 г. В комбинации с сульфаметоксазол или другими сульфаниламидами выпускается в соотношении 5 частей сульфаметоксазола и 1 часть триметоприма. в виде ампул по 5 мл. (400/80 мг) таблеток по 100/20, 200/40, 400/80 и 800/160; и сиропа для приема внутрь по 0,24 мг / 5 мл. Применение в ветеринарииТриметоприм применяется в ветеринарной практике для лечения телят, ягнят, козлят, свиней и домашней птицы (кур-бройлеров) при заболеваниях пищеварительной системы и мочевыводящих путей (в сочетании с сульфадиазином) для лечения инфекций мочевыводящих путей или с профилактической целью самостоятельно и для лечения инфекций дыхательной системы, пищеварительной системы, мочеполовой системы, мастита, септицемии, послеродовых инфекций, инфекций ушных раковин, глаз и ротовых ран у крупного рогатого скота, лошадей и собак (в поенанни с сульфадиазином) для лечения желудочно-кишечных инфекций у телят, коз, свиней, овец, домашней птицы в сочетании с колистином. info-farm.ru АнтибиотикиРациональная антибактериальная химиотерапия в ветеринарии Естественный отбор на фоне широкого применения антибиотиков и синтетических противомикробных средств в гуманной и ветеринарной медицине постоянно приводит к появлению резистентных штаммов микроорганизмов. На стороне микробов – высокий потенциал наследственной изменчивости, на стороне человечества – мощь науки и ограниченные приспособительные ресурсы прокариот, к которым относятся бактерии. Согласно широко распространенному мнению практических врачей, высокую чувствительность и медленное образование резистентности бактерии проявляют именно к синтетическим антибактериальным средствам (фторхинолонам, триметоприму, сульфаниламидам, нитрофуранам, метронидазолу), а также к полусинтетическим, химически модифицированным антибиотикам (пенициллинам, цефалоспоринам, макролидам, тетрациклинам, аминогликозидам). Таким образом, основной способ повышения эффективности противомикробной терапии – это применение «незнакомых» для микроорганизмов, не встречающихся в природе противомикробных средств. Классификация Антибактериальные средства можно классифицировать по типу действия и химической структуре (см. Таб.1). Таблица 1. Классификация антибактериальных химиотерапевтических средств.
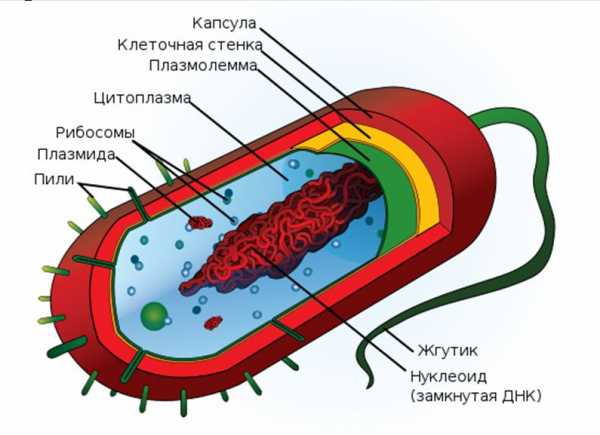
Механизмы резистентности к антибактериальным химиотерапевтическим средствам Резистентность микроорганизмов к антибиотикам и синтетическим антибактериальным средствам возникает путем мутаций и рекомбинаций геномов. Причем сами антибактериальные средства являются лишь фактором отбора измененных клеток. Бактерии способны получать генетическую информацию, кодирующую резистентность, не только при вертикальной передаче от материнской клетки к дочерним, но и при горизонтальной передаче с помощью плазмид, траспозонов и вирусов, а также при конъюгации и трансформации. Потомство измененной бактериальной клетки, если эти изменения закрепились в геноме, будет устойчиво в той или иной мере к антибактериальному средству или к целой группе таких средств, если механизм резистентности является общим для всей группы препаратов. Так возникает перекрестная устойчивость ко многим препаратам одной или даже нескольких группы. Типичный пример – перекрестная резистентность к бета-лактамным антибиотикам. Резистентность к антибактериальным средствам обеспечивается следующими основными механизмами: 1. Предотвращение попадания антимикробного средства в клетку (левомицетин) 2. Ускорение вывода антимикробных средств из микробной клетки (фторхинолоны) 3. Разрушение или изменение антимикробного средства в клетке или во внешней среде (бета-лактамы, аминогликозиды) 4. Модификация рецептора-мишени к антимикробному средству, делающая невозможным их соединение (тетрациклины, сульфаниламиды, фторхинолоны) 5. Образование обходного метаболического пути, не блокируемого антибактериальным средством (сульфаниламиды, триметоприм) Микроорганизмам сложнее выработать резистентность к противомикробному средству, если они используют механизм модификации рецептора-мишени, а противомикробное средство воздействует на 2 и более рецепторов. Фторхинолоны одновременно воздействуют на ДНК-гиразу и топоизомеразу IV бактерий. Частота мутаций у бактерий невысока. Например, вероятность возникновения у туберкулезных микобактерий мутаций, опосредующих устойчивость, составляет: 3,32 x 10-9 на одно деление клетки для рифампицина; 2,56 x 10-8 для изониазида; 2,29 x 10-8 для стрептомицина; 1,0 x 10-7 для этамбутола. Вероятность возникновения одновременно двух мутаций, приводящих к изменению двух рецепторов, в этом случае менее 10-15, что значительно меньше популяции бактерий в организме. Так же исчезающе мала вероятность возникновения в одной микробной клетке генетической информации, кодирующей резистентность одновременно к двум антибактериальным препаратам. Однако со временем, с помощью горизонтального переноса генетической информации, резистентность все же может появиться. С целью нейтрализации уже появившейся устойчивости бактерий к антибактериальным средствам используют три основных метода: 1. Химическая модификация природных антимикробных средств (например, использование полусинтетических макролидов вместо природного эритромицина) 2. Использование ингибиторов микробных ферментов, разрушающих антибиотики (например, использование пенициллинов вместе с ингибитором бета-лактамаз - клавулановой кислотой) 3. Использование синтетических противомикробных средств, против которых у бактерий нет механизмов устойчивости Для предотвращения появления резистентности у чувствительных штаммов микроорганизмов необходимо: 1. Не применять антимикробные препараты без явной необходимости 2. Антимикробные препараты применять в рекомендуемых дозах, выдерживая курс лечения 3. Чередовать антибактериальные препараты из разных групп 4. Комбинировать 2 или более антибактериальных препарата Дорогая плата за резистентность Прокариоты (см. Рис.1), к которым относятся бактерии, обладают гораздо более слабыми защитными и компенсаторными возможностями по сравнению с эукариотами, к которым относимся мы с вами. У прокариот отсутствуют митохондрии, обеспечивающие эукариот энергией. Из-за этого энергетические возможности бактерий значительно ниже. Нет эндоплазматического ретикулума, аппарата Гольджи, лизосом, клеточного ядра, отсутствует эндоцитоз. Прокариотические клетки меньше эукариотических в 100-1000 раз. Любая лишняя синтезируемая бактериями молекула ухудшает их шансы в конкурентной борьбе. Поэтому резистентные бактерии в отсутствие селекционного фактора, антимикробного препарата, постепенно вытесняются не резистентными бактериями. Таким путем восстанавливается чувствительность штаммов бактерий по истечении определенного периода времени, когда бактерии не подвергались воздействию антибактериального препарата. По клиническим наблюдениям этот срок составляет от нескольких месяцев до нескольких лет. Рисунок 1. Строение прокариотической клетки (цитируется на основании лицензии Creative Commons Attribution-ShareAlike)
Стратегия и тактика применения антибиотиков в ветеринарной медицине Дезинфекция, гигиена содержания Необходимо снизить количество патогенных бактерий во внешней среде, поскольку она, наряду с организмом животного, является резервуаром возбудителей инфекционных заболеваний. Объектом дезинфекции являются конструкционные поверхности, кормушки, поилки и прочее оборудование. Для снижения микробного загрязнения воздушной среды и создания благоприятного микроклимата важно поддерживать нормальные параметры воздухообмена, температуры, влажности и освещенности в животноводческих помещениях. Применяем то, что эффективно Как не парадоксально, ветеринарный врач, обслуживающий крупные хозяйства, зачастую имеет больше возможностей для постановки правильного этиологического диагноза и определения чувствительности выделенной микрофлоры к антибактериальным средствам, чем врач гуманной медицины, имеющий дело с одним пациентом и, в большинстве случаев, применяющий антимикробную терапию эмпирически, без лабораторной диагностики чувствительности к антибактериальным препаратам. Применение эффективных против данного возбудителя препарата или препаратов – критически важно для успеха антимикробной терапии. Существует несколько методов определения чувствительности к антибактериальным препаратам, важнейшие из которых диско-диффузный метод и метод последовательных разведений. Диско-диффузный метод дешевле и проще, но метод последовательных разведений точнее и позволяет определить минимальную ингибирующую концентрацию препарата для данного микроорганизма. Для объективной оценки чувствительности выделенной культуры бактерий к антибактериальному препарату, необходимо выполнить несколько условий. Ниже перечислены основные ошибки, приводящие к необъективному результату. Диско-диффузный метод: 1. Завышенное или заниженное содержания антимикробного препарата в диске 2. Неверная оценка зоны задержки роста бактерий 3. Неверная интерпретация зоны задержки роста бактерий 4. Неподходящая питательная среда Метод последовательных разведений: 1. Ошибки при изготовлении раствора антимикробного препарата (неподходящий растворитель, неполное растворение, ошибки в расчетах концентрации) 2. Неподходящая питательная среда 3. Неверная оценка роста или отсутствия роста бактерий Объективные результаты при использовании обоих методов можно получить только при тщательной стандартизации всех этапов исследования. Самая неочевидная, но, возможно, самая распространенная ошибка – применение неподходящей питательной среды. Поскольку катионы двухвалентных металлов отрицательно влияют на активность многих антибактериальных средств, в частности тетрациклинов и фторхинолонов [2], их содержание должно не превышать 35 мг/л для Mg2+ и 100 мг/л для Са2+. Кроме того, концентрация тимидина должна быть меньше 50 нг/л, поскольку тимин и тимидин препятствуют проявлению антибактериальных свойств сульфаниламидов и триметоприма. Для контроля среды на наличие антагонистов сульфаниламидных препаратов и триметоприма рекомендуется использовать штамм Enterococcus faecalis ATCC 29212. При величине зоны ингибиции вокруг диска, содержащего 1.25/23.75 мкг триметоприма/сульфаметоксазола, 20 мм и более среду следует признать удовлетворительной по качеству. Питательная среда также должна быть стерильной и подходящей для роста испытуемого штамма микроорганизмов. Антимикробная активность in vitro и in vivo может значительно отличаться. Это связано с ошибками определения антимикробной активности в лабораторных условиях, а также с фармакокинетическими особенностями антибактериальных препаратов, в частности с их избирательным накоплением в отдельных органах и тканях, скоростью выведения и образованием метаболитов, которые могут быть более активными или менее активными, чем исходное вещество. Бывает так, что вещество, продемонстрировавшее в лабораторных условиях более высокую антибактериальную активность, после применения на животных показывает меньший терапевтический эффект, чем вещество, продемонстрировавшее in vitro меньшую активность. Комбинированные препараты В последнее время практические ветеринарные врачи большее внимание уделяют антимикробным средствам, содержащим 2 или 3 компонента. Это связано с большей терапевтической эффективностью таких препаратов. Если препарат применяется «в слепую», без определения чувствительности выделенных патогенных штаммов к компонентам препарата, то вероятность получить ожидаемый эффект возрастает в 2-3 раза. Если препарат применяется после определения чувствительности, то, врач закономерно ожидает усиление эффекта, что может даже служить основанием к снижению дозы. Усиление эффекта, то есть синергизм, имеет место не при всех сочетаниях антимикробных препаратов. Сочетание бактерицидных антибиотиков, действующих в момент деления микробной клетки, с бактериостатическими препаратами (например, бензилпенициллина с сульфаниламидом) приводит к снижению эффекта. Суммационный синергизм, при котором эффект от сочетания равен сумме эффектов, встречается при сочетании препаратов, принадлежащих к одной группе антимикробных средств, обладающих одним механизмом действия (например, сочетание бензилпенициллина и оксациллина). Потенцированный синергизм, при котором эффект от сочетания больше, чем простая сумма эффектов, встречается при сочетании препаратов с разным механизмом действия. Одним из примеров такого удачного сочетания является препарат «Трифлон», содержащий энрофлоксацин и триметоприм. Энрофлоксацин - противомикробное средство широкого спектра действия из группы фторхинолонов. Механизм действия связан с угнетением бактериальной ДНК-гиразы, что приводит к нарушению репликации ДНК бактерий. Триметоприм - противомикробное средство широкого спектра действия из группы диаминопиримидинов. Механизм его действия связан с угнетением бактериальной редуктазы дигидрофолиевой кислоты. Бактериальная дигидрофолатредуктаза в 50-100 тысяч раз чувствительнее к триметоприму, чем у животных и человека. Триметоприм блокирует один из этапов синтеза нуклеиновых кислот - образование тетрагидрофолиевой кислоты из дигидрофолиевой, которая является субстратом для синтеза нуклеиновых кислот бактерий. Таким образом, оба препарата у микробов действуют на разные звенья одного и того же процесса - синтеза нуклеиновых кислот, что является предпосылкой для проявления потенцированного синергизма. При сочетании антибактериальных средств химиотерапевтического действия важно учитывать фармакокинетические параметры компонентов, которые должны обладать примерно одинаковым периодом полувыведения и проникать в места локализации возбудителя. И триметоприм и энрофлоксацин, вследствие своей высокой липотропности, способны проникать в труднодоступные для более гидрофильных веществ места, создавать там достаточные для проявления выраженного антибактериального действия концентрации. Предотвращение инактивации антибактериальных средств Некоторые антибактериальные химиотерапевтические средства чувствительны к ингибирующим факторам внешней среды. Биодоступность тетрациклинов и фторхинолонов резко снижается в присутствие ионов кальция, магния, железа, меди, свинца. Изменение рН среды в сторону от оптимальной снижает биодоступность макролидов и фторхинолонов, разрушает пенициллины. Фотодеградации под действием солнечного света подвержены фторхинолоны. Сульфаниламиды теряют свою активность при назначении с новокаином. Пенициллины неустойчивы при повышенной температуре. Для предотвращения физической или химической инактивации антибиотиков следует применять их не в виде чистых субстанций, а в виде готовых лекарственных препаратов, содержащих вещества, предотвращающие инактивацию в корме или питьевой воде. Необходимо также оберегать антибиотики от ионов металлов, помещая в неметаллическую посуду и использовать для приготовления растворов нежесткую воду, в идеале - дистиллированную воду. Для предотвращения инактивации бета-лактамных антибиотиков (пенициллинов и цефалоспоринов) бета-лактамазами микроорганизмов полезно сочетание их с ингибиторами бета-лактамаз (клавулановой кислотой, сульбактамом, тазобактамом). Сохранение нормальной микрофлоры Важной задачей во время антибактериальной химиотерапии является сохранение нормальной микрофлоры организма животного. Нарушения нормального микробного биоценоза, особенно биоценоза кишечника, приводит к дисбактериозу – состоянию, когда нормальная микрофлора замещается необычной, либо когда обычная микрофлора локализуется в необычных для себя местах. Типичным примером дисбактериоза является замещение нормальной микрофлоры кишечника грибками рода Candida или анаэробами рода Clostridia. Соответственно развивается кандидоз или некротический энтерит. Для предотвращения развития дисбактериоза следует применять антибиотики узкого спектра действия, что в реальной жизни вступает в противоречие с задачей, которую решает врач при невыясненной этиологии возбудителя. В гуманной медицине давно установлено, что чаще всего дисбактериоз вызывают такие антибиотики, как левомицетин, тетрациклины, клиндамицин. В ветеринарии отмена кокцидиостатических антибиотиков – ионофоров иногда приводит к возникновению некротического энтерита. Если есть возможность, необходимо использовать антибактериальный препарат не системного, а локального действия, например, колистин, который не всасывается в кишечнике и действует только в его просвете. Местно на коже и слизистых оболочках следует вместо антибиотиков применять антисептики, к которым у микроорганизмов резистентность почти не вырабатывается. Дисбактериоз, вызванный одним антибактериальным препаратом, нередко приходится лечить с применением другого препарата, влияющего на замещенную микрофлору. Фармакокинетические особенности действия антибактериальных препаратов Из фармакокинетических параметров антибактериальных средств для практического врача имеют значение такие параметры, как биодоступность, накопление в определенных органах и тканях, период полувыведения и пути выведения препарата. Биодоступность, то есть степень всасывания препарата, отражает долю препарата, поступившую в кровь. Биодоступность зависит, прежде всего, от химической природы вещества, размеров его частиц (чем меньше, тем выше биодоступность), лекарственной формы, наличия вспомогательных веществ, вида животного, свойств воды или корма, а также состояния кишечника (при оральном пути введения). Выше говорилось о влиянии ионов металлов на биодоступность. При оральном введении большое значение имеет состояние кишечника. При поносах поступившие с водой или кормом антибактериальные средства могут не успеть всосаться слизистой оболочкой кишечника и не оказать свое действие. Липофильные, хорошо растворимые в жирах вещества способны легко проникать через мембраны клеток и создавать в органах и тканях высокие концентрации, значительно большие, чем в крови. К таким препаратам относятся триметоприм, фторхинолоны, макролиды. Например, тилмикозин, макролидный антибиотик, накапливается у птиц в тканях легких и воздухоносных мешков в концентрации, превышающей концентрацию в крови соответственно 25 раз и в 16 раз [3]. Гидрофильные вещества, к которым относятся пенициллины и цефалоспорины, хуже проникают через клеточные барьеры и поэтому более эффективны при септицемии, чем при внутриклеточных инфекциях. Амфифильные вещества, к которым относятся фторхинолоны, проявляют смешанные свойства. Период полувыведения препарата, то есть время, в течение которого его концентрация падает в 2 раза, необходимо учитывать при расчете периодичности дачи препарата. Увеличение периода дачи препарата сверх рекомендуемого приводит к снижению терапевтической эффективности и возрастанию риска развития резистентности. Распространенной ошибкой является введение суточной дозы препаратов, имеющих период полувыведения 6-12 часов (например, энрофлоксацина), с питьевой водой в течение рабочего дня, то есть за 8 часов. При этом концентрация энрофлоксацина в течение оставшихся до следующего введения 6-8 часов ниже минимальной ингибирующей концентрации. Пути выведения препарата следует учитывать с целью достижения высокой концентрации препарата в месте локализации патогенных микроорганизмов. Например, гентамицина сульфат практически не всасывается в кровь при оральном введении и выводится с калом. При оральном введении гентамицин эффективен против желудочно-кишечных патогенов, а при инъекционном пути введения – при заболеваниях мочевыводящих путей, поскольку, в этом случае, на 90% выводится с мочой. В случае локализации возбудителя на коже и слизистых оболочках успешная антимикробная терапия бывает, как правило, тогда, когда химиотерапевтическое средство действует через кровь «изнутри» организма, а антисептик – снаружи, со стороны кожи или слизистой оболочки. Одностороннее воздействие часто неэффективно. Трудная для практического врача ситуация может возникнуть при локализации возбудителя на поверхности труднодоступных слизистых оболочек дыхательных путей и мочеполовых органов, когда не удается уничтожить возбудителя применяя только системный антимикробный препарат, а антисептик невозможно применить из-за анатомических особенностей. Применение пробиотиков и пребиотиков Применение пробиотиков (сапрофитных микроорганизмов) и пребиотиков (веществ, стимулирующих рост нормальной микрофлоры), а также кислот, ограничивающих рост патогенной микрофлоры, не может рассматриваться, как альтернатива антибактериальной химиотерапии. Вытеснить патогенную микрофлору, особенно в желудочно-кишечном тракте, без химиотерапевтических препаратов очень непросто. Гораздо большую перспективу имеет применение пробиотиков в период химиотерапии, если пробиотический микроорганизм нечувствителен к действию химиотерапевтического средства (например, Saccharomyces cerevisiae) или непосредственно после неё. Это позволяет не допустить развитие патогенной микрофлоры до того времени, пока начнет восстанавливаться нормальная микрофлора животного. Кроме того, пробиотики довольно дороги. Органические кислоты активно используются в виде кислот или солей в птицеводстве и свиноводстве. К наиболее эффективным препаратам относится муравьиная кислота и ее соли. Считаем деньги В конечном итоге ветеринарная медицина, за исключением антропозоонозных инфекций, руководствуется принципом экономической целесообразности. На первом месте стоит себестоимость продукции. Поэтому практические врачи стремятся получить максимум терапевтической или профилактической эффективности за минимум денег. От цены антибактериального препарата напрямую не зависит себестоимость продукции, поскольку необходимо учитывать ряд других факторов: периодичность и продолжительность лечения, трудозатраты на антибактериальную терапию, возможность возникновения рецидивов, период ожидания после применения препарата, когда нельзя использовать продукцию от животного, возможность возникновения резистентных штаммов микроорганизмов, влияние на продуктивность и качество животноводческой продукции. Нередко более дорогой препарат за счет большей эффективности или за счет меньшей курсовой дозы оказывается экономически более выгодным, чем более дешевый. Литература
Кузьмин А.А., кандидат ветеринарных наук Боровко А.Н., ветеринарный врач, ООО «АТ Биофарм» zoovetcnab.ru Возвращение забытого антибиотика: триметопримСкарлатину, кожные инфекции и инфекции горла часто вызывает бактерия, называемая пиогенный стрептококк (Streptococcus pyogenes). В слаборазвитых странах для лечения стрептококковой инфекции зачастую недорогие и хорошо усваиваемые антибиотики недоступны. Ученые из Центра исследования инфекционных заболеваний имени Гельмгольца (HZI), расположенного в г. Брауншвейг, Германия, обнаружили, что выходом в данной ситуации может стать антибиотик триметоприм. Вопреки устоявшемуся мнению, бактерии, как правило, не обладают устойчивостью к данному веществу. В публикации «Антимикробные агенты и химиотерапия» ученые показали три пути развития устойчивости – это означает, что стрептококки могут легко приобрести устойчивость к антибиотикам и быстро передать признаки. Бактерия пиогенный стрептококк (Streptococcus pyogenes) вызывает не только скарлатину, детское заболевание, характеризующееся появлением характерной сыпи на коже, но и гнойные инфекции на коже. У этой инфекции могут быть серьезные последствия, такие как острая ревматическая лихорадка и воспаление почек. В Германии терапевты прописывают пенициллин, антибиотик. Но в слаборазвитых странах, пенициллин не всегда является возможным методом лечения. Во-первых, пенициллин часто недоступен, а во-вторых, появляются коинфекции, т.е. сопутствующие инфекции, вызванные другой бактерией, золотистым стафилококком (Staphylococcus aureus), а этот микроорганизм часто невосприимчив к действию пенициллина. Группа ученых под руководством Д-ра Патрика Ницше-Шмитца из Центра исследования инфекционных заболеваний имени Гельмгольца начала сотрудничать с Немецким национальным справочным центром по стрептококкам в г. Аахен, Германия с целью исследовать может ли в данных ситуациях быть полезен антибиотик триметоприм. Триметоприм задерживает фермент метаболизма фолиевой кислоты, называемый дигидрофолатредуктаза, который играет важную роль в росте бактерий. Таким образом, триметоприм предотвращает попадание бактерий в организм. Раньше доктора не рекомендовали использовать данный лекарственный препарат для лечения стрептококковых инфекций. В основе этого лежало широко распространенное, но как сейчас становится все более очевидным, ошибочное мнение, что бактерии уже обладают устойчивостью к данному веществу. Причиной возникновения подобной ошибки послужило использование на ранних стадиях культурной среды, которая уменьшает антимикробное действие триметоприма. Ученые из Брауншвейга исследовали на устойчивость к триметоприму образцы, полученные у инфицированных больных в Германии и Индии. Большинство образцов проявили чувствительность к данному веществу. «Это доказывает, что триметоприм действительно во многих случаях эффективен при лечении инфекции Streptococcus pyogenes», говорит Ницше-Шмитц. Его команда также провела работу с образцами, в которых бактерии не отреагировали на вещество. Они обнаружили два вида устойчивости. Патрик Ницше-Шмитц объяснил, что «в гене дигидрофолатредуктазы могут произойти спонтанные мутации, что приведет к тому, что триметоприм не сможет больше противодействовать измененному ферменту, а, следовательно, он станет неэффективным». Команда из Брауншвейга обнаружила особую мутацию данного гена во многих образцах, которые являются устойчивыми к стрептококкам. Более того, бактерии могут передавать копии измененного гена дигидрофолатредуктаза другим бактериям. Такой процесс, называемый горизонтальный перенос генов, способствует быстрому распространению устойчивости. Ученые обнаружили два гена, которые в дальнейшем могут послужить причиной появления устойчивости. Согласно исследованию антибиотик триметоприм является возможным методом лечения инфекции пиогенный стрептококк (Streptococcus pyogenes) в некоторых географических регионах. Частота проявления устойчивости намного ниже, чем считалось раньше, а также лекарство недорогое, стабильное и эффективно действующее против сопутствующих инфекций золотистого стафилококка (Staphylococcus aureus). «Тем не менее, это своего рода меч, который может быстро потерять свою остроту. Мы обнаружили три причины быстрого распространения устойчивости. Очень важно, что триметоприм, как и другие антибиотики, не прописывают без необходимости, и все пациенты принимают препарат в соответствии с полученными инструкциями», говорит Ницше-Шмитц. Источник: http://www.sciencedaily.com/releases/2014/03/140319103556.htm?utm_source=feedburner&utm_medium=feed&utm_campaign=Feed%3A+sciencedaily%2Fhealth_medicine%2Fpharmacology+%28Pharmacology+News+--+ScienceDaily%29
xn--80aeisxqh1b.xn--p1ai Инструкция по применению лекарств, аналоги, отзывыОписание действующего вещества Триметоприм/ Trimethoprim.Формула: C14h28N4O3, химическое название: 5-[(3,4,5-Триметоксифенил)метил]-2,4-пиримидиндиамин.Фармакологическая группа: противомикробные, противопаразитарные и противоглистные средства/ синтетические антибактериальные средства/ другие синтетические антибактериальные средства.Фармакологическое действие: бактериостатическое, антибактериальное. Фармакологические свойстваТриметоприм активен против грамотрицательных (протей, кишечная палочка, клебсиелла) и части грамположительных микроорганизмов. Механизм действия триметоприма связан с ингибированием фермента дигидрофолатредуктазы в процессе образования тетрагидрофолиевой кислоты. Триметоприм всасывается в желудочно-кишечном тракте быстро и почти полностью (90 - 100%). С белками плазмы триметоприм связывается на 45%. Максимальная концентрация триметоприма достигается через 1 - 4 ч (при однократном приеме дозы максимальная концентрация примерно равна 1 мкг/мл). Триметоприм быстро распределяется в жидкостях и тканях организма, включая печень, почки, селезенку, слюну, мокроту и сперму, также определяется в костном мозге, желчи, губчатом слое костей (но не компактном). Содержание триметоприма в спинномозговой жидкости примерно составляет 30 - 50% от плазменной концентрации. Содержание в секрете и ткани простаты в 2 - 3 раза больше содержания в плазме крови. Триметоприм проникает через плаценту, выделяется с грудным молоком. Объем распределения у взрослых равен 1,3 - 1,8 л/кг, у новорожденных составляет 2,7 л/кг, у детей 1 - 10 лет – 1 л/кг. Триметоприм метаболизируется в печени (до неактивных метаболитов - 10 - 20% ). У взрослых период полувыведения триметоприма при нормальном функциональном состоянии почек равен 8 - 10 часов, у пациентов с анурией – 20 - 50 часов; у новорожденных – 19 часов, у детей 1 - 10 лет – 3 - 5,5 часов. Триметоприм выводится почками в течение суток на 50 - 60%, причем 80 - 90% выводится в неизмененном виде, в виде неактивных метаболитов вводится остальная часть. Примерно 4% выводится с желчью. При кислой реакции мочи выведение усиливается и при щелочной - ослабевает. Перитонеальный диализ неэффективен, при гемодиализе удаляется умеренное количество триметоприма. ПоказанияПрофилактика и терапия бактериальных инфекций мочевыводящих путей, которые вызваны чувствительными микроорганизмами. Способ применения триметоприма и дозыТриметоприм принимается внутрь, взрослые: 1 раз в сутки 40 - 60 мг; максимальная суточная доза равна 100 мг; дети старше 1 года: 1 раз в сутки 2 - 3 мг/кг.При продолжительном использовании триметоприма необходим систематический контроль функционального состояния почек и печени, периферической крови. Пожилым больным показано дополнительное использование фолиевой кислоты. Противопоказания к применениюГиперчувствительность, выраженные нарушения функционального состояния почек и печени, недостаточность фолиевой кислоты, мегалобластная анемия из-за недостаточности фолиевой кислоты, период лактации, беременность. Ограничения к применениюВозможная недостаточность фолиевой кислоты, отягощенный аллергологический анамнез, бронхиальная астма, нарушения функционального состояния печени, почек и щитовидной железы, ранний детский возраст. Применение при беременности и кормлении грудьюИспользование триметоприма противопоказано при беременности и грудном вскармливании. Побочные действия триметопримаНервная система: асептический менингит, головная боль;кроветворение: метгемоглобинемия, лейкопения, агранулоцитоз, анемия, тромбоцитопения;дерматологические реакции: злокачественная экссудативная эритема, кожная сыпь;пищеварительная система: анорексия, диарея, тошнота, гастралгия, рвота;мочевыделительная система: нефропатия. Взаимодействие триметоприма с другими веществамиКомбинация триметоприма с сульфаметоксазолом взаимно усиливает противомикробное действие. Миелотоксичные средства увеличивают вероятность дальнейшего угнетения костного мозга. При совместном использовании циклоспорина повышается частота нефротоксического влияния. При совместном использовании триметоприма с дапсоном возможно увеличение содержания как дапсона (повышается тяжесть и частота побочных реакций, в особенности метгемоглобинемии), так и триметоприма. Другие антагонисты фолиевой кислоты (пириметамин, метотрексат) при совместном использовании увеличивают вероятность развития мегалобластной анемии. Триметоприм уменьшает почечный клиренс прокаинамида, увеличивая содержание в сыворотке крови. Триметоприм подавляет печеночный метаболизм фенитоина. При совместном использовании триметоприм усиливает выведение и укорачивает период полувыведения рифампицина. Триметоприм усиливает за счет подавления метаболизма антикоагулянтный эффект варфарина. ПередозировкаОстрая передозировка: тошнота, диарея, рвота, головокружение, головная боль, зрительные и интеллектуальные расстройства, в тяжелых случаях - гематурия, кристаллурия, анурия. Хроническая передозировка: угнетение кроветворения (лейкопения, тромбоцитопения), а также прочие патологические изменения в крови, которые связаны с дефицитом фолиевой кислоты.Лечение (в зависимости от проявлений): промывание желудка, прием активированного угля и прочие меры по предотвращения дальнейшего всасывания препарата, форсированный диурез, гемодиализ; при выраженных изменениях крови или желтухе необходимо специфическая терапия; возможно назначение фолинат кальция для устранения действия триметоприма на кроветворение. Торговые названия препаратов с действующим веществом триметоприм
Комбинированные препараты: Ко-тримоксазол [Сульфаметоксазол + Триметоприм]: Бактрим®, Бактрим® форте, Берлоцид® 240, Берлоцид® 480, Би-Септин, Бисептол®, Бисептол® 480, Брифесептол®, Гросептол, Двасептол, Дуо-Септол, Ко-тримоксазол, Ко-тримоксазол-Акри, Ко-тримоксазол-Ривофарм, Ко-тримоксазол-СТИ, Котрифарм 480, Метосульфабол, Ориприм, Полсептол, Септрин®, Синерсул, Сулотрим, Суметролим®, Тримезол, Циплин;Сульфаметрол + Триметоприм: Лидаприм®. xn-----8kceunaflgjrqyoqfbei8dxl.xn--p1ai Котримоксазол (триметоприм и сульфаметоксазол) | Улучшая назначение антибиотиков В 1978 г. в Австралии вышла в свет маленькая брошюра "Руководство по антибиотикам", которая с тех пор регулярно обновляется. В ней приводятся руководящие принципы по использованию антибиотиков, разработанные на основе консенсуса специалистов-медиков. В одной больнице образовательная кампания для популяризации этой брошюры, и ее рекомендации привели к увеличению "надлежащего лечения антибиотиками" с 52% до 70% за период с 1978 по 1982 гг. Две следующие кампании в 12 больницах, проведенные в 1985 и 1986 гг., вызвали аналогичные улучшения в лечении. После вычета суммы затрат на проведение кампаний обнаружилось, что удалось сэкономить значительные средства. Образовательная кампания включала лекцию "академического" представителя, рассылку по почте рекламного материала, содействующего рациональному назначению, плакаты в помещениях больниц, лекции и юмористический видеофильм [1]. В медицинской амбулатории Небраски, США, для улучшения назначения антибиотиков было создано всестороннее руководство по назначению антибиотиков с данными о чувствительности, которое отражало местные условия. Реакция на него врачей была в целом благоприятной, и эта схема распространилась и по другим больницам в Небраске. Врачи попросили также создать отдельные схемы лечения для амбулаторных пациентов и детей [2].
В Йоркшире, Великобритания, в районной больнице общего типа назначения антибиотиков для профилактики хирургических инфекций менялись каждые полгода, с приходом каждой новой группы молодых врачей. Обследование выявило, что лишь 17% назначений было надлежащими. После введения в практику формального руководства надлежащее назначение улучшилось до 60% случаев. Была также достигнута значительная экономия средств [3]. На Фиджи учебная программа для персонала всех амбулаторий и пунктов первой помощи помогла почти на 50% снизить ненадлежащее использование антибиотиков при лечении острых респираторных инфекций. До начала учебных курсов в 1988 г. антибиотики неправильно назначались для лечения кашля и насморка в 43% случаев. После обучения только 24% пациентов с кашлем и насморком получали антибиотики [4]. Некоторые уроки для лиц, определяющих политику, и администраторов позволяет извлечь опыт больницы на 600 койко-мест в Северной Каролине, США, где была отменена политика ограничения антибиотиков. Было решено, что политика ограничения требовала слишком много усилий и средств. Однако ее отмена привела к увеличению числа терапевтических курсов до 158% (с 413 во время шестимесячного периода ограничения до 1064 за шесть месяцев после отмены ограничений). Расходы на антибиотики выросли на 103%, с 154542 до 313905 долларов. Также увеличилось ненадлежащее использование по крайней мере одного из антибиотиков. Исследователи, изучающие перемены в политике, рекомендовали другим больницам, что план отмены существующих ограничений на антибиотики "следует осторожно взвесить, так как этот шаг может серьезно повлиять на затраты на противомикробные средства и на качество медицинской помощи" [5]. Источники:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
г.Самара, ул. Димитрова 131 [email protected] |
 |