|
|
||||||||||
|
Бактерии научились приобретать устойчивость к антибиотикам в два шага. Толерантность к антибиотикамБактерии научились приобретать устойчивость к антибиотикам в два шага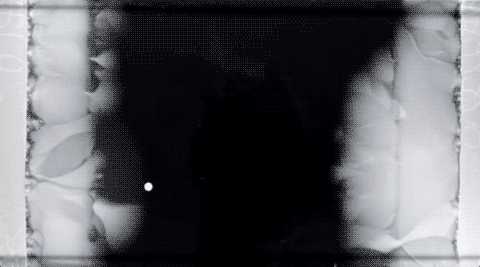 Движение двух фронтов бактериальных колоний навстречу друг другу. В центре концентрация антибиотика максимальная. Michael Baym et al., Science Микробиологи обнаружили, что резистентность бактерий к антибиотикам гораздо стремительнее развивается на фоне толерантности и находится с ней в тесной связи. Возможно, предотвращение развития толерантности способно решить проблему возникновения лекарственной устойчивости. Исследование опубликовано в журнале Science, кратко с его результатами можно ознакомиться в пресс-релизе Еврейского университета в Иерусалиме. С самого первого применения пенициллина и до наших дней бактерии усердно эволюционируют в сторону невосприимчивости к антибиотикам, а ученые непрерывно придумывают, что этому противопоставить. К несчастью, пока человечество скорее проигрывает в этой борьбе. К лекарственной устойчивости можно прийти разными путями — приобрести молекулярный насос, выкачивающий молекулы антибиотика из клетки, научиться заблаговременно разрушать их, переделать до неузнаваемости мишень, на которую направлено действие препарата или, например, подставить антибиотику «ложные цели», как это научился делать золотистый стафилококк. В любом случае, для человечества результат закономерен — снижение эффективности лекарств, а в конце концов — полная их бесполезность в пока еще некоторых случаях. Известно, что для бактерий приобретение резистентности не единственный способ выживания — существует еще толерантность, подразумевающая «замирание» микроорганизма, при котором он не может расти и размножаться, но и не умирает. Попав в благоприятную среду, бактерии не сразу переходят к экспоненциальному росту — ему предшествует латентная фаза, когда микробы обживаются на новом месте. Некоторые антибиотики, например ампициллин, препятствуют строительству клеточной стенки бактерий, то есть действуют только в фазу активного роста. А значит микроорганизмам ради спасения не обязательно изобретать способы борьбы с лекарством — достаточно просто задержаться в латентной фазе и потом продолжить беззаботное существование. В основе обоих путей борьбы с антибиотиками лежат мутации, но толерантность позволяет лишь переждать неблагоприятные условия, а резистентность — справиться с ними раз и навсегда. Единого мнения о том, как именно на эволюцию резистентности влияют толерантные штаммы, у научного сообщества до сих пор нет. Чтобы разобраться в этом вопросе, ученые взяли кишечную палочку и устроили эволюцию в лабораторном масштабе. Для этого культуры помещали в питательную среду с высокой, но сопоставимой с терапевтическими дозами концентрацией ампициллина. Через 4,5 часа клетки возвращали в среду с небольшой, в сто раз меньшей, концентрацией антибиотика, где они восстанавливались и нарастали в течение ночи. Затем клетки ночной культуры снова высевали на среду с высокой концентрацией и повторяли цикл до тех пор, пока у бактерий не выработалась резистентность. Эффект от возникших толерантных мутаций оценивали по проценту колоний, находившихся в латентной фазе дольше 4,5 часов, а эффект резистентных — по минимальной концентрации антибиотика, ингибирующей рост бактерий (МИК). В результате, когда ученые добились резистентности, МИК оказалась по меньшей мере в семь раз выше по сравнению со значением для обычных популяций. Последующий геномный анализ устойчивых культур показал, что все они приобрели усиливающие экспрессию мутации промоторной области гена ampC, который кодирует разрушающий ампициллин фермент. При дальнейшем анализе ученые обнаружили, что уже после 3-4 циклов эксперимента большинство бактерий даже на нормальной среде демонстрируют отложенный рост — ту самую задержку в латентной фазе. При этом свидетельствующая о развитии резистентности МИК начинает расти существенно позже — между 7 и 17 циклом. Не объясненным оставалось только как именно происходит переход между обычной популяцией и резистентной — через толерантную или напрямую.  Предлагаемый авторами механизм возникновения резистентной популяции на фоне толерантной. Обыкновенная популяция эволюционирует в толерантную (синяя стрелка), что способствует выживанию большего числа бактерий и служит опорой для развития резистентности (красная стрелка) Генетический анализ показал, что обладатели резистентных мутаций в ampC несут также и мутации, приводящие к толерантности, причем последние появились раньше, а значит резистентность возникла на фоне толерантности. Более того, оказалось, что на ее фоне резистентность развивается гораздо быстрее. Причина, судя по всему, в том, что при таком цикличном протоколе возможность возникновения и закрепления мутаций зависит от двух ключевых моментов — вероятности возникновения мутации как таковой и вероятности того, что тот, у кого она возникла, пережил воздействие антибиотика. К тому же приводящие к толерантности мутации возникают чаще — хотя бы потому, что могут происходить во многих местах генома, в то время как резистентные ограничены зоной промотора гена ampC.Вероятно, большее число толерантных особей создает потенциал, дающий преимущество для возникновения редких резистентных мутаций. Иными словами, толерантность способствует возникновению мутаций резистентности тем, что снижает вероятность потерять их. Ученые посчитали, что при выбранной схеме эксперимента переход от обычной популяции к резистентной напрямую, минуя толерантную, состоялся бы более чем через 100 циклов (против 17, наблюдавшихся в эксперименте). В свете новых данных механизм приобретения полной резистентности представляется следующим образом — часто происходящие мутации приносят в популяцию толерантность, которая более чем на порядок увеличивает выживаемость, а следующие за ними более узконаправленные мутации в ampC существенно повышают МИК, увеличивая выживаемость еще сильнее. Особенно важно то, что происходит это даже при очень высоких концентрациях антибиотика — толерантность позволяет закрепиться частичной резистентности, которая затем легко переходит в полную. В целом, значимая для развития резистентности роль толерантности открывает возможность использовать ее в разработке новых подходов лечения, препятствующих возникновению устойчивости. Юрий Солюс nplus1.ru , | :  : . 2 , . ...  Fender: , - ...  : . ... | . () ( ) ED/ /, . ( ED/ /), . in vitro , ; . : 1 - "" , ; 2 - "" , ( ) ; 3 - " " , ; 4 - "" , . : "", "" "". .3. - , .4.
, (, .), ( .) . () . - . () () 32 . : 2016-12-17; : 28 | : : |
| ( / ED/)* | |||||
| G | 0,25 | ³ 128 | |||
| V | 0,25 | ³128 | |||
| - | - | - | |||
| 0,25 | ³ 128 | ||||
| - | ³ 128 | ||||
| ³ 128 | |||||
| - | ³ 128 | ||||
| - | ³ 128 | ||||
| - | ³ 128 | ||||
| 0,5 | ³ 64 | ||||
| - | ³ 64 | ||||
| ³ 64 | |||||
| ³ 64 | |||||
| ³ 64 | |||||
| * . |
| 4 - | |||||||||||
| . | |||||||||||
| 1 N 2 | |||||||||||
| : | £20 £11 | 21-28 12-21 | ³29 ³10 | £20 £10 | 21-28 11-16 | ³29 ³17 | |||||
| : - | £20 £9 | 21-28 10-13 | ³29 ³14 | £20 £9 | 21-28 10-13 | ³29 ³14 | |||||
| : , - | £14 £13 | 15-18 14-16 | ³19 ³17 | £14 £13 | 15-18 12-14 | ³19 ³15 | |||||
| £13 | 14-17 | ³18 | £13 | 14-18 | ³19 | ||||||
| £19 | 20-23 | ³24 | £15 | 16-19 | ³20 | ||||||
| £11 | 12-16 | ³17 | - | - | - | ||||||
| £11 | 12-16 | ³17 | £14 | 15-18 | ³19 | ||||||
| £13 | 14-16 | ³17 | £16 | 17-19 | ³20 | ||||||
| £14 | 15-18 | ³19 | £14 | 15-18 | ³19 | ||||||
| £13 | 14-17 | ³18 | £12 | 13-16 | ³17 | ||||||
| £13 | - | ³14 | £15 | - | ³16 | ||||||
| £13 | - | ³14 | - | - | - | ||||||
| £15 | 16-19 | ³20 | £16 | 17-21 | ³22 | ||||||
| £12 | 13-19 | ³20 | - | - | - | ||||||
| £14 | 15-18 | ³19 | £17 | 18-21 | ³22 | ||||||
| £12 | 13-17 | ³18 | £16 | 17-20 | ³21 | ||||||
| £19 | 20-23 | ³24 | £19 | 20-23 | ³24 | ||||||
| £14 | 15-18 | ³19 | £1|2 | 13-15 | ³16 | ||||||
| £9 | 10-12 | ³13 | £12 | 13-15 | ³16 | ||||||
| £12 | 13-19 | ³20 | - | - | - | ||||||
| £8 | 9-12 | ³13 | £11 | 12-14 | ³15 | ||||||
| £9 | 10-11 | ³12 | £9 | 10-11 | ³12 | ||||||
, (, .), ( .) . () . - . () () 32 .
studopedia.ru
,
:
. () ( ) ED/ /, . ( ED/ /), . in vitro , ; .
:
1 - "" , ;
2 - "" , ( ) ;
3 - " " , ;
4 - "" , .
: "", "" "". .3. - , .4.
| ( / ED/)* | |||||
| G | 0,25 | ³ 128 | |||
| V | 0,25 | ³128 | |||
| - | - | - | |||
| 0,25 | ³ 128 | ||||
| - | ³ 128 | ||||
| ³ 128 | |||||
| - | ³ 128 | ||||
| - | ³ 128 | ||||
| - | ³ 128 | ||||
| 0,5 | ³ 64 | ||||
| - | ³ 64 | ||||
| ³ 64 | |||||
| ³ 64 | |||||
| ³ 64 | |||||
| * . |
| 4 - | |||||||||||
| . | |||||||||||
| 1 N 2 | |||||||||||
| : | £20 £11 | 21-28 12-21 | ³29 ³10 | £20 £10 | 21-28 11-16 | ³29 ³17 | |||||
| : - | £20 £9 | 21-28 10-13 | ³29 ³14 | £20 £9 | 21-28 10-13 | ³29 ³14 | |||||
| : , - | £14 £13 | 15-18 14-16 | ³19 ³17 | £14 £13 | 15-18 12-14 | ³19 ³15 | |||||
| £13 | 14-17 | ³18 | £13 | 14-18 | ³19 | ||||||
| £19 | 20-23 | ³24 | £15 | 16-19 | ³20 | ||||||
| £11 | 12-16 | ³17 | - | - | - | ||||||
| £11 | 12-16 | ³17 | £14 | 15-18 | ³19 | ||||||
| £13 | 14-16 | ³17 | £16 | 17-19 | ³20 | ||||||
| £14 | 15-18 | ³19 | £14 | 15-18 | ³19 | ||||||
| £13 | 14-17 | ³18 | £12 | 13-16 | ³17 | ||||||
| £13 | - | ³14 | £15 | - | ³16 | ||||||
| £13 | - | ³14 | - | - | - | ||||||
| £15 | 16-19 | ³20 | £16 | 17-21 | ³22 | ||||||
| £12 | 13-19 | ³20 | - | - | - | ||||||
| £14 | 15-18 | ³19 | £17 | 18-21 | ³22 | ||||||
| £12 | 13-17 | ³18 | £16 | 17-20 | ³21 | ||||||
| £19 | 20-23 | ³24 | £19 | 20-23 | ³24 | ||||||
| £14 | 15-18 | ³19 | £1|2 | 13-15 | ³16 | ||||||
| £9 | 10-12 | ³13 | £12 | 13-15 | ³16 | ||||||
| £12 | 13-19 | ³20 | - | - | - | ||||||
| £8 | 9-12 | ³13 | £11 | 12-14 | ³15 | ||||||
| £9 | 10-11 | ³12 | £9 | 10-11 | ³12 | ||||||
, (, .), ( .) . () . - . () () 32 .
mylektsii.ru
Критерии оценки чувствительности, устойчивости и толерантности микроорганизмов к антибиотикам и химиотерапевтическим препаратам
Используемые в медицине понятия чувствительности и устойчивости микроорганизмов к антибиотикам и химиотерапевтическим препаратам основаны на клинической точке зрения. В соответствен с этим подходом критерием чувствительности микроба является концентрация антибиотика (химиопрепарата) в организме человека (очаге инфекции) в ED/мл или мкг/мл, достигаемая при терапевтических дозировках препарата. С этим критерием сравнивают минимальную ингибирующую рост микроорганизма концентрацию антибиотика (МИК в ED/мл или мкг/мл), определяемую при выращивании микроба на питательной среде с антибиотиком. Если МИК антибиотика для микроорганизма in vitro меньше или равна концентрации этого антибиотика в организме человека, то этот микроорганизм чувствителен к антибиотику; при противоположном соотношении микроорганизм устойчив к антибиотику.
В соответствии с инструкцией по унифицированным методам в клинической практике микроорганизмы распределяют на ряд групп по степени чувствительности к антибиотикам:
1 группа - "чувствительные" микроорганизмы, когда обычно применяемые дозы антибиотика достаточны для достижения лечебного эффекта;
2 группа - "среднечувствительные" микроорганизмы, когда только повышенные (максимально переносимые) дозы антибиотика могут обеспечить лечебный эффект;
3 группа - "умеренно устойчивые" микроорганизмы, когда лечебный эффект может быть достигнут только при возможности концентрации препарата в очаге или введении непосредственно в очаг инфекции;
4 группа - "устойчивые" микроорганизмы, когда нельзя рассчитывать на лечебный эффект.
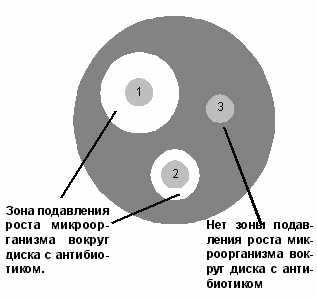
В медицинской практике обычно определяют три группы микроорганизмов по чувствительности к антибиотикам: "чувствительные", "среднечувствительные" и "устойчивые". Конкретные критерии их определения методом серийных разведении антибиотиков представлены в табл.3. Диско-диффузионньм методом определяют указанные группы чувствительности микроорганизмов, исходя из различных диаметров задержки роста бактерий вокруг дисков с антибиотиками конкретно для различных антибиотиков в соответствии с табл.4.
| Группы микроорганизмов по степени чувствительности к антибиотикам (МИК в мкг/мл или ED/мл)* | |||||
| Антибиотики | Группы микроорганизмов | ||||
| чувствительные | среднечувствительные | умеренноустойчивые | устойчивые | ||
| Пенициллин G | 0,25 | ³ 128 | |||
| Пенициллин V | 0,25 | ³128 | |||
| Метициллин | - | - | - | ||
| Ампициллин | 0,25 | ³ 128 | |||
| Карбенициллин | - | ³ 128 | |||
| Цефалоспорины | ³ 128 | ||||
| Стрептомицин | - | ³ 128 | |||
| Канамицин | - | ³ 128 | |||
| Неомицин | - | ³ 128 | |||
| Гентамицин | 0,5 | ³ 64 | |||
| Левомицетин | - | ³ 64 | |||
| Тетрациклины | ³ 64 | ||||
| Эритромицин | ³ 64 | ||||
| Линкомицин | ³ 64 | ||||
| *По унифицированным методам определения чувствительности микроорганизмов к химиотерапевтическим препаратам. |
| Таблица 4 Оценка результатов определения чувствительности бактерии к антибиотикам диско-диффузионным методом | |||||||||||
| Антибиотики | Диаметр зон задержки роста бактерий. мм | ||||||||||
| для сред № 1 и N 2 | для среды АГВ | ||||||||||
| устойчивые | среднеустойчивые | чувствительные | устойчивые | среднеустойчивые | чувствительные | ||||||
| Бензилпенициллин: для стрептококков для других бактерий | £20 £11 | 21-28 12-21 | ³29 ³10 | £20 £10 | 21-28 11-16 | ³29 ³17 | |||||
| Ампициллин: для стафилококков для Г- бактерий и энтеробактерий | £20 £9 | 21-28 10-13 | ³29 ³14 | £20 £9 | 21-28 10-13 | ³29 ³14 | |||||
| Карбенициллин: для эшерихий, протея для синегнойной п-ки | £14 £13 | 15-18 14-16 | ³19 ³17 | £14 £13 | 15-18 12-14 | ³19 ³15 | |||||
| Метициллин | £13 | 14-17 | ³18 | £13 | 14-18 | ³19 | |||||
| Оксациллин | £19 | 20-23 | ³24 | £15 | 16-19 | ³20 | |||||
| Цефалексин | £11 | 12-16 | ³17 | - | - | - | |||||
| Цефалотин | £11 | 12-16 | ³17 | £14 | 15-18 | ³19 | |||||
| Стрептомицин | £13 | 14-16 | ³17 | £16 | 17-19 | ³20 | |||||
| Канамицин | £14 | 15-18 | ³19 | £14 | 15-18 | ³19 | |||||
| Неомицин | £13 | 14-17 | ³18 | £12 | 13-16 | ³17 | |||||
| Гентамицин | £13 | - | ³14 | £15 | - | ³16 | |||||
| Сизомицин | £13 | - | ³14 | - | - | - | |||||
| Тетрациклин | £15 | 16-19 | ³20 | £16 | 17-21 | ³22 | |||||
| Доксициклин | £12 | 13-19 | ³20 | - | - | - | |||||
| Эритромицин | £14 | 15-18 | ³19 | £17 | 18-21 | ³22 | |||||
| Олеандомицин | £12 | 13-17 | ³18 | £16 | 17-20 | ³21 | |||||
| Линкомицин | £19 | 20-23 | ³24 | £19 | 20-23 | ³24 | |||||
| Левомицетин | £14 | 15-18 | ³19 | £1|2 | 13-15 | ³16 | |||||
| Рифампицин | £9 | 10-12 | ³13 | £12 | 13-15 | ³16 | |||||
| Фузидин | £12 | 13-19 | ³20 | - | - | - | |||||
| Полимиксин | £8 | 9-12 | ³13 | £11 | 12-14 | ³15 | |||||
| Ристомицин | £9 | 10-11 | ³12 | £9 | 10-11 | ³12 | |||||
В некоторых случаях при длительной химиотерапии инфекций, вызываемых грамположительными бактериями (стрептококками, энтерококками и др.), наблюдается отсутствие санирующего действия бактерицидных антибиотиков (пенициллина и др.) на фоне выделения бактерий чувствительных к используемому антибиотику по минимальной ингибирующей рост концентрации. Это проявление толерантности (терпимости) бактерий к антибиотику. Толерантность бактерий к антибиотику - это утрата ими чувствительности к бактерицидному действию антибиотика при сохранении чувствительности к бактериостатическому действию антибиотика. Условно критерием толерантности микроорганизма к антибиотику считают превышение минимальной бактерицидной концентрации (МБК) антибиотика его минимальной ингибирующей рост концентрации (МИК) в 32 раза и более.
pdnr.ru
Бактерии научились приобретать устойчивость к антибиотикам в два шага
 Движение двух фронтов бактериальных колоний навстречу друг другу. В центре концентрация антибиотика максимальная.Michael Baym et al., Science
Движение двух фронтов бактериальных колоний навстречу друг другу. В центре концентрация антибиотика максимальная.Michael Baym et al., Science
Микробиологи обнаружили, что резистентность бактерий к антибиотикам гораздо стремительнее развивается на фоне толерантности и находится с ней в тесной связи. Возможно, предотвращение развития толерантности способно решить проблему возникновения лекарственной устойчивости. Исследование опубликовано
в журнале Science, кратко с его результатами можно ознакомиться в пресс-релизе Еврейского университета в Иерусалиме.С самого первого применения пенициллина и до наших дней бактерии усердно эволюционируют в сторону невосприимчивости к антибиотикам, а ученые непрерывно придумывают, что этому противопоставить. К несчастью, пока человечество скорее проигрывает в этой борьбе.
К лекарственной устойчивости можно прийти разными путями — приобрести молекулярный насос, выкачивающий молекулы антибиотика из клетки, научиться заблаговременно разрушать их, переделать до неузнаваемости мишень, на которую направлено действие препарата или, например, подставить антибиотику «ложные цели», как это научился делать золотистый стафилококк. В любом случае, для человечества результат закономерен — снижение эффективности лекарств, а в конце концов — полная их бесполезность в пока еще некоторых случаях.
Известно, что для бактерий приобретение резистентности не единственный способ выживания — существует еще толерантность, подразумевающая «замирание» микроорганизма, при котором он не может расти и размножаться, но и не умирает. Попав в благоприятную среду, бактерии не сразу переходят к экспоненциальному росту — ему предшествует латентная фаза, когда микробы обживаются на новом месте. Некоторые антибиотики, например ампициллин, препятствуют строительству клеточной стенки бактерий, то есть действуют только в фазу активного роста. А значит микроорганизмам ради спасения не обязательно изобретать способы борьбы с лекарством — достаточно просто задержаться в латентной фазе и потом продолжить беззаботное существование. В основе обоих путей борьбы с антибиотиками лежат мутации, но толерантность позволяет лишь переждать неблагоприятные условия, а резистентность — справиться с ними раз и навсегда.
Единого мнения о том, как именно на эволюцию резистентности влияют толерантные штаммы, у научного сообщества до сих пор нет.
Чтобы разобраться в этом вопросе, ученые взяли кишечную палочку и устроили эволюцию в лабораторном масштабе. Для этого культуры помещали в питательную среду с высокой, но сопоставимой с терапевтическими дозами концентрацией ампициллина. Через 4,5 часа клетки возвращали в среду с небольшой, в сто раз меньшей, концентрацией антибиотика, где они восстанавливались и нарастали в течение ночи. Затем клетки ночной культуры снова высевали на среду с высокой концентрацией и повторяли цикл до тех пор, пока у бактерий не выработалась резистентность.
Эффект от возникших толерантных мутаций оценивали по проценту колоний, находившихся в латентной фазе дольше 4,5 часов, а эффект резистентных — по минимальной концентрации антибиотика, ингибирующей рост бактерий (МИК).
В результате, когда ученые добились резистентности, МИК оказалась по меньшей мере в семь раз выше по сравнению со значением для обычных популяций. Последующий геномный анализ устойчивых культур показал, что все они приобрели усиливающие экспрессию мутации промоторной области гена ampC, который кодирует разрушающий ампициллин фермент.
При дальнейшем анализе ученые обнаружили, что уже после 3-4 циклов эксперимента большинство бактерий даже на нормальной среде демонстрируют отложенный рост — ту самую задержку в латентной фазе. При этом свидетельствующая о развитии резистентности МИК начинает расти существенно позже — между 7 и 17 циклом. Не объясненным оставалось только как именно происходит переход между обычной популяцией и резистентной — через толерантную или напрямую.

Предлагаемый авторами механизм возникновения резистентной популяции на фоне толерантной. Обыкновенная популяция эволюционирует в толерантную (синяя стрелка), что способствует выживанию большего числа бактерий и служит опорой для развития резистентности (красная стрелка)
Генетический анализ показал, что обладатели резистентных мутаций в ampC несут также и мутации, приводящие к толерантности, причем последние появились раньше, а значит резистентность возникла на фоне толерантности. Более того, оказалось, что на ее фоне резистентность развивается гораздо быстрее. Причина, судя по всему, в том, что при таком цикличном протоколе возможность возникновения и закрепления мутаций зависит от двух ключевых моментов — вероятности возникновения мутации как таковой и вероятности того, что тот, у кого она возникла, пережил воздействие антибиотика. К тому же приводящие к толерантности мутации возникают чаще — хотя бы потому, что могут происходить во многих местах генома, в то время как резистентные ограничены зоной промотора гена ampC.
Вероятно, большее число толерантных особей создает потенциал, дающий преимущество для возникновения редких резистентных мутаций. Иными словами, толерантность способствует возникновению мутаций резистентности тем, что снижает вероятность потерять их. Ученые посчитали, что при выбранной схеме эксперимента переход от обычной популяции к резистентной напрямую, минуя толерантную, состоялся бы более чем через 100 циклов (против 17, наблюдавшихся в эксперименте).
В свете новых данных механизм приобретения полной резистентности представляется следующим образом — часто происходящие мутации приносят в популяцию толерантность, которая более чем на порядок увеличивает выживаемость, а следующие за ними более узконаправленные мутации в ampC существенно повышают МИК, увеличивая выживаемость еще сильнее. Особенно важно то, что происходит это даже при очень высоких концентрациях антибиотика — толерантность позволяет закрепиться частичной резистентности, которая затем легко переходит в полную.
В целом, значимая для развития резистентности роль толерантности открывает возможность использовать ее в разработке новых подходов лечения, препятствующих возникновению устойчивости.
Юрий Солюс
https://cont.ws/@jivoy/531192
naucaitechnika.ru
Бактерии научились приобретать устойчивость к антибиотикам в два шага
Микробиологи обнаружили, что резистентность бактерий к антибиотикам гораздо стремительнее развивается на фоне толерантности и находится с ней в тесной связи. Возможно, предотвращение развития толерантности способно решить проблему возникновения лекарственной устойчивости. Исследование опубликовано в журнале Science, кратко с его результатами можно ознакомиться в пресс-релизе Еврейского университета в Иерусалиме.
С самого первого применения пенициллина и до наших дней бактерии усердно эволюционируют в сторону невосприимчивости к антибиотикам, а ученые непрерывно придумывают, что этому противопоставить. К несчастью, пока человечество скорее проигрывает в этой борьбе.
К лекарственной устойчивости можно прийти разными путями — приобрести молекулярный насос, выкачивающий молекулы антибиотика из клетки, научиться заблаговременно разрушать их, переделать до неузнаваемости мишень, на которую направлено действие препарата или, например, подставить антибиотику «ложные цели», как это научился делать золотистый стафилококк. В любом случае, для человечества результат закономерен — снижение эффективности лекарств, а в конце концов — полная их бесполезность в пока еще некоторых случаях.
Известно, что для бактерий приобретение резистентности не единственный способ выживания — существует еще толерантность, подразумевающая «замирание» микроорганизма, при котором он не может расти и размножаться, но и не умирает. Попав в благоприятную среду, бактерии не сразу переходят к экспоненциальному росту — ему предшествует латентная фаза, когда микробы обживаются на новом месте. Некоторые антибиотики, например ампициллин, препятствуют строительству клеточной стенки бактерий, то есть действуют только в фазу активного роста. А значит микроорганизмам ради спасения не обязательно изобретать способы борьбы с лекарством — достаточно просто задержаться в латентной фазе и потом продолжить беззаботное существование. В основе обоих путей борьбы с антибиотиками лежат мутации, но толерантность позволяет лишь переждать неблагоприятные условия, а резистентность — справиться с ними раз и навсегда.
Единого мнения о том, как именно на эволюцию резистентности влияют толерантные штаммы, у научного сообщества до сих пор нет.
Чтобы разобраться в этом вопросе, ученые взяли кишечную палочку и устроили эволюцию в лабораторном масштабе. Для этого культуры помещали в питательную среду с высокой, но сопоставимой с терапевтическими дозами концентрацией ампициллина. Через 4,5 часа клетки возвращали в среду с небольшой, в сто раз меньшей, концентрацией антибиотика, где они восстанавливались и нарастали в течение ночи. Затем клетки ночной культуры снова высевали на среду с высокой концентрацией и повторяли цикл до тех пор, пока у бактерий не выработалась резистентность.
Эффект от возникших толерантных мутаций оценивали по проценту колоний, находившихся в латентной фазе дольше 4,5 часов, а эффект резистентных — по минимальной концентрации антибиотика, ингибирующей рост бактерий (МИК).
В результате, когда ученые добились резистентности, МИК оказалась по меньшей мере в семь раз выше по сравнению со значением для обычных популяций. Последующий геномный анализ устойчивых культур показал, что все они приобрели усиливающие экспрессию мутации промоторной области гена ampC, который кодирует разрушающий ампициллин фермент.
При дальнейшем анализе ученые обнаружили, что уже после 3-4 циклов эксперимента большинство бактерий даже на нормальной среде демонстрируют отложенный рост — ту самую задержку в латентной фазе. При этом свидетельствующая о развитии резистентности МИК начинает расти существенно позже — между 7 и 17 циклом. Не объясненным оставалось только как именно происходит переход между обычной популяцией и резистентной — через толерантную или напрямую.
Генетический анализ показал, что обладатели резистентных мутаций в ampC несут также и мутации, приводящие к толерантности, причем последние появились раньше, а значит резистентность возникла на фоне толерантности. Более того, оказалось, что на ее фоне резистентность развивается гораздо быстрее. Причина, судя по всему, в том, что при таком цикличном протоколе возможность возникновения и закрепления мутаций зависит от двух ключевых моментов — вероятности возникновения мутации как таковой и вероятности того, что тот, у кого она возникла, пережил воздействие антибиотика. К тому же приводящие к толерантности мутации возникают чаще — хотя бы потому, что могут происходить во многих местах генома, в то время как резистентные ограничены зоной промотора гена ampC.
Вероятно, большее число толерантных особей создает потенциал, дающий преимущество для возникновения редких резистентных мутаций. Иными словами, толерантность способствует возникновению мутаций резистентности тем, что снижает вероятность потерять их. Ученые посчитали, что при выбранной схеме эксперимента переход от обычной популяции к резистентной напрямую, минуя толерантную, состоялся бы более чем через 100 циклов (против 17, наблюдавшихся в эксперименте).
В свете новых данных механизм приобретения полной резистентности представляется следующим образом — часто происходящие мутации приносят в популяцию толерантность, которая более чем на порядок увеличивают выживаемость, а следующие за ними более узконаправленные мутации в ampC существенно повышают МИК, увеличивая выживаемость еще сильнее. Особенно важно то, что происходит это даже при очень высоких концентрациях антибиотика — толерантность позволяет закрепиться частичной резистентности, которая затем легко переходит в полную.
В целом, значимая для развития резистентности роль толерантности открывает возможность использовать ее в разработке новых подходов лечения, препятствующих возникновению устойчивости.
Юрий Солюс
wi-fi.ru
г.Самара, ул. Димитрова 131 [email protected] |
 |