|
|
||||||||||
|
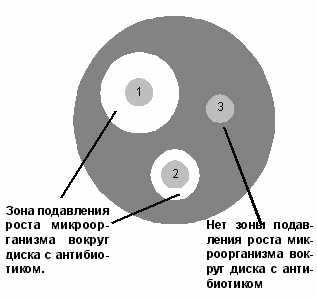
48.Методы определения чувствительности микробов к антибиотикам. Е тест антибиотикиМетоды определения чувствительности микроорганизмов к антибиотикамДиско-диффузионный метод На поверхность плотной питательной среды, засеянной сплошным газоном исследуемой культурой, накладывают не более 6 дисков, пропитанных антибиотиками, на расстоянии не менее 2 см друг от друга. Регистрация результатов проводится через 18-24 часов инкубирования в термостате по диаметру зоны отсутствия роста вокруг дисков с антибиотиками. Наличие роста вокруг диска свидетельствует о нечувствительности данного микроба к антибиотику. Для интерпретации результатов используются специальные таблицы. Рисунок 1. Определение чувствительности микроорганизмов диско-диффузионным методом: 1 – микроорганизм чувствителен к антибиотику; 2 – микроорганизм умеренно резистентен к антибиотику; 3 – микроорганизм устойчив к антибиотику. Метод Е-тестов Принцип метода. Определение чувствительности микроорганизма проводится аналогично тестированию диско-диффузионным методом. Отличие состоит в том, что вместо диска с антибиотиком используют полоску Е-теста, содержащую градиент концентраций антибиотика от максимальной к минимальной. В месте пересечения эллипсовидной зоны подавления роста с полоской Е-теста получают значение минимальной подавляющей концентрации (МПК).
Рисунок 2. Определение чувствительности микроорганизмов с помощью Е-тестов Метод серийных разведений в бульонной среде В пробирках, содержащих 1 мл Мюллер-Хинтон бульона, готовят серийные двукратные разведения антибактериального препарата, например 100 мкг/мл – 1-я, 50 мкг/мл – 2-я, 25 мкг/мл – 3-я, 12,5 мкг/мл – 4-я и т.д. Затем в каждую пробирку вносят 0,1 мл испытуемой бактериальной суспензии. Одновременно ставят контроль роста (1 мл Мюллер-Хинтон бульона и 0,1 мл суспензии бактерий). Посевы инкубируют при 37°С в течение 18-24 ч., после чего отмечают результаты. Отсутствие помутнения среды свидетельствует о задержке роста бактерий в присутствии данной концентрации препарата.
Рисунок 3. Определение значения МПК методом разведения в жидкой питательной среде Минимальная подавляющая концентрация (МПК) – наименьшая концентрация антибиотика (в мкг/мл или мг/л), которая in vitro полностью подавляет видимый рост бактерий. 2► Определение чувствительности разных штаммов стафилококков к антибиотикам методом стандартных дисков
Исследуемая культура является чувствительной к __________________________________________________ умеренно устойчивой к _________________________________________________________________________, устойчивой к _________________________________________________________________________________. Достоинства метода:____________________________________________________________________________ Недостатки метода:____________________________________________________________________________ 3►Определение минимальной подавляющей концентрации (МПК) пенициллина методом серийных разведений. Вывод: МПК пенициллина для исследуемого штамма составляет _____________________________________ Достоинства метода:____________________________________________________________________________ Недостатки метода:____________________________________________________________________________ 4►Выявление и регистрация антагонистического действия разных видов бактерий. На чашку с МПА штрихом по диаметру засевается микроб-антагонист и перпендикулярно к нему тест-штаммы. Учет результатов проводится через сутки после посева. Наличие и степень антагонистического действия определяют по величине зон задержки роста тест-культур.
Штриховой посев________________________ Вывод: наибольшее антагонистическое действие выявлено к тест-штаммам (укажите виды) _____________________________________________________________________________________________ ЗАНЯТИЕ № 8 ТЕМА: ИТОГОВОЕ ЗАНЯТИЕ ПО ТЕМЕ: «ИСТОРИЧЕСКИЕ ЭТАПЫ РАЗВИТИЯ МИКРОБИОЛОГИИ, МОРФОЛОГИЯ, ФИЗИОЛОГИЯ И ГЕНЕТИКА МИКРООРГАНИЗМОВ». ПЕРЕЧЕНЬ КОНТРОЛЬНЫХ ВОПРОСОВ
ЗАНЯТИЕ № 9 ТЕМА: ЭКОЛОГИЯ БАКТЕРИЙ. ИНФЕКЦИЯ. ПАТОГЕННЫЕ МИКРООРГАНИЗМЫ. ТОКСИНЫ МИКРОБОВ. БИОЛОГИЧЕСКИЙ (ЭКСПЕРИМЕНТАЛЬНЫЙ) МЕТОД. ПЕРЕЧЕНЬ КОНТРОЛЬНЫХ ВОПРОСОВ
ЛАБОРАТОРНАЯ РАБОТА 1► Изучения нормальной микрофлоры. А) Посев для изучения нормальной микрофлоры кожи рук на среду Эндо и кровяной агар методом реплик. Принцип метода: стерильные кусочки фильтровальной бумаги 1х1 см в чашке Петри увлажнить стерильным физ. раствором. Стерильным пинцетом поместить кусочек бумаги на исследуемую поверхность кожи рук на 0,5 мин. Поместить бумагу на поверхность плотной питательной среды (отпечаток) на 1 мин. Бумагу удалить. Чашки с отпечатками инкубировать при 370С, 24-48 часов. В) Провести учет посева микрофлоры, приготовить препараты из разных типов колоний, окрасить по Граму, микроскопировать (в демонстрационных посевах). Учет посева микрофлоры:
Микроскопия препаратов:
2► Оценка адгезивности E.coli по их способности к адсорбции на поверхности эритроцитов Принцип метода: К суспензии эритроцитов добавляют испытуемую культуру микроорганизмов. После инкубации готовят мазки, окрашивают и под микроскопом определяют среднее количество бактерий, адсорбировавшихся на одном эритроците. Эритроциты в данном случае используются в качестве модели клетки восприимчивого микроорганизма.
3► Определение ферментов инвазивности у стафилококков 1. Плазмокоагулаза Принцип метода: В пробирку, содержащую цитратную плазму крови кролика, вносится испытуемая культура. После инкубации в термостате учитывается результат. При положительном результате плазма свертывается (коагулирует).
2. Фибринолизин Принцип метода: В пробирку с фибрином (отмытый от эритроцитов сгусток крови) вносят испытуемую культуру. После инкубации в термостате учитывается результат. При положительном результате сгусток растворяется.
3. Гиалуронидаза Принцип метода: В пробирку с гиалуроновой кислотой (ГУК) вносят испытуемую культуру. После инкубации в термостате добавляют реактив, вызывающий свертывание ГУК и учитывают результат. При положительном результате (вследствие расщепления ГУК) сгустка не образуется.
4. Лецитовителлаза (лецитиназа) Принцип метода: выделенные культуры стафилококка засевают на желточно-солевой агар, который содержит 7,5% хлорида натрия и желточную суспензию. При положительном результате вокруг колоний вирулентных стафилококков образуется радужный ореол вследствие расщепления лецитина, содержащегося в желтке куриного яйца.
Вывод: (перечислите ферменты вирулентности каждого из двух изученных штаммов) _____________________________________________________________________________________________ _____________________________________________________________________________________________ Бактериальные токсины Токсичность __________________________________________________________________________________ Токсигенность _________________________________________________________________________________ Эндотоксин ___________________________________________________________________________________ Эндотоксический шок ___________________________________________________________________________ Практическое применение эндотоксинов: 1.____________________________________________________________________________________________ 2.____________________________________________________________________________________________ Экзотоксин ___________________________________________________________________________________ Анатоксин ____________________________________________________________________________________ Схема получения экзотоксина и анатоксина. 1.____________________________________________________________________________________________ 2.____________________________________________________________________________________________ 3.____________________________________________________________________________________________ 4.____________________________________________________________________________________________ Практическое применение анатоксинов: 1.____________________________________________________________________________________________ 2.____________________________________________________________________________________________ 3.____________________________________________________________________________________________ studfiles.net 48.Методы определения чувствительности микробов к антибиотикам.Определение чувствительности бактерий к антибиотикам: 1)Диффузионные методы-с использованием дисков с антибиотиками -с помощью Е-тестов 2)Методы разведения-разведение в жидкой питательной среде (бульоне) -разведение в агаре Культуры микроорганизмов, выделенные у больных, в настоящее время обязательно проверяют на чувствительность к антибиотикам, используемым для лечения. Это позволяет более рационально проводить антибиотикотерапию. Проверка чувствительности микробов к антибиотикам тем более необходима, что в последние годы появились штаммы микроорганизмов, устойчивые к различным антибиотикам. Для определения чувствительности микробов к антибиотикам существуют различные методы, среди которых наиболее распространены методы диффузии в агар (метод дисков) и метод последовательных разведений в жидкой или плотной питательной среде. Метод диффузии в агар, или метод дисков. Испытуемую культуру засевают сплошным газоном на поверхность чашки Петри с мясопептонным агаром. Затем на поверхность агара помещают диски, пропитанные растворами антибиотиков (рис. 26). Диски готовят из специального картона диаметром 6 мм. Содержание антибиотика в диске указывается на этикетке и соответствует рекомендации Всемирной организации здравоохранения (ВОЗ). Действие антибиотиков оценивают по феномену задержки роста вокруг диска после инкубации в термостате при 37°С в течение 18—24 ч. В зависимости от диаметра зоны задержки роста различают степень чувствительности испытуемого штамма: чувствительные (более 10 мм), малочувствительные (менее 10 мм) и устойчивые (отсутствие зоны). Вместо дисков при определении чувствительности микробов можно использовать цилиндрики (фарфоровые или металлические), куда заливают растворы антибиотика разной концентрации. Определение чувствительности микроорганизма с помощью Е-теста проводится аналогично тестированию диско-диффузионным методом. Отличие состоит в том, что вместо диска с антибиотиком используют полоску Е-теста, содержащую градиент концентраций антибиотика от максимальной к минимальной. В месте пересечения эллипсовидной зоны подавления роста с полоской Е-теста получают значение минимальной подавляющей концентрации (МПК). Несомненным достоинством диффузионных методов является простота тестирования и доступность выполнения в любой бактериологической лаборатории. Однако с учетом высокой стоимости Е-тестов для рутинной работы обычно используют диско-диффузионный метод. Метод последовательных разведений антибиотиков. Готовят серию двукратных разведений антибиотика в жидкой или плотной питательной среде, а затем в пробирки или на поверхность чашек Петри с каждым из разведений засевают испытуемую культуру микробов.Методы разведения основаны на использовании двойных последовательных разведений концентраций антибиотика от максимальной к минимальной (например от 128 мкг/мл, 64 мкг/мл, и т.д. до 0,5 мкг/мл, 0,25 мкг/мл и 0,125 мкг/мл). При этом антибиотик в различных концентрациях вносят в жидкую питательную среду (бульон) или в агар. Затем бактериальную суспензию определенной плотности, соответствующую стандарту мутности 0,5 по MсFarland, помещают в бульон с антибиотиком или на поверхность агара в чашке. После инкубации в течение ночи при температуре 35о-37оС проводят учет полученных результатов. Наличие роста микроорганизма в бульоне (помутнение бульона) или на поверхности агара свидетельствует о том, что данная концентрация антибиотика недостаточна, чтобы подавить его жизнеспособность. По мере увеличения концентрации антибиотика рост микроорганизма ухудшается. Первую наименьшую концентрацию антибиотика (из серии последовательных разведений), где визуально не определяется бактериальный рост принято считать минимальной подавляющей концентрацией (МПК). Измеряется МПК в мг/л или мкг/мл (рис. 3).Минимальная подавляющая концентрация (МПК) - наименьшая концентрация антибиотика (мг/л или мкг/мл), которая invitro полностью подавляет видимый рост бактерий. studfiles.net Методичка по антибиотикам61 -диско-диффузныйметод; -Е-тест. 2. Методы серийных разведений антибиотика в питательной среде: -разведение препарата в жидкой питательной среде; -разведение препарата в плотной питательной среде. По величине МПК все микроорганизмы можно разделить на три категории: чувствительные, умеренно устойчивые и устойчивые. Диффузные методы Несомненным достоинством диффузионных методов является простота тестирования и доступность выполнения в любой бактериологической лаборатории. Однако с учетом высокой стоимости Е-тестовдля рутинной работы обычно используютдиско-диффузионныйметод. Диско-диффузныйметод Диффузные методы определения чувствительности основаны на диффузии антибактериальных препаратов из носителя в плотную питательную среду. Стандартизованную суспензию исследуемого микроорганизма, соответствующую стандарту мутности 0,5 по MсFarland, засевают «газоном» на питательную среду. На поверхность посева укладывают стандартные бумажные диски, пропитанные антибиотиками, концентрации которых соответствуют требованиям ВОЗ. Диффузия антибиотика в агар приводит к формированию зоны подавления роста микроорганизмов вокруг дисков. После инкубирования посева в термостате оценивают чувствительность микроорганизма (рис. 5). Если исследуемый микроорганизм чувствителен к одному из препаратов, вокруг соответствующего диска образуется зона задержки роста, где концентрация антибиотика превосходит минимальную подавляющую концентрацию (МПК). Устойчивые к препарату культуры не образуют стерильных зон. Однако диффузный метод позволяет лишь косвенно судить о величине МПК, а результатом исследования является отнесение микроорганизма к одной из  62 категорий чувствительности (устойчивый, малоустойчивый, чувствительный, высокочувствительный штамм). Рис. 4. Определение чувствительности микроорганизмов диско-диффузионнымметодом. Е-тест Е-тест(от англ. ellips – эллипс, так как при наличии чувствительности образуется зона задержки роста эллиптической формы). Это модификация дискодиффузного метода, однако, пользуясь этим методом, можно определить МПК. Для реализации этого метода используют полоскуЕ-теста,содержащую градиент концентраций антибиотика от максимальной к минимальной (рис. 5). Полоски помещают на поверхность засеянной питательной среды. Если бактерии чувствительны к действию препарата, вокруг участков полоски, содержащих его ингибирующие концентрации, образуется эллипсовидная зона задержки роста, в месте пересечения которой с полоскойЕ-тестаполучают значение МПК.  63 Рис. 5. Определение чувствительности микроорганизмов с помощью Е-теста Метод серийных разведений в жидкой питательной среде Методы серийных разведений основаны на прямом определении основного количественного показателя, характеризующего микробиологическую активность антибактериальных препаратов – величины его МПК. МПК – минимальная концентрация, подавляющая видимый рост исследуемого микроорганизма в бульонной культуре или на плотной питательной среде. Принцип определения МПК основан на использовании двойных последовательных разведений концентраций антибиотика от максимальной к минимальной (например от 128 мкг/мл, 64 мкг/мл, и т.д. до 0,5 мкг/мл, 0,25 мкг/мл и 0,125 мкг/мл). При этом антибиотик в различных концентрациях вносят в жидкую питательную среду (бульон). Затем бактериальную суспензию определенной плотности, соответствующую стандарту мутности 0,5 по MсFarland, помещают в бульон с антибиотиком. После инкубации при температуре 37 оС проводят учет полученных результатов. Наличие роста микроорганизма в бульоне (помутнение бульона) свидетельствует о том, что данная концентрация антибиотика недостаточна, чтобы подавить его жизнеспособность. По мере увеличения концентрации антибиотика рост микроорганизма ухудшается. Первую наименьшую концентрацию антибиотика (из серии последовательных разведений), где визуально не определяется  64 бактериальный рост принято считать МПК. Измеряется МПК в мг/л или мкг/мл (рис. 6). МПК - наименьшая концентрация антибиотика (мг/л или мкг/мл), которая in vitro полностью подавляет видимый рост бактерий. Рис. 6. Определение значения МПК методом разведения в жидкой питательной среде. Несмотря на то, что метод серийных разведений является наиболее точным и информативным, его постановка в практических лабораториях сопряжена со значительными методическими трудностями. Прежде всего, речь идет о необходимости использования антибиотиков с известным уровнем активности, строгого соблюдения режимов хранения, тщательного выполнения контроля качества питательных сред, трудоемкости приготовления рабочих растворов антибиотиков. Метод серийных разведений в плотной питательной среде Этот метод аналогичен методу серийных разведений в жидкой питательной среде, однако определение МПК требует более сложных манипуляций. Готовят двойные серийные разведения препарата от 1:10000 до 1:320000, затем вносят по 1 мл каждого разведения в пробирки, содержащие расплавленный и остуженный до 45 0С агар. Затем содержимое пробирок быстро выливают в стерильные чашки Петри и после застывания питательной среды засевают 65 исследуемый микроорганизм. После инкубации определяют МПК по отсутствию роста на чашках, содержащих наименьшие концентрации препарата. Существуют два подхода к интерпретации результатов определения чувствительности: микробиологический и клинический. Микробиологическая интерпретация основана на анализе распределения значений концентраций антибиотика, подавляющих жизнеспособность бактерий. Клиническая интерпретация основана на оценке эффективности антибактериальной терапии. Оценка чувствительности к противогрибковым препаратам В связи с появлением случаев неэффективности противогрибковой терапии возникла реальная практическая потребность в определении чувствительности грибов к соответствующим препаратам. К сожалению, возможности для решения этой задачи весьма ограничены. В качестве стандартного рассматривают метод серийных разведений на среде RPMI 1640, воспроизводимые результаты обеспечивают ряд других методов и некоторые коммерческие тест-системы. Следует отметить, что использование нестандартизованных ("домашних" или коммерческих) методов оценки чувствительности грибов может привести к получению заведомо ложных результатов и серьезным ошибкам при выборе препаратов для лечения. studfiles.net ОПРЕДЕЛЕНИЕ ЧУВСТВИТЕЛЬНОСТИ К АМП | ООО «ВИТА РОС». Комплексное оснащение лабораторий оборудованием. Ростов-на-Дону | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Номер по каталогу | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Индивидуальнаяупаковка | Пенопластовый картридж(t° хранения +20°С / +4°С) | Пластиковая секционная упаковка(t° хранения –20°С) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Наименование | 30 стрипов | 100 стрипов | 30 стрипов | 100 стрипов | 30 стрипов | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Противогрибковые | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Амфотерицин | 526318 | 526310 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Анидулафунгин | 532008 | 532000 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Вориконазол | 532818 | 532810 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Итраконазол | 412380 | 525818 | 525810 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Каспофунгин | 412269 | 532418 | 532410 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Кетоконазол | 525918 | 525910 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Микафунгин | 535708 | 535700 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Позаконазол | 532118 | 532110 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Флюконазол | 412350 | 510818 | 510810 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Флюцитозин | 510918 | 510910 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Противотуберкулезные | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Изониазид | 527900 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Этамбутол | 527700 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Этионамид | 527500 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Противобактериальные | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Азитромицин | 412251 | 501618 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Азтреонам | 412259 | 501718 | 501710 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Амикацин | 412219 | 501318 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Амоксициллин | 412243 | 500918 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Амоксициллин / клавулановая кислота (2/1) | 412241 | 501018 | 501010 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Е-тест Ампициллин | 412253 | 501518 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Ампициллин/сульбактам (2/1) | 412251* | 501818 | 501810 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Бацитрацин | 528608 | 528600 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Бензилпенициллин (высокая концентрация) | 412263 | 502518 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Бензилпенициллин (низкая концентрация) | 412265 | 502618 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Ванкомицин | 412488 | 525518 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Гатифлоксацин | 530218 | 530210 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Гентамицин (высокая концентрация) | 512708 | 512700 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Гентамицин (низкая концентрация) | 412368 | 512518 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Даптомицин | 412324 | 535018 | 535010 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Доксициклин | 412328*** | 509718 | 509710 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Дорипенем | 412326*** | 535918 | 535910 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Имипенем | 412374 | 513618 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Канамицин | 527818 | 527810 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Кларитромицин | 508718 | 508710 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Клиндамицин | 412315 | 509518 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Колистин | 412317** | 537308 | 537300 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Левофлоксацин | 412393 | 527418 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Линезолид | 412396 | 531318 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Меропенем | 412402 | 513818 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Метронидазол | 412404 | 530018 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Мециллинам | 513708 | 513700 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Миноциклин | 412409*** | 516018 | 516010 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Моксифлоксацин | 412411** | 529018 | 529010 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Мупироцин | 412417*** | 413496 | 516300 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Налидиксовая кислота | 516508 | 516500 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Нетилмицин | 517518 | 517510 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Нитрофурантоин | 412426*** | 530408 | 530400 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Норфлоклацин | 412428** | 519508 | 519500 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Оксациллин | 412432 | 520518 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Офлоксацин | 519618 | 519610 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Пиперациллин | 521518 | 521510 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Пиперациллин/тазобактам (4мкг/мл) | 412434 | 521418 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Полимиксин | 533408 | 533400 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Рифампицин | 412450 | 526018 | 526010 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Спектиномицин | 529218 | 529210 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Стрептомицин | 412454 | 526808 | 526800 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Сульфаметоксазол | 534118 | 534110 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Тейкопланин | 412461 | 522018 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Тетрациклин | 412471 | 522518 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Тайгециклин | 412475 | 533518 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Тикарциллин/клавулановая кислота | 522618 | 522610 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Тобрамицин (высокая концентрация) | 533108 | 533100 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Тобрамицин (низкая концентрация) | 522718 | 522710 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Триметоприм | 523618 | 523610 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Триметоприм/сульфаметоксазол (1/16) | 412481 | 524418 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Фосфомицин | 529108 | 529100 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Фузидиева кислота | 511518 | 511510 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Хинупристин/дальфопристин | 528718 | 528710 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Хлорамфеникол | 412309 | 507518 | 507510 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Цефаклор | 504518 | 504510 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Цефалотин | 412307 | 503518 | 503510 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Цефепим | 412273 | 505018 | 505010 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Цефиксим | 412275 | 529918 | 529910 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Цефокситин | 412285 | 506518 | 506510 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Цефоперазон/сульбактам (2/1) | 529318 | 529310 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Цефотаксим (высокая концентрация) | 412279 | 505518 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Цефотаксим (низкая концентрация) | 412281 | 505618 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Цефотетан | 506308 | 506300 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Цефпиром | 506408 | 506400 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Цефподоксим | 505818 | 505810 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Цефтазидим | 412293 | 506718 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Цефтаролин | 412291 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Цефтизоксим | 527308 | 527300 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Цефтобипрол | 412297 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Цефтриаксон (высокая концентрация) | 412301 | 506618 | 506700 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Цефтриаксон (низкая концентрация) | 412303 | 507018 | 507000 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Цефуроксим | 506918 | 506910 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Ципрофлоксацин | 412311 | 508618 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Энрофлоксацин | 528908 | 528900 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Эритромицин | 412334 | 510518 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-тест Эртапенем | 412332 | 531618 | 531610 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
г.Самара, ул. Димитрова 131 [email protected] |
 |