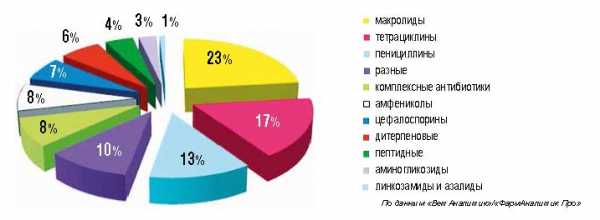
|
|
||||||||||
|
Современный взгляд на лечение системной красной волчанки. Скв и антибиотикиЭволюция методов лечения системной красной волчанкиПрофессор М. М. Иванова (Институт ревматологии РАМН)Несмотря на то, что прогноз системной красной волчанки (СКВ) в последние годы значительно улучшился, лечение этого заболевания остается весьма трудной задачей. Это обусловлено большой вариабельностью течения болезни, необходимостью подбирать адекватное активности болезни лечение в соответствии с органной патологией, разрабатывать так называемую поддерживающую терапию, чтобы избежать обострений и прогрессирования болезни. Оценка результатовПредставляет трудности и оценка отдаленных результатов. До сих пор обсуждается понятие «ремиссия» СКВ и тем более определение понятия такого состояния больных, когда на протяжении многих лет не возвращаются симптомы болезни даже без поддерживающей терапии. Больные ведут нормальный образ жизни, благополучно рожают и растят детей, работают, сохраняя профессиональную ориентацию, т.е. практически здоровы.Выживаемость больных СКВ значительно изменилась в течение последних 4 десятилетий: в 1959 г. 5-летняя выживаемость составляла менее 50 %, а к 90-м годам она достигла более 90 %. К 1998 г. 20-летняя выживаемость больных СКВ составляет 70 %. Основные причины улучшения прогноза больных СКВ — ранняя диагностика и разработка методов лечения с умелым применением ГКС, иммунодепрессантов, а также совершенствование терапевтических программ, включающих экстракорпоральные методы лечения, современные препараты, подавляющие отдельные симптомы болезни (гипотензивные, антитромботические, антибиотики и др.). Методы терапииОптимальные методы терапии разрабатывались на протяжении многих лет. Уже в первые годы работы Института ревматологии под руководством В.А.Насоновой были разработаны адекватные методы лечения СКВ глюкокортикостероидами (ГКС), когда удалось значительно увеличить продолжительность жизни больных, ранее обреченных [Насонова В.А. и др., 1968]. В последующие годы программа лечения ГКС неуклонно совершенствовалась, однако глюкокортикостероиды по сей день составляют основу лечения СКВ.Лекарственные формы ГКС совершенствовались на протяжении многих лет. Наиболее удобным при СКВ остается преднизолон, особенно 6-метилпреднизолон (урбазон, медрол, солюмедрол), минимально влияющий на водно-минеральный обмен. Введение фтора в молекулу преднизолона позволило создать новые ГКС (триамсинолон, дексаметазон, бетаметазон), которые используют при плохой переносимости преднизолона или его неэффективности в острой фазе СКВ. Однако для длительного применения они оказались малопригодными из-за быстрого развития ожирения, артериальной гипертонии (дексаметазон), миопатии (триамцинолон). ДозировкаДозировки ГКС на протяжении многих лет подбирались эмпирически. В большинстве случаев при высокой активности СКВ адекватной оказывается суточная доза преднизолона, составляющая 1 мг/кг массы тела. При гломерулонефрите и острых церебральных нарушениях, гематологическом кризе суточная доза может быть и выше (до 80—100 мг). Практически всем больным ГКС назначаются внутрь, так как они быстро и почти полностью всасываются в желудочно-кишечном тракте.Пероральный прием является наиболее эффективным путем введения ГКС. Укрепилось мнение о том, что ГКС следует давать больным СКВ в течение многих лет, в основном пожизненно, переходя с высоких доз в фазе активности к поддерживающим (7,5—5 мг) и сохраняя эту дозу даже в период клинической ремиссии. Лишь в редких случаях ГКС приходится вводить внутримышечно, увеличивая при этом дозу в 3—4 раза по сравнению с пероральной. Новую эру в лечении СКВ открыла пульс-терапия — внутривенное введение метилпреднизолона по 1000 мг в день в течение 3 дней. Метод оказался весьма эффективным у некурабельных ранее больных СКВ и успешно применяется в Институте ревматологии РАМН на протяжении последних 15 лет. Пульс-терапию проводят при активном люпус-нефрите, гематологическом кризе, острых нейропсихических расстройствах. Если в таких случаях диагноз СКВ не вызывает сомнений, не следует ждать, пока другая терапия окажется неэффективной. Поначалу показания к пульс-терапии были очень строгими. Так, например, считалось, что у больных с активным люпус-нефритом можно применять метилпреднизолон в сверхвысоких дозах лишь при наличии клеточной пролиферации в биоптате почки, подобной таковой при кризе отторжения. По мере накопления опыта изменилась и методика проведения пульс-терапии. Классическая пульс-терапия (по 1 г внутривенно в течение 3 дней) не всегда бывает достаточной. При активном люпус-нефрите мы проводили повторные курсы пульс-терапии метилпреднизолоном по 1000 мг (иногда 2000 мг) ежемесячно в течение 6—12 мес. Тактика ведения больных с активным люпус-нефритом очень сложна. Возможность быстрого снижения пероральной дозы преднизолона после пульс-терапии не подтвердилась в связи с ухудшением состояния у некоторых больных, прогрессированием почечного синдрома (в том числе быстрым снижением скорости клубочковой фильтрации). Вскоре после освоения метода пульс-терапии и оценки ее первых результатов мы изменили тактику лечения после завершения внутривенного введения метилпреднизолона. В последующие 4 нед продолжается лечение ГКС в достаточно высокой дозе внутрь (40— 50 мг преднизолона в сутки). У части больных-при недостаточной эффективности трехдневной пульс-терапии мы вводили метилпреднизолон внутривенно по 250 мг/сут еще 2—3 нед, что значительно повышало эффективность применения сверхвысоких доз ГКС при люпус-нефрите. Фармакокинетические исследования показали, что концентрация метилпреднизолона в плазме уже через 1 ч достигает максимума, а затем быстро снижается в течение 6—7 ч. Через 4 дня в периферической крови обнаруживают только следовые количества метилпреднизолона, чего явно недостаточно для достижения стойкого эффекта. О пересмотре механизма действия сверхвысоких доз метилпреднизолона сообщают Е.Л.Насонов и соавт. Пульс-терапия не только значительно снижает содержание активаторов воспаления, высвобождение вазоактивных веществ и их повреждающее действие на ткань почки, но и улучшает функцию почек за счет влияния на физиологические факторы (улучшение почечного кровотока, снижение общего периферического сосудистого сопротивления). Стимулируя почечный кровоток, метилпреднизолон в ударных дозах предотвращает сладж-феномен в капиллярах клубочков, характерный для активного люпус-нефрита. Наши наблюдения подтвердили, что внутривенное введение метилпреднизолона может несколько улучшить функциональную способность почек и при хронической почечной недостаточности, если имеются признаки активности нефрита, что можно объяснить уменьшением воспалительного процесса и активацией компенсаторных вазодилатационных механизмов. Пульс-терапию метилпреднизолоном следует индивидуализировать, учитывая возраст, особенности висцеральной патологии: у больных старшего возраста при давней болезни, артериальной гипертонии, поражении миокарда целесообразно изменить дозировку препарата (250—500 мг/сут в течение 8—10 дней). Многолетнее наблюдение показало, что в день проведения пульс-терапии следует в вечерние часы сохранять прием 1/4 суточной дозы преднизолона per os. Таким образом, тактика применения ГКС при СКВ за прошедшие десятилетия претерпела значительные изменения. Наиболее оправданным является применение препаратов метилпреднизолона, которые даже при длительном лечении реже вызывают побочные реакции. В.А.Насонова, Н.В.Бунчук medbe.ru что это такое, симптомы, лечение, признаки, причины, прогноз, диагностикаЧто такое системная красная волчанкаСистемная красная волчанка (СКВ) — системное хроническое воспалительное заболевание соединительной ткани с выраженным аутоиммунным патогенезом (иммунопатологическое заболевание). Частота. Первичная заболеваемость составляет около 30 случаев на 100 000 населения. Чаще болеют женщины детородного возраста (80 %). Соотношение женщин и мужчин — 10:1. Неудачное название болезни, не имеющей ничего общего с истинной, т. е. туберкулезной волчанкой. Правильнее называть красную волчанку эритематозом. Причины болезни еще точно не установлены —, ими могут быть перенесенные инфекции, резкое воздействие внешних раздражителей в виде холода, жара, травмы. Причины системной красной волчанкиПричины системной красной волчанки до настоящего времени остается невыясненной. Имеет место семейно-генетическая предрасположенность. Провоцируют заболевание аборты, беременность, роды, тяжелые нервные стрессы, начало менструальной функции у девушек, инфекции, инсоляция, поствакцинальная или лекарственная реакция аллергического характера. Не исключается влияние длительной персистенции вирусной инфекции, предрасполагающими факторами являются применение некоторых лекарственных средств (сульфаниламиды и антибиотики, гипотензивные и противосудорожные средства, вакцины и γ-глобулины), переохлаждение и длительная инсоляция, психические и физические травмы. Основным патогенетическим звеном при системной красной волчанке является образование иммунных комплексов, способных взаимодействовать с ядром клетки. В крови циркулируют иммунные комплексы ДНК-антиген + IgG и IgM. Отложения фибрина и микротромбообразование в капиллярах, артериолах и венулах способствуют развитию ишемии тканей и появлению геморрагии, вследствие повреждения сосудов микроциркуляторного русла. При системной красной волчанке отмечается и депрессия тимуса. В последнее время появились убедительные, в основном электронномикроскопические, данные об обнаружении в эндотелиальных клетках почки, кожи, лимфатических узлов и синовиальной оболочки больных вирусоподобных включений, которые имеют прямое отношение к развитию аутоиммунных нарушений, являясь либо нитями миксовирусов, либо продуктом жизнедеятельности вируса в клетке. Косвенно о значении вируса, по-видимому; близкого к миксовирусам, в развитии болезни свидетельствуют также высокие титры противокоревых, противогриппозных и других близких по группировке антител, обнаруженные при системной красной волчанке; имеются сообщения о высевании вируса из крови больных. Клинический опыт позволяет выявлять провоцирующие болезнь неспецифические факторы: инсоляцию (фотодерматоз), охлаждение, физическую и психическую травму, рентгеновы лучи, непереносимость антибиотиков, золота, сульфаниламидов, ряда противосудорожных средств; вакцинации, беременность, аборты и роды и т. д. Основное звено патогенеза связано с аутоиммунными нарушениями, обусловленными генетическими изменениями в иммуногенезе, в результате которых происходит избыточное образование циркулирующих и фиксированных аутоантител. Циркулирующие аутоантитела, в частности антитела к ДНК (нативной и с вторично измененной структурой), могут вступать в реакцию с соответствующими тканевыми аутоантигенами. Комплексы ДНК — анти-ДНК — комплемент обнаруживаются на базальных мембранах почек. Об аутоиммунной активности свидетельствует также пролиферация ретикулоплазмоцитарных элементов в иммунокомпетентных органах и.тканях. Определенное патогенетическое значение имеет также патология лизосомальных мембран, в результате разрыва которых в межклеточное пространство могут проникать ферменты — кислые гидралазы, способные вызвать воспалительную реакцию. В частности, повышенная чувствительность к солнечным лучам, ультрафиолетовому облучению, ряду лекарств связана со снижением устойчивости (лабилизацией) лизосомальных мембран. Глюкокортикоиды, напротив, повышают устойчивость этих мембран, с чем и связан один из механизмов лечебного действия препаратов этого ряда. Возможно патогенетическое значение промежуточных продуктов распада тирозина при нарушении его обмена. Патоморфология. В местах локализации иммунных комплексов выявляются васкулиты, инфильтрация тканей нейтрофи-лами, а в последующем — мононуклеарами с наличием в измененных тканях фибриноида и гематоксилиновых телец. К факторам, индуцирующим развитие СКВ, относят солнце, психологический стресс, периоды гормональной перестройки (беременность, роды, аборт), инфекции, лекарства (гидралазин, изониазид, вакцины и др.). Заболевание относят к В-клеточно-опосредованным аутоиммунным заболеваниям. Оно характеризуется генерацией аутоантител против ядерных антигенов. Классификация системной красной волчанкиСогласно классификации В.А. Насоновой, СКВ подразделяют:
Признаки и симптомы системной красной волчанкиПоражения сердца проявляются перикардитом, миокардитом с аритмиями, сердечной недостаточностью, эндокардитом Либмана—Сакса. Легкие при СКВ часто поражаются в виде плеврита или пневмонита. При аускультации люпус-пневмонит проявляется ослабленным дыханием. Могут выявляться дисковидные ателектазы. Поражение почек при СКВ протекает в виде нефрита с минимальными изменениями с небольшой протеинурией, гломерулонефрита, нефротического синдрома. Синдром Рейно встречается он у 10-40% больных в виде приступов периферического ангиоспазма с побледнением и отеком рук. Могут развиваться инсульт, менингит, периферическая нейропатия. Гематологические изменения при СКВ возникают в виде анемии, нормохромной или железодефицитной, после желудочно-кишечных кровотечений при стероидных язвах. Заболевание имеет волнообразный характер, полисиндромность развивается 2—3 года. Хроническое течение обусловлено возникновением рецидивов отдельных синдромов на протяжении продолжительного времени. Полисиндромность развивается в первые 5—10 лет, деформирующий полиартрит — в период следующих 5 лет. В случае высокой активности патологии отмечаются абдоминальные кризы, которые зачастую протекают по типу острого живота и могут развиваться в результате перитонитов, серозитов, возможной перфорации язвенных процессов, сосудистых расстройств и ишемии кишечникас развитием острой непроходимости. Характерно генерализованное распространение патологического процесса в сочетании с клиническим полиморфизмом (течение может быть как острым, так и хроническим). Болезнь проявляется чаще у девочек в пубертатном возрасте (с Шлет) повышением температуры тела с потливостью, недомоганием, слабостью и болями в суставах, а также разнообразными сыпями по типу аллергических. Характерны поражения кожи лица в виде «бабочки» (эритематозные высыпания на спинке носа и скуловых дугах) на слизистых оболочках в виде афтозного стоматита и молочницы с геморрагиями. Довольно быстро нарастает общая дистрофия, доходящая нередко до кахексии. Развиваются артралгии, подострый рецидивирующий недеформируюший артрит (по типу ревматического) и полисерозит. Поражаются различные внутренние органы с развитием кардитов, плеврита, сосудистой пневмонии, гепатита и гломерулонефрита, неврологических и гематологических нарушений. Патологические изменения со стороны нервной системы могут проявляться менингоэннефалитом, полирадикулоневритом, полиневритом, миелитом, энцефаломиелорадикулитом. Поражение органов кроветворения наблюдается у всех больных. В клиническом анализе крови выявляют лейкопению со сдвигом в формуле крови до промиелоцитов, миелоцитов, а также других форм в сочетании с лимфопенией. Отмечается умеренная гипохромная анемия, ускоренная до 50-70-90 мм в час СОЭ, часто — тромбоцитопения. Глазные симптомы при системной красной волчанкиПоражение глаз среди больных детей наблюдается примерно в 45-83% случаев, проявляясь ампулообразным расширением конъюнктивальных сосудов в окулолимбальной зоне, появлением в эписклере мелких гранулем, в роговице — множественных точечных субэпителиальных помутнений. Нередко развивается увеит по типу ревматоидного. По разным данным, сетчатка у таких больных поражается в 3-30% случаев, проявляясь единичными или множественными аневризмами, расширенными ретинальными капиллярами и неравномерным ходом сосудов, а также прерывистым током крови в сосудах сетчатки, т.е. ангиопатией сосудов сетчатки. Типичным признаком ретинопатии при синдроме красной волчанки являются «ватообразные» очаги мягкого экссудата, иногда сопровождающиеся геморрагиями. У больных, страдающих волчанкой более 5 лет, патологические изменения отмечаются преимущественно в сетчатке в виде геморрагии по ходу сосудов и беловато-желтоватых «ватообразных» очагов, реже — в виде более тяжелых вазо-окклюзивных осложнений (тромбозов ЦВС (или ЦАС) и ее ветвей в сочетании с васкулитами). Патологический процесс чаще развивается на двух глазах. Степень снижения зрения зависит от выраженности увеита, хориоретинита и двустороннего поражения зрительного нерва. Выявление у больных с системной красной волчанкой окклюзионных поражений сосудов сетчатки имеет важное диагностическое значение, так как оно предполагает наличие сопутствующего антифосфолипидного синдрома. Диагностика системной красной волчанки
Профилактический скрининг
Примечание. ЛПНП — липопротеины низкой плотности. Об активности процесса свидетельствуют рост СОЭ, фибриногена, гипергаммаглобулинемия. Возможна ложноположительная реакция Вассермана. В основе повреждений тканей при СКВ лежат потеря иммунной толерантности, избыточное содержание Th-лимфоцитов, постоянно меняющиеся Th2- и Тh3-индуцированные иммунные ответы (в итоге возникает дисбаланс цитокинов), дефект В-клеточной супрессии, повышенная активность В-лимфоцитов и безудержный синтез патологических антител. Перечисленные изменения реализуются в тканях в виде васкулитов и иммунного воспаления. Деструктивные и продуктивные васкулиты служат диагностически значимыми проявлениями. При этом ядерная патология клеток является патогномоничным признаком СКВ, включающая центральный хроматолиз, кариопикноз, кариорексис вплоть до формирования ядерной пыли, а также гематоксилиновые тельца. Антитела к клеточному материалу реализуют свое действие, разрушая хроматин, с развитием указанного признака в ядрах клеток мезенхимального происхождения (воспалительные и эндотелиальные клетки). При описании патологии почек необходимо разграничивать объем поражения отдельных клубочков и масштаб их вовлечения в патологический процесс. Когда говорим об отдельных клубочках, мы пользуемся терминами «сегментарный» и «тотальный». Сегментарное поражение означает наличие патологических изменений (некроз или пролиферация мезангиальных клеток) отдельных сегментов в пределах клубочка, тогда как тотальное поражение относится к клубочку в целом. Наряду с этим распространенность процесса в паренхиме почки оценивается по количеству измененных клубочков в корковом слое: при очаговом (фокальном) процессе имеется менее 50% патологически измененных клубочков, при диффузном процессе — более 50% клубочков. В 2003 г. консенсусная комиссия ВОЗ приняла классификацию гломерулонефритов, в соответствии с которой выделено шесть классов. Нельзя не отметить такого значимого морфологического симптома волчаночного нефрита, как симптом «проволочных петель» и так называемые гиалиновые тромбы. Для того чтобы «замуровать» депозиты, усиливается синтез вещества базальной мембраны пролиферирующими мезангиальными клетками. Наряду с этим развивается дистрофия эндотелия и подоцитов капсулы. Гиалиновые тромбы — массивные отложения иммунных комплексов, которые выступают в просвет капилляров. Важным показателем активности гломерулонефрита служит наличие лимфогистиоцитарных инфильтратов в интерстиции почки. При СКВ наиболее часто встречается мезангиопролиферативный гломерулонефрит. Это III (очаговый (фокальный) гломерулонефрит), IV (диффузный гломерулонефрит) типы и их исход — VI тип (нефросклероз). Наряду с определением морфологического типа гломерулонефрита особое значение для клиницистов имеет выраженность альтерации и воспаления, которые легли в основу определения индекса активности (ИА) гломерулонефрита. Его величина определяет выбор проводимой терапии. Ввиду постоянно прогрессирующего течения гломерулонефрита наряду с острыми изменениями в биоптатах почки выявляются и хронические проявления патологического процесса. Эти изменения отражают давность патологического процесса, проводимую терапию и позволяют определить индекс хронизации (ИХ), который имеет значение для оценки прогноза заболевания. Одним из критериев СКВ служит полисерозит. Серозные оболочки отечны, инфильтрированы лимфоцитами и плазматическими клетками, имеются наложения фибрина. Эти изменения видны при высокой активности волчаночного процесса. В стадии ремиссии преобладают спайки и утолщение оболочек. У больных СКВ может развиться эндокардит Либмана—Сакса с проявлениями пролапса митрального клапана. Створки клапана тусклые, ригидные, у основания прощупываются уплотнения. Гистологически на фоне выраженного отека видны очаговые лимфогистиоцитарные воспалительные инфильтраты с проявлениями ядерной патологии. Нередко при СКВ развивается пневмонит с присоединением вторичной инфекции и развитием крупозной пневмонии. СКВ может протекать с клиникой антифосфолипидного синдрома (АФС), который характеризуется невоспалительными поражениями сосудов всех калибров. В основе тромботических осложнений при АФС лежит васкулопатия — морфологический субстрат этого синдрома. При АФС иммунные комплексы обнаруживаются в виде депозитов в стенках сосудов. К основным особенностям сосудистой патологии при АФС относятся микротромбозы, геморрагии, альтерация эндотелия и базальной мембраны, отек, пролиферация клеточных элементов и ангиоматоз. Перечисленные изменения выявляются во всех внутренних органах. При первичном и вторичном АФС возможно сочетание васкулопатии с васкулитами. Выявленные морфологические признаки ядерной патологии, отложения иммунных комплексов в дермоэпидермальном стыке и лимфоцитарные васкулиты могут рассматриваться как прогностические признаки перехода первичного АФС во вторичный на фоне СКВ. Описанные морфологические признаки должны быть учтены при наличии клинических и лабораторных критериев АФС. Дифференциальный диагнозНапример, поражение суставов при СКВ и ревматоидном артрите (РА) может быть весьма сходным. Однако при РА артриты имеют стойкий прогрессирующий характер, сопровождаются значительной утренней скованностью, на рентгенограммах суставов выявляют эрозивные изменения. В отличие от РА при СКВ поражение суставов медленно прогрессирующее, не характерна утренняя скованность. СКВ дифференцируют с другими системными заболеваниями: системной склеродермией, дерматомиозитом. При дерматомиозите выявляют характерную гелиотропную сыпь — фиолетовые высыпания на веках; воспаление фиолетового цвета над суставами (симптом Готтрона), руки с трещинами кожи дистальных фаланг («рука машиниста»), васкулопатиями околоногтевой и десен ввиду отека и расширения сосудов. Прогноз системной красной волчанкиПрогноз для жизни — удовлетворительный при ранней диагностике, при адекватном и активном лечении заболевания и значительно ухудшается при развитии тяжелых осложнений. Летальность больных связана с почечной недостаточностью. Наблюдение и ведение пациентов с системной красной волчанкойТермин «волчанка» был впервые использован в начале 1800-х гг. и происходит от латинского «Canis lupus» — волк. Этот термин применили к кожному заболеванию «волчанка обыкновенная», чтобы описать вид поражений кожи, напоминающих волчьи укусы. Затем латинский термин был добавлен для обозначения красной волчанки. Почти во всех случаях наблюдают общую слабость, потерю массы тела и периодическую лихорадку. После общих симптомов наиболее частыми считают артралгию и проявления со стороны слизистых оболочек и кожи, которые составляют 5 из 11 критериев классификации СКВ (разработанной ACR). Боль в суставе с объективными признаками воспаления или без — наиболее частая причина обращения пациентов к своему врачу. В большинстве случаев поражение развивается в виде артрита мелких суставов, который захватывает также суставы запястья и коленные суставы и во многих отношениях напоминает РА. Оба заболевания могут быть полиорганными по своему проявлению, а узелки, подобные ревматоидным узелкам, могут быть у 10% пациентов. Эрозивные поражения не характерны для пациентов с СКВ. Сыпь в форме бабочки на скулах с распространением на носогубные складки — патогномоничный признак СКВ. Фотосенсибилизацию наблюдают примерно у половины пациентов с СКВ, что напоминает о важности избегания солнечных лучей и применения солнцезащитных средств, так как спектр света 360-400 нм вызывает как сыпь, так и обострение системных проявлений заболевания. Другие типы сыпи менее характерны для СКВ. Характер алопеции различный: от «остается больше волос на расческе или в ванной» до потери волос клочками, особенно при рубцевании дискоидных поражений волосистой части головы. Иммуносупрессивные препараты могут привести к снижению густоты волос. Прогрессирующее поражение почек при СКВ часто бессимптомное, и его необходимо выявлять с помощью анализа мочи на кровь и белок и периодического определения концентрации креатинина в сыворотке крови. Любое отклонение от нормы обосновывает дальнейшее исследование, включая суточный сбор мочи, микроскопию осадка мочи, и даже при небольших отклонениях показан осмотр нефрологом. Поражения плевры наблюдают у 30-60% пациентов, к ним относят симптоматический плеврит, выпоты и шумы трения плевры. Плеврит обычно не сопровождается шумом трения плевры, и дифференциальная диагностика включает первичный плевральный серозит и вторичный серозит по причине скрытой инфекции или инфаркт легкого (особенно у лиц с тромбофилией). Выпоты в плевральную полость могут быть обнаружены при рентгенографии, и обычно они небольшие. При достаточном для дренирования количестве экссудат содержит нормальное количество глюкозы. Мониторинг активности системной красной волчанкиСКВ поражает афроамериканцев в 3 раза чаще, чем евроамериканцев, и считают, что у них более плохой прогноз. Некоторые из различных социоэкономических, демографических и поведенческих показателей взаимосвязаны в высокой степени. Когортное исследование LUMINA (Lupus in minorities: nature versus nurture — Волчанка у малых наций: природа против воспитания) привело к созданию нескольких документов с последним сообщением о предикторах активности заболевания с течением времени. Когорта из 554 человек включала 18% техасских латиноамериканцев, 17% пуэрториканских латиноамериканцев, 36% афроамериканцев и 29% представителей европеоидной расы. Однофакторный анализ показал, что отношение шансов было равно 3 между техасскими латиноамериканцами или афроамериканцами и представителями европеоидной расы, а также свидетельствовал о более высокой активности заболевания с течением времени. Эти характеристики остаются значимыми в многофакторной модели. Высокая активность заболевания была независимо ассоциирована с недостатком страхования здоровья, нарушениями в поведении, связанными с заболеванием, и плохой социальной поддержкой и имела отрицательную связь с возрастом. Мониторинг лабораторных показателейГлавная цель — раннее выявление поражения почек, поскольку кривые выживаемости значительно различаются у лиц с поражением почек и без. Специфические симптомы не замечаются пациентом, пока не появится выраженный нефротический синдром или почечная недостаточность. Общий анализ мочи — очень дешевый и высокочувствительный метод определения гематурии и протеинурии, затем его можно дополнить сбором суточной мочи и количественной микроскопией осадка мочи. Рекомендуется регулярная оценка концентрации креатинина сыворотки крови. Рутинный анализ крови проводят для выявления анемии, лейкопении и тромбоцитопении. Интерпретация результатов должна входить в оценку эффективности терапии, глюкокортикоиды повышают содержание нейтрофилов и снижают содержание лимфоцитов, иммуннодепрессанты оказывают цитотоксический эффект. В исследовании LUMINA иммунологическим показателем, определяемым как независимый фактор, связанный с высокой степенью активности заболевания, были анти-дсДНК AT. Ранее эти AT связывали с активностью заболевания и волчаночным нефритом, но не с сопутствующими обострениями, поскольку существует мнение, что, когда иммунные комплексы откладываются в тканях, их концентрация в крови снижается. Повышенные титры анти-дсДНК AT, которые затем снижаются, могут свидетельствовать об ухудшении течения волчаночного нефрита или других органных нарушениях. Несмотря на то что этот факт остается противоречивым, некоторые авторы рекомендуют терапию глюкокортикоидами для профилактики обострений у пациентов с СКВ с такой картиной лабораторных изменений. При повышении титра анти-дсДНК AT следует провести тщательное обследование. Профилактическое наблюдениеС современными препаратами показатель выживаемости при СКВ значительно улучшается, так же как и при обострениях заболевания. Однако позже обнаруживают смертность из-за сердечно-сосудистого заболевания. Предрасположенность более молодых женщин к СКВ приводит к тому, что женщины с СКВ в пременопаузе имеют повышенный риск развития инфаркта миокарда (в 50 раз). Аутопсия и ангиографические исследования показывают повышенную распространенность атеросклеротических поражений у пациентов с СКВ. Оценка толщины комплекса «интима-медия» сонной артерии может быть использована в качестве суррогатного показателя атеросклероза, хотя из результатов исследований толщины комплекса «интима-медия» у пациентов с СКВ непонятно, повышается ли этот показатель при заболевании. При перекрестных исследованиях выявляют атеросклеротические бляшки в сонных артериях у одной трети женщин с СКВ. Остается неясным, повышена ли частота атеросклероза при СКВ в общем распределении или СКВ служит первично повышенным риском развития атеросклеротической бляшки. Традиционные факторы риска развития сердечно-сосудистых заболеваний следует искать и контролировать у пациентов с СКВ, но, согласно исследованию, существуют некоторые другие факторы риска. Подавление активности воспаления служит целью лечения СКВ; активность воспаления можно оценить по СОЭ и концентрации СРВ. При СКВ сложный гипергаммаглобулиновый ответ приводит к хроническому повышению СОЭ, делая СРВ лучшим маркером воспаления. Системное воспаление ускоряет атеросклеротический процесс. В общей популяции повышенные концентрации СРВ ассоциированы с повышенным риском развития сердечно-сосудистых заболеваний. В одном из сообщений LUMINA СРВ был специфическим фактором риска сердечно-сосудистых заболеваний: среднее значение СРВ в сыворотке крови у всех пациентов с сосудистыми явлениями было примерно в 3 раза выше, чем при отсутствии сосудистых проявлений. Однако эта находка также создает парадоксальную ситуацию с глюкокорти-коидами, которые, с одной стороны, представляют очень мощные ингибиторы воспаления, но, с другой стороны, при длительном применении высоких доз приводят к неблагоприятным исходам со стороны сердечно-сосудистой системы. Возможно, что низкие дозы глюкокортикоидов, которые оптимизируют подавление воспаления, могут оказывать положительное воздействие на сердечно-сосудистую систему. Даются рекомендации о прекращении курения, поскольку курение ускоряет развитие атеросклероза и обостряет течение СКВ. Недавний метаанализ показал, что курение повышало вероятность СКВ (отношение рисков 1,5), наиболее заметно при наличии AT к дсДНК. Соотношение риск/польза приема низких доз ацетилсалициловой кислоты (60-100 мг/сут) является основанием для ее применения у всех пациентов с СКВ. Всем пациентам с СКВ, имеющим определенный риск развития сердечно-сосудистых заболеваний, следует принимать ацетилсалициловую кислоту в низких дозах: как с положительными антикардиолипиновыми AT класса IgG, так и с положительным волчаночным антикоагулянтом. Лечение системной красной волчанкиЗаболевания лечится длительно. Основными лекарственными средствами лечения системной красной волчанки являются глюкокортикостероиды (ГКС). Подавляющая доза подбирается индивидуально: при подостром течении — 30-40 мг/сут преднизолона, при острых формах — 60-80 мг/сут; при активном процессе с поражением почек и ЦНС — 80-120 мг/сут. У больных с тяжелым течением СКВ и при волчаночных кризах оправдана «пульс-терапия», после чего назначают ГКС в обычной дозе. После исчезновения клинических и лабораторных признаков активности СКВ дозу ГКС постепенно снижают (темп — 1/2-1/4 таблетки в неделю) до поддерживающей. При отсутствии эффекта от ГКС применяют цитостатические иммунодепрессанты и методы экстракорпоральной иммунокоррекции (гемосорбция, плазмаферез), а при хронической почечной недостаточности — гемодиализ. У больных с быстропрогрессирующим течением заболевания, васкулите, цитопении применяют плазмаферез. Модифицируемые факторы жизни включают необходимость избегать солнечных лучей, прекратить курение, выполнять физические упражнения, соблюдать диету (особенно с влиянием на нарушенный баланс со3/со6-жирных кислот и со снижением потребления соли при наличии артериальной гипертензии) и контроль массы тела. Могут потребоваться специфические мероприятия для лечения дислипидемии, сахарного диабета и артериальной гипертензии. Необходимо избегать прямого воздействия солнечных лучей: широкополые шляпы, солнцезащитная одежда и регулярное применение качественных солнцезащитных средств. Доступность некоторых косметических увлажняющих средств и средств макияжа с солнцезащитным компонентом помогает в защите от солнечного воздействия. НПВС и селективные ингибиторы ЦОГ-2 часто применяют при симптомах со стороны мягких тканей и для контроля артралгии и артрита в общей популяции и при СКВ, хотя их действие совершенно неспецифично. Однако их следует применять с осторожностью из-за риска развития артериальной гипертензии, периферического отека и снижения функции почек. Согласно ныне принятым рекомендациям, ингибиторы ЦОГ-2 не следует использовать у пациентов, которые имеют сердечно-сосудистые заболевания или находятся в группе повышенного риска их развития. Гидроксихлорохин (200-400 мг/сут) полезен при кожных сыпях, суставных болях и язвах слизистой оболочки полости рта. Он также обладает слабым антиагрегантным действием. Дозы менее 6 мг/(кг х сут) ассоциированы с очень низким риском ретинопатии, и терапевтам необходимо обсудить с местным офтальмологом план наблюдения. Более высокие дозы могут быть использованы в коротком режиме у пациентов с продолжающейся фотосенсибилизацией. Пока механизм его действия окончательно не ясен: он нарушает образование Аг, влияя на рН фаголизосомы и может также регулировать врожденный имммунитет через То11-подобные рецепторы (TLR). У этого препарата ожидали тератогенный эффект, но нынешние результаты позволяют исключить его, в связи с чем применение данного препарата безопасно и эффективно во время беременности. Препарат дегидроэпиандростерон назначают для лечения СКВ, поскольку у пациентов снижается утомляемость. Дегидроэпиандростерон — предшественник половых гормонов, вырабатывается надпочечниками и превращается в эстрогены или андроген в различных периферических тканях. Рандомизированные плацебо-контролируемые исследования подтверждают умеренный лечебный эффект при приеме дегидроэпиандростерона в дозе 200 мг/сут, но этот эффект перевешивают побочные эффекты в виде гирсутизма, акне, артериальной гипертензии и неблагоприятного липидного профиля. Заманчиво назначить глюкокортикоиды внутрь пациенту с малыми симптомами СКВ. Однако, как было отмечено, очень трудно достичь хорошего контроля дозы и прекратить терапию. Токсические эффекты глюкокортикоидов включают гипергликемию, гиперхолестеринемию, артериальную гипертензию, остеопороз, глаукому, увеличение массы тела, атрофию кожи, миопатию и асептический некроз. В качестве дополнительного и конкурентного для глюкокортикоидов препарата азатиоприн представляет собой один из иммунодепрессантов, наиболее часто используемых при СКВ. Будучи пуриновым аналогом, он угнетает синтез ДНК и в дозах 1,5-2,5 мг/(кг х сут) эффективен в профилактике развития серьезных осложнений СКВ. Лекарственная гиперчувствительность наблюдается у небольшого процента пациентов, приводя к развитию системных поражений, сыпи, острому гепатиту и болям в животе. Рекомендуется контроль состояния костного мозга, функций печени и активности липазы с интервалами от 4 до 6 нед. Поскольку азатиоприн относится к цитотоксическим препаратам, его не рекомендуют применять во время беременности, хотя данные по тератогенности ограничены, а полезные эффекты влияния на контроль заболевания, исход для плода и здоровье матери могут потребовать продолжения его приема во время беременности. Нефрит при СКВ характеризуется клубочковым и тубулоинтерстициальным воспалением, опосредованным иммунными комплексами, которое приводит к развитию хронической почечной недостаточности в 30% случаев. Циклофосфамид служит основой лечения диффузного гломерулонефрита [IV класс по классификации Всемирной организации здравоохранения (ВОЗ)]. Циклофосфамид, назначаемый в инфузиях по 500 мг 6 раз с последующим приемом азатиоприна внутрь, был настолько же эффективен, как и режим первоначального применения более высоких доз циклофосфамида по схеме Национального института здоровья. Эволюция применения микофенолата мофетила от случаев отторжения трансплантата до более широких показаний для иммуносупрессии определила, что в дозе 2-3 г/сут он, так же как циклофосфамид, эффективен в индуцировании и поддержании ремиссии в случаях с легким или умеренным течением заболевания почек. Микофенолата мофетил обладает более хорошим профилем безопасности, чем циклофосфамид, не вызывает геморрагический цистит, недостаточность яичников и отдаленные риски развития рака. Систематический обзор и метаанализ выявили, что полный или частичный (66-80%) ответ наблюдался чаще при использовании микофенолата мофетила, чем циклофосфамида, препарат дает один дополнительный полный или частичный положительный ответ на каждые 8 пролеченных пациентов. Поражение ЦНС описано почти у 50% пациентов с СКВ. Наиболее частыми проявлениями, встречаемыми у 60-80% пациентов, стали нарушения сознания и головные боли. Редко встречаются асептический менингит, демиелинизация, миелопатия, острые нарушения сознания или психозы. Распространенность депрессии при СКВ не выше, чем при других хронических изнуряющих заболеваниях. Психоз при СКВ характеризуется возникновением бредовых идей или галлюцинаций; он не типичен для СКВ и встречается лишь у 2-5% пациентов, получающих высокие дозы [1 мг/(кг х сут)] глюкокортикоидов. До постановки диагноза волчаночного психоза всегда следует исключить вторичные его причины, такие, как применение препаратов или их отмена, метаболические и электролитные нарушения и сепсис. СКВ — заболевание, трудное для диагностики и успешного лечения. Ожидается повышение частоты развития легких форм системной красной волчанки, что связано с многообразием ее клинических проявлений, а также повышением доступности тестов на аутоАТ. Существуют значительные продвижения в лечении СКВ. Иммунодепрессанты, такие как микофенолата мофетил, привели к значительному улучшению эффективности лечения нефрита. На горизонте появились даже новейшие препараты, например препарат моноклональных AT — ритуксимаб, который вызывает выраженную и длительную ремиссию у пациентов, ранее не отвечавших на лечение. Остаются проблемы, связанные с улучшением общего качества жизни, снижением утомляемости и защитой пациентов от кардиоваскулярной смерти, поскольку у таких пациентов может развиваться инсульт. Иммуносупрессивные препаратыИммуносупрессивное лечение занимает большую часть ревматологической практики. Оно служит краеугольным камнем в лечении многих иммуноопосредованных заболеваний соединительной ткани, включая РА, СКВ, склеродермию, васкулиты и СШ. Вследствие широкого применения иммуносупрессивных препаратов терапевты и врачи общей практики должны знать методы их применения и мониторирования их эффектов. ГлюкокортикоидыЭти препараты связываются с элементами генома, отвечающими на глюкокортикоиды, таким образом, они регулируют активность большого числа генов, снижают экспрессию провоспалительных цитокинов, включая ИЛ-1 и ИЛ-6. Сниженная продукция ИЛ-2 Т-лимфоцитами сопровождается снижением пролиферации лимфоцитов. Угнетается активность цитотоксических клеток и фагоцитов. Повышенная активность ингибитора к-В снижает активность ключевого регулирующего пути, вовлекающего нуклеарный фактор к-В (NF-кВ) с последующим снижением регуляции компонентов иммунного ответа и увеличением апоптоза лимфоцитов. По крайней мере 1 из 200-400 человек в популяции (показатель выше среди пациентов пожилого возраста) длительно принимает глюкокортикоиды, особенно преднизолон. Одним из основных показаний к применению других иммунодепрессантов служит необходимость использования глюкокортикоидов в минимальных дозах в связи с их отдаленными побочными эффектами. Последние включают артериальную гипертензию, гипергликемию, остеопению, катаракту, язвы желудка, нарушение заживления ран и предрасположенность к инфекции. Следует по возможности использовать местные препараты (ингаляционные, ректальные или кожные). Антипролиферативные и антиметаболические препаратыАзатиоприн (имуран) — пуриновое производное, которое используется как антиметаболическое средство с начала 1960-х гг. Его применяют у пациентов с трансплантатами и при лечении РА. Побочные эффекты включают угнетение костного мозга, предрасположенность к инфекциям (особенно вирусам опоясывающего лишая и простого герпеса), гепатотоксичность, алопецию и повышенный риск злокачественных новообразований. Метотрексат используют при псориазе и РА, а также в лечении злокачественных новообразований. Он угнетает дигидрофолат редуктазу и, следовательно, снижает синтез пуринов и прогрессию клеточного цикла от фазы G1 до фазы S. Это может объяснить его цитотоксические эффекты, а противовоспалительные эффекты связаны с увеличением содержания аденозина. Побочные эффекты включают угнетение костного мозга, интерстициальную пневмонию, повышение активности ферментов печени, редко — более тяжелые поражения печени. Следует ежемесячно контролировать КАК, печеночные пробы и использовать адекватную контрацепцию. Циклофосфамид применяют чаще всего при СКВ и васкулитах, включая бесплодие, алопецию, гранулематоз Вегенера. Побочные эффекты включают лейкопению, геморрагический цистит и повышенный риск развития переходноклеточной карциномы, лимфомы. Лефлуномид применяют при активном РА, особенно у лиц, не отвечающих на метотрексат, у которых лефлуномид можно использовать самостоятельно или в комбинации с метотрексатом. К побочным эффектам относят диарею, алопецию, тяжелые кожные реакции, пневмонию, артериальную гипертензию и неврологическую токсичность. Следует ежемесячно контролировать КАК и печеночные пробы в первые 6 мес, а затем 1 раз в 2 мес, а также АД. Необходима адекватная контрацепция, поскольку лефлуномид обладает длительным периодом полувыведения из-за гепатической циркуляции. Микофенолата мофетил гидролизуется в организме до микофеноловой кислоты и угнетает пролиферацию Т- и В-лимфоцитов посредством ингибирования фермента инозинмонофосфат дегидрогеназы, используется чаще при волчаночном нефрите, других системных заболеваниях. Он может вызывать угнетение костного мозга, пневмонию и тяжелую диарею. Сиролимус (рапамун) связывается с РК506-связывающим белком (12 кДа) (FKBP-12) и в таком виде подавляет активацию киназы «мишени рапамицина млекопитающих» (mTOR) — ключевого белка клеточной пролиферации. Этот препарат применяют главным образом у пациентов с трансплантатами и в стентах, содержащих лекарственные препараты, у пациентов с ишемической болезнью сердца. Ингибиторы кальциневринаКальциневрин — Са2+/кальмодулин-зависимая фосфатаза, которая вовлечена в дифференциацию и пролиферацию Т-лимфоцитов. Фермент катализирует дефосфорилирование ядерного фактора активированных Т-лимфоцитов (NFAT), который затем транслоцируется в ядро и повышает экспрессию про-воспалительных цитокинов, включая ИЛ-2. Циклоспорин (взаимодействуя с циклофиллином) и такролимус (взаимодействуя с FKBP-12) подавляют фосфатазную активность кальциневрина. Циклоспорин — циклический пептид, состоящий из 11 аминокислот, который продуцируется грибом Beauveria nivea. Его преобладающий эффект заключается в угнетении Т-лимфоцитарного ответа. Препарат можно назначать внутривенно (сандиммун) или внутрь (неорал). Он главным образом используется при трансплантации, РА и псориазе. У пациентов с трансплантацией его обычно комбинируют с глюкокортикоидами и азатиоприном или микофенолатом мофетила. При РА его обычно используют при неэффективности БПРП первой и второй линии, включая метотрексат. С внедрением препаратов AT к ФИО циклоспорин стали использовать реже. Наиболее типичный тяжелый побочный эффект препарата — нефротоксичность. Этот препарат может также ухудшить течение артериальной гипертензии, гипергликемии и гиперури-кемии. Побочные эффекты включают также тремор, гирсутизм и гиперплазию десен. Следует проводить мониторинг поддержания концентрации препарата в плазме крови в диапазоне 50-100 нг/мл. Такролимус (програф) представляет собой антибиотик из группы макролидов, продуцируемый актиномицетом Streptomyces tsukubaensis. Его назначают внутрь или парентерально главным образом у пациентов после трансплантации. При его применении относительно часто развиваются нефротоксичность и нейротоксичность. Лечение моноклональными антителамиЛимфоцитарный иммуноглобулин и антитимоцитарный глобулин стали использовать для иммуносупрессии с 1960-х гг. Чтобы избежать побочных эффектов, связанных с применением поликлональной сыворотки, разработали лечение моноклональными или моноспецифичными AT. К ним относят следующие AT.
Другие препаратыГидроксихлорохин (плаквенил, 200-400 мг/сут) — противомалярийное средство, используемое при РА и СКВ. В последнем случае он может быть особенно полезен при кожных проявлениях. Препарат обычно хорошо переносят, но он может вызвать нарушение зрения. Пациента должен осмотреть офтальмолог до лечения и через 6 мес. Сульфасалазин применяют при РА и серонегативных спондилоартропатиях. Он может вызывать диспептические расстройства, головную боль, сыпь (включая фоточувствительную) и изменение окраски мягких контактных линз. Из-за потенциального токсического действия на костный мозг каждые 2 нед в первые 3 мес, а затем 1 раз в 3 мес следует оценивать КАК. Печеночные пробы следует контролировать 1 раз в месяц в течение первых 3 мес, а затем 1 раз в 6 мес. Использование иммуносупрессивных препаратов изменило тактику ведения многих незлокачественных заболеваний. Их следует применять только в тех случаях, при которых они строго показаны, и при соответствующей программе контроля действия лекарственного средства. Терапевтический мониторинг концентрации препаратов стали проводить чаще с появлением новейших лекарственных средств, включая циклоспорин, мико-фенолата мофетил, сиролимус и такролимус. Применение иммуносупрессивных препаратов
Фармакогеномика — быстроразвивающаяся область. Экспрессия ключевых ферментов значительно различается у индивидов, и это может объяснить, почему некоторые пациенты не отвечают на препараты, в то время как другие очень чувствительны и более предрасположены к развитию побочных эффектов. Для прогнозирования ответа на азатиоприн может быть полезна информация об активности тиопурин-метилтрансферазы. Лица с высокой активностью ферментов находятся в группе риска развития передозировки, а пациенты с низкой активностью ферментов могут быть более предрасположены к развитию побочных эффектов, включая угнетение костного мозга. Подобным образом важными показателями ответа на метотрексат могут быть различные вариации экспрессии метилен-тетрагидрофолат-редуктазы. Неясно, реагируют ли по-другому на препараты лица с более поздним началом РА, в отличие от лиц с более ранним началом заболевания. В последнем исследовании, проведенном Тутунку (Tutuncu) и соавт., у пациентов пожилого возраста с РА продолжительность и тяжесть болезни оказались сопоставимыми с таковыми у более молодых пациентов. Однако эти пациенты менее вероятно получают агрессивное лечение, что частично связано с недооценкой тяжести заболевания, особенно при наличии сопутствующих болезней, или страхом развития возможных побочных эффектов. Большинство стимулов разработки клинических исследований с более новыми средствами исходят из области трансплантологии. Примерами изменения показаний в практической деятельности служит возрастающее применение микофенолата мофетила при волчаночном нефрите (ранее препаратом выбора был циклофосфамид) и возрастающая частота применения циклоспорина при аутоиммунных заболеваниях. Нефротоксичность может ограничить использование данного препарата ревматологами, но он может быть очень эффективен при состояниях, угрожающих жизни, при которых другие лекарственные средства оказались неэффективны. Среди биологических препаратов самое широкое применение нашли антагонисты ФНО-а. Большая вероятность максимального эффекта биологических препаратов при РА наблюдается, когда их комбинируют с цитотоксическими средствами, такими как метотрексат. Количество иммуносупрессивных препаратов увеличивается, так же как и доказательства относительно их применения при отдельных заболеваниях. Выбор препарата зависит от клинической картины и диагноза, оценки вероятных полезных эффектов и возможных рисков. Первыми часто используют глюкокортикоиды, но существует тенденция применения их в низких дозах, и поэтому их часто комбинируют с другими препаратами. В течение многих лет используют метотрексат, азатиоприн и циклофосфамид, которые до сих пор играют большую роль в лечении. В целом наиболее важным аспектом служит контроль КАК, функции печени и почек. Применение более новых препаратов и биологических средств возрастает, хотя оно ограничено до сих пор ценой и клиническим опытом. При соответствующем мониторинге и выборе режима лечения безопаснее и эффективнее лечение системного заболевания соединительной ткани препаратами, подавляющими иммунную систему. Профилактика системной красной волчанкиРодственникам больных, имеющих стойкую лейкопению, увеличенную СОЭ, гипергаммаглобулинемию, антитела к ДНК, необходимо избегать переохлаждения, прививок, физиотерапевтического лечения. Ранней весной повторное лечение хлорохином (делагилом) и применение фотозащитных кремов, мазей. Больные эритематозом подлежат диспансерному наблюдению. СКВ — одна из великих «масок» в медицине с множеством различных проявлений. Несмотря на потенциальную возможность развития изнуряющего заболевания, в большинстве случаев имеется клиническая картина нечетко очерченного заболевания с преобладанием субъективных жалоб над объективными признаками. Со временем появляется большое количество признаков заболевания, представленных в табл. 22-1, и они не накапливаются, поэтому должен быть собран детальный предшествующий анамнез, особенно с учетом того, что многие проявления, такие как язвы слизистой полости рта или фотосенсибилизация, вновь спонтанно не возникают. Это говорит о том, что изменение клинической картины характерно для СКВ, и не стоит чрезмерно полагаться на наличие АНАТ для постановки этого диагноза. www.sweli.ru Современный взгляд на лечение системной красной волчанки | Клюквина Н.Г., Шекшина С.В., Насонов Е.Л.Для цитирования: Клюквина Н.Г., Шекшина С.В., Насонов Е.Л. Современный взгляд на лечение системной красной волчанки // РМЖ. 2002. №6. С. 307 ММА имени И.М. Сеченова, Институт ревматологии РАМН, Москва Системная красная волчанка (СКВ) – аутоиммунное ревматическое заболевание, в основе патогенеза которого лежат дефекты иммунорегуляции, приводящие к неконтролируемой гиперпродукции аутоантител к компонентам собственных тканей и развитию хронического воспаления, затрагивающего многие органы и системы. Пристальный интерес к СКВ за последние 50 лет позволил усовершенствовать методы диагностики заболевания, однако курация больных продолжает оставаться сложной задачей. Разработку методов лечения затрудняют прежде всего неизвестная этиология заболевания, большая вариабельность клинических проявлений, возможность как длительных спонтанных ремиссий, так и злокачественного, быстро прогрессирующего, иногда молниеносного течения [1]. Для контроля над болезнью в настоящее время используется практически весь арсенал существующих в медицине противовоспалительных и цитотоксических препаратов, применение которых позволило существенно улучшить прогноз жизни больных. Если до 1970 года продолжительность жизни только 40% больных СКВ превышала 5 лет, то в настоящее время 5–летняя выживаемость составляет 90% и более [2]. В этом плане трудно переоценить значение глюкокортикоидов (ГК), эффект которых наступает практически сразу после назначения. Многолетние наблюдения показали, что ГК были и остаются препаратами выбора при остром течении заболевания с висцеральными проявлениями. Однако уже на первых этапах стало ясно, что длительная глюкокортикоидная терапия у больных СКВ поднимает ряд вопросов в отношении доз, продолжительности лечения и профилактики осложнений, связанных с приемом сильнодействующих препаратов. Глюкокортикоидная терапия совершенствовалась на протяжении ряда лет: модифицировались лекарственные формы, установлены определенные положения о дозах в соответствии со степенью активности болезни и определенной висцеральной патологией. Укрепилось мнение о том, что ГК следует давать больным СКВ в течение многих лет, в основном пожизненно, переходя с высоких доз в фазу высокой активности к поддерживающим и сохраняя эту дозу даже в период клинической ремиссии. Новым этапом в использовании ГК при СКВ стало внедрение метода внутривенного введения сверхвысоких доз – «пульс–терапии», который оказался весьма эффективным у некурабельных ранее больных. Имеющиеся данные свидетельствуют о значительном иммуносупрессивном действии вводимых внутривенно высоких доз ГК уже в первые сутки. Полагают, что ударные дозы ГК (в первую очередь метилпреднизолона) приостанавливают образование иммунных комплексов, в большей степени депонируются в воспаленных тканях, блокируют повреждающее действие лимфотоксинов. Противовоспалительный и иммунорегуляторный эффект пульс–терапии в значительной степени обусловлен воздействием на систему цитокинов, фактор некроза опухоли и подавлением транскрипции генов металлопротеиназ и липокортина. За годы применения пульс–терапии изменилась и методика ее проведения. Во–первых, пересмотрена концепция о применении этого метода только тогда, когда не помогают другие виды лечения. Выделена определенная категория больных (молодой возраст, быстропрогрессирующий люпус–нефрит, высокая иммунологическая активность), у которых данный способ должен использоваться в дебюте заболевания или незамедлительно при любом обострении. Во–вторых, не всегда достаточно «классической» пульс–терапии (ежедневно в течение 3–х последовательных дней из расчета 15–20 мг на кг веса больного). С целью повышения эффективности в ряде случаев ударные дозы метилпреднизолона назначаются с интервалами в несколько недель в течение нескольких месяцев. Для усиления воздействия на иммунопатологические процессы программное назначение пульс–терапии метилпреднизолоном может быть усилено добавлением циклофосфамида, причем для достижения клинического эффекта в некоторых случаях внутривенное введение метилпреднизалона и циклофосфамида продолжается в течение 5–10 дней. Особым образом строится стратегия лечения больных при неэффективности стандартных программ пульс–терапии метилпреднизалоном и циклофосфамидом, в случаях резистентности к назначаемым препаратам, а также при наличии сочетания нескольких прогностически неблагоприятных факторов. В таких ситуациях наиболее перспективно проведение синхронной интенсивной терапии, в основе которой лежит комбинация пульс–терапии и экстракорпоральных методов лечения (плазмафереза) [3]. Терапия только ГК не позволяет подавить активность при некоторых формах СКВ. С 60–х годов в комплекс лечения были включены цитостатические иммунодепрессанты, аминохинолиновые производные и другие препараты, ставшие наряду с ГК как бы базисной терапией. Чаще всего при СКВ применяют циклофосфамид, азатиоприн и хлорбутин, в последние годы при некоторых формах стали с успехом назначать метотрексат. Показаниями к включению цитостатических иммунодепрессантов в комплексное лечение больных СКВ в настоящее время считаются активный волчаночный нефрит и генерализованный васкулит, высокая общая активность болезни и резистентность к ГК; появление побочных реакций этих препаратов уже на первых этапах лечения, необходимость уменьшения поддерживающей дозы преднизолона. Введение в комплекс лечения цитостатиков позволило подавить активность болезни на фоне более низких доз ГК, увеличить выживаемость больных, в первую очередь люпус–нефритом. При регулярном наблюдении и индивидуальном подборе дозы и препарата, тщательном контроле за терапией удалось значительно снизить число побочных реакций и осложнений. Не утратили своего значения и аминохинолиновые производные у больных СКВ без тяжелых висцеральных проявлений и в период снижения доз ГК и цитостатиков для поддержания ремиссии. Детальное изучение механизмов действия этих препаратов, выявившее противовоспалительный, антиагрегантный, гиполипидемический, фотопротективный, антиоксидантный , антимикробый и анальгетический эффекты, позволило по–новому взглянуть на перспективы их включения в схему лечения СКВ [4]. Тем не менее, несмотря на достигнутые успехи, ведение больных СКВ остается одной из наиболее сложных проблем современной ревматологии. По сочетанию эффективности и безопасности препараты, влияющие на иммунное воспаление – ГК, циклофосфамид, азатиоприн, хлорбутин и другие – не всегда удовлетворяют клиницистов. Кроме того, у многих больных раннее назначение адекватных доз ГК и цитотоксических препаратов не позволяет избежать необратимого поражения жизненно важных органов и систем (в первую очередь почек и центральной нервной системы), а также нередко ассоциируется с развитием тяжелых, потенциально смертельных побочных реакций (интеркуррентная инфекция, цитопения, геморрагический цистит, остеопоретические переломы, рост числа злокачественных новообразований и пр.). Все это определяет необходимость изучения новых подходов к фармакотерапии СКВ. Совершенствование методов воздействия на иммунный процесс происходит по двум направлениям: изменение традиционных режимов их применения и внедрение в практику новых препаратов. Точкой приложения новых терапевтических методик является воздействие на лимфоциты (пересадка костного мозга, использование нуклеозидных аналогов и экстракорпоральные методы лечения), профилактика образования и отложения иммунных комплексов, а также изменение иммунного ответа путем индуцирования антиген–специфической толерантности или взаимодействия с системой цитокинов. Рассматривая новые подходы к лечению, необходимо отметить, что аутоиммунные болезни человека, имея свои уникальные особенности, в целом напоминают иммунопатологические процессы, составляющие основу реакции трансплантационного иммунитета. Поэтому неудивительно, что многие современные виды иммунотерапии диффузных болезней соединительной ткани были впервые с успехом применены при пересадке органов и тканей [5]. Особенно большой интерес в последние годы вызывает циклоспорин А, который рассматривается как одно из наиболее эффективных лекарственных средств с селективной иммуносупрессивной активностью. Он все шире используется в клинической практике для лечения многих иммуновоспалительных заболеваний внутренних органов, в том числе и СКВ. Конкретные механизмы, определяющие эффективность циклоспорина А (ЦсА) при СКВ, до конца не ясны. Очевидно, что по характеру воздействия на синтез цитокинов ЦсА весьма близок к глюкокортикоидам. Нельзя исключить, что один из важных механизмов действия ЦсА при СКВ связан с ингибицией синтеза интерферона–g. Представляет интерес способность ЦсА подавлять экспрессию лиганда CD40 на мембране Т–лимфоцитов. Известно, что моноклональные антитела к лиганду CD40 весьма эффективно замедляют прогрессирование заболевания у мышиных моделей волчаночноподобного заболевания [6]. Сходной активностью, вероятно, обладает и ЦсА. В настоящее время накоплен определенный опыт применения ЦсА при СКВ. Еще в начале 80–х годов было проведено несколько открытых краткосрочных испытаний эффективности ЦсА при СКВ с использованием высоких доз (более 5 мг/кг/сутки) препарата. В 1981 году был впервые назначен ЦсА 5 больным СКВ в дозе 10 мг/кг/сутки в течение 7 недель. Однако во всех случаях лечение было прекращено из–за развития побочных эффектов (в первую очередь нефротоксического) и артериальной гипертонии. Таким образом, эффективность ЦсА значительно компрометировалась развитием большого количества осложнений, что скорее всего было обусловлено использованием высоких доз препарата. В последние годы проведена серия длительных (более 2 лет) открытых клинических испытаний, в которых оценивалась эффективность низких (менее 5 мг/кг/сутки) доз ЦсА при СКВ. Большая часть сообщений о применении ЦсА у больных СКВ касается использования этого препарата при люпус–нефрите, причем выраженный антипротеинурический эффект, наступающий в течение первых 2–3 месяцев терапии, наблюдался у значительного числа пациентов [7]. Рядом исследователей также была показана эффективность невысоких доз препарата при тромбоцитопении, анемии и лейкопении, кожных проявлениях СКВ, рефрактерном к терапии полисерозите и артрите. Необходимо отметить, что при наличии хорошего эффекта терапии развивающиеся у части больных побочные явления не были тяжелыми и редко служили основанием для прерывания лечения. Практически всеми исследователями регистрировался стероид–сберегающий эффект препарата. Несомненным достоинством ЦсА по сравнению с другими препаратами, использующимися для лечения СКВ, является меньшая частота как непосредственных, так и отдаленных побочных эффектов, в первую очередь инфекционных осложнений и злокачественных новообразований. Например, риск развития лимфопролиферативных опухолей на фоне длительного лечения ЦсА очень низкий – 0,05–0,14%, причем отмена препарата может приводить к обратному развитию опухоли. В отличие от других цитотоксических препаратов ЦсА обладает минимальной тератогенностью [8]. Имеющийся собственный опыт назначения ЦсА у больных СКВ подтверждает результаты других исследований: на фоне приема больными невысоких доз препарата (в среднем 2–2,5 мг/кг/сутки) зарегистрированы снижение активности заболевания, положительная динамика клинических проявлений СКВ, в первую очередь уменьшение суточной протеинурии, нормализация температуры, купирование артралгий, уменьшение яркости кожных высыпаний. Мы полагаем, что лечение ЦсА положительно влияет на активность заболевания, воздействуя на тяжелую органную патологию, а использование невысоких доз и тщательный мониторинг терапии позволяет избежать развития тяжелых побочных явлений. ЦсА можно считать альтернативным препаратом второго ряда при непереносимости и неэффективности глюкокортикоидов и цитостатиков. Кроме того, несомненными положительными сторонами включения ЦсА в схему лечения СКВ следует считать меньшую частоту развития сопутствующей инфекции и возможность назначения при беременности. Имеются предварительные данные о снижении на фоне терапии ЦсА уровня антикардиолипиновых и антитромбоцитарных антител, а также профилактическое действие в отношении раннего развития атеросклероза, что имеет огромное значение для больных СКВ [9]. Обнадеживающие результаты получены и при использовании у больных СКВ еще одного селективного иммуносупрессанта – мофетила микофенолата. Мофетила микофенолат (Селлсепт) представляет собой синтетический морфолиноэтиловый эфир микофенольной кислоты и является ее предшественником. После приема мофетила микофенолата внутрь печеночные эстеразы полностью превращают его в активное соединение – микофенольную кислоту – которая является неконкурентным ингибитором инозинмонофосфатдегидрогеназы, фермента, лимитирующего скорость синтеза гуанозиновых нуклеотидов. Поскольку функциональная активность лимфоцитов в большей степени, чем других быстро делящихся клеток, зависит от синтеза пуринов, препарат дает более выраженный антипролиферативный эффект в отношении лимфоцитов и проявляет цитостатическую, а не цитотоксическую активность. В наномолярных концентрациях микофенольная кислота подавляет пролиферацию стимулированных Т– и В–лимфоцитов периферической крови человека in vitro, обладает антипролиферативным действием в отношении мезангиальных клеток почек человека и животных, подавляет образование антител в культурах лимфоцитов и клеток селезенки человека. Кроме того, истощение запасов гаунозиновых нуклеотидов под воздействием микофенольной кислоты отрицательно влияет не только на синтез ДНК, но также и на процесс гликозилирования молекул, осуществляющих адгезию. Такая супрессия гуморального ответа может оказаться полезной при лечении заболеваний, опосредованных антителами [10]. Как иммунодепрессант антиметаболического типа, мофетила микофенолат был вначале изучен, как средство для лечения и профилактики острого отторжения аллогенных трансплантантов различных солидных органов. Как правило, этот препарат применяют в рамках комбинированной терапии после трансплантации, назначая его вместо азатиоприна, в сочетании с глюкокортикоидами и циклоспорином. В крупных рандомизированных контролируемых исследованиях у больных, перенесших пересадку почки или сердца, мофетила микофенолат, снижая частоту отторжения, продемонстрировал достоверно более высокую эффективность, чем азатиоприн.
Другим направлением терапии СКВ в последние года становится использование некоторых иммуномодуляторов, таких как талидомид, биндарит, нуклеозидные аналоги (флударабин, мизорибин, лефлюномид). Использование этих препаратов у экспериментальных моделей волчаночноподобного заболевания приводило к уменьшению протеинурии и увеличению выживаемости мышей. В настоящее время накоплен некоторый опыт и по применению этих препаратов у больных СКВ [13]. Клинические испытания талидомида в основном проводились у больных с тяжелым поражением кожи, резистентным к антималярийным препаратам и ГК. У подавляющего большинства больных удавалось добиться хорошего эффекта и снижения дозы ГК, при этом отмена препарата не приводила к обострению симптоматики. Главным ограничением при использовании талидомида является его тератогенность. Кроме того, описано развитие необратимой периферической нейропатии, зависящей от дозы и длительности лечения [14]. Имеются отдельные сообщения о применении при СКВ лобензарита, обладающего выраженной иммуномодулирующей активностью и способного подавлять синтез антител к ДНК и ингибировать синтез IgM–ревматоидного фактора [15]. Результаты исследования in vitro свидетельствуют о синергичном действии комбинации нуклеозидных аналогов и циклофосфамида; подобные схемы лечения с успехом в течение длительного времени уже применяются в онкологии. Что касается больных СКВ, то имеются единичные сообщения о эффективности данных препаратов у больных с волчаночным нефритом, доказано их стероид–сберегающее действие. В то же время нельзя не отметить высокую частоту развития сопутствующих инфекционных осложнений, что поднимает вопрос о безопасности применения этих препаратов и о соотношении «риск/польза» у больных СКВ [16]. Перспективы лечения больных СКВ, несомненно – за биологическими методами воздействия, с использованием так называемых «биологических» агентов. Эти препараты разрабатываются с целью воздействия на специфические иммунологические процессы, к которым относятся активация Т–клеток, Т–В–клеточное взаимодействие, выработка антител к двуспиральной ДНК, активация цитокинов и другие. В этом отношении большие возможности представляет применение антиидиотипических моноклональных антител, внутривенного иммуноглобулина. Имеются немногочисленные данные об эффективности у экспериментальных моделей люпуса рекомбинантной ДНК–азы, ДНК–расщепляющего фермента. Введение препарата мышам линии NZB/W с активным почечным процессом приводило к снижению протеинурии и креатинина сыворотки, однако применение у нескольких больных СКВ к настоящему моменту не дало убедительных положительных результатов, несмотря на хорошую переносимость препарата [17]. Выявление повышенных сывороточных уровней ИЛ–10 у больных СКВ и родственников, а также их корреляция с активностью заболевания послужили основанием для использования моноклональных антител к ИЛ–10. Предварительные результаты нескольких исследований свидетельствуют о положительном влиянии антител в отношении поражения кожи, почек, артрита и серозита, рефрактерных к глюкокортикоидной терапии [18]. Таким образом, несомненной перспективой лечения больных СКВ будет использование «биологических» агентов, тем более что большинство их них не обладает генерализованным иммуносупрессивным действием. Самым агрессивным методом лечения СКВ в настоящее время следует признать аутологичную трансплантацию стволовых клеток (АТСК). К 2000 году накоплен опыт использования АТСК у немногим более 30 больных СКВ [19]. Предварительные позитивные результаты, несомненно, нуждаются в дальнейшем подтверждении. Необходимо длительное наблюдение за больными, имея в виду возможность индукции развития злокачественных опухолей. Несмотря на создавшееся впечатление об эффективности данного вида терапии в случаях рефрактерного и тяжелого течения СКВ, вследствие сопровождающей его высокой летальности АТСК можно рекомендовать только в наиболее тяжелых, безнадежных случаях. Не утратили своей актуальности и попытки лечения СКВ при помощи модуляции половых гормонов, дисбаланс которых безоговорочно признается патогенетическим фактором заболевания. В качестве новых лекарственных препаратов в настоящее время используются дегидроэпиандростерон и другие андрогены, антагонисты эстрогенов (включая тамоксифен и селективные модуляторы эстрогеновых рецепторов), а также ингибитор пролактина, бромокриптин. На экспериментальных моделях было показано, что введение антагонистов эстрогенов или мужских половых гормонов может снижать активность заболевания. Первые попытки назначения гормональных препаратов касались синтетического андрогена, 19–нортестостерона и дали противоречивые результаты: за клиническим улучшением у женщин после отмены препарата наблюдался рецидив симптоматики, а у мужчин в процессе лечения отмечалась отрицательная динамика. Было высказано предположение, что отсутствие эффекта у лиц мужского пола можно объяснить слабым действием 19–нортестостерона, не оказывающим влияния на эндогенную выработку тестостерона. Изучение эффективности дегидроэпиандростерона, естественного андрогена с умеренным действием, позволило обсуждать целесообразность его назначения при нетяжелых формах СКВ. В одном плацебо–контролируемом исследовании была показана эффективность препарата, в два раза превосходящая плацебо, при в целом хорошей переносимости терапии. Эффективность дегидроэпиандростерона прежде всего приписывают изменению уровня половых гормонов надпочечников, главным образом увеличению концентрации тестостерона, хотя может иметь значение и опосредованное высвобождение минералокортикоидных и глюкокортикоидных гормонов [20]. Использование оральных контрацептивов и эстроген–заместительной терапии долгое время у больных СКВ оспаривалось. Однако в последнее время на экспериментальных моделях продемонстрирована эффективность селективных модуляторов эстрогеновых рецепторов, что позволило по–новому взглянуть на перспективы их использования у людей. Необходимо иметь в виду, что такая терапия должна проводиться с осторожностью ввиду потенциального риска развития тромботических осложнений, особенно у больных со вторичным антифосфолипидным синдромом [21]. Серия исследований посвящена оценке терапевтической активности тамоксифена – синтетического нестероидного антиэстрогена, специфически связывающегося с эстрогеновыми рецепторами, который применяется для лечения рака молочной железы у женщин. По данным ранних клинических исследований, выполненных на небольшом клиническом материале, тамоксифен не оказывал существенного влияния на течение болезни у женщин с СКВ [22]. Однако недавно было показано, что тамоксифен замедляет развитие патологического процесса у мышей с экспериментальным волчаночноподобным заболеванием, индуцированным иммунизацией моноклональными антителами к ДНК. Предполагается, что благоприятное действие препарата на течение СКВ может быть связано с изменением профиля синтеза Th–1 и Th–2–цитокинов, увеличением продукции кортизола и снижением уровня пролактина [23, 24]. Убедительно доказана ассоциация гиперпролактинемии с активностью СКВ [25]. Назначение бромокриптина, агониста допаминовых рецепторов, приводит к снижению уровня пролактина. При проведении рандомизированного, плацебо–контролируемого исследования у 66 больных СКВ даже при отсутствии высоких уровней пролактина было выявлено их статистически достоверное снижение по сравнению с контролем, сопровождавшееся снижением активности заболевания [26]. Таким образом, предварительные результаты испытаний на животных моделях или пилотные исследования на людях позволяют предположить эфффективность ряда фармакологических агентов при СКВ, к которым относятся как «неспецифические» иммунорегуляторы, так и препараты, влияющие на профиль половых гормонов. Следует упомянуть и еще об одном аспекте лечения СКВ. Несмотря на нежелательность полипрагмазии при СКВ, накопленный опыт свидетельствует о необходимости применения целого ряда вспомогательных лекарственных средств. Это касается использования препаратов, улучшающих мозговое кровообращение и метаболизм клеток головного мозга (винпоцетин, пентоксифиллин, церебролизин, пирацетам и др.), антиагрегантов, противосудорожных средств, транквилизаторов. Внесения коррекции в схемы терапии требует и наличие у больных СКВ вторичного антифосфолипидного синдрома (АФС). Сложную проблему представляет профилактика повторных тромбозов при АФС. Это связано с неоднородностью патогенетических механизмов, лежащих в основе АФС, полиморфизмом клинических проявлений, отсутствием достоверных клинических и лабораторных показателей, позволяющих прогнозировать рецидивирование тромботических нарушений. Больным АФС назначают антикоагулянты непрямого действия и антиагреганты (низкие дозы ацетилсалициловой кислоты), которые широко используются для профилактики тромбозов. Однако использование высоких доз непрямых антикоагулянтов ассоциируется с увеличением риска кровотечения, поэтому такая терапия нуждается в тщательном мониторинге. У больных с АФС нередко наблюдается умеренная тромбоцитопения, которая, как правило, корригируется небольшими дозами глюкокортикоидов. Иногда при резистентных к ГК формах тромбоцитопении эффективны низкие дозы ацетилсалициловой кислоты, даназола, варфарина. Большие надежды возлагают на использование низкомолекулярного гепарина, а также на внедрение новых методов антикоагулянтной терапии, основанных на использовании аргиналов, гиуидинов, антикоагулянтных пептидов и антитромбоцитарных агентов (моноклональные антитела к тромбоцитам) [27]. Важным направлением фармакотерапии СКВ является предотвращение развития или лечение сопутствующей (часто лекарственно индуцированной) патологии, в первую очередь «раннего» атеросклероза, остеопороза, инфекционных осложнений, которые оказывают не менее негативное влияние на жизненный прогноз, чем само заболевание. Это определяет необходимость более широкого внедрения современных гипотензивных, гиполипидемических, антиостеопоретических и антимикробных препаратов. Поскольку некоторые из них, например, статины, антибиотики и, возможно, бисфосфонаты обладают противовоспалительной и иммуномодулирующей активностью, их применение потенциально может повысить эффективность лечения воспалительных ревматических болезней. Вновь поставлен вопрос о диетическом режиме при СКВ, так как имеются данные о влиянии определенных пищевых веществ на механизм развития воспаления. Пониженное содержание в пище линолевой кислоты ведет к снижению синтеза простагландинов и лейкотриенов, оказывающих провоспалительное действие. При увеличении содержания в пище ненасыщенных жирных кислот уменьшается интенсивность процессов воспаления и фиброзообразования [1]. В связи с этим представляется целесообразным изучение влияния диет с определенным содержанием жирных кислот на различные проявления болезни, что позволит оценить действие диетических режимов и на развитие патологического процесса. Таким образом, сегодня имеется возможность достаточно эффективно воздействовать на патологический процесс при СКВ. При умелом применении сильнодействующих препаратов можно не только значительно улучшить прогноз у больных СКВ, но и избежать серьезных осложнений проводимой терапии. Несмотря на то, что представленный материал не может полностью охватить все многообразие подходов к лечению СКВ, в целом он все же позволяет проследить основные современные тенденции, в первую очередь касающиеся препаратов, с высокой специфичностью воздействующих на механизмы развития заболевания и характеризующихся достаточно высокой эффективностью и безопасностью. В то же время нельзя забывать и о разработке новых методик лечения, являющихся не симптоматическими, а патогенетически направленными. Литература: 1. Иванова М.М. Системная красная волчанка. Диагностика и лечение. Клин. Ревматология, 1995, 1, 2–20. 2. Gladman D.D., Urowitz M.B. Dubois’s Lupus erythematosus. 5–th Ed. Eds D.J.Waalace, B.H. Hahn, Baltimore, 1997, 1213–1228. 3. Соловьев С.К., Иванова М.М., Насонов Е.Л. Интенсивная терапия ревматических заболеваний. Издательство «МИК», Москва, 2001. 4. Насонов Е.Л. Противовоспалительная терапия ревматических болезней. Москва, издательство «М–СИТИ», 1996 , 169– 181. 5. Насонов Е.Л., Штутман В.З., Насонова В.А. Перспективы применения циклоспорина А при ревматических заболеваниях. Клин. Медицина, 1994, 5, 12–19. 6. Blank M., Ben–Bassat M., Shoenfeld Y. The effect of cyclosporin A on early and late stages of experimental lupus. Arthritis and Rheumatism, 1992, 35, 11, 1350–1354. 7. Caccavo D., Lagana B., Mitterhofer A. et al. Long–term treatment of systemic lupus erythematosus with cyclosporine A. Arthritis and Rheumatism, 1997, 40 (1), 27–35. 8. Cyclosporine. Clinical application in autoimmune diseases. Edited by David E. Yocum. Mosby–Wolfe, 2000. 9. Walter D.H., Haendeler J., Galle J. et al. Cyclosporine A inhibits apoptosis of human endothelial cells by preventing release of cytochrome C from mitochondria. Circulation, 1998, 98, 1153–1157. 10. Kingdon E.J., McLean A.G., Psimenou E. et al. The safety and efficacy of MMF in lupus nephritis: a pilot study. Lupus, 2001, 10, 60–611. 11. Adu D., Cross J., Jayne DRW. Treatment of systemic lupus erythematosus with mycophenolate mofetil. Lupus, 2001, 10, 203–208. 12. Chan T.M., Li F.K., Tang C.S.O. et al. Efficacy of mycophenolate mofetil in patients with diffuse proliferative lupus nephritis. The New England Journal of Medicine, 2000, 343 (16), 1156–1162. 13. Illei G.G., Klippel J.H. Novel approaches in the treatment of lupus nephritis. Lupus, 1998, 7, 644–648. 14. Stevens R.J., Andujar C., Edwards C.J. et al. Thalidomide in the treatment of cutaneous manifestations of lupus erythematosus experience in sixteen consecutive patients. Br.J.Rheumat., 1997, 36, 353–359. 15. Hirohata S., Ohnishi K., Sagawa A. Treatment of systemic lupus erythematosus with lobenzarit: an open clinical trial. Clin. And Exp. Rheumatol., 1994, 12, 261–265. 16. Strand V. Biologic agents and innovative interventional approaches in the management of systemic lupus erythematosus. Current Opinion in Rheumatology, 1999, 11, 330–340. 17. Davis J.C., Manzi S., Yarboro C. et al. Recombinant human Dnase in patients with lupus nephritis. Lupus, 1999, 8, 68–76. 18. Llorente L., Garcia–Padilla C., Richaud–Patin Y. et al. Treatment of systemic lupus erythematosus with an anti–interluken–10 monoclonal antibody. Arthrit. Rheum., 1998 (suppl.), 41, S109. 19. Tyndall A., Passweg J., Gratwohl A. Haemopoietic stem cell transplantation in the treatment of severe autoimmune diseases 2000. Ann.Rheum.Dis., 2001, 60, 702–707. 20. Vollenhoven R., Engleman E., McGuire J. Dehydroepiandrosterone in systemic lupus erythematosus. Arthr. Rheum., 1995, 38 (12) ,1826–1831. 21. Mok C., Lau C.S., Ho CTK. Safety of hormonal replacement therapy in postmenopausal patients with systemic lupus erythematosus. Scand J Rheumat, 1998, 27, 342–346. 22. Sturgess A.D., Evans D.T., Mackay I.R, Riglar A. Effects of the estrogen antagonist tamoxifen on disease indices in systemic lupus erythematosus. J.Clin.Lab.Immunol., 1984, 13, 11–14. 23. Levin J., Markhan M.J., Greenwald E.S. et al. Effects of tamoxifen treatment on cortisol metabolism and the course of the disease in advanced brest cancer. Cancer, 1981, 47, 1394–1397. 24. Liberman M.E., Jordan V.C., Fritsch M. Direct and reversible inhibition of estradiol stimulated prolactin synthesis by anti–estrogen in vitro. J.Biol. Chem., 1983, 258, 4734–4740. 25. Walker S.E., Allen S.H., Hoffman R.W. Prolactin a stimulator of disease activity in systemic lupus erythematosus. Lupus, 1995, 4, 3–9. 26. Alvarez–Nemegyei J., Covarrubias–Cobos A., Escalante–Triay F. et al. Bromocriptine in systemic lupus erythematosus: a double blind, randomized placebo controlled study. Lupus, 1998, 7, 414–419. 27. Насонов Е.Л., Баранов А.А., Шилкина Н.П. Васкулиты и васкулопатии. Ярославль, «Верхняя Волга», 1999, 540–574. Поделитесь статьей в социальных сетях Порекомендуйте статью вашим коллегам www.rmj.ru Системная красная волчанкаИстория изучения системной красной волчанки может быть разделена на три периода: классический, неоклассический и современный. Впервые заболевание было описано в XII веке Рогериусом, который первым использовал термин «волчанка» для описания классической красной сыпи на лице. Следующий этап напрямую связан с именем Капоши, который в 1872 году отметил наличие системных проявлений (то есть, поражения многих органов). В 1948 году были открыты волчаночные клетки (LE -клетки или ЛЕ-клетки в русской транскрипции), вторая половина XX и начало XXI века стали периодом активного изучения механизмов развития болезни и огромного прогресса в лечении.
Интересно, что волчанка имеет много общих симптомов с порфириями — редкими заболеваниями, связанными с нарушением обмена пигментов. Считается, что именно больные порфирией стали прообразом для появления историй о вампирах и оборотнях (у них часто отмечается светобоязнь, красное окрашивание зубов, избыточный рост волос и другие «страшные» симптомы). Возможно, свой вклад в формирование подобного фольклора внесли и больные волчанкой. Наиболее известный пациент с системной красной волчанкой — Майкл Джексон, который заболел в 1984 году. Общие сведения о системной красной волчанкеСистемная красная волчанка (СКВ или просто волчанка) — хроническое аутоиммунное заболевание, при котором могут поражаться кожа, суставы, почки, легкие, нервная система и/или другие органы тела. Тяжесть симптомов может быть различной. Системной красной волчанкой чаще страдают женщины. Болезнь обычно протекает в виде чередования периодов ухудшения и улучшения, однако улучшение обычно происходит только благодаря правильному лечению. Отдельно следует остановиться на особых случаях волчанки, которые отличаются от системной красной волчанки:
На нашем сайте вы также найдете информацию про такое заболевание как фиброзная мастопатия. Симптомы системной красной волчанкиСимптомы системной красной волчанки очень разнообразны. При этом заболевании возможны поражения практически всех органов, при этом варианты поражения также бывают различными. У каждого конкретного пациента могут отмечаться различные сочетания симптомов. Выраженность симптомов системной красной волчанки также колеблется.
Симптомы системной красной волчанки могут усиливаться, пропадать на какое-то время или оставаться на прежнем уровне, поэтому важно заранее заподозрить возможность этой болезни и провести правильное дообследование. Причины системной красной волчанкиПричина системной красной волчанки неизвестна. В его развитии принимают участие генетические, иммунологические, гормональные и внешние факторы. У некоторых пациентов пусковым фактором болезни становятся вирусные инфекции. В основе болезни лежит нарушение работы иммунной системы. В результате поломки иммунная система начинает вырабатывать специальные белки (антитела), которые атакуют нормальные ткани и органы. В результате в них развивается воспаление, приводящее к повреждению. Факторы риска системной красной волчанки Опасность системной красной волчанки повышена при наличии у родственников аутоиммунных заболеваний. Чаще болеют женщины, особенно в возрасте 20–40 лет. Профилактика системной красной волчанкиЭффективных способов профилактики не существует. Диагностика системной красной волчанкиДля диагностики синдрома Шегрена большое значение имеет правильный расспрос врача, а также исследования крови. Специфических тестов диагностики не существует. При анализах крови оценивают наличие воспаления, а также определяют специальных антител. Наиболее характерные изменения: повышение СОЭ (скорости оседания эритроцитов), С-реактивного белка (СРБ), антинуклеарного фактора (АНФ). Очень часто отмечается снижение количества клеток крови (эритроцитов и гемоглобина — анемия, лейкоцитов — лейкопения, тромбоцитов — тромбоцитопения). Обязательно исследование состояния почек (анализы мочи, определение уровня креатинина сыворотки крови), поскольку поражение почек представляет серьёзную угрозу здоровью и жизни и обуславливает необходимость активной и агрессивной терапии. Часто необходимо исследование на специфические антитела, которые могут повышаться при системной красной волчанке — антитела к ДНК, анти- Ro (анти-ро) и анти- La (анти-ля) антитела, антитела к Sm -антигену. Может понадобиться биопсия кожи, почек, которые позволяют уточнить характер поражения органов. В зависимости от поражения других органов и тканей могут использоваться самые различные анализы и исследования Лечение системной красной волчанкиЛечение системной красной волчанки позволяет облегчить самочувствие и помогает предотвратить повреждение внутренних органов, а в случае поражения — замедлить или остановить его прогрессирование. Важное значение принадлежит защите от прямых солнечных лучей. Необходимо использовать солнцезащитные крема с высокой степенью защиты, стараться не находится под солнцем длительное время. В активную фазу болезни физических нагрузок следует избегать, в период ремиссии уровень физической активности может быть нормальным. Необходимо избегать инфекций, вакцинаций, приёма различных биологически активных добавок, поскольку они могут стать причиной обострения болезни. Вопрос о назначении глюкокортикоидных препаратов и цитостатиков решает врач. В большинстве случаев они хорошо убирают симптомы болезни и предотвращают развитие тяжёлых последствий. Однако побочные эффекты глюкокортикоидов очень серьёзные, вопрос о их назначении, дозе и длительности терапии решается врачом индивидуально. Также обычно используются иммуносупрессивные препараты (от гидроксихлорохина до циклофосфамида), которые позволяют в будущем снизить дозу или вообще избавиться от глюкокортикоидов. Выбор конкретного препараты и схемы лечения очень индивидуален. ztema.ru ВолчанкаВолчанка (системная красная волчанка, СКВ) – это аутоиммунное заболевание, при котором иммунная система человека атакует клетки соединительной ткани хозяина как чужеродные. Соединительная ткань есть практически везде, а самое главное - в вездесущих сосудах. Воспаление, вызванное волчанкой, может поражать самые разные органы и системы, включая кожу, почки, кровь, мозг, сердце и легкие. Волчанка не передается от человека к человеку. Наука не знает точной причины возникновения волчанки, как и многих других аутоиммунных заболеваний. Эти болезни, скорее всего, вызваны генетическими нарушениями в иммунной системе, которые делают возможным для нее производить антитела против собственного хозяина. Волчанку трудно диагностировать, потому что ее симптомы очень разнообразны, и она может маскироваться под другие заболевания. Наиболее отличительный признак волчанки – это эритема на лице, которая напоминает крылья бабочки, распростертые через обе щеки больного (эритема-бабочка). Но этот признак встречается не во всех случаях волчанки. От волчанки нет никакого радикального метода лечения, но ее симптомы можно контролировать с помощью лекарств. Причины и факторы риска волчанки Сочетание внешних факторов может подтолкнуть аутоиммунный процесс. Причем некоторые факторы действуют на одного человека, а на другого не действуют. Почему так происходит, остается загадкой. Известно много вероятных причин волчанки: • Влияние ультрафиолетовых лучей (солнечного света) способствует возникновению волчанки или обострению ее симптомов. • Женские половые гормоны не вызывают волчанку, но влияют на ее течение. Среди них могут быть высокодозированные препараты женских половых гормонов для лечения гинекологических заболеваний. Но это не касается приема низкодозированных оральных контрацептивов (ОК). • Курение считается одним из факторов риска волчанки, который может вызывать болезнь и усугублять ее течение (особенно повреждение сосудов). • Некоторые лекарственные препараты могут усугублять течение волчанки (в каждом случае нужно ознакомиться с инструкцией к препарату). • Инфекции, такие как цитомегаловирус (ЦМВ), парвовирус (инфекционная эритема) и гепатит С, также могут вызывать волчанку. Вирус Эпштейна-Барр связан с возникновением волчанки у детей. • Химические вещества могут вызывать волчанку. Среди этих веществ на первом месте трихлорэтилен (наркотическое вещество, применяется в химической промышленности). Краски и фиксаторы для волос, ранее считавшиеся причиной волчанки, сейчас полностью оправданы. Вероятность возникновения волчанки выше у таких групп людей: • Женщины заболевают волчанкой чаще мужчин. • Выходцы из Африки болеют волчанкой чаще белых. • Люди в возрасте от 15 до 45 лет болеют чаще всего. • Заядлые курильщики (по данным некоторых исследований). • Люди с отягощенным семейным анамнезом. • Люди, постоянно принимающие лекарства, ассоциируемые с риском волчанки (сульфаниламиды, некоторые антибиотики, гидралазин). Лекарства, вызывающие волчанку Одной из распространенных причин возникновения волчанки является употребление лекарственных препаратов и других химических веществ. В Соединенных Штатах одним из главных препаратов, вызывающих лекарственно-индуцированную СКВ, считается гидралазин (около 20% случаев), а также прокаинамид (до 20%), хинидин, миноциклин и изониазид. Лекарственные препараты, чаще всего ассоциируемые с волчанкой, включают блокаторы кальциевых каналов, ингибиторы АПФ, антагонисты ФНО-альфа, тиазидные диуретики и тербинафин (противогрибковый препарат). Следующие группы препаратов обычно связывают с возникновением лекарственно-индуцированной СКВ: • Антибиотики: миноциклин и изониазид. • Антипсихотические препараты: хлоропромазин. • Биологические средства: интерлейкины, интерфероны. • Гипотензивные препараты: метилдопа, гидралазин, каптоприл. • Гормональные препараты: леупролид. • Ингаляционные препараты при ХОЗЛ: тиотропия бромид. • Противоаритмические препараты: прокаинамид и хинидин. • Противовоспалительные: сульфасалазин и пеницилламин. • Противогрибковые: тербинафин, гризеофульвин и вориконазол. • Гипохолестеринемические: ловастатин, симвастатин, аторвастатин, гемфиброзил. • Противосудорожные: вальпроевая кислота, этосуксимид, карбамазепин, гидантоин. • Другие препараты: глазные капли с тимололом, ингибиторы ФНО-альфа, сульфаниламидные препараты, высокодозированные препараты женских половых гормонов. Дополнительный список лекарственных препаратов, вызывающих волчанку: • Амиодарон. • Атенолол. • Ацебутолол. • Бупропион. • Гидроксихлорохин. • Гидрохлортиазид. • Глибурид. • Дилтиазем. • Доксициклин. • Доксорубицин. • Доцетаксел. • Золото и его соли. • Имиквимод. • Ламотриджин. • Лансопразол. • Литий и его соли. • Мефенитоин. • Нитрофурантоин. • Оланзапин. • Омепразол. • Практолол. • Пропилтиоурацил. • Резерпин. • Рифампицин. • Серталин. • Тетрациклин. • Тиклопидин. • Триметадион. • Фенилбутазон. • Фенитоин. • Фторурацил. • Цефепим. • Циметидин. • Эзомепразол. Иногда системная красная волчанка возникает под действием химикатов, попадающих в организм из окружающей среды. Это происходит только у некоторых людей, по непонятной пока причине. Эти химикаты включают: • Некоторые инсектициды. • Некоторые соединения металлов. • Эозин (флуоресцирующая жидкость в составе помад). • Парааминобензойная кислота (ПАБК). Симптомы волчанки Симптомы волчанки очень разнообразны, потому что болезнь может поражать разные органы. О симптомах этой сложной болезни написаны целые тома медицинских руководств. Мы можем рассмотреть их вкратце. Нет двух случаев волчанки, которые были бы точь в точь похожи. Симптомы волчанки могут возникать внезапно или развиваться постепенно, могут быть временными или беспокоить больного всю жизнь. У большей части больных волчанка протекает относительно легко, с периодическими обострениями, когда симптомы болезни становятся хуже, а затем утихают или исчезают вовсе. Симптомы волчанки могут быть следующими: • Утомляемость и слабость. • Повышение температуры. • Боль, отечность и скованность суставов. • Эритема на лице в виде бабочки. • Кожные поражения, ухудшающиеся из-за солнца. • Феномен Рейно (ухудшение кровотока в пальцах). • Проблемы с дыханием. • Боль в груди. • Сухость глаз. • Потеря памяти. • Нарушение сознания. • Головные боли. Предположить у себя волчанку до визита к врачу практически невозможно. Обратитесь за консультацией, если у вас появилась необычная сыпь, температура, боли в суставах, утомляемость. Диагностика волчанки Диагностика волчанки может быть очень затруднительна из-за разнообразия проявлений болезни. Симптомы волчанки могут изменяться со временем и напоминать другие болезни. Для диагностики волчанки может потребоваться целый комплекс тестов: 1. Общий анализ крови. При этом анализе определяют содержание эритроцитов, лейкоцитов, тромбоцитов, гемоглобина. При волчанке может обнаруживаться анемия. Низкое содержание лейкоцитов и тромбоцитов также может говорить о волчанке. 2. Определение показателя СОЭ. Скорость оседания эритроцитов определяется тем, насколько быстро эритроциты вашей крови оседают в подготовленном образце крови на дно пробирки. СОЭ измеряется в миллиметрах в час (мм/ч). Быстрая скорость оседания эритроцитов может говорить о воспалении, в том числе об аутоиммунном, как при волчанке. Но СОЭ повышается также при раке, других воспалительных заболеваниях, даже при банальной простуде. 3. Оценка функций печени и почек. Анализы крови могут показать, насколько хорошо работают ваши почки и печень. Это определяется по содержанию в крови печеночных ферментов и уровню токсичных веществ, с которыми должны справляться почки. Волчанка может поражать и печень, и почки. 4. Анализы мочи. В вашем образце мочи могут выявить повышенное содержание белка или красных кровяных телец. Это свидетельствует о поражении почек, которое может наблюдаться при волчанке. 5. Анализ на АНА. Антинуклеарные антитела (АНА) – это особые протеины, которые вырабатываются иммунной системой. Положительный анализ на АНА может указывать на волчанку, хотя это может быть и при других заболеваниях. Если ваш тест на АНА будет положителен, врач может назначить вам другие анализы. 6. Рентген грудной клетки. Получение изображения грудной клетки помогает обнаружить воспаление или жидкость в легких. Это может быть признаком волчанки или других заболеваний, которые поражают легкие. 7. Эхокардиография. Эхокардиография (ЭхоКГ) – это метод, использующий звуковые волны, чтобы получить изображение бьющегося сердца в реальном времени. ЭхоКГ может выявить проблемы с сердечными клапанами и многое другое. 8. Биопсия. Биопсия, взятие образца органа для анализов, широко применяется в диагностике разных болезней. Волчанка часто поражает почки, поэтому врач может назначить биопсию ваших почек. Эта процедура проводится с помощью длинной иглы после предварительного обезболивания, поэтому переживать не о чем. Полученный кусочек ткани поможет выявить причину вашей болезни. Лечение волчанки Лечение волчанки очень сложное и длительное. Лечение зависит от тяжести симптомов болезни и требует серьезного обсуждения с врачом рисков и пользы той или иной терапии. Ваш врач должен постоянно контролировать ваше лечение. Если симптомы болезни утихают, он может сменить препарат или уменьшить дозы. Если возникает обострение – наоборот. Современные препараты для лечения волчанки: 1. Нестероидные противовоспалительные средства (НПВС). Безрецептурные НПВС, такие как напроксен (Анапрокс, Налгезин, Флогинас) и ибупрофен (Нурофен, Ибупром), могут использоваться для лечения воспаления, отека и болей, вызванных волчанкой. Более сильные НПВС, такие как диклофенак (Олфен), отпускаются по назначению врача. Побочные эффекты НПВС включают боль в животе, желудочные кровотечения, проблемы с почками и повышение риска сердечно-сосудистых осложнений. Последнее особенно характерно для целекоксиба и рофекоксиба, которые не рекомендуются пожилым людям. 2. Противомалярийные препараты. Лекарства, которые обычно назначают для лечения малярии, такие как гидроксихлорохин (Плаквенил), помогают контролировать симптомы волчанки. Побочные эффекты: дискомфорт в желудке и повреждение сетчатки глаз (очень редко). 3. Кортикостероидные гормоны. Кортикостероидные гормоны – это сильнодействующие препараты, которые борются с воспалением при волчанке. Среди них метилпреднизолон, преднизолон, дексаметазон. Эти препараты назначает только врач. Для них характерны долговременные побочные эффекты: набор веса, остеопороз, повышение давления, риск диабета и восприимчивость к инфекциям. Риск побочных эффектов тем выше, чем большие дозы вы применяете и чем длительнее курс лечения. 4. Иммуносупрессоры. Препараты, подавляющие иммунную систему, могут быть очень полезны при волчанке и других аутоиммунных болезнях. Среди них циклофосфамид (Цитоксан), азатиоприн (Имуран), микофенолат, лефлуномид, метотрексат и другие. Возможные побочные эффекты: восприимчивость к инфекциям, поражение печени, пониженная фертильность, риск многих видов рака. Более новый препарат, белимумаб (Benlysta), также снимает воспаление при волчанке. Его побочные эффекты включают жар, тошноту и диарею. Советы для больных волчанкой. Если вы страдаете волчанкой, можно предпринять несколько шагов, чтобы помочь себе. Простые меры могут сделать обострения реже, а также повысить качество вашей жизни. Попробуйте следующее: 1. Адекватный отдых. Люди с волчанкой испытывают постоянную усталость, которая отличается от усталости у здоровых людей и не проходит после отдыха. По этой причине вам может быть тяжело судить, когда стоит приостановиться и отдохнуть. Выработайте для себя щадящий режим дня и следуйте ему. 2. Берегитесь солнца. Ультрафиолетовые лучи могут провоцировать обострения волчанки, поэтому вам стоит носить закрытую одежду и избегать прогулок под палящими лучами. Выберите себе солнцезащитные очки потемнее, и крем с SPF не менее 55 (для особо чувствительной кожи). 3. Придерживайтесь здорового рациона. Здоровая диета должна включать фрукты, овощи, цельные злаки. Иногда вам придется терпеть ограничения в диете, особенно если у вас повышается давление, возникли проблемы с почками или желудочно-кишечным трактом. Отнеситесь к этому серьезно. 4. Регулярно тренируйтесь. Физические упражнения, разрешенные вашим врачом, помогут вам улучшить свою форму и быстрее поправляться после обострений. В далекой перспективе тренированность – это снижение риска сердечного приступа, ожирения и диабета. 5. Откажитесь от курения. Кроме всего прочего, курение может ухудшать поражение сердца и сосудов, вызываемое волчанкой. Нетрадиционная медицина и волчанка Иногда нетрадиционная медицина может помочь больным волчанкой. Но не стоит забывать, что она нетрадиционная именно потому, что ее эффективность и безопасность не доказана. Обязательно обсудите с врачом все альтернативные методы лечения, которые вы хотите попробовать. Известные на Западе нетрадиционные методы лечения волчанки: 1. Дегидроэпиандростерон (DHEA). Диетические добавки, содержащие этот гормон, могут позволить снизить дозы стероидов, которые получает больной. DHEA облегчает симптомы болезни у некоторых пациентов. 2. Семя льна. Льняное семя содержит жирную кислоту, называемую альфа-линоленовой, которая может уменьшать воспаление. Некоторые исследования показали способность семян льна улучшать функции почек у больных волчанкой. Побочные эффекты включают вздутие и боль в животе. 3. Рыбий жир. Диетические добавки с рыбьим жиром содержит омега-3 жирные кислоты, которые могут быть полезными при волчанке. Предварительные исследования показали многообещающие результаты. Побочные эффекты рыбьего жира: тошнота, рвота, отрыжка и рыбный привкус во рту. 4. Витамин D. Есть некоторые свидетельства того, что этот витамин облегчает симптомы у больных волчанкой. Правда, научные данные по этому вопросу очень ограниченные. Осложнения волчанки Воспаление, вызванное волчанкой, может поражать разные органы. Это приводит к многочисленным осложнениям: 1. Почки. Почечная недостаточность является одной из основных причин смерти больных волчанкой. Признаки проблем с почками включают зуд по всему телу, боль, тошноту, рвоту, отеки. 2. Головной мозг. Если мозг затронут волчанкой, больной может испытывать головные боли, головокружение, изменения поведения, галлюцинации. Иногда возникают припадки, и даже инсульт. Многие больные волчанкой имеют проблемы с памятью и выражением своих мыслей. 3. Кровь. Волчанка может вызывать нарушения в составе крови, такие как анемия и тромбоцитопения. Последняя проявляется склонностью к кровотечениям. 4. Кровеносные сосуды. При волчанке могут воспаляться кровеносные сосуды различных органов. Это называется васкулит. Риск воспаления сосудов повышается, если больной курит. 5. Легкие. Волчанка повышает вероятность воспаления плевры – плеврита, который может сделать дыхание болезненным и затруднительным. 6. Сердце. Антитела могут атаковать сердечную мышцу (миокардит), околосердечную сумку (перикардит) и крупные артерии. Это приводит к повышению риска сердечного приступа и других тяжелых осложнений. 7. Инфекции. Люди с волчанкой становятся уязвимыми для инфекции, особенно в результате лечения стероидами и иммуносупрессорами. Наиболее часто возникают инфекции мочеполовой системы, респираторные инфекции. Распространенные возбудители: дрожжевые грибки, сальмонелла, вирус герпеса. 8. Аваскулярный некроз костей. Это состояние также известно как асептический, или неинфекционный некроз. Возникает при уменьшении кровоснабжения костей, приводящем к ломкости и легкому разрушению костной ткани. Часто возникают проблемы с тазобедренным суставом, который испытывает большие нагрузки. 9. Осложнения беременности. Женщины с волчанкой имеют высокий риск выкидыша. Волчанка повышает вероятность преэклампсии и преждевременных родов. Для уменьшения риска врач может порекомендовать вам воздержаться от зачатия, пока со времени последней вспышки болезни не прошло хотя бы 6 месяцев. 10. Рак. Волчанка связана с повышенным риском многих видов рака. Более того, некоторые препараты от волчанки (иммуносупрессоры) сами по себе увеличивают такой риск.
studfiles.net Системная красная волчанка в вопросах и ответахСистемная красная волчанка - очень тяжёлая и не такая уж редкая болезнь. Лечение её - занятие трудоемкое, больные подолгу лежат в больнице и получают достаточно агрессивную терапию. Что же такое красная волчанка? Отчего она возникает и поддаётся ли излечению? На эти и другие вопросы отвечает данная статья. Название связано с тем, что первоначально, в 1872 году, было описано кожное заболевание, которое было названо «красной волчанкой» – обильная ярко-красная сыпь разъедала кожу, особенно на лице, что напоминало волчьи укусы («волчанка» может быть, кстати, не только «красная», но и туберкулезная, при туберкулезе кожи). В последующем выяснилось, что при «красной волчанке» наряду с кожей часто поражаются суставы, сердце, почки, центральная нервная система и другие органы, в связи с чем и появилось название «системная красная волчанка», или СКВ. Что касается причин этого заболевания, то единой причины нет. В развитии болезни главная роль принадлежит нарушениям иммунной системы. В норме иммунные реакции направлены на разрушение чуждых для организма агентов – бактерий, вирусов, а также собственных клеток – состарившихся, поврежденных или мутировавших, то есть изменивших под воздействием каких-либо причин свои свойства. Одни клетки иммунной системы вырабатывают белки, которые распознают и «захватывают врага», другие этого «связанного врага» окружают и «поедают». Но в некоторых случая иммунная система начинает воспринимать как «врага» собственные ткани организма – кожу, слизистые оболочки, лимфатические узлы, сосуды, почки и т.д. Пусковым механизмом этого сбоя могут быть такие факторы, как солнечное излучение, охлаждение, стресс, травмы, бактериальные и вирусные инфекции, вакцинация, воздействие некоторых химических веществ и лекарственных препаратов. Большую, хотя до сих пор не вполне выясненную роль, играет высокий уровень женских половых гормонов, поэтому значительно чаще СКВ болеют женщины детородного возраста, заболевание нередко впервые проявляется (это не значит, что именно тогда оно и возникает) после родов и абортов. В части случаев пусковой механизм остается неизвестным, но упомянутые выше нарушения иммунной системы, раз возникнув, продолжают оказывать свое разрушительное действие. Вопрос №2. Передается ли СКВ по наследству? Болеют ли ею дети? СКВ не является наследственным заболеванием, однако генетические факторы играют в её развитии важную роль. Достаточно сказать, что у 5% больных с СКВ имеются родственники, также страдающие этим заболеванием, а однояйцевые близнецы заболевают в 24% случаев. Вместе с тем, ответственным за предрасположенность к этому заболеванию является не один конкретный ген, но множество различных генов, поэтому вероятность наследования невелика. Заболевание может развиться в детском возрасте, но это бывает достаточно редко, чаще всего, как мы уже упоминали, волчанкой заболевают молодые женщины. Вопрос №3. Зачем нужно сдавать так много сложных анализов и обязательно ли делать биопсию почки? Каждое заболевание имеет свои характерные признаки, свое «лицо», называемое у медиков «клинической картиной». При СКВ таких признаков множество – это типичные кожные изменения, боли в суставах, длительное повышение температуры, увеличение лимфатических узлов, поражение почек, центральной нервной системы, изменения со стороны крови и т.д. Эти симптомы могут встречаться в различных сочетаниях. Но хорошо известно, что аналогичные симптомы могут наблюдаться и при некоторых других заболеваниях – онкологических, гематологических, инфекционных. Это – так называемые «маски» болезни. Для того чтобы с уверенностью установить диагноз СКВ и исключить иные причины необходимо провести лабораторное обследование. Сочетание характерных симптомов с положительными данными лабораторных тестов позволяет поставить диагноз с точностью до 99%. Исследуют кровь на наличие аутоантител, то есть специфических белков, образующих комплексы с собственными тканями организма и повреждающих эти ткани. Наибольшей диагностической ценностью обладают антитела к ДНК и антинуклеарный фактор (АНФ). Кроме того, важным лабораторным признаком является так называемый «LE-феномен», определяемый по специфическому склеиванию клеток крови. Название происходит от латинского наименования заболевания «Luрus Erythematosus». Помимо этих специальных лабораторных исследований больным с СКВ выполняется множество «обычных» анализов крови и мочи. Это необходимо для того, чтобы правильно оценить ситуацию на различных этапах лечения. Что касается биопсии почки, то она необходима не столько для диагностики (хотя в некоторых случаях диагноз СКВ ставится именно по данным биопсии почки), сколько для определения тактики лечения. Дело в том, что более чем у 80% больных с СКВ имеется поражение почек. Тяжесть этого поражения очень различна, а точно узнать, насколько сильно повреждена ткань почек, можно только рассмотрев эту ткань под микроскопом, то есть – выполнив биопсию. Между тем, именно волчаночный нефрит (поражение почек) является одним из наиболее серьезных проявлений СКВ и требует наиболее агрессивного лечения. Поэтому биопсия почки помогает определить дозы лекарственных препаратов, режим их введения и длительность основного курса терапии. Вопрос №4. Нельзя ли обойтись без гормонов и химиотерапии? И почему лекарства надо принимать так долго? В тех случаях, когда речь идет не о кожной форме, а именно о системной красной волчанке, когда имеется поражение почек, центральной нервной системы, сердца, легких – обойтись без иммуносупрессивной, то есть подавляющей иммунные реакции, терапии, нельзя. СКВ относится к разряду заболеваний, при которых лечение проводить обязательно. Вплоть до середины двадцатого века, до внедрения в клиническую практику кортикостероидов (гормонов, одним из которых является преднизолон), СКВ относили к категории болезней с безнадежным прогнозом. Преднизолон подавляет иммунные реакции и тем самым снижает до минимума активность заболевания. Его применение позволило спасти жизнь многих тысяч больных СКВ. Лечение преднизолоном начинают сразу же после установления диагноза и проводят очень длительно. Причем дозы препарата должна быть высокими. Если доза или длительность лечения будут недостаточными, то либо улучшение не наступит совсем, либо после периода улучшения (это называется ремиссией) разовьется обострение. Но одного преднизолона недостаточно. Для успешного лечения требуется применение препаратов, называемых цитостатиками. Дословно это название переводится как «останавливающие клетки». Применительно к СКВ речь идет о воздействии на клетки иммунной системы. Цитостатики стали использовать с 70-х годов XX века, в результате чего выживаемость больных СКВ повысилась до 90%. Кроме того, применение цитостатиков позволяет уменьшить дозы преднизолона, а значит и его побочные эффекты. Какой именно цитостатик и в какой форме назначить – решает врач-специалист на основании комплексного обследования, в том числе и данных биопсии почки. Вопрос №5. Что делать, чтобы не прибавлять в весе, принимая преднизолон? Можно ли со временем совсем отменить этот препарат? Преднизолон – это гормон, аналогичный природному кортизолу. Кортизол вырабатывается надпочечниками и обладает широким спектром действия. Он участвует в регуляции водно-солевого, углеводного, белкового и жирового обмена, обеспечивает поддержание артериального давления, обладает противовоспалительным, противоалергическим и иммуносупрессивным (то есть подавляющим иммунные реакции) действием. При СКВ, так же как и при целом ряде других заболеваний, таких как бронхиальная астма, ревматоидный артрит, хронический гломерулонефрит, лечебный эффект достигается за счет иммуносупрессивного, противовоспалительного и антиаллергического действия преднизолона. Воздействие на обмен веществ, также как и раздражающее действие на слизистую оболочку желудка, являются побочными эффектами. Избежать их полностью невозможно, ведь лечебные дозы преднизолона существенно превышают естественный уровень кортизола в организме, но при соблюдении необходимых мер предосторожности можно свести побочные эффекты к минимуму. Прежде всего, больной получающий преднизолон, должен периодически проходить обследование желудка – гастроскопию. Для защиты слизистой желудка назначаются обволакивающие препараты, такие как альмагель, а также препараты, уменьшающие кислотность желудочного сока (ранитидин, фамотидин и др.). Для профилактики нарушений водно-солевого обмена, особенно больным с поражением почек, необходимо жестко соблюдать бессолевую диету. В противном случае преднизолон будет задерживать в организме натрий (а поваренная соль, как мы с вами должны помнить из школьного курса химии, – это хлористый натрий), а следом за ней и воду. Из-за этого, особенно на начальных этапах лечения, когда противовоспалительный и иммуносупрессивный эффект еще не наступил, могут возникать отеки и повышаться артериальное давление. Бессолевая диета подразумевает полное исключение подсаливания пищи в процессе приготовления, а это означает, что необходимо отказаться от мясных, рыбных и овощных консервов, соусов, маринадов, солений, копчений, минеральной воды, а также от колбасных изделий и сыра. Приготовленная дома пища не солится совсем. Для профилактики ожирения и развития сахарного диабета необходимо исключить легкоусвояемые углеводы (сахар, конфеты, шоколад, выпечку, макаронные изделия) и животные жиры (сливочное масло, жирное мясо). Немедленно возникает вопрос – а что же тогда есть? Фрукты, овощи, творог и кисломолочные продукты, крупы, нежирное мясо, морскую рыбу. Кстати, их потребление защитит костно-мышечную систему от воздействия преднизолона на обмен калия и кальция. Что же касается отмены преднизолона, то стремиться следует не к этому. Дело в том, что СКВ является не столько болезнью, сколько пожизненным состоянием. Имеется в виду состояние иммунной системы, которая, будучи в начале заболевания настроена против собственных тканей организма, сохраняет эту настроенность многие годы и десятилетия, даже если все это время сохраняется клиническая и лабораторная ремиссия. Поэтому после основного курса лечения необходимо постоянно проводить так называемую «поддерживающую терапию», в противном случае многократно возрастает вероятность обострения. Поддерживающая терапия включает в себя преднизолон в малых дозах (0,5-2 таблетки в день) и, в части случаев, цитостатики, также в небольших дозах. Поддерживающая терапия обладает минимальными побочными эффектами, но, разумеется, должна проводиться под наблюдением специалистов. Таким образом, больным СКВ следует наблюдаться у ревматолога или нефролога пожизненно. Самостоятельное прекращение лечения недопустимо. Вопрос №6. Можно ли продолжать работать, учиться? Обязательна ли инвалидность при СКВ? В период активности заболевания, когда проводится основной курс лечения, занимающий не менее полугода, а чаще всего 10-12 месяцев, необходимо длительное пребывание в стационаре, неоднократные повторные госпитализации. Современная иммуносупрессивная терапия требует строгого врачебного контроля. Кроме того, иммуносупрессия подавляет не только патологические иммунные реакции, но и нормальный иммунитет, поэтому пациенты, получающие преднизолон и цитостатики в лечебных дозах, становятся восприимчивы к любым вирусным и бактериальным инфекциям. А это означает, что для профилактики осложнений необходимо свести к минимуму поездки в транспорте, пребывание в местах скопления людей. Стало быть, на время основного курса лечения работу и учебу необходимо прервать – как минимум на год. Обычно при этом оформляется II группа инвалидности. Впоследствии, при достижении ремиссии заболевания и переходе на поддерживающее лечение, трудоспособность восстанавливается (разумеется, тяжелый физический труд и занятия, связанные с профессиональными вредностями, исключаются). Вопрос №7. Можно ли рожать больным с СКВ? Беременность и роды при СКВ увеличивают риск обострения болезни. Некоторые формы этого заболевания сами по себе приводят к выкидышам и невынашиванию беременности. Кроме того, прием некоторых цитостатиков может вызвать развитие врожденной патологии плода. Поэтому беременность для больных СКВ нежелательна. Тем не менее, в случаях длительной устойчивой ремиссии, на фоне приема малых доз преднизолона и препаратов, предотвращающих связанные с заболеванием выкидыши, под постоянным наблюдением специалистов, вынашивание беременности возможно. В частности мы в течение многих лет наблюдаем нескольких пациенток, благополучно родивших здоровых детей и остающихся в ремиссии. В заключение хочется еще раз подчеркнуть, что СКВ относится к категории заболеваний, при которых своевременное правильно подобранное лечение радикально меняет судьбу больных и позволяет продлевать полноценную жизнь на десятилетия. Разумеется, под регулярным врачебным наблюдением и при условии строгого соблюдения всех рекомендаций. По материалам статьи Е.В. Захаровой «Системная красная волчанка». www.medkrug.ru |
г.Самара, ул. Димитрова 131 [email protected] |
 |