 |
|
||||||||||
|
Т-клеточная иммунотерапия (Т-клеточная вакцинация) в лечении аутоиммунных и аллергических расстройств. Т клеточная вакцинаИзменение иммунной системы аутоиммунной терапиейСтатьи →© 2011 г. И.П. Иванова*, Г.В. Селедцова*, С.В. Мамаев***, Л.С. Литвинова**,Ю.А. Лопатникова*, С.В. Сенников*, В.И. Селедцов** * НИИ клинической иммунологии СО РАМН, г. Новосибирск, Россия; ** Балтийский федеральный университет им. И. Канта, г. Калининград, Россия; *** ФМБА ФГУЗ Клиническая больница № 85, г. Москва, РоссияПоступила: 07.07.2011. Принята: 07.10.2011 Пациенты с ревматоидным артритом были пролечены с использованием вакцины, состоящей из аутологичных коллагенреактивных Т-клеток. Установлено, что после иммунотерапевтического курса лечения антиген-специфическая пролиферативная активность мононукле- арных клеток периферической крови пациентов значительно снижалась. Вакцинотерапия приводила также к достоверному снижению уровня IFNy и повышению уровня IL-4 в плазме крови пациентов. В соответствии с этим, у больных после курса лечения Т-клеточной вакциной отмечалось снижение числа IFNy-продуцирующих CD4+ и CD8 + клеток в 1,6 — 1,8 раза, а также параллельное увеличение числа IL-4-продуцирующих CD4+ лимфоцитов в 1,7 раза. Кроме того, в настоящем исследовании показано, что у больных ревматоидным артритом в сравнении со здоровыми лицами содержание CD8 + CD45RO + CD62L- эффекторных Т-клеток памяти и количество центральных CD4+CD45RO + CD62L+ и CD8 + CD45RO + CD62L+ Т-клеток памяти было увеличено в 5 — 7 раз. В процессе лечения у вакцинированных пациентов наблюдалось значительное снижение числа CD4+ и CD8+ центральных Т-клеток памяти, а также уменьшение количества эффекторных CD8+ Т-клеток памяти. Нами обнаружено также, что после вакцинации у больных достоверно увеличивалось количество регуляторных CD4+CD25 + FoxP3+ Т-клеток в периферической крови. Однако количество CD4+CD25- FoxP3+ Т-клеток существенно не менялось в процессе всего периода лечения. В результате клинического применения Т-клеточной вакцинации клиническое улучшение было достигнуто у 87% пациентов. Ключевые слова: Т-клетки, вакцина, вматоидный артрит ВведениеОбщепринято, что в основе патогенеза ревматоидного артрита (РА) лежит аутоиммунный процесс, опосредуемый Т-хелперами I типа. Специфическое распознавание Т-лимфоцитами антигенных молекул, экспрессирующихся на синовиальных суставных поверхностях, запускает цепь событий, приводящих к воспалению и разрушению суставов [1, 2]. Аутореактивные Т-клетки, распознающие собственные антигены, являются составной частью иммунной системы здорового организма. Это значит, что посттимические механизмы контролируют эти аутоагрессивные Т-клетки и обеспечивают защиту от них. Такая регуляция может включать периферическую клональную делецию, модуляцию антагонистами цитокинов, ингибицию взаимодействия идиотипов T-клеточных рецепторов (ТКР). Нарушенная регуляторная сеть приводит к нарушению подавления активированных аутоиммунных клеток и развитию аутоиммунного заболевания [2 — 4]. Является очевидным, что иммунотропное лечение РА должно быть направлено на инактивацию аутоиммунных Т- и В-лимфоцитов, усиление активности естественных и индуцированных регуляторных Т-клеток, подавление продукции провоспалительных медиаторов. Т-клеточная вакцинация (ТКВ) — введение ослабленных аутореактивных Т-клеток — включает многие регуляторные механизмы иммунного ответа: — ТКВ индуцирует антиклонотипические Т-клетки. Они регулируют патогенные Т-клетки через распознавание клонотипических детерминант (идиотипов), т.е. антиидиотипический ответ. В основном, это цитотоксические CD8 + Т-клетки, рестриктированные по молекулам МНС I класса. Меньшую долю составляют антиидиотипические CD4+ Т-клетки. Эти клетки не цитотоксичны для аутореактивных клеток, но ингибируют их пролиферацию, распознавая идиотипические детерминанты в комплексе с молекулами гистосовместимости II класса. Они могут принадлежать к разным типам Т-лимфоцитов: Th3 — продуцентам IL-4; Th4- продуцентам TGFp [4-7]. — ТКВ также затрагивает функцию естественных CD4 + CD25+ регуляторных Т-клеток (Treg). Имеются данные, предполагающие, что часть этих клеток обладает специфичностью к ТКР и исходно вовлечена в идиотипантиодиотипическую иммунорегуляцию. Это означает, что Т-клеточная вакцинация может создавать благоприятные условия для экспансии CD4+CD25+ T reg, специфичных к вакцинальным ТКР [8]. — ТКВ воздействует на антиэрготипическую регуляцию Т-клеточных реакций, которая не связана с распознаванием идиотипических детерминанат. Независимо от своей антигенной специфичности, антиэрготипические Т-клетки реагируют только на активированные, а не покоящиеся аутореактивные Т-клетки [4, 9]. — ТКВ индуцирует не только Т-, но и В- клеточные реакции, а именно, образование антиидиотипических антител, которые связываются и ингибируют аутореактивные Т-клеточные клоны. Они относятся к IgG, распознают ТКР-детерминанты вне зависимости от молекул главного комплекса гистосовестимости. Механизм действия таких антител может быть связан с экранированием и функциональной блокадой ТКР [10]. Таким образом, имеющиеся экспериментальные и клинические данные дают основание полагать, что ТКВ может стать эффективным методом лечения аутоиммунных заболеваний, имеющим большой потенциал для своего дальнейшего развития [11, 12]. Целью настоящей работы было исследование иммунологических и клинических аспектов применения Т-клеточной вакцинации у больных РА. Материалы и методыТехнология получения Т-клеточной вакциныРазработанная нами технология получения Т-клеточной вакцины состоит из двух последовательных этапов. Первый этап включает в себя специфическую селекцию клеток, тогда как второй — их наращивание в необходимом количестве [13, 14]. На первом этапе выделенные из периферической крови мононуклеарные клетки (МНК) пациентов культивировали в концентрации 2×106 мл в среде RPMI 1640, содержащей 10% инактивированной аутологичной плазмы, 5 мМ HEPES, 2 мМ L-глутамина, 5×10-5 М меркаптоэтанола (все реагенты компании «Sigma», США) в присутствии синовиальных (1 мкг/мл) и хрящевых (1 мкг/мл) антигенов в течение 5— 7 дней во влажной атмосфере с 5% СО2. Хрящевые и синовиальные белковые антигены получены из суставных тканей свиньи. Антиген хрящевой ткани выделяли методом, описанным Strom S.C. [15]. Синовиальный белковый антиген получали путем центрифугирования синовиальной жидкости. На втором этапе антигенспецифические клетки наращивали посредством их стимуляции фитогемагглютинином (ФГА, 5 мкг/мл, «Sigma») и рекомбинантным IL-2 (100 ед/мл, «Биотех», Санкт- Петербург) в течение 5 дней. По завершению культивирования клетки инактивировали, далее криоконсервировали стандартным путем в плазме с 10% диметилсульфоксида («Sigma») и хранили в жидком азоте до момента использования. Общее количество полученных от одного больного клеток вакцины варьировало в пределах 18—27×107. Пролиферативный ответ полученных таким образом вакцинальных клеток на хрящевые и синовиальные антигены превышал контрольные значения 1,8 — 2,0 раза. В процессе культивирования число IFNy-продуцирующих CD4+ и CD8+ Т-клеток увеличивалось от 3 до 10 раз, содержание CD3 + СD45RO+ Т-клеток памяти увеличивалось в 2 раза, а содержание CD3 + СD45RА+ — в 1,3 раза [16]. Оценка пролиферативного ответа МНКДля оценки антиген-индуцированного пролиферативного ответа МНК культивировали в 96-луночном планшете в концентрации 2×105 в полной среде в присутствии хрящевых (1 мкг/мл) и синовиальных (1 мкг/мл) антигенов либо без них в течение 5 дней во влажной атмосфере с 5% СО2. Клеточная пролиферация учитывалась стандарным методом по включению [3Н] тимидина. Определение цитокинов в плазме крови и культуральных жидкостяхКоличественное содержание цитокинов — IFNy и IL-4 в образцах плазмы крови и супернатантах 72-часовых культур МНК оценивали иммуноферментным методом с использованием коммерческих тест-систем компании «Вектор-Бест» (п. Кольцово, Новосибирская область). Оценка содержания IFNy- и IL-4 — продуцирующих лимфоцитовКоличество IFNy- и IL-4- продуцирующих лимфоцитов оценивали с помощью метода определения внутриклеточных цитокинов после 4 ч культивирования МНК периферической крови в присутствии форболового эфира, иономицина и брефелдина А. По окончании периода культивации клетки обрабатывали моноклональными антителами к поверхностным маркерам (CD4 и CD8) и после фиксации и пермеабилизации инкубировали в присутствии моноклональных антител (МА) к IFNy и IL-4 (все реактивы «Becton Dickinson», США). После отмывки клетки анализировали на проточном цитометре. Определение содержания Т-клеток памятиОтносительное содержание клеток памяти определяли методом 3-цветной проточной цитофлюориметриии с помощью меченных фикоэритрином (РЕ) МА к CD4 и CD8 («Сорбент», Москва), конъюгированных с флюоресцеинизотиоцианатом (FITC) МА к CD45RO («eBioscience», США), меченных аллофикоцианином (APC) анти-CD62L МА («eBioscience», США). По наличию или отсутствию на клеточной поверхности соответствующих молекул определяли следующие клеточные популяции: наивные клетки — (CD45RO"CD62L+), центральные клетки памяти — (CD45RO+CD62L+), эффекторные клетки памяти — (CD45RO+CD62L«). В тексте указан процент каждой популяции от общего числа лимфоцитов. Определение содержания регуляторных Т-клетокПоверхностные маркеры регуляторных (CD4+CD25+FoxP3 + ) клеток определяли с помощью МА к CD4, меченных АРС; МА к IL-2 рецептору (CD25), конъюгированных с FITC. Экспрессию FoxP3 оценивали с использованием МА, меченных РЕ (все реактивы «Becton Dickinson», США). Процент позитивных от общего числа лимфоцитов клеток определяли на проточном цитометре «FACS Calibur». Клинические исследованияКлинические и экспериментальные исследования проводили в соответствии с протоколом, утвержденным Ученым советом и Этическим комитетом Института клинической иммунологии СО РАМН. От каждого пациента, участвующего в исследовании, было получено информированное согласие. Иммунотерапевтическое лечение было проведено 42 больным РА (37 женщин, 5 мужчин) в возрасте от 28 до 58 лет с давностью заболевания не менее 2 лет. Клинические испытания проводили на базе ФМБА ФГУЗ Клинической больницы № 85, г. Москва. Все пациенты получали базисную терапию метотрексатом в дозе не более 10 мг в неделю. Дополнительно схема лечения Т-клеточной вакциной включала в себя 4 еженедельных подкожных вакцинации (индуцирующий курс) и последующие вакцинации с интервалом в 1 месяц. Вакцинальная доза варьировала в пределах 2,0 — 4,0×107 клеток. Для оценки эффективности лечения Т-клеточной вакциной использовали критерии Европейской антиревматической лиги (EULAR), основанные на динамике DAS 28 [19]. Кроме того, анализировали отдельные показатели активности РА: интенсивность боли, длительность утренней скованности, число болезненных и число припухших суставов, СОЭ, параметры качества жизни (HAQ). Для иммунологического исследования составили контрольную группу из 10 здоровых доноров, сопоставимых по возрасту. Статистическую обработку результатов проводили с использованием критерия U Вилкоксона-Манна-Уитни, парного критерия Вилкоксона. Результаты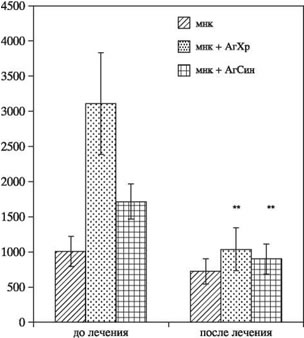 Рис. 1. Пролиферативный ответ МНК периферической крови больных РА (n = 12) на специфические антигены (хрящевой и синовиальный) до и через 1 год после начала лечения.** Р < 0,01 — статистическая значимость различий, критерий U Пролиферативный ответ и продукция про- и противовоспалительных цитокинов МНК периферической крови больных РА В процессе лечения Т-клеточной вакциной пролиферативный ответ МНК больных РА в ответ на хрящевые и синовиальные антигены достоверно снижался (рис. 1). Это может свидетельствовать об уменьшении количества аутоантиген-реактивных клеток в организме пациента. Вакцинотерапия приводила также к значительному и стойкому снижению уровня IFNy и увеличению уровня IL-4 в плазме крови через 6 месяцев после начала лечения (рис. 2). МНК вакцинированных пациентов в присутствии антигенов суставных тканей отличались пониженной способностью к продукции IFNy и повышенной способностью к продукции IL-4 по сравнению с исходными (до начала терапии) значениями (данные не представлены). В соответствии с этим, у больных РА уже после индуцирующего курса лечения Т-клеточной вакциной отмечалось достоверное снижение IFNy- продуцирующих CD4+ и CD8+ клеток в 1,6 — 1,8 раза, а также параллельное увеличение числа IL-4- продуцирующих CD4+ лимфоцитов в 1,7 раза (рис. 3). Исследование относительного содержания Т-клеток памяти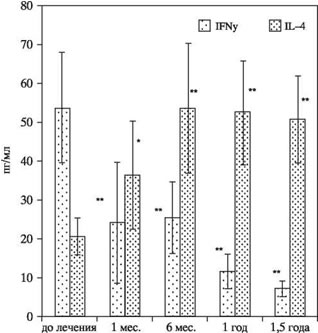 Рис. 2. Содержание IFNy и IL-4 в плазме крови больных РА (n = 12) в динамике лечения.* Р < 0,05; ** Р < 0,01 — статистическая значимость различий в сравнении с исходным уровнем, критерий U. В результате проведенного исследования нами обнаружено, что у как у здоровых лиц, так и у больных РА количество «наивных» CD4+CD45RO-CD62L+ и CD8+CD45RO’ CD62L+ существенно не различалось (таб. 1). В то же время, у больных РА содержание CD8+CD45Ro+Cd62L" эффекторных клеток памяти было увеличено в 5 раз, а количество центральных клеток памяти CD45RO+CD62L+ было увеличено как среди CD4+, так и среди CD8+ Т-клеток. Наши данные указывают, что при РА может иметь место ускоренная диффе- ренцировка «наивных» клеток в центральные CD4+ и CD8+ Т-клетки и цитотоксические эффекторные CD8+ Т-клетки, которая отражает антигенспецифическую экспансию Т-клеток в ответ на повторные, системные воздействия антигена [17, 18].  Рис. 3. Содержание IFNy и IL-4-продуцирующих лимфоцитов (CD4 и CD8) в периферической крови больных РА (n = 7) до и после индуцирующего курса лечения.* P < 0,05 — статистическая значимость различий по сравнению с исходным уровнем, парный критерий Вилкоксона. В процессе лечения у вакцинированных пациентов уже через 1 мес. наблюдалось достоверное и значительное (в 5 — 6 раз) снижение числа CD4+ и CD8 + центральных клеток памяти, а также уменьшение в 2 раза количества эффекторных CD8+ клеток памяти. Полученный эффект поддерживался в течение 9 мес. от начала вакцинации, после чего количественные характеристики клеток памяти возвращались к величинам, близким исходным. Исследование относительного содержания регуляторных Т-клетокПредставленные на рис. 4 данные показывают, что, по сравнению с донорами, в периферической крови больных РА отмечается незначительное снижение количества регуляторных «наивных» CD4+CD25+FoxP3 + Т-клеток, которое уже через 1 мес. после начала вакцинации достоверно увеличивается (практически в 6 раз). Этот эффект прослеживается в течение 6 мес. от начала лечения, а затем постепенно уменьшается. Что касается популяции индуцированных CD4+CD25- FoxP3+ Т-клеток, то их число существенно не меняется в процессе всего периода лечения. Результаты клинических испытанийТаблица 1. Содержание субпопуляций Т-клеток у больных РА в процессе лечения Т-клеточной вакциной (M ± m)
* P < 0,05 — статистическая значимость различий показателей при сравнении группы доноров и больных до начала лечения, а также в группах вакцинированных больных по сравнению с исходным уровнем (критерий U). Результаты оценки клинической эффективности Т-клеточной вакцинации у пациентов с РА свидетельствуют о хорошем/умеренном клиническом эффекте (по критериям EULAR) применяемого курса лечения. Это подтверждается достоверным и стойким снижением индекса DAS28, снижением интенсивности болевого синдрома, числа болезненных и числа припухших суставов, продолжительности утренней скованности и утомляемости начиная с 3 мес. после начала терапии (таб. 2).  Рис. 4. Количественное содержание регуляторных Т-клеток у больных РА в процессе лечения Т-клеточной вакциной.** P < 0,01 — статистическая значимость различий показателей по сравнению с исходным уровнем, критерий U. При более подробном анализе результатов установлено, что на фоне лечения хороший и умеренный эффект был достигнут к 6 мес. у 91,5% пациентов и только у 9,5% больных улучшения не было зарегистрировано. При этом у 28,5% развилась клиническая ремиссия (DAS < 2,6 ед.). Эффект лечения был стойким, и сохранялся в течение 2 лет от начала терапии. К 24 мес. наблюдения хорошие и умеренные результаты были зарегистрированы у 87% больных, низкая степень активности отмечена у 63,6%, а состояние клинической ремиссии достигнуто у 40,9% пациентов. Переносимость вакцинации, в целом, была удовлетворительной, только в одном случае наблюдалась местная реакция в виде покраснения кожи и в двух случаях отмечалось повышение температуры тела. Все побочные эффекты не требовали прекращения лечения и купировались самостоятельно. ОбсуждениеТрадиционное лечение РА основано на длительной неспецифической иммуносупрессирующей терапии, которая снижает иммунитет в целом и имеет высокий риск развития серьезных побочных эффектов. Имеется очевидная необходимость поиска новых подходов к лечению РА и других аутоиммунных заболеваний, нацеленных на избирательную инактивацию патогенных, аутореактивных лимфоцитов. Один из таких подходов базируется на вакцинации пациента аутоиммунными лимфоцитами, так как хорошо известно, что к антигенным рецепторам лимфоцитов, сформированным в постнатальный период, нет врожденной иммунологической толерантности и межлимфоцитарные идиотип- антиидиотипические взаимодействия играют важную роль в регуляции функционирования иммунной системы. Таблица 2. Динамика суставного синдрома и лабораторных показателей в процессе Т-клеточной вакцинации (M ± m)
Р < 0,001 — статистическая значимость различий в группах до и после лечения (критерий U). Очевидное преимущество ТКВ перед другими методами лечения заключается не только в ее избирательной направленности на инактивацию именно тех лимфоцитов, которые ответственны за развитие аутоиммунного процесса. Особенно важным представляется то, что механизм влияния ТКВ включает в себя целый ряд компонентов: стимуляцию анти-идиотипических иммунных реакций, индукцию и стимуляцию функциональной активности T reg, индукцию синтеза анти-идиотипических антител и др. Следует признать, что данных по клиническому применению метода ТКВ пока явно недостаточно. Ранее, в большинстве исследований для иммунизации использовались клонированные Т-лимфоциты. Однако, наработка Т-клеточных клонов — процедура дорогая, длительная и далеко не всегда заканчивающаяся успехом. Кроме того, инактивация одного или нескольких аутоиммунных клонов может не оказать существенного влияния на развитие заболевания, которое может быть обусловлено поликлональным иммунным ответом, направленным против множества антигенных детерминант, где значимость одного отдельного клона в аутоиммунном процессе может оказаться несущественной. Все это ограничивает возможности эффективного применения клонированных Т-клеток в лечении как РА, так и других аутоиммунных заболеваний. Разработанный в нашей лаборатории метод позволяет за относительно короткое время получить достаточное количество аутоантиген- реактивных Т-клеток. При этом состав вакцины определяется исходной индивидуальной реактивностью Т-клеток и представлен наиболее аутоагрессивными клетками, которые получали селективные ростовые преимущества, связанные с присутствием в культуре антигенов суставных тканей. Одной из основных целей проведенного нами пилотного клинического исследования являлась оценка иммунологической и клинической эффективности предлагаемого способа лечения. На иммунологическую эффективность ТКВ указывает значительное снижение пролиферативной активности МНК больных в ответ на воздействие тканевых суставных антигенов, которая может отражать снижение числа антиген-реактивных клеток в организме. Важное значение имеют также изменения в концентрации IFNy и IL-4, выявленные в плазме крови и супернатантах МНК вакцинированных пациентов. Снижение первого и повышение второго указывает на функциональную перестройку иммунной системы и включение неспецифических иммунных механизмов в торможение иммунопатологического процесса. Считается, что при РА, продуцируемый Т-хелперами 1 типа, IFNy играет ключевую роль в вовлечении макрофагов и других иммунокомпетентных клеток в патологическое воспаление, тогда как, продуцируемый Т-хелперами 2 типа, IL-4 способен снижать этот, опосредуемый IFNy, эффект и, таким образом, оказывать противовоспалительное действие. Снижение числа центральных и, в особенности, эффекторных CD8 + клеток памяти в результате иммунотерапии также является благоприятным признаком для развития заболевания, так как продуцирующие IFNy, TNFa и перфорин CD8+ Т-клетки участвуют в активации макрофагов и поддержании хронического воспаления и деструкции тканей сустава. С другой стороны, ослабление аутоиммунных реакций может быть, по-видимому, достигнуто за счёт зарегистрированного в нашем исследовании увеличения количества или усиления функциональной активности CD4+CD25+FoxP3+ регуляторных Т-клеток, которые способны оказывать выраженное негативное влияние как на генерацию клеток иммунной памяти, так и на функции эффек- торных клеток [20]. Полученные результаты также предполагают наличие значимой клинической эффективности применения Т-клеточной вакцинации, так как хороший и умеренный эффект лечения был достигнут у 87% больных. Таким образом, ТКВ открывает новые возможности в лечении РА и других аутоиммунных заболеваний. Она хорошо переносится, не имеет значительных побочных эффектов, ограничивающих её клиническое применение, позволяет индуцировать в иммунной системе долговременные изменения, препятствующие прогрессии заболевания. Очевидно, что развитие этой технологии и получение новых данных, связанных с её применением, чрезвычайно востребовано современной медициной. Список литературы1. Stamenkovic I., Stegagno M., Wright K.A., Krane S.M., Amento E.P. et al. Clonal dominance among T-lymphocyte infiltrates in arthritis. Proc. Natl. Acad. Sci. USA 1998, 85, 1179-1183. 2. VanderBorght A., Geusens P., Raus J., Stinissen P. The autoimmune pathogenesis of rheumatoid arthritis: role of autoreactive T cells and new immunotherapies. Semin. Arthritis Rheum, 2001, 31, 160-175. 3. Fekete A., Soos L., SzekaneczZ., Szabo Z., SzodorayP. et al. Disturbances in B- and T-cell homeostasis in rheumatoid arthritis: suggested relationship with antigen-driven immune responses. J. Autoimmun. 2007, 29(2-3), 154-163. 4. Correale J., Farez M., Gilmore W. Vaccines for multiple sclerosis. CNS Drugs 2008, 22(3), 175198. 5. Honda A., Ametani A., Matsumoto T., Iwaya A., Kano H.et al.Vaccinationwith an immunodominant peptide of bovine type II collagen induces an anti-TCR response, and modulates the onset and severity of collagen-induced arthritis. Int. Immunol. 2004, 16, 737-745. 6. Moreland L.W., Heck L.W., Koopman W.J., SawayP.A., Adamson T.C. et al. Vp 17 T cell receptor peptide vaccination in rheumatoid arthritis: results of phase 1 dose escalation study. J. Rheumatol. 1996, 23, 1353-1362. 7. Zang Y.C.Q., Hong J., Tejada-Simon M.V., Li S., Rivera V.M. et al. Th 2 immune regulation induced by T cell vaccination in patients with multiple sclerosis. Eur. J.Immunol. 2000, 30, 908-913. 8. Vandenbark A.A. TCR peptide vaccination in multiple sclerosis: Boosting a deficient regulatory network that may involve TCRspecific CD4+CD25+ Treg cells. Curr. Drug Targets Inflamm. Allergy 2005, 4, 85-94. 9. Hellings N., Raus J., Stinissen P. T cell vaccination in multiple sclerosis: update on clinical application and mode of action. Autoimm. Rev. 2004, 3, 267275. 10. Hong J., Zang Y.C.Q., Tejada-Simon M.V., Li S., Rivera V.M., Killian J. et al. Reactivity and regulatory properties of human anti-idiotypic antibodies induced by T cell vaccination. J. Immunol. 2000, 165, 6858-6864. 11. Селедцов Д.В., Селедцов В.И., Иванова И.П., Литвинова Л.С. Антиген-специфическая иммунотерапия рассеянного склероза. Цитокины и воспаление 2010, 9(1), 3-12. 12. Vandenbark A.A., Morgan E., Bartholomew R., Bourdette D., WhithamR. et al. TCR peptide therapy in human autoimmune diseases. Neurochem. Res. 2001, 26, 713-730. 13. Селедцов В.И., Иванова И.П., Самарин Д.М., Козлов В.А. Способ получения поликлональной Т-клеточной вакцины для лечения иммунологических расстройств. РФ, Патент на изобретение № 2277422, 10 июня 2006 г. 14. Иванова И.П., Селедцов В.И., Банул Н.В., Самарин Д.М., Селедцова Г.В. и др. Получение Т-клеточной вакцины и ее применение для лечения рассеянного склероза. Медицинская Иммунология 2005, 7(1), 27-32. 15. Strom S.C., Michalopoulos G. Collagen as a substrate for cell growth and differentiation. Methods Enzymol. 1982, 82(A), 554-555. 16. Иванова И.П., Селедцов В.И., СеледцовД.В., Самарин Д.М., Селедцова Г.В. и др. Характеристика иммуногенных свойств поликлональной Т-клеточной вакцины, предназначенной для лечения ревматоидного артрита. Клеточные технологии в биологии и медицине 2007, 4, 221-226. 17. Nanki T., Lipsky P.E. Cytokine, activation marker, and chemokine receptor expression by individual CD4+ memory T cells in rheumatoid arthritis synovium. Arthritis Res. 2000, 2(5), 415-423. 18. Селедцов В.И., Литвинова Л.С., Гончаров А.Г., Щуплецова В.В., Селедцов Д.В. и др. Клеточные механизмы генерации иммунологической памяти. Цитокины и воспаление 2010, 9(4), 9-15. 19. Fransen J., Stucki G., van Riel P.L.C. Rheumatoid arthritis measures. Arthr. & Rheum. 2003, 49, 214-224. 20. Corthay A. How do regulatory T cell work? Scand. J. Immunol. 2009, 70(4), 326-336. CHANGES OF IMMUNE PARAMETRS DURING T-CELLSVACCINATION IN PATIENTS WITH RHEUMATOID ARTHRIRIS I.P. Ivanova*, G.V. Seledtsova*, S.V. Mamaev***, L.S. Litvinova**, J.A.Lopatnikova*, S.V. Sennikov*, V.I. Seledtsov** Research Institute of Clinical Immunology, Siberian Division of Russian Academy of Medical Sciences, Novosibirsk, Russia; ** Baltic Federal University of Immanuel Kant, Kaliningrad, Russia; Clinical Hospital № 85, Moscow, Russia Rheumatoid arthritis patients were treated with an vaccine consisted of autological collagen- reactive T-cells. It was established, that antigen-specific, proliferative activity of the patients’ peripheral blood mononuclear cells was a significantly decreased after immunotherapy course. A significant decrease in IFNy level and an increase in IL-4 level were noted in the plasma of vaccine- treated patients. In accordance with this, after course of T-cells vaccination the number of IFNy- producing CD4+ and CD8+ cells was decreased (by 1,6 — 1,8 fold) in patients, whereas the number of IL-4-producing CD4+ lymphocytes was increased by 1,7 fold. In addition, the present study showed that effector memory CD8+CD45RO+CD62L- T-cells and central memory CD4+CD45RO+CD62L+ and CD8+CD45RO+CD62L+ T-cells were significantly increased (by 5 — 7 fold) in rheumatoid arthritis patients as compared with levels in healthy individuals. During the treatment the peripheral blood central memory CD4+ and CD8+ T-cells, as well the effector memory CD8+ T-cells levels significantly decreased in vaccinated patients. We revealed that after vaccinotherapy regulatory CD4+CD25+FoxP3+ T-cell levels significantly increased in the patients’ peripheral blood. However, amount of CD4+CD25-FoxP3+ Т-cells did not change during all treatment courses. As the result of the T-cell vaccine clinical application it has been established that clinical improvement was achieved in 87% patients. transplantation.ru способ получения поликлональной т-клеточной вакцины для лечения иммунологических расстройств - патент РФ 2277422Изобретение относится к биотехнологии и может найти применение в иммунологии. Мононуклеарные клетки больного культивируют в присутствии антигена, выбранного из группы миелинового белка, белков коллагена, аллергена, аллогенных клеток. Антиген-реактивные бластные Т-клетки отделяют с использованием градиентного центрифугирования на перколле. Выделенные Т-клетки наращивают посредством неспецифической митогенной стимуляции. Использование изобретения позволяет получать Т-клеточную вакцину для лечения иммунологических расстройств, обусловленных наличием антигена, выбранного из группы миелинового белка, белков коллагена, аллергена, аллогенных клеток за 10-12 дней. 4 з.п. ф-лы. Изобретение относится к биологии и медицине, а именно к иммунотропному лечению тяжелых заболеваний, в основе которых лежат антиген-индуцированные, патогенные Т-клеточные реакции, приводящие к повреждению собственных тканей организма (например, рассеянный склероз, ревматоидный артрит, аллергические заболевания). Стандартное лечение тяжелых аутоиммунных и аллергических заболеваний базируется на применении гормонов, цитостатиков и других препаратов, обладающих неспецифической иммуносупрессорной активностью. Такое лечение снижает иммунитет в целом и ассоциируется с высоким риском развития серьезных побочных эффектов. Очевидно то, что избирательная элиминация патогенных лимфоцитов из организма должна лежать в основе патогенетического лечения этих заболеваний. Один из способов достижения этой цели базируется на возможности стимуляции у больного антиидиотипического иммунного ответа, направленного на вариабельные фрагменты (идиотипы) антигенных рецепторов патогенных лимфоцитов [5]. В частности, показано, что вакцинация миелин-реактивными Т-клетками животных с экспериментальным аутоиммунным энцефаломиелитом может приводить к остановке развития демиелинизирующего процесса вследствие избирательной элиминации из организма именно тех лимфоцитов, которые ответственны за развитие аутоиммунного заболевания [3]. Представляется важным то, что этот метод лечения эксплуатирует механизм иммунной памяти и поэтому подразумевает возможность генерации длительного иммунного ответа, направленного против патогенных лимфоцитов. В пилотных клинических исследованиях показано, что в ответ на иммунизацию аутологичными миелин-реактивнымими Т-клеточными клонами у больных рассеянным склерозом (PC) генерируются антиклонотипические CD8+ Т клетки, которые способны лизировать миелин-специфичные Т-лимфоциты [1, 2, 4, 6, 7]. Т-клеточная вакцинация также вызывает генерацию анти-клонотипических CD4+ Т клеток, которые в активированном состоянии продуцируют противовоспалительные цитокины IL-4 и IL-10 [1, 2, 4, 6, 7] и, таким образом, тормозят развитие демиелинизирующего процесса. Дополнительный вклад в инактивацию аутоиммунных Т-лимфоцитов могут вносить активируемые Т-клеточной вакцинацией антиэрготипические Т-клетки. Антиэриготипическая регуляция непосредственно не связана с идиотип-антиидиотипическим Т-клеточным взаимодействием и направлена на предотвращение чрезмерной суммарной активности Т-лимфоцитов. Т-клеточная вакцинация имеет очевидные преимущества перед другими методами лечения заболеваний, обусловленных патогенной функциональной активностью Т-лимфоцитов. Известные методы получения Т-клеточной вакцины (WO 99/13904 С2, 25.03.1999; ЕР 0722738 А2, 24.07.1996; 1998; WO 90/11294 A1, 04.10.1990; WO 94/25063 A1, 10.11.1994; WO 95/24217 A1, 14.09.1995; WO 92/12990 А2, 06.08.1992) основаны на постоянной или периодической стимуляции лимфоцитов антигеном (например, миелином), поэтому процесс наработки вакцинальных клеток довольно длительный и дорогостоящий. Улучшение технологии получения Т-клеточных вакцин востребовано медициной и призвано обеспечить значимый прогресс в лечении целого ряда заболеваний, стандартное лечение которых, практикуемое в настоящее время, малоэффективно. Сущность предлагаемого изобретения заключается в следующем: технология получения Т-клеточной вакцины состоит из двух последовательных этапов. Первый этап включает в себя культуральную антиген-специфическую селекцию Т-клеток больного, тогда как второй - их наращивание до необходимого количества посредством неспецифической стимуляции. На первом этапе выделенные из периферической крови мононуклеарные клетки (МНК) больного (например, рассеянным склерозом) культивируются в концентрации 2×106 в мл среде RPMI 1640, содержащей 10% инактивированной аутологичной плазмы, 5 мМ HEPES, 2 мМ L-глутамина, 5×10 -5 М меркаптоэтанола в присутствии антигена(ов) (например, 50 мкг/мл свиного миелина) в течение 5-7 дней во влажной атмосфере с 5% СО2. Затем антиген-реактивные бластные лимфоциты отделяются от других клеток посредством их центрифугирования на перколле (плотность 1.065 г/л). На втором этапе выделенные Т-клетки культивируются в присутствии неспецифических стимуляторов (например, 5 мкг/мл фитогемагглютинина (ФГА) плюс 100 ед/мл рекомбинантного интерлейкина - 2) в течение 5 дней. По завершении культивирования клетки инактивируются (например, облучением в дозе 2000 рад), далее криоконсервируются стандартным путем в плазме с 10% диметилсульфоксида (ДМСО) и хранятся в жидком азоте до момента использования. Общее количество полученных от одного больного клеток варьирует в пределах 18-27×108. Разработанная двухэтапная технология получения Т-вакцины имеет очевидные преимущества перед методами, которые были описаны ранее. В частности, она не требует длительного культивирования клеток в присутствии антигена. Уже через 5-7 дней после культивирования с антигеном активированные, бластные, антиген-специфические Т-лимфоциты отделяются от непрореагировавших клеток с помощью градиентного центрифугирования на перколле и далее наращиваются до необходимого количества посредством их высокоэффективной неспецифической стимуляции. Важно, что такое интенсивное наращивание антиген-специфических клеток не требует добавления в культуру антигена и занимает всего 5 дней. В целом процедура получения Т-клеточной вакцины в количестве, достаточном для проведения полноценного курса иммунотерапевтического лечения, занимает 10-12 дней. Получение аналогичных количеств вакцинальных клеток методами, основанными на постоянной или периодической стимуляции Т-лимфоцитов антигеном (например, миелином), требует намного большего времени (28 дней и более). Важным представляется также то, что под удар индуцируемого поликлональной Т-клеточной вакциной антиидиотипического иммунного ответа должны попадать в первую очередь антиген-реактивные клетки, имеющие доминантное представительство в вакцине и в наибольшей степени вовлеченные в развитие патологического процесса. Таким образом, разработанный способ получения Т-клеточной вакцины представляется наиболее эффективным и наименее дорогим, в сравнении с имеющимися аналогами. Сведения, подтверждающие возможность осуществления изобретения Сведения, подтверждающие возможность осуществления изобретения, представлены на примере вакцин, предназначенных для лечения рассеянного склероза, ревматоидного артрита, поллиноза, а также в экспериментах на животных, и изложены последовательно ниже. Разработанная нами двухэтапная технология была использована для получения Т-клеточной вакцины, предназначенной для лечения рассеянного склероза (PC). Поверхностные маркеры миелин-реактивных вакцинальных клеток определяли с помощью моноклональных антител (МА) LT3 (CD3), LT4 (CD4), LT8 (CDS), LKN 16 (CD 16) («Сорбент», Москва), конъюгированных с флюоресцеинизотиоцианатом, и МА ICO-180 (CD20) («МедБиоСпектр», Москва), CD45RO («Becton Dickinson», США), меченных фикоэритрином. Процент позитивных клеток определяли на иммуноцитометре «FACS Calibur» («Becton Dickinson») с использованием программы «CELLQuest» («Becton Dickinson»). Цитофлюориметрический маркерный анализ полученных лимфоидных популяций показал, что процентное содержание в них CD3+, CD4+, CD8+, CD16+, CD20+ клеток составляет 90-94%, 50-67%, 25-38%, 3-9% и 2-3% соответственно. Содержание в них CD4+CD45RO+ и CD8+CD45RO+ Т-клеток-памяти превышало не менее чем в 2 раза значения, исходно выявляемые в периферической крови больного. Специфичность вакцинальных Т-лимфоцитов оценивали по их антиген-индуцированному пролиферативному ответу. Для этого 105 миелин-реактивных Т клеток культивировали в течение 72 часов совместно с облученными (2000 рад) аутологичными МНК в присутствии 50 мкг/мл миелина или контрольного антигена (белок мышиной меланомы) в лунках 96-луночного круглодонного планшета (Costar, США). Клеточная пролиферация оценивалась стандарным методом по включению [3Н] тимидина. Согласно полученным данным пролиферативный ответ Т-лимфоцитов на миелин превышал контрольные значения не менее чем в 2 раза. Для оценки специфичности андиидитипического ответа 105 МНК, выделенных из периферической крови вакцинированных больных рассеянным склерозом, культивировали в течение 72 часов совместно с облученными вакцинальными Т-лимфоцитами (105) или с Т-клетками, специфичными к антигенам мышиной меланомы. Последние были получены по той же методике, что и миелин-реактивные Т-клетки. Было установлено, что после 4 вакцинаций пролиферативный ответ МНК больного на вакцинальные клетки в 6 раз превышал контрольные значения. Отсюда можно сделать вывод, что входящие в состав вакцины миелин-реактивные Т-лимфоциты экспрессируют на своей поверхности рецепторные идиотипические детерминанты в количестве, достаточном для индукции эффективного антиидиотипического иммунного ответа. Для получения антиидиотипической Т-клеточной линии МНК (2×10-6 мл) культивировали с облученными миелин-реактивными Т-клетками (106/мл). Через 7 дней в культуру вносили облученные аутологичные МНК и идиотип-несушие Т-лимфоциты и продолжали клеточное культивирование в присутствии рекомбинантного ИЛ-2 (100 ед/мл) еще 7 суток. Далее прокультивированные клетки облучали (2000 рад) и оценивали их супрессорную активность в пролиферативном тесте. Для этого 10 5 этих клеток культивировали в течение 72 ч совместно с аутологичными миелин-реактивными Т-клетками (105) и с облученными МНК (105) в присутствии миелина (50 мкг/мл). В результате было установлено, что антиидиотипические Т-клеточные линии, реактивные по отношению к миелин-специфичным Т-клеткам, способны на 49-52% избирательно подавлять пролиферацию последних. Таким образом, полученная вышеописанным способом Т-клеточная вакцина по своим поверхностным характеристикам, специфичности и способности индуцировать антиидиотипический иммунный ответ полностью удовлетворяет предъявляемым требованиям. Клинические исследования проводились в соответствии с протоколом, утвержденным Ученым советом и Этическим комитетом Института клинической иммунологии СО РАМН. От каждого пациента, участвующего в исследовании, было получено информированное согласие. Иммунотерапевтическое лечение было проведено 18 больным церебро-спинальной формой PC в возрасте от 26 до 50 лет с давностью заболевания не менее 2 лет. У 4 больных имело место ремиттирующее, у 3 - прогредиентно-ремиттирующее, у 2 - первично-прогредиентное и у 9 - вторично-прогредиентное течение заболевания. Диагноз был установлен клинически и подтвержден магнитно-резонансным исследованием. Пациенты не получали иммуносупрессивную терапию, по крайней мере, в течение 6 месяцев до начала лечения. Схема иммунотерапии включала в себя 4 еженедельных подкожных Т-клеточных вакцинации и поддерживающие введения вакцины с интервалом в 2 месяца. Вакцинальная доза варьировала в пределах 2.0-4.0×10 7 клеток. Неврологический статус пациентов оценивался по функциональной шкале Куртцке с использованием расширенной шкалы инвалидизации (EDSS). Кроме того, проводилось электромиографическое исследование с оценкой времени центрального моторного проведения «кора - С7» и «кора - S1» в ответ на магнитную стимуляцию. За время наблюдения (12 месяцев) у 2 из 4 больных с ремитирующим и у 2 из 3 с прогредиентно-ремиттирующим течением PC обострений заболевания зарегистрировано не было, их состояние, оцениваемое по шкале Куртцке, было стабильным. По данным электромиографического исследования у одного пациента из этой подгруппы отмечено значительное улучшение показателей центрального моторного проведения «кора - S1». У 2 пациентов с первично-прогредиентным течением заболевания состояние сохранялось стабильным на протяжении всего срока наблюдения. Только у 3 из 9 пациентов с вторично-прогредиентным течением заболевания имела место стабилизация клинических параметров, у остальных отмечено ухудшение в неврологическом статусе, связанное с прогрессией болезни. Ни одного случая осложнений применения Т-клеточной вакцинации зарегистрировано не было. Таким образом есть основания полагать, что Т-клеточная вакцинация может быть наиболее эффективна на ранних стадиях заболевания. Вместе с тем, не исключено, что более продолжительное и интенсивное иммунотерапевтическое лечение больных PC позволит получить ощутимые результаты в лечении вторично-прогредиентной формы заболевания. Двухэтапная технология была использована для получения Т-клеточной вакцины, предназначенной для лечения ревматоидного артрита (РА). Для получения такой вакцины МНК больного культивировали с коллагеновыми белками (10 нг/мл), полученными из суставных тканей человека (г.Москва), в течение 7 дней, после чего бластные лимфоциты отделяли от непрореагировавших клеток с помощью перколльного центрифугирования и далее наращивали их посредством неспецифической стимуляции. Полученные клетки имели поверхностные характеристики, сходные с характеристиками миелин-реактивных Т-клеток. А именно, процентное содержание в них CD3+, CD4+, CD8+, CD16+, CD20+ клеток составляло 93%, 62%, 30%, 5% и 2% соответственно. Содержание CD3+CD45RO+ Т-клеток памяти в 2 раза превысило исходный уровень, а содержание CD3+CD45RA+ активированных клеток в 1,2-1,3 раза. Пролиферативный ответ полученных вакцинальных клеток в присутствии коллагена превышал исходно регистрируемые значения в 2-3 раза. Анти-идиотипический пролиферативный ответ МНК больных РА, получивших 4 вакцинации в 2,4-3,7 раз, превышал контрольные показатели. В то же время пролиферативный ответ МНК вакцинированных больных на клетки, неспецифически активированные (ФГА, интерлейкином - 2) или активированные другими антигенами (меланома мыши), не претерпевал существенных изменений. Анти-идиотипические Т-клеточные линии подавляли антиген-индуцированную пролиферацию коллаген-специфических клеток на 40-53%. Иммунотерапевтическое лечение было проведено 12 больным РА в возрасте 30-69 лет с давностью заболевания не менее 5 лет. 10 больных получали базисную терапию, включающую метатрексат (не более 10 мг/нед). Схема иммунотерапии включала 4 еженедельных вакцинации с интервалом в 1 мес. Вакцинальная доза составляла 3.0-4.0×107 клеток. В процессе лечения у 3 из 12 пациентов отмечалась местная реакция на первое введение вакцины в виде очага гиперемии размером до 5 см в диаметре на месте инъекции. У 1 больной отмечалась общая реакция в виде повышения температуры тела. Все перечисленные явления были кратковременными и купировались самостоятельно. За время наблюдения (6 месяцев) у 8 из 12 больных отмечено улучшение клинических параметров, характеризующих тяжесть заболевания. Достоверно снизились суставной индекс, счет боли, индекс припухлости и время утренней скованности. У остальных больных клиническое состояние существенно не изменилось. Заметной динамики лабораторных показателей за этот период времени отмечено не было. Двухэтапная технология была использована для получения Т-клеточной вакцины, предназначенной для лечения такого аллергического заболевания, как поллиноз. МНК больных поллинозом культивировали с аллергеном (пыльца деревьев или пыльца сорных трав производства НИИ вакцин и сывороток, г.Ставрополь; конечная концентрация 100 PNU/мл) в течение 7 дней, после чего аллерген-активированные, бластные лимфоциты отделяли от непрореагировавших клеток с помощью перколльного центрифугирования и далее наращивали их посредством неспецифической стимуляции. Группа пролеченных пациентов состояла из 12 человек в возрастном диапазоне от 18 до 56 лет. Установлено, что после 4 еженедельных вакцинаций пролиферативный ответ МНК больного на вакцинальные клетки в 1,8-3 раза превышал контрольные значения. Поддерживающий курс лечения состоял из ежемесячных вакцинаций. В результате проведенного лечения отчетливый клинический эффект был достигнут у 7 из 12 пациентов. Двухэтапная технология была использована для предотвращения (торможения) иммунных процессов, направленных на отторжение донорских органов и тканей. В экспериментах показано, что вакцинация мышей C57BL6 (H-2b) активированными Т-клетками мышей (C57BL6×DBA)F1 (Н-2b/Н-2d) приводила к генерации супрессорных Т-лимфоцитов, ингибирующих более чем в 2 раза пролиферативный ответ интактных мышиных спленоцитов C57BL6 на аллоантигены DBA (H-2d). В целом, описанная технология получения Т-клеточной вакцины не ограничивается упомянутыми заболеваниями. Используя разные антигены для активации соответствующих антиген-реактивных клеток, можно получать Т-клеточные вакцины для лечения разных заболеваний, в основе которых лежат патологические антиген-индуцируемые иммунные процессы. Источники информации 1. Correale J., Lund В., McMillan M et al. Т cell vaccination in secondary progressive multiple sclerosis. // J.Neuroimmunol. - 2000. - V.107, №2. - P.130-139. 2. Hermans G., Medaer R., Raus J., Stinissen P. Myelin reactive Т cells after Т cell vaccination in multiple scvlerosis: cytokine profile and depletion by additional immunizations. // J.Neuroimmunol. - 2000. - V.102, №1. - P.79-84. 3. Мог F., Cohen I.R. Experimental aspects of Т cell vaccination. // Clin. Exp. Rheumatol. - 1993. - Suppl.8. - P.55-57. 4. Stinissen P., Zhang J., Medaer R., et al. Vaccination with autoreactive Т cell clones in multiple sclerosis: overeiew of immunological and clinical data. // J. of Neuroscience Research. - 1996. - V.45. - P.500-511. 5. Stinissen P. and Raus J. Autoreactive Т lymphocytes in multiple sclerosis: pathogenic role and therapeutic targeting. // Acta neurol. Belg. - 1999. - V.99. - P.65-69. 6. Zang Y.C.Q., Hong J., Tejada-Simon M.V. et al. Th 2 immune regulation induced by Т cell vaccination in patients with multiple sclerosis. // Eur. J.Immunol. - 2000. - V.30. - P.908-913. 7. Zhang J., Stinissen P., Medaer R., et al. Т cell vaccination: clinical application in autoimmune diseases. // J. Mol. Med. - 1996. - V.74. - P.653-662. ФОРМУЛА ИЗОБРЕТЕНИЯ1. Способ получения Т-клеточной вакцины, предназначенной для лечения иммунологического расстройства, отличающийся тем, что включает в себя два этапа: на первом этапе мононуклеарные клетки больного культивируют в присутствии антигена, выбранного из группы миелиновых белков, или белков коллагена, или аллергенов, или аллогенных клеток, после чего антиген-реактивные бластные Т-клетки отделяют от непрореагировавших клеток с помощью градиентного центрифугирования на переколле; на втором этапе выделенные Т-клетки наращивают посредством их неспецифической митогенной стимуляции, облучают, затем криоконсервируют. 2. Способ по п.1, отличающийся тем, что на первом этапе для культивирования с Т-клетками используют миелиновые белки, и такая вакцина применима для лечения рассеянного склероза. 3. Способ по п.1, отличающийся тем, что на первом этапе для культивирования с Т-клетками используют коллагеновые белки, и такая вакцина применима для лечения ревматоидного артрита. 4. Способ по п.1, отличающийся тем, что на первом этапе для культивирования с Т-клетками используют в качестве аллергена пыльцу растений, и такая вакцина применима для лечения аллергического заболевания, представленного поллинозом. 5. Способ по п.1, отличающийся тем, что на первом этапе для культивирования с Т-клетками используют аллогенные клетки, и такая вакцина применима для профилактики отторжения донорского органа или ткани. www.freepatent.ru Лечение аутоиммунных болезней собственными клеткамиT-лимфоциты являются дирижерами адаптивных иммунных реакций. Функциональная активность патогенных Т-лимфоцитов лежит в основе иммунологических расстройств. Аутореактивные Т-лимфоциты, атакующие ткани организма, индуцируют аутоиммунное воспаление. Высокая активность аллерген-реактивных Т-лимфоцитов приводит к развитию аллергических заболеваний. Развитию иммунологических расстройств способствуют сбои в иммунорегуляции, осуществляемой регуляторными Т-лимфоцитами. Вариабельные части Т-клеточных рецепторов (ТКР) формируются в постнатальный период. Это означает, что по отношению к ТКР не формируется врожденной иммунологической толерантности. Иммуногенная вариабельная часть антиген-реактивного ТКР называется идиотипом (рисунок 1). Вариабельная часть другого ТКР, способного распознать идиотипический пептид ТКР в комплексе с молекулой главного комплекса гистосовместимости (МНС), называется антиидиотипом.  Назначение антиидиотипических Т-клеток — регуляция функциональной активности идиотипических Т-клеток. Метод поликлональной Т-клеточной вакцинации нацелен на стимуляцию антиидиотипических и антиэрготипических иммунных реакций, избирательно направленных на инактивацию патогенных Т-лимфоцитов. 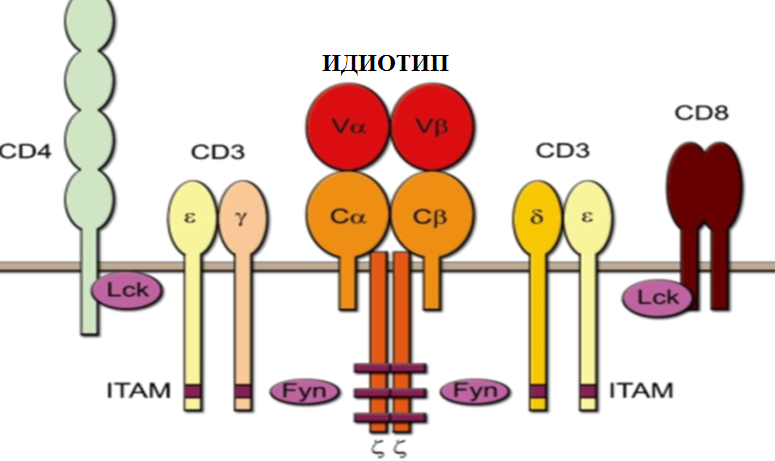 Рисунок 1. Схематичное изображение Т-клеточного рецептора. Иммунизация (идиотипическая «вакцинация») патогенными Т-клетками индуцирует антивоспалительный процесс, состоящий из 4 компонентов:
Как работает аутоиммунная Т-клеточная терапияМы берём у вас кровь и выделяем из неё Т-клетки, которые активируем и размножаем в лаборатории. На их основе изготавливается вакцина, которая инъектируется обратно в организм. Активированные Т-лимфоциты подавляют патогенные клетки, постепенно уменьшая симптомы и приводя к ремиссии. 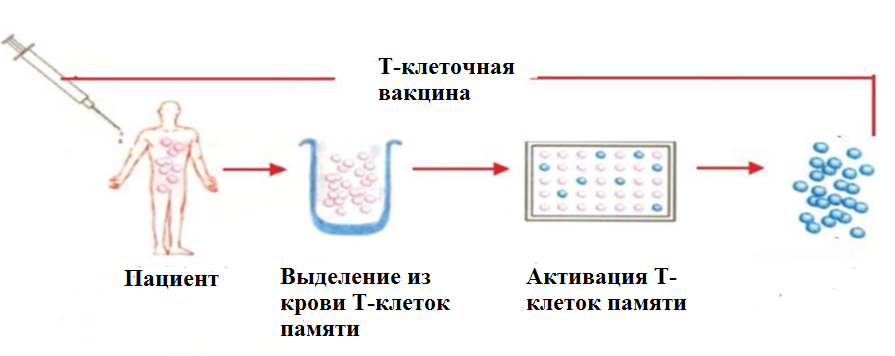 Получение индивидуальной поликлональной Т-клеточной вакцины 1 этап — выделение патогенных Т-лимфоцитов из крови. 2 этап — активация выделенных клеток с целью усиления их иммуногенных свойств. Оба этапа выполняются вне организма. Индуцирующий курс иммунотерапии состоит из 10 подкожных иммунизаций и обычно занимает 2 месяцев. Схема последующего лечения персонализируется в зависимости от течения заболевания. Лечение проводиться в амбулаторных условиях. Разработанная технология позволяет сохранить исходные пропорции патогенных Т-клеток. Это означает, что клетки, играющие наибольшую роль в развитии заболевания, будут вносит наиболее значимый вклад в индукции антиидиотипических иммунных реакций. Эффективность Т-клеточной аутоиммунотерапииРазработана технологии получения Т-клеточных вакцин, предназначенных для лечения болезни Бехтерева (анкилозирующий спондилоартрит), псориаза и аутоиммунных васкулитов. Ремиссия развивается в течение первых месяцев после начала лечения. Т-клеточная аутоиммунотерапия также эффективна в лечении полиантигенных аллергий, когда стандартная антиген-специфическая иммунотерапия (СИТ) не показана. Получены очень обнадеживающие данные при лечении аллергического ринита, аллергического конъюктивита, крапивницы, атопического дерматита. Рассматривается возможность использования метода в лечении бронхиальной астмы. Симптомы ослабляются у большинства пациентов в течение первых недель после начала лечения. Показана высокая клиническая эффективность Т-клеточной аутоиммунотерапии в лечении рассеянного склероза и ревматоидного артрита. Иммунные механизмы действия Т-клеточной иммунизации достаточно хорошо изучены (обзоры Селедцов и соавт., 2010; Huang et al.,2014). Преимущества Т-клеточной аутоиммунотерапии перед другими методами лечения иммунологических расстройств
Продолжительность курса — 2 месяца в зависимости от индивидуального ответа организма на иммунотерапию  Изготовление индивидуального препарата  7-10 подкожныхинъекций  Разработка схемы последующего лечения transplantation.ru Автор |
На главную Воспоминания Фотоальбом LDN терапия Рассеянный склероз(конспект врача) Что происходит при РС Дневник Новости медицины Форум Апитерапия Лекарства Врачи о лечении Аюрведа и РС SEX (помощь мужчинам) Полезные советы Советы "Бывалого" Книга Е. Майды Вопросы и ответы о РС Реабилитация Вопросы законодательства Поиск души |
Т-клеточная вакцинация Однако наш опыт показал, что использование технологий Экстракорпоральной гемокоррекции в лечении пациентов рассеянным склерозом, позволяя значительно более эффективно, чем традиционные медикаментозные методы лечения, купировать уже развившееся обострение заболевания, недостаточно эффективно в плане профилактики последующих обострений болезни. Вместе с тем в настоящее время разработаны принципиально новые методы лечения аутоиммунных заболеваний. Одним из таких высокоэффективных методов лечения – является метод Т-клеточной вакцинации. Суть метода Т-клеточной вакцинации заключается в индукции иммунных реакций, направленных против аутоиммунных Т-лимфоцитов, ответственных за развитие заболевания. То есть - использование Т-клеточной вакцины позволяет активизировать естественные механизмы контроля за аутоиммунными процессами и избирательно подавить патологические иммунные реакции. В Новосибирском НИИ Клинической Иммунологии разработана технология получения обогащенной популяции именно тех Т-клеток (Т-клеточной вакцины), которые ответственны за развитие аутоиммунного процесса и разрушение миелина, входящего в состав нервной ткани. Опыт применения Т-клеточной вакцины в Новосибирске, показал высокую эффективность данного метода лечения, особенно в плане профилактики обострений заболевания. Поскольку аутовакцинация запускает заложенные природой механизмы иммунологической памяти – ее влияние на иммунитет является непрерывным и долговременным. К настоящему времени в Новосибирском НИИ Клинической Иммунологии под наблюдением находятся десятки вакцинированных больных. У подавляющего большинства пациентов наблюдается стабилизация процесса, прекращаются обострения. Именно поэтому для эффективной профилактики последующих обострений болезни целесообразно использование метода Т-клеточной вакцинации. Этот метод является патогенетическим, не имеет противопоказаний и побочных эффектов. Однако, использование этого перспективного метода лечения для больных Рассеянным склерозом, проживающих в европейской части России, связано с вполне определенными трудностями. Многие их этих пациентов имеют в той или иной степени ограниченные возможности к передвижению. В связи с этим нами, с июня 2005 года начата работа по внедрению этого эффективного метода лечения в нашем Центре. Достигнуто соглашение, по которому Центр Экстракорпоральной гемокоррекции является клинической базой Новосибирского НИИ Клинической иммунологии в Москве и европейской части России. К настоящему времени решены все основные организационные вопросы, касающиеся проведения Т-клеточной вакцинации пациентов с Рассеянным склерозом и Ревматоидным артритом на базе нашего Центра. В конце сентября 2005 года нами начата вакцинация первой группы пациентов. Технически метод Т-клеточной вакцинации включает в себя следующие этапы: Забор крови пациента Наращивание аутоиммунных Т-лимфоцитов вне организма Иммунизация (вакцинация) аутоиммунными лимфоцитами пациента Специалистами Центра Экстракорпоральной гемокоррекции в настоящее время проводится 1-й и 3-й этапы, а также обеспечивается хранение Т-клеточной вакцины, изготовленной в Новосибирске. Жизнь идет. Идет потому, что есть надежда, без которой отчаяние убило бы жизнь.
НАЗАД | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
г.Самара, ул. Димитрова 131 [email protected] |
 |






