|
|
||||||||||
|
Взаимодействие антибиотиков и бактерий. Бактерии антибиотикиАнтибиотики и бактерии, что вызывает резистентность, как правильно пить детямАнтибиотики – это природные либо полусинтетические по своей природе вещества, которые угнетают рост чужеродных клеток. Чаще всего действие их направлено против простейших или прокариотов. По происхождению эти препараты могут быть на животных, микробных либо растительных экстрактах. Взаимодействие антибиотиков и бактерий может быть разнообразным. Одни препараты подавляют жизнь и активность определенной группы микробов, другие способствуют их гибели.
Антибиотики естественного происхождения, как правило, синтезируются актиномицетами, а также немицелиальными микроорганизмами. Часть антибактериальных препаратов значительно подавляет размножение и рост патологических микроорганизмов, практически не нарушая при этом целостность клеток и тканей макроорганизма. Именно по этой причине данные средства рекомендуют пить или вводить инъекционно в лечебных целях после установления бактериальной природы заболевания. Некоторое количество антибиотиков обладает противоопухолевым (цитостатическим) действием и применяется в лечении онкологических заболеваний. Однако на вирусы данная группа препаратов не воздействует, поэтому их применение для лечения против вирусов бесполезно. Но существуют данные, что некоторые группы антибиотиков (например, тетрациклины) способны оказывать эффект на вирусы наиболее крупных размеров. Виды и особенностиМножество видов антибактериальных препаратов стало причиной создания системы классифицирования их на группы. В зависимости от того, какое действие проявляет препарат после взаимодействия с бактериальной клеткой, различают две основных группы препаратов:
Согласно химическому составу в медицине широко применяется следующая классификация:
Механизм действияДействие антибиотиков не ограничивается антибактериальным эффектом при наружном применении, как у антисептиков. Антибиотиками эффективно лечат и вылечивают заболевание при правильном их системном использовании (таблетки, инъекционные формы, суппозитории).
Действие антибиотиков может протекать по различным механизмам влияния на бактериальную клетку:
Чем опасно неправильное использование антибиотиков?Антибиотики и бактерии – два взаимоисключающих понятия. Однако, если неправильно пить или вводить препараты, можно получить серьезные последствия, такие как резистентность. Под термином резистентность в медицине понимают устойчивость бактериальных клеток к антибактериальным препаратам определенной группы. Резистентность к препаратам у бактерий появляется спонтанно. Вызывает такую устойчивость мутация, которая под действием лекарственного средства укореняется в популяции. Препарат не вызывает резистентность, но стимулирует ее укрепление, а устойчивые штаммы распространяются. Резистентность может формироваться по разным механизмам и причинам:
Однако главной проблемой является даже не устойчивость бактериальной клетки к одному из групп антибиотиков, а ее резистентность к нескольким группам антибиотиков (мультирезистентность). Ведь чем более устойчивы микробы к различным препаратам, тем меньше медикаментозных средств остается для устранения заболевания. Одним из наиболее ярких примеров бактерий, которые имеют высокую устойчивость к ряду антибиотиков, является хеликобактер пилори (Helicobacter pylori).
Типичный представитель резистентных штаммовХеликобактер пилори является представителем тех бактерий, устойчивость которых к различным группам антибиотиков значительно затрудняет лечение. Учитывая широкую резистентность хеликобактер пилори, терапия включает несколько антибиотиков. Если пациент когда-то принимал назначенный врачом антибиотик, то лечение будет неэффективным, так как на него у хеликобактер уже выработалась устойчивость. Кроме того, все чаще встречается развитие дисбактериоза на фоне приема этих лекарств, так как они также убивают полезные бактерии в организме человека. Наблюдаются в отдельных случаях борьбы против хеликобактер и аллергические реакции на различные компоненты, входящие в лечение. Для максимально эффективного лечения патологий пищеварительной системы, вызванных хеликобактер, нужно использовать антибиотики специфического действия. Такие медикаменты должны обладать не только высокой эффективностью против хеликобактер, но и проявлять устойчивость к агрессивной среде желудка, быть способными проникнуть под слизь желудка для направленного действия против хеликобактер. Действие таких медикаментозных средств против хеликобактер должно быть локальным, и выводиться в кратчайшие сроки из организма после воздействия на микроб. Только полное уничтожение хеликобактер гарантирует полное излечение больного.
О чем говорит наличие бактерий в общем анализе мочиВыявление бактерий в моче является одним из наиболее распространенных первоочередных диагностических мероприятий. Важно не только обнаружение микробов в моче, но и их количество. Титр бактерий до 10 в четвертой степени на 1 мл в моче считается нормой. В моче мочевого пузыря бактерий нет, однако после ее протекания по всем мочевыводящим путям она значительно загрязняется ими. На количестве бактерий в моче отражается и время транспортировки, хранения. Поэтому бактерии в моче являются диагностически значимым критерием только после дополнительного лабораторного подтверждения. Правила безопасного использования антибиотиков в детском возрасте
Итак, не стоит заниматься самолечением, ведь далеко не всегда можно правильно определить свое заболевание самостоятельно, даже если анализ обнаружил бактерии в моче. Только специалист способен правильно установить диагноз и определить, какие препараты необходимо применить в лечении каждого отдельного случая. Множество патологий имеют общие симптомы, однако их лечение может кардинально отличаться. Не стоит сразу пить антибиотики, ведь причиной патологии могут оказаться вирусы, а не бактерии. Только внимательное отношение к своему здоровью и здоровью своих детей спасет от неприятных и опасных осложнений (резистентность), которые могут возникнуть, если лечение назначено неправильно. probakterii.ru Антибиотики и бактерии: гонка вооруженийКак отмечает Всемирная организация здравоохранения, устойчивость болезнетворных бактерий к антибиотикам приобретает в мире все более угрожающие масштабы. Исходя из пессимистических прогнозов, через 20 лет человечество может оказаться бессильно перед бактериальными инфекциями. На конференции "Нано-биотехнологии в перспективных космических экспериментах" (2012 год) Евгений Куликов из института микробиологии имени С. Н. Виноградского РАН отметил, что если в 1945–65 годы наблюдались только первые случаи антибиотикоустойчивости бактерий, а в 70-80-е годы резкого прироста устойчивости к патогенам не происходило, то с начала 90-х резистентных к антибиотикам штаммов становится все больше. В связи с увеличивающимися сроками выздоровления растут и затраты на восстановление пациентов. Приведенные в докладе Куликова данные по ЕС, Исландии и Норвегии (статистики по России нет) свидетельствуют о том, что каждый год дополнительно требуется 900 миллионов евро, чтобы справляться с больничными инфекциями, и еще 600 миллионов евро, чтобы оплачивать связанную с этим нетрудоспособность населения. В докладе ВОЗ, посвященном мутациям болезнетворных бактерий, тоже высказывается серьезная озабоченность: "Миру грозит постантибиотическая эра, когда люди будут снова умирать от травм, потому что многие инфекции окажутся непобедимыми". Доктор Кейи Фукуда, один из директоров ВОЗ по безопасности здоровья, считает, что эффективные антибиотики были одним из китов, на котором зиждилась уверенность общества в гарантированном здоровье и продолжительности жизни. Однако сейчас эта уверенность поколебалась. И связано это во многом с тем, что само лечение пациента в стационаре может обернуться заражением множественноустойчивыми патогенами: больной "подцепляет" внутрибольничные штаммы. А они всегда присутствуют там, где используются антибиотики, причем чем больше применяется антибиотиков, тем "вооруженнее" против них становятся микробы. В чем же причина гонки вооружений между антибиотиками и патогенами? Напомним, что антибиотики (от древне-греческого "анти" – против, "биос" – жизнь) – лекарственные препараты для лечения инфекционных заболеваний, обладающие высокой биологической активностью по отношению к определенным группам микроорганизмов и злокачественным опухолям. Все они природного происхождения (получаются из грибов, микробов, растений, живых тканей, а также их модификации) и способны уничтожать болезнетворные бактерии, останавливать их рост и размножение (к слову, болезнетворные составляют только примерно 1 процент от всех существующих в мире бактерий). Увеличенное под микроскопом изображение кишечных бактерийВ далеком 1884 году датский ученый Грам предложил свой метод исследования бактерий, который используется до сих пор. Для окрашивания клеточной мембраны стенки бактерии используется специальный анилиновый краситель и раствор йода для фиксации цвета. Бактерии, которые после промывания прочно окрашивались, получили название грамположительных, а те, что обесцвечивались, – грамотрицательных. Патогены в зависимости от формы делятся на кокки (круглые), палочки и извитые. Например, есть грамположительные кокки: стафилококки (гноеродные), стрептококки (вызывают воспалительные гнойные процессы у человека и животных). Грамотрицательные кокки: менингококки (возбудители менингита), гонококки (возбудители гонореи), пневмококки (возбудители пневмонии). Извитые патогены (например, спирохеты, спириллы) грамотрицательны, как скажем, возбудитель сифилиса – закрученные спиралевидные бактерии (бледная трепонема). Палочки являются возбудителями сибирской язвы, дифтерии, туберкулеза и других болезней. В свою очередь антибиотики бывают узкого спектра действия (только против грамположительных или грамотрицательных бактерий) или широкого (воздействуют и на те, и на другие). Важнейшие классы антибиотиков терапевтического назначения: b-лактамные (пенициллины, цефалоспорины – действуют на грамположительные и грамотрицательные бактерии), амино-гликозидные (стрептомицин, амикацин, гентамицин – в основном на грамотрицательные бактерии), тетрациклины (на грамположительные и грамотрицательные, хламидии, простейшие), макролиды (антибактериальные и противогрибковые – на грамположительные, грибы, некоторые простейшие), полипептидные и депсипептидные (полимиксины, ацитрацины – в основном грамотрицательные бактерии). Молекула пенициллинаВсе эти знания стали доступны человечеству после 1928 года, когда британский микробиолог Александр Флеминг, можно сказать, случайно открыл пенициллин. Ученый уже тогда предположил, что появление чудесного антибактериального оружия может вызвать симметричный ответ: микробы найдут возможности приспособиться к антибиотикам. Так оно с течением времени и оказалось. Например, там, где перестали действовать пенициллины (при лечении ангины, скарлатины, раневых, некоторых венерических инфекций), пришлось применять цефалоспорины, принадлежащие, как и пенициллины, к так называемой бета-лактамной группе антибиотиков. Цефалоспорины первого поколения стали применяться для лечения дыхательных путей, мочевыделительной системы, постоперационных осложнений. Затем появились цефалоспорины второго поколения (лечение кишечных инфекций) а потом, как следствие "гонки вооружений", и третьего поколения – их используют в тех случаях, когда препараты первых двух поколений бессильны из- за бактериальной устойчивости. В конце 80-х годов появились еще одна подгруппа бета-лактамной группы антибиотиков широкого спектра – карбапанемы, которые помогают лечить госпитальные осложнения вроде пневмонии, инфекции кровотока, мочеполовых путей, сепсиса новорожденных, инфекции пациентов отделения интенсивной терапии. Изначально карбапанемы были мощнейшим оружием – они помогали в 100 процентах случаев. Но это продлилось недолго: сейчас в некоторых странах около половины пациентов оказались невосприимчивы к этим лекарствам. В частности, карбапанемы оказались бессильны против супербактерии, синтезирующей высокотоксичный фермент NDM1, резистентный практически всем бета-лактамным препаратам. Эта бактерия-монстр была обнаружена несколько лет назад у британских пациентов, вернувшихся из Индии и Пакистана после косметической хирургии. И это лишь небольшая часть истории противостояния антибиотиков и патогенов, длящегося уже несколько десятков лет. Традиционно резистентность к антибиотикам связанна в первую очередь с так называемыми больничными инфекциями. Больничные палаты – особая среда, где война между лекарствами и бактериями идет особенно жарко, что дает последним возможности для ускоренной эволюции. Однако в последние годы поле битвы расширяется. Андрей Летаров, заведующий лабораторией вирусов микроорганизмов института микробиологии имени С. Н. Виноградского РАН, в беседе с корреспондентом Радио Свобода напоминает, что "еще несколько лет назад, когда мы говорили о резистентности к антибиотикам, упоминали только больничные инфекции. Однако устойчивость проявляется и у "домашних" пациентов. Если раньше резистентность была маргинальной и проявлялась в нескольких процентах случаев, то ныне процент устойчивости может достигать и 80". Это сказывается и на медицинской практике. Когда терапевт прописывает от пневмонии домашнему больному макролидный антибиотик (дается тем, у кого аллергия на пенициллины и цефаллоспорины), то его действие обязательно контролируется через 2-3 дня. Если такой антибиотик оказался неэффективен, его меняют на другой. В особо сложных случаях комбинируют несколько разных препаратов, то есть метод проб и ошибок становится реальностью. Дизинфекция школьного класса от стафилококков, ГрузияРезистентность к антибиотикам научились вырабатывать самые разные инфекции. Например, в докладе ВОЗ отмечается, что широко распространенная инфекция кишечной палочки, которая традиционно лечилась фторхинолонами, антибиотиками широкого спектра действия, ныне тоже демонстрирует устойчивость. Неэффективность лечения гонореи третьим поколением цефалоспоринов была подтверждена в Австрии, Австралии, Канаде, Франции, Японии, Норвегии, Словении, Южной Африке, Швеции и Великобритании. В некоторых источниках отмечается, что до 60 процентов стафилокковых инфекций, вызывающих гнойно-воспалительные очаги и интоксикацию, в Европе метицилин-устойчивы (MRSA). У пациентов с MRSA (метициллин-устойчивым золотистым стафилококком), на 64 процента больше риск умереть, чем у тех, кто восприимчив к антибиотикам. В США около 2 миллионов человек страдают от патогенных бактерий, резистентных антибиотикам, а 23 тысячи умирают ежегодно от инфекций, так как мультибактериальные препараты помочь не в состоянии. Ситуация в развивающихся странах выглядит еще более серьезно. В Африканском регионе просматривается значительная невосприимчивость кишечной палочки к цефалоспоринам и фторхинолонам последнего поколения. В некоторых зонах этого региона 80 процентов случаев золотистого стафилококка – MRSA. В Юго-Восточной Азии, где живет одна четвертая населения земного шара, отмечается высокая резистентность кишечной палочки и клебсиеллы пневмонии к цефалоспоринам и фторхинолонам третьего поколения. В Тихоокенском регионе резистентны к антибиотикам до 80 процентов этих инфекций. И это лишь некоторые примеры, касающихся далеко не всех патогенных микроорганизмов. С появлением антибиотиков у людей изменилось мироощущение: мы научились контролировать бактериальные инфекции, вытеснили смерть из жизни. Уколоться в саду и от этого умереть стало больше невозможно Андрей Летаров говорит о сложившейся ситуации как о кризисе нашей общей уверенности в безопасности здоровья. Все привыкли думать, что непобедимых инфекций нет. "С появлением антибиотиков у людей изменилось мироощущение: мы научились контролировать бактериальные инфекции, вытеснили смерть из жизни. Уколоться в саду и от этого умереть стало больше невозможно". Теперь от этого мироощущения приходится отказываться. По оценке Летарова, в России ситуация с устойчивостью к антибиотикам ничем принципиально не отличается от остального мира: за последние несколько лет резистентность возросла от отдельных случаев до десятков процентов случаев заболеваний. Более того, в России опять появился туберкулез, успешно побежденный в советские годы. И произошло это не только потому, что системная профилактика, принятая в советское время, перестала работать, но и в силу возникновения устойчивых к антибиотикам штаммов. Почему вырабатывается устойчивость Андрей Летаров отмечает, что, с одной стороны, далеко не всегда антибиотики правильно применяются при лечении. Зачастую предписанный врачом курс пациенты выдерживают не до конца – бросают пить лекарства, как только наступит улучшение, а между тем не все микробы в организме успевают погибнуть и дают о себе знать через какое-то время – инфекция возвращается снова и требует повторного курса, а затем, возможно, и становится хронической. Это дает патогенам возможность научиться лучше противостоять антибиотикам. Дезинфицирующие средства в больницах тоже "учат" микробы приспосабливаться: мутации в ДНК бактерий позволяют противостоять лекарствам, и эволюционировавшие бактерии-мутанты становятся все более опасными для пациентов стационаров. Есть и другой существенный источник устойчивых бактерий: в сельском хозяйстве (животноводстве, птицеводстве) антибиотики часто используются практически бесконтрольно. Ими же могут быть обработаны растительные продукты, особенно если их транспортируют с континента на континент и необходимо увеличить сроки хранения. В итоге продукты, содержащие антибиотики, попадают на стол. Сами того не ведая, мы становимся пассивными потребителями этих лекарств, пусть и в минимальных дозах. Никто не знает, каким будет кумулятивный накопительный эффект для человека, получающего регулярно, такие казалось бы, незначительные дозы. Вспомним еще о быстрорастущем населении Земли (сегодня оно составляет более 7 миллиардов человек) и глобальном характере международной миграции – очевидно, что у бактерий появилось больше возможностей обмениваться информацией и в ходе генетического переноса производить все более неуязвимые штаммы. Профессор химической биологии Ричард Ли из St. Jude Children's Research Hospital в Мемфисе, открывший в 2014 году полусинтетический антибиотик спектинамидес, рассказал в интервью Радио Свобода, что источник возрастающей устойчивости к антибиотикам – страны третьего мира, где низкий уровень здравоохранения: "Очевидно, что за 70 с лишним лет использования антибиотиков бактерии сумели приспособиться практически ко всем противомикробным средствам. Однако пока в мире будут оставаться такие бедные страны, как, скажем, Индия, где многие местные жители покупают на рынке горсть таблеток и принимают их все сразу (там так решается проблема бактериальных инфекций), большого порядка в употреблении антибиотиков мы не наведем". Кто-то, путешествуя по Индии, обращается к врачу или попадает в госпиталь с диареей, а потом возвращается в Европу или в США, "обогащенный" бактериями-мутантами Ричард Ли рассказал о выявленном в 2008 году гене, кодирующем им фермент Нью-Дели NDM-1 (металло-бета-лактамаза-1) – это один из многих белков, которые блокируют действие карбапанемов. Этот ген распространяется от одного штамма к другому в ходе горизонтального переноса и воспроизводит бактерии-монстры. Фактически это может выглядеть так: кто-то, путешествуя по Индии, обращается к врачу или попадает в госпиталь с диареей, а потом возвращается в Европу или в США, "обогащенный" бактериями-мутантами. Заболевание может возобновиться, и такой пациент вполне может попасть теперь уже в госпиталь на родине, распространяя опасные вариации патогенов еще дальше. Борьба Как бороться с изменчивыми патогенами? Самый очевидный путь – разработка новых, более совершенных антибиотиков. Этот процесс выглядит примерно так. Естественные продуценты антибиотиков – актиномицеты, плесневые грибы, бактерии. Главное место их обитания – почва. Так, чтобы выделить микроорганизмы, образующие антибиотики, берутся пробы почвы, их высушивают и делают высевы на специальные питательные среды. Сегодня испытываются новые продуценты, например, миксобактерии, производящие большое количество противомикробных агентов. Растения, животные и даже микробы исследуются в качестве возможных продуцентов новых антимикробных препаратов. Возможно, новые антимикробные ресурсы скрывают и океанские глубины. Пути получения новых антибиотиков – это мутагенез (искусственное получение мутаций с помощью мутагенов), клеточная и генная инженерия. Мутагенез происходит в ходе использования мутантных штаммов, у которых блокирован синтез отдельных фрагментов молекулы антибиотика. Клеточная инженерия помогает получать гибридные антибиотики, например, с новыми комбинациями агликона и сахаров. Генетическая инженерия позволяет вводить в геном микроорганизма информацию о ферменте, необходимом для модификации продуицируемого антибиотика. Роберт Кох, немецкий ученый, открывший бактерию, вызывающую туберкулезПримером разработки нового лекарства с использованием этих сложных технологий является спектинамидес – лекарство против туберкулеза (ТБ). Это инфекционное заболевание вызывается микобактерией (Mtb), распространяется по воздуху и обычно поражает легкие, что становится ежегодно причиной смерти 1,3 миллиона человек. ТБ лечится антибиотиками, но в последнее время мультирезистентная (MDR) бактерия ТБ существенно затруднила лечение. С ней приходится бороться в течение 2 лет, используя различную комбинации антибиотиков, которые весьма токсичны. Подобная терапия может иметь серьезный побочный эффект (например, гепато- или нефротоксические реакции). Помимо мультирезистентной бактерии появилась и микобактерия с продленным эффектом резистентности (XTB), отмеченная в 92 странах: некоторые штаммы ХТВ устойчивы ко всем видам лекарств. В течение шести лет над этой проблемой работал интернациональный коллектив ученых под руководством Ричарда Ли. В итоге ученые доказали на мышах эффективность нового лекарства спектинамидес для лечения туберкулеза с минимальным побочным эффектом. Изначально ученые использовали препарат для лечения гонорейных инфекций – спектиномицин, который блокирует рибосомы патогенных бактерий, и тем самым останавливает их рост. Исследователи проанализировали структуру антибиотика и испробовали различные модификации, чтобы получить новый класс. Этот полусинтетический антибиотик имеет высокую активность против обеих – MDR и XTB – и не "выталкивается" из ТБ-бактерий, что делает лекарство более эффективным. "Исследование показывает, как классические антибиотические вещества, полученные из натуральных продуктов, могут быть подвержены редизайну, целью которого становится создание мощных полусинтетических соединений. Именно они способны преодолеть механизмы лекарственной резистентности", – прокомментировал исследование Ли. Теперь новое лекарство проходит клинические испытания. Андрей Летаров считает, что альтернативой разработке новых антибиотиков может стать фаговая терапия: лечение бактериальных инфекций с помощью вирусов, которые эти бактерии поражают. Первый опыт фаговой терапии был осуществлен даже раньше появления первых сульфаниламидных препаратов: французский ученый Феликс Д’ Эрель лечил таким образом в начале XX века дизентерию, холеру в Индии и даже несколько случаев чумы. Возвращение интереса к фаговой терапии произошло в конце 80-х годов, как раз одновременно с проявлением устойчивости некоторых микробов к антибиотикам. Механизм действия заключается в том, что фаг проникает сквозь стенку бактерии, прокалывая ее специальной белковой иголкой, которая потом "разбирается", хвост фага достигает внутренней мембраны бактериальной клетки и закачивает туда ДНК. Бактериофаги размножаются внутри бактерий и вызывают их лизис (растворение). Микробы зачастую окружают себя защитной пленкой, непроницаемой для антибиотиков: фагам же такая пленка – не помеха. Фаговые лизины (фаги производят особый фермент, который разрушает клеточную оболочку бактерий) могут использоваться в качестве самостоятельных антибактериальных препаратов: особенно хорошо они справляются с грамположительными бактериями. Порой фаговые препараты оказываются даже более эффективными, чем антибиотики (например, в ситуациях труднодоступной локализации бактерий), ими лечат стафилококковые инфекции (гнойно-воспалительные заболевания дыхательных путей), в том числе и метицилин-резистентные стафилококки, инфекции, вызываемые кишечной палочкой, и другие болезни. Однако успешное применение фагов в больших масштабах – более сложная задача, чем использование антибиотиков, поскольку последние имеют более широкий спектр действия. Кроме того, создание современной фаговой терапии требует намного более глубокой исследовательской подготовки, существует и проблема безопасности фаговых препаратов – высокая степень очистки делает эти препараты очень дорогими. Польза от фаговой терапии очевидна, но пока неясно, может ли подобное лечение широко использоваться на практике Ричард Ли считает, что будущее за комбинацией различных терапий, одной из которых вполне может стать фаговая: "Польза от фаговой терапии очевидна, но пока неясно, может ли подобное лечение широко использоваться на практике. Бактерии и фаги сосуществуют миллионы лет, но мы пока не знаем, как на этом симбиозе скажется развитие фаговой терапии". Экономический тормоз В США в 1980–84 годах появилось около 18 новых антибиотиков, 10 лет спустя – около 12, в начале нового столетия – 4 и, наконец, в 2010–2014 – только один Андрей Летаров отмечает, что создание нового лекарства от лаборатории до рынка – процесс долгий и затратный. К тому же классы антибиотиков, получаемых из легко воспроизводимых продуцентов, похоже, оказались исчерпаны. Разработки нового антибиотика ведутся научными коллективами годами, и вернуть вложенные средства весьма проблематично. Так, Британское фармацевтическое сообщество отмечает, что доведение нового лекарства от момента изобретения до рынка занимает в среднем 12 лет и обходится в сумму от 50 миллионов фунтов до миллиарда. Проблема не только в высокой стоимости и времени, но и в технической сложности подобных разработок. По данным Европейского медицинского агентства, в лабораториях рассматривались около 90 новых антибактериальных агентов, но ни один из них не проявил себя как принципиально новый механизм действия. А американское агентство FDA (Food and Drug Administration) отмечает, что из 61 антибиотика, рекомендованного к производству с 1980 по 2009 год, 43 процента затем были сняты с продажи из-за серьезных побочных эффектов. При этом показатель снятия с продажи других лекарств – не антибиотиков – всего 13 процентов. Голая статистика показывает, как мы проигрываем гонку вооружений с бактериями: в США в 1980–84 годах появилось около 18 новых антибиотиков, 10 лет спустя – около 12, в начале нового столетия – 4 и, наконец, в 2010–2014 – только один. Эти данные безусловно коррелируют с финансовыми показателями: за последние пять лет антибиотики продемонстрировали средний годовой прирост на 4 процента в сравнении с 16,7 и 16,4 процентами соответственно на антивирусные лекарства и вакцины. Хотя антибиотики остаются на третьем месте по прибыльности для фармацевтических компаний после препаратов для центральной нервной и кардио-васкулярной систем, в 2003 году лучше всего продаваемый антибиотик заработал 2,01 миллиарда долларов, а липид, производимый той же компанией, – 9,2 миллиарда (данные Комитета по науке и технологиям Великобритании). Гораздо более рентабельным для фармакологических компаний становится производство тех лекарств, которые пациенты принимают постоянно или достаточно долгое время: например, препаратов, снижающих артериальное давление, уровень холестерола, противораковых препаратов, антидепрессантов. За противораковую терапию пациенты платят сотню тысяч долларов. Курс антибиотиков будет стоить максимально 4-5 тысяч долларов "За антираковую терапию, которая длится три месяца, пациенты платят сотню тысяч долларов. Курс антибиотиков в среднем принимается неделю-две, и лечение в стационаре будет стоить максимально 4-5 тысяч долларов, – отмечает Ричард Ли. – В обоих случаях пациентам спасают жизнь – сомнений нет. Однако фармакомпании будут заниматься разработкой более дорогих лекарств". Сейчас правительства разных стран обсуждают меры, которые могли бы повысить мотивацию фармацевтических компаний к разработке новых антибиотиков. Это могут быть налоговые скидки или, например, закрепление за производителем эксклюзивных прав на продажу нового лекарства и его аналогов в течение пяти лет. В США и Великобритании предполагается ввести финансовые рычаги, которые помогут уменьшить употребление антибиотиков в немедицинских целях (например, высокие штрафы или заградительные налоги в животноводстве). ВОЗ разрабатывает собственный план спасения человечества от бактериальных инфекций, который будет озвучен на 68-й ассамблее в мае 2015 года. В нем также будет содержаться призыв к правительствам найти экономические рычаги, стимулирующие исследования в области устойчивости к антибиотикам, увеличить инвестиции в диагностические средства, новые лекарства и вакцины. Приказано: выжить Что же в сухом остатке? Вот мнение Андрея Летарова: "До жизни, из которой будут полностью вытеснены антибиотики, человечеству еще далеко. Так что я бы не стал сгущать краски. А пока посоветовал бы "маленькие хитрости" – как можно меньше использовать антибиотики в повседневной жизни, беречь себя, лечиться вовремя". Ричард Ли считает, что нужно уделять еще больше внимания профилактике: "Поскольку проблема устойчивости к антибиотикам становится общемировой, лучший способ обезопасить себя от бактериальной и вирусной инфекции – это глобальная профилактика. Мы все сейчас тесно связаны, поэтому стоило бы продумать общемировую стратегию. По моим прогнозам, с учетом глобализации резистентность к антибиотикам в будущем будет иметь еще более серьезный экономический эффект. Бактерии существуют уже миллиарды лет, они научились мутировать, и чем лучше мы "вооружаемся", тем крепче становится их "броня". www.svoboda.org Бактерии могут победить антибиотики :: Частный КорреспондентНовостиForbes назвал 50 лучших финтех-проектов 2018 года Американский журнал Forbes в третий раз представил список из 50 лучших компаний мира 2018 года, работающих в сфере финансовых технологий. Примечательно, что более 20% (11 штук из 50) в списке заняли проекты, связанные с блокчейном и криптовалютами.
МненияНиколай ПодосокорскийВиртуальная дружбаТенденции коммуникации в Facebook Дружба в фейсбуке – вещь относительная. Вчера человек тебе писал, что восторгается тобой и твоей «сетевой деятельностью» (не спрашивайте меня, что это такое), а сегодня пишет, что ты ватник, мерзавец, «расчехлился» и вообще «с тобой все ясно» (стоит тебе написать то, что ты реально думаешь про Крым, Украину, США или Запад). Марат ГельманПособие по материализму«О чем я думаю? Пытаюсь взрастить в себе материалиста. Но не получается» Сегодня на пляж высыпало много людей. С точки зрения материалиста-исследователя, это было какое-то количество двуногих тел, предположим, тридцать мужчин и тридцать женщин. Высоких было больше, чем низких. Худых — больше, чем толстых. Блондинок мало. Половина — после пятидесяти, по восьмой части стариков и детей. Четверть — молодежь. Пытливый ученый, быть может, мог бы узнать объем мозга каждого из нас, цвет глаз, взял бы сорок анализов крови и как-то разделил бы всех по каким-то признакам. И даже сделал бы каждому за тысячу баксов генетический анализ. Дмитрий Волошин, facebook.com/DAVoloshinТеория самоневерияО том, почему мы боимся реальных действий Мы живем в интересное время. Время открытых дискуссий, быстрых перемещений и медленных действий. Кажется, что все есть для принятия решений. Информация, много структурированной информации, масса, и средства ее анализа. Среда, открытая полемичная среда, наработанный навык высказывать свое мнение. Люди, много толковых людей, честных и деятельных, мечтающих изменить хоть что-то, мыслящих категориями целей, уходящих за пределы жизни. facebook.com/ivan.usachevНемая любовь«Мы познакомились после концерта. Я закончил работу поздно, за полночь, оборудование собирал, вышел, смотрю, сидит на улице, одинокая такая. Я её узнал — видел на сцене. Я к ней подошёл, начал разговаривать, а она мне "ыыы". Потом блокнот достала, написала своё имя, и добавила, что ехать ей некуда, с парнем поссорилась, а родители в другом городе. Ну, я её и пригласил к себе. На тот момент жена уже съехала. Так и живём вместе полгода». Михаил ЭпштейнСимпсихоз. Душа - госпожа и рабыняПрироде известно такое явление, как симбиоз - совместное существование организмов разных видов, их биологическая взаимозависимость. Это явление во многом остается загадкой для науки, хотя было обнаружено швейцарским ученым С. Швенденером еще в 1877 г. при изучении лишайников, которые, как выяснилось, представляют собой комплексные организмы, состоящие из водоросли и гриба. Такая же сила нерасторжимости может действовать и между людьми - на психическом, а не биологическом уровне. Лев СимкинЧеловек из наградного листаНа сайте «Подвиг народа» висят наградные листы на Симкина Семена Исааковича. Моего отца. Он сам их не так давно увидел впервые. Все четыре. Последний, 1985 года, не в счет, тогда Черненко наградил всех ветеранов орденами Отечественной войны. А остальные, те, что датированы сорок третьим, сорок четвертым и сорок пятым годами, выслушал с большим интересом. Выслушал, потому что самому читать ему трудновато, шрифт мелковат. Все же девяносто.
КалендарьОлег ДавыдовКолесо ЕкатериныТок страданий, текущий сквозь время 7 декабря православная церковь отмечает день памяти великомученицы Екатерины Александрийской. Эта святая считалась на Руси покровительницей свадеб и беременных женщин. В её день девушки гадали о суженом, а парни устраивали гонки на санках (и потому Екатерину называли Санницей). В общем, это был один из самых весёлых праздников в году. Однако в истории Екатерины нет ничего весёлого. Ив ФэрбенксНельсон Мандела, 1918-20135 декабря 2013 года в Йоханнесбурге в возрасте 95 лет скончался Нельсон Мандела. Когда он болел, Ив Фэрбенкс написала эту статью о его жизни и наследии Достижения Нельсона Ролилахлы Манделы, первого избранного демократическим путем президента Южной Африки, поставили его в один ряд с такими людьми, как Джордж Вашингтон и Авраам Линкольн, и ввели в пантеон редких личностей, которые своей глубокой проницательностью и четким видением будущего преобразовывали целые страны. Брошенный на 27 лет за решетку белым меньшинством ЮАР, Мандела в 1990 году вышел из заточения, готовый простить своих угнетателей и применить свою власть не для мщения, а для создания новой страны, основанной на расовом примирении. Молот ведьм. Существует ли колдовство?5 декабря 1484 года началась охота на ведьм 5 декабря 1484 года была издана знаменитая «ведовская булла» папы Иннокентия VIII — Summis desiderantes. С этого дня святая инквизиция, до сих пор увлечённо следившая за чистотой христианской веры и соблюдением догматов, взялась за то, чтобы уничтожить всех ведьм и вообще задушить колдовство. А в 1486 году свет увидела книга «Молот ведьм». И вскоре обогнала по тиражам даже Библию. Александр ГоловковЦарствование несбывшихся надежд190 лет назад, 1 декабря 1825 года, умер император Александра I, правивший Россией с 1801 по 1825 год Александр I стал первым и последним правителем России, обходившимся без органов, охраняющих государственную безопасность методами тайного сыска. Четверть века так прожили, и государство не погибло. Кроме того, он вплотную подошёл к черте, за которой страна могла бы избавиться от рабства. А также, одержав победу над Наполеоном, возглавил коалицию европейских монархов.
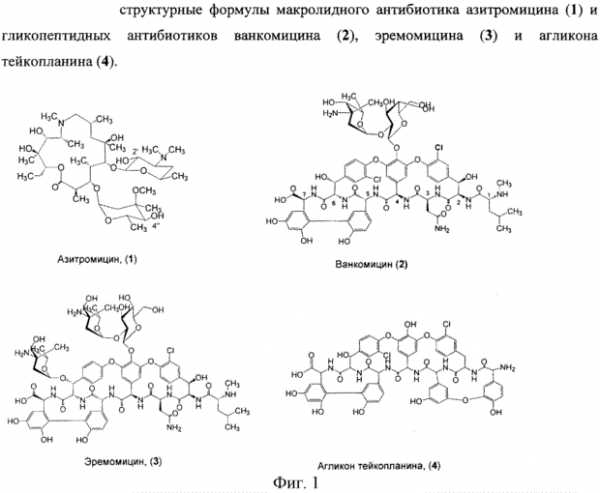
Интервью«Музыка Земли» нашейПианист Борис Березовский не перестает удивлять своих поклонников: то Прокофьева сыграет словно Шопена – нежно и лирично, то предстанет за роялем как деликатный и изысканный концертмейстер – это он-то, привыкший быть солистом. Теперь вот выступил в роли художественного руководителя фестиваля-конкурса «Музыка Земли», где объединил фольклор и классику. О концепции фестиваля и его участниках «Частному корреспонденту» рассказал сам Борис Березовский. Андрей Яхимович: «Играть спинным мозгом, развивать анти-деньги»Беседа с Андреем Яхимовичем (группа «Цемент»), одним из тех, кто создавал не только латвийский, но и советский рок, основателем Рижского рок-клуба, мудрым контркультурщиком и настоящим рижанином – как хороший кофе с черным бальзамом с интересным собеседником в Старом городе Риги. Неожиданно, обреченно весело и парадоксально. «Каждая собака – личность»Интервью со специалистом по поведению собак Антуан Наджарян — известный на всю Россию специалист по поведению собак. Когда его сравнивают с кинологами, он утверждает, что его работа — нечто совсем другое, и просит не путать. Владельцы собак недаром обращаются к Наджаряну со всей страны: то, что от творит с животными, поразительно и кажется невозможным. Юрий Арабов: «Как только я найду Бога – умру, но для меня это будет счастьем»Юрий Арабов – один из самых успешных и известных российских сценаристов. Он работает с очень разными по мировоззрению и стилистике режиссёрами. Последние работы Арабова – «Фауст» Александра Сокурова, «Юрьев день» Кирилла Серебренникова, «Полторы комнаты» Андрея Хржановского, «Чудо» Александра Прошкина, «Орда» Андрея Прошкина. Все эти фильмы были встречены критикой и зрителями с большим интересом, все стали событиями. Трудно поверить, что эти сюжеты придуманы и написаны одним человеком. Наш корреспондент поговорила с Юрием Арабовым о его детстве и Москве 60-х годов, о героях его сценариев и религиозном поиске. www.chaskor.ru Противобактериальные антибиотики | микроорганизмы и микробиология31.03.2011 Автор: Светлана Васильевна Некоторые авторы относят к антибиотикам не только те химические вещества, которые синтезируются микроорганизмами, но и неприродные соединения, синтезируемые химическими способами, полагая, что дело не столько в происхождении препарата, сколько в его антимикробной активности и полезности для человека. Наиболее обширную группу составляют антибактериальные препараты. К ним относятся:1. Бета-лактамные антибиотики, включающие природные пенициллины, несколько поколений полусинтетических пенициллинов (метициллин, оксациллин, ампициллин, аугментин, карбенициллин, амоксициллин, сулациллин и др.), несколько поколений цефалоспоринов (цефалоридин, цефаметин, цефиксим, цефетамин, цефтриаксон, цефоперазон и др.), нетрадиционные бета-лактамы (карба- и оксапенемы; карба- и оксацефемы и др.). Всего группа бета-лактамных антибиотиков включает в себя около 100 препаратов, активных против многих грамположительных и грамотрицательных, аэробных и анаэробных бактерий. 2. Стрептомицины и стрептомициноподобные антибиотики, активные против возбудителей туберкулеза, особо опасных инфекций и ряда грамотрицательных бактерий. 3. Макролиды — антибиотики, содержащие в своем составе макроциклическое лактонное кольцо, связанное с углеводными остатками. К этой группе относятся эритромицин, олеандомицин, карбомицин. Макролиды активны в отношении грамположительных бактерий (стафилококки, стрептококки и др.), а также в отношении некоторых грамотрицательных бактерий (бруцеллы, холерный вибрион, риккетсии и др.). 4. Аминогликозиды — антибиотики олигосахаридной или псевдоолигосахаридной природы: гентамицин, неомицин, канамицин, мономицин, а также тобрамицин, амикацин, сизомицин, нетилмицин. Гентамицин обладает широким спектром действия, подавляет рост многих грамположительных и грамотрицательных бактерий, высокоактивен против псевдомонад, протея. Антимикробные спектры мономицина, неомицина и канамицина близки к спектру гентамицина, но они уступают ему по активности. 5. Тетрациклины. Основой молекулы этих антибиотиков является полифункциональное соединение — тетрациклин. К этой группе относятся антибиотики с широким спектром действия, активные против многих грамположительных и грамотрицательных бактерий: хлортетрациклин, окситетрациклин, тетрациклин и их производные. 6. Гликопептиды — высокомолекулярные соединения, содержащие углеводы и аминокислоты: ванкомицин, ристомицин, линкомицин, клиндамицин, эремомицин и др. Действуют на многие грамположительные кокки и палочки, неактивны в отношении грамотрицательных бактерий. Ванкомицин применяют для лечения псевдомембранозного колита, вызванного Clostridium difficile. Этот колит часто возникает на фоне применения антибиотиков — антибиотикоассоциированный колит. Для его лечения хорош также эремомицин. 7. Хлорамфеникол (левомицетин) также является антибиотиком широкого спектра действия, активен в отношении многих видов грамотрицательных, включая риккетсии и спирохеты, и грамположительных бактерий. Большинство штаммов бактерий, устойчивых к пенициллинам, стрептомицинам и другим антибиотикам, сохраняет чувствительность к левомицетину. 8. Противотуберкулезные антибиотики. Как уже отмечалось, противотуберкулезной активностью обладают производные парааминосалициловой кислоты (препараты ПАСК), изоникотиновой кислоты (изониазиды), а также стрептомицин и его производные. Они составляют препараты первого ряда. К противотуберкулезным препаратам второго ряда относятся флоримицин, циклосерин и рифампицины. К рифампицинам высоко чувствительны также стафилококки, стрептококки, грамотрицательные кокки, многие не образующие спор анаэробы, сальмонеллы, возбудители особо опасных инфекций и другие бактерии — внутриклеточные паразиты. 9. Фосфомицины — антибиотики из группы фосфоновой кислоты. Фосфомицин обладает сильным бактерицидным действием на грамотрицательные бактерии (Escherichia, Proteus, Pseudomonas, Serratia, Salmonella, Shigella и другие роды). 10. Неприродные соединения - фторхинолоны. В клинике уже применяют около десяти фторхинолоновых препаратов (ципрофлоксацин, нефлоксацин, офлоксацин, ципробан и др.). Они обладают бактерицидным действием на многие грамотрицательные бактерии, в том числе на возбудителей самых тяжелых заболеваний. По своей эффективности фторхинолоны не уступают цефалоспоринам 3-го и 4-го поколений. Не нашли подходящую информацию? Не беда! Воспользуйтесь поиском на сайте в верхнем правом углу.www.rkm.kz |
г.Самара, ул. Димитрова 131 [email protected] |
 |