|
|
||||||||||
|
Защищенные пенициллины в амбулаторной практике педиатра. Антибиотики защищенныеКакие антибиотики применяют для лечения гайморитаПричиной острых синуситов, в том числе и гайморита, является инфекция. В большинстве случаев это бактерии. Возбудители инфекцииПри остром гайморите возбудители, это стрептококки, пневмококки, гемофильная палочка или стафилококк. Начинается все с острой респираторно-вирусной инфекции и потом присоединяется бактериальная флора. Для обострения хронического синусита характерна анаэробная флора или грамотрицательные палочки. Причем, четверть всех случаев заболевания гайморитом связана с зубной инфекцией. Это называется — одонтогенный гайморит. На начальном этапе жидкость в пазухах имеет не воспалительную природу, но она является питательной средой для бактерий. Бактерии размножаются в этой среде и дальше возникает гнойный синусит. Цели леченияЗдесь две основные задачи, восстановить дренаж пазухи и подавить инфекцию. То есть, нужно удалить из пазухи патологическое содержимое и восстановить ее нормальную аэрацию. Для решения первой задачи применяют сосудосуживающие средства, промывание пазухи, зондирование, а иногда и оперативное лечение, для второй антибиотики. В норме, в придаточных пазухах носа, должен быть только воздух, и ничего кроме воздуха. Теперь разберем каждую группу антибиотиков применяющихся для лечения придаточных пазух носа. МакролидыДовольно старая группа. Наиболее известные препараты, это эритромицин и олеандомицин. Все они уже устарели и сняты с производства. Сейчас применяются полусинтетические препараты этой группы: флуритромицин, азитромицин, рокитамицин и другие. У каждого препарата есть еще торговое наименование. То есть, разные заводы, в разных странах, выпускают одно и то же лекарство под своим названием. Возьмем для примера, Кларитромицин. Он выпускается под следующими названиями: Клацид, Фромилид, Фромилид Уно, Клабель, Кламед, Клерон и еще целая куча названий. В этой статье, я не смогу перечислить все препараты и все торговые названия, а буду рассматривать только группы и основных ее представителей. Иначе вместо статьи получиться фармацевтический справочник. Да и назначения, все равно должен делать врач, а он, я думаю, разберется. Макролиды, обычно используются в амбулаторной практике. Так как все препараты выпускаются в таблетированных формах и их можно принимать дома. Для детей рекомендованы следующие препараты этой группы: Сумамед, Сумамед Форте. Есть детские лекарственные формы в суспензии. Защищенные пенициллиныПрепараты этой группы очень широко применяются в лечении гайморита как у детей, так и у взрослых. Чаще всего применяется комбинация — Амоксициллин/Клавуланат (Аугментин) при легкой и среднетяжелой форме синусита. Есть формы выпуска таблетки и сироп. Это оптимальный антибиотик при стартовом лечении с острой ЛОР патологией. Благодаря сочетанию антибиотика и клавулановой кислоты подавляется выработка устойчивости бактерий к его действию. То есть сам антибиотик защищен от разрушения ферментами бактерий и поэтому расширяется его антибактериальный спектр действия.
Удобная форма для приема препарата этой группы - Флемоклав Солютаб. Таблетки растворимые можно применять у взрослых и детей. Очень высокая биодоступность препарата, более 90%. ЦефалоспориныЭта группа реже применяется для лечения синуситов, но так же может быть использована. Есть несколько поколений препаратов этой группы. Формы выпуска разные, как для применения для приема внутрь, так и в уколах. Их обычно используют, когда нужно вводить в уколах. В вену или мышцу. Например, антибиотик третьего поколения Клафоран (цефотаксим), Цефтриаксон и другие. Обладают широким спектром действия, действуют бактерицидно. Применяются у взрослых и детей. Есть лекарства этой группы как в таблетках, так и в сиропах, например цефалоспорин второго поколения Зиннат. Применяется при синуситах, тонзиллитах и часто используют при средних отитах. Удобно применять у детей. Эффективный и относительно безопасный препарат. К третьему поколению относятся антибактериальные препараты содержащие цефиксим. Наиболее часто в ЛОР практике применяются Супракс и Панцеф.
ФторхинолоныЭто не антибиотики, это группа антибактериальных препаратов. Применяются у пациентов старше 18 лет, так как они закрывают точки роста в костях и ребенок больше не вырастет. Могут быть применены и у детей, но по очень строгим, жизненным показаниям Эти препараты широкого противомикробного спектра. Чаще всего применяется Ципрофлоксацин. Применяется в таблетках, растворах для инъекций. Мощный и эффективный представитель этой группы – Таваник. Выпускается в таблетках покрытых оболочкой и растворе для инъекций. При остром гайморите применяется в таблетках. Еще два популярных препарата этой группы — Флорацид и хороший, современный представитель этой группы — Авелокс. Обычно применяются один раз в сутки, продолжительностью лечения около недели. Максимальная им можно лечить 21 день.
ЭкоантибиотикиЭто комбинация антибиотика с пробиотиком. В состав препаратов входит лактулоза, которая стимулирует рост нормальной кишечной микрофлоры. Таким образом, при применении этих антибиотиков защищается полезная микрофлора кишечника. Чаще всего применяются:
Эти лекарства рекомендуется использовать у пожилых пациентов и людей со сниженным иммунитетом. Все антибиотики имеют побочные эффекты, поэтому должны применяться по назначению и под наблюдением врача. Средние сроки лечения препаратами этой группы от пяти до десяти дней.
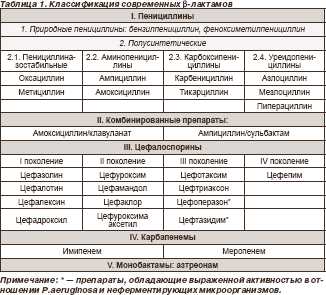
data-ad-client="ca-pub-7833244474785815"data-ad-slot="9717423574"> Если не нашли ответ на свой вопрос или что-то не поняли, можно задать свой вопрос здесь >>> vashnos.ru Защищенные пенициллины в амбулаторной практике педиатраСреди многочисленных антибактериальных препаратов особое место в широкой терапевтической и педиатрической практике занимают так называемые защищенные пенициллины – современные, удобные в применении и безопасные средства для лечения разнообразных инфекций. Эти препараты разработаны уже давно – более трех десятков лет тому назад, и с тех пор не теряют своей актуальности. С.П. Кривопустов, д.м.н., профессор тематический номер: ИНФЕКЦИИ В ПРАКТИКЕ ВРАЧА Несмотря на все возрастающие требования современной медицины к эффективности и безопасности антибактериальных средств, такой защищенный пенициллин, как амоксициллин/клавуланат, соответствует самым высоким стандартам и остается одним из наиболее востребованных антибиотиков во всем мире. На наши вопросы о преимуществах этого препарата отвечает доктор медицинских наук, профессор кафедры педиатрии № 2 с курсом медицинской генетики и неонатологии Национального медицинского университета им. А.А. Богомольца Сергей Петрович Кривопустов. – Чем была обусловлена необходимость разработки защищенных пенициллинов? – История применения пенициллинов в медицине уходит своими корнями к работам А. Флеминга и к Нобелевской премии, которая была вручена группе ученых в 1945 г. за открытие пенициллина и его лечебного эффекта при инфекционной патологии. Вместе с тем уже в 40-50-х гг. XX ст. было доказано, что природные антибиотики все же недостаточно эффективны при приеме внутрь, прежде всего – в связи с их разрушением в кислой среде желудка. Из этих соображений в конце 50-х гг. были получены синтетические пенициллины (ампициллин и др.). Значительным шагом вперед стала разработка в 1972 г. амоксициллина, который выгодно отличался от ампициллина своей высокой биодоступностью. Биодоступность нового препарата составила 90% при пероральном приеме и не зависела от приема пищи, в то время как биодоступность ампициллина не превышала 40% и дополнительно снижалась в 2 раза при приеме пищи. Кроме того, амоксициллин намного реже, чем ампициллин, оказывал побочные эффекты (диарею). Более высокая активность против пневмококка была еще одним преимуществом, благодаря которому амоксициллин быстро занял лидирующее положение среди пенициллинов. Однако одновременно с явлением миру очищенного пенициллина Г. Абрахамом и Э. Чейном был описан фермент, который его разрушает, – в 1940 г. была открыта пенициллиназа. Так микроорганизмы ответили на интеллектуальный вызов человечества – включением механизмов ферментативного расщепления антибиотика β-лактамазами. В связи с этим параллельно с разработкой и совершенствованием антибиотиков начались изыскания по поиску соединений, инактивирующих β-лактамазы. Такие вещества были найдены, к ним относятся клавулановая кислота, сульбактам, тазобактам. Наиболее широко в практике современной педиатрии применяется клавулановая кислота, которая была получена в начале 70-х гг. из культуры Streptococcus clavuligeris. Это вещество приводит к конкурентной необратимой ингибиции β-лактамаз, образует с этим ферментом стойкие неактивные комплексы, предотвращает разрушение антибиотика и продлевает постантибиотическое действие амоксициллина. Таким образом, в результате сочетания пенициллинов с ингибиторами β-лактамаз восстанавливается природная активность антибиотиков. – Какие современные защищенные пенициллины представляются наиболее перспективными? – На сегодня так называемые защищенные пенициллины широко применяются в клинической практике. К ним относятся такие комбинации, как амоксициллин/клавуланат, ампициллин/сульбактам, тикарциллин/клавуланат, пиперациллин/тазобактам. Наиболее популярен амоксициллин/клавуланат. Этот комбинированный препарат появился в клинической практике в 1981 г., первоначальное соотношение амоксициллина и клавуланата калия составляло 2:1. В настоящее время это соотношение представляется гораздо более выгодным и составляет 7:1, что усиливает бактерицидный эффект амоксициллина и увеличивает период, в течение которого сохраняется активность препарата. Сегодня в Украине есть такой препарат амоксициллина/клавуланата, как Кламокс. Он выпускается в таблетках по 625 мг, 1000 мг, в порошке для приготовления суспензии 228 мг в 5 мл и порошке для приготовления суспензии 457 мг в 5 мл. Это препарат производства компании Bilim Pharmaceuticals, которая основана в 1953 г., на сегодня представлена в 26 странах мира, имеет 120 продуктов, созданных на основе высоких технологий, и стремительно развивается. – Чем вызван интерес к этому антибиотику? – Кламокс мы рассматриваем как антибиотик для стартового эмпирического лечения в очень многих клинических ситуациях, поскольку он обладает оптимальным спектром антимикробной активности. Известные исследования, которые изучали этиологию основных бактериальных возбудителей респираторных инфекций (Alexander Project, 1998-2000 гг., 26 стран; PROJECT-1, 1999-2000 гг., 25 стран; ПеГАС-1, 2000-2001 гг., Россия, 15 центров), позволили сделать вывод о том, что во главе этиологии этих инфекций находятся S. pneumoniae, H. influenzae и M. catarrhalis. Именно эти три ведущих респираторных патогена высокочувствительны к Кламоксу. Помимо собственно спектра антимикробной активности клиницистов всегда интересует вопрос: может ли быть сохранена антимикробная активность при длительном применении различных препаратов? В контексте этой проблемы большое значение имеет исследование, проведенное R.N.Jones (Университет штата Айова, США, 1999 г.), где было показано, что важным является мониторинг характеристик резистентности H. influenzae и M. catarrhalis и использование данных, полученных в регионе, для эмпирического выбора препарата. В настоящее время примером антимикробного препарата, сохраняющего эффективность в отношении большинства микроорганизмов, является именно амоксициллин/клавуланат. Кроме того, Кламокс олицетворяет щадящий режим антибиотикотерапии в педиатрии. Внутримышечные инъекции в амбулаторной практике современной педиатрии должны стать анахронизмом. Тем не менее, участковые педиатры продолжают дискутировать о том, можно ли отказаться от инъекций антибиотиков в их практике лечения инфекций респираторного тракта. Не только можно, но и нужно! В качестве стартового антибиотика лучше всего использовать препараты, которые не разрушаются под действием β-лактамаз, то есть пероральные защищенные пенициллины, и тогда зачастую не возникает необходимости в парентеральных инъекциях. Важно понимать, что сам факт внутримышечного введения антибиотика не меняет механизма его действия, и ампициллин, введенный внутримышечно, все равно будет неэффективен против β-лактамазопродуцирующих штаммов. Безопасность применения амоксициллина/клавуланата в детской практике и во время беременности была подтверждена рядом исследований. Например, в исследовании M. Berkovitch и соавт. (2004), в котором принимали участие 382 женщины в первом триместре беременности, было показано, что применение амоксициллина/клавуланата во время беременности является безопасным для плода и не сопровождается повышенным риском возникновения пороков развития. – Каково же место этого препарата в ежедневной практике врача? – Комбинированный препарат, содержащий амоксициллин и клавулановую кислоту, в настоящее время включен во все современные стандарты, алгоритмы и протоколы лечения разнообразных инфекционных заболеваний. Основными показаниями к применению Кламокса являются: инфекции ЛОР-органов (тонзиллит, синусит, отит), дыхательных путей (бронхит, пневмония), мочевой системы (цистит, уретрит, пиелонефрит), мягких тканей и кожи (фурункул, абсцесс), костей (остеомиелит), стоматологические инфекции (альвеолярный абсцесс), интраабдоминальный сепсис и прочие инфекции. В педиатрической практике при отитах, синуситах препаратом первого выбора является амоксициллин или амоксициллин/клавуланат; согласно протоколу стартовой эмпирической антимикробной терапии заболеваний бронхолегочной системы у детей препаратом выбора является амоксициллин/клавуланат; при назначении стартовой терапии острого пиелонефрита наиболее оправдано применение защищенных пенициллинов; наконец, современные подходы к лечению инфекций кожи и мягких тканей, в том числе у детей, предполагают, что амоксициллин/клавуланат должен быть препаратом выбора при целлюлите, импетиго, фолликулите; особое место этот препарат занимает при инфекциях в результате укусов животных. На сегодня опубликовано значительное количество работ, которые показывают целесообразность как эмпирического, так и целенаправленного этиотропного лечения различных инфекций с помощью амоксициллина/клавуланата. Так, обращает на себя внимание мультицентровое исследование АРМИД (Н.А. Коровина и соавт., 2004), согласно результатам которого при инфекциях мочевой системы у детей резистентность E. coli к амоксициллину/клавуланату была незначительной (3,9%) по сравнению с таковой к ампициллину и незащищенному амоксициллину (51,5%). Поскольку кишечная палочка является ведущим ответственным патогеном при инфекциях мочевых путей, в качестве их эмпирической терапии в педиатрии наиболее часто используется амоксициллин/клавуланат. Хотелось бы обратить внимание и на исследование члена-корреспондента РАМН, профессора В.Т. Пальчуна и соавт. (2004), в котором изучались микробный пейзаж и пути рациональной антибиотикотерапии при острых гнойных заболеваниях ЛОР-органов. В рамках этой работы было обследовано 200 больных, которым проводилось микробиологическое исследование содержимого из гнойных очагов, изучались способность к продуцированию β-лактамаз и антибиотикочувствительность выявленной флоры. В результате исследования обнаружилось, что основные возбудители этих заболеваний в 88-100% случаев были чувствительны к амоксициллину/клавуланату, который был назван авторами оптимальным антибиотиком для стартовой терапии больных с острой гнойной ЛОР-патологией. Этот же препарат, наряду с незащищенным амоксициллином, по мнению известного специалиста в области микробиологии и антимикробной терапии профессора Л.С.Страчунского (2000), является препаратом выбора при легком и среднетяжелом течении синуситов у детей. Важно, что при легком и среднетяжелом течении терапию синуситов следует проводить пероральными препаратами. – А как обстоит дело с лечением внебольничных пневмоний? – Следует напомнить, что во взрослой практике лечения внебольничных пневмоний, существует два различных подхода. Как было отмечено профессором И.Г. Березняковым и соавт. (2006), один, условно говоря, «американский», в качестве препаратов выбора предлагает антибиотики, активные в отношении атипичных микроорганизмов, – макролиды, респираторные фторхинолоны, доксициклин. Другой – «европейский» (принятый в том числе и в нашей стране) – исходит из того, что β-лактамы сохраняют свои лидирующие позиции в амбулаторной терапии больных с внебольничной пневмонией. В детской практике, как известно, респираторные фторхинолоны не применяются. Учитывая данные ряда исследований, одним из ведущих антибиотиков в педиатрии при лечении внебольничной пневмонии остается амоксициллин/клавуланат. Так, в исследовании профессора Г.А. Самсыгиной и соавт. (2000), где изучались структура и чувствительность к антибиотикам возбудителей внебольничных инфекционных заболеваний бактериальной природы у детей, чувствительность к амоксициллин/клавуланату выделенных штаммов оказалась наиболее высокой – 90,1%, причем 79,9% были высокочувствительны. Для стрептококков этот показатель достиг 93% (в том числе для пневмококков – 62,7%), для стафилококков – 90,7%. – Подводя итоги нашего разговора, чем для вас сегодня является амоксициллин/клавуланат? – Хотелось бы сделать важный вывод, о котором следует помнить всем практическим врачам. Амоксициллин/клавуланат – препарат выбора в лечении инфекций мочевой системы, при воспалении среднего уха, синуситах, нетяжелых инфекций респираторного тракта, после укусов животных. Как высококачественный, безопасный и удобный в применении препарат амоксициллина/клавуланата Кламокс целесообразно применять в амбулаторной практике, в том числе и педиатрии. Подготовила Ирина Старенькая Читайте также www.health-ua.org защищаем печень и не только « Российская ФармацевтикаВ любую аптеку ежедневно приходит огромное число людей с рецептами на антибиотики. Конечно, можно просто отпустить посетителю лекарство и сказать «до свидания». Однако почему бы при этом не обратить его внимание на ряд вспомогательных препаратов, снижающих риски побочных эффектов антибиотикотерапии? Эффективность антибиотикотерапии определяется соотношением ее результативности и безопасности. В принципе фармспециалист своими рекомендациями и консультациями может положительно повлиять на оба этих параметра лечения. Например, подробно проинформировав о важнейших правилах приема тех или иных антибиотиков, он может оградить пациента от ошибок, ведущих к снижению терапевтического действия этой группы ЛС (таблица 1). И все же в большей степени «первостольник» властен над безопасностью антибиотикотерапии. Общеизвестно, что наряду с несомненной пользой, антибактериальные препараты зачастую вызывают ряд негативных последствий для организма больного, которые в идеале необходимо предотвратить. Увы, но как показывает опыт, врачи отнюдь не всегда уделяют должное внимание этой стороне лечения. В подобной ситуации позаботиться о повышении безопасности лечения призван провизор, в распоряжении которого есть широкий круг безрецептурных средств, уменьшающих наиболее частые «издержки» от приема антибиотиков (таблица 2). Защита печениК сожалению, многие антибиотики обладают отрицательным действием на печень. Наиболее опасны в этом плане такие группы антибактериальных средств, как тетрациклины (доксициклин, тетрациклин и др.), аминогликозиды (гентамицин, канамицицин, стрептомицин и др.), противотуберкулезные препараты (изониазид, фтивазид, пиразинамид и др.). Исключать риск негативного влияния на печень других антибиотиков также нельзя, особенно если вспомнить, что практически все они метаболизируются с участием главного фильтра человеческого организма. Наиболее актуальной проблема защиты печени становится в тех случаях, когда у пациента изначально имеются «неполадки» в работе этого органа. Речь здесь даже не столько о пациентах с гепатологическими заболеваниями (им, как правило, врачи любые препараты назначают крайне осмотрительно), сколько о «скрытых группах риска» — людях, систематически принимающих другие группы лекарств с гепатотоксическим потенциалом (НПВП, гормоны, антидепрессанты, антигипертензивные ЛС), склонных к перееданию, полноте, частому употреблению крепких напитков. В свете вышесказанного более чем уместной рекомендацией со стороны провизора в дополнение практически к любому антибиотику может быть параллельный прием гепатопротекторов. Наиболее предпочтительными при этом считаются препараты на основе эссенциальных компонентов, которые постоянно присутствуют в организме человека. В этой категории хорошо зарекомендовал себя препарат Гепагард, сочетающий в своем составе эссенциальные фосфолипиды (ЭФЛ – 280 мг в каждой капсуле) и витамин E. ЭФЛ как естественные компоненты клеточной мембраны гепатоцитов укрепляют их фосфолипидный бислой, препятствуя тем самым деструктивному влиянию антибиотиков на печень. Если же повреждения печени уже имеют место, ЭФЛ «залатывают» микродефекты в мембранах, способствуя восстановлению нормального морфологического и функционального состояния гепатоцитов. Витамин E в составе Гепагарда при этом образует вторую линию защиты: обладая мощным антиоксидантным действием, он дополнительно оберегает клетки от повреждающего действия свободных радикалов.Союзники полезной микрофлоры С учетом того что многие антибиотики в процессе своего действия «без разбора» подавляют (или уничтожают) не только «плохие», но и «хорошие» бактерии, традиционным фактором риска, сопутствующим их приему, является дисбиоз. Наиболее высока угроза развития этого состояния в случае назначения пациенту длительного курса антибиотикотерапии, а также при применении цефалоспоринов III-IV поколений (цефиксим, цефтибутен и др.), которые нередко на короткий срок вызывают «тотальную зачистку» кишечной микрофлоры (т.н. «стерильный кишечник»). В целях предотвращения дисбиоза в первую очередь используются средства-пробиотики, компенсирующие боевые потери полезных микроорганизмов. Правда, при выборе соответствующего препарата пациенту необходимо помнить, что не все из них совместимы с антибиотиками. К примеру, эубиотическая активность таких препаратов, как Бифидумбактерин, Пробифор, Бификол, Флорин Форте, при параллельном приеме с антибиотиками ощутимо снижается. Вследствие этого перечисленные средства используются главным образом не для профилактики, а для лечения дисбиоза после завершения курса антибиотикотерапии. К пробиотикам, не подверженным дезактивирующему влиянию антибактериальных препаратов, относятся такие препараты, как Линекс, Бифиформ, Лактобактерин. Здесь при выборе конкретного наименования для пациента определенное значение имеет такой критерий, как состав полезных микроорганизмов в том или ином препарате. Например, Лактобактерин (порошок) содержит только лактобактерии L. Acidophilus, Бифиформ – бифидобактерии B. longum и энтерококки Ent. Faecium, Линекс – комбинацию бифидо-, лактобактерий и энтерококков (B. Infantis, L. Acidophilus, Ent. Faecium). В целях создания благоприятных условий для поддержания жизнедеятельности и размножения бактерий в дополнение к пробиотикам можно также порекомендовать пребиотики. Среди БАД к пище, используемых для профилактики дисбиотических расстройств, можно назвать источники фруктоолигосахаридов и инулина (ЖКТ Транзит Пребиотик), пектина (Пектовит), лактулозы (Лактусан), арабиногалактана (ВитаЛАГ). Из лекарственных препаратов как для предотвращения нарушений кишечного биоценоза, так и его быстрого восстановления применяются такие пребиотики, как Хилак Форте (смесь продуктов обмена лактобактерий, кишечной палочки и Str. Faecalis), Дюфалак (лактулоза). Добавим также, что ряд профилактических БАД к пище содержат одновременно про- и пребиотики (Флорадофилус, Биовестин-лакто, Йогулакт и др.). Противогрибковая охрана При длительных и интенсивных курсах приема антибиотиков, особенно у больных с ослабленным иммунитетом, достаточно велик риск активизации на почве дисбиоза условно-патогенных грибов (Candida и др.), постоянно обитающих в кишечнике, и как следствие — и грибковых поражений слизистых оболочек. Еще сравнительно недавно для профилактики этого осложнения указанным группам пациентов врачи назначали «старый добрый» нистатин. Однако в связи с крайне невысокой эффективностью этого ЛС в последние годы приоритет сместился в сторону более современных антимикотиков в частности, препаратов флуконазола (Дифлюкан, Микосист, Флюкостат). Надо заметить, что, несмотря на безрецептурный статус указанных средств, их назначение все же должен осуществлять врач, т.к. в зависимости от индивидуальных особенностей пациента режим приема флуконазола может существенно варьировать. Вместе с тем и провизор может внести свой посильный вклад в этот аспект терапии: например, если больному, собирающемуся пройти продолжительный курс лечения антибиотиками, противогрибковые средства не назначены, «первостольнику» не лишне проинформировать его о возможной целесообразности приема антимикотиков и посоветовать обратиться к врачу за подробной консультацией. Это, во-первых, повысит профессиональный имидж фармспециалиста в глазах посетителя, а во-вторых, наверняка обернется для аптеки «отдаленной выгодой». Ведь если после консультации больного с врачом выяснится, что противогрибковый препарат действительно необходим, то пациент с высокой долей вероятности придет за этим лекарством именно в ту аптеку, где ему дали столь ценную «подсказку». Противоаллергическое прикрытие Наконец, нельзя не указать и на такую «скрытую угрозу» антибиотикотерапии, как риск развития аллергии на их введение в организм. Наибольшую опасность с этой точки зрения представляют пенициллины и цефалоспорины, имеющие достаточно высокий «аллергенный потенциал». Возможно, кто-то здесь скажет, что перед назначением терапии врач должен провести пробу на чувствительность организма к тому или иному антибиотику. Конечно, в ряде случаев такие пробы проводятся, однако, увы, в большинстве случаев антибактериальные препараты назначаются эмпирически. Особенно остро вопрос о возможной аллергии стоит тогда, когда определенный антибиотик назначен пациенту впервые. Итак, в целях десенсибилизации организма к антибиотикам, подавления потенциальных аллергических «эксцессов» провизору никогда не лишне будет посоветовать пациенту использовать «антигистаминное прикрытие», тем более, что большинство h2-гистаминоблокаторов разрешены к отпуску без рецепта. Выбор конкретного препарата должен осуществляться в зависимости от предпочтений пациента касательно частоты приема ЛС, предполагаемого ритма и образа жизни во время курса фармакотерапии, платежеспособности покупателя и, конечно, с учетом противопоказаний. Например, если пациент предпочитает разовый прием лекарства в течение суток, ему можно порекомендовать длительно действующие антигистаминные ЛС нового поколения – Эриус, Кестин, Ксизал, Зиртек. Те же препараты выходят на первый план, если посетитель планирует даже во время лечения вести активную деловую деятельность, если он постоянно находится за рулем. Причина – минимальная выраженность у них седативных эффектов в сравнении со старыми h2-гистаминоблокаторами (Супрастин, Тавегил, Диазолин). Если же пациент собирается лечиться дома, в покое, ему вполне могут подойти и средства I поколения, более доступные по цене. Как бы то ни было, главное донести до покупателя, что «береженого бог бережет». В том числе и от возможных издержек антибиотикотерапии. Источник: журнал «Российские аптеки» №21 (2010)Файл: Загрузить (36 кбайт) remedium pharmapractice.ru b-лактамные антибиотики в пульмонологии | Интернет-издание "Новости медицины и фармации"В доантибиотическую эру тяжелое инфекционное заболевание дыхательных путей — пневмонию лечили следующим образом: «Абсолютный покой; чай с молоком, кофе, коньяк, щелочно-соленые минеральные воды. При высокой t° хинин, салициловые препараты, ванны 20–25° С (до и после рюмка вина). Против колотья в боках горчичники, скипидарники, согревающие компрессы… При кашле капли дионина, кодеина, героина, морфия… При сильно затрудненном дыхании и цианозе — кровососные банки… Для поддержания сердечной деятельности — красное вино, коньяк, шампанское» (Гайкович Р. Спутник земского врача, 1905). Довольно приятный набор медикаментов и, что интересно, на то время достаточно эффективный. Но наука не стояла на месте, и с открытием пенициллинов началась новая эра в лечении бактериальных заболеваний. β-лактамные антибиотики являются одной из наиболее изученных, многочисленных и ведущих групп антимикробных препаратов, которые применяются для лечения инфекций как верхних, так и нижних дыхательных путей различной степени тяжести. Их многообразие объясняется стремлением ученых получить новые соединения с более широким спектром антибактериальной активности, улучшенными фармакокинетическими характеристиками и устойчивостью к постоянно возникающим новым механизмам резистентности микроорганизмов. Классификация современных β-лактамов (основанная на их химической структуре) и препараты, зарегистрированные в Украине, приведены в табл. 1.
Механизмы действия β-лактамовОбщим фрагментом в химической структуре является β-лактамное кольцо, которое связывается с пенициллинсвязывающими белками (ПСБ) — основным компонентом синтеза наружной мембраны как у грамположительных, так и у грамотрицательных микроорганизмов. Молекулы ПСБ жестко соединены с цитоплазматической мембраной микробной клетки, они осуществляют образование поперечных сшивок. Связывание β-лактамов с ПСБ ведет к их инактивации, прекращению роста и последующей гибели микробной клетки (рис. 1).
Уровень активности конкретных β-лактамных антибиотиков в отношении отдельных микроорганизмов в первую очередь определяется их аффинностью (сродством) к ПСБ. Чем ниже аффинность взаимодействующих молекул, тем более высокие концентрации антибиотика требуются для подавления ПСБ. Для взаимодействия с ПСБ антибиотику необходимо проникнуть из внешней среды через наружные структуры микроорганизма. У грамположительных микроорганизмов капсула и пептидогликан не являются существенной преградой для диффузии β-лактамов. Практически непреодолимой преградой для диффузии препаратов является липополисахаридный слой грамотрицательных бактерий. Единственным путем для диффузии этой группы антибиотиков служат пориновые каналы внешней мембраны, которые представляют собой воронкообразные структуры белковой природы и являются основным путем транспорта питательных веществ внутрь бактериальной клетки. Механизмы формирования резистентности микроорганизмов к β-лактамамОсновным фактором, ограничивающим доступ антибиотика к мишени действия, являются ферменты β-лактамазы, гидролизующие антибиотики. К практически важным свойствам β-лактамаз относятся: 1. Субстратный профиль (способность к преимущественному гидролизу тех или иных β-лактамов, например пенициллинов или цефалоспоринов или тех и других в равной степени). 2. Локализация кодирующих генов (плазмидная или хромосомная). Эта характеристика определяет эпидемиологию резистентности. При плазмидной локализации генов происходит быстрое внутри- и межвидовое распространение резистентности, при хромосомной наблюдают распространение резистентного клона. 3. Тип экспрессии (конститутивный или индуцибельный). При конститутивном типе микроорганизмы синтезируют β-лактамазы с постоянной скоростью, при индуцибельном количество синтезируемого фермента резко возрастает после контакта с антибиотиком (индукции). Поскольку пептидогликан (мишень действия β-лактамов) является обязательным компонентом микробной клетки, все микроорганизмы в той или иной степени чувствительны к антибиотикам этого класса. Однако на практике реальная активность антибиотиков ограничивается их концентрациями в крови или очаге инфекции. Если ПСБ не угнетаются при концентрациях антибиотиков, реально достижимых в организме человека, то говорят о природной устойчивости микроорганизма. Однако истинной природной резистентностью к β-лактамам обладают только микоплазмы, так как у них отсутствует пептидогликан — мишень действия антибиотиков. Кроме уровня природной чувствительности (или резистентности), клиническую эффективность β-лактамов определяет наличие у микроорганизмов приобретенной устойчивости. Приобретенная резистентность формируется при изменении одного из параметров, определяющих уровень природной чувствительности микроорганизма, т.е. 1) при cнижении аффинности ПСБ к антибиотикам; 2) снижении проницаемости внешних структур микроорганизма; 3) появлении новых β-лактамаз или изменении характера экспрессии имеющихся. Фармакодинамические и фармакокинетические показателиКак показали исследования последних лет, клиническая эффективность антибиотиков зависит не только от минимальной ингибирующей концентрации (МИК), являющейся статическим показателем, который отражает чувствительность возбудителя к препарату in vitro и определяет его антимикробную активность. При оценке эрадикационной потенции препарата чрезвычайно важно изучать сочетания МИК с фармакодинамическими и фармакокинетическими параметрами. Эти показатели позволяют прогнозировать антибактериальное действие и оптимальное дозирование препарата. Для оценки эффективности антибиотиков чаще используют 3 группы показателей: 1. Т > МПК. Для β-лактамных антибиотиков время превышения минимальной ингибирующей концентрации (T > MИК) определяет бактерицидную активность препаратов. Это очень хороший индикатор результата, так как он не изменяется в зависимости от режима дозирования, локализации инфекции и свойств большинства микроорганизмов [1]. Т > МПК является показателем эффективности пенициллинов, цефалоспоринов, эритромицина, кларитромицина. Если концентрация препарата в крови превышает значение МИК90 возбудителя в течение 40 % времени между дозированиями, антибиотик будет эффективен у 80 % пациентов [2]. Важным параметром, на который следует опираться при выборе антибиотика для эмпирической терапии, является способность препарата обеспечивать достаточную концентрацию в очаге инфекции в течение необходимого времени для подавления ведущих возбудителей. Среди β-лактамов для перорального применения амоксициллин/клавуланат (Аугментин) является единственным пероральным препаратом, концентрация которого в сыворотке крови превышает МИК90 для всех трех ведущих респираторных возбудителей в течение > 40 % длительности интервала дозирования [3]. β-лактамные антибиотики практически не имеют постантибиотического эффекта. Поэтому более важное значение приобретает не величина разовой дозы препарата, а кратность введения. Эти фармакокинетические особенности позволяют препаратам сохранять клиническую эффективность даже при пневмониях, вызванных умеренно устойчивыми штаммами. На рис. 2. показан фармакодинамический профиль амоксициллин/клавуланата (Аугментина), который при 2-кратном приеме пероральных форм обеспечивает достаточную концентрацию в очаге инфекции в течение необходимого времени для подавления ведущих возбудителей инфекций дыхательных путей — пневмококка, гемофильной палочки и моракселлы.
2. Сmax/МИК. Показатель соотношения пиковой сывороточной концентрации (Сmax) к МИК (Сmax/МИК) важен для определения клинической антибактериальной активности аминогликозидов, что позволяет вводить суточную дозу препарата однократно, тем самым увеличив его эффективность и снизив вероятность развития побочных явлений. 3. AUC24/МИК. Показатель отношения экспозиции препарата (зона под кривой сывороточной круглосуточной концентрации (AUC24)) к МИК (AUC24/МИК) определяет антимикробную активность азалидов и фторхинолонов. Эти показатели коррелируют с клинической эффективностью, бактериальной эрадикацией и появлением (профилактикой) резистентности. Природные пенициллиныС давних времен человечество использовало целебные свойства зеленой плесени (Penicillium), первые упоминания о них обнаружены в медицинских папирусах Древнего Египта. Однако первый антибиотик — пенициллин был выделен из грибка Penicillium notatum и изучен Флемингом в 1929 году. Ученым было установлено, что препарат угнетает бактерии кокковой группы, но неактивен в отношении кишечной группы. Технологию промышленного производства пенициллина разработали и наладили в 1940 году Г. Флори и Е. Чейн1. Препарат спас сотни тысяч жизней в период Второй мировой войны. Заслуги ученых были достойно оценены, и в 1945 году А. Флеминг, Г. Флори, Е. Чейн были удостоены Нобелевской премии. Природные пенициллины имеют довольно узкий спектр антимикробного действия. Они высокоактивны в отношении пиогенных стрептококков, грамположительных анаэробных кокков, малоактивны в отношении энтерококков. Еще в 40-х годах прошлого столетия Е. Чейн установил, что определенные штаммы микроорганизмов вырабатывают ферменты, разрушающие пенициллины. Например, к 1957 году было установлено, что около 80 % стафилококков вырабатывают β-лактамазы, что делает их резистентными к этой группе препаратов. Кроме того, начиная с конца 60-х годов наблюдается постепенный и неуклонный рост устойчивости пневмококков к этой группе препаратов, что связано с модификацией пенициллинсвязывающего белка. На сегодняшний день она колеблется от 12–60 % в некоторых странах Европы почти до 80 % в странах Восточной Азии. Природные пенициллины показаны для лечения пневмококковой пневмонии, вызванной чувствительным возбудителем, в низких дозах (4–8 млн ЕД/сут.), аспирационной пневмонии и абсцесса легкого, вызванного стрептококкоками группы А или анаэробными кокками в средних дозах (10–18 млн ЕД/сут.) в составе комбинированной терапии. Из побочных эффектов наиболее значимы аллергические реакции, которые являются перекрестными со всеми пенициллинами, иногда и с другими β-лактамами. Природные пенициллины быстро выводятся из организма, что требует частого (до 6 раз в сутки) введения. Пенициллины, устойчивые к разрушению пенициллиназойОксациллин был синтезирован для подавления стафилококков, вырабатывающих β-лактамазы. По антимикробному спектру он близок к природным пенициллинам, однако уступает им по уровню активности в отношении большинства микроорганизмов. Ограничен в применении. Назначается лишь при верифицированной стафилококковой инфекции, однако не активен в отношении метициллинрезистентных стафилококков, у которых устойчивость связана с модификацией ПСБ. АминопенициллиныПрепараты имеют более широкий спектр действия, чем природные пенициллины, включающий энтерококки, грамотрицательные бактерии (E.coli, P.mirabilis, Salmonella spp., Shigella spp., H.influenzae). Однако они неактивны в отношении штаммов, продуцирующих β-лактамазы (25–40 % H.influenzae), не действуют на синегнойную палочку. Спектр и сила противомикробного действия ампициллина и амоксициллина сходны. Но в отличие от ампициллина амоксициллин имеет ряд фармакокинетических и фармакодинамических преимуществ. Амоксициллин лучше всасывается при приеме внутрь (90 %), пища не влияет на его всасывание. Амоксицил лин создает более высокие и стабильные концентрации в крови, мокроте, моче, лучше переносится и реже вызывает диарею. Благодаря описанным качествам амоксициллин является препаратом выбора при лечении нетяжелой внебольничной инфекции нижних дыхательных путей у лиц с низкой вероятностью резистентных или атипичных возбудителей. Защищенные пенициллиныК защищенным пенициллинам относятся препараты, в состав которых входят аминопенициллин и ингибитор β-лактамаз. Ингибиторами называют вещества β-лактамной природы, обладающие минимальной антибактериальной активностью, но способные необратимо связываться с β-лактамазами и таким образом ингибировать их активность (суицидное ингибирование). В результате ингибиторы защищают антибиотики от гидролиза (рис. 3).
В клинической практике применяются три ингибитора β-лактамаз: клавулановая кислота, сульбактам и тазобактам. Клавулановая кислота является одним из наиболее активных ингибиторов β-лактамаз. Комбинация амоксициллина с клавулановой кислотой (Аугментин) зарекомендовала себя как высокоэффективный и надежный препарат при лечении различных внебольничных инфекций верхних и нижних дыхательных путей. Например, к концу 2002 года амоксициллин/клавуланат был включен в формулярные документы 150 стран мира по лечению заболеваний легких [4]. В стандартах антибактериальной терапии многих стран мира амоксициллин/клавулановая кислота (Аугментин) обычно рекомендуется в качестве препарата первого ряда при лечении этих инфекций (табл. 2).
Амоксициллин/клавуланат (Аугментин) является высокоактивным в отношении грампозитивных кокков, грамотрицательных бактерий (включая H.influenzae, M.catarrhalis), продуцирующих β-лактамазы, анаэробов. Сравнительные данные о микробиологической активности амоксициллин/клавуланата (Аугментина), других β-лактамов, макролидов и фторхинолонов против S.pneumoniae показывают, что препарат занимает лидирующие позиции благодаря невысоким уровням МИК (табл. 3).
По данным широкомасштабных исследований чувствительности S.pneumoniae к антибактериальным препаратам различных групп, возбудитель обладает высокой чувстительностью к амоксициллин/клавуланату как в целом в мире, так и в соседних с Украиной Польше и Российской Федерации (табл. 4).
Высокая чувствительность H.influenzae к амоксициллин/клавуланату подтверждена исследованием PRОTEKT (рис. 4).
По результатам международного мониторингового исследования Аlexander Project, проведенного на протяжении 1998–2001 гг. в 26 странах мира, амоксициллин/клавуланат (Аугментин) рекомендован как препарат первого выбора для лечения инфекций респираторного тракта [5]. Клиническая и микробиологическая эффективность амоксициллин/клавуланата (Аугментина) составляет до 96 %. На протяжении более чем 27-летнего клинического опыта применения препарата отсутствуют достоверные данные о росте резистентности к нему. Это обеспечивается накоплением препарата в высоких концентрациях в межклеточном пространстве, где преимущественно локализуются S.pneumoniae, H.influenzae, M.catarrhalis, а также длительным периодом времени поддержания высоких концентраций в плазме крови, что подавляет развитие чувствительных, умеренно резистентных пневмококков, H.influenzae, M.catarrhalis. Благодаря наличию пероральной и парентеральной форм Аугментин был первым антибиотиком, который стал назначаться для ступенчатой терапии. Ее суть заключается в том, что в начале антибактериального лечения, когда тяжесть состояния больного требует парентерального введения антибиотика, ему назначают парентеральную форму амоксициллин/клавуланата. В дальнейшем (обычно на 3–4-й день от начала лечения), когда состояние больного улучшается: снижается температура тела, уменьшаются симптомы интоксикации, отмечается положительная субъективная и объективная симптоматика поражения дыхательных путей, переходят на пероральный прием препарата в течение 7–10 дней. Это позволяет снизить количество осложнений, связанных с парентеральным введением, сократить сроки госпитализации при условии сохранения клинической эффективности лечения, позволяет завершить реабилитацию пациента в более комфортных домашних условиях, избежать риска присоединения нозокомиальной инфекции, снизить стоимость лечения. Перечисленные выше преимущества и особенности защищенных пенициллинов позволяют относить их к препаратами первого ряда для лечения негоспитальных инфекций нижних дыхательных путей с нетяжелым и тяжелым течением как в амбулаторных условиях, так и в стационаре. ЦефалоспориныЦефалоспорины являются одной из наиболее обширных групп антимикробных препаратов, которые включают 4 поколения антибиотиков, различающихся по спектру антимикробного действия. Представителем I поколения цефалоспоринов является цефазолин. Препарат имеет узкий спектр действия, сходный с природными пенициллинами: активен в отношении грамположительных кокков (стафилококки, стрептококки, пневмококки). Разрушается β-лактамазами грамотрицательных бактерий, но стабилен к β-лактамазам, продуцирующимся стафилококками. В связи с этим основная область применения цефазолина в клинике — доказанная или предполагаемая стафилококковая инфекция. В этом случае он является альтернативным средством пенициллиназостабильным пенициллинам (оксациллин и др.). Пневмококки проявляют полную перекрестную устойчивость к цефалоспоринам I поколения и пенициллинам. Активность препаратов в отношении H.influenzae и M.catarrhalis клинически незначимая, поскольку антибиотики чувствительны к гидролизу их β-лактамазами. В связи с узким спектром активности и широким распространением устойчивости среди потенциальных возбудителей применение цефазолина при инфекциях дыхательных путей не обосновано. Однако, по нашим данным, цефазолин назначается 34,9–41,8 % амбулаторных больных с внебольничными инфекциями нижних дыхательных путей, что не является обоснованным ни с микробиологической, ни с финансовой точки зрения. Цефалоспорины II поколения Одним из наиболее часто применяемых антибактериальных препаратов этой группы является цефуроксим. Препарат имеет повышенную по сравнению с цефалоспоринами I поколения активность в отношении грамотрицательных бактерий (H.influenzae), большую стабильность к β-лактамазам. Он мало активен в отношении некоторых грамотрицательных микроорганизмов (Enterobacter spp., Citrobacter spp., Serratia spp., P.rettgeri, Klebsiella spp., P.vulgaris). Pseudomonas spp., Acinetobacter spp., анаэробы B.fragilis природно устойчивы. Наличие парентеральной и пероральной форм (цефуроксима аксетил) позволяет проводить ступенчатую терапию. Применение цефуроксима для лечения внебольничных инфекций нижних дыхательных путей оправданно клинически и микробиологически, однако он уступает амоксициллин/клавуланату по фармакоэкономическим показателям. Цефалоспорины III поколения Имеют более высокую активность in vitro в отношении грамотрицательных бактерий (семейство Enterobacteriaceae, H.influenzae, M.catarrhalis, N.gonorrhoeae, N.meningitidis) по сравнению с цефалоспоринами II поколения. Кроме того, некоторые цефалоспорины этой группы активны в отношении синегнойной палочки; по силе действия на P.aeruginosa они располагаются в следующем порядке: цефтазидим — цефоперазон — цефтриаксон — цефотаксим. Препараты обладают более высокой устойчивостью к β-лактамазам грамотрицательных бактерий, однако хуже действуют на грамположительные кокки. Оправданны в составе комбинированной терапии тяжелой внебольничной и нозокомиальной инфекции дыхательных путей на госпитальном этапе. Цефалоспорины IV поколения На рынке Украины представлены цефепимом. Благодаря наличию положительного и отрицательного заряда в структуре молекулы антибиотика он способен быстро проникать внутрь микроорганизма, что защищает его от разрушения β-лактамазами, и связываться с ПСБ. Препарат имеет хорошо сбалансированный широкий антимикробный спектр: активен в отношении грамположительных микроорганизмов, в том числе пенициллинустойчивых пневмококков, и грамотрицательных бактерий (в том числе P.aeruginоsa), некоторых анаэробов. Цефепим обладает самой высокой среди цефалоспоринов устойчивостью к β-лактамазам и самой низкой вероятностью развития резистентности. Показан для эмпирической терапии тяжелой госпитальной инфекции нижних дыхательных путей, в том числе осложненной сепсисом; при установлении высокого уровня резистентности к цефалоспоринам III поколения. КарбапенемыИмипенем и меропенем благодаря положительно и отрицательно заряженной молекуле быстро проникают внутрь микробной клетки, кроме того, связываются с ПСБ 1b, 2, 4 и 7-го типов, что обеспечивает самый широкий спектр активности среди всех β-лактамных антибиотиков против грамположительных, в том числе и пенициллинрезистентных пневмококков, грамотрицительных и анаэробных микроорганизмов. Природно устойчивы к ним атипичные возбудители, MRSA. Приобретенная устойчивость описана только у синегнойной палочки. Связь карбапенемов с ПСБ 2-го типа вызывает филаминацию бактерий, что приостанавливает их жизнедеятельность и предотвращает выброс большого количества эндотоксинов в кровь и поражение сердца, почек, ЦНС. Карбапенемы являются препаратами резерва для лечения тяжелых госпитальных инфекций, вызванных множественно-резистентными микробными ассоциациями, а также у лиц с подавленным иммунитетом. При угрожающих жизни инфекциях неустановленной этиологии карбапенемы могут назначаться в качестве препаратов первого ряда эмпирической монотерапии. МонобактамыАзтреонам обладает узким спектром действия: аэробные грамотрицательные бактерии, включая устойчивую P.aeruginosa. При использовании азтреонама очень редко возникают побочные явления. Препарат не вступает в перекрестные взаимодействия с другими β-лактамами. Антибиотик является препаратом резерва для лечения тяжелой аэробной внебольничной или госпитальной инфекции нижних дыхательных путей, вызванной грамотрицательными бактериями, резистентными к аминогликозидам или β-лактамным антибиотикам широкого спектра; у пациентов с аллергией к β-лактамным антибиотикам, с тяжелыми нарушениями функции почек; у пациентов с муковисцидозом. Заключениеβ-лактамные антибиотики явились первыми антибактериальными препаратами, с которыми связывают принципиальные достижения в лечении инфекционных заболеваний. Создание пенициллина положило начало синтезу группы лекарств, без которых в настоящее время не возможна курация большинства больных, страдающих болезнями легких, сердца, мочевыводящих путей. Настоящая публикация не претендует на полноту освещения проблемы, а ставит целью определить расстановку акцентов и степень важности того или иного препарата. Мы практически не коснулись взаимодействий β-лактамов с другими препаратами, их побочных эффектов, применения у беременных и кормящих, частично осветили вопросы резистентности. Надеемся, что в следующих публикациях мы осветим эти темы, что еще в большей степени будет способствовать более оптимальному применению данной группы лекарств в практике врача. Статья опубликована при поддержке компании «ГлаксоСмитКляйн» AGMT/10/UA/01.04.20081363 1 Оба ученых являлись сотрудниками лаборатории «Бичем Ресерч Лабораторис», которая позже станет составляющей одной из самых больших фармацевтических компаний в мире — «ГлаксоСмитКляйн».↑ www.mif-ua.com |
г.Самара, ул. Димитрова 131 [email protected] |
 |