|
|
||||||||||
|
Клинические симптомы и методы лечения печеночной энцефалопатии. Антибиотики при печеночной энцефалопатииПеченочная энцефалопатия: причины, симптомы, лечениеВы здесь: Печеночная энцефалопатия У вас в браузере отключен java script, вам надо его включить или вы не сможете получить всю информацию по статье «Печеночная энцефалопатия и симптомы проявления». Категория: ЖКТ, мочеполовая система Просмотров: 32047Печеночная энцефалопатия - основные симптомы:Печёночная энцефалопатия – это заболевание, для которого характерен патологический процесс, протекающий в печени и затрагивающий ЦНС. Результатом такой болезни становятся нейропсихические нарушения. Для этого недуга характерны изменения личности, депрессии и нарушения интеллекта. Справиться с печёночной энцефалопатией самостоятельно не получится, здесь не обойтись без врачебного вмешательства. Факторы, провоцирующие появление заболеванияК основным причинам развития этого патологического процесса можно отнести следующее:
СимптоматикаПечёночная энцефалопатия может протекать в острой, подострой и хронической форме. ОстраяДля такого типа заболевания развитие недостаточного функционирования печени происходит внезапно, а длится от двух часов до нескольких дней. Острая печёночная энцефалопатия сопровождается очень тяжёлым течением. На фоне такого недуга быстро развивается печёночная кома. Наличие острого вирусного, медикаментозного и токсического гепатита – основные причины формирования острой формы печёночной энцефалопатии. ПодостраяТакое заболевание характеризуется медленным развитием печёночной комы. Предположительное время – неделя и более. Для заболевания подострого типа характерно рецидивирующее течение, поэтому перед тем, как наступят симптомы фазы обострения, состояние пациентов удовлетворительное. ХроническаяПечёночная недостаточность хронического типа формируется на фоне цирроза печени, сопровождающегося с портальной гипертензией. При таком состоянии у пациента могут возникнуть следующие симптомы:
Стадии болезниТечение печёночной энцефалопатии может происходить в 4 стадии, для каждой из которых характерный свои симптомы. 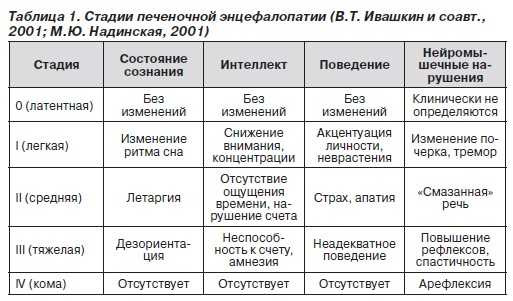 Стадии печеночной энцефалопатии Проявления первой стадииЭта стадия характеризуется следующими признаками:
На первоначальной стадии пациенты правильно отвечают на все вопросы, но их затруднительно сконцентрировать внимание, по этой причине они по несколько раз повторяют одни и те же слова. Бывают случаи развития преходящей дезориентации во времени и пространстве. Ночью пациенты отмечают плохой сон и бессонница, но днем им постоянно хочется спать. Помимо описанных проявлений, люди с печёночной энцефалопатии первой стадии отмечают следующие симптомы:
Таким людям проблематично выполнять в уме даже самые простые математические задачки. Патологические процессы неврологического характера проявляются нарушением координации движений, изменением почерка. У пациентов увеличиваются зрачки, ослаблена зрачковая реакция. Не исключены носовые кровотечения и кожные кровоизлияния. Проявления второй стадииЕсли на первой стадии пациенты испытывали сильное возбуждение, быструю перемену настроения, то здесь наблюдаются такие симптомы:
Отмечаются периодические непродолжительные обмороки. Во время пробуждения пациенты ощущают спутанное сознание, дезориентацию в пространстве, времени. У них поддёргивают мышцы лица, возникают судороги мышц ног и рук. Уменьшаются сухожильные и зрачковые рефлексы. Дыхание становится учащённым, возникает интенсивная желтуха, а из ротовой полости ощущается печёночный запах. При проведении электроэнцефалограммы можно обнаружить резкое торможение ритма, повышение амплитуд волн, возникают тета- и дельта-волны постоянного характера. Проявления третьей стадииУ пациентов происходит выраженное патологическое нарушение сознания в форме оглушенности. При резкой стимуляции у них наступает резкое пробуждение, бывает кратковременное возбуждение, сопровождающееся бредом и галлюцинациями. Характерными проявлениями третьей стадии печёночной энцефалопатии являются:
К неврологическим симптомам недуга можно отнести:
Диагностика недугаДля постановки диагноза используют следующие лабораторные методы:
Эффективная терапияЛечение печёночной энцефалопатии направлено на:
Суть медикаментозного леченияПри назначении терапии при помощи препаратов, врачи руководствуются следующим:
Антибактериальная терапияТакое лечение предполагает приём следующих препаратов:
 Препарат Ванкомицин Приём невсасывающихся дисахаридов и их производныхВ сложившейся ситуации очень важным является достаточное количество лактулозы. Она представляет собой невсасывающий дисахарид. Его применение осуществляется внутрь в виде сиропа. Суточная дозировка составляет 60–120 мл. На первой стадии лечение направлено на то, чтобы вызвать расстройство стула, а после – мягкий стул 2–3 раза в день. Механизм влияния лактулозы включает в себя несколько звеньев:
Лактулоза в сочетании с неомицином или метронидазоломЛактулоза является нетоксичным элементом, поэтому её нужно сочетать с Метронидазолом или Неомицином. Для достижения максимального результата лактулозу и антибактериальные препараты нужно применять в комплексе. Если рН кала меньше 5, то антибактериальные медикаменты не оказывают воздействие на лактулозу. Поэтому врачи советуют периодически проверять этот показатель для точного удостоверения, что дополнительный приём Неомицина не наносит разрушительное действие лактулозе микроорганизмами. На сегодняшний день отсутствует единое мнение насчёт того, что применяемые в/в аминокислотные смеси, насыщенные разветвлёнными аминокислотами, положительно влияют на печёночную энцефалопатию. По причине высокой стоимости таких составов, применять их рекомендуют только тогда, когда другое лечение не оказало необходимой эффективности. При нехватке цинка в организме создаются все благоприятные условия для развития печёночной энцефалопатии. Согласно результатам нескольких проводимых учений, была доказана эффективность сульфата и ацетата цинка. Максимальный эффект этот компонент оказывает при комплексном приёме его с Гистидином. Хирургическая терапия Портокавальное шунтирование Оперативное лечение подразумевает под собой следующие варианты операцией:
Соблюдение диеты Диета при печеночной энцефалопатии Если представленный недуг протекает в тяжёлой форме, то суточное поступление белка с пищей не должно превышать 20–30 г. Продолжительное ограничение белка запрещено. При наступлении улучшения пациенту каждые 3 дня разрешают употреблять белок на 10 г больше. Помимо этого назначается парентеральный ввод препаратов аминокислот с разветвлённой боковой цепью. Санация кишечника проводится при помощи высоких клизм и слабительных медикаментов. ПрогнозПри диагностировании заболевания 0–1 стадия процент выживаемости оставляет 100%; 2 стадия – 60–75%, 3–4 стадия – 30%. При печёночной коме эта цифра составляет 10–20%. Меры профилактикиДля предупреждения развития представленного заболевания необходимо выполнять следующие рекомендации:
Печёночная энцефалопатия – это достаточно серьёзная патология, которая в случае отсутствия соответствующего лечения может привести к печёночной коме. Придерживаясь всех вышеописанных рекомендаций и советов, можно не только избежать этого недуга, но и улучшить своё состояние при постановке такого диагноза. Поделиться статьей: Если Вы считаете, что у вас Печеночная энцефалопатия и характерные для этого заболевания симптомы, то вам может помочь врач гепатолог. Также предлагаем воспользоваться нашим сервисом диагностики заболеваний онлайн, который на основе введенных симптомов подбирает вероятные заболевания. Заболевания со схожими симптомами: Рак головного мозга – недуг, в результате прогрессирования которого в головном мозге формируется опухоль злокачественного характера, прорастающая в его ткани. Патология очень опасная и в большинстве клинических ситуаций заканчивается летальным исходом. Но срок жизни пациента можно значительно продлить, если своевременно выявить первые признаки недуга и обратиться в медицинское учреждение для проведения комплексного лечения. ...Опухоль головного мозга — это заболевание, для которого характерно раковое поражение мозговых оболочек, нервных окончаний, черепа. Этот вид заболевания является очень опасным, так как если запустить его и вовремя не провести операцию, то все приведёт к летальному исходу. ...Транзиторная ишемическая атака (ТИА) — недостаточность мозгового кровообращения вследствие сосудистых нарушений, сердечных болезней и понижения артериального давления. Чаще встречается у лиц, страдающих остеохондрозом шейного отдела позвоночника, кардиальной и сосудистой патологией. Особенность транзиторно возникшей ишемической атаки — это полное восстановление всех выпавших функций в течение 24 часов. ... Уремия (совпадающих симптомов: 6 из 20)Уремия — это процесс отравления организма человека продуктами белкового обмена. Развивается она из-за нарушения нормальной работы почек. Данное состояние иногда называют «самоотравление мочой». Его название с латинского переводится как «моча» и «кровь». Для заболевания характерны патологические изменения, происходящие в системе нервно-гуморальной регуляции организма. Уремия имеет довольно сложный патогенез. ...Солнечный и тепловой удар – состояния, при развитии которых следует незамедлительно начать оказывать помощь пострадавшему, так как существует прямая угроза его жизни. Данные состояния возникают чаще всего в весенне-летний период, когда активность солнца увеличивается в несколько раз. Многие люди утверждают, что и солнечный удар, и тепловой удар, это одно и то же состояние, но это не так. Они имеют некоторые различия. ...simptomer.ru Принципы лечения печеночной энцефалопатииРодительская категория: Заболевания печени Категория: Печеночная энцефалопатия
Лечение печёночной энцефалопатии (табл. 7-5) можно разделить на три основных пункта: 1. Установление и устранение факторов, способствующих развитию печёночной энцефалопатии. 2. Меры, направленные на снижение образования и абсорбции аммиака и других токсинов, образующихся в толстой кишке. Они включают уменьшение количества и модификацию пищевых белков, изменение кишечной микрофлоры и внутрикишечной
Таблица 7-5. Лечение печёночной прекомы и комы
Острая печёночная энцефалопатия: 1. Выявляют факторы, способствующие развитию энцефалопатии. 2. Очищают кишечник от азотсодержащих веществ: а) останавливают кровотечение б) делают фосфатную клизму 3. Назначают безбслковую диету и по мере выздоровления медленно повышают содержание белка в пище 4. Назначают лактулозу или лактитол 5. Назначают неомицин внутрь по 1г 4 раза в сутки в течение 1 нед 6. Поддерживают калорийность пищи, количество жидкости и электролитный баланс 7. Отменяют диуретики, контролируют уровень электролитов в сыворотке крови
Хроническая печёночная энцефалопатия:
1. Избегают применения азотсодержащих лекарств 2. Ограничивают содержание белка в пище в пределах переносимого — около 50 г в сутки, рекомендуя потреблять в основном растительные белки 3. Обеспечивают опорожнение кишечника по меньшей мере 2 раза в день 4. Назначают лактулозу или лактитол 5. При ухудшении состояния переходят на лечение, применяемое при острой энцефалопатии среды (антибиотики, лактулоза или лактитол), стимуляцию опорожнения толстой кишки (клизмы, лактулоза или лактитол). 3. Назначение препаратов, модифицирующих соотношение нейромедиаторов прямым (бромокриптин, флумаземил) или непрямым (аминокислоты с разветвлённой цепью) путём. В настоящее время в клинической практике эти методы применяются мало. Выбор метода лечения зависит от клинической картины: субклинической, острой или персистирующей хронической энцефалопатии.
Рис. 7-10. Многофакторный механизм развития печёночной энцефалопатии. Нарушение нейромедиаторных систем приводит к тому, что головной мозг становится более чувствительным к другим повреждающим факторам, включая наркотики, сепсис, гипоксию и артериальную гипотензию.
ДИЕТА
При острой печёночной энцефалопатии количество пищевых белков необходимо уменьшить до 20 г в сутки. Калорийность пищи поддерживают на уровне 2000 ккал в сутки или выше при приёме внутрь или парентеральном питании. Во время выздоровления содержание белка увеличивают на 10 г через день. При возникновении рецидива энцефалопатии возвращаются к предыдущему уровню белка в пище. У больных, выздоравливающих после острого эпизода комы, содержание белка в пище вскоре доводят до нормы. При хронической энцефалопатии больным необходимо постоянно ограничивать количество пищевых белков во избежание развития психопатологических симптомов [68]. Обычное содержание белка в пище составляет 40—60 г в сутки. Растительные белки переносятся лучше, чем животные [72]. У них меньший аммониегенный эффект и они содержат мало метионина и ароматических аминокислот. Кроме того, растительные белки оказывают более выраженное слабительное действие, при их применении увеличивается поступление пищевых волокон; это ведёт к усилению связывания и выведения азота, содержащегося в бактериях толстой кишки [77]. Приём растительной пищи может быть затруднен из-за развития метеоризма, диареи и вздутия живота. В острых случаях можно полностью исключить из пищи белки на срок от нескольких дней до нескольких недель — это не принесёт вреда больному. Даже при хронической энцефалопатии у больных, у которых потребление пищевых белков ограничивалось в течение многих месяцев, редко встречаются клинические признаки белковой недостаточности. Ограничение белка показано только больным с признаками энцефалопатии. В остальных случаях при заболеваниях печени можно успешно назначать высокобелковую диету; это достигается одновременным применением лактулозы или лактитола.
АНТИБИОТИКИ
Назначаемый перорально неомицин успешно уменьшает образование азотистых соединений в кишечнике [20|. Несмотря на то что только небольшое количество этого препарата всасывается из кишечника, его можно обнаружить в крови больных, поэтому длительное применение неомицина может привести к снижению слуха или глухоте. Его следует назначать только в острых случаях по 4—6 г/сут в несколько приёмов в течение 5—7 дней. При этом улучшение клинического состояния больных сложно связать с изменением фекальной микрофлоры |20|. Метронидазол в дозе 200 мг 4 раза в сутки внутрь, по-видимому, действует так же эффективно, как и неомицин [40]. Его не следует применять в течение длительного времени из-за дозозависимого токсического воздействия на ЦНС. При острой печёночной коме назначают лактулозу, а если её действие наступает медленно или оказывается неполным, добавляют неомицин. Эти два препарата являются синергистами [76], вероятно потому, что воздействуют на разные группы бактерий.
ЛАКТУЛОЗА (рис. 7-11) [8] И ЛАКТИТОЛ (табл. 7-6)
Слизистая оболочка кишечника человека не содержит ферменты, расщепляющие эти синтетические дисахариды. Принимаемая перорально, лактулоза достигает слепой кишки, в которой она расщепляется бактериями с образованием преимущественно молочной кислоты; рН каловых масс понижается. Это способствует росту бактерий, расщепляющих лактозу; при этом рост аммониегенных микроорганизмов, таких как бактероиды, подавляется. Лактулоза может «детоксицировать» жирные кислоты с короткой цепью, образующиеся при наличии крови и белков. В присутствии лактулозы и крови бактерии толстой кишки в основном расщепляют лактулозу [47]. Это имеет особое значение при печёночной энцефалопатии, вызванной кровотечением. При применении лактулозы осмотическое давление в толстой кишке повышается. Механизм действия этого препарата точно не известен. Кислая реакция каловых масс может уменьшить ионизацию и, следовательно, абсорбцию аммиака, а также аминов и других токсичных азотсодержащих соединений; при этом содержание аммиака в кале не возрастает. В толстой кишке лактулоза более чем в 2 раза увеличивает образование бактерий и растворимых соединений азота [77]. В результате азот не абсорбируется в виде аммиака и уменьшается образование мочевины [77]. При назначении лактулозы нужно стремиться к образованию у больного кислого кала без диареи. Препарат назначают в дозе 10—30 мл 3 раза в сутки, что приводит к двукратной дефекации полужидким калом.
Таблица 7-6. Эффективность лактитола по сравнению с лактулозой
Сходное действие в толстой кишке Столь же эффективен при печёночной энцефалопатии Действует более быстро Более удобен в употреблении (порошкообразный) Менее сладкий В меньшей степени вызывает диарею и метеоризм
Рис. 7-11. Лактулоза достигает толстой кишки в неизменённом виде. Там под влиянием бактерий она расщепляется с образованием органических кислот, в результате формируется кислый кал. Этот процесс вызывает ионизацию аммиака в толстой кишке и снижение его всасывания.
Побочные эффекты включают в себя метеоризм, диарею и боли в кишечнике. Диарея может быть настолько сильной, что уровень натрия в сыворотке крови превышает 145 ммоль/л, уровень калия снижается и развивается алкалоз. Объём циркулирующей крови уменьшается, в результате чего нарушается функция почек. Такие осложнения развиваются особенно часто, если суточная доза препарата превышает 100 мл. Некоторые побочные эффекты могут быть связаны с примесью в сиропе лактулозы других Сахаров. Кристаллическая лактулоза может оказаться менее токсичной. Лактитол (бета-галактозидсорбитол) представляет собой второе поколение дисахаридов. Его легко получать в химически чистой кристаллической форме, из которой можно приготовить порошок. Этот препарат не инактивируется и не абсорбируется в тонкой кишке, но расщепляется бактериями толстой кишки [53]. Порошкообразный лактитол более удобен в употреблении, чем жидкая лактулоза, и может быть использован как сахарозаменитель. Он приятнее на вкус и менее приторный. Суточная доза составляет приблизительно 30 г. Лактитол так же эффективен при лечении хронической [44] и острой портосистемной энцефалопатии, как и лактулоза. Лактитол действует быстрее лактулозы и в меньшей степени вызывает диарею и метеоризм [10, 44]. Лактулозу и лактитол используют для лечения субклинической формы печёночной энцефалопатии [46]. При их применении улучшаются результаты психометрических тестов. В дозе 0,3—0,5 г/кг в сутки лактитол хорошо переносится больными и достаточно эффективен [61]. Очищение кишечника при помощи слабительных средств. Печёночная энцефалопатия развивается на фоне запоров, а ремиссии связаны с возобновлением нормального действия кишечника. Поэтому у больных с печёночной энцефалопатией необходимо обратить особое внимание на роль клизм и очищения кишечника сульфатом магния. Можно применять клизмы с лактулозой и лактозой, а после них — с чистой водой [73]. Все клизмы должны быть нейтральными или кислыми, чтобы понизить абсорбцию аммиака. Клизмы с сульфатом магния могут привести к опасной для больного гипермагниемии [15]. Фосфатные клизмы безопасны.
ДРУГИЕ ФАКТОРЫ, СПОСОБСТВУЮЩИЕ РАЗВИТИЮ ЭНЦЕФАЛОПАТИИ
Больные с печёночной энцефалопатией крайне чувствительны к седативным препаратам, поэтому по возможности следует избегать их применения. Если у больного предполагают передозировку таких препаратов, то необходимо ввести соответствующий антагонист. Если больного невозможно удержать в постели и необходимо его успокоить, назначают небольшие дозы темазепама или оксазепама. Морфин и паральдегид абсолютно противопоказаны. Хлордиазепоксид и геминеврин рекомендуют пациентам, страдающим алкоголизмом с надвигающейся печёночной комой. Больным с энцефалопатией противопоказаны препараты, о которых известно, что они могут вызвать печёночную кому (например, аминокислоты и диуретики для применения внутрь). Недостаток калия можно восполнить фруктовыми соками, а также шипучим или медленно растворимым хлоридом калия. При неотложной терапии хлорид калия можно добавить в растворы для внутривенного введения.
ЛЕВОДОФА И БРОМОКРИНТИН
Если портосистемная энцефалопатия связана с нарушением в дофаминергических структурах, то восполнение запасов дофамина в головном мозге должно улучшить состояние больных. Дофамин не проходит через гематоэнцефалический барьер, но это может сделать его предшественник — леводофа. При острой печёночной энцефалопатии этот препарат может оказать временное активирующее действие [37], однако он эффективен только у небольшого числа больных. Бромокриптин представляет собой специфический агонист дофаминовых рецепторов с пролонгированным действием. Назначаемый в дополнение к малобелковой диете и лактулозе, он приводит к улучшению клинического состояния, а также психометрических и электроэнцефалографических данных у больных с хронической портосистемной энцефалопатией [42]. Бромокриптин может оказаться ценным препаратом для отдельных больных с плохо поддающейся лечению хронической портальной энцефалопатией, резистентной к ограничению белка в диете и лактулозе, развившейся на фоне устойчивой компенсации функции печени.
ФЛУМАЗЕНИЛ
Этот препарат является антагонистом бензодиазепиновых рецепторов и вызывает временное, неустойчивое, но отчётливое улучшение состояния приблизительно у 70 % больных с печёночной энцефалопатией, связанной с ФПН или циррозом печени [4, 25]. Рандомизированные исследования подтвердили этот эффект и показали, что флумазенил может препятствовать действию лигандов, агонистов бензодиазепиновых рецепторов, которые образуются in situ в головном мозге при печёночной недостаточности [57]. Роль этой группы препаратов в клинической практике в настоящее время изучается.
АМИНОКИСЛОТЫ С РАЗВЕТВЛЁННОЙ ЦЕПЬЮ
Развитие печёночной энцефалопатии сопровождается изменением соотношения между аминокислотами с разветвлённой цепью и ароматическими аминокислотами. Для лечения острой и хронической печёночной энцефалопатии применяются инфузии растворов, содержащих большую концентрацию аминокислот с разветвлённой цепью. Полученные результаты крайне противоречивы. Это, вероятно, связано с использованием в подобных исследованиях различных типов аминокислотных растворов, разных путей их введения и различиями в группах больных. Анализ контролированных исследований не позволяет однозначно говорить об эффективности внутривенного введения аминокислот с разветвлённой цепью при печёночной энцефалопатии [43]. Принимая во внимание высокую стоимость аминокислотных растворов для внутривенного введения, трудно оправдать их использование при печёночной энцефалопатии в тех случаях, когда уровень аминокислот с разветвлённой цепью в крови высок. Несмотря на отдельные исследования, показывающие, что аминокислоты с разветвлённой цепью, назначаемые внутрь, с успехом применяются при печёночной энцефалопатии [56], эффективность этого дорогостоящего метода остаётся спорной [21, 41].
ОККЛЮЗИЯ ШУНТОВ
Хирургическое устранение портокавального шунта может привести к регрессу тяжелой портосистемной энцефалопатии, развившейся после его наложения. Для того чтобы избежать повторных кровотечений, перед выполнением этой операции можно прибегнуть к пересечению слизистой оболочки пищевода f9]. С другой стороны, шунт можно перекрыть при помощи рентгенохирургических методов с введением баллона [58] или стальной спирали [14]. Эги методы можно также применить для закрьпия спонтанных спленоренальных шунтов [28].
ПРИМЕНЕНИЕ ИСКУССТВЕННОЙ ПЕЧЕНИ
У больных циррозом печени, находящихся в коме, не прибегают к сложным методам лечения с применением искусственной печени. Эти больные либо находятся в терминальном состоянии, либо выходят из комы без этих методов. Лечение с помощью искусственной печени обсуждается в разделе, посвящённом острой печёночной недостаточности (см. главу 8).
ТРАНСПЛАНТАЦИЯ ПЕЧЕНИ
Этот метод может стать окончательным решением проблемы печёночной энцефалопатии. У одного больного, страдавшего энцефалопатией на протяжении 3 лет, в течение 9 мес после трансплантации наблюдалось заметное улучшение [51]. У другого больного с хронической гепатоцеребральной дегенерацией и спастической параплегией состояние значительно улучшилось после ортотопической пересадки печени [59] (см. главу 35).
physiomed.com.ua особенности ведения пациентов на амбулаторном и стационарном этапах00:00 Владимир Трофимович Ивашкин, академик РАМН, доктор медицинских наук: - Сейчас профессор Марина Викторовна Маевская сделает сообщение «Печеночная энцефалопатия». Марина Викторовна Маевская, профессор: - Спасибо, Владимир Трофимович. Добрый день, дорогие коллеги. Печеночная энцефалопатия – это, к сожалению, обычное явление в гастроэнтерологической (более точно, в гипотологической практике). Это одно из основных осложнений цирроза печени, которое встречает каждый врач, сталкивающийся в своей профессиональной жизни с пациентами, страдающими циррозом печени. Печеночная энцефалопатия – это комплекс потенциально обратимых нервно-психических нарушений, которые возникают либо в результате печеночной недостаточности, либо в результате портосистемного шунтирования крови. Как правило, у пациента присутствует тот и другой фактор. В 1998-м году была принята классификация печеночной энцефалопатии, которую мы не очень используем в своей клинической практике. Во всяком случае, мы никогда не выносим как категорию печеночную энцефалопатию класса А, В, С. Если пояснить, что это означает, то печеночная энцефалопатия класса А – это энцефалопатия, которая развивается у пациентов с острой печеночной недостаточностью без цирроза печени. Например, острый вирусный гепатит, протекающий с угнетением функций печени, острый алкогольный гепатит без цирроза печени. Аббревиатура А появилась от слова "acute". Портосистемное шунтирование в отсутствие заболевания печени приводит к развитию печеночной энцефалопатии класса В. То, с чем мы работаем в своей повседневной практике, наиболее частая форма печеночной энцефалопатии – та, которая наблюдается у пациентов с циррозом печени. Гораздо более актуально знать особенности течения печеночной энцефалопатии и соответственно строить свою лечебную практику. Термин «минимальная энцефалопатия» заменил такое понятие как «латентная энцефалопатия. Формы клинически манифестной печеночной энцефалопатии, в основном служат основанием для госпитализации пациентов. Острая, рецидивирующая или хроническая (или персистирующая) энцефалопатия. Она требует непрерывного наблюдения за пациентом и искусства относительно его лечебной тактики. 02:37 Если говорить о том, с какой частотой встречаются различные формы энцефалопатии, то следует сказать, что минимальная энцефалопатия наблюдается по данным разных авторов от 32% до 85% случаев. Чуть позже я более подробно остановлюсь на этой форме энцефалопатии. Это пациент, который, как правило, находится в амбулаторных условиях. У него клинических проявлений энцефалопатии нет. Но есть определенные аспекты жизни, которые представляют и весьма достойны пристального врачебного внимания. Клинически выраженная энцефалопатия у пациентов с циррозом печени встречается почти у половины и очень часто служит поводом для госпитализации. Печеночная энцефалопатия – это клинический эквивалент печеночной недостаточности. Она определяет жизненный прогноз пациента. Около 42% пациентов живут в течение первого года появления этого осложнения. Трехлетняя выживаемость этих пациентов составляет всего 23%. Мы больше привыкли в своей клинической работе к разделению печеночной энцефалопатии на следующие стадии: 1, 2, 3 и 4. Это фигурирует в нашем клиническом диагнозе. Стадии 1, 2, 3 и 4 отражают степень нарушения сознания и других (в том числе интеллектуальных и ментальных) функций у пациентов с циррозом печени с клинически выраженной энцефалопатией. Стадия 1 – нарушение ритма сна, сонливость, снижение концентрации внимания. Пациент нуждается в дополнительном времени для того, чтобы отвечать на вопросы. Стадия 2 – летаргия или апатия. Стадия 3 – это уже сомноленция и дезориентация. Очень редко пациенты с циррозом и энцефалопатией бывают агрессивными. Но это тоже встречается в нашей практике. Стадия 4 – это печеночная кома. Минимальная энцефалопатия (раньше ее называли латентной энцефалопатией) требует применения психометрических тестов для того, чтобы этот диагноз можно было поставить. Если пытаться количественно выразить степень глубины энцефалопатии, то при стадии 3 и 4 можно использовать шкалу для оценки глубины комы Глазго. Она включает в себя такие критерии как открывание глаз от спонтанного до отсутствия вообще какого-то ответа и измерения в баллах этого признака, речь и движение. Сумма колеблется от 3-х до 15-ти баллов. Чем меньше сумма по шкале Глазго, тем хуже прогноз пациента, тем глубже нарушение его сознания. 05:47 (Демонстрация слайда). Тест связи чисел хорошо знаком тем, кто работает с пациентами, страдающими циррозом печени. Он стандартизован. Его количественное выражение представлено на слайде справа. Делается поправка на возраст пациента. Прежде чем оценивать тест связи чисел, пациенту обязательно нужно дать возможность потренироваться, потому что это тоже влияет на скорость его выполнения. Первый раз он соединяет цифры в том порядке, в котором это положено – это тренировочный тест. Когда он это делает повторно, то уже оценивается время. Но расположение цифр должно быть другим. Клинически выраженная энцефалопатия – это, как правило, пациент стационарный. Минимальная энцефалопатия (или латентная, как ее называли раньше) – пациент амбулаторный. Соответственно, принципы лечения и наблюдения за этими пациентами немного отличаются. Но, когда речь идет об энцефалопатии, самое важное – устранение разрешающего фактора. Разрешающие факторы могут быть разными. Это может быть какая-то инфекция (вплоть до острой вирусной инфекции). Это может быть кровотечение. Может быть любая стрессовая ситуация для организма. Очень важно контролировать какие-то сопутствующие патологические состояния, которые часто встречаются при циррозе печени. Это электролитные нарушения. Я помню, что когда у нас была монотематическая конференция по циррозу печени в 2009-м году в Суздале, Владимир Трофимович Ивашкин читал лекцию по гипонатриемии при циррозе печени. У пациентов с циррозом гипонатриемия разведения может иметь разную природу и сама по себе вызывать нарушение сознания, весьма серьезные и глубокие. В тот период времени Владимир Трофимович уделял в своей лекции время дифференциальному диагнозу энцефалопатии при циррозе. Это результат электролитных нарушений или проявления печеночной недостаточности (гипогликемия, уремия). Все это может вносить свой вклад в развитие энцефалопатии. 08:09 Если мы фиксируем печеночную энцефалопатию, мы должны очень быстро начинать эмпирическую терапию. На сегодняшний день для эмпирической терапии печеночной энцефалопатии существует три препарата, которые мы используем либо последовательно, либо одновременно. Это «Лактулоза» ("Lactulose"), «Рифаксимин» ("Rifaximin") и «L-орнитин-L-аспартат». Каждый из этих препаратов имеет собственную точку приложения. Подавление продукции аммония. Аммоний продуцируется протеолитической кишечной флорой. Для того чтобы подавить разложение этой флоры и уменьшить продукцию аммония, используются антибиотики и дисахариды. Дисахариды – это «Лактулоза», «Лактитол» ("Lactitol"). На рынке в России присутствует только «Лактулоза». Воздействие на метаболизм аммония. Для этого используется препарат «L-орнитин-L-аспартат». Это препарат «Гепа-Мерц» ("Gepa-Merc"). Все другие препараты в клинической практике не используются. Но о них нужно знать. «Лактулоза» на протяжении десятилетий входит в стандарт лечения печеночной энцефалопатии. При циррозе печени она используется перорально, в клизмах, вводится через назогастральный зонд. Ее эффективность исследовалась в мета-анализах, в Кохрейновских обзорах. На сегодняшний день постулировано, что это препарат, который относится к препаратам первой линии в лечении печеночной энцефалопатии. Антибиотики в лечении энцефалопатии при циррозе печени тоже используются очень давно. Многие годы назад в клинической практике применялся «Неомицин» ("Neomycin"), «Канамицин» ("Kanamycin"), которые обладают ототоксичностью, нефротоксичностью. Сейчас их вытеснили совсем другие препараты, более эффективные, невсасывающиеся и имеющие очень широкий спектр действия. К таким препаратам относится «Рифаксимин», который в 2009- м году был одобрен FDA как препарат (в том числе первой линии) выбора для лечения печеночной энцефалопатии. Это очень разумно, потому что в патогенезе практически всех осложнений цирроза печени (в том числе печеночной энцефалопатии) играет роль бактериальная транслокация. Это происходит на фоне застойных явлений в тонкой и в толстой кишке. В условиях портальной гипертензии бактериальная транслокация выступает как пусковой фактор порочного круга. Играет роль в развитии гепаторенального синдрома, варикозных кровотечений (которые, казалось бы, далеки от этого феномена) и, естественно, печеночной энцефалопатии. Изучение эффективности антибиотиков представляется весьма рациональным в этих условиях. 11:26 На сегодняшний день среди них лидирует «Рифаксимин». Этот антибиотик является производным «Рифампицина» ("Rifampicin"). Он подавляет ДНК-зависимую РНК-полимеразу и угнетает синтез РНК и различных белков бактерий. У него широкий спектр действия. Он влияет как на анаэробную, так и аэробную флору, как грамположительную, так и грамотрицательную. Рациональность для использования какого-либо препарата и результаты клинических исследований – это два процесса, которые идут параллельно, но не всегда взаимно дополняют друг друга. В данной ситуации можно сделать ссылки на весьма убедительные клинические исследования. Одно было опубликовано в 2007-м году. Это исследование было посвящено ретроспективному анализу истории болезни пациентов с циррозом и энцефалопатией в одном лечебном центре. Части пациентов назначалась «Лактулоза». Части пациентов – «Рифаксимин» на протяжении 6-ти месяцев. Было показано, что за период приема этих препаратов на фоне лечения «Рифаксимином» количество госпитализаций пациентов из-за рецидива печеночной энцефалопатии и сам по себе период госпитализации (когда речь шла о стационарных пациентах) были достоверно меньше. Минимальная печеночная энцефалопатия. Последний результат говорит о том, что пациенты с минимальной печеночной энцефалопатией – это объект для исследования. Минимальная энцефалопатия клинически, как правило, не проявляется. Но она может переходить в клинически манифестную энцефалопатию и служить поводом для госпитализации пациента и экономических затрат. 13:23 Тем не менее, пациенты с минимальной энцефалопатией, когда она выявляется только с использованием специальных тестов, в обычных условиях с точки зрения врача имеют определенные особенности. У них снижены внимание и память. Снижена концентрация внимания. Они послужили объектом исследования в очень интересном аспекте. Исследование, результаты которого были опубликованы в 2004-м году, было призвано оценить их способность к вождению автомобиля. Этих пациентов разделили на 2 группы. Часть пациентов была с минимальной энцефалопатией. Часть без печеночной энцефалопатии вообще, но с циррозом печени. В результате было показано, что пациенты с минимальной энцефалопатией и группой контроля вели себя за рулем совершенно по-другому. Правильно оценивать ситуацию, адаптироваться в сложной дорожной ситуации, хорошо концентрировать свое внимание на дороге пациенты с минимальной энцефалопатией не могли. Их было 14 человек. В пяти случаях потребовалось вмешательство инструктора, чтобы предотвратить дорожно-транспортное происшествие. Пациенты с циррозом, у которых признаков минимальной энцефалопатии не было, никоим образом по своему водительскому мастерству не отличались от группы контроля (группы здоровых). Не буду здесь приводить, чтобы не терять время, ужасные клинические наблюдения, которые связаны с этим аспектом. Но это исследование лишний раз иллюстрирует то, что пациент с циррозом печени должен очень тщательно мониторироваться на амбулаторном этапе. Минимальную энцефалопатию тоже нужно лечить. Это иллюстрируют результаты исследования, которое было опубликовано в любимом журнале нашего руководителя Владимира Трофимовича Ивашкина "The New England Journal of Medecine". Оценивалась эффективность «Рифаксимина» для лечения минимальной энцефалопатии у пациентов на амбулаторном этапе. Курс лечения тоже составил 6 месяцев. Для того чтобы предотвратить вопрос, хочу сказать, что пациенты непрерывно получали «Рифаксимин» в течение 6-ти месяцев в дозе 1100 мг в сутки. Было показано, что у пациентов на фоне приема «Рифаксимина» по сравнению с группой, которая принимала плацебо, количество рецидивов и госпитализаций из-за обострения энцефалопатии было достоверно меньше. В заключение мне бы хотелось сказать, что «Рифаксимин» достоверно эффективнее поддерживает ремиссию печеночной энцефалопатии в сравнении с плацебо. Достоверно уменьшает риск госпитализации пациентов из-за рецидивов энцефалопатии. Суммируя все, о чем я говорила, нужно акцентировать внимание на том, что энцефалопатия – это неблагоприятный фактор прогноза для больных циррозом печени. Ранняя диагностика, правильное и своевременное лечение энцефалопатии могут предупредить прогрессирование этого осложнения вплоть до комы. Диагностика и лечение минимальной энцефалопатии, лечение, в частности с использованием «Рифаксимина», позволяет снизить риск рецидива клинически манифестной энцефалопатии, риск повторных госпитализаций. Это очень важно в экономическом аспекте. Спасибо за внимание. internist.ru Печеночная энцефалопатия - Лечение | Компетентно о здоровье на iLiveЛечение печёночной энцефалопатии можно разделить на три основных пункта:
Лечение печёночной прекомы и комы Острая печёночная энцефалопатия:
Хроническая печёночная энцефалопатия:
Выбор метода лечения зависит от клинической картины: субклинической, острой или персистирующей хронической энцефалопатии Диета При острой печёночной энцефалопатии количество пищевых белков необходимо уменьшить до 20 г в сутки. Калорийность пищи поддерживают на уровне 2000 ккал в сутки или выше при приёме внутрь или парентеральном питании. Во время выздоровления содержание белка увеличивают на 10 г через день. При возникновении рецидива энцефалопатии возвращаются к предыдущему уровню белка в пище. У больных, выздоравливающих после острого эпизода комы, содержание белка в пище вскоре доводят до нормы. При хронической энцефалопатии больным необходимо постоянно ограничивать количество пищевых белков во избежание развития психопатологических симптомов. Обычное содержание белка в пище составляет 40-60 г в сутки. Растительные белки переносятся лучше, чем животные. У них меньший аммониегенный эффект и они содержат мало метионина и ароматических аминокислот. Кроме того, растительные белки оказывают более выраженное слабительное действие, при их применении увеличивается поступление пищевых волокон; это ведёт к усилению связывания и выведения азота, содержащегося в бактериях толстой кишки. Приём растительной пищи может быть затруднен из-за развития метеоризма, диареи и вздутия живота. В острых случаях можно полностью исключить из пищи белки на срок от нескольких дней до нескольких недель - это не принесёт вреда больному. Даже при хронической энцефалопатии у больных, у которых потребление пищевых белков ограничивалось в течение многих месяцев, редко встречаются клинические признаки белковой недостаточности. Ограничение белка показано только больным с признаками энцефалопатии. В остальных случаях при заболеваниях печени можно успешно назначать высокобелковую диету; это достигается одновременным применением лактулозы или лактитола. Антибиотики Назначаемый перорально неомицин успешно уменьшает образование азотистых соединений в кишечнике. Несмотря на то что только небольшое количество этого препарата всасывается из кишечника, его можно обнаружить в крови больных, поэтому длительное применение неомицина может привести к снижению слуха или глухоте. Его следует назначать только в острых случаях по 4-6 г/сут в несколько приёмов в течение 5-7 дней. При этом улучшение клинического состояния больных сложно связать с изменением фекальной микрофлоры. Метронидазол в дозе 200 мг 4 раза в сутки внутрь, по-видимому, действует так же эффективно, как и неомицин. Его не следует применять в течение длительного времени из-за дозозависимого токсического воздействия на ЦНС. При острой печёночной коме назначают лактулозу, а если её действие наступает медленно или оказывается неполным, добавляют неомицин. Эти два препарата являются синергистами, вероятно потому, что воздействуют на разные группы бактерий. Лактулоза и лактитол Слизистая оболочка кишечника человека не содержит ферменты, расщепляющие эти синтетические дисахариды. Принимаемая перорально, лактулоза достигает слепой кишки, в которой она расщепляется бактериями с образованием преимущественно молочной кислоты; рН каловых масс понижается. Это способствует росту бактерий, расщепляющих лактозу; при этом рост аммониегенных микроорганизмов, таких как бактероиды, подавляется. Лактулоза может «детоксицировать» жирные кислоты с короткой цепью, образующиеся при наличии крови и белков. В присутствии лактулозы и крови бактерии толстой кишки в основном расщепляют лактулозу. Это имеет особое значение при печёночной энцефалопатии, вызванной кровотечением. При применении лактулозы осмотическое давление в толстой кишке повышается. Механизм действия этого препарата точно не известен. Кислая реакция каловых масс может уменьшить ионизацию и, следовательно, абсорбцию аммиака, а также аминов и других токсичных азотсодержащих соединений; при этом содержание аммиака в кале не возрастает. В толстой кишке лактулоза более чем в 2 раза увеличивает образование бактерий и растворимых соединений азота. В результате азот не абсорбируется в виде аммиака и уменьшается образование мочевины. При назначении лактулозы нужно стремиться к образованию у больного кислого кала без диареи. Препарат назначают в дозе 10-30 мл 3 раза в сутки, что приводит к двукратной дефекации полужидким калом. Эффективность лактитола по сравнению с лактулозой
Побочные эффекты включают в себя метеоризм, диарею и боли в кишечнике. Диарея может быть настолько сильной, что уровень натрия в сыворотке крови превышает 145 ммоль/л, уровень калия снижается и развивается алкалоз. Объём циркулирующей крови уменьшается, в результате чего нарушается функция почек. Такие осложнения развиваются особенно часто, если суточная доза препарата превышает 100 мл. Некоторые побочные эффекты могут быть связаны с примесью в сиропе лактулозы других Сахаров. Кристаллическая лактулоза может оказаться менее токсичной. Лактитол (бета-галактозидсорбитол) представляет собой второе поколение дисахаридов. Его легко получать в химически чистой кристаллической форме, из которой можно приготовить порошок. Этот препарат не инактивируется и не абсорбируется в тонкой кишке, но расщепляется бактериями толстой кишки. Порошкообразный лактитол более удобен в употреблении, чем жидкая лактулоза, и может быть использован как сахарозаменитель. Он приятнее на вкус и менее приторный. Суточная доза составляет приблизительно 30 г. Лактитол так же эффективен при лечении хронической и острой портосистемной энцефалопатии, как и лактулоза. Лактитол действует быстрее лактулозы и в меньшей степени вызывает диарею и метеоризм. Лактулозу и лактитол используют для лечения субклинической формы печёночной энцефалопатии. При их применении улучшаются результаты психометрических тестов. В дозе 0,3-0,5 г/кг в сутки лактитол хорошо переносится больными и достаточно эффективен. Очищение кишечника при помощи слабительных средств. Печёночная энцефалопатия развивается на фоне запоров, а ремиссии связаны с возобновлением нормального действия кишечника. Поэтому у больных с печёночной энцефалопатией необходимо обратить особое внимание на роль клизм и очищения кишечника сульфатом магния. Можно применять клизмы с лактулозой и лактозой, а после них - с чистой водой. Все клизмы должны быть нейтральными или кислыми, чтобы понизить абсорбцию аммиака. Клизмы с сульфатом магния могут привести к опасной для больного гипермагниемии. Фосфатные клизмы безопасны. ilive.com.ua Печеночная энцефалопатия - причины, симптомы, диагностика и лечениеПеченочная энцефалопатия – одно из наиболее тяжелых осложнений печеночной недостаточности, заключающееся в токсическом поражении ЦНС и проявляющееся изменениями личности, снижением интеллекта, депрессией, неврологическими и эндокринными расстройствами. Для установления диагноза проводят биохимические пробы печени, УЗИ печени и желчного пузыря, МРТ и КТ печени и желчевыводящих путей, электроэнцефалографию. Лечение печеночной энцефалопатии включает диетотерапию, эрадикацию инфекционного агента, очищение кишечника, подавление кишечной микрофлоры, симптоматические мероприятия. Печеночная энцефалопатия при заболеваниях печени встречается не так уж часто, однако имеет очень тяжелый исход – до 80% случаев печеночной комы заканчиваются смертью пациента. Гепатологи отмечают интересный факт: развитие энцефалопатии на фоне острой печеночной недостаточности практически всегда является фактором, исключающим цирроз печени в будущем. При хронических поражениях печени это осложнение развивается гораздо чаще, чем при острых; является потенциально обратимым, но при этом оказывает значительное влияние на социальную активность и трудоспособность пациента. Патогенез и механизмы развития ПЭ на сегодняшний день до конца не изучены, исследованием этой проблемы занимаются ведущие специалисты в области гастроэнтерологии. Раскрытие механизмов развития печеночной энцефалопатии приведет к разработке патогенетического лечения и позволит снизить смертность от этого грозного осложнения печеночной недостаточности. Причины печеночной энцефалопатииВыделяют несколько типов печеночной энцефалопатии, в зависимости от причин ее развития: ПЭ, связанная с острой печеночной недостаточностью, с попаданием в кровоток кишечных нейротоксинов, с циррозом печени. Факторами развития острой печеночной недостаточности с печеночной энцефалопатией могут служить острые вирусные гепатиты, алкогольный гепатит, рак печени, другие заболевания, сопровождающиеся гепатоцитолизом, лекарственные и другие интоксикации. Причиной попадания в кровоток кишечных нейротоксинов может быть активное и чрезмерное размножение облигатной флоры кишечника, употребление слишком больших количеств белковой пищи. Цирроз печени с развитием печеночной энцефалопатии характеризуется замещением нормально функционирующих гепатоцитов соединительной рубцовой тканью с угнетением всех печеночных функций. Запустить процесс гибели гепатоцитов и токсического поражения головного мозга могут следующие факторы: кровотечения из желудка и кишечника, злоупотребление алкоголем, неконтролируемый прием медикаментов, постоянные запоры, избыточное употребление белка, инфекции, операции, развитие перитонита на фоне асцита. При печеночной недостаточности в организме развивается целый комплекс патологических нарушений: изменение КОС и водно-электролитного состояния крови, гемостаза, онкотического и гидростатического давления и т. д. Все эти изменения значительно нарушают работу таких клеток, как астроциты, которые представляют собой треть всей клеточной массы головного мозга. На астроциты возложена функция регуляции проницаемости барьера между тканью головного мозга и кровью, обезвреживания токсинов, обеспечения поступления в клетки мозга электролитов и нейротрансмиттеров. Постоянное воздействие на астроциты аммиака, в избытке поступающего в кровоток при печеночной недостаточности, приводит к ухудшению их функционирования, повышению ликворопродукции, развитию внутричерепной гипертензии и отека головного мозга. Кроме аммиака, токсическое воздействие на астроциты способны оказывать ложные нейротрансмиттеры, жирные кислоты и аминокислоты, магний, продукты распада углеводородов и жиров. Симптомы печеночной энцефалопатииВ клинической картине печеночной энцефалопатии выделяют различные неврологические и психические нарушения. Обычно к ним относят расстройства сознания (патологическая сонливость, фиксация взгляда, заторможенность с последующим развитием сопора, комы), нарушения сна (в дневное время пациент патологически сонлив, а в ночное предъявляет жалобы на бессонницу), нарушения поведения (раздражительность, эйфория, безучастность, апатия), интеллекта (забывчивость, рассеянность, нарушения письма), монотонность речи. Появление либо усиление сладковатого печеночного запаха изо рта связано с нарушением метаболизма меркаптанов (продуктов жизнедеятельности кишечной флоры) в печени, в связи с чем они начинают выводиться через дыхательные пути. У многих пациентов признаком печеночной энцефалопатии является астериксис – несимметричные крупноразмашистые аритмичные подергивания, возникающие в мышцах конечностей, туловища и шеи при их тоническом напряжении. Обычно астериксис выявляется при вытягивании рук вперед, напоминает суетливые движения кистей и пальцев. Достаточно часто при печеночной энцефалопатии поражается терморегуляционный центр, из-за чего может отмечаться пониженная или повышенная температура, либо же чередование эпизодов гипотермии и гипертермии. По течению выделяют острую и хроническую форму печеночной энцефалопатии. Острая энцефалопатия развивается очень быстро и может приводить к развитию комы в течение нескольких часов или дней. Хроническая форма развивается медленно, иногда в течение нескольких лет. В своем развитии печеночная энцефалопатия проходит несколько стадий. В начальной стадии (субкомпенсации) появляются незначительные изменения психики (апатия, бессонница, раздражительность), сопровождающиеся иктеричностью кожи и слизистых. На стадии декомпенсации изменения психики усугубляются, пациент становится агрессивным, появляется астериксис. Возможны обмороки, неадекватность поведения. В терминальной стадии происходит угнетение сознания вплоть до сопора, однако реакция на болевые раздражители еще сохраняется. Последняя стадия печеночной энцефалопатии – кома, реакция на раздражители отсутствует, развиваются судороги. На этой стадии погибает девять из десяти пациентов. Диагностика печеночной энцефалопатииЦелью диагностики при печеночной энцефалопатии служит выявление ее симптомов, установление степени тяжести и стадии заболевания. Большое значение для выявления печеночной энцефалопатии имеет правильно собранный анамнез (упоминание о перенесенных вирусных гепатитах, злоупотреблении алкоголем, бесконтрольном приеме медикаментов). Консультация гастроэнтеролога должна быть проведена как можно раньше, и данный специалист обязан уделить достаточно внимания неврологической симптоматике и признакам расстройств психики. Следует помнить, что появление симптомов поражения стволовых структур мозга у пациентов в коме говорит о возможности летального исхода в ближайшие часы. Проводят общий анализ крови (выявляет анемию, снижение количества тромбоцитов, лейкоцитоз с токсической зернистостью нейтрофилов), исследуют коагулограмму (из-за угнетения белково-синтезирующей функции печени развивается коагулопатия дефицита, затем ДВС-синдром), печеночные пробы (отмечается повышение активности трансаминаз, ЩФ, Г-ГТП, растет уровень билирубина). При необходимости возможно проведение других лабораторных тестов, которые укажут на поражение внутренних органов (полиорганную недостаточность). Для выяснения степени поражения печени могут потребоваться такие неинвазивные исследования, как УЗИ печени и желчного пузыря, МРТ печени и желчевыводящих путей, КТ желчевыводящих путей. Обязательно производится пункционная биопсия печени для выяснения точной причины печеночной недостаточности. Оценка степени поражения головного мозга осуществляется с помощью электроэнцефалографии. Дифференциальный диагноз печеночной энцефалопатии проводят с другими (внепеченочными) причинами поражения головного мозга: внутричерепная катастрофа (геморрагический инсульт, кровоизлияние в желудочки мозга, разрыв аневризмы церебральных сосудов и пр.), инфекции ЦНС, метаболические расстройства, внепеченочные причины повышения уровня азота в крови; алкогольные, лекарственные и послесудорожные энцефалопатии. Лечение печеночной энцефалопатииТерапия печеночной энцефалопатии является сложной задачей, и начинать ее нужно с устранения причин этого состояния, лечения острой либо хронической печеночной недостаточности. В схему лечения печеночной энцефалопатии включают диетотерапию, очищение кишечника, снижение уровня азота, симптоматические мероприятия. Следует снизить количество поступающего с пищей белка до 1г/кг/сут. (при условии переносимости такого рациона пациентом) на достаточно длительное время, так как у некоторых больных возврат к нормальному содержанию белка вызывает повторное появление клиники печеночной энцефалопатии. На время диеты назначаются препараты аминокислот, ограничивается содержание соли. Для обеспечения эффективного выведения аммиака с калом необходимо достигнуть опорожнения кишечника не менее двух раз за сутки. С этой целью производятся регулярные очистительные клизмы, назначаются препараты лактулозы (их прием необходимо продолжить и на этапе амбулаторного лечения). Также улучшает утилизацию аммиака орнитин, сульфат цинка. Антибактериальная терапия включает назначение препаратов широкого спектра действия, проявляющих активность преимущественно в просвете кишечника (неомицин, ванкомицин, метронидазол и др.). С седативной целью при печеночной энцефалопатии нежелательно назначать препараты бензодиазепинового ряда, предпочтение отдают галоперидолу. Течение печеночной энцефалопатии может осложниться отеком головного мозга, кровотечениями, аспирационной пневмонией, панкреатитом; поэтому лечение пациентов на 3-4 стадии заболевания должно осуществляться в отделении реанимации. Прогноз и профилактика печеночной энцефалопатииПрогноз при печеночной энцефалопатии зависит от нескольких факторов, но в целом неблагоприятный. Выживаемость лучше в случаях, когда энцефалопатия развилась на фоне хронической печеночной недостаточности. При циррозе печени с печеночной энцефалопатией прогноз ухудшается при наличии желтухи, асцита, пониженного уровня белка в крови. При острой печеночной недостаточности прогноз хуже у детей до 10 лет и взрослых после 40 лет, на фоне вирусного гепатита, желтухи и гипопротеинемии. Летальность на 1-2 стадиях печеночной энцефалопатии 35%, на 3-4 стадии – 80%. Профилактика данной патологии заключается в отказе от алкоголя и неконтролируемого приема медикаментов, лечении заболеваний, которые приводят к развитию печеночной энцефалопатии. www.krasotaimedicina.ru Лечение печёночной энцефалопатииЛечение печёночной энцефалопатии можно разделить на три основных пункта:
Выбор метода лечения зависит от клинической картины: субклинической, острой или персистирующей хронической энцефалопатии. Острая печёночная энцефалопатия:
Хроническая печёночная энцефалопатия:
ДиетаПри острой печёночной энцефалопатии количество пищевых белков необходимо уменьшить до 20 г в сутки. Калорийность пищи поддерживают на уровне 2000 ккал в сутки или выше при приёме внутрь или парентеральном питании. Во время выздоровления содержание белка увеличивают на 10 г через день. При возникновении рецидива энцефалопатии возвращаются к предыдущему уровню белка в пище. У больных, выздоравливающих после острого эпизода комы, содержание белка в пище вскоре доводят до нормы. При хронической энцефалопатии больным необходимо постоянно ограничивать количество пищевых белков во избежание развития психопатологических симптомов. Обычное содержание белка в пище составляет 40-60 г в сутки. Растительные белки переносятся лучше, чем животные. У них меньший аммониегенный эффект и они содержат мало метионина и ароматических аминокислот. Кроме того, растительные белки оказывают более выраженное слабительное действие, при их применении увеличивается поступление пищевых волокон; это ведёт к усилению связывания и выведения азота, содержащегося в бактериях толстой кишки. Приём растительной пищи может быть затруднен из-за развития метеоризма, диареи и вздутия живота. В острых случаях можно полностью исключить из пищи белки на срок от нескольких дней до нескольких недель - это не принесёт вреда больному. Даже при хронической энцефалопатии у больных, у которых потребление пищевых белков ограничивалось в течение многих месяцев, редко встречаются клинические признаки белковой недостаточности. Ограничение белка показано только больным с признаками энцефалопатии. В остальных случаях при заболеваниях печени можно успешно назначать высокобелковую диету; это достигается одновременным применением лактулозы или лактитола. АнтибиотикиНазначаемый перорально неомицин успешно уменьшает образование азотистых соединений в кишечнике. Несмотря на то что только небольшое количество этого препарата всасывается из кишечника, его можно обнаружить в крови больных, поэтому длительное применение неомицина может привести к снижению слуха или глухоте. Его следует назначать только в острых случаях по 4-6 г/сут в несколько приёмов в течение 5-7 дней. При этом улучшение клинического состояния больных сложно связать с изменением фекальной микрофлоры. Метронидазол в дозе 200 мг 4 раза в сутки внутрь, по-видимому, действует так же эффективно, как и неомицин. Его не следует применять в течение длительного времени из-за дозозависимого токсического воздействия на ЦНС. При острой печёночной коме назначают лактулозу, а если её действие наступает медленно или оказывается неполным, добавляют неомицин. Эти два препарата являются синергистами, вероятно потому, что воздействуют на разные группы бактерий. Лактулоза и лактитолСлизистая оболочка кишечника человека не содержит ферменты, расщепляющие эти синтетические дисахариды. Принимаемая перорально, лактулоза достигает слепой кишки, в которой она расщепляется бактериями с образованием преимущественно молочной кислоты; рН каловых масс понижается. Это способствует росту бактерий, расщепляющих лактозу; при этом рост аммониегенных микроорганизмов, таких как бактероиды, подавляется. Лактулоза может «детоксицировать» жирные кислоты с короткой цепью, образующиеся при наличии крови и белков. В присутствии лактулозы и крови бактерии толстой кишки в основном расщепляют лактулозу. Это имеет особое значение при печёночной энцефалопатии, вызванной кровотечением. При применении лактулозы осмотическое давление в толстой кишке повышается. Механизм действия этого препарата точно не известен. Кислая реакция каловых масс может уменьшить ионизацию и, следовательно, абсорбцию аммиака, а также аминов и других токсичных азотсодержащих соединений; при этом содержание аммиака в кале не возрастает. В толстой кишке лактулоза более чем в 2 раза увеличивает образование бактерий и растворимых соединений азота. В результате азот не абсорбируется в виде аммиака и уменьшается образование мочевины. При назначении лактулозы нужно стремиться к образованию у больного кислого кала без диареи. Препарат назначают в дозе 10-30 мл 3 раза в сутки, что приводит к двукратной дефекации полужидким калом. Побочные эффекты включают в себя метеоризм, диарею и боли в кишечнике. Диарея может быть настолько сильной, что уровень натрия в сыворотке крови превышает 145 ммоль/л, уровень калия снижается и развивается алкалоз. Объём циркулирующей крови уменьшается, в результате чего нарушается функция почек. Такие осложнения развиваются особенно часто, если суточная доза препарата превышает 100 мл. Некоторые побочные эффекты могут быть связаны с примесью в сиропе лактулозы других сахаров. Кристаллическая лактулоза может оказаться менее токсичной. Лактитол (бета-галактозидсорбитол) представляет собой второе поколение дисахаридов. Его легко получать в химически чистой кристаллической форме, из которой можно приготовить порошок. Этот препарат не инактивируется и не абсорбируется в тонкой кишке, но расщепляется бактериями толстой кишки. Порошкообразный лактитол более удобен в употреблении, чем жидкая лактулоза, и может быть использован как сахарозаменитель. Он приятнее на вкус и менее приторный. Суточная доза составляет приблизительно 30 г. Лактитол так же эффективен при лечении хронической и острой портосистемной энцефалопатии, как и лактулоза. Лактитол действует быстрее лактулозы и в меньшей степени вызывает диарею и метеоризм. Лактулозу и лактитол используют для лечения субклинической формы печёночной энцефалопатии. При их применении улучшаются результаты психометрических тестов. В дозе 0,3-0,5 г/кг в сутки лактитол хорошо переносится больными и достаточно эффективен. Очищение кишечника при помощи слабительных средств. Печёночная энцефалопатия развивается на фоне запоров, а ремиссии связаны с возобновлением нормального действия кишечника. Поэтому у больных с печёночной энцефалопатией необходимо обратить особое внимание на роль клизм и очищения кишечника сульфатом магния. Можно применять клизмы с лактулозой и лактозой, а после них - с чистой водой. Все клизмы должны быть нейтральными или кислыми, чтобы понизить абсорбцию аммиака. Клизмы с сульфатом магния могут привести к опасной для больного гипермагниемии. Фосфатные клизмы безопасны. liver.su Печеночная энцефалопатия: симптомы и лечениеПеченочной энцефалопатией называется поражение центральной нервной системы аммиаком и другими токсинами кишечника. Заболевание является осложнением печеночной недостаточности, цирроза печени, вирусного гепатита. У больных наблюдается снижение интеллектуальных способностей, изменение личности, депрессивное состояние, расстройства эндокринной и неврологической системы. Недуг в 80% случаев имеет неблагоприятный исход, приводит к развитию комы, может закончиться летальным исходом. Причины патологииС учетом этиологии классифицирует несколько форм печеночной энцефалопатии:
 Патогенез печеночной энцфалопатии При острой печеночной недостаточности изменяется кислотно-основное состояние крови, водно-электролитный баланс, гемостаз, осмотическое давление. Подобное нарушение оказывает пагубное влияние на клетки-астроциты, обеспечивающие барьерную функцию между головным мозгом и кровью, обезвреживающие токсины. При печеночной энцефалопатии в кровь попадает большое количество аммиака, жирных кислот, углеводов, липидных соединений, продуктов распада, эти вещества способствует увеличению объема ликвора, повышению внутричерепного давления, вызывают отек мозга. Печеночная энцефалопатия может иметь эпизодический характер и спонтанно разрешаться или длится на протяжении нескольких лет. Подобные симптомы наблюдаются у больных циррозом. ПатогенезАммиак образуется в толстой кишке, мышцах, почках и печени. В норме это вещество вместе с кровотоком попадает в печень, где превращается в мочевину. Благодаря орнитиновому циклу предотвращается абсорбцию токсинов в системный кровоток. При печеночной энцефалопатии эти процессы нарушаются, снижается скорость метаболизма аммиака. Еще одни путь, по которому токсину могут попадать в ЦНС – это портокавальные анастомозы, идущие в обход печени. Отравляющие вещества проникают через гемоэнцефалический барьер, стимулируют выработку глутамина, снижают скорость окисления глюкозы, при этом возникает энергетическое голодание мозговых структур. Избыток глутамина вызывает образование отека. Кроме аммиака, в ЦНС попадают аминокислоты. Они накапливаются в тканях головного мозга, что вызывает торможение ферментной системы, происходит угнетение ЦНС, истощаются функции мозга, развивается энцефалопатия. Для ПЭ характерно снижение соотношения аминокислот в крови и ликворе. У здоровых людей оно соответствует 3–3,5, а при печеночной энцефалопатии могут наблюдаться значения 1,5 и ниже. Гамма-аминомасляная кислота – это основной тормозной нейромедиатор головного мозга, участвующий в метаболических процессах, связывающийся со специфическими рецепторами и барбитуратами. Блокирование этих молекулярных комплексов приводит к открытию каналов ионов хлора. При токсической атаке происходит накопление хлора, тормозится проводимость нервных импульсов. ГАМК в плазме крови у больных печеночной энцефалопатией повышен. После вирусного гепатита изменяется строение клеток печени, нарушается микроциркуляция крови в органе, развивается дистрофия и гибель гепацитов.
Аммиак и другие токсины на фоне печеночной недостаточности способны проникать через гемато-энцефалический барьер головного мозга, тормозить нервные импульсы, вызывая характерные проявления развивающегося недуга. Симптомы печеночной энцефалопатииПризнаки печеночной энцефалопатии характеризуются психическими расстройствами, неврологическими нарушениями. К таким проявлениям относится:
Человек, страдающий печеночной энцефалопатией, часто застывает в одной позе, впадает в оцепенение. При этом происходит угнетение сознания, утрачивается способность к произвольным движениям, но рефлекторная деятельность сохраняется. Вывести больного из такого состояния можно физическим воздействием, после которого появляются слабые мимические сокращения в ответ на болевой синдром. В дальнейшем супор может привести к коме. Еще одно характерное проявление печеночной энцефалопатии – непроизвольные, размашистые подергивания, мышечный тик. Подобные движения происходят при напряжении шеи, конечностей, туловища. Если попросить больного вытянуть руки вперед, происходят непроизвольные сгибательно-разгибательные движения в суставах пальцев, кистей. Пациент по мере прогрессирования заболевания не может распознавать форму объектов, их положение в пространстве, у него развивается недержание мочи и фекалий.
При латентной форме печеночной энцефалопатии симптомы отсутствуют или проявляются незначительно. Такой тип заболевания диагностируется у 70% больных, страдающих циррозом печени. Для выявления патологии требуется проведение специальных психометрических тестов. Классификация заболеванияКлассифицируется острая печеночная энцефалопатия и хроническая. Острая имеет стремительное течение, может в течение 1–2 дней спровоцировать развитие комы. Хроническая форма сопровождается менее выраженными симптомами, прогрессирует несколько лет. Стадии печеночной энцефалопатии:
Летальный исход при печеночной энцефалопатии происходит из-за гидроцефалии и повреждения структур головного мозга, почечной недостаточности, отека легких, токсического или гиповолемического шока. Печеночная кома на фоне энцефалопатии бывает:
При своевременно начатом лечении заболевания удается восстановить сознание больному, хотя прогноз заболевания остается неблагоприятным. В случае развития комы 90% пациентов, страдающих печеночной энцефалопатией, умирают. Методы диагностикиДля установки диагноза больного осматривает врач, проверяет рефлексы, проводит опрос, слушает жалобы, оценивает адекватность поведения. Важное значение имеет правильно собранный анамнез о перенесенных ранее гепатитах, злоупотреблении алкоголем, неправильном приеме медицинских препаратов. По биохимическому анализу, результату печеночных проб определяется повышение активности аминотрансфераз, уровня ГАМК, билирубина, аммиака, Г-ГПТ. При этом снижена концентрация гемоглобина, альбуминов, протромбина, прокоивертина, проакцелерина, холинэстеразы. В составе ликвора обнаруживается высокое содержание белка. Дополнительно проводится УЗИ печени, желчного пузыря, электроэнцефалограмма головного мозга, МРТ, компьютерная томография, измеряется внутричерепное давление. Берут пункцию печени для выяснения причины развития печеночной недостаточности. Дифференциальная диагностика энцефалопатии печени выполняется с инсультом, кровоизлиянием головного мозга, разрывом аневризмы, инфекционным поражением нервной системы, метаболическим синдромом, хронической алкогольной интоксикацией, болезнью Вестфаля-Вильсона-Коновалова. Лечение острой печеночной энцефалопатииПри лечении энцефалопатии придерживаются трех основных направлений:
Лечение печеночной энцефалопатии острой стадии начинают с назначения диуретиков, седативных средств (настойки пустырника, валерианы). При выраженных психических расстройствах прописывают Галоперидол. При инфекционном поражении печени, воспалительном процессе показан прием антибиотиков. Для терапии энцефалопатии применяют препараты широкого спектра действия, проявляющие активность в просвете толстого кишечника (Неомицин, Метронидозол). Больной должен соблюдать постельный режим, специальную диету, принимать дезинтоксикационную терапию. Внутривенно вводят раствор глюкозы, витамины, электролиты, гидрокарбонат натрия, препараты калия, желатиноль. При печеночной энцефалопатии показано применение высоких клизм с лактулозой для очищения кишечника. Дисахариды (Дюфалак) уменьшают образование аммиака, предотвращают его всасывание, ускоряют утилизацию с каловыми массами. Для профилактики отека мозга используют кортикостероиды Дексаметазон, Преднизолон. Чтобы снять отечность тела, внутривенно вводят Фуросемид, Лазикс. Тяжелые формы печеночной недостаточности лечат в условиях интенсивной терапии, так как существует прямая угроза для жизни больного. Диета при печеночной энцефалопатии ограничивает употребление белка до 1 г на килограмм массы тела в сутки, поваренной соли, назначаются экзогенные аминокислоты. После стабилизации состояния количество белка постепенно увеличивают каждые 5 дней на 10 г, максимально больному разрешается съедать 50 г. Терапия хронической печеночной энцефалопатииПри хроническом течении печеночной энцефалопатии лечение симптомов начинают с соблюдения низкобелковой диеты. Рекомендуется увеличить употребление растительного протеина. Чтобы обеспечить человека энергией внутривенно раствор глюкозы. Проводится дезинтоксикационная терапия, как и при острой форме печеночной энцефалопатии. Требуется двухразовое очищение кишечника дисахаридами, назначение препаратов, уменьшающих уровень аммиака и ускоряющих его выведение из организма. В комплексе с медикаментозным лечением печеночной энцефалопатии проводится лазерная терапия. При тяжелых формах заболевания может потребоваться трансплантация печени. Бензоат натрия способствует связыванию аммиака, превращая его в гиппуровую кислоту. При этом токсин полностью обезвреживается и выводится с мочой в обход печеночного цикла. Глутаминовая кислота, L-аргинин назначают для обезвреживания эндогенных токсинов в печени. Гепа-мерц ускоряет метаболизм аммиака в печени и головном мозге. Для дезинтоксикации организма при печеночной энцефалопатии применяется плазмофорез, энтеросорбция. ПрогнозИсход и эффективность лечения зависит от степени тяжести печеночной недостаточности. Кома в 90% заканчивается смертью пациента. Прогноз значительно ухудшается при низком уровне общего белка, альбумина, наличии асцита, желтухи. При 3–4 стадии печеночной энцефалопатии выживает около 20%, при 1–2 – 70% пациентов. После проведения трансплантации показатели улучшаются. При острой недостаточности происходят остаточные поражения головного мозга, после чего человек не сможет вернуться к нормальной жизни. Эффективность терапии острой печеночной энцефалопатии зависит от возраста пациента, причины недостаточности органа, степени нарушения соотношения между фракциями белков, наличия желтухи. Прогноз неблагоприятен у детей младше 10 лет и у пациентов старше 40. serdechka.ru |
г.Самара, ул. Димитрова 131 [email protected] |
 |