|
|
||||||||||
|
Антибиотикопрофилактика послеоперационных раневых осложнений. Антибиотики послеоперационныеАнтибиотики после операции24 августа 2015 Просмотров: 8494 Антибиотики после операции больным назначают в виде антибиотикотерапии при условии проведения тщательного изучения клиники осложнений и характера воспалительного процесса, так как в силу определенных особенностей организма у некоторых пациентов появляются послеоперационные осложнения. Целесообразность проведения такого лечения определяется врачом индивидуально для каждого больного.
Существует множество факторов, которые могут повлиять на решение врача о назначении антибиотиков. К ним относятся состояние иммунной системы человека, индивидуальная непереносимость препаратов данной группы и многие другие. Курс терапии антибиотиками проводится с целью лечения и как профилактика предупреждения послеоперационных осложнений. Почему назначается терапия антибиотиками?Отличие антибиотиков от медицинских препаратов других групп заключается в том, что они действуют не на клеточные рецепторы, а на микроорганизмы, которые стали причиной воспалительного процесса организма. В ходе терапии антибиотики уничтожают все бактерии, которые имеют к ним чувствительность, не зависимо от того, являются они причиной данного заболевания или нет. Попадая в организм человека разными путями, антибиотики оказываются в его крови. В каждом органе человеческого организма разные антибиотики скапливаются в определенном количестве. Не зависимо от того, как он будет применяться — местно, внутривенно или перорально, он окажет эффект, но только при условии, если его будут применять с правильной дозировкой и вовремя. Антибиотики могут выводиться из организма с мочой, с желчью. При условии правильного применения (согласно рекомендации лечащего врача и руководства инструкции препарата) эффективность лечения антибиотиками в разы эффективнее и быстрее, чем от других медицинских препаратов. Выбирая антибиотики после операции, необходимо учитывать ряд моментов:
Антибиотики после зубных операцийК назначению антибиотиков после операций на зубах могут прибегнуть врачи только при условии воспалительного процесса в лунке, когда наблюдается сильный отек, краснота и выделение гноя. При ослабленном иммунитете, когда рана долго заживает, употребление антибиотиков должно проходить в комплексе с иммуноукрепляющими лекарствами. Назначают антибиотики после операций на зубах и в том случае, если больной пренебрегает элементарными правилами личной гигиены: забывает полоскать рот, что приводит к попаданию в ранку возбудителей инфекции и в результате — к воспалительному процессу. При условии, если в лунке после удаления зуба не образовался тромб, что снижает уровень защиты и грозит попаданием в нее инфекции, также назначают антибиотик. Самыми опасными формами воспалительных процессов в области послеоперационных зубных ран являются периостит — инфекция в надкостнице, альвеолит — воспаление лунки, периодонтит — наличие инфекции в корневом канале и остеомилит. Прекрасно зарекомендовали себя антибиотики, оказывающие максимальную пользу при зубных послеоперационных воспалениях: Цефазоли, Цефтриаксон, Цефиксим. Они разрушают клеточные стенки бактерий. Угнетают микробные ферменты, а также блокируют синтез ДНК некоторых видов бактерий препараты Лефлоксацин, Норфлоксацин, Спартфло и другие фторхинолоновые группы антибиотиков. Угнетают белковый синтез бактерий препараты Олететрин, Докисициклин и другие тетрациклиновые группы. Самыми распространенными при лечении зубных воспалительных послеоперационных процессов являются антибиотики Амоксиклав, Амоксицилин и Линкомицин, которые снимают воспаление и препятствуют попаданию инфекции в лунку. Антибиотики в гинекологииВ гинекологии вопрос послеоперационных осложнений является одним из самых актуальных и сложных. С каждым годом частота подобного явления становится все выше. Основными возбудителями воспалительных процессов в данной области являются энтеробактерии, грамположительные кокки и другие. В комплексе с хирургическими и терапевтическими методиками лечения огромную роль играет профилактика антибиотиками, при помощи которой предупреждают инфекционные осложнения. Профилактика антибиотиками осуществляется путем создания определенной концентрации препарата в тканях с момента их возможного попадания в организм и весь операционный период. Введение антибиотиков по окончании операции помогает предотвратить развитие инфекции. Длительность полноценного курса — около семи дней. Для этой цели используют максимально щадящие антибиотики — Метронидазол с цефалоспоринами, а также препараты, входящие в группу аминогликозидов. Применение антибиотиков после детских операцийАнтибиотики после операции назначают детям только при условии гнойной инфекции и воспалительного процесса, сопровождающегося очень высокой температурой. Как правило, при послеоперационных осложнениях врачами проводится ряд лабораторных исследований крови для того, чтобы определить степень чувствительности бактерий к антибиотикам разных групп. Самыми распространенными и хорошо себя проявившими в терапевтических целях являются антибиотики группы пенициллинов, которые имеют широкий спектр действия. Они имеют удобные для приготовления суспензий гранулированные формы. К таким относится, например, Амоксициллин. Препарат Аугментин той же группы запрещен для детей младше трех месяцев, но при этом имеет гораздо более широкий спектр действия. Достаточно эффективны препараты Зенацеф, Зиннат — цефалоспорины второго поколения, которые широко применяют после операций верхних и нижних дыхательных путей. Суммадед Форте оказывает широкий спектр действия на бактерии. Эффективен препарат при лечении послеоперационных осложнений после операций на легких, тонзиллитах и операбельных синуситах. Противопоказан малышам до шести месячного возраста. Хорошим средством против воспалительных процессов ЛОР-органов у детей в послеоперационный период является Супракс. Кишечный антибиотик, который имеет широкий спектр воздействия на желудочные инфекции — Флемоксин Салютаб. Препараты запрещены детям до года. Инъекционный препарат Цефтриаксон назначают при инфекциях мягких тканей, органов верхних и нижних дыхательных путей, мочеполовой системы и для профилактики послеоперационных гнойных септических осложнений. Препарат противопоказан недоношенным детям и больным желтухой. Что нужно помнить?Назначенные медиками антибиотики после операции должны приниматься больными только строго по прописанной инструкции. Необходимо строго соблюдать время приема препарата, так как это влияет на его всасываемость в кровь. Антибиотики следует запивать только чистой водой. Если больной принимает другие медицинские препараты, об этом необходимо сообщить лечащему врачу. Вместе с антибиотиками после операции следует принимать и лекарства, которые препятствуют развитию побочных эффектов, таких как дисбактериоз, молочница. Даже если прием антибиотиков в самые короткие сроки привел к улучшению, нельзя останавливать его прием. Это чревато тем, что бактерии быстро выработают устойчивость к лекарству,в результате чего могут возникнуть негативные последствия. Если в течение двух суток прием антибиотика не привел к положительным итогам, следует обратиться к врачу, чтобы тот назначил другой, более эффективный препарат. Заниматься самолечением нельзя, даже если речь идет о самом безобидном лекарстве. Применение антибиотиков без назначения и консультации с врачом могут привести к тяжелейшим последствиям для организма, которые в некоторых случаях приводят к инвалидности. Автор: Иван Иванов Поделись статьей: Оцените статью: Загрузка...Похожие статьи prooperacii.ru Антибиотикопрофилактика послеоперационных раневых осложненийПрименение антибактериальных препаратов для профилактики инфекционных раневых осложнений в послеоперационном периоде обосновано постулатом «предупреждение лучше, чем лечение». Послеоперационные раневые осложнения не являются ни случайностью, ни фатальной неизбежностью. В каждом клиническом случае можно определить причину, фактор, предрасполагающий к развитию инфекционного процесса.К факторам риска развития послеоперационной раневой инфекции относят возраст больного старше 60 лет, экстренную операцию, оперативные вмешательства по поводу внутри-полостных гнойно-воспалительных процессов, расширение операционной раны в ходе вмешательства, длительность операции более 3 ч, дренирование через операционную рану. Возбудители послеоперационной раневой инфекции в гнойной хирургии представлены Staphylococcus spp., Streptococcus spp., Enterobacter spp., Esherichia coli, Proteus spp. В ряде случаев возбудителями раневой инфекции являются типичные нозокомиальные виды микроорганизмов (Ps. aeruginosae, MRSA, Acinetobacer spp.), но большинство авторов не склонны считать нагноение операционных ран проявлением внутрибольничной инфекции и указывают на преимущественно эндогенный (контактный, гематогенный, лимфогенный) путь инфицирования. Иными словами, состав микробной флоры при послеоперационной раневой инфекции является прямым следствием инфицирования раны из гнойного очага или выхода сапрофитирующей микрофлоры из ареала ее обитания вследствие развития воспалительного или (и) некротического процесса, нарушения анатомических барьеров в процессе оперативного вмешательства, транслокации микрофлоры. Малая роль экзогенного инфицирования в послеоперационном нагноении ран определяется использованием современных средств и методов асептики. Основные методы профилактики послеоперационной инфекции, по сути, являются методами профилактики эндогенного инфицирования и включают специфические и неспецифические мероприятия. К неспецифическим мероприятиям традиционно относят предоперационную коррекцию нарушений гомеостаза, нормализацию доставки кислорода, коррекцию сопутствующей патологии и иммунного дисбаланса, совершенствование техники оперирования с уменьшением травматичности продолжительности вмешательств (особенно этапов, сопровождающихся вскрытием гнойного очага или просвета полого органа), тщательный гемостаз, использование синтетического резорбируемого монофиламентного шовного материала. Под специфическими мероприятиями профилактики понимают различные методы воздействия на вероятные возбудители инфекционных осложнений, прежде всего использование антимикробных препаратов. В гнойной хирургии специфическая профилактика послеоперационной раневой инфекции не подлежит сомнению. При профилактическом введении антимикробного препарата едва ли возможна полная эрадикация микроорганизмов из тканей, можно надеяться лишь на значительное уменьшение микробного числа до уровня, предполагающего эффективную работу иммунной системы в предотвращении развития гнойной инфекции. Это важно, так как инфицирование раны происходит в основном во время операции. На протяжении всей операции — от кожного разреза до наложения последнего кожного шва — в тканях в зоне операционного доступа должна сохраняться эффективная концентрация антимикробного препарата, что особенно необходимо к моменту окончания операции, когда микробная контаминация тканей максимальная. При введении же антимикробного препарата уже после начала операции достоверно возрастает вероятность развития раневой инфекции. Введение антимикробного препарата более чем через сутки после окончания операции не влияет на частоту послеоперационных нагноений. При выборе антибактериального препарата для профилактики исходят, прежде всего, из чувствительности к данному препарату наиболее вероятных возбудителей раневой инфекции, величины пенетрации препарата в ткани, инфицированные в ходе операции, периода полувыведения, обеспечивающего бактерицидную концентрацию препарата в тканях на протяжении всего вмешательства. Кроме того, большое значение для выбора препарата имеет и малая токсичность. Этим требованиям в наибольшей степени отвечают представители цефалоспоринов второй-третьей генерации, наиболее популярные при проведении предоперационной антимикробной профилактики. Эффективность цефалоспоринов подтверждает пример использования цефоперазона (цефобида). В течение всего времени оперативного вмешательства концентрация цефоперазона в тканях превышает МПК50 для наиболее значимых в развитии нагноения операционной раны микроорганизмов: Enterobacter spp. — 0,002-0,1 мг/л; Escherichia coli — 0,02-2,0 мг/л; Proteus spp. — 0,002-0,5 мг/л; Staphylococcus spp. — 0,1—0,5 мг/л; Streptococcus spp. — 0,06—0,5 мг/л. Повышение дозы цефоперазона более 1 г с целью увеличения его тканевой концентрации не оправдано, поскольку эффективность бета-лактамов зависит от времени, в течение которого концентрация антибиотика превышает МПК. Введения 1 г цефоперазона вполне достаточно для поддержания адекватной концентрации препарата в тканях во время оперативного вмешательства. Через 90 мин от момента введения величина пенетрации цефоперазона в подкожную жировую клетчатку и в мышцы достигает 50 % сывороточной концентрации и не меняется в более поздние сроки. Достижение максимальной тканевой концентрации цефалоспоринов в подкожной жировой клетчатке и в мышцах имеет принципиальное значение, поскольку подкожный жировой слой служит «инкубатором» для развития микробной флоры в ране. Особо хотелось бы отметить перспективы применения препарата при экстренных операциях по поводу острого аппендицита, острого холецистита, перфоративных гастродуоденальных язв, острых гастродуоденальных язвенных кровотечений. Цефоперазон обладает рядом положительных качеств, необходимых при профилактическом его применении. Непременным условием выбора антибиотика для профилактики инфекционных послеоперационных осложнений в гнойной хирургии является спектр антимикробного действия препарата при эмпирическом применении. Цефоперазон (цефобид) по существу перекрывает спектр вероятных основных возбудителей раневой инфекции: энтеробактерии, энтерококки, протей, стафилококки, стрептококки, бактероиды. Данные микроорганизмы в условиях эндогенного инфицирования высокочувствительны к цефалоспоринам третьей генерации и прежде всего к цефоперазону. Вторым важным условием профилактического применения цефоперазона (цефобида) является его способность к пенетрации в ткани и к сохранению достаточной концентрации в сыворотке крови и тканях операционной раны на весь период оперативного вмешательства. Болюсное внутривенное введение 1,0 г препарата за 30 мин до начала операции обеспечивает достаточную концентрацию (более МПК50) в тканях операционной раны на протяжении всего оперативного вмешательства. Введение цефобида в указанной дозе не оказывает токсического воздействия, а соотношение стоимость/ эффективность оказывается оптимальным. Антибактериальный эффект цефобида по МПК в тканях и сыворотке крови обеспечивается на протяжении всего оперативного вмешательства. Воздействие на бактероиды определяет возможность использования цебофида в качестве монотерапии. С учетом основных принципов специфической профилактики послеоперационных гнойных осложнений варианты выбора антибиотиков различны. Препараты вводят внутривенно. В торакальной хирургии: • клафоран 1,0 + карбенициллин 2,0 г; • линкомицин 0,6 г + доксициклин 0,1 г; • цефуроксим 1,5 г; • тиенам 2,0 г; • амоксициллин/клавулонат 12 г. В абдоминальной хирургии: • цефуроксим 1,5 г; • цефалоспорины третьего поколения 1,0 г + метроджил 1,0 г; • клиндамицин 0,6—0,9 г + гентамицин 1,5 мг/кг; • гентамицин 1,5 мг/кг + метроджил 0,5—1,0 г; • цефоперазон 1,0 г; • амоксициллин/клавулонат 1,2 г; • ампициллин/сульбактам 1,5 г; • цефолитин 2,0 г. При хирургическом лечении гнойных заболеваний мочеполовой системы: • клафоран 2,0 гр + метроджил 100 мг; • тиенам 500 мг 2 раза; • офлоксацин 100-400 мг 2 раза; • ампициллин/сульбактам 1,5 г; • амоксициллин/клавулонат 1,8 г. Гнойные заболевания опорно-двигательного аппарата: • гентамицин 80 мг 2 раза + ампициллин 1,0 г; • клафоран 1,0 в/м + линкомицин 0,3 - 2 раза в сутки; • азитромицин 0,5 г; • ломефлоксацин 400 мг; • ванкомицин 1,0 г; • цефазолин 1,0—2,0 г. Курс профилактического применения антибиотиков при «чистых» операциях ограничен этапом операции. В гнойной хирургии антибиотики применяют в течение 48—72 ч. Курс профилактического применения антибиотиков определяется особенностями фармакокинетики. Так, цефобид вводят внутривенно болюсно по 1,0 г через каждые 12 ч после первого (дооперационного) введения. Это обеспечивает быстрое создание необходимой и достаточной концентрации антибиотика в тканях операционной раны. Унифицированных схем антибиотикопрофилактики в хирургии нет. Один антибактериальный препарат сам по себе не в состоянии обеспечить профилактику нагноений операционных ран. Комплексный подход к профилактике осложнений с учетом состояния больного, особенностей микробной флоры, характера, объема, травматичности и длительности оперативного вмешательства, использование возможностей неспецифической и специфической профилактики позволяют добиться успеха в предупреждении операционных гнойных осложнений. В.К. Гостищев medbe.ru классификация и действие на организмАнтибиотики после операции, необходимо принимать для уничтожения болезнетворных микроорганизмов, снимая таким образом воспаление. Так как при наличии воспалительного процесса при операционном вмешательстве, возможны гнойные осложнения. Если посмотреть перевод слова «антибиотики» с древнегреческого языка, получится «против жизни». И действительно, эти препараты используются для подавления роста живых клеток. Назначаются они при определенных медицинских показаниях и ни в коем случае не должны применяться без ведома врача. Но некоторые пациенты категорически против антибиотических препаратов, ведь они уничтожают не только вредные, но и полезные клетки. Как же быть, и кто прав? Как действуют антибиотикиСовременный человек хотя бы раз сталкивался с антибиотиками, заболевая гриппом или кишечной инфекцией. А некоторые использовали антибиотические препараты, не подозревая об этом. Например, оксолиновая мазь, которой мамы мажут носики деткам в период гриппа. Вред антибиотиков заключается в том, что они губительно действуют на все бактерии в организме, в том числе и на полезные. Этот факт и ставит под сомнение необходимость приема антибиотических препаратов. Ведь помимо того, что будут уничтожены вредные микробы, нарушится и естественная микрофлора. Т.е. организм станет уязвимым к проникновению самых разных патогенов. Но эта проблема решаема: пробиотики после антибиотиков (бифидобактерии, лактобактерии и др.) помогут восстановить иммунитет и вернуть полноценное здоровье. Их тоже должен назначать врач. Теоретически, можно переносить некоторые болезни и без такой кардинальной терапии, но это рискованно. Патогенная микрофлора может распространиться по организму очень быстро и вызвать сильнейшую интоксикацию, которая неизвестно к чему приведет. Поэтому нужно трезво взвешивать все за и против и ни в коем случае не принимать антибиотики без врачебных назначений. Кстати! Большинство видов антибиотиков нельзя принимать длительно. Оптимальный срок лечения составляет 5-7 дней. Больше нельзя, т.к. организм должен сам найти ресурсы для отторжения вредных бактерий. А антибиотические препараты просто служат подспорьем для этого. Классификация антибиотиковПервые антибиотические препараты имели природное происхождение и производились из плесневых грибов. Да, речь идет о том самом пенициллине, о котором мы знаем еще с уроков биологии. Со временем люди научились синтезировать антибиотические препараты нового поколения, и пенициллиновые антибиотики стали всего лишь одной из многочисленных групп. С развитием медицины классификация становится все больше и больше. И сегодня антибиотик и систематизируют по самым разным признакам. По характеру воздействияБактерицидные (пенициллины, аминогликозид, рифампицин) и бактериостатические (тетрациклины, стероиды). Их разница в том, что первые полностью уничтожают клетки, а вторые – подавляют их рост и размножение. По спектру действия Тот отчитывается, что назначил антибиотики широкого спектра действия. Но ответ не удовлетворяет опытного заведующего терапией, и он требует более конкретного отчета. И действительно, под «широким спектром» подразумевается не универсальность, а то, что препарат способен лечить от самых разных заболеваний. А антибиотики узкого спектра действия направлены на борьбу с конкретными бактериями (например, грамположительными, стафилококками и др.). По способу полученияЭто природные, синтетические и полусинтетические антибиотики. К природным относят не только пенициллин, но и обычные продукты: лук, мед, капусту, астрагал и др. Но, чтобы полностью вылечить какую-то сложную болезнь, придется съесть очень много капустно-лукового салата. Поэтому диету чаще используют как дополнение к основному лечению. Полусинтетические препараты получают путем модифицирования структур природных антибиотиков. Такие лекарства используют чаще всего, потому что они вызывают минимум побочных эффектов. А синтетические антибиотические препараты иначе называют химиотерапевтическими и применяют только при тяжелых заболеваниях. По направленности действияВ этой классификации известно три вида антибиотиков. Первые: антибактериальные. Они уничтожают бактерий. Вторые: противоопухолевые. Назначаются при злокачественных и активно растущих доброкачественных новообразованиях. Третьи: противогрибковые. Это как раз таки препараты против молочницы, микозов и других заболеваний, имеющих грибковую природу. По химическому строениюЭто только полусинтетические и синтетические антибиотики:
Каждый препарат имеет определенные особенности состава и структуры (химического строения), которые нужно учитывать при назначениях в зависимости от болезни пациента, его возраста, анамнеза жизни и, руководствуясь результатами анализов. Можно ли давать антибиотики детямЗаинтересованность в быстром выздоровлении ребенка часто толкает родителей на кардинальные ошибочные поступки. Они самостоятельно находят в Интернете название самого сильного антибиотика, покупают его и лечат малыша. Но это может привести к непоправимым последствиям, потому что чем сильнее препарат, тем больше вреда он принесет маленькому организму. Из таких последствий выделяют аллергические реакции, дисбактериоз (очень часто), разрушение зубной эмали, частичная или полная глухота, поражение почек и т.д. Внимание! Для детей антибиотики должен прописывать строго врач. Даже популярные и, как многим кажется, безобидные препараты (тетрациклин – кишечный антибиотик, азитромицин – от простуды) не следует давать ребенку без врачебных назначений. После операций антибиотики ребенку нужны не всегда. Их назначают только при развивающихся гнойных и острых воспалительных процессах бактериальной природы. Препараты подбираются особенно тщательно, потому что детский иммунитет и так ослаблен после хирургического вмешательства. А родители, которые обычно находятся с ребенком в стационаре, должны контролировать систематичность приема лекарств и строгое соблюдение дозировок. Антибиотики после стоматологических операций И тогда риск получить заражение возрастает. Иногда антибиотики принимают при удалении зуба, вернее, по завершении этой операции. Это может быть связано с недостаточной гигиеной полости рта или с несоблюдением врачебных рекомендаций (слишком раннее удаление стерильной ватки, срывание кровяной корочки и т.д.). Антибиотики, которые чаще прописывают при стоматологических операциях:
Зачастую приходится пить антибиотики при удалении зуба мудрости, потому что эта операция сопровождается потерей большого количества крови и длительным заживлением ранки. Женские антибиотикиТакой группы нет, но есть определенные антибиотические препараты, которые прописывают при женских заболеваниях. Например, при молочнице, вызванной грибками, помогает Флуконазол. Этот препарат кто-то относит к противогрибковыми антибиотикам, а другие считают, что это просто лекарственное средство. В любом случае, достаточно одной таблетки, чтобы побороть молочницу. Антибиотики в гинекологии применяются и при более серьезных болезнях. Выбор препарата осуществляется после полноценной диагностики и лабораторных анализов, которые помогут выявить чувствительность микрофлоры к тем или иным таблеткам и свечам. Так, антибиотики могут прописать при воспалении половых губ (Цефазолин), слизистой влагалища (Тержинан), цервикального канала (Нистатин, Доксициклин), фаллопиевых труб (Ампициллин) и др.Неважно, в каком случае вам понадобился антибиотик: при удалении зуба, ОРВИ, молочнице или дизентерии. Выбор препарата, дозировка и длительность приема должны быть обсуждены с врачом. В противном случае, есть риск полного дисбаланса микрофлоры и приобретения других заболеваний, иногда более тяжелых, чем то, которое вы хотели вылечить антибиотиком. medoperacii.ru Антибиотикопрофилактика послеоперационных раневых осложненийПрименение антибактериальных препаратов для профилактики инфекционных раневых осложнений в послеоперационном периоде обосновано постулатом «предупреждение лучше, чем лечение». Послеоперационные раневые осложнения не являются ни случайностью, ни фатальной неизбежностью. В каждом клиническом случае можно определить причину, фактор, предрасполагающий к развитию инфекционного процесса.К факторам риска развития послеоперационной раневой инфекции относят возраст больного старше 60 лет, экстренную операцию, оперативные вмешательства по поводу внутри-полостных гнойно-воспалительных процессов, расширение операционной раны в ходе вмешательства, длительность операции более 3 ч, дренирование через операционную рану. Возбудители послеоперационной раневой инфекции в гнойной хирургии представлены Staphylococcus spp., Streptococcus spp., Enterobacter spp., Esherichia coli, Proteus spp. В ряде случаев возбудителями раневой инфекции являются типичные нозокомиальные виды микроорганизмов (Ps. aeruginosae, MRSA, Acinetobacer spp.), но большинство авторов не склонны считать нагноение операционных ран проявлением внутрибольничной инфекции и указывают на преимущественно эндогенный (контактный, гематогенный, лимфогенный) путь инфицирования. Иными словами, состав микробной флоры при послеоперационной раневой инфекции является прямым следствием инфицирования раны из гнойного очага или выхода сапрофитирующей микрофлоры из ареала ее обитания вследствие развития воспалительного или (и) некротического процесса, нарушения анатомических барьеров в процессе оперативного вмешательства, транслокации микрофлоры. Малая роль экзогенного инфицирования в послеоперационном нагноении ран определяется использованием современных средств и методов асептики. Основные методы профилактики послеоперационной инфекции, по сути, являются методами профилактики эндогенного инфицирования и включают специфические и неспецифические мероприятия. К неспецифическим мероприятиям традиционно относят предоперационную коррекцию нарушений гомеостаза, нормализацию доставки кислорода, коррекцию сопутствующей патологии и иммунного дисбаланса, совершенствование техники оперирования с уменьшением травматичности продолжительности вмешательств (особенно этапов, сопровождающихся вскрытием гнойного очага или просвета полого органа), тщательный гемостаз, использование синтетического резорбируемого монофиламентного шовного материала. Под специфическими мероприятиями профилактики понимают различные методы воздействия на вероятные возбудители инфекционных осложнений, прежде всего использование антимикробных препаратов. В гнойной хирургии специфическая профилактика послеоперационной раневой инфекции не подлежит сомнению. При профилактическом введении антимикробного препарата едва ли возможна полная эрадикация микроорганизмов из тканей, можно надеяться лишь на значительное уменьшение микробного числа до уровня, предполагающего эффективную работу иммунной системы в предотвращении развития гнойной инфекции. Это важно, так как инфицирование раны происходит в основном во время операции. На протяжении всей операции — от кожного разреза до наложения последнего кожного шва — в тканях в зоне операционного доступа должна сохраняться эффективная концентрация антимикробного препарата, что особенно необходимо к моменту окончания операции, когда микробная контаминация тканей максимальная. При введении же антимикробного препарата уже после начала операции достоверно возрастает вероятность развития раневой инфекции. Введение антимикробного препарата более чем через сутки после окончания операции не влияет на частоту послеоперационных нагноений. При выборе антибактериального препарата для профилактики исходят, прежде всего, из чувствительности к данному препарату наиболее вероятных возбудителей раневой инфекции, величины пенетрации препарата в ткани, инфицированные в ходе операции, периода полувыведения, обеспечивающего бактерицидную концентрацию препарата в тканях на протяжении всего вмешательства. Кроме того, большое значение для выбора препарата имеет и малая токсичность. Этим требованиям в наибольшей степени отвечают представители цефалоспоринов второй-третьей генерации, наиболее популярные при проведении предоперационной антимикробной профилактики. Эффективность цефалоспоринов подтверждает пример использования цефоперазона (цефобида). В течение всего времени оперативного вмешательства концентрация цефоперазона в тканях превышает МПК50 для наиболее значимых в развитии нагноения операционной раны микроорганизмов: Enterobacter spp. — 0,002-0,1 мг/л; Escherichia coli — 0,02-2,0 мг/л; Proteus spp. — 0,002-0,5 мг/л; Staphylococcus spp. — 0,1—0,5 мг/л; Streptococcus spp. — 0,06—0,5 мг/л. Повышение дозы цефоперазона более 1 г с целью увеличения его тканевой концентрации не оправдано, поскольку эффективность бета-лактамов зависит от времени, в течение которого концентрация антибиотика превышает МПК. Введения 1 г цефоперазона вполне достаточно для поддержания адекватной концентрации препарата в тканях во время оперативного вмешательства. Через 90 мин от момента введения величина пенетрации цефоперазона в подкожную жировую клетчатку и в мышцы достигает 50 % сывороточной концентрации и не меняется в более поздние сроки. Достижение максимальной тканевой концентрации цефалоспоринов в подкожной жировой клетчатке и в мышцах имеет принципиальное значение, поскольку подкожный жировой слой служит «инкубатором» для развития микробной флоры в ране. Особо хотелось бы отметить перспективы применения препарата при экстренных операциях по поводу острого аппендицита, острого холецистита, перфоративных гастродуоденальных язв, острых гастродуоденальных язвенных кровотечений. Цефоперазон обладает рядом положительных качеств, необходимых при профилактическом его применении. Непременным условием выбора антибиотика для профилактики инфекционных послеоперационных осложнений в гнойной хирургии является спектр антимикробного действия препарата при эмпирическом применении. Цефоперазон (цефобид) по существу перекрывает спектр вероятных основных возбудителей раневой инфекции: энтеробактерии, энтерококки, протей, стафилококки, стрептококки, бактероиды. Данные микроорганизмы в условиях эндогенного инфицирования высокочувствительны к цефалоспоринам третьей генерации и прежде всего к цефоперазону. Вторым важным условием профилактического применения цефоперазона (цефобида) является его способность к пенетрации в ткани и к сохранению достаточной концентрации в сыворотке крови и тканях операционной раны на весь период оперативного вмешательства. Болюсное внутривенное введение 1,0 г препарата за 30 мин до начала операции обеспечивает достаточную концентрацию (более МПК50) в тканях операционной раны на протяжении всего оперативного вмешательства. Введение цефобида в указанной дозе не оказывает токсического воздействия, а соотношение стоимость/ эффективность оказывается оптимальным. Антибактериальный эффект цефобида по МПК в тканях и сыворотке крови обеспечивается на протяжении всего оперативного вмешательства. Воздействие на бактероиды определяет возможность использования цебофида в качестве монотерапии. С учетом основных принципов специфической профилактики послеоперационных гнойных осложнений варианты выбора антибиотиков различны. Препараты вводят внутривенно. В торакальной хирургии: • клафоран 1,0 + карбенициллин 2,0 г; • линкомицин 0,6 г + доксициклин 0,1 г; • цефуроксим 1,5 г; • тиенам 2,0 г; • амоксициллин/клавулонат 12 г. В абдоминальной хирургии: • цефуроксим 1,5 г; • цефалоспорины третьего поколения 1,0 г + метроджил 1,0 г; • клиндамицин 0,6—0,9 г + гентамицин 1,5 мг/кг; • гентамицин 1,5 мг/кг + метроджил 0,5—1,0 г; • цефоперазон 1,0 г; • амоксициллин/клавулонат 1,2 г; • ампициллин/сульбактам 1,5 г; • цефолитин 2,0 г. При хирургическом лечении гнойных заболеваний мочеполовой системы: • клафоран 2,0 гр + метроджил 100 мг; • тиенам 500 мг 2 раза; • офлоксацин 100-400 мг 2 раза; • ампициллин/сульбактам 1,5 г; • амоксициллин/клавулонат 1,8 г. Гнойные заболевания опорно-двигательного аппарата: • гентамицин 80 мг 2 раза + ампициллин 1,0 г; • клафоран 1,0 в/м + линкомицин 0,3 - 2 раза в сутки; • азитромицин 0,5 г; • ломефлоксацин 400 мг; • ванкомицин 1,0 г; • цефазолин 1,0—2,0 г. Курс профилактического применения антибиотиков при «чистых» операциях ограничен этапом операции. В гнойной хирургии антибиотики применяют в течение 48—72 ч. Курс профилактического применения антибиотиков определяется особенностями фармакокинетики. Так, цефобид вводят внутривенно болюсно по 1,0 г через каждые 12 ч после первого (дооперационного) введения. Это обеспечивает быстрое создание необходимой и достаточной концентрации антибиотика в тканях операционной раны. Унифицированных схем антибиотикопрофилактики в хирургии нет. Один антибактериальный препарат сам по себе не в состоянии обеспечить профилактику нагноений операционных ран. Комплексный подход к профилактике осложнений с учетом состояния больного, особенностей микробной флоры, характера, объема, травматичности и длительности оперативного вмешательства, использование возможностей неспецифической и специфической профилактики позволяют добиться успеха в предупреждении операционных гнойных осложнений. В.К. Гостищев medbe.ru |
г.Самара, ул. Димитрова 131 [email protected] |
 |



 Телесериалы про врачей – это не только развлекательный, но и весьма познавательный контент. Там часто можно слышать различные термины, которые потом встречаются в реальной жизни. Так, в одной из серий «Интернов» доктор Быков спрашивает у будущего врача Лобанова о ходе лечения пациента.
Телесериалы про врачей – это не только развлекательный, но и весьма познавательный контент. Там часто можно слышать различные термины, которые потом встречаются в реальной жизни. Так, в одной из серий «Интернов» доктор Быков спрашивает у будущего врача Лобанова о ходе лечения пациента.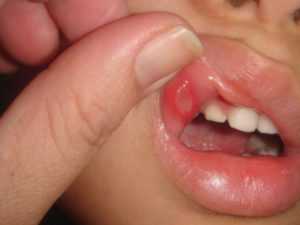 Вскрытие капюшона десны, лоскутное вмешательство при пародонтозе, вырезание кисты – все это подразумевает нарушение целостности слизистой и возможность бактериального заражения. Обычно такие операции проводят только после полной санации полости рта, но иногда это экстренный случай.
Вскрытие капюшона десны, лоскутное вмешательство при пародонтозе, вырезание кисты – все это подразумевает нарушение целостности слизистой и возможность бактериального заражения. Обычно такие операции проводят только после полной санации полости рта, но иногда это экстренный случай.