|
|
||||||||||
|
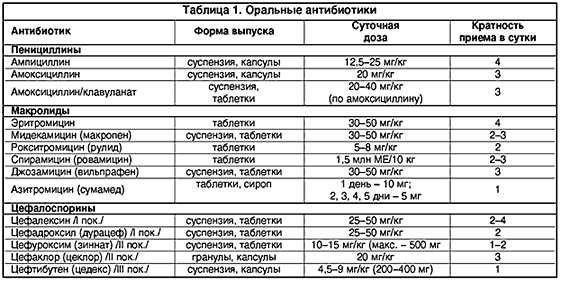
Оральные антибактериальные препараты при бронхолегочных заболеваниях у детей. Антибиотики оральныеОральные антибактериальные препараты при бронхолегочных заболеваниях у детей | Середа Е.В., Катосова Л.К.Для цитирования: Середа Е.В., Катосова Л.К. Оральные антибактериальные препараты при бронхолегочных заболеваниях у детей // РМЖ. 2001. №16. С. 706 Научный центр здоровья детей РАМН Совершенствование терапевтической тактики при острых и хронических бронхолегочных заболеваниях является одной из важных и далеко не решенных проблем. Антибиотикотерапия – один из важнейших компонентов комплексного лечения заболеваний органов дыхания у детей. Выбор антибактериального препарата и пути его введения до сих пор представляют для врача сложную задачу. В настоящее время фармацевтическая промышленность располагает огромным арсеналом антибактериальных пероральных средств, которые находят широкое применение в педиатрической практике в связи с наличием детских лекарственных форм в виде суспензий, сиропов, таблеток с соответствующей дозировкой. В табл. 1 приведены антибиотики для орального применения. Оценивая классические пути введения антибиотиков, а именно, парентеральный и пероральный, в ряде случаев у детей следует отдать предпочтение последнему, как наиболее щадящему, исключающему прсихотравмирующий эффект. Парентеральный путь введения препарата, зарекомендовавший себя, как основной метод лечения болезней органов дыхания, при многих безусловных его достоинствах (точность дозирования, высокие пиковые концентрации и др.), не лишен недостатков. Это, в первую очередь, связано с опасностью возможного переноса инфекции (сывороточного гепатита, ВИЧ–инфекции), вероятностью послеинъекционных осложнений, а также с психотравмирующим действием болезненных инъекций. Все это диктует необходимость разумного сужения показаний к парентеральному введению препаратов у детей.
Однако следует подчеркнуть, что оральная антибактериальная терапия, как стартовое лечение, наиболее показана при легких и среднетяжелых формах заболевания, в том числе при неосложненных острых пневмониях и обострениях хронических воспалительных бронхолегочных заболеваний. Этиологическая структура заболеваний органов дыхания у детей имеет свои особенности в зависимости от формы, тяжести заболевания и возраста ребенка, что необходимо учитывать при решении вопроса о назначении антибиотиков. Наиболее частыми возбудителями внебольничной пневмонии, особенно осложненных ее форм, в первые месяцы жизни ребенка являются Staphylococсus aureus (58%). Значительно реже выделяются Streptococcus pneumoniae и Haemophilus influenzae (10–15%). В более старшем возрасте увеличивается роль Streptococcus pneumoniae (35–60% и более). Атипические возбудители пневмонии у детей в возрасте 1–6 месяцев выявляются более чем у 10–20%, чаще это Chlamidia trachomatis, реже Mycoplasma hominis [1–3]. Mycoplasma pneumoniae определяется у 10–15% больных в возрасте 1–6 лет. В школьном возрасте (7–15 лет) увеличивается частота атипичных пневмоний, особенно вызванных Mycoplasma pneumoniae (20–40%) и Chlamidia pneumoniae (7–24%). Многолетний клинико–бактериологический мониторинг, проведенный в НИИ педиатрии НЦЗД РАМН позволил установить, что микробный спектр при хронических бронхолегочных заболеваниях у детей в периоде обострения представлен в основном двумя пневмотропными микроорганизмами. При этом Haemophilus influenzae является доминирующим причинным фактором инфекционного процесса, составляя 61–70% , из которых в 27% случаев она находится в ассоциации с пневмококком [4]. Пневмококк выделяется у 35% больных. Значительно реже определяется участие в этиологии хронического воспаления Branchamella catarrhalis (4–10%), Рroteus mirabilis (2,2%), Klebsiella pneumoniae (1,1%), Streptococcus pyogenes (1,1%), Staphylococсus aureus (0,1%). Данные, накопленные специалистами разных стран, свидетельствуют о распространении и возрастающей роли устойчивых штаммов микроорганизмов (пневмококка, гемофильной палочки, и бранхамеллы катаралис) при различных инфекциях верхних и нижних дыхательных путей. Однако при выборе адекватной антибиотикотерапии следует ориентироваться на региональные данные о резистентности пневмотропных микроорганизмов, полученные в России. Мониторинг определения чувствительности основных пневмотропных бактерий, проведенный нами, позволил выявить, что Streptococcus pneumoniae сохраняет высокую чувствительность к препаратам пенициллинового ряда (табл. 2), что соответствует результатам многоцентрового исследования резистентности, выполненного в России [5]. Отмечается также высокая чувствительность Streptococcus pneumoniae к макролидам и цефалоспоринам, при их природной резистентности к аминогликозидам. Haemophilus influenzae также сохраняет высокую чувствительность к ампициллину, амоксициллину, амоксициллину/клавуланату, азитромицину, левомицетину, аминогликозидам и цефалоспоринам II–III поколений. Почти все штаммы Haemophilus influenzae обладают резистентностью к таким антибиотикам, как оксациллин (84 %), олеандомицин (97 %), линкомицин (100 %), что подтверждает нецелесообразность их применения в этих случаях. Низкой и средней активностью обладают макролиды и цефалоспорины I поколения при сохранении высокой чувствительности к азитромицину и препаратам цефалоспоринового ряда II–III поколений. Штаммы Branchamella catarrhalis обладают резистентностью к пенициллину (70–80%), но сохраняют высокую чувствительность к амоксициллину/клавуланату, макролидам, цефалоспоринам II и III поколений.
Комбинированный антибиотик пенициллиновой группы амоксициллин/клавуланат привлекает особое внимание педиатров, поскольку он решает проблему бета–лактамазной устойчивости основных патогенных организмов, являясь при этом антибиотиком широкого спектра действия. Он удобен для применения у детей, так как наряду с парентеральной формой имеются таблетки и сироп. Это позволяет применять его в качестве эмпирической терапии как при тяжелых инфекциях органов дыхания (в том числе с использованием “ступенчатого” метода), так и при легких - внутрь. Наш опыт применения амоксициллина/клавуланата при обострении хронической пневмонии выявил его высокую клиническую (86%) и бактериологическую эффективность. Внедрение в лечебную практику новых макролидов позволило расширить возможности применения пероральных антибактериальных препаратов, что способствует снижению потребности в парентеральных методах введения антибиотиков. Кроме того, макролиды считаются одной из самых безопасных групп антибиотиков и обладают высокой активностью к Streptococcus pneumoniae и Branchamella catarrhalis. Новые макролиды – мидекамицин (Макропен), рокситромицин, спирамицин и джозамицин – по сравнению с эритромицином обладают лучшими органолептическими и фармакокинетическими свойствами, большей биодоступностью, более длительным периодом полувыведения при лучшей переносимости, что позволяет сократить число приемов препарата до 2–3 раз в сутки (табл.1) и повысить терапевтическую эффективность. 16-членные макролиды (мидекамицин, джозамицин и др.), в отличие от 14- и 15-членных макролидов, не выводятся из бактериальной клетки ее мембранными насосами, дольше оказывая свое действие. Будучи 16-членным макролидом, мидекамицин не взаимодействует с другими лекарственными препаратами, в отличие от эритромицина и некоторых других макролидов, которые могут замедлять метаболизм теофиллина, антигистаминных (терфенадина, астемизола) и других препаратов, вызывая серьезные нежелательные эффекты. Макролидные антибиотики являются препаратами выбора при атипичных пневмониях, вызванных внутриклеточными возбудителями (микоплазменной, хламидийной инфекциями), а также при внебольничной пневмонии, вызванной пневмококком и бранхамеллой катаралис, особенно у детей с аллергическими проявлениями и повышенной чувствительностью к пенициллинам [7-9]. Проведенное нами сравнительное изучение эффективности макролидов подтвердило их высокую эффективность при лечении детей раннего возраста с острой пневмонией и при обострениях хронической инфекции. При этом полное рассасывание пневмонии происходило происходило в те же сроки, что и при парентеральном применении других антибиотиков [6]. При оральном применении эритромицина в случаях внебольничной острой пневмонии и обострении хронической пневмонии была получена клиническая эффективность 75% и 71%, соответственно. Но при этом у 16% и 19% больных наблюдались побочные реакции, потребовавшие отмены препарата. Высокая частота нежелательных реакций ограничивает применение эритромицина, особенно у детей раннего возраста. Более высокая эффективность была достигнута при применении новых макролидов: мидекамицин – 82%, рокситромицин – 90%, спирамицин – 89%, азитромицин – 93,4%. Наряду с этим отмечалась хорошая переносимость этих препаратов и редкость нежелательных реакций (3–5%). Подтверждаются данные литературы об эффективности и безопасности макролидных антибиотиков при лечении детей [7-9]. Цефалоспориновые препараты являются в настоящее время одними из наиболее активных антибиотиков широкого спектра действия, применяемых для лечения заболеваний органов дыхания у детей, однако при внебольничных пневмониях цефалоспорины могут применяться в случае неэффективности стартовых препаратов. Среди цефалоспоринов II и III поколений, доказавших свою высокую эффективность на практике, следует отметить пероральные антибиотики – цефуроксим, цефаклор и цефтибутен. Если при острой пневмонии или бронхите цефалоспорины I, II и III поколений рассматриваются, как препараты резерва, то при хронической бронхолегочной патологии, особенно связанной с пороками развития легких и бронхов, а также у детей с иммунодефицитными состояниями цефалоспорины II и III поколений являются одними из основных антибиотиков с учетом их широкого спектра действия, устойчивости к бета–лактамазам, высокой эффективности и хорошей переносимости [10]. При тяжелых формах заболевания пероральные препараты могут использоваться также для продолжения лечения при необходимости стартового парентерального назначения антибиотиков широкого спектра действия, их смены, комбинирования препаратов и методов введения, в том числе при “ступенчатом” методе лечения. Следует подчеркнуть тот факт, что детям с острыми рецидивирующими и особенно с хроническими бронхолегочными заболеваниями нередко приходится назначать повторные курсы антибактериальных препаратов. В связи с этим возникает ряд сложностей, связанных не только с развитием устойчивости возбудителей воспалительного процесса в бронхах и легких, но и продиктованных необходимостью обеспечить наиболее обоснованное, щадящее лечение. Наиболее адекватное лечение проводится с учетом антибиотикограммы. При невозможности получения этих данных и в экстренных случаях рекомендуется использование антибиотиков широкого спектра действия. В заключение следует отметить, что имеются большие резервы для повышения эффективности лечения детей с бронхолегочными заболеваниями. Создание и внедрение в педиатрическую практику эффективных пероральных антимикробных препаратов широкого спектра действия, в том числе детских лекарственных форм для приема внутрь, будет способствовать совершенствованию терапевтической тактики при заболеваниях органов дыхания у детей не только в стационарах, но и в амбулаторно – поликлинических условиях.
Литература: 1. Таточенко В.К., Середа Е.В., Федоров А.М., Катосова Л.К., Самсыгина Г.А., Дементьева Г.М., Страчунский Л.С. Антибактериальная терапия пневмоний у детей. Антибиотики и химиотерапия, 2000; 5: 33–40. 2. Таточенко В.К. Антибактериальная терапия внебольничной пневмонии у детей. Материалы Международной конференции “Антибактериальная терапия в педиатрической практике.” Москва, 1999: 45–9. 3. Вербицки С. Антибактериальная терапия внебольничной пневмонии у детей. Материалы Международной конференции “Антибактериальная терапия в педиатрической практике.” Москва, 1999: 42–4. 4. Середа Е.В., Катосова Л.К. Современные подходы к применению макролидов при заболеваниях органов дыхания у детей. Русский медицинский журнал, 2000; 1: 34–9. 5. Кречикова О.И. Состояние антибиотикорезистентности Streptococcus pneumoniae в России. Русский медицинский журнал Пульмонология VIII Российский национальный конгресс “Человек и лекарство” 2001: 8–10. 6. Таточенко В.К., Федоров А.М., Хайрулин Б.Е. Об использовании оральных антибактериальных средств в лечении острой пневмонии у детей. Педиатрия, 1992; 4–6: 38–41. 7. Страчунский Л.С., Козлов С.Н. Макролиды в современной клинической практике. Русич, Смоленск, 1998: 302с. 8. Йерман А., Дриновец Й. Клинические аспекты применения макролидных антибиотиков. KrKa Med Farm 1996; 16(28): 26–32. 9. Кишимото К. Место макролидов в педиатрической практике. Материалы Международной конференции “Антибактериальная терапия в педиатрической практике.” Москва, 1999: 52–5. 10. Середа Е.В., Рачинский С.В., Волков И.К., Катосова Л.К., Лукина О.Ф. Лечение пороков развития легких и бронхов у детей. Русский медицинский журнал, 1999; 11: 510– 4. Мидекамицин – Макропен (торговое название) (KRKA) (торговое название)Поделитесь статьей в социальных сетях Порекомендуйте статью вашим коллегам www.rmj.ru Биодоступность отдельных оральных антибиотиков — Мегаобучалка
Предпочтение следует отдавать препарату с наибольшей биодоступностью, ее необходимо учитывать и при определении дозы. При назначении антибиотика врач должен быть уверен, что его концентрация в очаге инфекции будет превосходить минимальную подавляющую концентрацию (МПК) для возбудителя. Выбор оптимального антибиотика для ступенчатой терапии является непростой задачей. Р. Jewesson приводит характеристики "идеального" перорального антибиотика для второго этапа ступенчатой терапии: · Оральный антибиотик тот же, что и парентеральный. · Доказанная клиническая эффективность при лечении данного заболевания. · Наличие различных оральных форм (таблетки, растворы и т.д.). · Высокая биодоступность. · Отсутствие лекарственных взаимодействий на уровне всасывания. · Хорошая переносимость при пероральном приеме. · Длительный интервал дозирования. · Низкая стоимость. Варианты ступенчатой терапии В зависимости от орального АБ выделяют 4 варианта ступенчатой терапии: · парентерально и внутрь назначают один и тот же АБ; оральный АБ обладает хорошей биодоступностью; · парентерально и внутрь назначают один и тот же АБ; оральный АБ имеет низкую биодоступность; · парентерально и внутрь назначают разные АБ; оральный АБ обладает хорошей биодоступностью; · парентерально и внутрь назначают разные АБ; оральный АБ имеет низкую биодоступность. С теоретической точки зрения идеальным является первый вариант. Второй вариант ступенчатой терапии приемлем при инфекциях легкой или средней тяжести, когда возбудитель высоко чувствителен к применяемому оральному антибиотику, а у пациента нет иммунодефицита. На практике чаще всего используется третий вариант, так как не все парентеральные антибиотики имеют пероральную форму. Клиническая эффективность ступенчатой терапии при различных инфекциях была доказана в ходе многочисленных исследований. Ступенчатая терапия является фармакоэкономически обоснованным режимом антибактериальной терапии, обеспечивающим преимущества, как для пациента, так и стационара. Ступенчатая терапия может применяться в любых лечебных учреждениях, она не влечет за собой дополнительных вложений и затрат, а требует лишь изменения привычных подходов врачей к проводимой антибактериальной терапии. Особенности применения антиинфекционных препаратов У разных пациентов Применение антиинфекционных препаратов у пациентов с почечной и печеночной недостаточностью. При нарушении функции печени инактивация некоорых препаратов может существенно замедляться, что сопровождается увеличением конценрации ЛС в сыворотке крови и повышением риска их токсического воздействия. Одновремеено нежелательному воздействию препаратов подвергается и сама печень, что приводит к дальнейшему нарушению функции гепатоцитов и создает угрозу развитию комы. Замедленное выведение АМП и их метаболитов при почечной недостаточности повышает риск их токсического воздействия как на отдельные системы, так и на организм в целом. Чаще всего страдает центральная нервная система, кроветворная и сердечно-сосудистая системы. Поэтому в каждом конкретном случае следует сопоставлять риск и пользу от предполагаемого назначения АМП. Применение антиинфекционных препаратов у лиц пожилого возраста. Фармакокинетические свойства антимикробных препаратов (АПМ) изменяются вследствии сопутствующих заболеваний с наличием функциональных изменений печени и почек. С возрастом уменьшается уровень метаболизма ЛС в печени, одновременно снижается экскреция их, что приводит к увеличению концетрации ЛС в крови. Чаще развиваются токсические эффекты пркпаратов, что требует уменьшение дозы ЛС. У пожилых лиц предпочтительнее применение ЛС, назначаемых 1-2 раза в сутки. Это способствуе комплаентности фармакотерапии. Упожилых пациентов чаще встречается резистентность к антимикробным препаратам. Применение антиинфекционных препаратов при беременности и кормлению грудью. Применение АМП во время беременности предполагает выполнение следующих условий: - необходимо испльзовать ЛС только с установленной безопасностью применеия при беременности, с известными путями метаболизма; - при назначении препаратов необходимо учитывать срок беременности: ранний или поздний; - в процессе лечения необходим тщательный контроль за состоянием матери и плода. Необходимо учитывать категории риска применения ЛС при беременности, разработанные Американской администрации по контролю за лекарствами и пищевыми продуктами – FDA. ЛИТЕРАТУРА 1. Практическое руководство по антиинфекционной химиотерапии. Под ред. Л.С.Страчунского, Ю.Б.Белоусова, С.Н.Козлова. М.: Боргес, 2002. 2. Рациональная антимикробная фармакотерапия, ред. В.П.Яковлев и С.В.Яковлев. М.: Литтерра, 2003; с. 102-11, 495-513. 3. Руководство по инфекционным болезням. Ред. Ю.В. Лобзин, А.П.Казанцев. СПб.: Комета, 1996. 4. Ефименко Н.А., Гучев И.А., Сидоренко С.В. Инфекции в хирургии. Фармакотерапия и профилактика. Смоленск, 2004. 5. Лукьянов С.В. Клиническая фармакология макролидов.// Консилиум-Медикум.- 2004.- Т.6.-N10. 6. Падейская Е.Н. 5-Нитроимидазолы – антимикробные препараты для лечения бактериальных и протозойных инфекций. // Консилиум-Медикум.- 2004.- т.6.-N 1. 7. Падейская Е.Н. Аминогликозиды - антимикробные препараты широкого спектра действия: значение в терапии бактериальных инфекций на современном этапе.// Консилиум-Медикум.- 2006.- Т.8.-N1. 8. Сидоренко С.В. Проблемы этиотропной терапии внебольничных инфекций дыхательных путей.// Консилиум-Медикум.- 2002.- Т.4.-N 1. 9. Страчунский Л.С., Каманин Е.И., А.А.Тарасов А.А. Влияние антибиотикорезистентности на выбор антимикробных препаратов в оториноларингологии.// Консилиум-Медикум.- 2001.- Т.3.-N8. 10. Страчунский Л.С. Антибактериальная терапия внебольничной пневмонии в амбулаторных условиях.// Консилиум-Медикум.- 2002.- Т.4.-N 4. 11. Чучалин А.Г., Цой А.Н., Архипов В.В. Диагностика и лечение пневмоний с позиций медицины доказательств.//Консилиум-Медикум.- 2002.-Т.4.-№12. 12. Яковлев В.П. Антимикробные препараты группы фторхинолонов.//Консилиум-Медикум.- 2006.- т.8.-N 1. 13. Яковлев С.В., Дворецкий Л.И., Суворова М.П., Бактериальные инфекции в амбулаторной практике: выбор оптимального антибактериального препарата.// Консилиум-Медикум.- 2002.- Т.4.-N1. 14. Яковлев С.В. Критический анализ антибактериальных препаратов для лечения урологических инфекций.// Консилиум-Медикум.- 2002.- Т.4.-N 7. 15. Яковлев С.В., Яковлев В.П., Бета-Лактамные антибиотики.// Консилиум-Медикум.- 2006.- Т.8.-N1. megaobuchalka.ru Оральные антибактериальные препараты при бронхолегочных заболеваниях у детей19 октября, 2011 год 1234 ПоделитьсяПрофессор Е.В. Середа, профессор Л.К. КатосоваНаучный центр здоровья детей РАМН Совершенствование терапевтической тактики при острых и хронических бронхолегочных заболеваниях является одной из важных и далеко не решенных проблем. Антибиотикотерапия – один из важнейших компонентов комплексного лечения заболеваний органов дыхания у детей. Выбор антибактериального препарата и пути его введения до сих пор представляют для врача сложную задачу. В настоящее время фармацевтическая промышленность располагает огромным арсеналом антибактериальных пероральных средств, которые находят широкое применение в педиатрической практике в связи с наличием детских лекарственных форм в виде суспензий, сиропов, таблеток с соответствующей дозировкой. В табл. 1 приведены антибиотики для орального применения. Оценивая классические пути введения антибиотиков, а именно, парентеральный и пероральный, в ряде случаев у детей следует отдать предпочтение последнему, как наиболее щадящему, исключающему прсихотравмирующий эффект. Парентеральный путь введения препарата, зарекомендовавший себя, как основной метод лечения болезней органов дыхания, при многих безусловных его достоинствах (точность дозирования, высокие пиковые концентрации и др.), не лишен недостатков. Это, в первую очередь, связано с опасностью возможного переноса инфекции (сывороточного гепатита, ВИЧ–инфекции), вероятностью послеинъекционных осложнений, а также с психотравмирующим действием болезненных инъекций. Все это диктует необходимость разумного сужения показаний к парентеральному введению препаратов у детей. Трудно переоценить значение создания новых пролонгированных форм антибиотиков, способствующих сокращению кратности их введения, которые обладают не только широким спектром действия, но и низкой токсичностью, что особенно важно для детей. Особого внимания заслуживает внедрение в практику “ступенчатого” метода лечения, сокращающего сроки парентерального введения антибиотиков до 1–3 дней. Он заключается в переходе на прием адекватного антибиотика перорально при наметившемся положительном клиническом эффекте. Использование антибиотиков внутрь, особенно пролонгированных форм, значительно уменьшает риск распространения инфекционных заболеваний, снижает нагрузку на медицинский персонал, сокращает количественную потребность в шприцах и позволяет шире применять препараты не только в стационаре, но и в поликлинических условиях. Однако следует подчеркнуть, что оральная антибактериальная терапия, как стартовое лечение, наиболее показана при легких и среднетяжелых формах заболевания, в том числе при неосложненных острых пневмониях и обострениях хронических воспалительных бронхолегочных заболеваний. Этиологическая структура заболеваний органов дыхания у детей имеет свои особенности в зависимости от формы, тяжести заболевания и возраста ребенка, что необходимо учитывать при решении вопроса о назначении антибиотиков. Наиболее частыми возбудителями внебольничной пневмонии, особенно осложненных ее форм, в первые месяцы жизни ребенка являются Staphylococсus aureus (58%). Значительно реже выделяются Streptococcus pneumoniae и Haemophilus influenzae (10-15%). В более старшем возрасте увеличивается роль Streptococcus pneumoniae (35-60% и более). Атипические возбудители пневмонии у детей в возрасте 16 месяцев выявляются более чем у 10-20%, чаще это Chlamidia trachomatis, реже Mycoplasma hominis [13]. Mycoplasma pneumoniae определяется у 10-15% больных в возрасте 16 лет. В школьном возрасте (7-15 лет) увеличивается частота атипичных пневмоний, особенно вызванныхMycoplasma pneumoniae (20-40%) и Chlamidia pneumoniae (724%). Многолетний клиникобактериологический мониторинг, проведенный в НИИ педиатрии НЦЗД РАМН позволил установить, что микробный спектр при хронических бронхолегочных заболеваниях у детей в периоде обострения представлен в основном двумя пневмотропными микроорганизмами. При этом Haemophilus influenzae является доминирующим причинным фактором инфекционного процесса, составляя 6170% , из которых в 27% случаев она находится в ассоциации с пневмококком [4]. Пневмококк выделяется у 35% больных. Значительно реже определяется участие в этиологии хронического воспаления Branchamella catarrhalis (4-10%), Рroteus mirabilis (2,2%), Klebsiella pneumoniae (1,1%), Streptococcus pyogenes (1,1%), Staphylococсus aureus (0,1%). Данные, накопленные специалистами разных стран, свидетельствуют о распространении и возрастающей роли устойчивых штаммов микроорганизмов (пневмококка, гемофильной палочки, и бранхамеллы катаралис) при различных инфекциях верхних и нижних дыхательных путей. Однако при выборе адекватной антибиотикотерапии следует ориентироваться на региональные данные о резистентности пневмотропных микроорганизмов, полученные в России. Мониторинг определения чувствительности основных пневмотропных бактерий, проведенный нами, позволил выявить, что Streptococcus pneumoniae сохраняет высокую чувствительность к препаратам пенициллинового ряда (табл. 2), что соответствует результатам многоцентрового исследования резистентности, выполненного в России [5]. Отмечается также высокая чувствительность Streptococcus pneumoniae к макролидам и цефалоспоринам, при их природной резистентности к аминогликозидам. Haemophilus influenzae также сохраняет высокую чувствительность к ампициллину, амоксициллину, амоксициллину/клавуланату, азитромицину, левомицетину, аминогликозидам и цефалоспоринам II-III поколений. Почти все штаммы Haemophilus influenzae обладают резистентностью к таким антибиотикам, как оксациллин (84 %), олеандомицин (97 %), линкомицин (100 %), что подтверждает нецелесообразность их применения в этих случаях. Низкой и средней активностью обладают макролиды и цефалоспорины I поколения при сохранении высокой чувствительности к азитромицину и препаратам цефалоспоринового ряда II-III поколений. Штаммы Branchamella catarrhalis обладают резистентностью к пенициллину (70-80%), но сохраняют высокую чувствительность к амоксициллину/клавуланату, макролидам, цефалоспоринам II и III поколений.Проведенное нами изучение чувствительности выделяемых бактерий при заболеваниях органов дыхания показывает, что препараты пенициллинового ряда остаются препаратами выбора при лечении пневмонии и ряда других инфекций у детей, вызванных грамположительными кокками (пневмококками, стафилококками, стрептококками). Среди остальных антибиотиков наиболее широкое применение при лечении заболеваний органов дыхания, в частности, при внебольничной пневмонии, получили аминопенициллины (ампициллин, амоксициллин и амоксициллин/клавуланат). При неосложненных внебольничных пневмониях легкой и средней тяжести, особенно в амбулаторных условиях, предпочтительно применение этих антибиотиков с учетом чувствительности Streptococcus pneumoniae, являющегося наиболее частым возбудителем внебольничных пневмоний [6]. Комбинированный антибиотик пенициллиновой группы амоксициллин/клавуланат привлекает особое внимание педиатров, поскольку он решает проблему беталактамазной устойчивости основных патогенных организмов, являясь при этом антибиотиком широкого спектра действия. Он удобен для применения у детей, так как наряду с парентеральной формой имеются таблетки и сироп. Это позволяет применять его в качестве эмпирической терапии как при тяжелых инфекциях органов дыхания (в том числе с использованием ступенчатого метода), так и при легких - внутрь. Наш опыт применения амоксициллина/клавуланата при обострении хронической пневмонии выявил его высокую клиническую (86%) и бактериологическую эффективность.Внедрение в лечебную практику новых макролидов позволило расширить возможности применения пероральных антибактериальных препаратов, что способствует снижению потребности в парентеральных методах введения антибиотиков. Кроме того, макролиды считаются одной из самых безопасных групп антибиотиков и обладают высокой активностью к Streptococcus pneumoniae и Branchamella catarrhalis. Новые макролиды мидекамицин (Макропен), рокситромицин, спирамицин и джозамицин по сравнению с эритромицином обладают лучшими органолептическими и фармакокинетическими свойствами, большей биодоступностью, более длительным периодом полувыведения при лучшей переносимости, что позволяет сократить число приемов препарата до 2-3 раз в сутки (табл.1) и повысить терапевтическую эффективность. 16-членные макролиды (мидекамицин, джозамицин и др.), в отличие от 14- и 15-членных макролидов, не выводятся из бактериальной клетки ее мембранными насосами, дольше оказывая свое действие. Будучи 16-членным макролидом, мидекамицин не взаимодействует с другими лекарственными препаратами, в отличие от эритромицина и некоторых других макролидов, которые могут замедлять метаболизм теофиллина, антигистаминных (терфенадина, астемизола) и других препаратов, вызывая серьезные нежелательные эффекты. Макролидные антибиотики являются препаратами выбора при атипичных пневмониях, вызванных внутриклеточными возбудителями (микоплазменной, хламидийной инфекциями), а также при внебольничной пневмонии, вызванной пневмококком и бранхамеллой катаралис, особенно у детей с аллергическими проявлениями и повышенной чувствительностью к пенициллинам [7-9]. Проведенное нами сравнительное изучение эффективности макролидов подтвердило их высокую эффективность при лечении детей раннего возраста с острой пневмонией и при обострениях хронической инфекции. При этом полное рассасывание пневмонии происходило происходило в те же сроки, что и при парентеральном применении других антибиотиков [6]. При оральном применении эритромицина в случаях внебольничной острой пневмонии и обострении хронической пневмонии была получена клиническая эффективность 75% и 71%, соответственно. Но при этом у 16% и 19% больных наблюдались побочные реакции, потребовавшие отмены препарата. Высокая частота нежелательных реакций ограничивает применение эритромицина, особенно у детей раннего возраста. Более высокая эффективность была достигнута при применении новых макролидов: мидекамицин 82%, рокситромицин 90%, спирамицин 89%, азитромицин 93,4%. Наряду с этим отмечалась хорошая переносимость этих препаратов и редкость нежелательных реакций (35%). Подтверждаются данные литературы об эффективности и безопасности макролидных антибиотиков при лечении детей [7-9].Цефалоспориновые препараты являются в настоящее время одними из наиболее активных антибиотиков широкого спектра действия, применяемых для лечения заболеваний органов дыхания у детей, однако при внебольничных пневмониях цефалоспорины могут применяться в случае неэффективности стартовых препаратов. Среди цефалоспоринов II и III поколений, доказавших свою высокую эффективность на практике, следует отметить пероральные антибиотики цефуроксим, цефаклор и цефтибутен. Если при острой пневмонии или бронхите цефалоспорины I, II и III поколений рассматриваются, как препараты резерва, то при хронической бронхолегочной патологии, особенно связанной с пороками развития легких и бронхов, а также у детей с иммунодефицитными состояниями цефалоспорины II и III поколений являются одними из основных антибиотиков с учетом их широкого спектра действия, устойчивости к беталактамазам, высокой эффективности и хорошей переносимости [10]. При тяжелых формах заболевания пероральные препараты могут использоваться также для продолжения лечения при необходимости стартового парентерального назначения антибиотиков широкого спектра действия, их смены, комбинирования препаратов и методов введения, в том числе при ступенчатом методе лечения. Следует подчеркнуть тот факт, что детям с острыми рецидивирующими и особенно с хроническими бронхолегочными заболеваниями нередко приходится назначать повторные курсы антибактериальных препаратов. В связи с этим возникает ряд сложностей, связанных не только с развитием устойчивости возбудителей воспалительного процесса в бронхах и легких, но и продиктованных необходимостью обеспечить наиболее обоснованное, щадящее лечение. Наиболее адекватное лечение проводится с учетом антибиотикограммы. При невозможности получения этих данных и в экстренных случаях рекомендуется использование антибиотиков широкого спектра действия. В заключение следует отметить, что имеются большие резервы для повышения эффективности лечения детей с бронхолегочными заболеваниями. Создание и внедрение в педиатрическую практику эффективных пероральных антимикробных препаратов широкого спектра действия, в том числе детских лекарственных форм для приема внутрь, будет способствовать совершенствованию терапевтической тактики при заболеваниях органов дыхания у детей не только в стационарах, но и в амбулаторно поликлинических условиях. Литература: 1. Таточенко В.К., Середа Е.В., Федоров А.М., Катосова Л.К., Самсыгина Г.А., Дементьева Г.М., Страчунский Л.С. Антибактериальная терапия пневмоний у детей. Антибиотики и химиотерапия, 2000; 5: 33-40. 2. Таточенко В.К. Антибактериальная терапия внебольничной пневмонии у детей. Материалы Международной конференции Антибактериальная терапия в педиатрической практике. Москва, 1999: 45-9. 3. Вербицки С. Антибактериальная терапия внебольничной пневмонии у детей. Материалы Международной конференции Антибактериальная терапия в педиатрической практике. Москва, 1999: 42-4. 4. Середа Е.В., Катосова Л.К. Современные подходы к применению макролидов при заболеваниях органов дыхания у детей. Русский медицинский журнал, 2000; 1: 34-9. 5. Кречикова О.И. Состояние антибиотикорезистентности Streptococcus pneumoniae в России. Русский медицинский журнал Пульмонология VIII Российский национальный конгресс Человек и лекарство 2001: 8-10. 6. Таточенко В.К., Федоров А.М., Хайрулин Б.Е. Об использовании оральных антибактериальных средств в лечении острой пневмонии у детей. Педиатрия, 1992; 46: 38-41. 7. Страчунский Л.С., Козлов С.Н. Макролиды в современной клинической практике. Русич, Смоленск, 1998: 302с. 8. Йерман А., Дриновец Й. Клинические аспекты применения макролидных антибиотиков. KrKa Med Farm 1996; 16(28): 26-32. 9. Кишимото К. Место макролидов в педиатрической практике. Материалы Международной конференции Антибактериальная терапия в педиатрической практике. Москва, 1999: 52-5. 10. Середа Е.В., Рачинский С.В., Волков И.К., Катосова Л.К., Лукина О.Ф. Лечение пороков развития легких и бронхов у детей. Русский медицинский журнал, 1999; 11: 5-10 4. Опубликовано с разрешения администрации Русского Медицинского Журнала. www.medcentre.com.ua Применение системных средств лечения Acne Vulgaris (обыкновенных угрей)BETTY ANNE JOHNSON, M.D., PH.D., and JULIA R. NUNLEY, M.D. из Virginia Commonwealth University Medical College of Virginia School of Medicine, Richmond, Virginia Эффективное лечение acne vulgaris (обычных угрей) может предотвратить физические и так сказать, моральные рубцы. Терапия угрей варьирует в зависимости от тяжести состояния. Местные препараты эффективны преимущественно при удалении комедональных угрей, тогда как для лечения воспалительных угрей требуется дополнительное оральное лечение. Наиболее эффективны системные антибиотики. Современные комбинированные контрацептивы также помогают регулировать образование кожного сала у пациентов женского пола. Тяжелые нодулярные угри, которые не реагируют на топические ретиноиды и системные антибиотики могут быть излечены изотретиноином (isotretinoin). Тем не менее, отмечены выраженные побочные действия, и врачи должны быть хорошо информированы о возможных побочных действиях. (Am Fam Physician 2000;62:1823-30,1835-6.) Acne vulgaris или обычные угри – дерматологическое нарушение волосяно-сального комплекса, которое обычно развивается у подростков и уменьшается в зрелые годы. В частности, мальчики-подростки могут сильно страдать от этого заболевания и в том случае, если их не лечить, могут остаться со шрамами на всю оставшуюся жизнь. Рис 1. Стадии угря. (A) Нормальный фолликул; (B) открытый комедон (черная головка) (C) закрытый комедон (D) папула (E). Патофизиология угрей По крайней мере, четыре фактора важны для развития угрей: закупорка волосяного фолликула вязкими остатками десквамированных клеток, повышенная активность сальных желез, бактериальный рост (особенно Propionibacterium acnes) стимулируемый кожным салом (жиром) и воспалением (Рис 1). Первые изменения в волосяном фолликуле развиваются, когда волосяной канал блокируется патологически кератинизированными десквамированными клетками. Эта пробка образуется над местом открытия сальных желез в фолликулярный канал и вызывает постепенное распространение клеток и кожного сала по каналу. Указанная пробка становится видимой под поверхностью кожи как белая папулка ("белая головка" или закрытый комедон). В том случае, если фолликулярный канал расширяется, эта пробка высовывается из канала и окрашивается в черный цвет ("чёрная головка или открытый комедоны). Хотя повышенное образование кожного сала у мальчиков-подростков, вследствие повышенной андрогенной стимуляции повышает продукцию кожного сала – это не единственная причина, вызывающая угри. Бактерии (преимущественно P. acnes) имеются у многих лиц страдающих угрями. В большинстве случаев воспаление возникает благодаря действию ферментов продуцируемых этой бактерией. Эти ферменты гидролизируют кожное сало до свободных жирных кислот, которые стимулируют воспалительный процесс. Хемотаксические факторы, освобождающиеся при этой реакции, привлекают нейтрофилы. Если стенка фолликула воспалена, на поверхности кожи образуются эритематозные папулы. В условиях возрастающей продукции кожного сала, обструкции и бактериальногo роста, фолликулярный комплекс разрывается, изливая своё содержимое в кожу. Приток нейтрофилов способствует формированию пустул. Продолжающееся тяжелое воспаление приводит к образованию узлов и в последующем кист. Классификация угрей С точки зрения особенностей лечения угри могут разделяться на три категории:
Комедональные угри состоят из открытых или закрытых комедонов с небольшим воспалением или без него (Рисунок 2). Этот тип угрей обычно реагирует на топические кератолитические агенты, которые уменьшают вяжущие свойства. Эритематозные папулы или пустулы представляют собой воспалительные угри, но комедоны так же имеют место (Рисунок 3). Топических агентов может оказаться недостаточно для лечения воспалительных угрей, в этом случае может потребоваться назначение системных антибиотиков. Нодулоцистические угри могут состоять из комедонов и воспалительных поражений, так же как из глубоко расположенных узлов и кист (Рисунок 4). Хотя может оказаться достаточно шестимесячного курса системных антибиотиков, нодулоцистические угри часто требуют лечения изотретиноином (accutane). Перед началом лечения изотреноином, должна быть выяснены, возможные причины неудачного лечения антибиотиками. Необычные причины упорных угрей включают лекарственные угри, тропические угри, угри шарообразные (conglobates) и угри фульминантные. Рис.2. Комедональные угри. В закрытых комедонах (белые головки), масса десквмированных клеток закупоривает канал фолликула над местом открытия сальных желез. Сало скапливается в фолликулярном канале и приводит к появлению белой папулы видимой на поверхности кожи. При открытых комедонах (черные головки), когда отверстие фолликулярного канала расширяется, пробка высовывается из канала и окрашивается в черный цвет Рисунок 3. (Сверху и снизу) Воспалительные угри. Разрыв стенок фолликула, освобождение кожного сала, клетки и бактерии в окружающие ткани, вызывает воспаление и покраснение. Рисунок 4. (Сверху и снизу) Нодулоцистические угри. Распространенное воспаление в тканях приводит к формированию узлов, кист и абсцессов. Системная терапия Acne Оральные антибиотики. Несмотря на то, что местная терапия обычно эффективна в отношении комедональных акне, контроль воспалительных угрей обычно требует назначения системных антибиотиков. Наиболее эффективные антибиотики включают тетрациклин, доксициклин (вибрамицин), миноциклин (миноцин) и эритромицин. Эти препараты проникают в фолликулы и сальные железы и снижают рост P. acnes. Они так же имеют противовоспалительное действие независимо от их антимикробных свойств. Несмотря на то, что изредка отмечаются реакции гиперчувствительности, в общем эти антибиотики отмечаются прекрасной безопасностью, поэтому у здоровых пациентов рутинные методы лабораторного контроля не требуются .1,2 Pекомендации по назначению этих антибиотиков и подробный перечень побочных реакция приведен в таблицах 2 и 3. Тетрациклин очень дешев, но может давать побочные эффекты, включая грибковые инфекции влагалища и диспепсию (редко язвенный эзофагит). Другие редкие побочные эффекты включают фоточувствительность и псевдоопухоль мозга. Механизмы взаимодействия тетрациклина с оральными контрацептивами не ясны и поэтому молодым женщинам рекомендуется применять запасной метод контрацепции во время приема тетрациклина.3 Tетрациклин может вызывать изменения цвета формирующихся зубов и не должен назначаться беременным женщинам и детям младше 13 лет до тех пор, пока не вырастут постоянные зубы. Хотя тетрациклины имеют долгую историю своего безопасного применения, имеются примеры моноорганных дисфункций (наиболее часто, тяжелые кожные реакции), так же как несколько случаев реакций гиперчувствительности и сывороточной болезни2 (Таблица 3). Лечения тетрациклином следует избегать у пациентов с заболеваниями печени и почек. Доксициклин – производное тетрациклина, которое отличается прекрасным проникновением в фолликулы и сальные железы. Он лучше переносится, чем тетрациклин и его можно принимать во время еды. Как и другие производные тетрациклина, он часто даёт фотосенсибилизацию. Другие побочные действия аналогичны тетрациклину. ТАБЛИЦА 1.Варианты лечения Acne
* - Могут быть полезны при воспалительных изменениях Миноциклин может быть наиболее эффективен из дериватов тетрациклина, так как случаи устойчивости бактерий к этому препарату редки.4 Он может приниматься во время еды и, так же как и другие тетрациклины изредка дает реакции фотосенсибилизации. Большинство побочных эффектов миноциклина такие же, как и у других тетрациклинов (Таблица 3). Тем не менее, миноциклин может вызывать кожную гиперпигментацию рубцов, вертиго и в редких случаях, волчаночноподобный синдром. Миноциклин ассоциирован с большим количеством реакций гиперчувствительности, чем другие тетрациклины. Хотя гиперпигментации медленно исчезает, другие реакции обычно исчезают после прекращения лечения. В большинстве случаев воспаление при acne результат действия ферментов продуцируемыхPropionibacterium acnes. Эритромицин так же недорог, но часто вызывает диспепсию и абдоминальный дискомфорт, даже если его принимают во время еды. Его считают безопасным при приеме во время беременности. Однако резистентность P. acnes к эритромицину развивается более часто (в 60 процентах случаев), чем у других антибиотиков. Если, несмотря на комплайенс, системная терапия антибиотиками неудачна, необходимо подумать о двух возможных причинах: антибиотикорезистентность и фолликулит, связанный с усиленным ростом грам-негативных enterobacteriaceae, стафилококков и грибка Malassezia.4 Для оптимального выбора антибиотиков должны применяться анаэробные и аэробные культуры и определение чувствительности. Грам-негативный фолликулит часто лечат ампициллином, реже триметопримом с сульфаметаксазолом (Bactrim, Septra) и иногда иизотретиноином .5,6 Дополнение терапии топическим бензил пероксидом (benzoyl peroxide), антибиотиком широкого спектра действия так же может быть дать позитивный эффект у многих пациентов, которые страдают фолликулитом связанным с бактериями и грибами.4 Гормональная терапия Оральные контрацептивы могут быть полезным дополнением лечения всех типов acne у женщин и девочек подростков. Продукция кожного сала контролируется андрогенами, тогда, как известно, что оральные контрацептивы снижают уровень андрогенов, повышая уровень связывающих половые гормоны глобулинов, снижая уровень биологически активного свободного тестостерона. Представителю третьего поколения прогестинов норгестимату (norgestimate) меньше свойственна андрогенность, чем другим доступным в настоящее время прогестинам7 и он эффективен при лечении умеренно выраженных воспалительных угрей.8,9 Орто-Три-циклен (Ortho Tri-Cyclen) трициклическая комбинация норгестимата и ацетил эстрадиола (ethinyl estradiol) которая рекомендована U.S. Food and Drug Administration (FDA) для лечения acne vulgaris у женщин и девочек-подростков. Возможными препаратами выбора могут быть другие контрацептивы содержащие норгестимат (Ortho-Cyclen) или desogestrel (Desogen). Для появления эффекта требуется от двух до четырёх месяцев лечения. При прекращении лечения возможны рецидивы. Воспалительные угри часто требуют лечения оральными антибиотиками. Взрослые женщины, у которых наблюдаются acne в сочетании с гирсутизмом, алопецией и менструальными нарушениями должны быть обследованы для исключения яичникового и адреналового гипеандорогенизма.10,11 Основные скрининговые тесты включают измерение свободного тестостерона и уровня дегидроэпиандростерона сульфата (dehydroepiandrosterone sulfate -DHEA-S), а так же соотношение лютеинизирующего /фолликулостимулирующего гормона (LH/FSH). Повышение уровня свободного тестостерона в сыворотке крови свидетельствует о гиперандрогеновом состоянии адреналового или яичникового происхождения; повышение уровня DHEA-S level свидетельствует о адреналовом гиперандрогенизме и коэффициент LH/FSH более 3 свидетельствует о синдроме поликистоза яичников. Для лечения этих состояний требуется консультация эндокринолога. Стойкие угри могут уступить лечению изотретиноином, контрацептивам с низкоандрогенным прогестином и другим антиандрогенам таким как спиронолактон (Aldactone).11-13 Хотя спиронолактон не рекомендован FDA для лечения acne, этот препарат в дозе от 100 до 200 мг в день, может быть эффективен при лечении угрей у большинства женщин и девочек-подростков; частые побочные действия включают: нерегулярность менструаций, болезненность грудных желез и усталость.14 К числу редких осложнений у подростков, принимающих спиронолактон, относится гиперкалиемия.14 ТАБЛИЦА 2Указания по назначению системных антибиотиков
* - Приём начальной дозы должен быть продолжен до отчетливого улучшения, обычно от трех до шести недель. ИзотретиноинНодулоцистические угри, если их не лечить, могут оставлять не только физические и душевные рубцы. Эта форма угрей редко уступает топической терапии. В начале этим пациентам следует назначить оральные антибиотики. В том случае, если угри в течение шести месяцев не уступают соответствующей терапии, должно быть рекомендовано лечение изотретионоином .6 Изотретиноин оральный ретиноид, который уменьшает размер и секрецию сальных желез, нормализует, фолликулярную кератинизацию, тормозит рост P. acnes и даёт противовоспалительный эффект.15 Изотретиноин показан для лечения пациентов с нодулоцистическими угрями и вызывает улучшение этих состояний у большинства пациентов. Согласно мнению международных консенсусов, изотретиноин является препаратом первого выбора при нодулоцистических угрях. Кроме того, пациентам, которые не адекватно реагируют на соответствующую терапию, и при менее выраженных угрях может так же быть полезна такое лечение.16 Пациенты, у которых имеются рубцующиеся воспалительные угри и те, у которых угри вызывают психологическую травму, так же могут быть кандидатами на лечение изотреноином.6,16 Тем не менее, изотретиноин рекомендован FDA только для лечения тяжелых упорных нодулярных угрей. Обычная доза изотретиноина от 0,5 до 1 мг в день в два приёма, со стандартным кумулятивным максимумом от 120 до 150 мг на кг на курс лечения .6,15,16,18,19 В связи с тем, что побочные эффекты изотретиноина дозозависимы, должна быть избрана по возможности малая доза. Тем не менее, при дозировке 0.5 мг на кг в день и менее, чаще встречается неудачное лечение.16,20 В начале лечения, изотретиноин может вызвать обострение угрей. Поэтому, обычной практикой является постепенное повышение дозы, начиная от 0,1 до 0,5 мг кг в день и повышая упомянутую дозу до 1 мг/ кг в день к окончанию первого месяца лечения. 6,15 Средняя длительность лечения пять месяцев. В течение этого времени достигается желаемая общая доза от 120 до 150 мг на кг веса. Таким образом, пациентам требуется более длительный курс лечения. Который начинают с меньшей начальной или дневной дозировки. ТАБЛИЦА 3Побочные действия при применении оральных антибиотиков
*-- Фотосенсибилизация намного реже встречается при применении миноциклинов, чем при применении других тетрациклинов.†-- Отсутствие идиопатической системной красной волчанки (СКВ), наличие антинуклеарных антител и по крайней мере, один клинический признак СКВ, который исчезает при отмене препарата и может снова появиться при возобновлении терапии.‡-- Тяжелые моноорганные заболевания (например тяжелые кожные поражения, пневмониты, панкреатиты, гепатиты)§-- Лихорадка, кожные изменения с вовлечением внутренних органов, развивающиеся в течение восьми недель от начала терапии.||--Лихорадка, кожные изменения, артралгии, ± лимфоаденопатии, отмеченные в течение шести недель от начала лечения. Адьювантная терапия другими лекарственными средствами может быть назначена при лечении изотретиноином. Могут быть полезны топические антибиотики, но в таком случае должно быть прервано применение топических кератинолитиков и подсушивающих агентов, так как может развиться избыточная сухость. В некоторых случаях в начале лечения изотретиноином, может применяться оральный эритромицин и преднизолон, для того чтобы предотвратить начальное обострение угревой сыпи. С этой целью не должен применяться ни один из тетрациклинов, так как комбинация тетрациклина и изотретионина повышает вероятность развития явлений псевдоопухоли мозга.20 Пустулы исчезают более быстро, чем папулы или нодулы (узелки). Поражения на лице, верхних конечностях и ногах реагируют более быстро, чем на туловище. После того, как достигнута желательная курсовая доза от 120 до 150 мг на кг, терапия изотретиноином должна быть прервана, даже если угри исчезли не полностью. Так как улучшение может развиваться в течение от одного до двух месяцев последующих за прекращением лечения. Результаты наблюдения за пациентами в течение 10 лет, показывают, что однократный курс изотретиноина приводит к полному исчезновению угрей у более, чем 60 процентов.16 Если отмечается рецидив, то он обычно развивается, в течение первых трех лет после терапии изотретиноином; о 78 процентах рецидивов сообщается в течение первых 18 месяцев.16 Среди 39 процентов пациентов, у которых наблюдался рецидив, у 16 процентов требовалось повторное назначение оральных антибиотиков, а у 23 процентов требовалась дополнительная терапия изотретиноином.16 У больных с рецидивом может потребоваться полный курс изотретиноина. У 23 процентов пациентов, которые потребовали повторных курсов, согласно одному исследованию, 17 процентам было необходимо два курса, у 5 процентов три курса и 1 процент получил четыре – пять курсов, с предсказуемым успешным результатом и без дополнительных побочных реакций.21 Спектр побочных эффектов изотретиноина широк. Поэтому врач, назначающий это лекарственное средство должен быть хорошо информирован о возможных опасных последствиях. Пациенты должны обследоваться каждые четыре недели, на предмет побочных реакций и комплайенса терапии.18 Уменьшение дозировки и отмена терапии обычно вызывает быстрое исчезновение клинических и лабораторных побочных действий. Слизисто-кожные реакции являются наиболее частым побочным явлением .19 Сухость слизистых оболочек наблюдается почти у всех пациентов. Наиболее частой находкой является хейлит. В таких случаях требуются частые аппликации увлажняющих агентов. Многие пациенты, которые носят контактные линзы, бывают вынуждены перейти на очки из-за сухости конъюнктив. В различных популяциях с различной частотой встречается повышение фоточувствительности и покраснение кожи19Более серьезные побочные эффекты редки и чаще всего вовлекают костно-мышечную систему.19 Артралгии и мышечная скованность чаще встречается у лиц, которые часто выполняют энергичные упражнения. Долговременная терапия ретиноидами может осложняться изменениями скелета, включая остеопороз и образование остеофитов. Однако нет исследований, в которых бы сообщалось о выраженных костных изменениях связанных с кратковременными курсом изотретиноиновой терапии acne. Довольно часто наблюдается легкая и умеренная головная боль, пациенты должны обследоваться на предмет псевдоопухоли мозга, которое изредка ослoжняет лечение. Пациенты могут жаловаться на усталость и легкое снижение настроения, а изредка применение изотретиноина ассоциировано с депрессией. Имеются сообщения о пациентах принимавших изотретиноин, которые совершили суицид и поэтому за больными из группы риска необходимо тщательное наблюдение.22 Для того чтобы предотвратить побочные обменные нарушения необходимо лабораторное наблюдение (Table 4). У 25 процентов пациентов наблюдаются расстройства липидного метаболизма в виде гипетриглицеридемии и гиперхолестеринемии. Должен так же контролироваться уровень печеночных энзимов, которые изредка могут выходить из референтных пределов. 19 Хотя на этот счет существуют различные мнения, многие врачи определяют уровень печеночных ферментов в начале лечения, через две и четыре недели спустя.18,19 В том случае, если не отмечается патологических отклонений, некоторые авторы рекомендуют прекратить периодическое тестирование,9 а другие советуют продолжать тестирование каждые четыре – восемь недель.18 В том случае, если отмечается повышение уровня ферментов, снижают дозировку, или в редких случаях, прекращают лечение изотретиноином.6 От compliance (податливость) качество больного характеризующее его возможность желание выполнять предписания врача ТАБЛИЦА 4Рекомендуемый лабораторный мониторинг у лиц применяющих изотретиноин
hCG = человеческий хориональный гонадотропин - human chorionic gonadotropin.*--Официальные требования относительно показаний выдвигаемые U.S. Food and Drug Administration. Наиболее разрушительным побочным эффектом изотретиноина является тератогенность. Большие аномалии развития могут наблюдаться у 25 - 30 процентов плодов, подвергшихся действию изотретиноина.23. Наиболее распространены дефекты развития краиниофациальных, кардиальных, тимических и невральных структур.23 Несмотря на то, что программа предотвращения беременности реализуется по указаниям производителя, беременность встречается у 3,4 на 1,000 курсов лечения изотретиноином.24 Врачи должны поощряться к применению "Информации для пациента относительно лечения " - формы, которая получена от производителя, во время консультации пациентов. До начала лечения, пациентка должна быть освидетельствована на предмет отсутствия беременности. Так же должны быть применены два конкурентных, эффективных метода контроля рождаемости за один месяц до начала терапии изотретиноином. Контрацепция должна проводиться в течение всего курса лечения и в течение одного месяца спустя после отмены терапии.25 ССЫЛКИ: 1. Driscoll MS, Rothe MJ, Abrahamian L, Grant-Kels JM. Long-term oral antibiotics for acne: is laboratory monitoring necessary? J Am Acad Dermatol 1993;28:595-602.2. Shapiro LE, Knowles SR, Shear NH. Comparative safety of tetracycline, minocycline, and doxycycline. Arch Dermatol 1997;133:1224-30.3. Miller DM, Helms SE, Brodell RT. A practical approach to antibiotic treatment in women taking oral contraceptives. J Am Acad Dermatol 1994;30: 1008-11.4. Eady EA. Bacterial resistance in acne. Dermatology 1998;196:59-66.5. Ortonne JP. Oral isotretinoin treatment policy. Do we all agree? Dermatology 1997;195(suppl 1):34-7.6. Cunliffe WJ, van de Kerkhof PC, Caputo R, Cavicchini S, Cooper A, Fyrand OL, et al. Roaccutane treatment guidelines: results of an international survey. Dermatology 1997;194:351-7.7. Phillips A. The selectivity of a new progestin. Acta Obstet Gynecol Scand Suppl 1990;152:21-4.8. Lucky AW, Henderson TA, Olson WH, Robisch DM, Lebwohl M, Swinyer LJ. Effectiveness of norgestimate and ethinyl estradiol in treating moderate acne vulgaris. J Am Acad Dermatol 1997;37:746-54.9. Redmond GP. Effectiveness of oral contraceptives in the treatment of acne. Contraception 1998;58: 29S-33S.10. Goulden V, Clark SM, Cunliffe WJ. Post-adolescent acne: a review of clinical features. Br J Dermatol 1997;136:66-70.11. Diamanti-Kandarakis E. Current aspects of antiandrogen therapy in women. Curr Pharm Des 1999;5:707-23.12. Beylot C, Doutre MS, Beylot-Barry M. Oral contraceptives and cyproterone acetate in female acne treatment. Dermatology 1998;196:148-52.13. Schmidt JB. Other antiandrogens. Dermatology 1998;196:153-57.14. Shaw JC. Antiandrogen and hormonal treatment of acne. Dermatol Clin 1996;14:803-11.15. Leyden JJ. The role of isotretinoin in the treatment of acne: personal observations. J Am Acad Dermatol 1998;39:45-8.16. Layton AM, Knaggs H, Taylor J, Cunliffe WJ. Isotretinoin for acne vulgaris--10 years later: a safe and successful treatment. Br J Dermatol 1993;129: 292-6.17. Accutane prescribing information. Nutley, N.J.: Roche Pharmaceuticals, 1998.18. Orfanos CE, Zouboulis CC. Oral retinoids in the treatment of seborrhea and acne. Dermatology 1998;196:140-7.19. Meigel WN. How safe is oral isotretinoin? Dermatology 1997;195(suppl 1):22-8.20. Wolverton SE. Retinoids. In: Wolverton SE, Wilkin JK, eds. Systemic drugs for skin diseases. Philadelphia: Saunders, 1991:187-218.21. Stainforth JM, Layton AM, Taylor JP, Cunliffe WJ. Isotretinoin for the treatment of acne vulgaris: which factors may predict the need for more than one course? Br J Dermatol 1993;129:297-301.22. Lamberg L. Acne drug depression warnings higlight need for expert care [News]. JAMA 1998; 279:1057.23. Lammer EJ, Chen DT, Hoar RM, Agnish ND, Benke PJ, Braun JT, et al. Retinoic acid embryopathy.N Engl J Med 1985;313:837-41.24. Mitchell AA, Van Bennekom CM, Louik C. A pregnancy-prevention program in women of childbearing age receiving isotretinoin. N Engl J Med 1995;333:101-6.25. Shear NH. Oral isotretinoin: prescribers beware [Editorial]. CMAJ 1999;160:1723-4. medafarm.ru |
г.Самара, ул. Димитрова 131 [email protected] |
 |