|
|
||||||||||
|
Новости медицины в Европе EuroMedNews. Антибиотик против эшерихия колиКишечная палочка (E.coli) [LifeBio.wiki] ВведениеКишечная палочка и родственные бактерии составляют около 0,1% от кишечной флоры, и фекально-оральный путь передачи является основным маршрутом, через который патогенные штаммы бактерии вызывают болезни. Клетки способны выживать вне тела в течение ограниченного промежутка времени, что делает их идеальными индикаторными организмами для тестирования проб окружающей среды относительно фекального загрязнения. Бактерия также может быть выращена легко и недорого в лабораторных условиях, и интенсивно исследуется на протяжении более 60 лет. Кишечная палочка является наиболее широко изученной прокариотической моделью организма, а также важным видов в области биотехнологии и микробиологии, где служит в качестве организма-хозяина для большей части работ с рекомбинантной ДНК. Немецкий врач-педиатр и бактериолог Теодор Эшерих обнаружили кишечную палочку в 1885 году, и теперь она классифицируется как часть семейства Enterobacteriaceae гамма-протеобактерий. 2) СеротипыПатогенные штаммы E. coli могут быть категоризированы на основании элементов, которые могут вызывать иммунный ответ у животных, а именно: O антиген: часть липополисахаридного слоя K антиген: капсула H антиген: флагеллин Например, штамм Е. coli EDL933 принадлежит к группе O157: H7. O антигенНаружная мембрана клетки палочки Е. содержит миллионы молекул липополисахаридов (LPS), которые состоят из:
Антиген O используется для серотипирования кишечной палочки и эти обозначения группы O идут от O1 до O181, за исключением некоторых групп, которые исторически были удалены, а именно, O31, O47, O72, О67, O93 (ныне K84), O94 и O122; группы 174 до 181 являются предварительными (O174 = OX3 и O175 = OX7) или изучаются (от 176 до 181 – STEC / VTEC). Кроме того, существуют подтипы для многих групп O (например, O128ab и O128ac). Следует отметить, однако, что антитела по отношению к нескольким антигенам O перекрестно реагируют с другими антигенами O и частично с K антигенами не только из E.coli, но и от других видов бактерий Escherichia и вида Enterobacteriaceae. 3) Антиген O кодируется генным кластером rfb. Рол (cld) ген кодирует регулятор длины липополисахаридной O-цепи. K антигенКислый капсульный полисахарид (КПС) представляет собой толстый слизистый слой полисахарида, который окружает некоторые патогены E.coli. Существуют две отдельные группы K-антигеновых групп, называемые группа I и группа II (в то время как небольшая промежуточная группа (K3, K10 и K54 / K96) была классифицирована как группа III). Первая (I) группа состоит из 100 кДа (крупных) капсульных полисахаридов, а вторая (II) связана с внекишечными заболеваниями и имеет размер меньше 50 кДа. Группа IK антигенов обнаруживаются только с определенными О-антигенами (группы О8, O9, O20 и O101), далее они подразделяются на основании отсутствия (IA, аналогично видам Klebsiella в структуре) или присутствия (IB) аминосахаров и некоторые K-антигены группы I прикреплены к липидному А-ядру липополисахарида (KLPS), аналогичным образом, как антигены O (и, будучи структурно идентичны антигенам O, в некоторых случаях рассматриваются только как K антигены при совместной экспрессии с другим подлинным антигеном O). Антигены из группы II K напоминают антигены грам-положительных бактерий и сильно различаются по составу и далее подразделяются в соответствии с их кислотными компонентами. Как правило, 20-50% цепей КПС связаны с фосфолипидами. В общей сложности, насчитывается 60 различных K антигенов, которые были признаны (K1, K2A / переменного тока, К3, К4, К5, К6, К7 (= K56), К8, К9 (= O104), K10, K11, K12 (K82), K13 (= K20 и = K23), K14, K15, K16, K18a, K18ab (= K22), K19, K24, K26, K27, K28, K29, K30, K31, K34, K37, K39, K40, K41, K42 , K43, K44, K45, K46, K47, K49 (o46), K50, K51, K52, K53, K54 (= K96), K55, K74, K84, K85ab / акр (= O141), K87 (= O32), K92, K93, K95, K97, K98, K100, K101, K102, K103, KX104, KX105, и KX106). H антигенАнтиген Н является основным компонентом жгутиков, участвующим в движении кишечной палочки. Он, как правило, кодируется геном FLIC. Существует 53 идентифицированных антигена H, пронумерованных от h2 до Н56 (Н13 и Н22 не были антигенами E.coli, но входят в группу Citrobacter freundii и было обнаружено, что Н50 – это то же самое, что h20). 4) Роль в развитии болезнейУ людей и у домашних животных, вирулентные штаммы кишечной палочки могут вызывать различные заболевания. В организме человека: гастроэнтерит, инфекции мочевых путей, а также менингит у новорожденных. В более редких случаях, вирулентные штаммы также могут вызывать гемолитико-уремический синдром, перитонит, мастит, септицемию и грамотрицательную пневмонию. Желудочно-кишечные инфекцииКаждая отдельная бактерия представляет собой округлый цилиндр. Некоторые штаммы кишечной палочки, такие как O157: H7, O104: h5, O121, O26, O103, O111, O145 и O104: h31, производят потенциально смертельные токсины. Пищевое отравление, вызванное кишечной палочкой, может быть вызвано употреблением в пищу немытых овощей или плохо разделанного и плохо приготовленного мяса. O157: H7 также печально известно благодаря тому, что вызывает серьезные и даже угрожающие жизни осложнения, такие как гемолитико-уремический синдром. Этот штамм связан со вспышками кишечной палочки 2006 года в США из-за свежего шпината. O104: h5 штамм является одинаково вирулентным. Против него не так хорошо развиты методы лечения антибиотиками и поддерживающие протоколы лечения (он может быть очень энтерогеморрагическим, как O157: H7, вызывая кровавый понос, но и более энтероагрегативным, то есть, он хорошо адгезируется и прилипает к кишечным мембранам). Этот штамм ответственен за смертельную вспышку кишечной палочки в Европе в июне 2011 года. Степень тяжести заболевания значительно варьирует; это может привести к летальному исходу, особенно у детей младшего возраста, пожилых людей или лиц с ослабленным иммунитетом, но чаще протекает в более мягкой форме. Ранее, в 1996 году, плохая гигиена при приготовлении мяса в Шотландии вызвала гибель семи человек из-за отравления кишечной палочкой, и сотни человек получили заражение. Кишечная палочка может питать как термостойких, так и термолабильных энтеротоксинов. Последние, названные LT, содержат одну А субъединицу и пять В субъединиц, расположенных в одном голотоксине, и в высокой степени сходны по своей структуре и функции с холерными токсинами. В субъединицы способствуют присоединению и вступлению токсина в кишечные клетки-хозяева, в то время как А субъединица расщепляется и предотвращает поглощению воды клетками, вызывая диарею. LT секретируется в ходе типа 2 пути секреции. Если бактерии кишечной палочки избегают желудочно-кишечного тракта через перфорацию (например, от язвы, разорванного аппендикса, или из-за хирургической ошибки) и проникают в живот, они обычно вызывают перитонит, который могут привести к летальному исходу без своевременного лечения. Тем не менее, кишечная палочка чрезвычайно чувствительна к таким антибиотикам, как стрептомицин или гентамицин. Последние исследования показывают, что лечение энтеропатогенной кишечной палочки антибиотиками может не улучшить исход заболевания, поскольку это может значительно увеличить вероятность развития гемолитического-уремического синдрома. 5) E.coli в слизистой оболочке кишечника наблюдаются в повышенных количествах при воспалительных заболеваниях кишечника, болезни Крона и неспецифическом язвенном колите. Высокие количества инвазивных штаммов E.coli существуют в больших количествах в воспаленной ткани, а количество бактерий в воспаленных участках коррелирует с тяжестью воспаления кишечника. Желудочно-кишечные инфекции могут привести к развитию Т-клеток памяти, которые атакуют микробы кишечника в кишечном тракте. Пищевое отравление может вызвать иммунный ответ на микробные бактерии кишечника. Некоторые исследователи предполагают, что это может привести к воспалительным заболеваниям кишечника. ВирулентностьКишечная палочка E.coli (ЕС) классифицируется на основе серологических характеристик и свойств вирулентности. Виротипы включают: Энтеротоксигенная кишечная палочка (ETEC) является возбудителем диареи (без лихорадки) у человека, свиньи, овцы, козы, крупного рогатого скота, собак и лошадей. ETEC использует фимбриальные адгезины (проекции из бактериальной клеточной поверхности), чтобы связать клетки энтероцитов в тонком кишечнике. ETEC может производить два протеиновых энтеротоксина: Больший из этих двух белков, LT энтеротоксин, подобен холерному токсину по структуре и функциям. Меньший белок, ST энтеротоксин, вызывает скопление цГМФ в клетках-мишенях и последующую секрецию жидкости и электролитов в просвет кишечника. Штаммы ETEC являются неинвазивным, и они не оставляют просвета кишечника. ETEC является ведущей бактериальной причиной диареи у детей в развивающихся странах, а также наиболее частой причиной диареи путешественников. Каждый год ETEC вызывает более 200 миллионов случаев диареи и 380000 смертей, в основном, у детей в развивающихся странах. 6)Энтеропатогенная кишечная палочка (ЕРЕС) является возбудителем диареи у людей, кроликов, собак, кошек и лошадей. Подобно ETEC, ЕРЕС также вызывает понос, но молекулярные механизмы колонизации и этиология различны. ЕРЕС не имеет ST и LT токсинов, но использует адгезин, известный как интимин, для связывания клеток кишечника хозяина. Этот виротип имеет множество факторов вирулентности, которые подобны Shigella, и может иметь токсин Шига. Связывание со слизистой оболочкой кишечника вызывает перегруппировку актина в клетке-хозяине, приводя к значительным деформациям. ЕРЕС клетки являются умеренно инвазивными (т.е. они проникают в клетки-хозяева) и вызывают воспалительную реакцию. Изменения ультраструктуры кишечных клеток из-за «привязанности и сглаживания», скорее всего, является основной причиной диареи у тех, кто страдает ЕРЕС. Энтероинвазивная кишечная палочка (EIEC) встречается только у людей. EIEC инфекция вызывает синдром, который идентичен дизентерии, с обильной диареей и высокой температурой. Энтерогеморрагическая E. coli (EHEC) содержится в организме человека, крупного рогатого скота и коз. Наиболее печально известным членом этого виротипа является штамм O157: H7, который вызывает кровавый понос без лихорадки. EHEC может вызвать гемолитико-уремический синдром и синдром внезапной почечной недостаточности. Он использует бактериальные фимбрии для прикрепления (общий пилус E.coli, ECP), [19] умеренно инвазивен и обладает фаго-закодированным токсином Шига, который может вызывать интенсивную воспалительную реакцию. Энтероаггегантная E. coli (ЕАЭС) обнаружена только в организме человека называется так потому, что имеет фимбрии, которые агрегируют клетки культуры ткани. ЕАЭС связываются со слизистой оболочкой кишечника, вызывая водянистый понос без лихорадки. EAEC неинвазивны. Они производят гемолизин и энтеротоксин ST, подобно ЕТЕС. Адгезивно-инвазивные E. coli (AIEC) обнаружены в организме человека. AIEC способны вторгаться в эпителиальные клетки кишечника и размножаться внутриклеточно. Вполне вероятно, что AIEC способны более эффективно размножаться в организмах с дефектным врожденным иммунитетом. Они связаны со слизистой оболочкой кишечника при болезни Крона. Эпидемиология инфекции желудочно-кишечного трактаПередача патогенной кишечной палочки часто происходит фекально-оральным путем. Общие пути передачи включают в себя:. Негигиеничное приготовление пищи, фермерское загрязнение из-за навоза, орошение посевов загрязненной или грязной водой из неочищенных сточных вод, наличие одичавших свиней на пахотных землях, или прямое потребление сточных загрязненных вод. Молочный и крупный рогатый скот являются основными резервуарами кишечной палочки O157: H7, и они могут переносить его бессимптомно и распространять через свои фекалии. Пищевые продукты, связанные со вспышками E.coli, включают огурец, сырой мясной фарш, сырые ростки семян или шпинат, сырое молоко, непастеризованный сок, непастеризованный сыр и продукты, загрязненные инфицированными работниками пищевой промышленности фекально-оральным путем. В соответствии Управлением по безопасности продуктов питания и лекарственных средств США, фекально-оральный цикл передачи может быть нарушен при правильном приготовлении пищи, предотвращении перекрестного загрязнения, использовании барьеров, таких как перчатки, для пищевых работников, политика здравоохранения, обращение сотрудников пищевой промышленности за медицинской помощью, если они больны, пастеризация сока или молочных продуктов и соответствующие требования для мытья рук. Кишечная палочка, продуцирующая Шига токсин (STEC), в частности, серотип O157: H7, также передавался через мух, а также при непосредственном контакте с сельскохозяйственными животными, животными из мини-зоопарка, и частицами, распространяющимися в воздухе, в среде, где содержатся животные. 7) Инфекции мочевыводящих путейУропатогенные кишечные палочки (UPEC) являются причиной примерно 90% инфекций мочевыводящих путей (ИМП), наблюдаемых у людей с обычной анатомией. При восходящих инфекциях, фекальные бактерии колонизируют уретру и распространяются от мочевого тракта до мочевого пузыря, а также в почки (вызывая пиелонефрит), или простату у мужчин. Поскольку женщины имеют более короткий мочеиспускательный канал, чем мужчины, они в 14 раз чаще страдают от восходящих ИМП. Уропатогенные кишечные палочки используют P фимбрии (пиелонефрит-ассоциированные пили), чтобы связать уротелиальные клетки мочевых путей и колонизировать мочевой пузырь. Эти адгезины специфически связывают фрагменты D-галактоза-D-галактозы на антигене P групп крови эритроцитов и уроэпителиальных клетках. Примерно 1% населения Земли испытывает недостаток этого рецептора, и его присутствие или отсутствие опосредует восприимчивость или не восприимчивость человека к инфекции мочевых путей E.coli, соответственно. Уропатогенные кишечные палочки производят альфа- и бета-гемолизины, которые вызывают лизис клеток мочевых путей. Другим фактором вирулентности, который обычно присутствует в UPEC, является семейство Dr из адгезинов, которые особенно связаны с циститом и ассоциированным с беременностью пиелонефритом. Адгезины Dr связывают антиген Dr группы крови (DRA), который присутствует на распад ускоряющем факторе (DAF) на эритроцитах и других типах клеток. Там, Dr адгезины индуцируют развитие длинных клеточных расширений, которые обертываются вокруг бактерий, сопровождаясь активацией нескольких сигнальных каскадов, включая активацию PI-3-киназы. UPEC может обойти врожденную иммунную защиту организма (например, систему комплемента), вторгаясь в поверхностные клетки с образованием внутриклеточных бактериальных сообществ (ВБС). Кроме того, они обладают способностью к образованию K антигена, капсульных полисахаридов, которые способствуют образованию биопленки. Кишечные палочки, производящие биопленку, являются недостижимыми для иммунных факторов и антибактериальной терапии, и часто влияют на развитие хронических инфекций мочевых путей. Инфекции E.coli, производящие K антиген, обычно встречаются в верхних мочевых путях. Нисходящие инфекции возникают, хотя и сравнительно редко, когда клетки кишечной палочки входят в органы верхних мочевых путей (почки, мочевой пузырь или мочеточники) из потока крови. Неонатальный менингит (NMEC)Производится серотипом кишечной палочки, которая содержит капсульный антиген под названием K1. Колонизация кишечника новорожденного этими штаммами, которые присутствуют во влагалище матери, приводит к бактериемии, которая, в свою очередь, приводит к менингиту. И из-за отсутствия антител класса IgM от матери (они не пересекают плаценту, потому что FcRn опосредует только передачу IgG), к тому же, стоит учитывать также тот факт, что организм распознает антиген K1 как часть себя, поскольку он напоминает церебральные гликопептиды, и приводит к развитию серьезной степени менингита у новорожденных. Роль в развитии рака или клеточном старенииСуществуют некоторые штаммы кишечной палочки, которые содержат геномный остров поликетидсинтазы (PKS), чья функция заключается в кодировании мульти-ферментативного механизма, который производит генотоксическое вещество, называемое колибактин. Колибактин может вызывать клеточное старение или рак, повреждая ДНК. Тем не менее, барьер слизистой оболочки препятствует достижению E.coli поверхности энтероцитов. Только тогда, когда совместно с инфекцией E. coli развиваются некоторые воспалительные поражения, бактерия способна вводить колибактин в энтероциты, вызывая развитие опухоли. Болезни животныхУ животных, вирулентные штаммы E.coli вызывают различные заболевания, среди прочих – септицемия и диарея у новорожденных телят, острый мастит у молочных коров, колибактериоз также ассоциируется с хроническими респираторными заболеваниями с микоплазмой, вызывая перигепатит, перикардит, септические легкие, перитонит и т.д. у домашней птицы, и гниль Алабама у собак. Большая часть серотипов, выделенных из птицы, являются патогенными только для птиц. Таким образом, птичьи источники кишечной палочки не кажутся важными источниками инфекций у других животных. Лабораторная диагностикаВ образцах кала, микроскопия покажет грамотрицательные стержни, без особого расположения клеток. Затем, либо агар МакКонки или агар ЕМВ (или оба) высевают с калом. На агаре МакКонки, образуются темно-красные колонии, поскольку организм является лактозоположительным, и ферментация этого сахара приведет к падению среднего уровня рН, что приводит к потемнению среды. Рост на агаре EMB производит черные колонии с зеленовато-черным металлическим блеском. Это служит для диагностики кишечной палочки. Организм также лизин-положителен, и растет на TSI с (А / А / g + / h3S-) профилем. Кроме того, IMViC {+ + - -} для E.coli; поскольку он индол-положительный (красное кольцо) и метил красно-положительный (ярко-красный), но VP-отрицательный (без изменений-бесцветный) и цитрат-отрицательный (без изменений-зеленый цвет). В тестах для токсина могут использоваться клетки млекопитающих в культуре ткани, которые быстро убиваются токсином Шига. Несмотря на то, что этот метод чувствительный и очень специфический, он является медленным и дорогим. 8) Как правило, диагноз делается при культивировании на сорбит МакКонки среде, а затем – с помощью типирования антисыворотки. Тем не менее, в настоящее время анализы латекса и некоторые типирования антисыворотки показали перекрестные реакции с колониями не-E.coli O157. Кроме того, не все штаммы кишечной палочки O157, связанные с HUS, являются несорбитольными ферментёрами. Государственный совет и Территориальные эпидемиологи рекомендуют клиническим лабораториям проводить скрининг, по крайней мере, всего кровавого стула на наличие этого патогена. Центры США по контролю и профилактике заболеваний рекомендуют, «весь стул, представленный для обычного тестирования у пациентов с острой внебольничной диареей (независимо от возраста больного, времени года, или присутствия или отсутствия крови в стуле) одновременно культивировать на E. coli O157:H7 (O157 STEC) и тестировать с помощью анализа, который обнаруживает токсины Шига для обнаружения не-O157 STEC». Антибактериальная терапия и резистентностьБактериальные инфекции обычно лечат с помощью антибиотиков. Тем не менее, чувствительности к антибиотикам у различных штаммов E.coli отличается друг от друга. В качестве грамотрицательного микроорганизма, кишечная палочка устойчива ко многим антибиотикам, которые эффективны против грамположительных микроорганизмов. Антибиотики, которые могут быть использованы для лечения инфекции E. coli, включают амоксициллин, а также другие полусинтетические пенициллины, много цефалоспоринов, карбапенемов, азтреонам, триметоприм-сульфаметоксазол, ципрофлоксацин, нитрофурантоин и аминогликозиды. Устойчивость к антибиотикам является растущей проблемой. Частично, это происходит из-за чрезмерного использования антибиотиков, но частично это, вероятно, связано с применением антибиотиков в качестве стимуляторов роста в кормах для животных. В исследовании, опубликованном в журнале Science в августе 2007 года, было установлено, что скорость приспособительных мутаций у E.coli составляет «порядка 10-5 на геном, за поколение, что в 1000 раз выше, чем предыдущие оценки». Это открытие может иметь значение для изучения и управления бактериальной резистентностью к антибиотикам. Устойчивые к антибиотикам кишечные палочки могут также передавать гены, ответственные за устойчивость к антибиотикам, к другим видам бактерий, таким как золотистый стафилококк, посредством процесса, называемого горизонтальный перенос генов. Бактерии E. coli часто несут несколько плазмид с лекарственной резистентностью, и в условиях стресса способны легко передавать эти плазмиды другим видам. В самом деле, E.coli является частым членом биопленки, где существует много видов бактерий в непосредственной близости друг от друга. Это смешение видов позволяет штаммам E.coli принимать и передавать плазмиды из других бактерий и обратно. Таким образом, E.coli и другие энтеробактерии являются важными резервуарами переводимой устойчивости к антибиотикам. Штаммы бета-лактамазыУстойчивость к бета-лактамным антибиотикам стала особой проблемой в последние десятилетия, поскольку штаммы бактерий, которые производят бета-лактамазы расширенного спектра, становятся все более распространенными. Эти ферменты бета-лактамазы делают многие, если не все, пенициллины и цефалоспорины неэффективными в качестве терапии. E.coli расширенного спектра, продуцирующие бета-лактамазы (ESBL E.coli), обладают высокой устойчивостью к массе антибиотиков, и инфекции, вызванные этими штаммами, трудно поддаются лечению. Во многих случаях, только два пероральных антибиотика и очень ограниченная группа внутривенных антибиотиков, остаются эффективными. В 2009 году, в Индии и Пакистане на бактерии E.coli был обнаружен ген под названием ген металло-бета-лактамазы Нью-Дели (сокращенно NDM-1), который дает резистентность даже к внутривенному антибиотику карбапенему. Повышенная озабоченность по поводу распространенности этой формы «супербактерии» в Соединенном Королевстве привела к призывам к дальнейшему мониторингу и стратегиям для борьбы с инфекциями и смертями по всей Великобритании. Тестирование к восприимчивости должно определять лечение всех инфекций, при которых организм может быть выделен для культуры. ФаготерапияФаготерапия – использование вирусов, которые направленно воздействуют на патогенных бактерий, была разработана в течение последних 80 лет, в основном, в странах бывшего Советского Союза, где она использовалась для предотвращения диареи, вызванной кишечной палочкой. В настоящее время, фаготерапия для людей доступна только в центре фаготерапии в Республике Грузия и в Польше. Тем не менее, 2 января 2007 года FDA Соединенных Штатов дало одобрение для компании Omnilytics на применение фага, убивающего кишечную палочку O157: H7 для живых животных, которые будут зарезаны для потребления человеком. Фага энтеробактерии Т4, широко изученная фага, направлена на кишечную палочку. ВакцинацияИсследователи активно работают над разработкой безопасных, эффективных вакцин для снижения случаев инфекции E. coli во всем мире. В марте 2006 года сообщалось, что вакцина, вызывающая иммунный ответ против палочки E. coli O157:H7 О-специфический полисахарид, конъюгированный с рекомбинантным экзотоксином А синегнойной палочки (O157- rEPA), является безопасной у детей от двух до пяти лет. Предыдущая работа уже указала, что она безопасна для взрослых. Планируется III фаза клинических испытаний, чтобы проверить крупномасштабную эффективность лечения. В 2006 году, Fort Dodge Animal Health (Уайет) представил эффективную, живую, ослабленную вакцину для борьбы с аэроциститом и перитонитом у кур. Вакцина представляет собой генетически модифицированную авирулентную вакцину, которая продемонстрировала защиту от O78 и нетипируемых штаммов. В январе 2007 года канадская биофармацевтическая компания Bioniche объявила о разработке вакцины для скота, которая уменьшает количество O157:H7 в навозе, на коэффициент 1000, то есть, убивет около 1000 патогенных бактерий на грамм навоза. В апреле 2009 года исследователь Университета штата Мичиган объявил, что он разработал рабочую вакцину для штамма E.coli. Доктор Махди Саид, профессор эпидемиологии и инфекционных заболеваний в колледжах ветеринарной медицины и медицины человека Университета штата Мичиган, подал патентную заявку на свое открытие и вступил в контакт с фармацевтическими компаниями для её коммерческого производства. :TagsСписок использованной литературы:1) Bentley R, Meganathan R (Sep 1982). «Biosynthesis of vitamin K (menaquinone) in bacteria». Microbiological Reviews 46 (3): 241–80. PMC 281544. PMID 6127606 2) Eckburg PB, Bik EM, Bernstein CN, Purdom E, Dethlefsen L, Sargent M, Gill SR, Nelson KE, Relman DA (Jun 2005). «Diversity of the human intestinal microbial flora». Science 308 (5728): 1635–8. Bibcode:2005Sci…308.1635E. doi:10.1126/science.1110591. PMC 1395357. PMID 15831718 3) Tatum E. L.; Lederberg J. (1947). «Gene recombination in the bacterium Escherichia coli». J. Bacteriol 53: 673–684 4) E. coli genotypes – OpenWetWare 5) D'Herelle F (1918). «Sur le rôle du microbe filtrant bactériophage dans la dysenterie bacillaire». Compt. Rend. Acad. Sci. 167: 970–972. 6) Kuttner A. G. (1923). «Bacteriophage phenomena». J. Bacteriol 8 (1): 49–101. PMC 379003. PMID 16558985 7) «The Phage Course – Origins». Cold Spring Harbor Laboratory. 2006. Archived from the original on September 16, 2006. Retrieved 2007-12-03 8) Bacteria make major evolutionary shift in the labкишечная_палочка.txt · Последние изменения: 2016/07/02 14:32 — nataly lifebio.wiki Эшерихия коли в мазке: причины, симптомы, лечениеУсловно-патогенные бактерии Эшерихия коли в мазке — сигнал о сбое в работе пищеварительной или мочеполовой системы. При появлении такого симптома нужно немедленно начинать лечение антибиотиками. Медикаменты помогут предотвратить переход заболевания в хроническую форму. Причины появления Эшерихии колиЭшерихии коли или кишечные палочки — это бактерии палочкообразной формы, обитающие обычно в кишечнике. По разным причинам они способны увеличивать территорию своего обитания, заселяя, кроме кишечника, влагалище и мочевые пути. Кишечные палочки могут размножаться практически в любом человеческом органе, так как для жизни им нужны всего лишь влажная среда и стабильная температура.  Эшерихия коли есть даже в абсолютно здоровой микрофлоре влагалища, но их рост и размножение сдерживают лактобактерии. Если лактобактерии по какой-то причине исчезают (например, после лечения антибиотиками), то начинается бурное размножение эшерихии коли, а заодно других условно-патогенных микроорганизмов: кандид, стафилококков, энтеробактерий. В мазке из влагалища и цервикального канала найти эшерихий коли сложно, так как микроб образует колонии в виде цепочек, которые ошибочно диагностируют как стафилококковые. Легче обнаружить эшерихий коли в посеве мазка. К сдаче мазка на посев нужно подготовиться — вымыть теплой чистой водой интимные органы без мыла и геля, за несколько дней до анализа отказаться от алкоголя. Эшерихия коли резистентна к основным видам антибиотиков и антибактериальных препаратов. Лечение кишечной палочки в мазке долгое и комплексное, причем результатов удается добиться не всегда. Одной из распространенных причин заселенности влагалища E-coli является недостаточная личная гигиена мочеполовых органов. Заразиться можно половым путем и через общие банные полотенца, мочалки, белье, но для этого нужно, чтобы иммунитет был ослаблен: люди с сильной иммунной защитой не могут заразиться кишечной палочкой бытовым путем. Видео: Кишечная палочка, размножившись в мочеполовых путях, приводит к развитию воспалений. Кроме посева мазка, эшерихию коли можно обнаружить в посеве мочи. В таком случае можно говорить о воспалительном процессе в почках, мочеточниках или мочевом пузыре. Нефрологические и урологические инфекции очень опасны, так как могут стать причинами почечной недостаточности. Симптомы заболеванияЗаражение влагалища и мочевых путей кишечной палочкой редко проходит бессимптомно. Признаками инфицирования мочеполовых органов могут стать:
Без врачебного вмешательства рост кишечной палочки во влагалище и цервикальном канале будет продолжаться, а состояние здоровья ухудшаться. Со временем бактерионосительство переходит в хроническую стадию, после чего качество жизни пациентки сильно снижается, так как появляются специфический дискомфорт, зуд, жжение во влагалище и постоянные проблемы с мочеиспусканием. Кишечные палочки могут долгое время без вреда для себя находиться на воздухе, поэтому ими можно заразиться бытовым путем. Попав в мочеполовую систему, они находят там для себя благоприятные условия для размножения. Видео: Избавиться от эшерихии коли в мазке непросто, лучше не допустить инфицирования влагалища кишечной палочкой. Для этого нужно соблюдать личную и социальную гигиену:
Правила просты и общеизвестны, их соблюдение защищает от множества неприятностей со здоровьем. Заниматься самолечением эшерихии коли в мазке означает попусту тратить время. После появления первых же неприятных симптомов дисбактериоза влагалища нужно немедленно обратиться к гинекологу. Доктор возьмет мазок на посев и выяснит причины зуда и жжения. Способы леченияЛечение назначается строго индивидуально, перед назначением антибиотиков врач должен проверить чувствительность микроорганизмов к лекарству. В последнее время женщинам, у которых в мазке обнаружено избыточное количество кишечной палочки, перестали прописывать антибиотики, так как микроорганизм приобрел резистентность, образовав стойкие разновидности и гибриды. Лечение E-coli в мазке нужно начинать с восстановления микрофлоры кишечника. Пролечив дисбактериоз, можно заодно избавиться от эшерихии коли в мазке и моче без антибиотиков. Для восстановления микрофлоры кишечника используют пробиотики: Бифиформ, Линекс, Энтерол, Трихопол и другие. Врач индивидуально подберет курс, поэтому, возможно, потребуется сменить несколько лекарств. Во время лечения придется соблюдать диету. Видео: Запрещено есть продукты, полученные в результате брожения, квашения и копчения. Под запретом оказываются пиво, дрожжевое тесто, вино, квашеные овощи и даже мед. Другими словами, избавляться от эшерихии коли в мазке придется с помощью не только гинеколога, но и гастроэнтеролога. Для лечения от эшерихии коли в мазке не обязательно колоть антибиотики, можно попытаться искусственно заселить влагалище лактобактериями. Восстановить нормальную вагинальную флору можно с помощью свечей Ацилакт, Вагинорм, Гинофлор. Вести борьбу с микроорганизмами можно с помощью препарата «Интести-бактериофаг», представляющим собой раствор для ректального и вагинального введения и приема внутрь. Лекарство помогает избавиться не только от дисбактериоза влагалища, но и от нарушений в балансе кишечной микрофлоры, энтероколита, колита и даже дизентерии и сальмонеллеза. Средство можно применять даже ребятишкам первых месяцев жизни. Курс лечения составляет 7 – 10 дней. Особенно опасны кишечные палочки в мазке во время беременности, так как могут привести к развитию цистита, пиелонефрита и аднексита. Заболевания мочеполовой системы у беременной женщины лечатся в стационаре. Доктор назначит антибиотики, которые можно применять без опасения навредить плоду. Лечение эшерихии коли в мазке нужно вести до тех пор, пока их уровень не упадет до нормального показателя и не исчезнут симптомы инфекции.  На это может уйти от нескольких недель до нескольких месяцев, ведь придется не только избавиться от инфекции в мочеполовых органах, но и восстановить естественную микрофлору. Заболевания, возникшие в результате дисбактериоза влагалища, после перехода в хроническую стадию могут привести к бесплодию. Любая женщина, у которой обнаружено превышение эшерихий коли в мазке, должна помнить об этой опасности и не пренебрегать лечением. moydiagnos.ru кишечная палочка - Лечебно-Диагностический Центр Полярной МедициныЭшерихиозы Патогенные серотипы кишечных палочек могут быть причиной эшерихиозов — различных инфекционных заболеваний, протекающих с интоксикацией, лихорадкой, обычно с поражением желудочно-кишечного тракта, реже — мочевыводящих, желчевыводящих путей, других органов или с развитием сепсиса. Эшерихиозы чаще встречаются у детей раннего возраста. Механизм распространения эшерихиозов ЖКТ — фекально-оральный. Чаще всего заражение происходит через загрязнённую пищу или воду. Энтеропатогенная кишечная палочка Энтеропатогенная кишечная палочка часто обозначается аббревиатурой на латинице — ETEC. Кишечные инфекции, вызываемые энтеропатогенными штаммами кишечных палочек, развиваются чаще всего в тонкой кишке у детей первого года жизни, в том числе у новорождённых. Заболевание сопровождается сильным поносом с водянистым стулом без примеси крови, выраженными болями в животе, рвотой. Энтеропатогенные escherichia coli являются частой причиной диарей в родильных домах. Штаммы ETEC являются основной причиной развития острой водянистой диареи в развивающихся странах, особенно в теплый и влажный сезон. Как в развитых, так и в развивающихся странах штаммы энтеропатогенной кишечной палочки являются наиболее распространенной причиной «диареи путешественников», которая обычно проходит без лечения. Энтеротоксигенная кишечная палочка Энтеротоксигенные кишечные палочки обладают способностью прикрепляться к эпителиальным клеткам слизистой оболочки тонкой кишки и продуцировать токсины, вызывающих диарею. Энтеротоксигенные кишечные палочки являются основной причиной острых диарей у детей и взрослых и наиболее частой причиной так называемой «диареей путешественников». Энтерогеморрагическая кишечная палочка Энтерогеморрагические кишечные палочки (EHEC) являются причиной геморрагического колита, а также тяжелого заболевания — гемолитико-уремического синдрома (микроангиопатической гемолитической анемии, сочетающейся с почечной недостаточностью; аббревиатура ГУС или HUS). Для геморрагического колита характерно острое начало в виде сильных спастических болей в животе и водной диареи, которая вскоре становится кровавой. Лихорадка обычно отсутствует, но у некоторых температура тела может достигать 39 °С. В легких случаях геморрагического колита продолжается 7–10 дней. Приблизительно в 5 % случаев геморрагический колит осложняется геморрагическим синдромом, острой почечной недостаточностью и гемолитической анемией. Источником инфекции мая 2011 года в Германии и других европейских странах являлся штамм продуцирующей шига-токсин STEC (синоним: продуцирующей веротоксин - VTEC) энтерогеморрагической кишечной палочки. Заражение STEC или VTEC-кишечной палочкой происходит чаще всего через продукты питания или при близком контакте с больными людьми или животными. Для начала заболевания достаточно небольшого числа STEC/VTEC Escherichia coli. Установлено, что возбудителем европейской инфекции мая 2011 года является кишечная палочка серологической группы E. coli O104 (серотип E. coli O104:h5), имеющая в своем геноме ген, ответственный за продукцию шига-подобного токсина 2-го типа. Штаммы E. coli O104:h5, выделенные от пациентов, характеризовались резистентностью к бета-лактамным антибиотикам за счет продукции бета-лактамазы расширенного спектра, но оставались чувствительными к группе аминогликозидов (гентамицин) и фторхинолонам. После заражения энтерогеморрагической кишечной палочкой инкубационный период длится чаще всего от 48 до 72 часов, но может быть и от 1 до 10 дней. Симптомы заражения включают схваткообразные боли в животе и диарею, нередко с кровью. Могут наблюдаться лихорадка и рвота. Большинство больных выздоравливают в течение 10 дней. Иногда инфекция может приводить к опасным для жизни состояниям, таким как гемолитико-уремический синдром. Энтероинвазивная кишечная палочка Энтероинвазивная кишечная палочка часто обозначается аббревиатурой на латинице — EIEC. Энтероинвазивные кишечные палочки являются причиной заболеваний, похожих по проявлению на бактериальную дизентерию (причиной которой являются шигеллы). Штаммы EIEC подобны штаммам Shigella как биохимически, так и серологически. Как и в случае Shigella, энтероинвазивные кишечные палочки проникают в эпителиальные клетки ободочной кишки и размножаются там. У больного отмечаются боли в животе, обильный водянистый понос с примесью крови. В развивающихся странах штаммы EIEC встречаются редко. Они служат причиной возникновения периодических вспышек инфекций пищевого происхождения среди детей и взрослых. Симптомы заболевания имеют много общего с проявлениями шигеллёза. Предположительно против EIEC эффективны те же антибиотики, что и против Shigella при условии сохранения чувствительности этого штамма на той или иной территории, однако результативность терапии еще никогда не оценивалась в рамках контролируемых исследований. Escherichia coli — возбудитель заболеваний мочеполовых органов Инфицирование кишечными палочками (а также другими уропатогенными микробами, обитающими в кишечнике) мочеполовых органов, особенно у женщин, часто происходит непосредственно из желудочно-кишечного тракта при недостаточном соблюдении гигиены или применении специфических сексуальных практик. Кишечные палочки являются причиной: - около 80 % внебольничных инфекций мочевыводящих путей - 64 % всех заболеваний острым простатитом - 80 % всех хронических простатитов - для пациентов старше 35 лет — большей части всех эпидидимитов (воспалительный процесс в придатке яичка), орхитов (воспаление яичка) и эпидидимоорхитов (сочетанное воспаление яичка и придатка яичка) - 70-95 % инфекций мочевых путей, достигающих мочевого пузыря или почки восходящим путем - других заболеваний мочеполовых органов. Бактериурия — наличие бактерий в моче может являться признаком воспаления в мочевыводящих путях, мочевом пузыре, почках. При отсутствии каких-либо симптомов, истинная бактериурия (инфекция мочевых путей) диагностируется при наличии не менее 105 микробных тел кишечных палочек (или других энтеробактерий) в 1 мл свежевыпущенной мочи, иначе предполагается, что загрязнение мочи происходит при ее заборе. Если бактериурия не сопровождается какими-либо симптомами, тогда она называется бессимптомной. Бессимптомная бактериурия не всегда требует немедленного лечения. При наличии симптомов или при заборе мочи катетером диагностический порог может быть значительно уменьшен. В частности, при наличии клинической симптоматики (лихорадка, озноб, тошнота, рвота, боли в поясничной области, дизурия) и выделении не менее 10 лейкоцитов в 1 мкл мочи, критерием для диагностики острого пиелонефрита является наличие не менее 104 кишечных палочек (или других патогенных энтеробактерий) в 1 мл свежевыпущенной мочи. Острый цистит диагностируется при наличии соответствующей клинической симптоматики, выделении не менее 10 лейкоцитов в 1 мкл мочи и обнаружении не менее 102 кишечных палочек (или других колиформных бактерий) в 1 мл мочи. Штаммы Escherichia coli — пробиотики и компоненты лекарств Штамм кишечной палочки Escherichia coli Nissle 1917 (DSM 6601) считается наиболее эффективным пробиотиком, помогающим уменьшить воспаление и оттянуть следующий приступ язвенного колита. Специально подобранные штаммы эшерихии коли входят в состав лекарств: Хилак форте (штамм DSM 4087), Бификол (штамм М-17), Колибактерин (штамм М-17) и других. Антибиотики, активные в отношении кишечной палочки Антибактериальные средства, активные в отношении кишечной палочки: амоксициллин, левофлоксацин, нифурател, нифуроксазид, рифаксимин, фуразолидон, ципрофлоксацин. www.polar-med.ru Врачи нашли средство против бактерии эшерихия коли
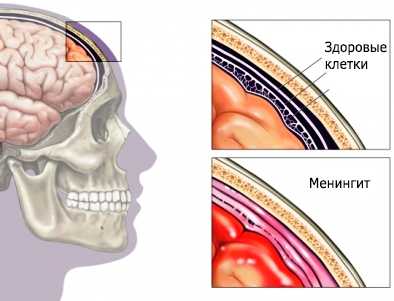
Врачи из Ганновера и Грейфсвальда публикуют исследование о пациентах с нейрологическими осложнениями после иммунной адсорбции (диализ) антител IgG. Заболевания, которые сопровождаются поносом и вызываются вирусными возбудителями, такими как норовирусы, в Германии встречаются ежедневно. Известны также и бактериальные возбудители инфекций, такие как сальмонеллы или кампилобактер, однако в 2011 году здесь появился абсолютно неизвестный и особенно опасный бактериальный житель кишечника — штамм бактерии EHEC O104:h5: Он вызывал очень тяжелые нейрологические осложнения гемолитико-уремического синдрома (HUS). Сейчас врачи из Ганновера и Грейфсвальда занимаются публикацией терапевтического исследования относительно иммунной адсорбции антител IgG у пациентов с нейрологическими нарушениями, такими как галлюцинации, судорожные припадки и дефекты речи. 7 сентября 2011 года приват-доцент, доктор Ян Кильштайн из Ганновера заявил: «Целенаправленное удаление антител IgG из крови пациентов с нейрологическими осложнениями бесспорно привело к значительному улучшению». Норовирусы и ротавирусы, как и бактерия EHEC (энтерогеморрагическая кишечная палочка или EAHEC), вызывают острые симптомы: рвоту, головную боль, ощущение головокружения, тошноту и водянистую диарею. При этом, как бактерии EHEC, так и ротавирусы производят ядовитые вещества. Ротавирусы производят, например, энтеротоксины, а EHEC O104 — шигатоксины. Особенно сильный клеточный токсин EHEC под названием шигатоксин 2 (Stx) или веротоксин 2 (Vtx) вызвал необычайно много случаев гемолитико-уремического синдрома (ГУС) в Германии. Многие пациенты в отделениях интенсивной терапии боролись с нейрологическими осложнениями, такими как расстройство сознания и эпилепсия. Врачи и ученые Медицинского института Ганновера и Грейфсвальдского университета разработали для выживания своих пациентов новый терапевтический подход к тяжелым осложнениям ГУС. Симптоматичная терапия, антитела и плазмафарезПростые заболевания, которые сопровождаются диареей без осложнений, лечат просто с помощью симптоматичной терапии, используя оральные регидратационные растворы. В данном случае напитки с цитратом, глюкозой, калием и натрием компенсируют потерю электролитов и жидкости. Однако против вызванных клеточными токсинами EHEC нейрологических осложнений симптоматичная терапия и некоторые другие методы терапии помогают мало. Нефролог д-р Кильштайн объясняет: «До терапии посредством иммунной адсорбции ни плазмафарез, ни прием антител не привели к значительному терапевтическому успеху». Эти неудачные терапевтические методы испытывались врачами, так как предполагалось, что тяжелое течение болезни ГУС вызывали так называемые аутоантитела. Аутоантитела — образованные от иммунокомпетентных клеток белковые структуры, такие как иммуноглобулин Г (IgG). Они, например, иногда препятствуют кровоснабжению важных регионов головного мозга и почек аккумуляцией факторов свертывания крови. Терапия ГУС посредством иммунной адсорбции оказалась успешнойВ отличие от плазмафареза терапия ГУС посредством иммунной адсорбции оказалась существенно эффективнее. Врачи лечили дюжину пациентов в возрасте от 38 до 63 лет с самыми тяжелыми нейрологическими проблемами, применяя специальный гемодиализ (диализ) под названием иммунная адсорбция. Иммунная адсорбция автоматически отфильтровывает аутоантитела, такие как иммуноглобулин G, из крови пациентов. Антитела IgG, вероятно, разрушительно действовали против аутогенной ткани пациентов или образовывали ядовитые и опасные соединения с клеточными токсинами EHEC. Профессор, доктор Андреас Грайнахер из Грейфсвальда объясняет: «Хотя точный механизм действия будет еще исследоваться при проведении в следующие месяцы других лабораторных анализов, сведения этого общего терапевтического исследования заставляют полностью по-новому взглянуть на возникновение болезни». Однако результаты терапии ГУС посредством иммунной адсорбции многообещающи. Все пациенты пережили тяжелые осложнения заболевания EHEC, у 10 пациентов после лечения больше не проявлялись нейрологические симптомы. Несмотря на отказ почек, ни одному пациенту больше не потребовался диализ. euromednews.ru |
г.Самара, ул. Димитрова 131 [email protected] |
 |

 Кишечная палочка (E.coli) представляет собой грамотрицательные, палочковидные бактерии, которые обычно находятся в нижней части кишечника теплокровных (эндотермических) организмов. Большинство штаммов кишечной палочки безвредны, но некоторые серотипы являются патогенными и могут вызвать серьезное пищевое отравление у людей, и их наличие в продукции может даже повлечь за собой отзыв продуктов с рынка. Безвредные штаммы являются частью нормальной флоры кишечника, и могут быть полезны для организма, поскольку производят витамин К2 и предотвращают производство патогенных бактерий в кишечнике. 1)
Кишечная палочка (E.coli) представляет собой грамотрицательные, палочковидные бактерии, которые обычно находятся в нижней части кишечника теплокровных (эндотермических) организмов. Большинство штаммов кишечной палочки безвредны, но некоторые серотипы являются патогенными и могут вызвать серьезное пищевое отравление у людей, и их наличие в продукции может даже повлечь за собой отзыв продуктов с рынка. Безвредные штаммы являются частью нормальной флоры кишечника, и могут быть полезны для организма, поскольку производят витамин К2 и предотвращают производство патогенных бактерий в кишечнике. 1)