|
|
||||||||||
|
Анализ на чувствительность к антибиотикам: суть, как сдавать, расшифровка. Анализ антибиотиковАнализ на чувствительность к антибиотикам: суть, как сдавать, расшифровкаАнализ на чувствительность к антибиотикам является обязательным при возникновении у врача подозрений, что заболевание пациента имеет бактериальную природу. Это связано с тем, что медики пытаются контролировать назначение данных препаратов, чтобы не стимулировать мутации и не вызывать резистентность у микроорганизмов. Определение
Анализ на чувствительность к антибиотикам – это лабораторный способ выявления препарата, который будет оказывать наибольшее действие на патогенную флору в данном конкретном случае болезни. На данный момент антибактериальная терапия применяется достаточно широко там, где она нужна, а также в тех случаях, когда это совсем не обязательно, для перестраховки от возможных осложнений. Например, после кесарева сечения, лапароскопических операций, удаления конкрементов из почек или мочеточников и т. д. Фармацевтическая промышленность может предложить широкий выбор препаратов как в плане цены, так и в плане действенности. Для того чтобы не «тыкать пальцем в небо» и назначить эффективный антибиотик, нужно провести посевы на чувствительность. Показания
Перед тем как врач подберет терапию, пациенту необходимо сдать некоторые анализы. Посев на чувствительность к антибиотикам назначается, если необходимо определить лекарство, которое в данном случае будет наиболее уместно. Чаще всего это исследование назначается для лечения заболеваний, передающихся половым путем, или ЗППП. Для детей же необходимость в определении антибиотика – это обязательное условие. Кроме того, определение чувствительности нужно, чтобы избежать устойчивости бактерий к лечению. Если пациента недавно лечили антибиотиками, и теперь вновь необходим повторный курс, то требуется замена препарата. Это позволит использовать меньшие дозы лекарства и не вызывать мутации у возбудителя. В гнойных хирургических отделениях антибиотики меняют каждые два-три месяца. Данный анализ необходим еще в том случае, если на основную группу антибиотиков у больного возникает аллергическая реакция. Диффузионные методы
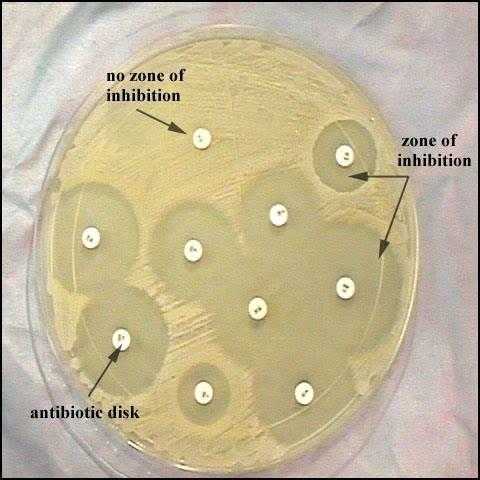
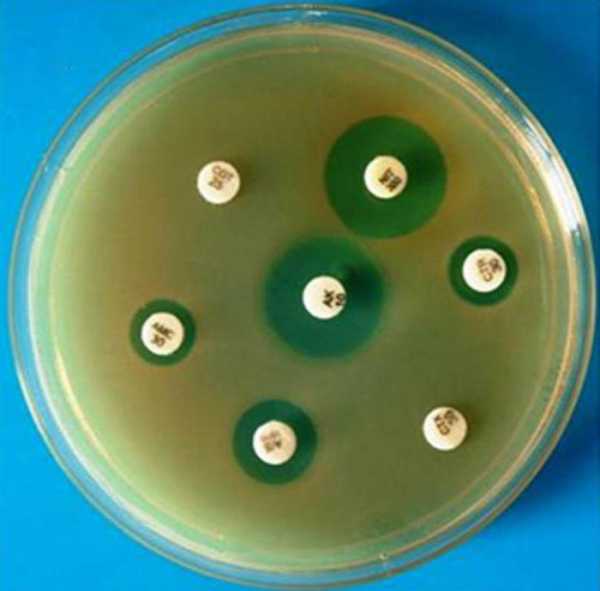
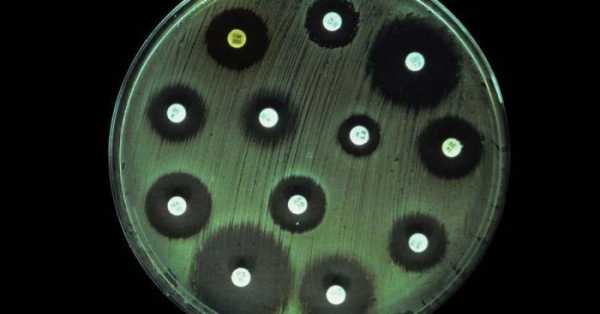
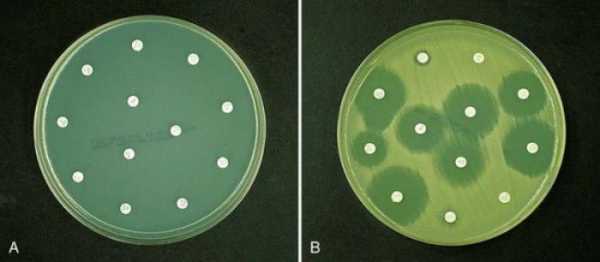
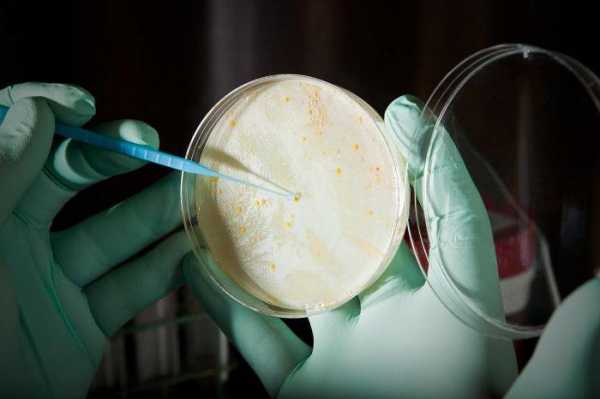
Анализ мочи на чувствительность к антибиотикам, и не только ее, можно провести несколькими способами. Первый из них – это метод дисков. Проводят его следующим образом. В чашку Петри заливают агар, а когда он застынет, специальным инструментом наносят исследуемый материал. Затем по поверхности агара раскладывают бумажные диски, пропитанные антибиотиками. После чашку закрывают и ставят в термостат. Постепенно диск погружается в желатин, а антибиотик диффундирует в окружающее пространство. Вокруг бумаги образуется зона «подавления роста». Чашки проводят в термостате двенадцать часов, затем их вынимают и измеряют диаметр вышеуказанной зоны. Второй способ – это метод Е-теста. Он похож на предыдущий, но вместо бумажных дисков используют полоску, которая на своем протяжении в разной степени пропитана антибиотиком. После двенадцати часов экспозиции в термостате чашку Петри достают и смотрят, в каком месте зона подавления роста соприкасается с полоской бумаги. Это будет наименьшая концентрация препарата, которая необходима для лечения заболевания. Достоинством этих тестов является быстрота и простота их проведения. Методы разведения
Анализ на флору и чувствительность к антибиотикам можно провести и другим способом. Этот метод основан на последовательном уменьшении концентрации антибиотика (от максимальной до минимальной) с целью определить, в какой из пробирок прекратится сдерживание роста бактерий. Сначала подготавливают растворы препарата. Затем их вносят в жидкую среду с бактериями (бульон или агар). Все пробирки на ночь (то есть 12 часов) помещаются в термостат при температуре 37 градусов, а утром проводят анализ получившихся результатов. Если содержимое пробирки или чашки Петри мутное, это свидетельствует о росте бактерий и, следовательно, неэффективности антибиотика в данной концентрации. Первая пробирка, в которой визуально не будет определяться рост колоний микроорганизмов, будет считаться достаточной концентрацией для лечения. Это разведение препарата принято называть минимальной подавляющей концентрацией (МПК). Она измеряется в миллиграммах на литр или микрограммах на миллилитр. Интерпретация результатов
Анализ на чувствительность к антибиотикам нужно уметь не только правильно сделать, но и грамотно расшифровать. Основываясь на получаемых результатах, все микроорганизмы делят на чувствительные, умеренно резистентные и резистентные. Для того чтобы различать их между собой, используются условные пограничные концентрации препаратов. Эти значения не являются постоянными и могут изменяться в зависимости от приспосабливаемости микроорганизмов. Разработкой и пересмотром этих критериев поручено заниматься химиотерапевтам и микробиологам. Одной из официальных структур такого рода является Национальный комитет по клиническим лабораторным стандартам США. Разработанные ими стандарты признаны во всем мире для использования в оценке активности антибиотиков, в том числе для рандоминизированных многоцентровых исследований. Различают два подхода к оценке результатов анализа на чувствительность к антибиотикам: клинический и микробиологический. Микробиологическая оценка ориентируется на распределение эффективных концентраций антибиотика, а клиническая - на качество антибактериальной терапии. Резистентные и чувствительные микроорганизмы
Анализ - определение чувствительности антибиотикам - назначается с целью выявить чувствительные и устойчивые микроорганизмы. Чувствительными называются возбудители, которые поддаются лечению антибиотиками в средней терапевтической концентрации. Если достоверная информация о категории чувствительности микроорганизма отсутствует, то учитываются данные, полученные в условиях лаборатории. Они совмещаются со знаниями о фармакокинетике используемого препарата, и после синтеза данной информации делается вывод о восприимчивости бактерий к лекарству. К резистентным, то есть устойчивым, микроорганизмам относятся те бактерии, которые продолжают вызывать заболевания даже при использовании максимальных концентраций лекарственных веществ. Промежуточную резистентность устанавливают в том случае, если заболевание в процессе лечения может иметь несколько исходов. Выздоровление пациента возможно в случае использования высоких доз антибиотиков либо в случае прицельного накапливания лекарства в месте инфекции. Минимальная бактерицидная концентрация
Анализ на микрофлору и чувствительность к антибиотикам определяет такой показатель, как минимальная бактерицидная концентрация, или МБК. Это самая низкая концентрация препарата, которая в лабораторных условиях вызывает элиминацию практически всех микроорганизмов в течение двенадцати часов. Знание этого показателя врачи используют, когда назначают терапию не бактерицидными, а бактериостатическими лекарственными средствами. Или в случаях, когда стандартная антибактериальная терапия оказывается неэффективной. Чаще всего этот анализ заказывают для больных с бактериальным эндокардитом, остеомиелитом, а также при оппортунистических инфекциях. Что может быть образцом?Анализ на чувствительность к антибиотикам может проводиться с использованием биологических жидкостей: - слюна; - кровь; - моча; - сперма; - грудное молоко. Кроме того, для определения местной чувствительности производят забор мазков из уретры, цервикального канала и верхних дыхательных путей. Подготовка к анализамБак. анализ на чувствительность к антибиотикам не требует от пациентов существенной подготовки, но некоторые ограничения все-таки есть.
На сегодняшний день не существует клинических или лабораторных методов, которые бы со стопроцентной вероятностью могли предсказать эффект от антибактериальной терапии. Но в то же время определение чувствительности бактерий к лекарственным веществам может быть ориентиром для врачей в вопросах выбора и коррекции лечения. fb.ru Анализ антибиотиков - Химия - ПрочееАнализ антибиотиков Антибактериальная терапия является важнейшим компонентом современной клинической медицины. Сегодня среди возбудителей тяжёлых инфекций преобладают грамположительные микроорганизмы. В начале 80-х годов прошлого века в этиологии инфекций на их долю приходилось около 40% случаев заболеваний, спустя 10 лет - свыше 50% , в настоящее время - 55-60% . Первые антибиотики, в частности пенициллины, были активны главным образом, в отношении грамположитеьных микроорганизмов - стафилококков и стрептококков. Эффективное лечение заболеваний вызванных грамположительными бактериями повлекло за собой изменение этиологической структуры ряда инфекций. В частности, стала возрастать роль микроорганизмов, обладающих природной устойчивостью или способных быстро формировать приобретённую резистентность к доступным антибиотикам. Как правило, это были грамотрицательные бактерии. Надо отметить интересную особенность: в отличие от стафилококков, пиогенные стрептококки за 60 лет использования пенициллина так и не приобрели к нему устойчивости, они по сей день высокочувствительны к этому антибиотику. Наиболее актуальными антибиотиками для лечения инфекций респираторного тракта являются препараты 3-х групп: аминопенициллины, цефалоспорины 2-го поколения и макролиды. Так как к ампициллину и амоксициллину у ряда микроорганизмов выработалась устойчивость, для лечения осложнений используют ингибитор защищённые аминопенициллины: клавуланаты ( аугментин, амоксиклав). Общая характеристика лекарственных препаратов пенициллинов. Открытие английским микробиологом О. Флемингом пенициллина стало началом эры антибиотиков. Пенициллины - группа антибиотиков, производные 6- аминопенициллановой кислоты. Пенициллины первого поколения - это природные пенициллины. К ним относятся бензилпенициллин - натрий, бензилпенициллин - калий, бенизилпенициллин - новокаин, бицилин-1, бицилин-5, феноксиметилпеницилин. Пенициллины первого поколения теперь не вводят в медицинскую практику, так как они легко инактивируются пенициллиназой и малоактивны. Значительным достижением современной химиотерапии является создание полусинтетических пенициллинов второго и третьего поколения - важных противомикробных средств. Пенициллины второго поколения - это полусинтетические антибиотики, молекулы которых содержат аминопенициллятную кислоту, ацилированную синтетическими кислотами, которые не встречаются в природе. Полусинтетические пенициллины - это лекарственные средства с широким спектром антибактериального действия, однако некоторые и них разрушаются под действием пенициллиназы. Создание пенициллинов третьего поколения является важным событием в медицине и фармации. Основной особенностью этих антибиотиков является взаимодействие с бактериальными -лак- тамазами и блокирования их. Вследствие этого антимикробная активность намного увеличивается. Они состоят из двух веществ - полусинтетического антибиотика и ингибитора -лактамаз. К антибиотикам третьего поколения принадлежат аммоксиклав, сультамициллин, тиментин. Лекарственные средства природных и полусинтетических пенициллинов - это белые кристаллические вещества без запаха, горькие на вкус. Пенициллины - нестойкие вещества, они легко поддаются инактивации под действием воды. Натриевая и калиевая соль бензилпенициллина гигроскопичны и легко растворяются в воде. Новокаиновая соль бензилпенициллина, феноксиметилпенициллин и ампициллин малорастворимы в воде. Несмотря на появление новых групп противомикробных средств, антибиотические препараты пенициллинового ряда продолжает занимать значительное место в терапии инфекционных заболеваний. В частности, среди отечественных препаратов пенициллинов большого распространения приобрели стойкие к гидролизу полусинтетические препараты «Ампициллин» и «Оксациллин». Так, ампициллин, благодаря дополнительной активности по отношению к граммотрицательной флоре, на которую не действует препарат природного происхождения «Бензилпенициллин», считается антибиотиком широкого спектра действия, пригодный для употребления per os при заболеваниях, вызванных смешанной инфекцией. Стоит отметить, что среди парентеральных форм препаратов пенициллинового ряда бензилпенициллин и теперь часто применяется в медицинской практике. Что касается оксациллина, то по спектру противомикробной активности он в общем подобен бензилпенициллину, но превосходит его по гидролитической стойкости и поэтому, в отличии от последнего, как и ампициллин, пригоден к пероральному употреблению. Специфичность биологической активности пенициллина прежде всего обусловлено наличием в его молекуле тиазолидинового и - лактамного циклов. Расщепление одного из них приводит к полной потери препаратом активности относительно бактерий, которые не являются продуцентами фермента -лактамазы пенициллинов. Четырёхчленный лактамный цикл характеризуется большой лабильностью к действию разных по характеру химических факторов. Гидролитическая стойкость пенициллинов главным образом зависит от нуклеофильности атома кислорода экзоциклической амидной структуры и существенно повышается при введении в молекулу електроакцепторных заместителей. Введение в молекулу 6-АПК остатков аминофенилуксусной и 5-метил-3-фенилизоксазо-4-карбоновой кислот позволило получить относительно стойкие к гидролитическому расщеплению препараты «Ампициллин» и «Оксациллин». Их продуцируют в виде солей - натрия или калия (бензилпенициллин), новокаина или N, N-дибензилэтилендиаминовой соли (бензилпеницилин) - бициллина-1, кислоты или тригидрата (ампициллин) разного дозирования в виде быстрорастворимого стерильного порошка во флаконах или таблеток (ампициллин, оксациллин), гранул для изготовления суспензий (ампициллин) и др. Особенно широкое применение находят комбинированные препараты, которые состоят из смеси натриевой соли ампициллина и оксациллина в соотношении 2 : 1 ( «Ампиокс-натрий », в Украине - «Ампициллин - оксациллин» ) и ампициллина тригидрата и оксациллина натриевой соли , взятых в соотношении 1 : 1 ( ампиокс ) , которые выпускаются во флаконах по 100 , 200 или 500 мг и капсулах по 0.25 мг препарата ( сумма ампициллина тригидрата и оксациллина натриевой соли ) соответственно. Хранение. Препараты пенициллинов хранят в сухом месте, при комнатной температуре. Форма выпуска. Флаконы, герметически закрыты резиновыми пробками, обжатые алюминиевыми колпачками. Калиевая и натриевая соли бензилпенициллина содержат в каждом флаконе по 125000, 250000, 500000 и 1000000 ЕД; новокаиновая соль бензилпенициллина - по 300000, 600000, 1200000 ЕД. Применение. Для лечения пневмонии, гонорее, сифилиса, раневых и гнойных инфекций, перитонита, дифтерии, скарлатины, ангин различной этиологии и инфекционных заболеваний, вызванных чувствительными к пенициллину микроорганизмами. В результате гидролиза пенициллинов раскрывается -лактамное кольцо и образуется относительно стойкая пенициллоиновая кислота, которая отвечает за аллергические реакции на пенициллин. При благоприятных условиях, например в присутствии щелочей, кислот или нагревания, наблюдается дальнейшее расщепление пеницилоиновой кислоты. Продуктами гидролитического расщепления пенициллинов являются, главным образом, два соединения: пеницилламин и пенилоальдегид, однако они образуются не сразу, а через ряд промежуточных продуктов. Рассмотренные процессы изображены на схемах 1 и В настоящее время в качестве основных средств стартовой терапии внебольничных респираторных инфекций в амбулаторной практике обычно применяют аминопенициллины (амоксицилин, ампицилин), защищённые аминопеницилины (амоксицилин, потенциированный клавулановой кислотой), цефалоспорины II поколения для перорального приёма (цефуроксим аксетил), макролиды (эритромицин, кларитромицин, азитромицин), фторхинолоны II поколения (левофоксацилин, моксифлоксацилин). Клиническая эффективность всех этих препаратов примерно одинакова. Для лечения внебольничных инфекций нижних и верхних дыхательных путей широко применяют неащищённые аминопенициллины. Препараты данной группы характеризуются высокой природной активностью в отношении S. pneumoniae, M. pneumoniae, C.pneumoniae, а также H. influenzae. Несмотря на проблему пенициллинрезистентности, амоксициллин в дозе 2-3г в сутки сохраняет клиническую эффективность в отношении как устойчивых штампов пневмоккока, так и штампов с промежуточной чувствительностью. Аминопенициллины являются препаратами выбора при не тяжёлом течении хронического бронхита у больных молодого и среднего возраста, не уступая по клинической эффективности защищённым пенициллинам и цефалоспоринам II поколения. Это объясняется достаточно высокой активностью препаратов в отношении основных возбудителей бронхита в этой группе больных - пневмококка и гемофильной палочки. Кроме того, незащищённые амоксициллины (наряду с макролидами) являются препаратами первого выбора при лечении пациентов с нетяжёлым течением негоспитальной пневмании. Применение защищённых пенициллинов не всегда безопасно, поэтому при отсутствии сопутствующей патологии и других модифицирующих факторов предпочтение отдаётся полусинтетическим амоксициллинам, проявляющим антибактериальную активность в отношении основных возбудителей заболевания. Только нетяжёлые формы пневмонии лечатся амбулаторно, а препаратом выбора в данном случае, согласно приказу, является незащищённый амоксициллин. Следует помнить, что при эмпирическом выборе стартовой антибактерицидной терапии инфекционных заболеваний дыхательных путей следует учитывать не только характер вероятных возбудителей, но и их потенциальную чувствительность к наиболее часто назначаемым антимикробным средствам. Например, при выборе стартовой этиотропной терапии при остром синусите и среднем отите следует учитывать, что наиболее частыми возбудителями этих заболеваний являются пневмококк, гемофильная палочка и моракселла. Это определяет выбор для стартовой этиотропной терапии антибиотиков более широкого спектра действия - незащищённых аминопенициллинов. Например, если острый синусит (отит) развивается впервые или ранее при лечении не использовались лактамные антибиотики, препаратом выбора считают амоксицилин. Если же имеет место рецидив заболевания либо ранее уже применялись природные или полусинтетические незащищённые пенициллины, то терапию целесообразно начинать с антибиотиков, устойчивых к бактериальным -лактамазам, например амоксициллина/ клавулановой кисоты, цефалоспоринов II или III поколения. Во многих странах мира наиболее часто используют Флемоксин Солютаб ( амоксициллина тригидрат) - полусинтетический пенициллин третьего поколения, выпускаемый известной фармацевтической компанией «Яманучи Юроп. Б.В.». Эффективность препарата по сравнению с другими представителями этой группы обусловлена его высокой биодоступностью и лучшей всасываемостью. После перорального приёма амоксициллин всасывается быстро и практически полностью (93%). Флемоксин Солютаб - препарат первого выбора в амбулаторной практике при лечении острых инфекционно-воспаительных заболеваний ЛОР - органов ( остром негнойном отите и синусите, тонзиллите, ангине) и нижних дыхательных путей (бронхите и бронхопневмонии). Помимо этого, показаниями к его применению являются бактериальные инфекции, вызванные чувствительными к препарату микроорганизмами, - инфекции органов мочеполовой системы и пищеварительного тракта, а также инфекционные поражения кожи и мягких тканей. Флемоксин Солютаб отличается не только широким спектром антибактериального действия, оптимальными фармакокинетическими и фармакодинамическими свойствами, но и уникальнойлекарственной формой. Таблетку препарата можно растворять в любой жидкости, включая соки и даже молоко. Кроме того, на эффективность препарата не оказывает влияния способ его применения - растворимую таблетку можно глотать, толочь и жевать. Растворимая таблетка препарата Флемоксин Солютаб - это возможность быстро, эффективно и безопасно победить болезнь в домашних условиях. Для количественного определения препаратов пенициллинового ряда рекомендованы методы высокоэффективной жидкостной хроматографии, спектрофотометрии, потенциометрического титрования, йодометрии; для определения ампициллина также успешно применяют метод потенциаметрии с использованием ионно-селективных электродов, различные варианты вольтамперометрии, ампераметрии, полярографического анализа, кинетики. Известны также спектрофотометрические методики, которые основываются на реакциях окисления продуктов гидролитического расщепления пенициллинов с солями феррума (III), молибдата и ванадата аммония, взаимодействия их с солями меди (II), дегидроаскорбиновой кислотой и др. Эти методики позволяют определить пенициллины в лекарственных препаратах, которые содержат кроме пенициллинов разные добавки и наполнители. Однако вопрос количественного определения пенициллинов не теряет своей актуальности. Существующие фармакопейные методики определения препаратов этого ряда сложные, занимают много времени на подготовку и требуют использования сложной аппаратуры. Большинство известных методик количественного определения пенициллинов сводится к определению конечных продуктов их гидролитического расщепления, которые получают на предыдущей стадии анализа, длительные и требуют нагревания. Интерес вызывают кинетические методы анализа, в основе которых лежат реакции модификации молекулы определяемого пенициллина: благодаря хромофорным свойствам образуемых продуктов их можно использовать в спектрофотометрическом варианте кинетического определения пенициллинов в присутствии имеющихся продуктов их гидролиза. В литературе описываются реакции химической модификации ампициллина для спектрофотометрического определения его в лекарственных смесях. Как индикаторная предложена реакция образования интенсивно окрашенного жёлтого продукта в результате взаимодействия со щёлочью окисленного производного ампициллина, полученного в начальной стадии анализа по реакции исследуемого ампициллина с азотной кислотой в присутствии воды. Разработанные методики определения пенициллинов имеют ряд преимуществ перед уже известными: позволяют определить различные по природе пенициллины (ампициллин, оксоцилин, бензилпенициллин и др.) в значительно меньших количествах, чем фармакопейным методом йодометрии; пригодные для того же интервала определяемых концентраций, что и в методе фотометрии продуктов гидролиза, но при этом не требуют длительного нагревания реакционной смеси, проще методик хромотографического анализа и быстрее. Предложенные методики заключаются в окислении ампицилина (натриевой соли или тригидрата), оксациллина или бензилпенициллина избытком дипероксидикарбоновой кислоты с последующим определением продукта окисления в щелочной среде спектрофотометрически кинетическим методом. Кроме того, комбинация метода непрямого йодометрического определения суммарного содержания пенициллинов по расходованию пероксикислоты с кинетическим методом определения быстро реагирующего компонента смеси позволяет осуществлять полный анализ бинарной смеси близких по химическим свойствам пенициллинов - ампициллинов и оксацилина при совместном присутствии. Подлинность препаратов пенициллинов подтверждают с помощью УФ - и ИК - спектрофотометрии. ИК - спектры препаратов пенициллина идентифицируют по совпадению с максимумами светопоглощения соответствующих стандартных образцов в области 4000 - 400 см . Для испытания подлинности препаратов пенициллинов и их полусинтетических аналогов используют цветную реакцию основанную на разрыве - лактамного цикла и образования медной соли гидроксамовой кислоты (осадок зелёного цвета): В препаратах пенициллинов можно обнаружить органически связанную серу после превращения её в сульфид - ион сплавлением с едкими щелочами. Поскольку соли бензилпенициллина очень слабо диссоциируют в растворах, для обнаружения ионов натрия или калия необходимо предварительно минерализовать препарат путём сжигания в тигле. Затем остаток растворяют в воде и фильтруют. Фильтрат испытывают на ион натрия или калия с помощью соответствующих реакций. Новокаиновую соль бензилпеициллина подвергают испытанию на первичные ароматические амины. Препараты пенициллина отличаются друг от друга по различной окраске продуктов реакции с хромотроповой кислотой в присутствии концентрированной серной кислоты. Ампициллин, благодаря наличию в молекуле остатка фениламиноуксусной кислоты, даёт положительную реакцию с нингидрином подобно аминокислотам, а при взаимодействии с реактивом Фелинга приобретает фиолетовое окрашивание. Феноксиметилпенициллин отличают от других пенициллинов по отрицательной реакции с концентрированной серной кислотой. Раствор остаётся бесцветным и после нагревания на водяной бане. Реактив Марки (раствор формальдегида в концентрированной серной кислоте) используют для идентификации феноксиметилпенициллина. Наличие в его молекуле феноксиуксусной кислоты обуславливает образование красного окрашивания смеси препарата с реактивом. При нагревании на водяной бане наблюдается усиление интенсивности окраски. Другие пенициллины не образуют окрашенных продуктов при комнатной температуре, а при нагревании приобретают жёлтое или жёлто-бурое окрашивание (ампициллин) красно-коричневое окрашивание (соли бензилпеницилина). Для идентификации и фотоколориметрического определения солей бензилпенициллина, феноксиметилпенициллина, натриевой соли оксациллина используют реакцию, основанную на образовании полиметиновых красителей. Бензилпенициллин подвергают кислотному гидролизу до бензилпеницилленовой кислоты. Она вступает в реакцию сочетания с производным глютаконового альдегида, который образуется (pH 4,9) в результате расщепления пиридинового цикла под действием тиоцианата хлора. Последний предварительно получают при взаимодействии хлорамина Б и тиоцианата аммония. В соответствии с требованиями НТД препараты пенициллинов и их полусинтетических аналогов подвергают испытаниям на токсичность, пирогенность, стерильность, а натриевую и калиевую соли бензилпенициллина - также на термостабильность. multiurok.ru Чувствительность к антибиотикам: особенности сдачи анализаАнтибиотиками – называют препараты натурального или синтетического происхождения, которые используются для лечения разнообразных болезней. Основные компоненты этих средств оказывают пагубное воздействие на быстрый рост бактерий и клеток. Однако, несмотря на то, что антибиотические средства помогают вылечить инфекционные, вирусные, бактериальные патологии, все-таки они оказывают негативное воздействие на микрофлору кишечника и снижают иммунную систему. По этой причине, прежде чем начинать принимать это средства обязательно нужно провести анализ на чувствительность к антибиотикам. Кроме этого эти средства должен назначать только лечащий врач в зависимости от индивидуальных особенностей организма каждого пациента. Зачем проводят исследование на чувствительность к антибиотикамАнализ на чувствительность к антибиотикам называется бактериальным посевом. За счет проведения этих мероприятий врач может точно определить вид возбудителя и его уровень концентрации в организме. Цель состоит в выявлении в полученном материале вредных микроорганизмов. Это в дальнейшем помогает подобрать необходимое лечение, которое сможет быстро подавить активность патогенных организмов. После применения антибиотиков микроорганизмы могут проявлять разное состояние. По этой причине их разделяют на несколько разновидностей:
Чувствительными микроорганизмами считаются те, активность которых подавляется установленными дозировками антибиотических медикаментов. Для снижения деятельности условно-устойчивых бактерий необходимо повышать дозировки антибиотика. А вот активность устойчивых организмов не прекращается даже после поступления повышенных дозировок антибиотического средства. При этом у каждого человека уровень чувствительности микрофлоры к антибиотическим препаратам у каждого индивидуальный. У разных людей микроорганизмы могут реагировать на одни и те же антибиотические средства по-разному. По этой причине иногда назначение антибиотических средств только лишь на основании состояния больного и среднестатической клинической картины не всегда может обеспечить положительное воздействие. Поэтому обязательно нужно сдать анализы на чувствительность к антибиотикам. Преимущества и недостаткиПри приеме антибиотиков врачи рекомендуют проведение бакпосева. При этой процедуре проводится исследование организма человека на чувствительность к составляющим компонентов антибиотиков. Этот метод отличается повышенной специфичностью, при котором не наблюдается перекрестных ложных реакций. Сдается анализ для того, чтобы выявить уровень чувствительности патогенных бактерий к лечебным антибиотическим средствам. Благодаря этому можно будет в дальнейшем подобрать эффективную лечебную терапию. Но у этой процедуры имеются и недостатки. К наиболее популярным относятся:
Показания и материалДля того чтобы определить степень чувствительности к антибиотикам для начала стоит изучить при каких показаниях нужно сдавать анализы. Часто исследование крови при приеме антибиотиков проводится при инфекционных патологиях. Особенно часто к этому методу прибегают в гинекологии, урологии, хирургии, онкологии, отоларингологии и в других областях медицины Главным показанием для проведения исследования считаются патологии с воспалительным характером внутренних органов и систем, а также признаки сепсиса. Для исследования восприимчивости организма к антибиотикам можно сдавать разный материал:
Можно ли принимать препараты перед сдачей анализа крови?Некоторые пациенты просто не знают — влияют ли антибиотики на анализ крови. Но это исследование обладает несколькими важными правилами, от соблюдения которых зависит ее результат. Если их заранее не изучить, то в полученном результате могут наблюдаться некоторые отклонения от нормы. Так влияет ли прием антибиотиков на анализ крови? Ведь иногда такое исследование делается прямо после приема, антибиотиков, поэтому его результаты могут быть не точными. Но для того чтобы этого не произошло, нужно точно соблюдать несколько рекомендаций:
Выполняя анализ крови на стерильность, врач должен учитывать наличие возбудителей, давность инфицирования, а также состояние иммунитета. Также он должен изучить, как влияет прием антибиотиков на анализ, потому что от этого могут измениться результат. После приёма антибиотиков должно пройти определенное время, а вот, сколько определяет только специалист, но не меньше 10 дней. Если вдруг результаты будут не точными, то может быть проведен повторный анализ, а вот через какое время решает специалист. Особенности сдачи анализа на чувствительность к антибиотикамКачество исследования зависит от нескольких факторов, главный из которых является соблюдение правил при заборе материала для проведения исследования. Подготовка материала к обследованию должна быть выполнена правильно. Обязательно материал нужно помещать в стерильную посуду и брать стерильными инструментами, иначе в нем могут быть обнаружены и другие бактерии. Доставка в лабораторию должна быть быстрой, потому что может произойти быстрое изменение кислотности материала. Как сдавать материал на анализ:
РасшифровкаПосле того как проведено исследование на чувствительность к антибиотикам расшифровка проводится уже через несколько суток. Расшифровка анализа выполняется достаточно просто. Изучение материала при расшифровке включает несколько степеней:
Эти условия важно соблюдать, потому что именно от них зависит точное выявление наличие условно-патогенной микрофлоры. Первая и вторая степень не являются показателями наличия в организме наличия инфекции, а только лишь говорят о загрязненности материала. А вот 3 и 4 степень свидетельствуют о расширенной инфекции с воспалительным характером. Если выявляется патогенная инфекция, то прием антибиотиков можно начинать сразу, но их назначает врач. При проведении анализа важной составляющей должна быть резистентность бактерий на определенный вид антибиотика. Для этого обязательно выполняется антибиотикограмма, которая помогает подобрать подходящие названия антибиотических средств для лечения, их совместимость. Чувствительный микроорганизм к антибиотиком погибает при установленных дозах врачом, если же он обладает повышенной устойчивостью на действие антибиотиков, то врач подбирает более сильные препараты в повышенной дозе proantibiotik.ru как сдавать, расшифровка результатов :: SYL.ruЕсли у лечащего врача возникнут подозрения о наличии бактериальной природы заболевания пациента, то он обязательно попросит сдать анализ на чувствительность к антибиотикам. Данная процедура помогает представителям медицины назначать правильные лекарственные препараты, поскольку микроорганизмы могут мутировать и развить к ним резистентность. Общая информация о проводимом исследованииЭто исследование представляет собой лабораторный метод определения лекарственного средства, оказывающего наибольшее воздействие на болезнетворные микроорганизмы, вызвавшие развитие данного конкретного заболевания. Фармацевтический рынок предлагает огромный выбор лекарственных средств, как в плане эффективного воздействия, так и в плане стоимости. Поэтому, чтобы выбрать наиболее эффективное антибактериальное средство, назначают бактериологический посев. Показания к назначению анализаВ целях подбора правильной терапии врач рекомендует пациенту пройти обследование. Анализ на чувствительность к антибиотикам назначают для определения самого эффективного и уместного лекарства в данном случае. Наиболее часто это необходимо для лечения инфекций, передающихся половым путём. Также определение самого эффективного антибиотика является обязательным условием при терапии заболеваний у детей. Помимо этого, определение чувствительности необходимо во избежание развития устойчивости микроорганизмов к антибиотикам. Если пациент перед этим уже принимал антибиотики, а теперь нужно провести повторный курс лечения, то препарат необходимо заменить на другой. Подобный образ действия позволяет применить меньшую дозировку лекарства и предотвратить мутацию возбудителя. В отделениях гнойной хирургии антибиотики заменяют раз в несколько месяцев. Тест на чувствительность бактерий необходим при возникновении у пациента аллергических реакций на определенную группу препаратов. Анализ мочи на чувствительность к антибиотикам также проводится очень часто. Диско-диффузионный методНа сегодняшний день существует несколько основных методов определения чувствительности микроорганизмов к антибиотику. Самым распространенным и простейшим является диско-диффузионный способ, или метод дисков. Для определения чувствительности диско-диффузионным способом по поверхности застывшего агара в чашке Петри распределяют исследуемый материал (бактериальную суспензию). После этого туда помещают картонные диски, пропитанные определенными антибиотиками. Затем бакпосев закрывают и размещают в термостате при температуре 35-37°С на 12-18 часов. Диффузия антибиотика влечет за собой формирование зоны подавления роста бактерий вокруг бумажных дисков. По истечении указанного времени результат проверяют путём замера диаметра этой зоны. E-тестВторой анализ на чувствительность к антибиотикам – это Е-тест. Он проводится аналогично предыдущему способу, только вместо картонных дисков применяют полоску Е-теста, которая содержит градиент степени пропитки антибиотиком от минимальной к максимальной. После двенадцатичасовой инкубации в термостате специалист достает чашку и оценивает эффективность каждого вида антибиотика, просматривая конкретное место соприкосновения зоны подавления роста бактерий и шкалу полоски. Такова будет самая минимальная концентрация лекарства, необходимого для лечения заболевания. Преимуществом диффузионных методов является доступность для любой бактериологической лаборатории и простота тестирования. Однако стоимость Е-тестов высока, поэтому наиболее часто используют диско-диффузионный способ. Как именно осуществляются анализ - посев на чувствительность к антибиотикам? Методы разведенияДанные методы основываются на применении последовательных двойных разведений антибактериального препарата от максимальной до минимальной концентрации. При этом различную концентрацию антибиотика распределяют по жидкой питательной среде (бульону) или агару. После этого бактериальную суспензию помещают на поверхность агара в чашке или в бульон с антибиотиками. По истечении двенадцатичасовой инкубации в термостате при температуре 35-37°С, специалисты анализируют полученные результаты. Помутнение бульона (рост бактерий) или поверхности агара говорят о том, что данной концентрации антибиотика недостаточно для подавления жизнеспособности микроорганизмов. Увеличение концентрации антибиотика влечет за собой ухудшение роста бактерий. После серии последовательных разведений антибиотика, первая наименьшая концентрация, где не наблюдается рост бактерий, считается минимальной подавляющей концентрацией (МПК), то есть достаточной для лечения. Расшифровка анализа на чувствительность к антибиотикамНа основании полученных данных (значения МПК или диаметра зоны подавления роста) бактерии разделяют на чувствительные, с промежуточной резистентностью и резистентные. Для разделения данных категорий резистентности (или чувствительности) применяют пограничные концентрации антибиотика. Эти величины не являются постоянными и пересматриваются в зависимости от изменений чувствительности бактерий. Пересмотром критериев и их разработкой занимаются микробиологи и химиотерапевты, которые входят в специальные комитеты. Всего существует два метода интерпретации полученных результатов анализа чувствительности: клинический и микробиологический. Последний основывается на тестировании значений распределения концентрации антибиотика, подавляющего жизнедеятельность микроорганизмов. Клинический метод интерпретации основывается на оценивании эффективного действия антибактериальной терапии. Как сдавать анализ на чувствительность к антибиотикам? Чувствительные бактерииЧто же означает это интересное понятие? Клинически к чувствительным относят микроорганизмы, если во время лечения стандартной дозировкой антибиотика инфекции, вызванной данными бактериями, наблюдается хорошее терапевтическое действие. Если достоверная клиническая информация отсутствует, то разделение на категории резистентности основывается на совокупности результатов, полученных in vitro, а также на концентрации антибиотика в сыворотке крови. Резистентные бактерииКакие из них являются резистентными? Микроорганизмы относят к устойчивым, когда во время лечения заболеваний, вызванного данными бактериями, от терапии не наблюдается никакого положительного эффекта, даже при применении максимальной дозировки антибиотика. Данные бактерии обладают механизмом резистентности. Сдать анализ мочи на чувствительность к антибиотикам довольно просто. Промежуточная резистентность микроорганизмовКогда говорят о промежуточной резистентности бактерий, то подразумевают случай, когда заболевание, вызванное этими штаммами, имеет различный терапевтический исход. Терапия может оказаться успешной при применении повышенной дозировки антибиотика, или если инфекция локализуется в месте, где накапливается самая высокая концентрация антибактериального препарата. Иногда резистентные микроорганизмы и штаммы с промежуточной устойчивостью объединяются в одну категорию устойчивых бактерий. В определенных ситуациях при недостатке результатов тестирования чувствительности распространенными способами, применяют определение минимальной бактерицидной концентрации. Расшифровка анализа мочи на чувствительность к антибиотикам интересует многих. Минимальная бактерицидная концентрация (МБК)Говоря о минимальной бактерицидной концентрации (МБК), имеют в виду наименьшую концентрацию антибиотика, вызывающую при исследовании in vitro уничтожение 99,9% бактерий от изначального показателя на протяжении определенного временного промежутка. Показатель МБК применяют во время лечения антибиотиками, способными оказывать бактериостатическое действие, или если у особой категории пациентов отсутствует эффект от антибактериальной терапии. К частным случаям применения МБК относят остеомиелит, бактериальный эндокардит или генерализованные инфекции у больных с ослабленным иммунитетом. Что используют в качестве образца для бак. анализа на чувствительность к антибиотикам?Тестирование бактерий на чувствительность к антибиотику проводят с применением следующих биологических жидкостей:
Помимо этого, для того чтобы узнать местную чувствительность, проводят забор материала из уретры, верхних дыхательных путей или цервикального канала. В заключениеВ заключении хотелось бы сказать, что в нынешнее время не существует способов, которые с абсолютной достоверностью позволили бы предсказать потенциальный клинический эффект антибиотиков при терапии заболеваний, вызванных проникновением в организм болезнетворных микроорганизмов. Однако результаты определения чувствительности, могут стать отличным ориентиром врача для подбора и корректировки антибактериального лечения. Мы рассмотрели то, как проводится анализ на чувствительность к антибиотикам. www.syl.ru Анализ антибиотиков - n1.docприобрестиАнализ антибиотиковскачать (249 kb.)Доступные файлы (1):n1.docМИНИСТИРСТВО ОБРАЗОВАНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Химический факультет Кафедра аналитической химии Курсовая работа Анализ антибиотиков Исполнитель: Руководитель: Минск-2009 СодержаниеСодержание 2Введение 2 1. Качественное определение антибиотиков 4 2. Количественное определение антибиотиков 6 2.1. Микробиологическое исследование антибиотиков 7 2.1.1. Методы разведений 8 2.1.2. Турбидиметрические методы 8 2.1.3. Методы диффузии в агар 9 2.2. Определение отдельных составных частей антибиотиков 11 2.3 Химические и физико-химические методы определения антибиотиков 13 2.3.1. Химические методы 13 2.3.2. Оптические методы. Колориметрия и спектрофотометрия в видимом свете 13 2.3.3. Спектрофотометрия в ультрафиолетовом свете 14 2.3.4. Инфракрасная спектроскопия 14 2.3.5. Флюорометрия 15 2.3.6. Оптическое вращение 15 2.3.7. Электрохимические методы 15 2.3.8. Полярография 16 2.3.9. Амперметрическое (полярометрическое) титрование 17 2.3.10. Кондуктометрия 17 2.3.11. Радиоактивные изотопы в анализе антибиотиков 17 2.4. Количественное определение некоторых антибиотиков 18 2.4.1. Пенициллин 18 2.4.2. Стрептомицин 20 2.4.3. Тетрациклины 22 2.4.4. Левомицетин 22 2.4.5. Эритромицин 23 2.4.6. Неомицин 23 2.4.7. Флоримицин 24 2.4.8. Грамицидин С 24 2.4.9. Циклосерин 25 Заключение 25 Список использованной литературы 26 ВведениеАнтибиотики ? органические соединения, образуемые микроорганизмами и обладающие способностью в незначительных концентрациях избирательно тормозить рост других микроорганизмов или убивать их.Это определение, справедливое в отношении большинства антибиотиков, не является, конечно, исчерпывающим настолько, чтобы оно охватывало все вещества, входящие в данную группу. Чтобы уточнить понятие «антибиотик», необходимо дополнить его определение несколькими примечаниями. 1. Ряд микроорганизмов вырабатывает вещества, обладающие способностью тормозить рост других микроорганизмов, но, несмотря на это, они не могут быть причислены к антибиотикам. Это, например, органические кислоты, этиловый спирт, перекись водорода и некоторые другие вещества, действие которых проявляется в значительно более высоких концентрациях, нежели у антибиотиков. 2. Среди антибиотиков можно выделить также антибиотически активные вещества, получаемые из зелёных растений, так называемые фитонциды. Сюда относятся, например, хлорелин, аллицин, томатин, антибиотик из настурции (Tropaelum majus) и т.д. Среди антибиотиков в широком смысле слова можно выделить и антибиотически активные вещества животного происхождения. Это, например, экмолин ? препарат, получаемый из органов рыб и зарекомендовавший себя как средство для лечения ряда заболеваний, а также как средство, продлевающее действие пенициллина, стрептомицина и других антибиотиков. Другими примерами могут служить препараты, поучаемые из членистоногих, среди которых, например иридомирмецин, выделенный из экстракта одного из видов тропических муравьёв, имеет очень широкий антимикробный спектр и вдобавок обладает инсектицидным действием. В настоящее время известно очень много антибиотиков, поэтому, чтобы легче ориентироваться, их необходимо разделить на несколько групп. 3. Отдельные антибиотики, которые первоначально были обнаружены и выделены как продукты обмена определённых микроорганизмов, т.е. получены путём биосинтеза, можно получать и производить также и методами химического органического синтеза. Эти антибиотики, следовательно, являются переходными между собственно антибиотиками и химиотерапевтическими средствами. Химиотерапия в самом широком смысле слова есть лечение химическими веществами. В более узком смысле слова химиотерапия есть лечение инфекционных болезней химическими веществами, что прежде всего предполагает специфическое действие последних на определённый вид или целую группу патогенных микробов. Для того чтобы быть хорошим лечебным средством, каждый антисептик должен обладать несколькими основными свойствами.
Применение антибиотиков в настоящее время не ограничивается лишь областью медицины. Антибиотики с огромным успехом используют как добавки в корма сельскохозяйственных животных, для лечения заболеваний растений, как средства, предотвращающие инфицирование в бродильной, консервной и других отраслях промышленности. Пока ещё не ясно, какое место займут антибиотики в качестве стимуляторов роста растений. 1. Качественное определение антибиотиковЗадача качественно определить неизвестный антибиотик встаёт как при изучении новых антибиотиков, так и в практике, если нужно показать присутствие антибиотика в фармацевтических препаратах. Обе задачи требуют совершенно различных методов.Самым надёжным методом идентификации антибиотика является определение его инфракрасного спектра. Результаты здесь абсолютно однозначны. Только после измерения инфракрасного спектра можно с полной уверенностью судить об отличии или идентичности двух антибиотиков различного происхождения. Поскольку инфракрасным спектрофотометром оснащена не каждая лаборатория, то для идентификации антибиотиков были разработаны системы простых химических реакций, довольно надёжных для идентификации известных антибиотиков (табл. 1). Таблица 1 Перечень химических тестов для качественного определения антибиотика
Для быстрого качественного определения антибиотиков в фармацевтических препаратах очень удобна осциллографическая полярография. При хорошо подготовленной аппаратуре можно за несколько минут идентифицировать большинство ныне применяемых антибиотиков. Практически наиболее важным являются разграничение тетрациклиновых антибиотиков от хлорамфеникола, а также проверка состояния и чистоты пенициллиновых препаратов, причём важно быстро установить, до какой степени препарат разложился. Другим быстрым физическим методом идентификации антибиотиков является определение показателя преломления твёрдого вещества. В табл. 2 приведены величины показателей преломления для обычно применяемых антибиотиков в твёрдом состоянии. Таблица 2 Индексы преломления некоторых антибиотиков в твёрдом состоянии, определённые методом погружения
Практическую ценность представляет разница между показателем преломления хлортетрациклина и окситетрациклина, на основе которой можно эти два антибиотика различить. Очень специфическими являются микробиологические методы идентификации антибиотиков. Для этого применяются штаммы, специфически резистентные к данному антибиотику, или же так называемые зависимые штаммы, т.е. такие, рост которых обусловлен присутствием определяемого антибиотика. Этот метод особенно надёжен, однако изыскание или выведение таких штаммов является обычно очень трудоёмким делом. 2. Количественное определение антибиотиковВ процессе производства требуется определить содержание антибиотика в культуральной жидкости в ходе ферментации, во всех промежуточных продуктах при выделении и очистке и, наконец, в готовом препарате. Для этого применяют большое количество самых разнообразных биологических и химических методов.Количество антибиотиков выражают в так называемых единицах действия (ЕД). Определение единицы не одинаково для всех антибиотиков. У антибиотиков, которые были выделены в чистом виде, единица определяется как микрограмм чистого вещества. К сожалению, здесь нет единства, так как у некоторых антибиотиков за единицу принимается микрограмм соли (например, хлортетрациклин солянокислый), а у других ? микрограмм основания(например, у стрептомицина). Активность антибиотических препаратов в твёрдом состоянии выражается количеством единиц в 1 мг вещества. Содержание антибиотика в культуральной жидкости, в концентратах и растворах выражается числом единиц в 1 мл жидкости. Количественное определение антибиотиков можно проводить как химическими, так и микробиологическими методами. Главными преимуществами химических методов являются их быстрота и сравнительно высокая точность. Преимуществом же микробиологических методов является их намного большая специфичность: посторонние примеси, содержащиеся в испытуемых образцах, не влияют в такой степени на результаты, как это бывает при химических методах. Микробиологически можно определить и содержание таких антибиотиков, химические и физико-химические свойства которых ещё подробно неизвестны. 2.1. Микробиологическое исследование антибиотиковОсновным принципом микробиологических методов количественного определения активности антибиотика является определение степени задержки роста микроба, чувствительного к данному антибиотику. Культуры или микробы, используемые для этой цели, называются тест-культурами, или тест-микробами. Задержка роста, вызванная определённым количеством используемого материала с неизвестным содержанием антибиотика (например, культуральной жидкости, промежуточного продукта на стадии выделения лекарственно формы препарата и т. п.), сравнивается с задержкой роста тест-культуры, вызванной определённым, известным количеством данного антибиотика (стандартом).Микробиологические методы определения активности антибиотиков можно в основном разделить на методы, при которых воздействие на тест-культуру исследуется на жидкой среде, и методы, при которых воздействие антибиотика на тест-культуру оценивается с применением твёрдой питательной среды. К первой группе относятся методы серийных разведений и турбидиметрические методы; ко второй группе ? методы диффузии в агар на чашках и методы диффузии в агар в капиллярах или пробирках. Основными требованиями, которые необходимо предъявлять к микробиологическим методам количественного определения антибиотиков, являются следующие. 1. Точность. 2. Чувствительность. 3. Простота техники эксперимента. 4. Наиболее короткое время инкубации. Более или менее совершенное выполнение всех этих требований зависит прежде всего от применяемого метода. Для достижения максимальной чувствительности, кроме того, немалую роль играет культура, используемая для определения. Важным критерием метода является также хорошая воспроизводимость результатов в условиях различных лабораторий. 2.1.1. Методы разведенийПринципом методов разведений является определение количества антибиотика, которое полностью подавляет рост тест-культуры. При этом раствор анализируемого образца с неизвестным содержанием антибиотика и раствор стандарта с известным содержанием антибиотика разводят в геометрической прогрессии питательной средой, предварительно засеянной тест-культурой. По истечении необходимого времени инкубации определяют максимальное разведение образца и стандарта, которое ещё подавляет рост тест-культуры. Путём сравнения этих разведений вычисляют активность исследуемого образца. Вследствие того что оценку проводят по качественному признаку («растёт»-«не растёт»), этот метод не удовлетворяет первому из перечисленных выше требований. Вместе с тем главным преимуществом методов разведений является их высокая чувствительность, возможность определять очень малые количества антибиотиков, а в некоторых случаях – и короткое время (около 3 часов), необходимое для получения результатов.При определении содержания антибиотиков в жидкостях тела методом серийных разведений можно использовать индикаторы, реагирующие на изменение рН или окислительно-восстановительного потенциала в процессе роста тест-микроба, например бромкрезоловый красный, метиленовый синий, тимоловый синий, водный синий или феноловый красный и др. 2.1.2. Турбидиметрические методыТурбидиметрические методы, как и методы разведений, обычно удовлетворяют требованиям, указанным в пп. 2-4, но при этом их точность по сравнению с методами разведений значительно выше ввиду возможности непрерывного проведения количественных измерений.Принципом, на котором основаны эти методы, является измерение задержки роста тест-организма, проявляющейся в большем или меньшем помутнении питательной среды. Для измерения помутнения используют фотоэлектрические нефелометры. Путём сравнения интенсивности задержки роста, вызванной действием неизвестного количества антибиотика со стандартной кривой, выражающей степень задержки, вызываемой известными количествами антибиотика, производят вычисление активности анализируемого образца. Турбидиметрические методы по сравнению с методами диффузии обычно являются сравнительно менее точными, так как микроорганизм, растущий на жидких питательных средах, при рабочих условиях проведения анализа более чувствителен к изменчивым факторам внешней среды. На результат могут повлиять и некоторые сопутствующие вещества, содержащиеся в испытуемом образце; при методах диффузии влияние этих веществ вследствие их меньшего проникновения в агар устраняется. Этими веществами являются, например, жирные кислоты или глюкозодегидрогеназа. Эти методы нельзя применять для определения активности антибиотиков в образцах, которые являются либо окрашенными, либо дают мутный раствор, если только это явление нельзя устранить путём соответствующей обработки стандарта. Источником ошибок могут быть и конечные, неспецифические изменения окраски культуры или изменения помутнения, которые могут произойти, например вследствие изменения рН при выращивании микроорганизмов. Несмотря на это, однако, турбидиметрические методы применяются весьма широко, главным образом потому, что по сравнению с методами диффузии в агар они требуют значительно меньшего времени инкубации. 2.1.3. Методы диффузии в агарПри производстве и разработке технологии получения антибиотиков, пожалуй, наиболее часто применяют методы диффузии в агар, которые по сравнению с предыдущими двумя методами обеспечивают большую точность результатов. В некоторых модификациях с помощью этих методов можно определять даже доли микрограмма антибиотика. Их недостаток состоит в том, что они требуют относительно длительного времени инкубации (примерно 18 часов). По сравнению с турбидиметрическими методами методы диффузии являются более выгодными также и потому, что они обычно требуют меньше места для инкубации.Методы диффузии в агар на чашках основаны на том, что антибиотик диффундирует из испытуемого образца в питательную агаровую среду, засеянную чувствительной к данному антибиотику культурой. Вокруг образца образуется круглая зона, в пределах которой тест-культура не растёт. Начало этому методу положила оксфордская группа исследователей, которая разработала так называемый метод с цилиндриками. По этому раствор антибиотика (образца и стандарта) заливают в полые цилиндрики, помещённые на поверхность засеянной тест-микробами агаровой среды в чашках Петри. Определение активности производят путём сравнения величин зон задержки роста у образца и стандарта при одном и том же разведении. При методах диффузии в агар на чашках образующиеся зоны задержки не являются точно круглыми, и, следовательно, измерение их диаметра в разных направлениях даёт непостоянные и тем самым недостаточно точные результаты. От этого недостатка свободны линейные методы диффузии, при которых измеряется задержка роста, получавшаяся вследствие диффузии раствора антибиотика лишь в одном измерении. При этих методах раствор антибиотика либо наливают на засеянную тест-микробами питательную среду в пробирке, либо засеянную питательную среду насасывают в стеклянные капилляры, которые погружают затем в раствор антибиотика. Рост и здесь может быть выявлен вследствие гемолиза или изменения окраски индикатора, добавленного к агаровой питательной среде. Весь процесс может быть в ряде операций механизирован и автоматизирован. При приготовлении растворов испытуемого образца и стандарта для количественного определения антибиотиков методами диффузии значительно более серьёзной задачей является выбор жидкостей, применяемых для растворения. Обычно для растворения образца и стандарта применяют фосфатные буферные растворы, рН которых выбирают так, чтобы разложение антибиотика было как можно меньшим, а тест-культура была наиболее чувствительной. Для стрептомицина, например, выбирают буфер с рН>7,0, для пенициллина и тетрациклиновых антибиотиков – буфер с рН В соответствии с этим устанавливают и рН используемой для определения агаровой питательной среды. Здесь, однако, нужно иметь в виду, что рН среды влияет на рост тест-организма и что фосфатные анионы оказывают стабилизирующее действие на растворы пенициллина. Особой проблемой микробиологического определения активности антибиотиков является определение отдельных антибиотиков в смесях методом, отличным от хроматографического. Эта проблема возникла впервые, когда нужно было определять отдельные пенициллины относительно друг друга. Ввиду того что активность отдельных пенициллинов различна при испытании с разными культурами, можно, кроме хроматографического метода, использовать и так называемое дифференциальное титрование, при котором образец, содержащий смесь пенициллинов, титруют либо турбедиметрическим, либо методом диффузии в агар с использованием нескольких различных тест-организмов. Присутствие отдельных пенициллинов в смеси затем рассчитывают на основании соотношения известной активности отдельных пенициллинов против отдельных тест-культур. При определении содержания пенициллина и стрептомицина в лекарственных формах, содержащих смесь этих антибиотиков, можно либо инактивировать пенициллин с помощью пенициллиназы, либо определить пенициллин с микробом, устойчивым к пенициллину. Подобные же методы применяют и при определении других антибиотиков в смесях. 2.2. Определение отдельных составных частей антибиотиковМногие антибиотики, как, например, пенициллин, стрептомицин, эритромицин, бацитрацин, неомицин, полимиксин и т. д., не являются химически индивидуальными веществами, а представляют собой смесь нескольких структурно сходных веществ. Бумажная хроматография и электрофорез на бумаге позволяют выделить эти составные части и отделить их количественно.Для изучения антибиотиков можно применять нисходящую, восходящую и горизонтальную хроматографию. Выбор системы растворителей зависит от химической природы антибиотика. Зоны отдельных антибиотиков выявляются на хроматограммах или электрофотограммах чаще всего биоавтографически, т. е. методом, подобным определению антимикробной активности антибиотиков чашечным методом. Хроматограмму на узкой полоске фильтровальной бумаги после её высушивания кладут на лоток с твёрдой агаровой средой, засеянной суспензией тест-микроба. Лоток помещают на несколько часов в термостат при 37є. В ходе инкубации микроб, посеянный на агар, вырастает, так что агар мутнеет и становится молочно-белым. Он не растёт, однако, вокруг тех мест полосок фильтровальной бумаги, где находятся антибиотически активные вещества. В этих местах остаются чистые прозрачные округлые зоны, которые с первого же взгляда указывают на расположение антибиотически активных составных частей первоначальной смеси. Измеряя диаметр прозрачной зоны, можно установить и количество соответствующей составной части путём сравнения этого диаметра с диаметром зоны стандарта, хроматографируемого одновременно с анализируемыми образцами. Этот метод применяют для обнаружения антибиотиков и витаминов с той лишь разницей, что витамины выявляются положительно, т. е. микроб растёт лишь в местах, где имеется витамин. Главным достоинством биоавтографии является её чувствительность, которая значительно превосходит чувствительность всех цветных реакций. В этом с нею сравним лишь метод флюоресценции. Это, однако, не говорит о том, что при хроматографировании антибиотиков для их обнаружения не применяют цветные реакции с помощью химических веществ. Этот способ применяют тогда, когда хотят определить составную часть антибиотика, химически подобную ему, но биологически неактивную. В табл. 3 приведены основные способы хроматографии наиболее употребительных антибиотиков. Если же образец, помимо антибиотика, содержит ещё большое количество солей или иных примесей, то бумажная хроматография может и не дать хороших результатов. В этих случаях можно прибегнуть к электрофорезу га бумаге или же сочетать электрофорез с хроматографией. Таблица 3 Бумажная хроматография антибиотиков
Бумажная хроматография и электрофорез незаменимы при контроле процесса получения антибиотиков путём ферментации. Их главным достоинством является то, что они одинаково хорошо пригодны как для неочищенных растворов, так и для очищенных веществ. Это обусловлено прежде всего специфичностью биоавтографического метода. Ещё большее значение, нежели для технологии, имеет бумажная хроматография для изыскания и изучения новых антибиотиков. 2.3 Химические и физико-химические методы определения антибиотиков2.3.1. Химические методыХимические методы используются для анализа антибиотиков очень редко. Практически это будет лишь несколько методов, применяемых для пенициллина. Они основаны на поглощении йода продуктами гидролиза пенициллина. Эти методы в различных модификациях применяются в практике при контроле ферментации и экстракции пенициллина. При более старом способе с применением щелочного гидролиза необходимо было экстрагировать пенициллин из культуральной жидкости амилацетатом при рН=2,0 и температуре 0є, затем из амилацетата экстрагировать его фосфатным буфером при рН=7,8 и только с этим экстрактом производить непосредственное йодометрическое определение. Более новый метод, про котором пенициллин разрушается кислотой, позволяет проводить работу прямо с культуральной жидкостью без экстракций.Пенициллин можно определять также ацидометрически после его расщепления до пенициллоиновой кислоты, при этом из ?-лактамного кольца пенициллина освобождается одна свободная карбоксильная группа, которую можно титровать; ?-лактамное кольцо пенициллина можно расщепить либо щёлочью, либо пенициллиназой. Этот метод, однако, нельзя применять для нативного раствора, который содержит множество посторонних веществ, делающих точное ацидометрическое титрование невозможным. 2.3.2. Оптические методы. Колориметрия и спектрофотометрия в видимом светеСюда относятся наиболее часто применяемые методы количественного определения антибиотиков. Основным достоинством колориметрических методов определения являются их простота, скорость и сравнительно высокая точность, недостатком ? их малая специфичность.Для колориметрического определения антибиотики превращают в окрашенные производные. При этом используют цветные реакции либо с самими антибиотиками, либо с продуктами их расщепления. Например, тетрациклиновые антибиотики образуют окрашенные комплексы с хлорным железом в кислой среде. Стрептомицин расщепляют едким натром до мальтола, который даёт цветную реакцию с хлорным железом или с реактивом Фелинга. Антибиотики группы фенола или ароматических аминов со свободным орто- или пара-положением можно обычно перевести в азокрасителе путём реакции с диазониевыми солями. Так можно определять, например, тетрациклиновые антибиотики. Некоторые антибиотики можно перевести в соединения с каким-либо красителем, затем выделить эти вещества из реакционной смеси и определить колориметрически. Так можно определять пенициллин с помощью N-(1-нафтил-4-азобензол)-этилендиамина. 2.3.3. Спектрофотометрия в ультрафиолетовом светеСпектральный анализ имеет большие возможности, нежели колориметрия. Большинству антибиотиков свойствен характерный спектр поглощения в ультрафиолетовой области, и поэтому определять их спектрофотометрически можно непосредственно. Недостатком является то, что присутствие посторонних веществ мешает определению в значительно большей мере, нежели при колориметрии или спектрофотометрии в видимом свете, и поэтому определять антибиотики этим методом можно лишь в отдельно чистых образцах.Можно повысить специфичность метода и сделать его применимым к менее чистым препаратам путём измерения экстинкции при двух различных длинах волн, из которых одна находится на максимуме, а другая ? при соседнем минимуме кривой экстинкции антибиотика. Этим путём зачастую удаётся установить влияние среды. Важно, чтобы все измерения проводились при строго определённом рН, поскольку спектр поглощения антибиотика в ультрафиолетовом свете очень сильно зависит от рН среды. 2.3.4. Инфракрасная спектроскопияЭтот метод является специфичным для качественного определения антибиотика. Его можно, однако, очень хорошо использовать и для количественного определения. Обычно достигается точность, равная точности спектрофотометрии в ультрафиолетовом свете, а в некоторых случаях даже ещё более высокая (±1%). Можно производить количественный анализ как растворов, так и твёрдых веществ. При анализе веществ в растворах необходимо выбрать подходящий растворитель, который сам бы не поглощал инфракрасные лучи в данной области. Обычно это бывает сероуглерод или же галоидопроизводные углеводородов. Поэтому антибиотик нужно иметь в такой форме, чтобы его можно было в этих веществах растворить. Если же подходящий растворитель найти не удаётся, можно провести спектрофотометрическое определение вещества в твёрдом состоянии. Твёрдые вещества либо таблетируют с бромистым натрием. Либо суспендируют в масле: измерение поглощения производят в тонких слоях этой суспензии.Для количественного определения необходимо знать плотность слоёв этой суспензии. Её определяют путём добавления известного количества кристаллического вещества, например ?-аланина, к суспензии антибиотика и измерения экстинкции при одном из максимумов поглощения добавленного вещества. 2.3.5. ФлюорометрияЭто один из наиболее чувствительных методов определения антибиотиков, приближающийся по своей чувствительности к биологическим методам. Главной областью его применения являются тетрациклиновые антибиотики, которые сами по себе флюоресцируют жёлтым светом в умеренной щелочной среде; однако обычно измеряется синяя флюоресценция их продуктов разложения (в щелочной среде). Хлортетрациклин инактивируют щелочами, например 0,2 М тринатрийфосфатом, оставив смесь стоять в течение 30 минут при комнатной температуре, в то время как тетрациклин кипятят при этом в течение более продолжительного времени.Антибиотики, которые сами по себе не флюоресцируют и не образуют флюоресцирующих продуктов разложения, можно тем не мене определять флюорометрически путём соединения с подходящим флюоресцирующим веществом и выделения подходящего дополнительного соединения. 2.3.6. Оптическое вращениеПоляриметрические методы дают очень надёжные результаты применительно к концентратам оптически активных антибиотиков, если только они не слишком сильно окрашены. Вследствие удобства работы они получили очень широкое применение как обычные методы контроля, в особенности при выделении стрептомицина. Для определения антибиотиков в культуральной жидкости они непригодны, поскольку в этих случаях они малочувствительны.Сконструирован автоматический регистрирующий поляриметр, при помощи которого изучена кинетика разрушения пенициллина кислотами. 2.3.7. Электрохимические методыАнтибиотики, являющиеся кислота или основаниями, можно титровать потенциометрически. Эти методы применяют сравнительно редко, поскольку с такими антибиотиками редко приходится иметь дело в этих формах. Исключение составляет, например, пенициллин.Хлоргидраты тетрациклиновых антибиотиков имеют сильно кислотные свойства, напротив, основность этих антибиотиков очень слаба. Поэтому хлоргидраты можно титровать непосредственно алкалиметрически. После подтитровки хлоргидрата (достижения степени диссоциации свободной амфотерной формы антибиотика) на кривой потенциометрического титрования можно ясно видеть резкое изменение потенциала. Намного большую точность и значительно более широкие возможности имеет потенциометрическое титрование в неводных растворителях. Так, например, слабоосновные антибиотики, как тетрациклины, а также эритромицин и карбомицин, можно определять с помощью титрованного раствора хлористой кислоты в диоксане. Напротив, антибиотики с кислотными свойствами, пусть даже и очень слабыми, удаётся титровать в среде безводных оснований, например, в триэтаноламине. Эти методы выгодны тем, что они являются универсальными для целой группы антибиотиков. Конечно, они могут применяться исключительно лишь для чистых веществ и готовых препаратов. 2.3.8. ПолярографияАнтибиотики, содержащие в своей молекуле восстанавливающиеся группы (например, нитрогруппы, кетогруппы, примыкающие к одной или более двойной связи, альдегидные группы, карбоксильные группы, примыкающие к двойным связям) либо имеющие хиноподобную структуру, могут быть восстановлены на ртутном капельном электроде и могут поэтому определяться полярографически. Сюда относятся прежде всего хлорамникол, далее ? все тетрациклиновые антибиотики, стрептомицин, все хиноновые антибиотики, цитринин и туяплацины.Другие антибиотики, напротив, окисляются на ртутном капельном электроде и могут поэтому давать анодную волну, которая также может служить для их количественного определения. Примером является гентизиловый спирт, производное гидрохинона. Антибиотики, которые сами по себе полярографически неактивны, можно перевести несколькими способами в полярографически активные вещества. Так, например, пенициллин гидролизуется сначала щёлочью или пенициллиназой и далее в кислой среде ? до диметилцистеина. Эта аминокислота, содержащая группу ? SH, даёт хорошо измеряемую волну в кобальтовом растворе Брдички. Очень ценна с аналитической точки зрения полярография хлорамникола. Этот антибиотик можно количественно определять полярографическим методом в биологическом материале, как-то: в крови и моче человека, в кутьтуральной жидкости. Следующей областью применения полярографии являются тетрациклиновые антибиотики. Их можно определять количественно в готовых продуктах и в фармацестических препаратах. При соответствующем выборе среды можно определять количественно соотношение хлортетрациклина и окситетрациклина. Однако количественный анализ смеси хлортетрациклин и окситетрациклина лучше всего удаётся колориметрическим методом. В культуральной жидкости тетрациклиновые антибиотики определить нельзя, поскольку в этом случае определению мешает выделение водорода, катализируемое белками и другими веществами, присутствующими в фильтрате культуральной жидкости. 2.3.9. Амперметрическое (полярометрическое) титрованиеКаждый антибиотик, который осаждается полярографически активными веществами, можно титровать амперметрически. Определение это является более точным, однако значительно менен специфичным, чем обычная непосредственная полярография. Эти методы до настоящего времени применялись очень мало.2.3.10. КондуктометрияДля прямого определения активности антибиотических препаратов можно использовать кондуктометрическое титрование. Этот метод до сего времени применялся очень мало, хотя несомненно, что на его основе возможно со временем обогатить анализ антибиотиков несколькими точными микроопределениями. Чаще кондуктометрия используется для определения зольности готовых антибиотических препаратов либо для контроля десорбции антибиотиков из ионообменных колонн (особенно стрептомицина).2.3.11. Радиоактивные изотопы в анализе антибиотиковВ области антибиотиков сфера применении радиоактивных и тяжёлых изотопов необычайно широка. Меченые препараты можно одинаково широко применять как для аналитического контроля производства, так и для решения основных проблем действия антибиотиков на микроорганизм и макроорганизм, для объяснения механизмов всасывания, циркуляции, накопления и выделения антибиотиков в теле. В области фармакологии и биохимии антибиотиков с помощью изотопов были достигнуты ценные результаты.Приготовление антибиотика, меченного изотопом, производится в процессе биосинтеза путём, в общем сходным с получением обычного антибиотика. Возможность специфической метки (т. е. локализации изотопа в одном определённом, заранее известном месте молекулы антибиотика) имеется лишь тогда, когда точно известен предшественник антибиотика и когда этот предшественник можно специфически пометить. Такая возможность имеется у бензилпенициллина, предшественник которого ? фенилуксусная кислота с каким-либо изотопом углерода в карбоксильной группе ? легко доступен. Если теперь при ферментации мы введём в качестве предшественника меченную таким образом фенилуксусную кислоту, то мы получим специфически меченный пенициллин. Определение антибиотиков при помощи препаратов, меченных изотопами, проводят обычно методом разбавления изотопов. Этот способ применим для анализа образца любой химической природы, если только из него можно получить хотя бы небольшое количество чистого антибиотика. Например, к культуральной жидкости прибавляют заранее известное количество чистого меченого антибиотика с известной удельной радиоактивностью. При этом меченый препарат в определённой степени разбавляют антибиотиком, содержащимся в образце. Затем из жидкости выделяют антибиотик и несколько раз перекристаллизовывают до постоянно удельной радиоактивности. Поскольку изотопы нельзя определить простыми физическими методами, степень разбавления меченого препарата, содержащегося и в выделенном антибиотике, а также его удельная радиоактивность будут обратно пропорциональны содержанию антибиотика в культуральной жидкости. 2.4. Количественное определение некоторых антибиотиков2.4.1. ПенициллинЙодометрический методПод влиянием щелочей или пенициллиназы происходит раскрытие бета-лактамного кольца в структуре антибиотика с образованием пенициллоиновой кислоты. Последняя и реагирует с йодом. По разности йода, израсходованного на взаимодействие с пенициллином до и после гидролиза молекулы антибиотика, судят о количестве препарата в исследуемых образцах. Этот метод даёт хорошо совпадающие результаты с данными биологических методов определения активности, и он применим для большинства лекарственных форм пенициллина. Взвешивают 25-30 мг исследуемого образца антибиотика и растворяют в фосфатном буфере (рН 6,0) до получения концентрации примерно 2000 ЕД/мл. По 2 мл полученного раствора вносят в две 125-миллилитровые колбы Эрленмейера. В первую из них добавляют 2 мл 1N раствора едкого натра и оставляют на 15 мин при комнатной температуре. После этого в данную колбу вносят 2 мл 1,2 N раствора соляной кислоты и 10 мл 0,01 N йода. Через 15 мин избыток йода оттитровывают 0,01 N раствором гипосульфита натрия. В конце титрования добавляют 1 каплю раствора крахмала и продолжают титрование при энергичном встряхивании до обесцвечивания синей окраски крахмала. Во вторую колбу добавляют 10 мл 0,01 N раствора йода и титруют сразу 0,01 N раствором гипосульфита натрия (контроль). Активность пенициллина определяют по нижеприведённой формуле: где ? ? количество ЕД пенициллина в 1 мг; a ? разность в титрах; b ? активность рабочего стандарта в ЕД/мг; c ? вес образца, мг; F ? количество мл 0,01N раствора йода, поглощённого 1 мл рабочего стандарта натриевой соли бензилпенициллина. Следует помнить, что расход йода при титровании зависит от температуры, рН среды, концентрации йода и других причин. Поэтому необходимо строго соблюдать условия стандартности опытов, тогда результаты будут неизменно воспроизводимыми. Весовой метод определения бензилпенициллина Этот метод является ориентировочным, так как характер и количество осадка зависят от условий осаждения. Бензилпенициллин с N-этилпиперидином образует кристаллические соли, плохо растворимые в смеси ацетил-ацетона и при определённой концентрации выпадающие из раствора в виде осадка. Это позволяет определить пенициллин G не только в виде кристаллической натриевой соли, но и в смеси с другими солями пенициллина. Метод не пригоден для определения пенициллина G в смеси с пенициллином X. Метод ультрафиолетовой спектрофотометрии Фенильная группа в пенициллине G позволяет получать характерный максимум поглощения в ультрафиолетовом свете при 263 нм. Хроматографичевкий метод Смесь пенициллинов достаточно чётко разделяется на полосках хроматографической бумаги. Проявление местоположения их осуществляется по зонам задержки роста тест-микроба вокруг определённых участков полоски, наложенной на микробный газон. Метод выполняется следующим образом. Полоски хроматографической бумаги (35Ч0,5 см) пропитываются раствором фосфатного буфера (рН 6,8), представляющего смесь насыщенных растворов дигидрофосфатов калия и натрия, и подсушивают между слоями фильтровальной бумаги при окончательном досушивании на воздухе. На линию старта наносят по 1-2 мл испытуемого раствора с исходной концентрацией 800-1000 ЕД/мл. Бумагу помещают в хроматографическую банку, в лоток которой налит освобождённый от перекисей эфир, насыщенный водой (нисходящая хроматография). Банку ставят в рефрижератор на сутки. После этого бумажную ленту отрезают на 0,5 см выше линии старта и переносят на засеянные тест-микробами лотки. Лента должна плотно прилегать к агару. Лотки оставляют в термостате (37є) на 16-18 ч и затем читают результаты. Количество зон задержки роста культуры соответствует числу типов пенициллинов, а порядок чередования их на бумажной ленте зависит от коэффициента распределения. Наиболее подвижен пенициллин К (гептилпенициллин), за ним последовательно располагаются дигидропенициллин F (амилпенициллин), пенициллин F (2-пентенилпенициллин), пенициллин G (бензилпенициллин) и пенициллин Х (пара-оксибензилпенициллин0. Чем больше зона задержки роста, тем больше в смеси того или иного типа антибиотика, количество которого можно определить следующим образом: отрезанную бумажную ленту разрезают по длине на две равные части, одну из которых помещают на агар с тест-культурой, а вторую через 16-18 ч разрезают на части соответственно зонам задержки роста. Пенициллин из обрезков извлекают водой и водные экстракты титруют чашечным методом. Этот способ менее точен, чем описанный ранее диффузионный, а поэтому его следует расценивать лишь как ориентировочный. Тем не менее качественное определение пенициллинов хроматографическим методом распространено широко. 2.4.2. СтрептомицинМальтольный методЭтим методом возможно определение не только стрептомицина, но и маннозидстрептомицина. Он основан на том, что оба названных антибиотика при нагревании с раствором разбавленной щёлочи образуют мальтол, который определяется затем колориметрически или спектрофотометрически по окраске, образуемой им с солями железа или реактивом фолина. В мерную колбу на 25 мл наливают 10 мл испытуемого образца стрептомицина-основания, содержащего 0,5 мл антибиотика и 1 мг раствора. В эту же колбу добавляют 2 мл 1 N NaOH и ставят её на кипящую водяную баню на 10 мин. Затем охлаждают колбу в ледяной или проточной водопроводной воде и приливают 2 мл 1,2 N HCl; добавляют 5 мл 0,25% хлористого железа и доводят общий объём смеси дистиллированной водой до метки. Полученный окрашенный раствор калориметрируют при 550 нм в соответствующем фотоэлектрокалориметре против раствора стандартного образца антибиотика и дистиллированной воды в контролях. Результаты выражают графически на полулогарифмической сетке, где по оси ординат откладывают значения для степени прохождения света, а по оси абсцисс ? концентрацию стрептомицина. Активность испытуемого образца вычисляют по стандартной кривой. Недостатки метода: нельзя определять стрептомицин и маннозидстрептомицин отдельно при нахождении их в смеси; если в последней будет ещё и оксистрептомицин, то он в условиях опыта даст оксимальтол, который также образует окрашенные продукты с солями железа. Нитропруссидный метод Этим методом можно определять различные стрептомицины, так как известно, что нитропруссид натрия в щелочной среде даёт окрашивание с гуанидином. Определение выполняется следующим образов: смешивают равные объёмы 10% растворов нитропруссида натрия, железистосинеродистого калия и едкого натра. К смеси приливают 3 объёма воды. Через 30 мин раствор готов к употреблению (он имеет ярко-жёлтую окраску). При появлении мути в растворе его заменяют свежим. Обычно реактив пригоден для работы лишь в течение нескольких часов. К 5 мл раствора стрептомицина (концентрация 20-25 Ед/мл) приливают 1 мл реактива. При этом возникает устойчивая оранжевая окраска. Раствор калриметрируют против раствора стандартного образца стрептомицина (контроль). Последний должен быть прозрачным, поскольку мутные растворы могут исказить результаты определения. Метод не вполне специфичен, так как окрашенные соединения получаются и с другими веществами, содержащими гуанидиновые группы, и, в частности со стрептидином ? продуктом расщепления стрептомицина, не обладающим биологической активностью. Микроманометрический метод Метод применим для определения низких концентраций антибиотика (0,005-0,05 ЕД/мл). В сосудики от аппарата Варбурга вносится взвесь 16-18-часовой культуры золотистого стафилококка 209Р (25-100 млн. клеток/мл), мясо-пентонный бульон без NaCl и глюкозы; рН среды 8,0. Объём смеси в каждом сосудике должен быть равен 2 мл. В центральную часть сосудика наливают 0,2 мл 1 N раствора NaOH. Температура водяной бани ? 37є. Стрептомицин используется в концентрациях от 0,005 до 0,05 ЕД/мл. При этом между количеством поглощённого бактериями кислорода и концентрацией стрептомицина существует прямолинейная зависимость. Измерение дыхания проводят в пределах 2,5 ч с интервалом измерений объёма поглощённого кислорода через каждые 15-30 мин. По результатам опытов строят стандартную кривую, на основании которой производят расчёт активности в испытуемом образце. Для этого по оси ординат откладываколичество (мм3) поглощённого кислорода за 2,5 ч, а по оси абсцисс ? концентрацию антибиотика (ЕД/мл). Следует отметить, что растворы стрептомицина более высокой концентрации, чем 0,05 ЕД/мл, необходимо предварительно разбавлять до концентрации 0,005-0,05 ЕД/мл или определять другими методами. Микроманометрическое определение пригодно для выявления концентрации стрептомицина в негемолизированной крови (гемолизированная кровь убивает стафилококка). 2.4.3. ТетрациклиныКолориметрический методФенольно-гидроксильные группы в структуре хлортетрациклина, окситетрациклина и тетрациклина позволяют использовать цветную реакцию их с хлорным железом для количественного определения названных антибиотиков. В колбу Эйленмейера (объёмом 50 мл) вносят 10 мл раствора испытуемого препарата ? основания, приготовленного путём растворения последнего в 0,01 N HCl и содержащего 0,1 мг антибиотика в 1 мл. В эту же колбу наливают 10 мл 0,05% раствора хлорного железа, перемешивают и оставляют при 16-18є на 10 мин, после чего определяют прохождение света для стандарта и испытуемого препарата при 490 нм на ФЭК против 0,01 n раствора соляной кислоты (контроль). По данным анализа для растворов стандарта строят стандартную кривую на полулогарифмической сетке (по оси ординат откладывают показатели колориметра, а по оси абсцисс ? концентрацию антибиотика-основания). По этой кривой определяют количество антибиотика в испытуемом образце. Подобным методом возможно определение хлортетрациклина и тетрациклина, приобретающих стойкую жёлтую окраску при нагревании с соляной кислотой. Окситетрациклин такой реакции не даёт. Спектрофотометрический метод Растворы окситетрациклина и тетрациклина дают жёлтое окрашивание при добавлении щёлочи. При этом максимальное поглощение выявляется при 380 нм. Хлортетрациклин при обработке щёлочью даёт нестойкое жёлтое окрашивание и, по существу, не удаётся выявить максимум при 380 нм. Следовательно, данный метод позволяет определять окситетрациклин и тетрациклин в присутствии хлортетрациклина. Описаны и другие методы определения тетрациклинов и, в частности, хроматографические, флуорометрический и пр. 2.4.4. ЛевомицетинМетод диазотирования с последующим титрованием 0,1 М раствором нитрита натрия (ГФХ).Берут точную навеску препарата (0,5 г) и помещают её в коническую колбу на 250 мл, приливают 20 мл концентрированной соляной кислоты и осторожно, небольшими порциями, 5 г цинковой пыли. Затем приливают ещё 10 мл той же кислоты, обмывая стенки колбы, и после полного растворения цинковой пыли (можно подогреть), раствор количественно переносят в стакан для диазотирования, охлаждаемой снаружи льдом; прибавляют 3 г бромида калия и медленно титруют 0,1 M раствором нитрита натрия. Титрование считают законченным, когда капля жидкости, взятая через 3 мин после прибавления раствора нитрита натрия, будет вызывать немедленное посинение йодкрахмальной бумаги; 1 мл 0,1 М раствора NaNO2 соответствует 0,03231 г левомицетина. Колориметрический метод Этот метод основан на восстановлении нитрогруппы левомицетина в аминогруппу, которая при диазотировании образует окрашенные соединения. В колбу Эрленмейера на 10 мл вносят 2 мл раствора испытуемого образца в дистиллированной воде, содержащего 15 мкг антибиотика в 1 мл. Затем добавляют 1 мл 0,3 N NaOH и 25 мг NaHSO3. Полученный раствор оставляют при 16-18є в течение 15 мин. Спустя указанный срок в колбу приливают 0,5 мл 5 % раствора NaNO2 и 5-10 капель концентрированной (36-37%) соляной кислоты. Через 1-3 мин добавляют 1 мл 5% раствора сульфаминовой кислоты. Образующиеся в колбе азотистые пары удаляют с помощью водоструйного насоса в течение нескольких секунд. Затем приливают0,5 мл 0,5% раствора N-(1-нафтил)-дихлордиэтилендиамина и доводят объём дистиллированной водой до метки. Через 2 ч производят замеры на ФЭК при 558 нм против дистиллированной воды, обработанной вышеуказанным способом (контроль). Концентрацию испытуемого образца определяют по стандартной кривой на полулогарифмической сетке. Указанный метод чаще используется при определении хлорамникола, получаемого ферментативным путём. 2.4.5. ЭритромицинСпектрофотометрический методЭтот метод позволяет определять эритромицин даже в присутствии продуктов его кислой инактивации (в отличие от колориметрических методов). Он основан на измерении оптической плотности раствора эритромицина при 236 нм после слабой щелочной обработки. Для внесения поправки на поглащение света различными примесями и продуктами разложения используют раствор эритромицина, инактивированный кислотой (контроль). 2.4.6. НеомицинКолориметрический методМетод основан на количественном определении пентозы, входящей в структуру антибиотика. К 1 мл испытуемого раствора антибиотика добавляют 2 мл концентрированной соляной кислоты с хлорным железом (100 мг FeCl3 на 100 мл HCl) и 0,1 мл 10% раствора орцина в этаноле; затем смесь нагревают на водяной бане в течение 20 мин и быстро охлаждают; объём доводят дистиллированной водой до 10 мл и фотометрируют на ФЭК с красным светофильтром (610-750 нм). Расчёт количества неомицина в испытуемом образце ведётся по стандартной кривой, построенной по данным измерения на ФЭК растворов стандарта антибиотика. 2.4.7. ФлоримицинКолориметрический методМетод основан на определении антибиотика по биуретовой реакции. Точную навеску флоримицина (80-90 мг) растворяют в 100 мл дистиллированной воды в мерной колбе. Полученный раствор в количестве 20 мл переносят в 50-миллилитровую колбу Эрленмейера, добавляют 2 мл 2% раствора CuSO4Ч5h3O и 5 мл 2 N раствора NaOH. Содержимое колбы доводят до метки дистиллированной водой и тщательно перемешивают. Спустя 3 мин выпавший осадок гидроокиси меди отфильтровывабт через бумажный фильтр. После этого измеряют оптическую плотность прозрачного фильтрата, окрашенного в фиолетовый цвет. Используют ФЭК с зелёным светофильтром; длина кюветы 5 см. В качестве контроля используют дистиллированную воду. Расчёт активности испытуемого образца флоримицина ведётся на калибровочной кривой, построенной для стандартного флоримицина с известными концентрациями. Описанный метод применим для определения активностиантибиотика в культуральной жидкости. При этом, кроме указанных выше реактивов, используют смолу кБ-1 с содержанием дивинилбензола ?6% или КБ-2 с содержанием дивинилбензола 2,5-3%; 2 N раствор NaOH и 0,5 N раствор h3SO4. 2.4.8. Грамицидин СМетод скоростной хроматографии на бумагеГрамицидин С избирательно проявляется бром-фенолом синим на бумажной хроматограмме. Это свойство было использовано для определения антибиотика на хроматограммах и в спиртовых экстрактах. Хроматографирование проводится в камере, сваренной из нержавеющей стали. Подставка изготавливается из стеклянных палочек. В качестве растворителя применяют метилэтилкетон – пропионовая кислота – вода (15:5:6) или н-бутанол-уксусная кислота – вода (4:1:5). Вторая система перед употреблением уравновешивается при 60є, для чего она выдерживается без отделения водного слоя при этой температуре не менее 30 мин. Используют верхний слой. На дно камеры помещают чашку Петри с системой растворителей. На бумагу наносят 10 или 25 мкл испытуемого раствора, содержащего в 1 мл 1000 мкг антибиотика (параллельно со стандартным образцом грамицидина). При содержании в образце более 5000 мкг/мл его необходимо предварительно развести, но не более чем до 50 мкг в 1 мл. Бумагу с нанесёнными образцами и стандартом заправляют в сухую хроматографическую лодочку, камеру плотно закрывают крышкой с зажимами и помещают её при 60є на 20-25 мин. По истечении указанного времени растворитель наливают через отверстие в крышке камеры (ранее закрытое резиновой пробкой) в лодочку. Отверстие закрывают и камеру оставляют при 60є на 30-60 мин. Затем хроматограмму вынимают, проявляют бромфеноловым синим и высушивают. Оценку результатов проводят с помощью денситометра. Возможно также элюирование окрашенных пятен спиртом при нагревании и их спектрофотометрии при 580 нм. 2.4.9. ЦиклосеринКолориметрический методМетод основан на реакции циклосерина с нитропруссидным реагентом (смесь равных объёмов 4% раствора нитропруссида натрия и 4 N раствора едкого натра) в кислой среде с образованием комплекса голубого цвета. К 1 мл раствора циклосерина с концентрацией 50-200 мкг/мл добавляют 3 мл 1 N раствора уксусной кислоты и 1 мл приготовленного накануне нитропруссидного реагента. После перемешивания раствор оставляют при комнатной температуре нВ течение 10 мин и колориметрируют с красным светофильтром против дистиллированной воды (контроль). Длина кюветы 0,5 см. Концентрацию антибиотика рассчитывают по стандартной кривой, построенной для растворов стандарта. Колориметрическим методом можно определять циклосерин в присутствии продуктов его инактивации в кислой, щелочной и нейтральной средах. На результаты не оказывают влияние Na2SO4, MgSO4, (Nh5)2SO4, NaCl и CaSO4 в концентрациях не выше 1,6 N. ЗаключениеГотовый антибиотик, полученный в форме вещества, подвергается химической и биологической проверке по всем пунктам, указанным в Фармакопее. Каждую партию антибиотика проверяют особо. Если препарат отвечает всем требованиям Фапмакопеи, то его затем превращают в лекарственные формы (т. е. расфасовывают в ампулы, если препарат предназначен для инъекций, таблетируют или помещают в капсулы, если препарат предназначен для приёма внутрь, и т. д.). лекарственные формы затем снова проверяют соответствующим методом, чтобы удостовериться, что препарат не испортился при превращении его в лекарственную форму и содержание антибиотика в каждой отдельной дозе (например, в одном флаконе или таблетке) отвечает указанной активности.Готовые антибиотики контролируют химически, микробиологически и фармакологически и проверяют клинически. Химический контроль предусматривает прежде всего определение содержания антибиотика с помощью некоторых химических методов, описываемых подробно в Фармакопее. Биологическая активность играет важнейшую роль в оценке химиотерапевтических свойств того или иного антибиотика, поэтому естественно стремление научных и практических работников применять микробиологический контроль в производстве, клинике и лаборатории. Однако в ряде случаев незаменимыми являются физико-химические методы определения активности антибиотических. В данной работе были рассмотрены методы, которые наиболее часто используются для анализа антибиотиков. Список использованной литературы
nashaucheba.ru Влияют ли антибиотики на анализ крови и как их приниматьАнтибиотики — это специальные лекарственные средства натурального или синтетического происхождения, предназначенные для лечения различных заболеваний. Активные компоненты фармакологических препаратов способны подавлять быстрый рост живых микроорганизмов и клеток. Наряду с лечебным эффектом, антибактериальные лекарства негативно воздействуют на кишечную микрофлору и угнетают иммунную систему. Поэтому принимать антибиотики нужно исключительно по рецепту лечащего врача. Особенности антибактериальной терапии Особенности действия антибиотиков Особенности действия антибиотиковВсе антибиотики классифицируются по двум группам, в зависимости от влияния на вредные микроорганизмы: Бактерицидные. Действие медикаментозного средства основывается на уничтожение инфекции. Бактериостатические. Активное вещество вызывает нарушение клеточной цепочки возбудителя, отчего тот утрачивает возможность размножаться и постепенно гибнет. Попадая в организм, антибиотик разносится вместе с кровью по всем органам и системам. Каждый препарат, в зависимости от входящих в состав действующих веществ, может накапливаться в определенных количествах в каком-то одном органе. Так, концентрация ампициллина во внутренней полости среднего уха выше, чем средства из пенициллиновой группы. Соответственно, инфекционный возбудитель будет уничтожен быстрее. Однако опасность для человека представляет тот факт, что многие виды антибактериальных препаратов нацелены на уничтожение не одного возбудителя, а целых групп, в которых существуют не только болезнетворные, но и полезные микроорганизмы. Нарушение баланса влечет за собой размножение грибковой инфекции, устойчивой к влиянию почти всех известных антибиотиков. У больного подавляется иммунитет, развиваются аллергические реакции, нарастает токсическое действие на организм. Кроме этого, антибактериальные средства могут менять состав крови. Как узнать, влияют ли антибиотики на биохимический анализ крови? Прежде всего, сдать гематологический анализ и дождаться результатов, которые покажут клиническую картину. Влияние антибиотиков на анализ крови Влияние антибиотиков на анализ крови Влияние антибиотиков на анализ кровиПрежде чем назначать курс лечения, врач проведет все необходимые исследования, выпишет направление на биохимический анализ крови. Это нужно для того, чтобы установить основную причину заболевания. Ведь при вирусной инфекции антибиотики не помогают, напротив, такой подход к лечению чреват множеством осложнений. В борьбе с инфекцией бактериального происхождения задействуют антибиотики широкого спектра действия. Специфические изменения в гематологическом анализе помогут терапевту установить правильный диагноз и назначить эффективное лечение. Что такое бактериологический посев крови?Цель бактериологического посева – определение количества болезнетворных микроорганизмов в крови. Исключить либо подтвердить наличие бактериемии под микроскопом нельзя. Для получения точного результата надо провести выращивание (посев) бактерий в питательной среде. Затем содержимое пристально изучают под микроскопом, чтобы идентифицировать опасную инфекцию. Когда возбудитель определен, специалисты приступают к тестам, выявляющим чувствительность бактерии к разным антибактериальным препаратам. Это позволяет эффективно подавить рост и размножение болезнетворных организмов. Как влияет прием антибиотиков на анализ крови Как влияет прием антибиотиков на анализ крови Как влияет прием антибиотиков на анализ кровиПоскольку действие фармакологических средств по-разному сказывается на организме, важно, знать, влияют ли антибиотики на анализ крови. Кроветворение – это непрерывный процесс. Делящиеся молодые клетки в большей степени подвержены негативному воздействию антибактериальных препаратов. Токсическое влияние лекарственных средств меняет состав крови. Развиваются побочные эффекты, разрушающие ткани и органы. Влияние антибиотиков на анализ крови давно доказано многочисленными исследованиями. Во время приема этих препаратов наиболее часто встречаются следующие изменения гематологических показателей: Аминопенициллины. Прием препаратов из этой группы нередко вызывает формирование эозинофилии, нейтропении. Также увеличивается протромбиновое время, наблюдается положительная реакция Кумбса.Цефалоспорины. Эта категория препаратов систематизируется по 4 поколениям. К последствиям приема антибактериальных средств цефалоспориновой группы относится эозинофилия, нейтропения, снижение гемоглобина, анемия.Полимиксины. У больного, принимающего Полимиксин-М-сульфат, может развиться тромбоцитопения, гипокальциемия, гипокалиемия.Ансамакролиды. Могут повлиять на увеличение активности печеночных трансаминаз.Азалиды. Их токсическое действие влечет за собой повышение активности печеночных ферментов.Пенициллины. Стимуляция ложноположительной пробы Кумбса, эозинофилия, нейропения.Антисинегнойные пенициллины. Здесь может обнаружиться снижение агрегации тромбоцитов, гипонатриемия, эозинофилия, увеличение времени кровотечения.Антистафилококковые пенициллины. Лекарства из этой группы повышают активность печеночных трансаминаз, приводят к нейтропении и ложноположительной пробе Кумбса.Гликопептиды. При неправильном введении препарата развивается «синдром красного человека» из-за выделения большого количества гистамина.Хлорамфениколы. В некоторых случаях прием левомицитина приводит к образованию лейкопении, ретикулоцитопении.Аминогликозиды. Канамицин, Гентамицин и Стрептомицин провоцируют тромбоцитопению, повышение концентрации печеночных трансаминаз. Влияют ли антибиотики на общий анализ крови, когда происходит прогрессирование патологического состояния? Ответ положительный. В некоторых ситуациях отсутствие контроля за показателями крови приводит к тому, что функциональные изменения принимают морфологическую форму. Сложность структуры антибактериальных средств, обусловленную входящими в состав активными веществами, определяет развитие положительного результата и побочных эффектов. По этой причине заниматься самолечением нельзя. Можно ли принимать препараты перед сдачей анализа крови? Можно ли принимать антибиотики перед сдачей анализа крови? Можно ли принимать антибиотики перед сдачей анализа крови?Многие больные, в том числе занимающиеся самолечением, попросту не знают, влияет ли прием антибиотиков на анализ крови. Между тем у такой процедуры есть несколько правил, незнание которых приводит к обнаружению разнообразных отклонений от нормы. Так, нельзя принимать любые виды лекарственных средств за 24 часа до сдачи крови на биохимический анализ. Отступить от нормы можно исключительно с разрешения лечащего врача. Помимо этого, анализы делают натощак, чтобы не повысились такие показатели, как глюкоза, холестерол, билирубин. Для клинического анализа нужно будет отказаться от приема пищи минимум за час до процедуры. Поскольку показатели зависят от времени суток, необходимо учитывать и этот момент, сдавая кровь на гормоны. При заборе крови из вены на ее состав влияет физическая активность человека, эмоциональное перенапряжение. Немаловажное значение имеет присутствие в организме инфекционного возбудителя, давность инфицирования и состояние иммунной системы. Если врач сомневается в результатах анализов, он может назначить повторное исследование. Анализ крови и антибиотики при наличии хронических заболеванийПрактически все препараты выводятся из организма почками. Поэтому даже небольшие перемены в работе этого важного органа иногда становятся причиной нарастающей интоксикации. На ткань и структуру почек оказывают влияние антибиотики из группы гликозидов, тетрациклиновой группы. Если прием этих медикаментозных средств сопровождается параллельным употреблением цитостатиков, гормональных препаратов, нестероидных противовоспалительных средств, то вероятность повреждения почек растет в геометрической прогрессии. Анализ крови определит увеличение числа эритроцитов и лейкоцитов. Все это, необходимо учитывать при проведении биохимического анализа. Когда лекарство выводится из организма с желчью, могут возникнуть проблемы с печенью и желчным пузырем, что чревато повышением печеночных трансаминаз и нарастанием токсического действия. Влияют ли антибиотики на анализ крови общий, если у больного нет сопутствующих заболеваний? Каждый человек индивидуален, поэтому сложно предсказать реакцию организма на тот или иной медикаментозный препарат. В любом случае показатели крови будут отклоняться от нормы, потому что лекарственная терапия воздействует на все органы и ткани. Общий анализ крови при приеме гормоновМогут ли антибиотики повлиять на анализ крови в период приема гормональных контрацептивов? Таким вопросом задаются женщины, принимающие противозачаточные лекарства. Антибактериальная терапия меняет состав кишечной флоры, отчего организм не может усваивать гормоны на прежнем уровне. Соответственно, меняются показатели крови, снижается количество лекарственного препарата. Если другой метод контрацепции не используется, может наступить беременность. Анализ крови при нарушениях пищеваренияЛечение антибактериальными средствами нередко приводит к диарее и другим расстройствам пищеварения. Разнообразные заболевания органов ЖКТ могут ухудшать всасывание питательных веществ и лекарственных препаратов, отчего инфекционная патология примет хроническую форму течения. Анализ крови в таком случае покажет увеличение числа лейкоцитов, снижение гемоглобина, эозинофилию. В заключениеВремя проведения диагностики крови после завершения лечения антибиотиками устанавливается врачом в индивидуальном порядке, который должен учитывать результаты анализов и состояние здоровья пациента. В отдельных случаях целесообразным будет исследование в период приема препаратов. Эффективность лечебного курса и действия антибактериальных лекарств можно проверить на 2–5 день после приема последней таблетки или инъекции. Прием антибиотиков на анализ крови не повлияет, если проходить исследование не раньше, чем через 10 дней после завершения терапии. med-advisor.ru Антибиотики, анализ - Справочник химика 21ПОЛЯРИМЕТРИЯ — метод физикохимического исследования, основанный на измерении вращения плоскости поляризации света оптически активными веществами. Чаще всего такими веществами являются органические соединения с асимметрическим атомом углерода. Измерения производят с помощью поляриметров — оптических приборов, в которых луч света последовательно проходит через систему двух поляризующих призм. Благодаря пропорциональности, существующей между углом вращения и концентрацией оптически активного вешества, поляриметрические измерения используют для количественного определения оптически активного вещества. П. является основным методом контроля в сахарной промышленности по величине угла вращения определяют содержание сахара в растворе. Методы П. используются также для анализа эфирных масел, алкалоидов, антибиотиков и др. Большое значение имеет поляриметрический метод исследования в органической химии, где на основании определения знака и величины вращения плоскости поляризации можно судить о химическом строении и пространственной конфигурации соединения, делать выводы о механизме реакций и др. Для этого в последнее время особенно успешно используется спектрополяри-метрия. [c.201]Принципиальная схема типового флуориметра показана на рис. 1.34. Излучение источника 1, выделенное первичным светофильтром 2, попадает на кювету с пробой 3. Возникающее излучение флуоресценции Уф через вторичный светофильтр 4 попадает на фотоэлемент или фотоумножитель 5, где оно преобразуется в электрический сигнал, пропорциональный интенсивности флуоресценции, который усиливается электронным усилителем 6 и измеряется миллиамперметром. При использовании линейного участка градуировочного графика воспроизводимость флуориметрических определений составляет приблизительно 5%. Метод применяют для чувствительного определения очень малых количеств элементов при анализе органических веществ, при определении малых количеств витаминов, гормонов, антибиотиков, канцерогенных соединений, нефтепродуктов и др. [c.97] Наибольшее применение, как уже отмечалось, тонкослойная хроматография нашла в анализе органических соединений природного и синтетического происхождения. В настоящее время разработано большое количество методик разделения и определения различных классов органических веществ — от простейших углеводородов до витаминов, антибиотиков и нуклеиновых кислот. [c.140] Инфракрасная спектроскопия (ИКС) — раздел спектроскопии, охватывающий длинноволновую область спектра (>700 нм за красной границей видимого спектра). По инфракрасны.ч спектрам поглощения можно установить строение молекул различных органических (и неорганических) веществ антибиотиков, ферментов, алкалоидов, полимеров, комплексных соединений и др. По числу н положению пиков в ИК спектрах поглощения можно судить о природе вещества (качественный анализ), а по интенсивности полос поглощения — о количестве вещества (количественный анализ). Основные приборы — различного типа инфракрасные спектрографы. [c.57] Ионный обмен используют в кожевенной, гидролизной, фармацевтической промышленности для очистки растворов, а также для удаления солей из сахарных сиропов, молока, вин. С помощью ионитов улавливают ионы ценных элементов из природных растворов и отработанных вод различных производств. Промышленное производство многих продуктов жизнедеятельности микроорганизмов (антибиотиков, аминокислот) оказалось возможным или было значительно удешевлено благодаря использованию ионитов. Применение ионного обмена позволило усовершенствовать методы качественного и количественного анализа многих неорганических и органических веществ. [c.304] Для выделения, очистки и анализа алкалоидов, антибиотиков, витаминов применяются ионообменные смолы (иониты), уголь, окись алюминия, силикагель, бентонит и другие сорбенты. Распределительная хроматография на бумаге, чаще всего нисходящая, применяется в анализе аминокислот, алкалоидов, сульфаниламидных препаратов, антибиотиков и других органических соединений, а также смесей катионов и анионов. [c.516] Основным направлением развития фармацевтического анализа в настоящее время является дальнейшая разработка и усовершенствование физико-химических методов анализа фармацевтических препаратов и лекарственных форм и широкое внедрение их в практические учреждения (аптеки, контрольно-аналитические лаборатории), разработка простых, доступных для внутриаптечного контроля методов анализа сложных лекарственных смесей, развитие и совершенствование анализа новых лекарственных препаратов, особенно из группы сложных природных соединений с сильным биологическим действием (гли-козиды сердечного действия, гормоны, витамины, антибиотики), изучение условий хранения химико-фармацевтических препаратов, готовых лекарственных средств, галеновых препаратов в различных зонах страны, а также изучение влияния высокополимерных соединений (упаковочный материал) на действие лекарственных средств, дальнейшее развитие и совершенствование биофармацевтического анализа. [c.14] В настоящее время хроматография — один из наиболее распространенных методов анализа и выделения витаминов, антибиотиков, белков, гормонов, аминокислот и других природных соединений. [c.71] Начиная с работ М. С. Цвета, открывшего элютивную жидкостно-адсорбционную хроматографию, ее развитие сопровождалось ростом числа приложений в области биологии и медицины. Разработка А. Мартином и Р. Синджем (1941) жидкостной распределительной хроматографии значительно расширила возможности хроматографических методов. Преимуществами распределительной хроматографии является возможность работы в области линейной изотермы сорбции, что позволяет избавиться от деформации хроматографических полос. Кроме того, использование органических жидкостей в качестве неподвижной фазы улучшает возможность подбора необходимого сорбента. Она с успехом применяется для анализа и разделения лекарственных препаратов, гормонов, пестицидов, антибиотиков и других веществ. Основным недостатком классической жидкостной хроматографии является длительность процесса, достигающая суток. [c.78] Катионит СДВ. Катионит полимеризационного типа, имеет одну функциональную группу —ЗОзН, которая осуществляет обмен в широких пределах pH. Катионит обладает хорошей механической прочностью и химической устойчивостью. Его применяют при очистке антибиотиков, в анализе неорганических веществ, в гидрометаллургии и в ряде других процессов. [c.291] Иониты применяют в биологии для разделения органических кислот, аминокислот и углеводов, для выделения витаминов, алкалоидов и антибиотиков, для очистки ферментов и других веществ. Ионный обмен приобретает все большее значение в агропочвоведении и в агрохимическом анализе. А на промышленных предприятиях и электрических станциях иониты используют для умягчения или деминерализации воды. [c.302] Методы анализа. Для качественной идентификации антибиотиков, в отличие от ряда групп природных соединений (алкалоиды, гликозиды), не существует общих, групповых реакций. В основу качественной характеристики антибиотиков положена индивидуальность их химической структуры, характер функциональных групп, в зависимости от которых антибиотики дают те или другие реакции, преимущественно цветные. [c.414] Каталитические ферментативные методы анализа используют преимущественно для определения многих органических соединений, п частности таких, которые содержатся в биологических объектах (в крови, моче, тканях и др.). Таким способом можно определять мочевину, мочевую кислоту, аминокислоты и другие органические кислоты, глюкозу и другие сахара, антибиотики и т. д. [c.450] Пример 2. В химико-фармакологической лаборатории изучали распределение антибиотика эритромицина между водой и диизоамиловым эфиром. Свободный эритромицин (Эр) —слабое основание с константой диссоциации 10 поэтому для определения его концентрации в обеих фазах его титровали 0,003 М раствором НС1. При этом оказалось, что суммарное содержание Эр в обеих фазах всегда ниже исходного, т. е. при анализе как бы возникает нарушение материального баланса [c.59] Область применения пеногаситель в фармации - при упаривании экстрактов лекарственных растений, элюатов антибиотиков, при анализе сильно пенящихся жидких препаратов. [c.273] АРМ физико-биохимических анализов, состоящее из набора автоматизированных измерительных модулей с микропроцессорными контроллерами, — для морфометрического анализа, измерения активности антибиотиков, анализов реплик колоний на чашках Петри и состава культуральных сред с помощью газовой и жидкостной хроматографии, непрерывного измерения оптической плотности суспензий, определения дыхательной активности микроогранизмов методом замедленной флуоресценции, биохимических анализов с помощью хемилюминометра [c.106] Эта общая закономерность была названа законом распределения. который характеризует равновесное состояние в трехкомпонентной системе. Подобные системы образуются в процессе получения антибиотиков, галеновых препаратов и др., а также при анализе лекарственных форм. [c.46] Методы анализа фракций могут быть физическими, химическими и биологическими. Одним из лучших методов считается детектирование радиоактивных изотопов. Результаты измерений оформляют в виде кривой зависимости определяемой величины от объема злюата. По распределению пиков на хроматограмме судят о возможности объединения некоторых фракций, совершенно чистых, без примесей других компонентов. Методом ионообменной хроматографии можно разделять различные катионы и анионы, четвертичные аммониевые основания, амины, аминокислоты, белки, продукты гидролиза пептидов, физиологические жидкости, гидролизаты клеточных оболочек микробов, антибиотики, витамины, нуклеиновые кислоты. [c.361] Проведенные в ряде стран исследования показали и существенные различия в качестве используемых ЛС. Например, в больницах США пациенты получают в 2 раза больще медикаментов, чем необходимо. В скандинавских странах наблюдаются аналогичные расхождения в назначении антигипертензивных средств, которые не могут быть объяснены различиями в заболеваемости, в подготовке или информированности врачей. В США более 60% госпитализированных больных получают ненужные им антибиотики, а в 20 - 40% сл)Д1аев назначаемые препараты вообще не соответствуют диагнозу. Выборочный анализ 500 назначений во Франции показал, что в 36% случаев имелись отклонения в дозировке, в 31%> несколько лекарственные средства содержали один и тот же активный компонент, в 23% прописывались противодействующие препараты (например стимулирующие и седативные), а 41% назначений вообще представлял потенциальную опасность для больных. Такая же проблема существует и в Испании. [c.98] Принципиально иной подход к ретросинтетическому анализу антибиотика 83 бьш развит Келли и Гхошалом [ПЬ]. Целостное рассмотрение циклической системы 83 позволило им обнаружить близкое соответствие между картинами замещения в циклах АВС целевой молекулы, с одной стороны, и в [c.320] Многие виды микроорганизмов выделяют вещества, которые Офаничивают рост микроорганизмов других видов или убивают их. Эти вешества, названные антибиотиками, могут быть также продуктами жизнедеятельности высших растений и животных и являются как бы химическими средствами зашиты. К настоящему времени известно более 10 тысяч природных и синтетических антибиотиков и уже более ста из них применяют в медицине, а также в сельском хозяйстве для защиты растений и животных от болезней. Их общее производство во всем мире превышает 50 тыс т в год. Большинство антибиотиков имеет весьма сложную структуру. Их история начинается с первого наблюдения гибели стафилококковых бактерий при контакте с зеленой плесенью Peni illium (1929 г ) и последующего выделения из нее действующего начала - пенициллина (1940 г.). Во время второй мировой войны пенициллин использовался в больших масштабах, хотя его строение было установлено лишь в 1945 г. с помощью рентгеноструктурного анализа Для ученых казалось невероятным, что этот антибиотик содержал четырехчленный р-лактамный цикл, так как в то время считали, что азетидиновые циклы чрезвычайно неустойчивы. Оказалось, однако, что именно этот гетероцикл является ответственным за антибиотическое действие не только пенициллина, но и целого ряда других, открытых много позднее групп природных и полу-синтетических антибиотиков [c.79] Строение эритромицина изучено на основании данных функционального анализа и продуктов гидролиза при этом доказано наличие в нем метоксильной, двух N-метильных и восьми С-метильных групп. По ИК-спектру антибиотик содержит две СО-группы, одна из которых входит в состав лактонной или сложноэфирной группировки. Вторая карбонильная группа [c.710] Переработанный и отредактированный справочник содержит сведения об основных физико-химических свойствах, методах синтеза и анализа, а также применении и лекарственных формах 170 сиитетически.х лекарственных средств. Основное внимание уделено оригинальным отечественным препаратам и лекарственным средствам, получаемым с применением новых и оригинальных синтетических методов. В справочник не попали общеизвестные препараты и методы, новые лекарственные средства, иа которые в момент подготовки справочника к печати отсутствовала необходимая документация или оформлялось патентование, а также биопрепараты, антибиотики, витамины, продукты фитохимии и неорганические соединения. [c.3] Для оптимального разделения некоторых аминокислот, плохо отделяющихся друг от друга в перечисленных системах, используют п другие растворители, которые приведены в соответствующих руководствах (см., например Хроматография на бумаге//Под ред. И. Хайса и К. Мацека. М., 1962). Так, для отделения валина от фенилаланина (проблема, возникающая при анализе антибиотика грамицидина С. состоящего всего из пяти разных аминокислот) можно рекомендовать последовательное пропускание двух растворителей систему 2-бута-нол — 3%-ный аммиак (3 1), а затем систему н-бутанол — уксусная кислота — вода (8 3 1). [c.129] И. X. применяется для разделения катионов металлов, напр, смесей лантаноидов и актиноидов, 2г и НГ, Мо и W, КЬ и Та последние разделяют на анионитах в виде анионных хлоридных комплексов в р-рах соляной и плавиковой к-т. Щелочные металлы разделяют на катионитах в водных и водно-орг. средах, щел.-зем. и редкоземельные металлы-на катионитах в присут. комплексонов. Большое значение имеет автоматич. анализ смесей прир. аминокислот на тонкодисперсном сульфокатионите.в цитратном буфере при повыш. т-ре. Аминокислоты детектируют фотометрически после их р-ции с нингидрином или флюориметрически после дериватизации фталевым альдегидом. Высокоэффективная И. X. (колонки, упакованные сорбентом с размером зерен 5-10 мкм, давление для прокачивания элюента до 10 Па) смесей нуклеотидов, нуклеозидов, пуриновых и пиримидиновых оснований и их метаболитов в биол. жидкостях (плазма крови, моча, лимфа и др.) используется для диагностики заболеваний. Белки и нуклеиновые к-ты разделяют с помощью И. X. на гидрофильных высокопроницаемых ионитах на основе целлюлозы, декстранов, синтетич. полимеров, широкопористых силикагелей гидрофильность матрицы ионита уменьшает неспецифич. взаимод. биополимера с сорбентом. В препаративных масштабах И. х. используют для вьщеления индивидуальных РЗЭ, алкалоидов, антибиотиков, ферментов, для переработки продуктов ядерных превращений. [c.264] Антибиотики этой группы широко распространены в природе, они продуцируются различными видами акти-номицетов, бактерий, грибов и весьма разнообразны по своему химическому строению — столь разнообразны, что их химическая классификация становится размытой, т.е. можно выделить слишком много различных подгрупп. Поэтому мы ограничимся лишь анализом наиболее типичных структур, ярких примеров и тех структурных особенностей, которые являются достаточно обш,ими. [c.310] В завершении раздела об антибиотиках следует остановить внимание на антибиотиках, обладаюш,их противоопухолевой активностью (анти-неоплас-тики, цитостатики, цитотоксины). При анализе различных групп антибиотиков, проведенном выше, мы уже обращали внимание на те из них, которые проявляют указанное действие — антрациклины, саркомицин. Факт такого действия антибиотиков также любопытен сам по себе, поскольку название класса указывает на его активность в отношении инфекционных заболеваний, к которым раковые заболевания отнести никак нельзя. Но причина такого [c.324] Хро.матографические Ж. а. Действие их основано на разл. сорбционной способности компонентов, входящих в состав анализируемой жидкости. Последняя фракционируется в зтих приборах, и затем разделенные компоненты детектируются посредством оптич., электро- и термохйм. и др. методов. Области применения анализ белков, антибиотиков, витаминов, углеводородов, спиртов, нуклеиновых к-т, нефти определение содержания металлов в жидких средах, бензола и толуола в сточных водах и т. д. (см. также, напр.. Жидкостная хроматография, Тонкослойная хроматография, Эксклюзионная хроматография). [c.151] В последующих главах рассматриваются результаты конформацион-1 0го анализа большой серии природных олигопептидов. Их пространст- енное строение практически полностью определяется взаимодействиями ежду близко расположенными в цепи остатками, и поэтому они представляют собой естественные объекты исследования средних взаимодействий. Здесь нельзя было ограничиться анализом единичных примеров в силу по крайней мере двух обстоятельств. Во-первых, изучение конформационных возможностей природных олигопептидов является, как станет ярно позднее, самым ответственным и сложным, но в то же время 1 иболее интересным этапом на пути к априорному расчету трехмерных структур белков. Очевидно, понимание пространственного строения и механизма спонтанной, быстрой и безошибочной укладки белковой последовательности в нативную конформацию невозможно без установления инципов пространственной организации эволюционно отобранных низко- лекулярных пептидов. Между природными олиго- и полипептидами нет четко очерченных границ, и количественная конформационная теория лее простых молекул является естественной составной частью конформационной теории более сложных соединений той же природы. Во-вторых, Й1ание пространственной организации и динамических конформационных свойств природных олигопептидов - гормонов, антибиотиков, токсинов и т.д. - необходимо -вакже для изучения молекулярных механизмов узнавания, действия и регуляции биосистем, выявления структурно-функциональных особенностей пептидов и белков. [c.233] Применение. Процессы И. о. используют в аналит. химии и в пром-сти. С помощью И. о. концентрируют следовые кол-ва определяемых в-в, определяют суммарное солесодер-жание р-ров, удаляют мещающие анализу ионы, количественно разделяют компоненты сложных смесей (см. Ионообменная хроматография). И.о. применяют для получения умягченной и обессоленной воды (см. Водоподготовка) в тепловой и атомной энергетике, в электронной пром-сти в цветной металлургии-при комплексной гидрометаллургич. переработке бедных руд цветных, редких и благородных металлов в пищ. пром-сти - в произ-ве сахара, при переработке гидролизатов в мед. пром-сти-при получении антибиотиков и др. лек. ср-в, а также во мн. отраслях пром-сти-для очистки сточных вод в целях организации оборотного водоснабжения и извлечения ценных компонентов, очистки воздуха. Разрабатываются ионообменные методы комплексного извлечения из океанской воды ценных микрокомпонентов. [c.262] Количественно Н. определяют с помощью биол. методов анализа, спектрофотометрии (в виде окрашенного соед., образующегося в присут. трихлорхинонимина) и бумажной хроматографии. Н.-антибиотик, применяется при лечении пневмонии, разл. инфекций тканей легких и нек-рых др. заболеваниях. [c.288] В первом случае хроматография может быть использована не только для качественного определения состава смесей, но и для количественного анализа. Особенно большое значение имеет адсорбционная хроматография при анализе газообразных углеводородов, нефтей, терпенов, каротинои-дов, стероидов, гликозидов, жирных кислот, сахаров, витаминов,, антибиотиков и т. д. [c.374] chem21.info |
г.Самара, ул. Димитрова 131 [email protected] |
 |