|
|
||||||||||
|
III. Антихеликобактерные препараты и основные схемы. Антихеликобактерные антибиотикиАнтихеликобактерные препараты | Лекарственный справочник | Здоровье | ||||||
| Действующее вещество: Висмута трикалия дицитрат | |||||||
| Де-Нол(Астеллас)Новобисмол (Фармпроект) |
495,8–639,4 368,97–499 |
Обладает антибактериальным, противовоспалительным и вяжущим действием. Повышает устойчивость слизистой оболочки желудка и кишечника к воздействию ферментов и соляной кислоты. При использовании возможны тошнота, рвота, учащение стула или запоры. Эти эффекты носят временный характер. Противопоказан при выраженном нарушении функции почек, беременности и кормлении грудью. | |||||
| Действующее вещество: Тетрациклин | |||||||
| Тетрациклин (разные производители) | 6–44 | Является антибиотиком широкого спектра действия. При использовании возможны тошнота, рвота, снижение аппетита, боли в животе, диарея, запор, сухость во рту, изменение цвета языка, временное нарушение функций печени с появлением отклонений в анализах. Противопоказан при печеночной недостаточности, понижении уровня лейкоцитов, микозах, детям до 8 лет, беременным и кормящим женщинам. | |||||
| Действующее вещество: Амоксициллин | |||||||
| Амоксициллин(разные производители)Амоксициллин ДС (Мекофар Кемикал- Фармасьютикал)Амосин(Синтез ОАО)Флемоксин Солютаб(Астеллас)Хиконцил (КРКА) |
10,72–20 9,8–14
18,7–38 105,7–232 41–69 |
Антибиотик широкого спектра действия. Нередко вызывает аллергические реакции и дисбактериоз. Противопоказан при аллергии на пенициллины. | |||||
| Действующее вещество: Левофлоксацин | |||||||
| Левофлоксацин(разные производители)Леволет(Доктор Реддис)Глево(Гленмарк)Лефокцин(Шрея)Таваник(Санофи-Авентис)Флексид(Лек д.д.)Флорацид (Валента)Хайлефлокс (Хайгланс Лабораториз)Эколевид(Авва Рус)Элефлокс(Ранбакси) |
176,1–344 100,9–267 163–215,5 190–663,2 310–415 366–511 203,1–575 270–393 100–362 130–551 |
Антибиотик широкого спектра действия. В схемах антихеликобактерной терапии обычно используется как «препарат резерва», в тех случаях, если человек не переносит другие антибиотики или предыдущее лечение хеликобактерной инфекции оказалось неэффективным. При приеме возможны тошнота, рвота, диарея, снижение аппетита, боль в животе, снижение артериального давления, головокружение, слабость, сонливость и другие побочные эффекты. В течение курса лечения препаратом нельзя загорать (в том числе в солярии). Противопоказан при эпилепсии, беременности, кормлении грудью и детям до 18 лет. | |||||
| Действующее вещество: Кларитромицин | |||||||
| Кларитромицин(разные производители)Клабакс(Ранбакси)Клабакс ОД(Ранбакси)Клацид(Эббот)Клацид СР(Эббот)Фромилид(КРКА)Фромилид Уно(КРКА)Экозитрин(Авва Рус) |
99,6–144,5 208–290 180–245,43 344–414,5 428–557 497–683,44 174,3–275 275–387,7 |
Антибиотик широкого спектра действия из группы макролидов. Может вызывать тошноту, боли в животе, рвоту и диарею. Иногда возможны нарушения функции печени и другие побочные эффекты. Противопоказан при тяжелых нарушениях функции печени или почек. Может вступать в реакции лекарственного взаимодействия с другими препаратами. Поэтому тем, кто постоянно принимает лекарства, надо озвучить их полный перечень лечащему врачу, назначающему кларитромицин. | |||||
| Действующее вещество: Метронидазол | |||||||
| Клион(Гедеон Рихтер)Метронидазол (разные производители) |
51,22–74,5 3–8 |
Антибактериальный препарат. Часто вызывает тошноту, ухудшение аппетита, «металлический» привкус во рту. Возможны также рвота, кишечная колика, запоры, сухость во рту, воспаление языка, стоматит, головокружение, нарушение координации движений, слабость, бессонница, головная боль и другие побочные эффекты. Во время приема категорически запрещено употребление спиртных напитков. Противопоказан при пониженном уровне лейкоцитов, почечной и печеночной недостаточности, эпилепсии, в I триместре беременности и при кормлении грудью. | |||||
| Этапы лечения | Средства лечения | Критерии самоконтроля |
| ЯБ желудка, 12-п. кишки: а) впервые выявленная неосложненная; б) хроническая, неосложненная стадия ремиссии или обострения (в т.ч. после неадекватной терапии) | -Эрадикация Н.р. ("тройная схема") на 7 дней -Продолжить прием анти-секреторных средств: 5 недель при ЯБ 12 п-кишки; 7 недель при ЯБ желудка -Прием симптоматических средств -Планирование и проведение профилактической терапии: а) терапия "по требованию" б) непрерывная поддерживающая терапия | 1. Ремиссия полная клинико- эндоскопическая ч/з 4 недели (ЯБ 12-п кишки), ч/з 8 недель при ЯБ желудка; Н.р.- 2. Ремиссия неполная (активный гастродуоденит ч/з 4 или 8 недель; Н.р.+ ) 3. Ремиссии нет (только улучшение самочувствия) |
| ЯБ желудка, 12-п. кишки: а) неэффективность преды-дущей "тройной схемы" б) большие размеры язвы, угроза кровотечения | -Эрадикация Н.р. ("квадро-терапия") на 7 дней -Н 2-гистаминоблокаторы в/венно -Продолжить прием анти-секреторных средств, цитопротекторов -Прием симптоматических средств -Планирование и проведение профилактической терапии: а) терапия "по требованию" б) непрерывная поддерживающая терапия | 1. Ремиссия полная клинико- эндоскопическая ч/з 4 недели (ЯБ 12-п кишки), ч/з 8 недель при ЯБ желудка; Н.р.- 2. Ремиссия неполная (активный гастродуоденит ч/з 4 или 8 недель; Н.р.+ ) 3. Ремиссии нет (только улучшение самочувствия) а) повторная ФГДС (уточнить диагноз: малигнизация? каллезная язва? б) определить показания к хирургическому лечению |
Фармакотерапия при заболеваниях печени
«Базисной» терапией при поражении печени является насыщение ее глюкозой (+ препараты калия, витамины) для достаточного образования гликогена.
К мембранопротекторам (хотя эффективность этих препаратов многими берется под сомнение) относят эссенциале, силимарин (карсил, гепабене, силибор и т.д.), цианиданол.
Эссенциале назначают при жировых гепатозах, циррозе печени алкогольной этиологии, токсических гепатитах, а также при псориазе, токсикозах беременности, заболеваниях почек.
Адеметионин (гептрал) – производное метионина. Участвует в синтезе фосфолипидов, глютатиона (антиоксидант) и полиаминов (пролиферация гепатоцитов и регенерация печени). Обладает антидепрессивным действием.
studfiles.net
III. Антихеликобактерные препараты и основные схемы
эрадикации
Helicobaсter pylory – это Гр(-) микроорганизмы, паразитирующие преимущественно в антральном отделе желудка.
Для устранения микробного фактора наиболее эффективны следующие препараты:
Антибиотики - кларитромицин, амоксициллин, доксициклин, тетрациклин
Синтетические противомикробные средства – метронидазол (трихопол), тинидазол
Ингибиторы протонной помпы – омепразол и др.
Гастропротектор - де-нол
Эти препараты применяются в различных комбинациях, включающие 3 или 4(квадритерапия) препарата.
Основные схемы, принятые Маастрихским соглашением и включенные в Российские рекомендации
Тройная терапия (трехчастная)
Омепразол 20 мг 2 раза в день
Кларитромицин 500 мг 2 раза в день
Амоксициллин 1000м г 2 раза в день
В случае отсутствия успеха в лечении, назначается 4-х частная терапия -
Квадротерапия (четырехчастная)
Омепразол 20 мг 2 раза в день
Тетрациклин 500 мг 4 раза в день
Метронидазол 500мг 3 раза в день
Де-нол 120 мг 4 раза в день
Данные схемы обычно применяют вместе с лекарственными средствами, снижающими кислотность желудочного сока, т.к. гиперацидные состояния в желудке способствуют размножению Helicobaсter pylory.
IV. Гастропротективные средства
К гастропротективным средствам относятся различные препараты, которые усиливают защитные свойства слизистой оболочки и непосредственно защищают ее в области эрозии или изъязвления.
Де-нол
Механизм действия и фармакологические эффекты
Препарат является коллоидным висмутом субцитратом, который в кислой среде образует комплекс с протеином. Этот комплекс обладает способностью концентрироваться в области эрозированных и изъязвленных участков, т.о. образуется защитный барьер, способствующий быстрому заживлению язвы.
Кроме того, де-нол обладает бактериостатическим действием в отношении Helicobaсter pylory т.к. оказывает повреждающее действие на клеточную стенку Helicobakter pylory, а также нарушает способность бактерии связываться с эпителием желудка.
Фармакокинетика
Де-нол назначают внутрь в виде таблеток 4 раза в сутки (3 раза за 30 минут до еды и 1 раз через 2 часа после последнего приема пищи). Биодоступность низкая, 95% выводится с калом, 5% почками. Препарат эффективен только в кислой среде. Поэтому нельзя назначать антациды в течение 30 мин до и после его приема.
Показания к назначению
1. Язвенная болезнь
2. Гиперацидный гастрит связанный с колонизацией Helicobakter pylory
Побочные эффекты
1. Диспепсические расстройства (тошнота, рвота, диарея)
2. Окрашивание языка, стула в черный цвет (за счет висмута
сульфида)
3. Головная боль, головокружение
4. Гиперчувствительность редко
5. При длительном применении может развиться энцефалопатия
Противопоказания
1. ХПН
Сукральфат (вентер)
Механизм действия и фармакологические эффекты
Препарат является алюминиевой солью сульфированных дисахаридов. Препарат полимеризуется в кислой среде желудка, образуется вязкий пастообразный полимер. Он способен формировать защитный барьер в области эрозированных и изъязвленных участков, препятствующий повреждающему действию соляной кислоты и пепсина, что способствует заживлению язв и эрозий.
Фармакокинетика
Препарат назначают внутрь в виде таблеток 4 раза в сутки (3 раза за 30 минут до еды и 1 раз через 2 часа после последнего приема пищи). Таблетки проглатывают целиком, не разжевывая, запивают небольшим количеством воды. Биодоступность очень низкая, выводится с калом.
Показания к назначению
1. Язвенная болезнь
2. Эрозивные гастриты, дуодениты
Побочные эффекты
1. Диспепсические расстройства (тошнота, дискомфорт в
эпигастрии)
2. Расстройство функции кишечника (чаще обстипация)
3. Сухость во рту
4. Гиперчувствительность (редко)
Противопоказания
1.Беременность 1 триместр
2.Кормление грудью
3. Дети до 4 лет
4. ХПН
studfiles.net
Новые возможности адъювантной антихеликобактерной терапии | #03/15
Несмотря на то, что Helicobacter pylori (H. pylori) был обнаружен более 30 лет назад и что за определение взаимосвязи данного возбудителя с рядом заболеваний желудочно-кишечного тракта (ЖКТ) австралийцам Маршаллу и Уоррену была присуждена Нобелевская премия по физиологии и медицине, инфекция, вызванная H. pylori (Нр-инфекция), по-прежнему остается сложной проблемой для многих исследователей и врачей, особенно когда речь идет о ее лечении. Нр-инфекция имеет глобальное значение. Профессор D. Graham называет ее наиболее частой инфекцией человека [1]. Примерно 60% населения земного шара инфицировано H. pylori [2]. В настоящее время имеются однозначные научные доказательства связи Нp-инфекции с хроническим гастритом, язвенной болезнью желудка и двенадцатиперстной кишки, злокачественными опухолями желудка — аденокарциномой и экстранодальной В-клеточной лимфомой. Развитие и рецидивирование язвы желудка и двенадцатиперстной кишки в 99,9% случаев и хронического гастрита в 75–85% случаев связаны с Hp-инфекцией [3–5]. Эрадикация H. pylori предотвращает осложнения и рецидивы язвенной болезни и является экономически эффективным методом выбора по сравнению с длительной кислотоподавляющей терапией.
Современные стандартные методы эрадикации H. pylori основаны на использовании ингибитора протонной помпы (ИПП) плюс два или более антибиотиков в течение одной-двух недель [6], схемы лечения подбираются индивидуально и зависят от многих факторов [7–9]. Эффективность лечения в последние годы снизилась до 80% [10, 11], в основном за счет увеличения резистентности к антибиотикам, а также нежелательных лекарственных реакций (НЛР), таких как тошнота, рвота, диарея, запор, лихорадка, головная боль [12]. Эти проблемы могут привести к ухудшению качества жизни пациентов и самостоятельному прекращению лечения.
Альтернативным подходом к преодолению существующих проблем с антибактериальной терапией может быть вакцинация. Было опубликовано большое количество доклинических исследований по эффективности «вакцин-кандидатов» против H. pylori, которые имели ограниченное количество клинических испытаний [13]. К сожалению, в ходе испытаний необходимой эффективности этих вакцин не удалось выявить. Поэтому в настоящее время не существует лицензированных антихеликобактерных вакцин.
В настоящее время усиливается интерес к альтернативной терапии (например, нацеленной на уреазу как на известный фактор вирулентности) или адъювантной антихеликобактерной терапии [14], направленной на уменьшение эффектов, связанных с употреблением антибиотиков. Для этих целей в качестве «возможных» инструментов были предложены пробиотики [15]. На сегодняшний день проведено значительное количество исследований по их возможной роли в лечении и профилактике Нр-инфекции [16].
Пробиотики включают в себя ряд микроорганизмов и их метаболитов, в основном различных видов Lactobacillus или Bifidobacterium, которые при приеме внутрь в определенных количествах оказывают определенную пользу для здоровья человека [17, 18]. Благотворное влияние пробиотиков на желудочно-кишечные заболевания, в том числе на профилактику и лечение антибиотик-ассоциированной диареи (ААД), многократно описаны в различных работах [19, 21–24].
Многочисленные исследования in vitro продемонстрировали бактерицидные или бактериостатические эффекты пробиотиков в отношении H. pylori, которые позже были изучены в доклинических и клинических исследованиях [25]. Эти исследования показали некоторую эффективность антихеликобактерной активности пробиотиков в монотерапии и увеличение эффективности и/или уменьшение НЛР при их включении в стандартную эрадикационную терапию [26, 27].
Возможные механизмы эффективности пробиотиков по уменьшению НЛР и/или улучшению эффективности антихеликобактерной терапии
ААД является наиболее распространенным НЛР эрадикационной терапии H. pylori. Антибиотики, изменяя микрофлору кишечника, вызывают диарею, что приводит к распространению устойчивых штаммов бактерий и к усилению бродильных процессов патогенными и условно-патогенными бактериями [22]. Некоторые авторы уже продемонстрировали значительное снижение возникновения ААД, а также острой диареи с помощью пробиотических средств [21, 24]. Пробиотики могут стимулировать усиление иммунных механизмов слизистой оболочки кишечника, например, активировать локальные макрофаги и модулировать профили цитокинов. Введение пробиотиков при Нр-инфекции у детей восстанавливает нормальное соотношение Bifidobacterium spp./Е. coli, увеличивает сывороточный IgA, а также уменьшает сывороточный интерлейкин-6 (ИЛ-6) [28]. Пробиотический эффект может осуществляться не только через иммунные механизмы, но и через антагонизм и конкуренцию с потенциальными патогенами. В частности, пробиотики способны синтезировать антиоксиданты и противомикробные вещества, изменять значения рН, стимулировать выработку муцина, повышать барьерные функции кишечника, уменьшать выработку токсинов патогенной микрофлорой, влиять на колонизацию, конкурируя с патогенными микроорганизмами за питательные вещества и привязке к клетке-хозяину на поверхности кишечного эпителия [24, 29]. Наконец, микрофлора, через дугу «кишка — мозг», предположительно вовлечена в патофизиологию формирования депрессивных и тревожных расстройств, а также играет возможную роль в модуляции абдоминальных болей [23, 30]. Все эти эффекты пробиотиков были предложены для повышения эффективности эрадикационной антихеликобактерной терапии [31, 32].
Вырабатываемая H. pylori уреаза катализирует превращение мочевины до диоксида углерода и аммиака, а аммиак, в свою очередь, образует гидроксид аммония, который нейтрализует локальную кислотность в пользу выживания H. pylori. Ряд исследований сообщили о возможности Lactobacillus сasei ингибировать вырабатываемую H. pylori уреазу [33], этот эффект может быть связан с повышением активности молочной и других органических кислот, производимых этими бактериями [29, 34].
J. B. Ewaschuk и соавт. определили, что B. infantis формируют более плотные соединения с эпителием, что имеет особое значение в лечении воспалительных заболеваний кишечника, таких как болезнь Крона или язвенный колит. Кроме того, он может участвовать в эпителиальной защите слизистой оболочки желудка и уменьшать повреждение H. pylori слизистой оболочки и последующее воспаление. Кроме того, B. infantis в сочетании с антибиотиками в терапии H. pylori-инфекции более эффективен [35].
A. I. Dajani и соавт. выявили альтернативу стандартной тройной терапии для эрадикации H. pylori, эффективность которой значительно снизилась в последние годы до 68,9%, в сравнении с результатами десятилетней давности — 95%. Пробиотик, содержащий B. infantis, при добавлении в качестве адъюванта к тройной терапии в течение 2 недель одновременно или последовательно приводил к успешной эрадикации в 83–90,8% случаев (p < 0,001) [36].
Объединенные данные, полученные от исследований с участием более чем 1900 взрослых и детей, показали, что частота эрадикации составила 82,5% (95% ДИ: 80,1–84,7%) у пациентов с добавлением пробиотика, по сравнению с 73,7% (95% ДИ: 71–76,4%) у пациентов, получавших плацебо (ОР: 1,11; 95% ДИ: 1,07–1,17). Эти данные не представляют убедительных доказательств в поддержку использования пробиотиков в качестве адъюванта с целью повышения частоты эрадикации H. pylori. Тем не менее, необходимы дальнейшие исследования, чтобы выяснить их роль в данном вопросе [37].
Lactobacilli являются синантропными микроорганизмами в человеческом пищеварительном тракте, их концентрации в нормальном желудке человека варьирует от 0 до 103 колониеобразующих единиц/г (КОЕ) [38]. Подвергаясь воздействию кислоты, они сохраняются в желудке дольше, чем другие бактерии. О возможной роли местной микрофлоры в защите желудочного эпителия от хеликобактерных поражений можно судить по исследованию Elliott и соавт. [39], которые обнаружили, что уровень общего количества аэробов в желудке у здоровых крыс находится в диапазоне от 103 до 104 КОЕ/г. Они представлены автохтонной желудочной флорой Lactobacilli, а грамотрицательные микроорганизмы составляют лишь 5%. Тем не менее, на следующий день после индукции у этих крыс язв желудка, общее количество аэробов достигло 109–1010 КОЕ/г и оставалось высоким в течение 1 недели. При этом грамотрицательные бактерии стали доминирующими в общем количестве аэробов, а Lactobacilli исчезли совсем. Колонизация грамотрицательных бактерий происходила преимущественно на месте язвы. Эти результаты показывают, что гастродуоденальная микрофлора, хоть и в малом количестве, может представлять собой первую линию обороны против патогенных бактерий. Таким образом, потребление экзогенных молочнокислых бактерий, в частности, с пробиотическими свойствами, может усилить эти защитные функции в желудке, поддерживая местный микробиологический гомеостаз, препятствуя колонизации H. pylori и/или уменьшая воспалительные процессы [40, 41].
Некоторые штаммы Lactobacillus (L. gasseri и L. plantarum), по данным X. Chen и соавт., способны конкурентно подавлять рост H. pylori на эпителиальных клетках желудка [42]. Аналогичные результаты были описаны для некоторых штаммов Lactobacillus (в том числе L. acidophilus, L. johnsonii и L. salivarius, подвид salicinius), которые уменьшали адгезию H. pylori в желудке человека. Этот эффект был более значительным при использовании культуральной жидкости лактобактерий, а не самих бактериальных клеток L. salivarius для ингибирования увеличения ИЛ-8, вызванного адгезией H. pylori к клеткам аденокарциномы желудка (AGS). Применение L. johnsonii или L. salivarius у крыс, инфицированных H. pylori, показало снижение бактериальной нагрузки, местного синтеза ИЛ-8 и проявлений воспаления желудка [43]. Кроме того, культуральный супернатант L. johnsonii La1 уменьшает подвижность и колонизацию H. pylori в желудке человека [44]. У животных моделей длительное применение йогурта с добавлением пробиотиков (L. acidophilus, L. bulgaricus, B. lactis, S. thermophilus) приводит к снижению колонизации H. pylori, снижает уровень ФНО-α, уменьшает воспаление желудка и уровень кишечной метаплазии, по сравнению с инфицированными сородичами, не получающими пробиотики [45].
Уменьшение воспаления слизистой желудка у инфицированных H. pylori больных после применения пробиотиков было продемонстрировано Pantoflikova и соавт., как непосредственно на желудочных биоптатах, так и косвенно по снижению сывороточного гастрина-17 (L. jonhsonii LJ1, L. rhamnosus GG, L. rhamnosus LC705, Propionibacterium freudenreichii JS, Bifidobacterium lactis BB12) [46, 47].
Дальнейшие исследования показали, что L. acidophilus может ингибировать активацию белка Smad7, что приводит к уменьшению воспалительных явлений [48].
В рандомизированном двойном слепом контролируемом исследовании, проведенном в Италии, при симптоматическом лечении детей с инфекцией H. pylori применяли штамм L. reuteri АТСС55730 или плацебо в течение 20 дней. Для оценки тяжести и частоты симптомов была использована шкала оценки тяжести симптомов со стороны ЖКТ (Gastrointestinal Symptom Rating Scale, GSRS), которая включает опросник по следующим симптомам: боль в животе, кислая отрыжка, изжога, ощущение подсасывания в эпигастрии, тошнота, рвота, вздутие живота, повышенное газообразование, нарушения дефекации, отсутствие аппетита, неприятный запах изо рта, нарушение вкуса и крапивница. Интенсивность проявления симптоматики регистрировалась по четырем уровням: слабые (не мешают повседневной деятельности), умеренные (немного мешают повседневной деятельности), тяжелые (мешают повседневной деятельности), очень тяжелые (непрерывные, приводящие к прерыванию лечения). Данные получали до (за 1 неделю до вмешательства), в течение (5-й и 10-й день) и после завершения терапии (15-й и 20-й день). Статистически значимых различий между исследуемой и контрольной группами в эрадикации H. pylori не было обнаружено. Тем не менее, у всех детей, получающих пробиотики, по сравнению с теми, кто получал плацебо, было значительное снижение баллов по шкале GSRS за время эрадикационной терапии, которые уменьшались к концу периода наблюдения. Дети, получавшие L. reuteri, отмечали меньше НЛР эрадикационного лечения, чем те, кто получал плацебо [49].
Целью проведенного китайскими учеными метаанализа было оценить влияние добавления лактобактерий в стандартные режимы эрадикации H. pylori на частоту достижения эрадикации H. pylori и частоту возникновения НЛР на фоне антихеликобактериального лечения. В метаанализ включались исследования, в которых сравнивалось добавление лактобактерий или плацебо к стандартным режимам эрадикации H. pylori. Было идентифицировано 8 рандомизированных исследований с общим числом пациентов 1372. При проведении анализа у всех пациентов, подлежащих лечению, объединенная частота эрадикации H. pylori составила 82,26% (95% ДИ 78,01–86,51%) и 76,97% (95% ДИ 73,11–80,83%) в группе применения лактобактерий и плацебо соответственно, а отношение шансов составило 1,78 (95% ДИ 1,21–2,62). Общая частота нежелательных явлений между сравниваемыми группами не отличалась и составила 30,84% (95% ДИ 24,82–36,86%) на фоне добавления пробиотиков к эрадикационной терапии и 42,24% (95% ДИ 35,89–48,59%) при использовании плацебо, при этом отношение шансов было равно 0,49 (95% ДИ 0,24–1,02). В то же время на фоне применения лактобактерий отмечалась меньшая частота возникновения диареи, вздутия живота и нарушений вкуса. Таким образом, результаты данного метаанализа продемонстрировали, что добавление лактобактерий к стандартной схеме эрадикации H. pylori может способствовать увеличению частоты эрадикации у пациентов, лечение которым проводится впервые, а также оказывать положительное влияние на некоторые НЛР, возникающие на фоне эрадикационной терапии [50].
Недавний метаанализ 14 рандомизированных исследований показал, что добавление в антихеликобактерные схемы антибиотикотерапии определенных пробиотиков может быть эффективным в повышении процента эрадикации и полезным для пациентов с недостигнутой эрадикацией H. pylori [51].
M. P. Dore и соавт. изучили эффективность L. reuteri в эрадикационной терапии H. pylori. Хеликобактерная инфекция диагностировалась с помощью гистологического и С13 уреазного дыхательного тестов (С13УДТ). Пациентам назначали штамм L. reuteri DSM 17938 108 КОЕ с пантопразолом 20 мг два раза в день в течение 8 недель. Контроль эрадикации проводился через 4–6 недель после терапии. Комбинация L. reuteri с пантопразолом была эффективна у 13,6–14,2% в зависимости от метода диагностики. Также оценивали активность уреазы до и через 4–6 недели после терапии, в итоге отмечалось значительное снижение данного показателя от 38,8% до 25,4‰ (p = 0,002). Таким образом, L. reuteri может иметь потенциальную роль в эрадикации H. pylori [52].
R. Francavilla и соавт. в проспективном двойном слепом рандомизированном плацебо-контролируемом исследовании с участием 100 H. pylori+-пациентов (3-я фаза) кроме стандартной тройной терапии получали дополнительно L. reuteri 2 × 108 КОЕ или плацебо. Всем пациентам назначалось: C13УДТ, определение уровня гастрина-17 (G17) в сыворотке крови, фиброгастродуоденоскопия (ФГДС) по шкале GSRS. Эффективность эрацикации оценивалась с помощью C13УДТ через 8 недель после завершения терапии. Показатели C13УДТ в группе с L. reuteri снизились на 13% по сравнению с повышением на 4% в группе плацебо (–13,2 ± 34% против 4,3 ± 27%; p < 0,03). Результаты тестирования по опроснику GSRS были намного хуже в группе плацебо по сравнению с группой, получавшей L. reuteri (6,8 ± 2,9 против 4 ± 3,1; р < 0,01). Значительно реже регистрировались НЛР у пациентов, получавших L. reuteri, по сравнению с группой плацебо (40,9% против 62,8%, р < 0,04). У больных, получавших плацебо, G17 был выше, по сравнению с группой, получавшей L. reuteri (28% против 12%; р < 0,02). Уровень эрадикации составил 75% в группе с L. reuteri и 65,9% в группе плацебо (разница 9,1%, отношение шансов: 1,5). L. reuteri способны оказывать ингибирующее действие на рост H. pylori, а при сочетании с антибиотиками эрадикационной схемы они значительно снижают антибиотик-ассоциированные НЛР. Кроме того, H. pylori, снижая уровень сывороточного G17, повышают скорость эрадикации H. pylori [53].
Еще в одном исследовании 2014 г. M. H. Emara и соавт. назначали пациентам H. pylori+ стандартную тройную терапию (Омепразол 20 мг + Амоксициллин 1000 мг + Кларитромицин 500 мг два раза в день) в течение 2 недель и L. reuteri (смесь штаммов H. pylori DSM 17938 и L. reuteri АТСС РТА 6475) или плацебо в течение 4 недель. Всем пациентам предлагали заполнить опросник GSRS, определяли H. pylori-антиген в кале, проводили ФГДС с биопсией для быстрого уреазного теста и гистологического исследования биоптатов до начала лечения и через 4 недели после лечения. Частота эрадикации хеликобактерной инфекции была 74,3% и 65,7% соответственно в группах, получавших L. reuteri и плацебо. Таким образом, выявлена значительная разница в отношении зарегистрированных НЛР, пациенты, получавшие L. reuteri, реже отмечали диарею и вкусовые расстройства, чем те, кто получал плацебо. Большая разница отмечалась по результатам шкалы GSRS — у пациентов, получавших L. reuteri, улучшилась желудочно-кишечная симптоматика, по сравнению с пациентами, принимающими плацебо. Тройная терапия H. pylori с добавлением L. reuteri приводила к увеличению скорости эрадикации на 8,6%, улучшению качества жизни по шкале GSRS, реже отмечались НЛР и улучшились гистологические признаки инфекции H. pylori по сравнению с добавлением плацебо [54].
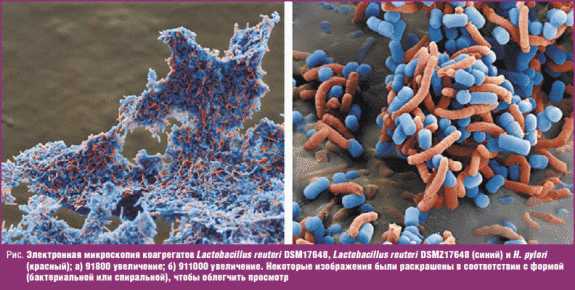
Основываясь на предыдущих исследованиях, микробиологи из Organobalance GmbH (Германия) создали оригинальный штамм Lactobacillus reuteri DSMZ17648, а затем было начато его производство в концерне Lonza Group Ltd. (Швейцария) под названием Pylopass™. Данный штамм бактерий, имеющий статус GRAS (Generally Recognized As Safe — абсолютно безопасный), одобрен Управлением по надзору за качеством пищевых продуктов и лекарственных средств США (Food and Drug Administration, FDA). Технология производства этого штамма принципиально отличается от производства других пробиотиков — вместо лиофильной сушки используется сушка путем распыления лактобацилл, затем они подвергаются ферментации и инактивации, после которых выдерживают изменения условий окружающей среды, в том числе низкие рН, и остаются высокостабильными при хранении. Данный кислотоустойчивый штамм специально «обучен» распознавать поверхностные рецепторы H. pylori и прикрепляться к ним, создавая так называемые ко-агрегаты, которые затем естественным путем выводятся из организма. Pylopass коагрегирует с H. pylori (рис.), позволяет уменьшить общую бактериальную обсемененность желудка, что снижает риск развития гастрита и язвы желудка и двенадцатиперстной кишки. Pylopass связывается исключительно с H. pylori и не влияет на другую микрофлору пищеварительного тракта.
H. Mehling и соавт. провели пилотное слепое, плацебо-контролируемое исследование с участием 22 H. pylori+-пациентов, у которых не было гастроинтестинальных симптомов, но они имели положительный результат С13УДТ выше порога 12‰, что указывало на умеренно высокую колонизацию H. pylori. Уровень обсеменения H. pylori в динамике определялся с помощью С13УДТ после 14 дней приема препарата, а также через 6, 12 и 24 недели после окончания приема препарата. Всем пациентам назначались Lactobacillus reuteri DSMZ17648 Pylopass в суточной дозе 2 × 1010 КОЕ, контрольную группу составили H. pylori+-волонтеры, которые получали плацебо. В опытной группе наблюдалось значительное снижение концентрации H. pylori (р < 0,05). У пациентов не было отмечено никаких НЛР в течение 14 дней приема плацебо или L. reuteri DSMZ17648 Pylopass. Впервые клетки L. reuteri DSMZ17648 Pylopass, приготовленные по инновационной технологии, были использованы в исследовании с людьми (in vivo), а полученные данные согласуются с результатами исследования данного продукта in vitro. Результаты данного исследования подтверждают потенциал Pylopass в качестве нового способа снижения нагрузки H. pylori [55].
C. Holz и соавт. закончили в декабре 2014 г. углубленное пилотное плацебо-контролируемое исследование L. reuteri DSMZ17648 Pylopass, который был использован для оценки влияния на H. pylori бессимптомные H. pylori+ испытуемых. В исследование были включены 128 волонтеров (47 пар близнецов и 34 одиночек), которые имели положительный С13УДТ. Назначение плацебо не привело к сильному изменению С13УДТ (Dplacebo –0,6 ± 5,3), в то время как прием L. reuteri DSMZ17648 Pylopass привел к выраженному снижению показателей С13УДТ (Dverum –4,9 ± 7,8, р = 0,026 по сравнению с плацебо), что показало значительное уменьшение колонии H. pylori в желудке. С увеличением уровня колонизации эффект уменьшения КОЕ H. pylori, вызванный приемом L. reuteri DSMZ17648 Pylopass, оказывался сильнее. Этот эффект снижения количества H. pylori продолжался и по окончанию лечения. Потенциальный эффект плацебо был значительно ниже, чем действие L. reuteri DSMZ17648 Pylopass. В ходе исследования не было зарегистрировано каких-либо изменений в качестве жизни, например, в физической деятельности, питании или здоровье, о которых обследуемые сообщали в анкете. Никаких НЛР не было отмечено ни в одной группе исследования [56].
С конца 2014 г. в России появился препарат L. reuteri DSMZ17648 Pylopass под коммерческим названием Хелинорм в капсулах по 200 мг. Один грамм этого препарата содержит около 1 трлн специально обработанных микробных клеток. Продолжительность курса Хелинорма составляет 4 недели. В день достаточно принимать всего 1 капсулу, которую рекомендуется проглатывать, не вскрывая, во время еды, запивая небольшим количеством воды. Благодаря высокой безопасности Хелинорм может назначаться детям старше 6 лет. Препарат можно назначать в виде монотерапии или в комплексной схеме антихеликобактерного лечения для повышения его эффективности, особенно сегодня, когда резко растет резистентнось к применяемым в этой схеме антибиотикам.
Заключение
Пробиотики, как правило, считаются безопасными агентами для применения, а ряд штаммов уже получили признание для использования при различных заболеваниях. Введение безопасных пробиотиков в качестве адъюванта антихеликобактерной терапии представляется весьма перспективным. Дальнейшие исследования механизмов прямых и косвенных эффектов влияния пробиотиков на H. pylori может помочь не только улучшить лечение, но также способствовать новому пониманию некоторых аспектов патогенеза «взаимоотношений» H. pylori с человеком. Новый препарат Хелинорм предлагает альтернативное лечение, не способствует увеличению резистентности H. pylori к антибиотикам и снижает уровень колонизации этого вредоносного агента.
Литература
- Graham D. Y., Malaty H. M., Evans D. J. et al. Epidemiology of Helicobacter pylori in an asymptomatic popylacion in the United states: effect of age, race, and socioeconomic status // Gastroenterology. 1991. 100. Р. 1495–1501.
- Cave D. R. How is Helicobacter pylori transmitted? // Gastroenterology. 1997. Vol. 113. Suppl. I. P. 48–51.
- Аруин Л. И., Исаков В. А. // Арх. пат. 1995. Т. 57, № 3. С. 75–76.
- Рекомендации по диагностике и лечению инфекции Helicobacter pylori у взрослых при язвенной болезни желудка и двенадцатиперстной кишки // Рос. журн. гастроэнтерол. гепатол. колопроктол. 1998. № 1. С. 105–107.
- Григорьев П. Я., Яковенко Э. П. Современные представления о пилорическом геликобактериозе // Практикующий врач. 1998. № 2 (13). С. 14–17.
- Malfertheiner P., Megraud F., O`Morian C. A., Atherton J., Axon A. T. R., Bazzoli F., Gensini G. F., Gisbert J. P., Graham D. Y., Rokkas T., El-Omar E. M., Kuipers E. J. European Helicobacter Pylori study group (Европейская группа по изучению Helicobacter Pylori, EHSG). Диагностика и лечение инфекции Helicobacter pylori — отчет о согласительной конференции Маастрихт IV. Флоренция // Вестник практического врача. Спецвыпуск. 2012. 1. С. 6–22.
- O’Connor A., Molina-Infante J., Gisbert J. P., O’Morain C. Treatment of Helicobacter pylori infection 2013 // Helicobacter. 2013. 18, Suppl 1. Р. 58–65.
- Couturier M. R., Marshall B. J., Goodman K. J., Mégraud F. Helicobacter pylori diagnostics and treatment: could a lack of universal consensus be the best consensus? // Clin Chem. 2014. 60. Р. 589–594.
- Ierardi E., Giorgio F., Losurdo G., Di Leo A., Principi M. How antibiotic resistances could change Helicobacter pylori treatment: A matter of geography? // World J Gastroenterol. 2013. 19. Р. 8168–8180.
- Graham D. Y., Lu H., Yamaoka Y. A report card to grade Helicobacter pylori therapy // Helicobacter. 2007. 12. Р. 275–278.
- Цуканов В. В., Амельчугова О. С., Буторин Н. Н. и др. Современные аспекты эрадикации Helicobacter pylori // Тер. архив. 2013. 2. С. 73–75.
- Yuan Y., Ford A. C., Khan K. J., Gisbert J. P., Forman D., Leontiadis G. I., Tse F., Calvet X., Fallone C., Fischbach L. et al. Optimum duration of regimens for Helicobacter pylori eradication // Cochrane Database Syst Rev. 2013. 12. CD008337.
- Del Giudice G., Malfertheiner P., Rappuoli R. Development of vaccines against Helicobacter pylori // Expert Rev Vaccines. 2009. 8. Р. 1037–1049.
- Raghavan S., Quiding-Järbrink M. Immune modulation by regulatory T cells in Helicobacter pylori-associated diseases // Endocr Metab Immune Disord Drug Targets. 2012. 12. Р. 71–85.
- D’Elios M. M., Andersen L. P. Helicobacter pylori inflammation, immunity, and vaccines // Helicobacter. 2007. 12, Suppl 1. Р. 15–19.
- Ruggiero P. Use of probiotics in the fight against Helicobacter pylori // World J Gastrointest Pathophysiol. 2014. Nov 15. 5 (4). Р. 384–391.
- Guarner F., Schaafsma G. J. Probiotics // Int J Food Microbiol. 1998. 39. Р. 237–238.
- FAO/WHO Expert Consultation. Health and Nutritional Properties of Probiotics in Food including Powder Milk with Live Lactic Acid Bacteria. Córdoba, Argentina 1–4 Oct. 2001. Available from: http://www.who.int/foodsafety/publications/fs_management/en/probiotics.pdf.
- Плотникова Е. Ю., Захарова Ю. В. Роль пробиотиков в профилактике и лечении антибиотик-ассоциированной диареи // Доказательная гастроэнтерология. 2013. № 4. Том 2. С. 51–57.
- Behnsen J., Deriu E., Sassone-Corsi M., Raffatellu M. Probiotics: properties, examples, and specific applications // Cold Spring Harb Perspect Med. 2013. 3. Р. a010074.
- Petschow B., Doré J., Hibberd P., Dinan T., Reid G., Blaser M., Cani P. D., Degnan F. H., Foster J., Gibson G. et al. Probiotics, prebiotics, and the host microbiome: the science of translation // Ann N Y Acad Sci. 2013. 1306. Р. 1–17.
- Sarowska J., Choroszy-Król I., Regulska-Ilow B., Frej-M?drzak M., Jama-Kmiecik A. The therapeutic effect of probiotic bacteria on gastrointestinal diseases // Adv Clin Exp Med. 2013. 22. Р. 759–766.
- Foligné B., Daniel C., Pot B. Probiotics from research to market: the possibilities, risks and challenges // Curr Opin Microbiol. 2013. 16. Р. 284–292.
- Guarner F., Khan A. G., Garisch J., Eliakim R., Gangl A., Thomson A., Krabshuis J., Lemair T., Kaufmann P., de Paula J. A. et al. World Gastroenterology Organisation Global Guidelines: probiotics and prebiotics // J Clin Gastroenterol. 2012. 46. Р. 468–481.
- Hamilton-Miller J. M. The role of probiotics in the treatment and prevention of Helicobacter pylori infection // Int J Antimicrob Agents. 2003. 22. Р. 360–366.
- Wilhelm S. M., Johnson J. L., Kale-Pradhan P. B. Treating bugs with bugs: the role of probiotics as adjunctive therapy for Helicobacter pylori // Ann Pharmacother. 2011. 45. Р. 960–966.
- Patel A., Shah N., Prajapati J. B. Clinical application of probiotics in the treatment of Helicobacter pylori infection — a brief review // J Microbiol Immunol Infect. 2014. 47. Р. 429–437.
- Yang Y. J., Sheu B. S. Probiotics-containing yogurts suppress Helicobacter pylori load and modify immune response and intestinal microbiota in the Helicobacter pylori-infected children // Helicobacter. 2012. 17. Р. 297–304.
- Ljungh A., Wadström T. Lactic acid bacteria as probiotics // Curr Issues Intest Microbiol. 2006. 7. Р. 73–89.
- Rousseaux C., Thuru X., Gelot A., Barnich N., Neut C., Dubuquoy L., Dubuquoy C., Merour E., Geboes K., Chamaillard M. et al. Lactobacillus acidophilus modulates intestinal pain and induces opioid and cannabinoid receptors // Nat Med. 2007. 13. Р. 35–37.
- Marteau P., Rambaud J. C. Potential of using lactic acid bacteria for therapy and immunomodulation in man // FEMS Microbiol Rev. 1993. 12. Р. 207–220.
- Vítor J. M, Vale F. F. Alternative therapies for Helicobacter pylori: probiotics and phytomedicine // FEMS Immunol Med Microbiol. 2011. 63. Р. 153–164.
- Aiba Y., Suzuki N., Kabir A. M., Takagi A., Koga Y. Lactic acid-mediated suppression of Helicobacter pylori by the oral administration of Lactobacillus salivarius as a probiotic in a gnotobiotic murine model // Am J Gastroenterol. 1998. 93. Р. 2097–2101.
- Lin W. H., Wu C. R., Fang T. J., Guo J. T., Huang S. Y., Lee M. S., Yang H. L. Anti-Helicobacter pylori activity of fermented milk with lactic acid bacteria // J Sci Food Agric. 2011. 91. Р. 1424–1431.
- Ewaschuk J. B., Diaz H., Meddings L., Diederichs B., Dmytrash A., Backer J. et al. Secreted bioactive factors from Bifidobacterium infantis enhance epithelial cell barrier function // Am J Physiol Gastrointest Liver Physiol. 2008. 295. Р. G1025–34.
- Dajani A. I., Adnan M. Abu Hammour, Yang D. H., Chung P. C., Nounou M. A., KaiTao Y. Yuan, Zakaria M. A., Schi H. S. Do Probiotics Improve Eradication Response to Helicobacter Pylori on Standard Triple or Sequential Therapy? // Saudi J Gastroenterol. 2013. May-Jun,19 (3). Р. 113–120.
- Lionetti E., Indrio F., Pavone L., Borrelli G., Cavallo L., Francavilla R. Role of Probiotics in Pediatric Patients with Helicobacter pylori Infection: A Comprehensive Review of the Literature // Helicobacter. April 2010. 15, Issue 2. Р. 79–87.
- Gotteland M., Brunser O., Cruchet S. Systematic review: are probiotics useful in controlling gastric colonization by Helicobacter pylori? // Aliment Pharmacol Ther. 2006. 23. Р. 1077–1086.
- Elliott S. N., Buret A., McKnight W., Miller M. J., Wallace J. L. Bacteria rapidly colonize and modulate healing of gastric ulcers in rats // Am J Physiol. 1998. 275. Р. G425-G432.
- Alsahli M., Michetti P. Lactobacilli for the management of Helicobacter pylori // Nutrition. 2001. 17. Р. 268–269.
- Pacifico L., Osborn J. F., Bonci E., Romaggioli S., Baldini R., Chiesa C. Probiotics for the treatment of Helicobacter pylori infection in children // World J Gastroenterol. 2014. Jan 21, 20 (3). Р. 673–683.
- Chen X., Liu X. M., Tian F., Zhang Q., Zhang H. P., Zhang H., Chen W. Antagonistic activities of lactobacilli against Helicobacter pylori growth and infection in human gastric epithelial cells // J Food Sci. 2012. 77. Р. M9–14.
- Hsieh P. S., Tsai Y. C., Chen Y. C., Teh S. F., Ou C. M., King V. A. Eradication of Helicobacter pylori infection by the probiotic strains Lactobacillus johnsonii MH-68 and L. salivarius ssp. salicinius AP-32 // Helicobacter. 2012. 17. Р. 466–477.
- Isobe H., Nishiyama A., Takano T., Higuchi W., Nakagawa S., Taneike I., Fukushima Y., Yamamoto T. Reduction of overall Helicobacter pylori colonization levels in the stomach of Mongolian gerbil by Lactobacillus johnsonii La1 (LC1) and its in vitro activities against H. pylori motility and adherence // Biosci Biotechnol Biochem. 2012. 76. Р. 850–852.
- Kuo C. H., Wang S. S., Lu C. Y., Hu H. M., Kuo F. C., Weng B. C., Wu C. C., Liu C. J., Tsai P. Y., Lee T. C. et al. Long-Term Use of Probiotic-Containing Yogurts Is a Safe Way to Prevent Helicobacter pylori: Based on a Mongolian Gerbil’s Model // Biochem Res Int. 2013. Р. 594561.
- Pantoflickova D., Corthesy-Theulaz I., Dorta G. et al. Favorable effect of long-term intake of fermented milk containing Lactobacillus johnsonii on Helicobacter pylori associated gastritis // Aliment Pharmacol Ther. 2003. 18. Р. 805–813.
- Myllyluoma E., Kajander K., Mikkola H. et al. Probiotic intervention decreases serum gastrin-17 in Helicobacter pylori infection // Dig Liver Dis. 2007. 39. Р. 516–523.
- Kim J. M., Kim J. S., Kim Y. J., Oh Y. K., Kim I. Y., Chee Y. J., Han J. S., Jung H. C. Conjugated linoleic acids produced by Lactobacillus dissociates IKK-gamma and Hsp90 complex in Helicobacter pylori-infected gastric epithelial cells // Lab Invest. 2008. 88. Р. 541–552.
- Lionetti E., Miniello V. L., Castellaneta S. P., Magistá A. M., de Canio A., Maurogiovanni G., Ierardi E., Cavallo L., Francavilla R. Lactobacillus reuteri therapy to reduce side-effects during anti-Helicobacter pylori treatment in children: a randomized placebo controlled trial // Aliment Pharmacol Ther. 2006. 24. Р. 1461–1468.
- Zou J., Dong J., Yu X. Meta-analysis: Lactobacillus containing quadruple therapy versus standard triple first-line therapy for Helicobacter pylori eradication // Helicobacter. 2009. 14 (5). Р. 97–107.
- Tong J. L., Ran Z. H., Shen J., Zhang C. X., Xiao S. D. Meta-analysis: The effect of supplementation with probiotics on eradication rates and adverse events during Helicobacter pylori eradication therapy // Aliment Pharmacol Ther. 2007. 25. Р. 155–168.
- Dore M. P., Cuccu M., Pes G. M., Manca A., Graham D. Y. Lactobacillus reuteri in the treatment of Helicobacter pylori infection // Intern Emerg Med. 2014. Sep, 9 (6). Р. 649–654.
- Francavilla R., Polimeno L., Demichina A., Maurogiovanni G., Principi B., Scaccianoce G., Ierardi E., Russo F., Riezzo G., Di Leo A., Cavallo L., Francavilla A., Versalovic J. Lactobacillus reuteri strain combination in Helicobacter pylori infection: a randomized, double-blind, placebo-controlled study // J Clin Gastroenterol. 2014. May-Jun, 48 (5). Р. 407–413.
- Emara M. H., Mohamed S. Y., Abdel-Aziz H. R. Lactobacillus reuteri in management of Helicobacter pylori infection in dyspeptic patients: a double-blind placebo-controlled randomized clinical trial // Therap Adv Gastroenterol. 2014. Jan,7 (1). Р. 4–13.
- Mehling H., Busjahn A. Non-Viable Lactobacillus reuteri DSMZ 17648 (Pylopass™) as a New Approach to Helicobacter pylori Control in Humans // Nutrients. 2013. 5 (8). Р. 3062–3073.
- Holz C., Busjahn A., Mehling H., Arya S, Boettner M., Habibi H., Lang C. Significant Reduction in Helicobacter pylori Load in Humans with Non-viable Lactobacillus reuteri DSM17648: A Pilot Study // Probiotics & Antimicro. Prot. December 2014. 14 (1). Р. 110–120.
Е. Ю. Плотникова*, 1, доктор медицинских наук, профессорВ. Н. Золотухина**, кандидат медицинских наукО. А. Краснов*, доктор медицинских наук, профессор
* ГБОУ ВПО КемГМА МЗ РФ, Кемерово** МБУЗ ГКБ № 2, Кемерово
1 Контактная информация: [email protected]
www.lvrach.ru
г.Самара, ул. Димитрова 131 [email protected] |
 |