 |
|
||||||||||
|
Стрептококковая инфекция у ребенка: виды заболеваний и методы их лечения. Вакцина стрептококковаяКак выявить, вылечить и предупредить стрептококковую инфекцию?Заболевания, вызванные стрептококком – одни из самых распространенных среди детей. Их тяжесть варьируется от легкой болезненности горла до менингита и пневмонии. Именно эти микроорганизмы чаще всего провоцируют ангины, конъюнктивиты, отиты, кожные заболевания. По статистике у одного из четырех детей с ангиной причиной воспаления горла является стрептококк. Эти микроорганизмы обладают высокой способностью к распространению. Они могут передаться контактным путем, например, при касании к больному или зараженным предметам, а также капельножидким (при чихании, кашле). Чрезвычайно быстро эти бактерии распространяются в детских коллективах. Содержание: Как правило, это конъюнктивиты. Патологии характеризуются покраснением слизистой оболочки век, беловатыми и гнойными выделениями, жжением, зудом, отечностью век. Выделения мешают открыть глазки после сна. Как правило, воспаляются оба органа зрения, хотя это не всегда происходит одновременно. У малышей до 3-летнего возраста симптоматика таких патологий обычно менее выражена, чем у старших ребят. У грудничков часто повышается температура тела, появляются выделения из носа. У малышей от 1 до 3 лет часто наблюдаются лихорадки, капризность, снижение аппетита, увеличение шейных лимфоузлов. От заражения до появления первых признаков заболевания (инкубационный период) проходит 2-5 дней. У ребенка более старшего возраста наблюдаются следующие симптомы воспаления горла: 
Основным симптомом наличия стрептококка при инфекции в носоглотке являются зеленоватые, гнойные, густые выделения. Часто они сопровождаются кашлем, повышением температуры, общей слабостью, болью в переносице и головной болью. Наблюдается заложенность носа, снижается обоняние.  Бактерии могут спровоцировать воспаление поверхностных (импетиго) и глубоких слоев кожных покровов (рожистое).Первые характеризуются типичными волдырями на коже вокруг рта, носа, на верхних и нижних конечностях, туловище, которые в дальнейшем покрываются гнойными корочками и преобразуются в кожные эрозии. Рожистые воспаления в первую очередь характеризуются сильной головной болью, ознобом, рвотой, общей слабостью, высокой температурой тела (около 40°C). По мере прогрессирования инфекции возникает сильный кожный зуд, покраснение и отечность; формируется болезненный, покрасневший, горячий валик кожи; образуются мелкие кровоизлияния или пузырьки, наполненные прозрачной жидкостью, которые в дальнейшем сменяются эрозиями и язвами. В данном случае речь идет о синдроме токсического шока и сепсисе новорожденных. Эти явления представляют угрозу жизни малыша. Признаки заражения стрептококком В в первые 12 часов с момента появления на свет:
К симптомам токсического шока относится падение давления крови, понос, рвота, высокая температура, кожные высыпания, поражение внутренних органов. Признаки таковой в первую очередь зависят от возбудителя и локализации воспаления. К общим симптомам, которыми характеризуется хроническая инфекция, относится недомогание, вялость, быстрая утомляемость, лихорадка, частые головные боли. Иногда наблюдаются боли в суставах (ревматизм), в области сердца, переносицы, а также одышка, приступы сердцебиения (поражение сердца), гнойные выделения из носа (хронический гайморит и этмоидит). Когда возникают следующие симптомы заболеваний, необходимо срочно показать ребенка врачу: 
Если стрептококковая инфекция уже диагностирована, врач назначил лечение, но оно не дает результатов в первые 24-48 часов, необходима более тщательная диагностика. Подтвердить наличие бактерий можно с помощью обычного мазка из горла или пораженных участков кожи. Взятый материал отправляется в лабораторию для выполнения анализа на питательные среды. Сейчас также существуют методы экспресс-диагностики, которые позволяют выявить возбудителя заболевания всего за полчаса. При выявлении возбудителя заболевания проводят тест на его чувствительность к антибиотикам, чтобы выбрать максимально эффективное лечение. Подтвердить наличие в организме стрептококковой инфекции на более поздних этапах можно с помощью анализа крови на специфические антитела. Необходимо провести дифференциальную диагностику, так как, к примеру, энтеровирусная инфекция имеет схожую клиническую картину. Терапия заключается в применении пенициллина и его производных.  Могут быть использованы препараты в форме таблеток или растворов для инъекций. Также может применяться цефалоспорин, амоксициллин и ампициллин. При наличии у малыша аллергии на пенициллин лечение проводится эритромицином. Температуру снижают ибупрофеном, ацетаминофеном, парацетамолом. Лечение конъюнктивита предполагает применение мазей и глазных капель с антибиотиками. Стрептококковая инфекция у новорожденного требует внутривенного введения антибактериальных препаратов. Основная мера – предотвращение контактов с больными людьми. Малыши, которые болеют ангиной или имеют кожные воспаления, не должны контактировать со здоровыми детьми, пока не пройдут полный курс лечения антибиотиками.  Также существует прививка от стрептококковой инфекции, которая ставится детям. Она не входит в календарь плановой вакцинации, и родители могут сделать ее по собственному желанию. Называется таковая «ПНЕВМО-23». Ставят ее только после 2-летнего возраста. Данная вакцина может защитить от 23 видов стрептококка. Рекомендуется такая профилактика малышам, которые контактируют с большим количеством больных, а также ослабленным деткам, имеющим какие-либо хронические заболевания, например, сахарный диабет, астму или бронхит. Также показанием к вакцинации является наследственная анемия, удаление селезенки и заболевания почек. Прививка от стрептококка группы А, который провоцирует тонзиллит, скарлатину, ревматизм не разработана. Это обусловлено тем, что подобная прививка может спровоцировать развитие тяжелых негативных реакций со стороны организма, например, воспаление почек или острую ревматическую лихорадку. При своевременном выявлении заболевания и, соответственно, лечении риск появления осложнений сводится к минимуму. В противном случае высока вероятность более сильного поражения организма, к примеру, самыми легкими осложнениями являются отит и синусит.  Тяжелым последствием ангины, вызванной стрептококком, является острый ревматизм, который поражает сердце и суставы, и гломерулонефрит. Если малыш перенес какое-либо из заболеваний, но у него наблюдается припухлость в области суставов, а также лихорадка, сыпь, затрудненное дыхание, то необходимо снова обращаться к врачу, проводить более тщательное исследование и лечение, так как подобные явления могут свидетельствовать о наличии острого ревматизма. Если спустя неделю после заболевания моча становится темного цвета, подозревают воспаление почек. Лечение в стационаре также требуется и в этом случае. Понравиласьстатья? Поделитесьс друзьями! mjusli.ru что нужно о ней знать? Восприимчивый детский организм постоянно подвергается вирусным атакам, особенно в весенне-осенний период. Каждое успешно перенесенное ребенком заболевание становится маленьким шагом к укреплению иммунитета. Среди многообразия детских инфекций выделяется группа заболеваний, вызываемых вредоносным микроорганизмом — стрептококком. Содержание: Стрептококковая инфекция у детейДо изобретения пенициллина стрептококковая инфекция у детей практически не поддавалась лечению и часто приводила к смерти ребенка. Проникая в неокрепший детский организм, микроб начинает выделять яд (экзотоксин), который вызывает сильнейшую интоксикацию. Частота заболеваний объясняется количеством разновидностей микроба — их насчитывается больше 50 видов. Приобретённый иммунитет против одного типа не сработает против другого. От стрептококковой инфекции не защищен ни один внутренний орган:
Со стороны мочевыделительной системы страдают почки, чаще всего стрептококк провоцирует развитие цистита и гломерулонефрита. Инфекция суставов проявляется в форме артрита и остеомиелита. Из-за проникновения стрептококков в сердечно-сосудистую систему может развиться эндо- или перикардит. К тяжелым последствиям приводит заражение новорожденного болезнетворным микробом. Инфекция попадает через околоплодные воды, в первые несколько часов жизни ребенка стремительно развивается заражение крови. При таком течении болезни летальный исход неизбежен в 50% случаев. Наиболее опасным для детского организма считается гемолитический стрептококк, без медикаментозного лечения он может нанести серьезный урон здоровью. Более подробную информацию о стрептококковой инфекции кожи вы сможете узнать из данного видео. Стрептококковая инфекция: причиныЧаще всего заражение передается воздушно-капельным путем. В детских садах и школах регулярно фиксируются вспышки заболевания стрептококком, в основном распространение происходит во временной диапазон между поздней осенью и ранней весной. У новорожденных проникновение стрептококковой инфекции происходит через пупочную ранку или еще во время процесса родов при прохождении родовых путей. Проявиться заболевание может либо сразу после рождения, либо спустя несколько недель. Подвергнуться заражению можно контактно-бытовым путем: через грязные игрушки или не прошедшие дезинфекцию вещи персонала детского учреждения. Благоприятными условиями для размножения стрептококка являются молочные продукты: молоко, сметана, творог, крем. Такая пища, не подвергшаяся термической обработке, непременно приведет к развитию в организме колоний микроба. Микроорганизмы разбрызгиваются с кашлем или при чихании, во время разговора с зараженным стрептококком. Стоит отметить, что на расстоянии трех метров от инфицированного заражение маловероятно.
Стрептококк - крайне «живучая» бацилла, он может месяцами существовать на предметах, в выделениях мокроты или гноя. Свои патогенные свойства микроб сохраняет при высушивании, на него не влияет жаркое или холодное время года. Уничтожить бактерию немедикаментозным образом можно посредством дезинфицирующих средств и влиянием температуры выше 56. Колонии стрептококка поселяются в организме ребенка независимо от состояния его иммунитета. Даже закаленные и здоровые дети не застрахованы от заражения инфекцией. Стрептококковая инфекция: симптомыИнкубационный период длится от нескольких часов до 5 дней. Наиболее уязвимы к стрептококку органы верхних и нижних дыхательных путей, ввиду их анатомических особенностей. Начало любого заболевания, спровоцированного стрептококком, начинается в острой форме. Чем старше ребенок, тем тяжелей ему переносить болезнь. У детей грудного возраста температура поднимается незначительно, ребенок плачет, отказывается от еды. Дети до трех лет жалуются на боль в горле, потерю аппетита, при поражении органов дыхания резко увеличиваются в размере миндалины. Течение инфекционного процесса у подростков гораздо хуже. Характерными признаками стрептококка являются лихорадка до 40, головокружение, тошнота, гипертрофия миндалин с появлением на них гнойного налета. Симптомами, которые сигнализируют о возможном заражении стрептококком считаются:
Классическим симптомом стрептококка у малышей грудного возраста считается насморк мутного желто-зеленого цвета. Иногда детей беспокоит боль в животе, тошнота, возможно появление рвоты. Стрептококковый конъюнктивит характеризуется покраснением белка в глазах, белыми выделениями, гиперемией век. Чаще всего страдают оба глаза, ресницы из-за гнойных выделений склеиваются настолько, что ребенок после сна не в состоянии открыть глаза самостоятельно. Мгновенное развитие болезни у новорожденных сопровождается кровоизлиянием в слизистые оболочки, выделениями крови изо рта, возможна остановка дыхания, страдают печень, селезенка, легкие. Несмотря на ярко выраженные симптомы, принимать решение о выборе лекарственного препарата должен врач-педиатр. Стрептококковая инфекция: диагностикаПризнаки стрептококковой инфекции настолько специфичны, что диагностика не вызывает затруднений. Уточнить диагноз помогают бактериологические исследования. Берется сегмент биологического материала из очага инфекции:
Главная задача подобного анализа:
Лабораторный анализ собранного материала занимает несколько дней, за этот период колонии микроорганизмов достигают оптимальных размеров. Существуют и экспресс-тесты для определения бактериальных колоний, чаще всего с их помощью определяются стрептококки группы А. Результат анализа становится известным через 30 минут. В этом случае повторный анализ не требуется.
Поскольку многие виды микроорганизмов постоянно изменяются и приобретают устойчивость к антибиотикам, врачи изобрели тест на чувствительность. Он позволяет установить наиболее эффективный тип антибиотика, подавляющий инфекцию. Исследование занимает 8-10 часов. При постановке диагноза врачу необходимо отличить схожие по признакам болезни: дифтерию, краснуху или корь, дерматиты и экземы. В качестве дополнительных методов инструментальной диагностики применяются рентгенография легких, электрокардиограмма, УЗИ диагностика внутренних органов. Дополнительные исследования важны в том случае, когда ребенок поступает в тяжелом состоянии или с наличием осложнений. Традиционно берут анализ крови на содержание лейкоцитов и скорость оседания эритроцитов. Воспалительный процесс в организме ребенка повышает эти показатели. Определив тип антибиотика, на который реагирует стрептококк, врач разрабатывает схему дальнейшего лечения. Стрептококковая инфекция: лечениеПобороть бактерии способны исключительно антибиотики. Они действуют быстро, снижают риск осложнений и предотвращают распространение колоний стрептококка по всему организму. Максимально эффективно на микробов воздействуют пенициллины и группа цефалоспоринов. Чаще всего детям прописывают: Детям с аллергией на пенициллин проводят лечение эритромицином. Схему приема назначает лечащий врач, отменять или корректировать дозировку самостоятельно не рекомендуется. Правильно подобранный препарат начинает действовать уже в первые сутки, а неприятные проявления начинают ослабевать на второй день заболевания. Игнорирование лечением в первые дни недуга грозит тяжелым течением стрептококковой инфекции, вероятными осложнениями, процесс выздоровления займет более продолжительное время. Чем скорее начато лечение, после обнаружения первых симптомов, тем меньше риска заражения для окружающих.Целесообразным считается использование медикаментов местного действия, которые помогают облегчить симптоматику заболевания: полоскание раствором фурацилина или хлоргексидина, глазные капли при конъюнктивите, препараты ибупрофена или парацетамола для снижения температуры. При стрептококковых отитах и лимфаденитах применяют физиотерапевтические мероприятия, главным образом, УВЧ. Новорожденным лечение проводится путем внутривенного введения антибиотика либо сразу после рождения, либо матери время родов.
Желательно после приема курса антибиотиков пропить препараты, восстанавливающие кишечную микрофлору (Йогурт, Линекс, Бифиформ), а также витаминный комплекс группы В и С. Для скорейшего избавления от токсинов рекомендуется обильное питье (обычная вода, чай, соки, морс). Рацион питания должен состоять из легкоусвояемой пищи, богатой витаминами, с ограничением соленых и копченых продуктов. Процесс выздоровления напрямую зависит от того, насколько ребенок выполняет предписанные врачом назначения. Стрептококковая инфекция: профилактикаК сожалению, защитить ребенка от заражения стрептококком специальными профилактическими мерами не представляется возможным. Вакцин против стрептококка группы А не существует, даже ее изобретение ставит под вопрос целесообразность применения. Любая введенная вакцина провоцирует ответ иммунной системы организма, в случае со стрептококком прививка может вызвать тяжелые последствия в виде воспалительного процесса в почках или ревматической лихорадки. Общие правила профилактики стрептококковой инфекции аналогичны профилактике респираторных заболеваний:
В детских садах и школах должны проводиться санитарно-гигиенические мероприятия, соблюдаться режим обработки дезинфицирующими средствами поверхностей и посуды. В дошкольных заведениях недопустима большая скученность детей в одном помещении, это чревато вспышками эпидемии. Родильные дома также придерживаются санитарных норм во избежание заражения стрептококком новорожденных детей. Перечень требований составляет Министерство здравоохранения и регулярно контролирует их исполнение. Стрептококк — одна из самых распространенных бактерий на планете, с которой врачи научились успешно бороться. Своевременное начало лечения гарантирует скорое выздоровление, а игнорирование врачебных рекомендаций повлечет серьезные осложнения для детского здоровья. vekzhivu.com вакцина против пневмонии, вызываемой streptococcus pneumoniae, на основе гибридного белка - патент РФ 2510281Изобретение относится к области медицины. Предложена вакцина против пневмонии, вызываемой Streptococcus pneumoniae, на основе гибридного белка, соответствующего SEQ ID NO:1, включающего фрагменты белков Streptococcus pneumoniae PspA, Spr1895, PsaA, а также компоненты флагеллина в качестве адъюванта, соединенные гибкими мостиками. Изобретение обеспечивает эффективную профилактику и терапию пневмонии за счет того, что гибридный белок вакцины составлен из различных иммуногенных эпитопов, на которые вырабатывается специфический иммунный ответ с формированием иммунологической памяти. 4 ил., 8 пр. Изобретение относится к медицине, фармакологии, биотехнологии и может быть использовано для профилактики и лечения пневмонии, вызываемой пневмококками (латинское название вида - Streptococcus pneumoniae (S. pneumoniae)). Термин «гибридный белок» здесь обозначает белок, полученный в результате экспрессии рекомбинантной молекулы ДНК, в которой соединены друг с другом в одной рамке считывания кодирующие участки нескольких разных генов. Пневмония (син. воспаление легких) считается распространенным заболеванием как у взрослых, так и у детей, и требует ответственного проведения диагностических и лечебных мероприятий. По медицинской статистике, более одного миллиона россиян ежегодно заболевают воспалением легких, и у 5% пациентов болезнь заканчивается летальным исходом (http://www.who.int/mediacentre/factsheets/fs331/ru/index.html). Термин «пневмония» объединяет большую группу болезней, каждая из которых имеет свою этиологию, патогенез, клиническую картину, рентгенологические признаки, данные лабораторных исследований и особенности терапии, может протекать как самостоятельное заболевание или как осложнение других болезней. Пневмония - воспалительный процесс инфекционного происхождения дыхательных систем человека. Возбудителями пневмонии могут быть вирусы, грибы, но чаще всего ими являются бактерии. Самая частая причина бактериальной пневмонии - пневмококк (S. pneumoniae). Изучение глоточной микрофлоры выявляет носительство пневмококков у 5-25% здоровых людей. Для пневмококков характерна мощная полисахаридная капсула, которая выполняет функцию защиты микроорганизма от опсонизации и последующего фагоцитоза. Вследствие того, что капсула пневмококков является основным поверхностным элементом, распознаваемым системой иммунитета, капсульный полисахарид характеризуется наибольшей вариабельностью. К настоящему времени обнаружен 91 различный капсульный тип пневмококков, но большинство (более 90%) инвазивных пневмококковых заболеваний вызывается 23 наиболее распространенными сероварами. Большое количество иммунологических вариантов капсульного полисахарида является фактором, осложняющим создание эффективных полисахаридных вакцинных препаратов. Заболеть пневмококковой инфекцией может любой человек, но существуют группы риска, в большей степени подверженные заболеванию, это лица в возрасте от 65 лет, маленькие дети, лица, имеющие определенные проблемы со здоровьем, лица с ослабленной иммунной системой, курильщики. Пневмококковая инфекция нередко с трудом поддается лечению, поскольку многие циркулирующие эпидемические штаммы пневмококков приобрели множественную лекарственную устойчивость к антибиотикам. Для предупреждения развития заболевания используются вакцины. Согласно позиции ВОЗ (Всемирная Организация Здравоохранения) и Российского респираторного общества, «Вакцинация - единственная возможность предотвратить развитие пневмококковой инфекции». На данный момент FDA(Food and Drag Administration) одобрило 2 типа вакцин: пневмококковую конъюгатную вакцину и пневмококковую полисахаридную вакцину (http://www.nlm.nih.gov/medlineplus/pneimiococcalinfections.html). В России зарегистрированы вакцина Пневмо 23 (PPSV23) - 23-валентная пневмококковая полисахаридная вакцина производства компании Санофи Авентис Пастер, Франция, и вакцина Превенар (PCV7) - семивалентная пневмококковая полисахаридная конъюгированная адсорбированная вакцина компании Вайет Фармасьютикалз, США. Пневмококковая полисахаридная вакцина (ППСВ) показана взрослым. У большинства здоровых взрослых людей, прошедших вакцинацию ППСВ, вырабатывается сопротивляемость большинству типов бактерий (антигены которых имеются в вакцине) в течение 2-3 недель после прививки. У лиц очень пожилого возраста, детей до 2 лет и людей с хроническими заболеваниями вакцинация может не привести к созданию стойкого иммунитета, либо иммунитет к заболеванию не возникает совсем (http://www.nlm.nih.gov/medlineplus/languages/pneumococcalinfections.html#Russian). Кроме того, после вакцинации могут возникнуть осложнения: покраснение, болезненные ощущения в месте инъекции, высокая температура, мышечные боли или более серьезные местные реакции (Donalisio MR, Rodrigues SM, Mendes ET, Krutman M. Adverse events after pneumococcal vaccination. J Bras Pneumol. 2007 Feb; 33(1):51-6). Однако, ППСВ оказалась достоверно эффективна лишь для людей с низким риском заболевания пневмококковой инфекцией. Для детей до 2 лет одновременно с вакцинацией показана профилактика с использованием антибиотиков (Bade A, Diot P, Lemarie E. Anti-pneumococcal vaccine: justifications and results. Rev Pneumol Clin. 1997; 53(3): 128-37). Оказалось, что ППСВ не уменьшает частоту пневмонии и связанную с ней смертность и лишь немного уменьшает риск заражения тяжелой пневмококковой инфекцией. Также показано, что данная вакцина не защищает от пневмококков, чувствительных к пенициллину в больших концентрациях (Pneumococcal vaccine: a second look. Solution for SC or IM injection: pneumococcal vaccine. Prescrire Int. 1998 Feb; 7(33):16-8). Такие же результаты были показаны и для людей страрше 65 лет (Pneumococcal vaccination for elderly subjects: license extension. Still no proof of clinical efficacy. Prescrire Int. 2000 Aug; 9(48):106-9). Действующим веществом ППСВ являются полисахариды 23 серотипов Streptococcus, вызывающих до 90% инвазивных заболеваний пневмококковой этиологии. Полисахарид - это антиген, не связанный с реакцией Т-клеток, потому вызывает лишь краткосрочный иммунитет без иммунной памяти; вакцины, содержащие только данные вещества, неэффективны, что показано у детей до 2 лет (Greenwood В М et al., Trans R Soc Trop Med Hyg, 1980, 74:756-760; международная заявка на изобретение WO 2010120921 A1, дата приоритета 16.04.2009). Также тот факт, что существует порядка 90 серотипов пневмококков, поскольку возбудители заболеваний в разных областях земного шара различаются, затрудняет создание универсальной вакцины на основе полисахаридов. В конъюгированной вакцине, показанной детям, наряду с полисахаридами 7 сероваров пневмококков, которые наиболее часто вызывают заболевания среди детей, также содержится белок-носитель CRM 197 (мутант дифтерийного токсина), в качестве адъюванта. Благодаря наличию адъюванта в препарате вакцины данный антигенный комплекс хорошо распознается Т-клетками, обеспечивая устойчивый иммунитет (Schneerson R, Barrera O, Sutton A, Robbins JB. Preparation, characterization, and immunogenicity of Haemophilus influenzae type b polysaccharide-protein conjugates. J Exp Med. 1980 Aug 1; 152(2):361-76). CRM 197 связывается с гепарин-связывающим эпидермальным фактором роста и может ингибировать heparin-binding EGF-like growth factor (HB-EGF). Несмотря на то, что токсичность CRM197 примерно в 106 раз меньше, чем дифтерийного токсина, все же его использование должно быть осторожным, особенно в высоких дозировках (Takuya Kageyama, Minako Ohishil, Shingo Miyamoto, Hiroto Mizushima, Ryo Iwamoto and Eisuke Mekada. Diphtheria Toxin Mutant CRM197 Possesses Weak EF2-ADP-ribosyl Activity that Potentiates its Anti-tumorigenic Activity. Received April 16, 2007. Accepted May 2, 2007). Кроме того, после вакцинации могут возникнуть осложнения: покраснение, чувствительность или припухлость в месте введения препарата, температура выше 38-39 ОС, а также беспокойность, сонливость, потеря аппетита. Более того, вакцинацию рекомендуют проводить детям до 2 лет четыре раза, от 2 до 5 лет - в зависимости от возраста ребенка, В общей сложности для вакцинации ребенка требуется введение как минимум 4 доз, что дорого и небезопасно. Известна вакцина, двумя главными компонентами которой являются полисахарид оболочки N. meningitidi и белок PsaA S.pneumoniae (может также использоваться белок PspA) (международная заявка на изобретение WO2010120921 A1, дата приоритета 16.04.2009). Ввиду невозможности выработки иммунной памяти на полисахариды, считаем использование полисахарида оболочки N. meningitidi в качестве компонента вакцины неоправданным. Использование же белков PsaA и PspA целесообразно - это поверхностные антигены пневмококков, которые способны вызывать и иммунный ответ, и формирование иммунологической памяти. При создании патентуемой вакцины опирались на индукцию сильного иммунного ответа с последующим формированием иммунной памяти. Для этого в нашей разработке центральное место заняли не полисахариды, а белки пневмококков, полученные с использованием методов молекулярной биологии и рекомбинантной ДНК. По литературным данным, в качестве вакцинных кандидатов белковой природы наиболее перспективными антигенами являются три поверхностных белка пневмококков: PsaA, PspA, Spr1895. Белок PsaA считают перспективным иммуногеном и авторы международной заявки на изобретение WO 2004102199 A2, дата приоритета 16.05.2003. Авторы приводят данный белок и еще несколько белков (SlrA - ротамаза липопротеинов, IgA1 - протеаза, PpmA - белок созревания стрептококков) или их компонентов в качестве основы для создания вакцины. Однако, мы считаем более перспективным подход с использованием других поверхностных белков S. pneumoniae - помимо PsaA, PspA и Spr1895. Описан гибридный белок, включающий PsaA и В-субъединицу холерного токсина в качестве адъюванта (Areas АР, Oliveira ML, Miyaji EN, Leite LC, Aires KA, Dias WO, Ho PL. Expression and characterization of cholera toxin B-pneumococcal surface adhesin A fusion protein in Escherichia coli: ability of CTB-PsaA to induce humoral immune response in mice. Biochem Biophys Res Commun. 2004 Aug 13; 321(1):192-6). Однако мы считаем использование холерного токсина, либо его компонентов в качестве компонента вакцины менее безопасным, чем флагеллина, ввиду того, что люди высокочувствительны к холерному токсину, и даже 8 мкг токсина может вызвать сильную диарею. Исследования показали, что белки PsaA и PspA целесообразно использовать как основу для вакцин от пневмококковой инфекции. Белок PsaA высококонсервативен среди различных серотипов пневмококков и обусловливает адгезию бактерии и ее вирулентность (Berry AM, and Paton JC: Sequence heterogeneity of psaA, a 37-kilodalton putative adhesin essential for virulence of Streptococcus pneumoniae. Infect Immun 1996; 64:5255-5262). Показано, что антитела к PsaA обладают перекрестной активностью относительно всех серотипов S. pneumonia. PspA - это холин-связывающий поверхностный антиген, который ингибирует комплемент-опосредованный фагоцитоз, связывается с лактоферрином и предотвращает лактоферрин-опосредованную элиминацию бактериальных клеток (Hammerschmidt S, Bethe G, Remane PH, Chhatwal GS(1999) Identification of pneumococcal surface protein A as a lactoferrin-binding protein of Streptococcus pneumoniae. Infect Immun 67:1683-1687). В данной статье также указывается белок PsaA как перспективный для создания вакцины. Авторами показан еще ряд белков, кандидатных для создания вакцин для защиты от пневмококковой инфекции, однако мы сочли целесообразным использование именно белков PsaA и PspA ввиду их консервативности среди серотипов пневмококков и некоторых других бактерий. Одним из главных компонентов предлагаемой вакцины также является белок Spr1895, закодированный в гене фосфат-связывающего белка фосфатного ABC транспортера. Данный белок является жизненно важным для бактерий, константным, что обуславливает его выбор для создания вакцины от пневмонии, вызываемой S. pneumonia. В настоящем изобретении также фигурирует белок флагеллин (FliC) в качестве адъюванта. FliC, взаимодействуя с Toll-like receptor-5 (TLR-5), стимулирует созревание макрофагов и дендритных клеток - антиген-презентирующих клеток, что приводит к выработке иммунного ответа (Me Dermott P.F..High-affinity interaction between Gram-negative flagellin and a cell surface polypeptide results in human monocyte activation. Infect. Immun. - 2000. - V.68. - p.:5525-5529; Means Т.K. et al. The Toll-like receptor 5 stimulus bacterial flagellin induces maturation and chemokine production in human dendritic cells. J.Immunol. - 2003. - V.170. - p.:5165-5175). На данный момент флагеллин является одним из наиболее перспективных и хорошо изученных адьювантов нового поколения. Результаты исследований показывают, что рекомбинантные белки, вводимые с флагеллином, имеют повышенные иммуногенные и антигенные характеристики. Ответы на них регистрируются в более короткие сроки и вызывают более сильный клеточный и гуморальный иммунный ответ (Balaram, 2008). В настоящем изобретении указывается, что в качестве адъюванта могут быть использованы компоненты флагеллина. Во флагеллине обнаружены два рецептор -активирующих участка в терминальных областях (а.о. 79-117 и а.о. 408-439) (Tonyia, 2001). Таким образом, оправдан подход с использованием в качестве адъюванта определенных компонентов флагеллина (FliC domain I, FliC domain 2). TLR-5 экспрессирован на клетках врожденного иммунитета, на эпителиальных и эндотелиальных клетках (Sebastiani G. et al. Cloning and characterization of the murine Toll-like receptor 5(Tlr5) gene: sequence and mRNA expression studies in Salmonella-susceptibleMOLF/Eimice. Genomics. - 2000. - V.64. - p.230-240; Zarember K.A. and Godowski P.J. Tissue expression of human Toll-like receptors and differential regulation of Toll-like receptor mRNAs in leukocytes in response to microbes, their products, and cytokines. J.Immunol. - 2002. - V.168. - p.554-561; Delneste, 2007). Ввиду этого целесообразно использование для иммунизации поверхности слизистой, что значительно облегчает доставку иммуногена. Таким образом, к наиболее близким к настоящему изобретению можно отнести изобретение, описанное в WO2004102199 А2, и конструкцию CTB-PsaA, описанную в вышеприведенной статье. В международной заявке, однако, предлагается использовать белки или их функциональные части в качестве отдельных компонентов вакцины. В основе же нашего изобретения лежит гибридный белок, который, помимо специфической белковой компоненты S.pneumoniae, также включает адъювант.В связи с этим, прототипом настоящего изобретения является гибридный белок, описанный бразильскими авторами. Гибридный белок CTB-PsaA включает PsaA серотипа 6 В S.pneumoniae (289 а.о.), а также В-субъединицу холерного токсина в качестве адъюванта (Areas АР, Oliveira ML, Miyaji EN, Leite LC, Aires KA, Dias WO, Ho PL. Expression and characterization of cholera toxin B-pneumococcal surface adhesin A fusion protein in Escherichia coli: ability of CTB-PsaA to induce humoral immune response in mice. Biochem Biophys Res Commun. 2004 Aug 13; 321(1):192-6). Однако, выгоднее и удобнее (для обеспечения правильного фолдинга молекулы) использовать фрагмент белка - антигенную детерминанту - вместо полноразмерного белка. Именно такой подход - использование наиболее иммуногенных фрагментов белков - был использован при создании настоящего изобретения. Кроме того, мы считаем использование холерного токсина, либо его компонентов в качестве компонента вакцины менее безопасным, чем флагеллина, ввиду того, что люди высокочувствительны к холерному токсину, и даже 8 мкг токсина может вызвать сильную диарею. Относительно метода получения данного гибридного белка, ген, кодирующий белок PsaA, амплифицируется отдельно с плазмиды, в которую он введен, с последующим клонированием по сайтам рестрикции в вектор, содержащий ген, кодирующий СТВ. В нашем же случае использовался подход с применением синтеза полноразмерного гена, кодирующего гибридный белок. Настоящее изобретение представляет собой вакцину на основе высокоочищенного гибридного белка, соответствующего SEQ ID NO:1, включающего иммуногенные фрагменты белков PspA (160-262 а.о. gb|EHD89266.1| pneumococcal surface protein A [Streptococcus pneumoniae]), Spr1895 (94-161 a.o. ref|ZP 01836139.1| LysM domain protein [Streptococcus pneumoniae]), PsaA (238-309 a.o. gb|AAF70667.1| PsaA [Streptococcus pneumoniae]), а также компоненты флагеллина в качестве адъюванта (1-169 а.о. gb|AAB33952.1| flagellin {alternatively spliced} [Salmonella typhimurium], 311-405 a.o. gb|AAB33952.1| flagellin {alternatively spliced} [Salmonella typhimurium]), соединенные гибкими мостиками. Для получения в соответствии с настоящим изобретением гибридного белка могут быть использованы стандартные методы молекулярной биологии и микробиологии, известные специалистам в данной области техники. Такие методы полно представлены в научной литературе. После вакцинации на входящие в состав гибридного белка вакцины эпитопы бактериальных поверхностных белков вырабатываются антитела, и формируется способность вырабатывать антитела в ответ на попадание в организм S. pneumoniae. В гибридном белке вакцины представлены антигенные детерминанты консервативных белков пневмококка, которые присутствуют у всех сероваров данного микроорганизма, поэтому иммунный ответ, который вырабатывается после вакцинации, будет вырабатываться при встрече с любым сероваром пневмококка. Использование эпитопов нескольких белков позволит увеличить эффективность вакцины. Наличие в сыворотке крови человека протективных антител к S. pneumoniae приведет к тому, что человек не заболеет или легко перенесет болезнь. Вакцина обладает как профилактическим, так и терапевтическим эффектом. Технический результат от использования изобретения заключается в обеспечении универсальной защиты от пневмококков, благодаря возможности и профилактики, и терапии заболеваний, вызываемых S.pneumoniae, за счет того, что белок вакцины составлен из иммуногенных эпитопов нескольких консервативных белков пневмококков, на которые вырабатывается специфический иммунный ответ с формированием иммунологической памяти. Технический результат от использования изобретения также заключается в усилении иммунного ответа на активный компонент вакцины, за счет использования в составе конструкции адъюванта, компонентов флагеллина. Технический результат выражается и в увеличении безопасности вакцины, благодаря использованию в качестве адъюванта нетоксичного агента (компонентов флагеллина). Изобретение проиллюстрировано следующими графическими материалами. Фигура 1. 3D-структура гибридного белка, показаны Фигура 2. 3D-структура гибридного белка, показаны аминокислотные остатки. Фигура 3. Динамика выживаемости мышей (%) после заражения 1 LD S. pneumoniae (профилактическая модель). Фигура 4. Динамика выживаемости мышей (%) после заражения 1 LD S. pneumoniae (терапевтическая модель). Осуществление настоящего изобретения. Пример 1. Моделирование гибридного белка. Спланированный гибридный полипептид является сложным мультидоменным белком (5 доменов: FHCdomainl, FliCdomain2, PspA, Spr1895, PsaA). Для моделирования мультидоменных белков были произведены определение границ доменов, построение модели целого белка для определения ориентации доменов, построение моделей для каждого домена (с использованием образцов 3D структур и ab initio) и докинг моделей с использованием модели целого белка. В спланированном гибридном полипептиде два домена имели образцы, а три нуждались в ab initio моделировании, кроме этого, в ab initio моделировании требовалось сформировать гибкие мостики между доменами. Для получения более приближенных к реальности результатов в автоматическом режиме использовали алгоритм I-Tasser, признанный лучшим на последних трех CASP (Critical Assessment of protein Structure Prediction) - соревнованиях по моделированию белков. Данный анализ проводили в течение трех дней. Однако, даже с использованием данного мощного алгоритма получение адекватных данных для мультидоменного белка с необходимостью ab initio моделирования доменов и их границ не полностью достоверно (70%). Для получения более точных данных разбили белок на используемые домены, провели их моделирование с использованеием I-Tasser и далее провели их докинг. Проделав все шаги, получили конструкцию, представленную на фиг.1, 2. Смоделированный гибридный белок состоит из 536 а.о., представлена его аминокислотная последовательность - SEQ ID NO:1. Анализ аминокислотной последовательности данного белка с помощью программы ProtParam (http://au.expasy.org/tools/protparam.html) показал, что гибридный белок имеет молекулярную массу 56,6 кДа, pI 4.56. Пример 2. Создание нуклеотидной последовательности, кодирующей гибридный белок. Перевели аминокислотную последовательность гибридного белка, включающего FliCdomainl, FliCdomain2, PspA, Spr1895, PsaA, в нуклеотидную (1623 п.н.), оптимизировав последнюю для экспрессии в клетках E. coli. Синтез данной нуклеотидной последовательности осуществляли путем удлиннения взаимоперекрывающихся олигонуклеотидов согласно описанным методам (Majumder, 1992). Олигонуклеотиды представляли собой фрагменты гибридного гена длиной около 70 нуклеотидов со взаимоперекрывающимися участками длиной около 20 нуклеотидов. Основные требования к праймерам заключались в том, что их длина не должна была превышать 60 нуклеотидов, а участки гибридизации должны были быть не меньше 20 нуклеотидов. Кроме того, на концах олигонуклеотидов не должно было быть длинных участков с повторяющимися G или C. В ряде случаев подбор оптимальных праймеров осуществляли эмпирически путем сдвига праймера по отношеню к матрице или изменения длины праймера на 3-6 нуклеотидов. В общей сложности для синтеза гибридного гена длиной 1623 п.н. было использовано 59 праймеров. Синтезированные фрагменты по 300 п.н. выделяли с помощью гель-электрофореза и клонировали в плазмидный вектор pGEM-T Easy. Клонирование осуществляли с использованием рестрикционных сайтов Kpnl, SacII, EcoRV, BamHI или посредством Пример 3. Создание плазмидной ДНК, кодирующей гибридный белок. По методике, описанной в примере 2, получили нуклеотидную последовательность гибридного белка для создания вакцины от пневмонии. Клонировали полученный ген в плазмиде рЕТ24а для последующей экспрессии. Для этого провели реакцию лигирования гена и вектора рЕТ24а, с использованием соответствующего буфера и лигазы. Реакцию проводили при +20°C в течение 2 часов. Смесь прогрели при +95°C в течение 10 мин и очистили от солей диализом на нитроцелюлозных фильтрах с диаметром пор 0,025 мкм (Millipore, США). Диализ провели против раствора, содержащего 0,5 мМ ЭДТА в 10% глицерине, в течение 10 мин. Пример 4. Создание штамма E. coli для амплификации плазмидной ДНК, содержащей гибридный ген. По методике, описанной в примере 3, получили нуклеотидную последовательность белка для создания вакцины от пневмонии и клонировали ее в плазмиде рЕТ24а. Полученной плазмидой были трансформированы клетки Е. coli штамма Dh20B/R (Gibko BRL, США) с генотипом F-mcrA После трансформации клетки инкубировали в SOC-среде (2% бакто-триптон, 0.5% дрожжевой экстракт, 10 мМ NaCl, 2.5 мМ KCl, 10 мМ MgCl 2, 10 мМ MgSO4, 20 мМ глюкоза) в течение 40 мин при +37°C. С помощью скрининга клеток E.coli на наличие плазмид на селективной среде, содержащей LB-arap, 100 мкг/мл ампициллина, отобрали колонии клеток E. coli - штамм E. coli для амплификации плазмидной ДНК, содержащей гибридный ген. Из выросших клонов была выделена плазмидная ДНК с использованием набора Wizard Minipreps DNA Purification System (Promega, США). Очищенная плазмидная ДНК была проверена с помощью рестрикционного анализа и секвенирования. В ходе работы были отобраны клоны, содержащие фрагменты ДНК требуемого размера в составе плазмиды, из которых такие плазмиды были выделены для дальнейшей индукции экспрессии гена. Пример 5. Создание штамма E. coli - продуцента гибридного белка. По методике, описанной в примере 4, получили нуклеотидную последовательность белка для создания вакцины от пневмонии и клонировали ее в плазмиде рЕТ24а, амплифицировали полученную плазмиду в клетках E. coli штамма Dh20B/R с последующим ее выделением. Для экспрессии белка использовали клетки E.coli штамма BL21 Star (DE3) (Invitrogen, USA), с генотипом F-ompT hsdSB (rB-mB-) gal dcm rne131 (DE3), содержащие в геноме Подготовили клетки Е. coli штамма BL 21 с генотипом F- ompT hsdSB (rB-mB-) gal dcm rne131 (DE3) следующим образом. Инкубировали клетки при +37°C в течение ночи в 5 мл L-бульона, содержащего 1% триптон, 1% дрожжевой экстракт и 1% натрий хлористый. Развели культуру свежим L-бульоном в 50-100 раз и вырастили на качалке при +37°C до оптической плотности 0,2-0,3 при длине волны 590 нм. При достижении оптической плотности более 0,3 культуру развели свежим L-бульоном до оптической плотности 0,1 и растили 30 мин. Перенесли 100 мл культуры в стерильную центрифужную пробирку и осадили клетки при +4°C на 5000g в течение 10 мин. Супернатант слили, клетки ресуспендировали в деионизованной воде в исходном объеме с последующим центрифугированием. Процедура отмывки повторялась трижды. После отмывки осадок клеток ресуспендировали в малом объеме деионизованной воды и центрифугировали 30 сек. при 5000 об/мин, на микроцентрифуге. Трансформацию компетентных клеток осуществляли методом электропорации. Для этого 1 мкл плазмидной ДНК добавляли к 12 мкл компетентных клеток, перемешивали и проводили электропорацию на генераторе высоковольтных импульсов ГВИ-1 (СПбГТУ, Санкт-Петербург) в стерильных ячейках при электрическом импульсе напряженностью 10 кВ/см длительностью 4 мсек. После трансформации клетки инкубировали в SOC-среде (2% бакто-триптон, 0,5% дрожжевой экстракт, 10 мМ NaCl, 2,5 мМ КС1, 10 мМ MgCl2, 10 мМ MgSO4, 20 мМ глюкоза) в течение 40 мин. при +37°C. 10-100 мкл клеточной суспензии высеивались на селективную LB-среду (Gibko BRL, США), содержащую ампициллин (100 мкг/мл), для отбора клонов, содержащих плазмиды (штаммов-продуцентов). Полученная после трансформации компетентных клеток штаммов Е. coli плазмида обеспечивает высокий уровень биосинтеза рекомбинантного белка, закодированного в ней. Пример 6. Получение гибридного белка для создания вакцины от пневмонии в клетках E. coli индукцией синтеза белка 0.2% лактозой по методу Штудиера. По методике, описанной в примере 5, получили нуклеотидную последовательность гибридного белка для создания вакцины от пневмонии и клонировали ее в плазмиде рЕТ24а, амплифицировали полученную плазмиду в клетках E.coli штамма Dh20B/R с последующим ее выделением, трансформировали ею клетки E.coli штамма BL21 для последующей индукции экспрессии целевого гена. Для культивирования полученных штаммов-продуцентов использовалась стандартная агаризованная LB-среда, содержащая ампициллин в концентрации 100 мкг/мл и глюкозу в концентрации 1% для блокирования неспецифической экспрессии. Индукция экспрессии проводилась при достижении культурой клеток оптической плотности 0.6-0.8 оптических единиц при длине волны 600 нм. В качестве индуктора использовалась 0.2% лактоза (Studier, 2005). Для автоиндукции экспрессии по методу Штудиера (Studier, 2005) использовалась среда PYP-5052, состоящая из 1% пептона (Gibco, США), 0.5% дрожжевого экстракта (Gibco, США), 50 мМ Na2HPO4, 50 мМ K2HPO4, 25 мМ (Nh5) 2SO4, 2 мМ MgSO4, 0.5% глицерола, 0.05% глюкозы и 0.2% лактозы. В среду PYP-5052, содержащую ампициллин в концентрации 100 мкг/мл, была инокулирована единичная колония штамма-продуцента. Ферментация проводилась при +37°C в термостатированном шейкере роторного типа при 250 об. мин. в течение 20 часов до отсутствия существенного изменения ОП600 за 1 час. Отбиралась аликвота клеток на анализ экспрессии гена, кодирующего вакцинный белок, методом электрофореза в ПААГ, а оставшуюся биомассу осаждали центрифугированием при 9000g. Белок выделяли из клеток E. coli посредством лизиса клеток. Клетки ресуспендировали в лизирующем буфере, содержащем 20 мМ трис-HCl рН 7,5, 5 мМ ЭДТА и 1 мМ феноксиметилсульфонилфторид, из расчета на 1 г клеток 5-7 мл буфера. Суспензию клеток обрабатывали ультразвуком 7 раз по 30 сек с интервалом в 30 сек (частота ультразвука составляет 22 кГц). Лизат центрифугировали 10 мин при +4°C, 5000 g. Надосадочную жидкость сливали, к осадку добавляли раствор 1 М мочевины из расчета 10 мл на 1 г клеток, интенсивно перемешивали. Повторяли центрифугирование. Супернатант сливали, осадок ресуспендировали в растворе 2М мочевины того же объема. Повторяли центрифугирование. Супернатант сливали. Полученный препарат содержал по данным SDS-PAGE (PolyAcrylamide Gel Electrophoresis with Sodium dodecyl sulfate) около 97% гибридного белка в концентрации 1 мг/мл. Условия выделения и очистки подбирались экспериментальным путем и могут варьировать в известных среднему специалисту в этой области значениях. Пример 7. Протективное действие вакцины на основе гибридного белка, содержащего PspA, Sprl895, PsaA, FliCdomainl, FliCdomain2, на профилактической модели летальной инфекции S. pneumoniae. Для определения протективного действия препарата гибридного белка использовали мышей. Опытная и контрольная группы содержали по 30 мышей линии Balb/c (самки), 7-8 недель (массой 18-20 г), каждая. Гибридный белок вводили в количестве 10 мкг на мышь. Через 1 месяц заражали вакцинированных мышей пневмококковой инфекцией: вводили внутрибрюшинно 104 КОЕ (колониеобразуещих единиц) S.pneumoniae (это минимальная летальная доза для мыши). Наблюдали выживаемость таких мышей в течение 14 дней после введения летальной дозы пневмококка (Фиг.3). Иммунизированные вакциной на основе рекомбинантного гибридного белка мыши показали выживаемость 80% через неделю после заражения и 68% на 14 день наблюдений. В контрольной группе выживаемость составила 0% уже на 5 день эксперимента. Таким образом, препарат предлагаемой вакцины обладает протективным действием. Кроме того, исследуемая доза препарата вакцины (10 мкг/мышь) не оказывает токсического действия на мышей. Пример 8. Протективное действие вакцины на основе гибридного белка, содержащего PspA, Sprl895, PsaA, FliCdomainl, FliCdomain2, на терапевтической модели летальной инфекции S. pneumoniae. Опытная и контрольная группы содержали по 30 мышей линии Balb/c (самки), 7-8 недель (массой 18-20 г), каждая. Мышей заражали пневмококковой инфекцией: вводили внутрибрюшинно 104 КОЕ (колониеобразуещих единиц) S. pneumoniae (это минимальная летальная доза для мыши). В этот же день мышам вводили гибридный белок в количестве 10 мкг на мышь. Наблюдали выживаемость таких мышей в течение 14 дней после введения летальной дозы пневмококка. При совместном введении пневмококка и вакцины на основе гибридного белка мыши показали выживаемость 76% через неделю после заражения и 65% на 14 день наблюдений. В контрольной группе выживаемость составила 0% уже на 6 день эксперимента. Такие результаты доказывают хорошую иммуногенность вакцины, предлагаемой в данном изобретении. Таким образом, вакцина может использоваться для терапии пневмококковой инфекции. ФОРМУЛА ИЗОБРЕТЕНИЯВакцина против пневмонии, вызываемой Streptococcus pneumoniae, на основе гибридного белка, соответствующего SEQ ID NO:1, включающего фрагменты белков Streptococcus pneumoniae PspA, Spr1895, PsaA, а также компоненты флагеллина в качестве адъюванта, соединенные гибкими мостиками. www.freepatent.ru Стрептококковая инфекция - Причины, симптомы и лечение. Журнал МедикалСтрептококки - это целое семейство микроорганизмов. Под микроскопом они выглядят, как цепочка шариков. Среди этого семейства есть неопасные для человека, однако несколько видов вызывают довольно большое количество опасных заболеваний от пищевых отравлений до гнойных процессов практически в любой точке организма.
Стрептококк под микроскопом Термином «стрептококковая инфекция» определяют группу заболеваний, вызванных бета-гемолитическим стрептококком. Так его назвали из-за свойства разрушать красные кровяные клетки. В эту группу входят, рожа, скарлатина, местные и генерализованные гнойно-воспалительные процессы: абсцессы, флегмоны, фурункулы, остеомиелит, раневая инфекция, стрептококковый сепсис и эндокардит. Стрептококковая инфекция является пусковым механизмом для ревматической лихорадки (ревматизм), острого гломерулонефрита (воспаление почечной ткани). Ближайший родственник бета-гемолитического стрептококка - пневмококк (стрептококк пневмонии) является основным возбудителем пневмонии, синуситов. Болезнетворное воздействие стрептококка определяется его способностью производить токсины (яды): стрептолизин оказывает разрушающее действие на клетки крови и ткани сердца, эритрогенин вызывает расширение мелких сосудов и обуславливает появление сыпи, например при скарлатине, лейкоцидин разрушает лейкоциты – один из элементов иммунной системы. Кроме того стрептококк выделяет ферменты, способствующие проникновению и распространению его в тканях. Источником инфекции является больной человек, возможно бессимптомное носительство возбудителя. Основной путь передачи стрептококка – воздушно капельный, кроме того возможен контактно-бытовой путь - через грязные руки, загрязненный предметы ухода за больными. Проникновение в организм чаще происходит через слизистую оболочку дыхательных путей (96-97%), возможно заражение через поврежденную кожу или через пупочную ранку у новорожденных. В месте внедрения стрептококка в организм развивается очаг воспаления серозный, гнойный или с омертвением пораженных тканей (некротический). Выделяя особые ферменты, стрептококк преодолевает местные барьеры и проникает в кровь и лимфатическую систему, вызывая образование очагов стрептококковой инфекции в отдаленных органах (сердце, кости и др.), воспаление лимфатических узлов. Токсины, выделяемые стрептококком, вызывают резкий подъем температуры, рвоту, головную боль, нарушения сознания (чаще бывает при скарлатине, роже, сепсисе). Не менее значим и так называемый аллергический синдром: в организме больного развивается аллергическая реакция на компоненты клеточной оболочки стрептококка, в ходе которой собственной иммунной системой повреждаются почки, сердце, суставы. Иммунитет после перенесенной стрептококковой инфекции нестоек, поэтому человек может неоднократно болеть стрептококковыми заболеваниями (исключение составляет один из компонентов – против токсинов вырабатываемых стрептококком, он остается на всю жизнь, обеспечивая защиту от повторного заболевания скарлатиной). Симптомыв стрептококковой инфекцииКоротко рассмотрим частные проявления стрептококковой инфекции. Скарлатина. Пурпурной лихорадкой называли скарлатину в 17 веке из-за одного из ее проявлений – обильной точечной сыпи. Скарлатина протекает с высокой температурой тела, выраженной интоксикацией. Один из признаков скарлатины – воспаление миндалин (тонзиллит, ангина). Заболевание начинается остро с ознобом, общей слабостью, головной болью, болью в горле при глотании, подъемом температуры тела до 38-39˚. Через 6-12 часов после начала заболевания появляется сыпь, вначале более заметная на кистях, стопах, верхней части туловища. Максимального развития сыпь достигает на 2-3 день заболевания, постепенно исчезая к началу второй недели.
Симптомы стрептококковой инфекции Если у человека есть иммунитет против токсинов стрептококка, то заразившись этим возбудителем, человек заболеет не скарлатиной, а ангиной. Ангина – это воспаление миндалин глотки (чаще всего небных). Именно перенесенная ангина, при отсутствии противострептококкового лечения, чаще других заболеваний является причиной развития аутоиммунных процессов, приводящих к поражению сердца и почек. Вероятность заболевания ангиной зависит от состояния местного иммунитета миндалин: чем он ниже – тем больше вероятность заболеть ангиной. Снижение общего иммунитета, под воздействием переохлаждения, неблагоприятных условий окружающей среды также повышает вероятность заболевания ангиной. Преодолев местные защитные барьеры миндалин, стрептококк начинает размножаться и продуцировать различные вещества, вызывающие воспалительный процесс, который может быть по своему характеру катаральным, фолликулярным, лакунарным и некротическим. Проникновение стрептококков и продуктов их жизнедеятельности по лимфатическим путям в лимфатические узлы вызывает их острое воспаление. При недостаточности барьерной функции тканей, окружающих миндалины, стрептококки могут проникать ткани вокруг миндалины, вызывая их воспаление (так называемый перитонзиллит, перитонзиллярный абсцесс), а при проникновении в кровь могут привести к развитию сепсиса. Всасывающиеся в кровь продукты жизнедеятельности стрептококков вызывают нарушение терморегуляции, а также поражение тканей организма и в первую очередь - центральной и периферической нервной системы, почек, печени, кровеносных сосудов, миокарда, и других. Инкубационный период при ангине составляет 1-2 суток. Начало заболевания острое. Чаще всего среди полного здоровья появляются озноб, общая слабость, головная боль, ломота в суставах, боль в горле при глотании. Озноб продолжается в течение 15-30 мин, затем появляется чувство жара. При тяжелых формах болезни озноб продолжается в течение длительного срока, повторяется и на следующие сутки. Головная боль тупая, не имеет определенной локализации, сохраняется в течение 2-3 суток. Ломота в суставах, в пояснице появляется почти одновременно с ознобом и сохраняется в течение 1-2 суток. Боль в горле, вначале незначительная, беспокоит только при глотании, затем постепенно усиливается, становится постоянной, достигает максимальной выраженности на вторые сутки. Сыпи при ангине не бывает. Миндалины при ангине увеличены, с желто-белым гнойным налетом или белыми пузырьками (фолликулами).
Воспаление костного мозга, распространяющееся на все слои кости называют остеомиелитом. Стрептококк может являться его причиной в 6-8% случаев. Заболевание проявляется гнойным поражением костного мозга. Вещество кости отмирает, образуется гнойник, который вскоре прорывается наружу.Крайним проявлением стрептококковой инфекции является сепсис. Это заболевание развивается у людей с резко сниженным иммунитетом. Из первичного очага возбудитель разносится кровью по организму, появляются новые и новые очаги инфекции – гнойники в печени, почках, головном мозге, легких, костях, суставах и т.д. Заболевание может принимать молниеносные формы, с гибелью больного в течение 2-3 дней, но может и длиться годами (так называемый хрониосепсис). Диагностика стрептококковой инфекцииДиагноз стрептококковой инфекции ставится на основании симптомов заболевания. Для уточнения характера заболевания (степени реакции организма), а также исключения возможных осложнений больному проводят анализы крови, мочи, электрокардиографию. Для уточнения вида возбудителя проводятся бактериологические исследования – посевы биологического материала с очагов инфекции (напр., мазки с миндалин, очагов на коже, мокроты из легких). Устанавливая диагноз, врач должен отличать заболевания стрептококковой природы от дифтерии (поражение миндалин, похожее на ангину), краснухи и кори (сыпь, похожая на таковую при легких формах скарлатины), инфекционного мононуклеоза (ангина), дерматитов и экземы (сходны с поражением кожи при роже). Лечение стрептококковой инфекцииЛечение стрептококковой инфекции проводится с использованием антибиотиков пенициллинового ряда: бензилпенициллин, ампициллин, бициллин-3 или бицилли-5 на третьи-четвертые сутки после начала лечения пенициллином. Устойчивость против пенициллиновых антибиотиков стрептококки приобрести не способны. При аллергии на пенициллины может быть назначен антибиотик эритромицинового ряда (эритромицин, олеандомицин). Препараты группы сульфаниламидов (сульфадиметоксин, ко-тримоксазол) и тетрациклинов (тетрациклин, доксициклин) не эффективны и не рекомендуются для лечения, их применение может привести к бессимптомному носительству (носитель будет заражать окружающих). К концу лечения антибиотиками назначаются препараты нормализующие микрофлору кишечника (линекс, бактисубтил). Для выведения токсинов из организма необходимо обильное питье до 3-х литров жидкости в сутки (чай, морс, фруктовые соки или просто вода). С лечебной и общеукрепляющей целью принимают витамин С, обладающий способностью укреплять стенки кровеносных сосудов и участвовать в выведении токсинов. Комбинированные препараты с парацетамолом типа колдрекс, терафлю использовать можно, но кратковременно, так как при их применении может возникать видимость благополучия, что служит причиной отказа от лечения и возникновения осложнений. Препараты для полоскания глотки не способны воздействовать не только на стрептококк, находящийся в глубине тканей, но и на поверхности. Поэтому полоскание применяется скорее в гигиенических, чем в лечебных целях. Полоскание более предпочтительно, чем пастилки для рассасывания, так как в первом случае возбудитель вымывается и выводится наружу, а во втором проглатывается.Диета больного человека должна быть легкоусвояемой (организму не надо тратить лишние силы на расщепление пищи), с достаточным количеством витаминов. Народные способы лечения стрептококковой инфекцииНародные способы лечения стрептококковой инфекции принесут большую пользу больному человеку, однако в качестве единственного или самостоятельного способа лечения не годятся. Принимая решение об отказе от традиционных (с антибиотиками) способов лечения, человек должен понимать, что берет на себя ответственность за возможное возникновение тяжелых осложнений инфекции. Препараты, применяемые в народной медицине, представлены в основном отварами и настоями лекарственных растений. Это настои ягод, содержащие большое количество витаминов (шиповник, клюква, малина) – их употребление укрепляет защитные силы организма и способствует быстрому выведению токсинов, эту же цель преследует употребление отваров растений с мочегонными свойствами (брусничный лист, толокнянка). Отвары растений, обладающими вяжущими, противовоспалительными и антибактериальными свойствами (кора дуба, кора ивы, ромашка, череда) применяются как внутрь, так и наружно в качестве полосканий и примочек. Тепловые процедуры, например, баню с использованием веников и отваров лекарственных трав, можно проводить в период выздоровления, только без излишеств: перегрев также плохо влияет на организм, как и переохлаждение, механическое воздействие на очаг на коже может привести к обострению процесса. Если рецепт лечения покажется сложным, сомнительным, то от него стоит отказаться в пользу простых проверенных средств. Применяя народные методы, не стоит вдаваться в крайности: так некоторые «народные целители» предлагают использовать в качестве лечения примочки с мочой и даже свежий навоз! Профилактика стрептококковой инфекции заключается в соблюдении правил личной гигиены, гигиены жилища и общественных мест. Закаливание и занятия спортом способствуют укреплению защитных свойств организма. Здоровое, полноценное питание немаловажный компонент защиты от любых заболеваний. Вредные привычки: табакокурение и злоупотребление алкоголем снижают эффективность не только общих и местных защитных барьеров, но и отрицательно влияют на исход заболевания, увеличивая риск осложнений. Своевременная обработка микротравм (например, раствором йода) снизит риск проникновения и развития возбудителя в ране. Если в ближайшем окружении есть больные стрептококковой инфекцией, то они должны быть изолированы на время лечения. Консультация врача по теме Стрептококковая инфекция.Есть ли прививка от стрептококковой инфекции?Ответ: Нет, вакцину от бета-гемолитического стрептококка не разрабатывали. Есть вакцина от его «родственника» пневмококка. Можно ли заболевать скарлатиной два раза?Ответ: Можно, но это скорее в теории. На практике это бывает крайне редко Какая длительность курса приема антибиотика? Нельзя ли отменить пораньше?Ответ: Стандартный курс антибиотикотерапии составляет 7-10 дней. По усмотрению врача курс может быть сокращен до 5 дней, либо продлен до 2 недель. Самостоятельно сокращать курс настоятельно не рекомендуется. Что эффективней полоскание горла или спреи (брызгалки)?Ответ: Оба способа большой лечебной значимости не имеют. Полоскание более предпочтительно, с гигиенической целью, для удаления продуктов воспаления. В состав спреев часто входят малоэффективные при стрептококковых инфекциях сульфаниламиды. В какие сроки могут возникать осложнения стрептококковой инфекции?Ответ: Осложнения могут возникать в срок от 1-2 дней до 4 недель. наблюдение за переболевшим и щадящий режим могут продолжаться на срок до 3 месяцев Врач терапевт Соков С.В. Видео о том, что такое стрептодермия, какие у нее симптомы, какие анализы сдать и какое лечение может назначить врач:www.medicalj.ru Живая стрептококковая вакцина и способ её полученияИзобретения относятся к области микробиологии и касаются способа получения живой стрептококковой вакцины и непосредственно вакцины. Представленный способ включает инкубирование на жидкой питательной среде живой культуры слабовирулентного штамма MPK-12 β-гемолитических стрептококков группы A (Streptococcus pyogenes), с последующим добавлением в полученную биомассу, содержащую смесь живых бактерий и продукты метаболизма, защитной среды высушивания. Разливают вакцину в ампулы и/или флаконы и проводят лиофильную сушку с последующей укупоркой. Предложенные изобретения могут быть использованы для профилактики стрептококковых инфекций, профилактики и лечения онкологических заболеваний, энзимотерапии, а так же как противовирусный, тромболитический и иммуномодулирующий препарат. 2 н.п. ф-лы, 2 пр.
Изобретение относится к микробиологии, производству медицинских и ветеринарных биологических препаратов, а в частности к способам получения из бактерий вида Streptococcus pyogenes препаратов, обладающих онкопротекторной, тромболитической, противовирусной и иммуномодулирующей активностью. В научной литературе описаны противораковые и иммуномодулирующие свойства бактерий вида Streptococcus pyogenes. Так, известно, что липотейхоевые кислоты, липополисахариды и фрагменты ДНК Streptococcus pyogenes действует на рецепторы дендритных клеток, макрофагов и лимфоцитов, запуская выработку каскада цитокинов, которые приводят в конечном итоге к усилению неспецифического иммунитета в организме и повышению сопротивляемости вирусным инфекциям (Linnebacher М., Maletzki С., Klier U., Klar Е. Bacterial immunotherapy of gastrointestinal tumors [Text] / M. Linnebacher et al. // Langenbecks. Arch. Surg. - 2012. - Vol. 397. - P. 557-568.). Важный противораковый механизм препаратов на основе Streptococcus pyogenes связан с ускорением созревания дендритных клеток. Установлено, что активация дендритных клеток вызывается взаимодействием ТПР-9 с фрагментами ДНК Streptococcus pyogenes. При этом дендроциты начинают активно вырабатывать интерлейкин-12 и гамма-интерферон, увеличивают экспрессию антигенов (CD40, CD80, CD83, CD86), молекул клеточной адгезии (ICAM-1) и индуцируют появление цитотоксических лейкоцитов, в том числе Т-лимфоцитов с противоопухолевой активностью. Таким образом, компоненты клеток Streptococcus pyogenes, активируя дендритные клетки организма человека, стимулируют противораковый иммунитет (Hovden А.-О., Karlsen М., Jonsson R., Aarstad Н.J., Silke Appel Maturation of monocyte derived dendritic cells with OK432 boosts IL-12p70 secretion and conveys strong T-cell responses / A.-O. Hovden et al. // BMC Immunology. - 2011. - Vol. 12. - P. 2-5.). Установлено прямое противораковое действие протеолитических ферментов Streptococcus pyogenes на 4 типа клеток карцином человека (Eslami-Nejad Z., Nematollahi-Mahani S.N., Saffari F., Mollaii H., Arabzadeh S. A. M. Cell death induction by Streptococcus pyogenes in four types of malignant cell lines / Z. Eslami-Nejad et al. // Med. J. of the Islamic Repub. of Iran. - 2010. - Vol. 23(4). - P. 207-217.). Бактерии Streptococcus pyogenes вырабатывают гликопротеин SAGP, белок, который действуя на опухоль напрямую, угнетает митотическую активность опухолевых клеток и вызывает их апоптоз, а также оказывает иммуномодулирующее действие (Yoshida J., Takamura S., Nishio M. Characterization of a streptococcal antitumor glycoprotein (SAGP) [Text] / J. Yoshida et al. // Life Sciences. - 1998. - Vol. 62(12). - P. 1043-1053.). Из патентной литературы известен способ получения иммуностимулирующего препарата Пицибанил (ОК-432), включающий выращивание бактерий Streptococcus pyogenes на питательной среде с последующей инактивацией с помощью процесса пастеризации, затем обработки пенициллином, лиофилизацией, удалением пенициллина и повторной лиофилизацией (US 4328218 А - Method for the treatment of cells of Streptococcus pyogenes). Недостатком данного метода является вирулентность используемого штамма, которая требует сложного процесса инактивации и, как следствие, невозможность использования живого штамма. В то же время известно, что живые бактерии Streptococcus pyogenes гораздо более эффективно вызывают регрессию различных видов опухолей и предотвращают метастазы, чем убитые термической обработкой (Maletzki С., Linnebacher М., Kreikemeyer В., Emmrich J. Pancreatic cancer regression by intratumoural injection of live Streptococcus pyogenes in a syngeneic mouse model / C. Maletzki // Gut. - 2008. - Vol. 57. - P. 483-491.). Известен способ получения энзимотерапевтического, противовирусного и иммуномодулирующего препарата из живой слабовирулентной культуры Streptococcus pyogenes штамм «Гуров», в котором штамм бактерий выращивают сначала на жидкой питательной среде, затем пересевают на чашки Петри на твердую питательную среду и после инкубации смывают с чашек Петри физиологическим раствором (патент №2086246). Недостатком данного способа является его технологическая непригодность для промышленного производства препарата, так как при производстве препарата высока доля ручного труда и отсутствует возможность автоматизации процесса, так как при помощи смыва с чашки Петри препарат можно получать лишь в небольших количествах. К дополнительным недостаткам данного способа относится повышенная вероятность контаминации патогенной микрофлорой на этапах пересева и при смыве с чашек Петри физиологическим раствором, а также короткий срок жизнеспособности бактерий в физиологическом растворе (4-5 часов), что не позволяет приготовить живой лиофилизированный препарат. В то же время оптимальным методом сохранения живых бактерий Streptococcus pyogenes является лиофильная сушка. Но проведенные опыты по лиофильной сушке Streptococcus pyogenes в физиологическом растворе, даже в присутствии питательного бульона дают очень плохие результаты. Полученный вышеописанным способом препарат может быть применен только по месту производства и не может транспортироваться на дальние расстояния. Кроме того, продукты метаболизма бактерий Streptococcus pyogenes содержат важные для лечения компоненты: липотейхоевые кислоты, липополисахариды и фрагменты ДНК Streptococcus pyogenes, гликопротеин SAGP, фермент Стрептокиназу, гиалуроновую кислоту и другие. При описанном выше способе приготовления препарата эти важные и нужные вещества в организм не поступают. Они начнут продуцироваться только после того, как бактерии Streptococcus pyogenes начнут размножаться в организме. Эксперименты, проведенные на добровольцах, показывают, что при введении интрадермально одного и того же количества бактериальных клеток вместе с продуктами метаболизма вызывает тромболитический эффект в течение 20 минут после введения. А при введении очищенных от продуктов метаболизма бактериальных клеток, такой же эффект проявляется только через 5-6 часов. Таким образом, препарат, содержащий бактериальные клетки вместе с продуктами метаболизма, может использоваться для экстренной медицинской помощи в качестве тромболитика. Предлагаемый способ получения препарата включает выращивание β-гемолитических стрептококков группы A (Streptococcus pyogenes), выбранных среди слабовирулентных штаммов, например штамм «Гуров», штамм MPK-12, или аналогичных и/или смесь разных штаммов на жидкой питательной среде, затем в полученную биомассу, содержащую смесь живых бактерий и продукты метаболизма, добавляют защитную среду высушивания, разливают в ампулы и/или флаконы и проводят лиофильную сушку с последующей укупоркой. При таком способе производства возможно применение промышленных технологий автоматизации выращивания культуры и обеспечивается более высокая степень стерильности при производстве препарата, так как уменьшается доля ручного труда, уменьшается количество операций, и соответственно уменьшается вероятность контаминации патогенной микрофлорой. Также обеспечивается возможность продолжительного хранении и транспортировки препарата. Лиофильно высушенная культура бактерий, запаянная в ампулы, сохраняет жизнеспособность в течение длительного времени (до 10 лет). Ампулы с препаратом могут перевозиться любым видом транспорта на любые расстояния. Пример 1. В бутыль объемом 0,5 литра с 400 мл питательного бульона с 2% глюкозы и 2% экстракта дрожжей добавляют 20 мл лошадиной сыворотки и вносят лиофилизированную культуру β-гемолитических стрептококков группы А штамма MPK-12. Бутыль с культурой помещают в термостат и инкубируют при 37°C в течение 24-36 часов. После образования в бутыли хлопьевидного осадка культуру проверяют на стерильность, добавляют защитную среду высушивания, разливают по ампулам и/или флаконам и проводят лиофильную сушку с последующей укупоркой. Пример 2. В пробирку объемом 10 мл с 7 мл питательного бульона с 2% глюкозы вносят лиофилизированную культуру β-гемолитических стрептококков группы А штамма MPK-12. Пробирку с культурой помещают в термостат и инкубируют при 37°C 24-36 часов до образования хлопьевидного осадка. Затем проводят пересев культуры из пробирки в бутыль объемом 0,5 литра с 400 мл питательного бульона с 2% глюкозы, добавляют 20 мл крови человека и вносят лиофилизированную культуру β-гемолитических стрептококков группы А штамма MPK-12. Бутыль с культурой помещают в термостат и инкубируют при 37°C в течение 24-36 часов. После образования в бутыли хлопьевидного осадка культуру проверяют на стерильность, добавляют защитную среду высушивания, разливают по ампулам и/или флаконам и проводят лиофильную сушку с последующей укупоркой. 1. Способ получения живой стрептококковой вакцины, которая может быть использована для профилактики стрептококковых инфекций, профилактики и лечения онкологических заболеваний, энзимотерапии, а так же как противовирусный, тромболитический и иммуномодулирующий препарат, заключающийся в том, что живую культуру слабовирулентного штамма MPK-12 β-гемолитических стрептококков группы A (Streptococcus pyogenes) инкубируют на жидкой питательной среде, затем в полученную биомассу, содержащую смесь живых бактерий и продукты метаболизма, добавляют защитную среду высушивания, разливают в ампулы и/или флаконы и проводят лиофильную сушку с последующей укупоркой. 2. Живая стрептококковая вакцина, которая может быть использована для профилактики стрептококковых инфекций, профилактики и лечения онкологических заболеваний, энзимотерапии, а так же как противовирусный, тромболитический и иммуномодулирующий препарат, представляющая собой бактерии живой культуры слабовирулентного штамма MPK-12 β-гемолитических стрептококков группы A (Streptococcus pyogenes), инкубированные на жидкой питательной среде, подвергнутые лиофильной сушке вместе с продуктами метаболизма и защитной средой высушивания. www.findpatent.ru Стрептококковые инфекции: лечение, симптомы, причины, признакиСимптомы изменяются в зависимости от пораженного органа. Осложнения включают ревматическую лихорадку и гломерулонефрит. Клинические диагнозы подтверждаются цитобактериоскопией мазков, окрашенных по Граму, и посевом обогащенных питательных сред. Большинство штаммов чувствительны к пенициллину, за исключением энтерококков, которые могут быть полирезистентны. Недавно появились макролидрезистентные штаммы. Классификация стрептококковой инфекцииСтрептококки дифференцируют по характерным зонам гемолиза при выращивании на агаре с бараньей кровью. Различают три типа стрептококков. Бета-гемолитические стрептококки вызывают полный лизис эритроцитов с просветлением кровяного агара вокруг каждой колонии, α-гемолитические стрептококки (включая группу стрептококков вириданс) вызывают частичный лизис эритроцитов, приводящий к зеленовато-серому окрашиванию кровяного агара, и γ-гемолитические стрептококки не являются гемолитическими. Последующая классификация, основанная на углеводах клеточной стенки, подразделяет стрептококки на группы по классификации Лэнсфилда от А до Н и от К до Т. Стрептококки группы вириданс формируют отдельную группу, которая трудно поддается классификации. В классификации Лэнсфилда энтерококки были первоначально включены в группу стрептококков D. Позже энтерококки были классифицированы как отдельный род Факторы вирулентности. Многие стрептококки вырабатывают факторы вирулентности, включая стрептолизины, ДНКазы и гиалуронидазу, которые способствуют разрушению ткани и распространению инфекции. Отдельные штаммы продуцируют экзотоксины, которые активизируют определенные Т-клетки, вызывая выделение цитокинов, включая фактор α-некроза опухоли, интерлейкины и другие иммуномодуляторы. Эти цитокины активизируют комплемент, коагуляцию и фибринолитические системы, что ведет к шоку, полиорганной недостаточности и смерти. Болезни, вызываемые стрептококкамиОдним из самых распространенных патогенных микроорганизмов этой группы считается S. pyogenes, который является β-гемолитическим и относится к группе А по классификации Лэнсфилда как β-гемолитические стрептококки группы А. Два наиболее распространенных острых заболевания, обусловленных β-гемолитическими стрептококками группы А - инфекции кожи и фарингит; кроме того, отдаленные негнойные осложнения (ревматизм, острый гломерулонефрит) наблюдаются спустя >2 нед после инфекции. Заболевания, вызываемые другими стрептококковыми разновидностями, менее распространены и обычно включают инфекцию мягкой ткани или эндокардит. Некоторые инфекции, не вызываемые β-гемолитическими стрептококками группы А, встречаются у определенных групп населения (например, группа В стрептококков - у новорожденных и родильниц, энтерококки - у госпитализированных пациентов). Инфекции могут распространяться через поражённые ткани и вдоль лимфатических каналов к региональным лимфоузлам. Нагноение зависит от тяжести инфекции и восприимчивости ткани. Приблизительно у 20% пациентов наблюдается острый тонзиллит, лихорадка, покраснение ротоглотки и гнойный налет на миндалинах. У остальных - менее выраженные симптомы, первичный осмотр может выявить картину, похожую на вирусный фарингит. Шейные и подчелюстные узлы увеличены и болезненны. Состояние бессимптомного носительства может наблюдаться в 20%. Скарлатина на сегодняшний день редкое заболевание, вызывается стрептококками стрептококков группы А (иногда группы В или С), которые продуцируют эритрогенный токсин, приводящий к диффузному розово-красному покраснению кожи, бледнеющему при надавливании. Сыпь лучше всего видна на животе или боковой части груди в виде темно-красных полос в кожных складках (линии Пастиа) на фоне бледного носогубного треугольника. Малиново-красный язык (воспалённые сосочки, проявляющиеся сквозь ярко-красную оболочку) типичен и его необходимо дифференцировать от изменений языка, характерных при синдроме токсического шока и болезни Кавасаки. Отмечаются маленькие (1-2 мм) папулезные высыпания, придающие коже вид наждачной бумаги. Другие симптомы похожи на стрептококковый фарингит, а течение и контроль скарлатины - те же, как и при других инфекциях группы А. Инфекции кожи включают импетиго и целлюлит. Целлюлит распространяется быстро из-за многочисленных литических ферментов и токсинов, продуцируемых этой группой стрептококков. Рожистое воспаление является особой формой стрептококкового целлюлита. Некротирующий фасциит, обусловленный S. pyogenes является тяжелой инфекцией кожи (или редко мышечной ткани), которая распространяется по фасциальным каналам. Заражение происходит через кожу или кишечник. Дефект может быть хирургическим, тривиальным, отдаленным от места болезни или неизвестного происхождения, как в случае с абсцессами дивертикулов толстой кишки или аппендикса. Некротирующий фасциит распространен среди наркоманов, злоупотребляющих внутривенными препаратами. Прежде известный как стрептококковая гангрена, этот синдром может также быть полимикробным, с участием аэробной и анаэробной микрофлоры, включая Clostridium perfringens. Если некротирующий фасциит развивается в промежности, это заболевание называют гангреной Фурнье. К возникновению этого заболевания предрасполагают ослабленный иммунитет, сахарный диабет, алкоголизм. Заболевание начинается остро с повышения температуры тела и резкой ограниченной боли; быстро прогрессирует и в течение долгого времени часто бывает первым и единственным проявлением болезни. Может присутствовать диффузная или локальная эритема. У 20-40% пациентов поражены соседние мышцы. Шок и дисфункция почек распространены. Характерна высокая летальность даже при адекватном лечении. Другие тяжелые стрептококковые инфекции включают септицемию, послеродовый сепсис, эндокардит и пневмонию. Стрептококковый синдром токсического шока, похожий на тот, который вызывается S. aureus, может явиться следствием воздействия токсин-продуцирующих штаммов β-гемолитических стрептококков группы А. У здоровых детей и взрослых стрептококки этой группы вызывают обычно инфекции мягких тканей и кожи. Поздние осложнения. Механизм, при котором определенные штаммы β-гемолитических стрептококков группы А вызывают поздние осложнения, неясен, может проявиться как аутоиммунное заболевание. Ревматическая лихорадка, воспалительное заболевание, встречающееся приблизительно у 3% пациентов нескольких недель после недолеченной инфекции верхних дыхательных путей. Это заболевание было широко распространено в период до открытия антибиотиков. Диагноз основан на сочетании симптомов артрита, кардита, хореита, специфических кожных проявлений и результатов лабораторных анализов (критерии Джонса). Одна из самых основных причин необходимости лечения стрептококкового воспаления горла состоит в том, чтобы предотвратить ревматическую лихорадку. Постстрептококковый острый гломерулонефрит - острый почечный синдром, развивающийся как осложнение нелеченного фарингита или инфекции кожи, вызываемый нефрогенным штаммом β-гемолитических стрептококков группы А. После инфекции горла или кожи, вызванной одним из этих штаммов, приблизительно 10-15% пациентов заболевают острым гломерулонефритом. Состояние чаще распространено среди детей и развивается спустя 1-3 нед после инфекции. Почти все дети и несколько меньшее число взрослых выздоравливают без хронического почечного нарушения. Лечение данной инфекции антибиотиками имеет небольшое влияние на последующее развитие гломерулонефрита. Синдром PANDAS, относится к подмножеству обсессивных нарушений или тиковых расстройств у детей, которые, как считается, также связаны с инфекцией β-гемолитических стрептококков группы А. Определенные формы псориаза (например, каплевидный) могут также быть связаны с β-гемолитическими стрептококковыми инфекциями. Диагноз стрептококковой инфекции
Стрептококки быстро идентифицируются посевом в питательной среде с бараньей кровью. Доступны методы быстрого выявления антигена, которые могут обнаружить β-гемолитические стрептококки группы А непосредственно по мазку из ротоглотки. Многие анализы основаны на иммуноферментном анализе, но в последнее время шли применяться анализы с использованием оптического иммунологического исследования. Эти быстрые тесты имеют высокую специфичность (>95%), но варьируют в значительной степени по чувствительности (от 55 до 80-90% у более современных оптических иммунологических анализов). При отрицательных результатах должны проводиться бактериологические посевы (особенно если для лечения используют макролиды ввиду возможной индуцибельной резистентности). Во время выздоровления подтверждение о перенесенной инфекции может быть получено косвенно, путем обнаружения антистрептококковых антител в сыворотке. Обнаружение антител является основным при диагностике постстрептококковых заболеваний,таких как ревматизм и гломерулонефрит. Для подтверждения диагноза необходимы парные сыворотки крови с нарастающим титром антител во втором и последующих образцах, т.к. в одном образце сыворотки может быть высокий титр антител из-за длительной предшествующей инфекции. Образцы сыворотки должны отбираться каждые две недели в течение 2 мес. Чтобы считать диагностическим повышение (или снижение) титра антител, оно должно охватить не менее 2 серийных разведений. Титр антистрептолизина О повышается только в 75-80% инфекций. Для окончательного подтверждения диагноза в трудных случаях может также использоваться любой из других анализов (антигиалуронидаза, антидезоксирибонуклеаза В, антиникотинамид аденин динуклеотидаза, антистрептокиназа). Пенициллин, который назначают в течение первых 5 дней при симптоматическом стрептококковом фарингите, может задержать появление и уменьшить интенсивность иммуного ответа на антистрептолизин. Лечение стрептококковой инфекции
Обычно ротоглоточные инфекции, вызванные β-гемолитическими стрептококками группы А, включая скарлатину, являются ограниченными. Антибиотики сокращают продолжительность течения инфекции у маленьких детей, переносящих скарлатину, но оказывают лишь несущественное воздействие на симптоматику у подростков и взрослых. Однако применение антибиотиков предотвращает развитие гнойных локальных осложнений (например, перитонзиллярный абсцесс), средний отит и ревматическую лихорадку. Пенициллин является препаратом выбора. Ни один изолят β-гемолитических стрептококков группы А не приобрел резистентности к пенициллину клинически, вероятно, потому, что нет мутаций пенициллин-связывающих белков и механизм передачи генов резистентности несовершенен. Однако у некоторых стрептококковых штаммов есть устойчивость к пенициллину in vitro; клиническая значимость таких штаммов неясна. Единственной инъекции бензатин пенициллина G по 600 000 единиц внутримышечно маленьким детям или по 1,2 миллиона единиц внутримышечно подросткам и взрослым обычно достаточно. Пенициллин V перорально можно назначать, если пациент может соблюдать режим приема препарата в течение необходимых 10 дней; пенициллин V назначают по 500 мг (по 250 мг детям <27 кг) перорально два или три раза в день. Пероральные цефалоспорины также эффективны. Цефдинир, цефподоксин и азитромицин могут назначаться в качестве 5-дневного курса терапии. Задержка лечения на 1-2 дня, пока не придёт лабораторное подтверждение, не влияет ни на продолжительность заболевания, ни на вероятность возникновения осложнений. Клиндамицин по 5 мг/кг перорально 4 раза в день - препарат выбора для детей, у которых регистрируются рецидивы хронического тонзиллита, возможно, потому, что у этого препарата высокая активность против пенициллиназа-продуцирующих стафилококков и анаэробов, параллельно колонизирующих крипты миндалины и инактивирующих пенициллин G и поскольку он (клиндамицин) купирует продукцию быстрее, чем другие препараты. Амоксициллин/клавуланат также эффективен. TMP/SMX, некоторые из фторхинолонов и тетрациклины не эффективны для терапии инфекций, обусловленных β-гемолитическими стрептококками группы А. Боль в горле, головную боль и лихорадку можно лечить анальгетиками или жаропонижающими. Инфекция кожи. Целлюлит часто лечат, не проводя посева, потому что выявление микроорганизмов затруднительно. Таким образом, используются антибиотики широкого спектра действия, эффективные против стрептококков и стафилококков. Некротирующий фасциит необходимо лечить в отделении интенсивной терапии. Требуется обширная (иногда и повторная) хирургическая санация. Препаратом выбора для стартовой терапии служит β-лактам плюс клиндамицин. Другие стрептококковые инфекции. Цефалоспорины или макролиды обычно эффективны, но необходимо опираться на результаты антибиотикограмм, особенно тяжелобольных пациентов, людей с ослабленным иммунитетом или истощенных больных и у людей с инородными телами в месте инфекции. Хирургический дренаж раны и санация в качестве дополнения к антибактериальной терапии обязательны. 5. bovis относительно восприимчив к антибиотикам. Хотя обнаружены изоляты ванкомицин-резистентного S. bovis, но микроорганизм остается чувствительным к пенициллину и аминогликозидам. Большинство стрептококков группы вириданс чувствительны к пенициллину G и другим β-лактамам. Резистентность растет, а терапия для таких штаммов должна быть продиктована результатами анализов чувствительности in vitro. www.sweli.ru Стрептококк. | Карапузики
Термином «стрептококковая инфекция» определяют группу заболеваний, вызванных бета-гемолитическим стрептококком. Так его назвали из-за свойства разрушать красные кровяные клетки. В эту группу входят, рожа, скарлатина, местные и генерализованные гнойно-воспалительные процессы: абсцессы, флегмоны, фурункулы, остеомиелит, раневая инфекция, стрептококковый сепсис и эндокардит. Стрептококковая инфекция является пусковым механизмом для ревматической лихорадки (ревматизм), острого гломерулонефрита (воспаление почечной ткани). Ближайший родственник бета-гемолитического стрептококка — пневмококк (стрептококк пневмонии) является основным возбудителем пневмонии, синуситов. Болезнетворное воздействие стрептококка определяется его способностью производить токсины (яды): стрептолизин оказывает разрушающее действие на клетки крови и ткани сердца, эритрогенин вызывает расширение мелких сосудов и обуславливает появление сыпи, например при скарлатине, лейкоцидин разрушает лейкоциты – один из элементов иммунной системы. Кроме того стрептококк выделяет ферменты, способствующие проникновению и распространению его в тканях. Источником инфекции является больной человек, возможно бессимптомное носительство возбудителя. Основной путь передачи стрептококка – воздушно капельный, кроме того возможен контактно-бытовой путь — через грязные руки, загрязненный предметы ухода за больными. Проникновение в организм чаще происходит через слизистую оболочку дыхательных путей (96-97%), возможно заражение через поврежденную кожу или через пупочную ранку у новорожденных. В месте внедрения стрептококка в организм развивается очаг воспаления серозный, гнойный или с омертвением пораженных тканей (некротический). Выделяя особые ферменты, стрептококк преодолевает местные барьеры и проникает в кровь и лимфатическую систему, вызывая образование очагов стрептококковой инфекции в отдаленных органах (сердце, кости и др.), воспаление лимфатических узлов. Токсины, выделяемые стрептококком, вызывают резкий подъем температуры, рвоту, головную боль, нарушения сознания (чаще бывает при скарлатине, роже, сепсисе). Не менее значим и так называемый аллергический синдром: в организме больного развивается аллергическая реакция на компоненты клеточной оболочки стрептококка, в ходе которой собственной иммунной системой повреждаются почки, сердце, суставы. Иммунитет после перенесенной стрептококковой инфекции нестоек, поэтому человек может неоднократно болеть стрептококковыми заболеваниями (исключение составляет один из компонентов – против токсинов вырабатываемых стрептококком, он остается на всю жизнь, обеспечивая защиту от повторного заболевания скарлатиной).
Стрептококк симптомы. Коротко рассмотрим частные проявления стрептококковой инфекции. Скарлатина. Пурпурной лихорадкой называли скарлатину в 17 веке из-за одного из ее проявлений – обильной точечной сыпи. Скарлатина протекает с высокой температурой тела, выраженной интоксикацией. Один из признаков скарлатины – воспаление миндалин (тонзиллит, ангина). Заболевание начинается остро с ознобом, общей слабостью, головной болью, болью в горле при глотании, подъемом температуры тела до 38-39˚. Через 6-12 часов после начала заболевания появляется сыпь, вначале более заметная на кистях, стопах, верхней части туловища. Максимального развития сыпь достигает на 2-3 день заболевания, постепенно исчезая к началу второй недели. Если у человека есть иммунитет против токсинов стрептококка, то заразившись этим возбудителем, человек заболеет не скарлатиной, а ангиной. Ангина – это воспаление миндалин глотки (чаще всего небных). Именно перенесенная ангина, при отсутствии противострептококкового лечения, чаще других заболеваний является причиной развития аутоиммунных процессов, приводящих к поражению сердца и почек. Вероятность заболевания ангиной зависит от состояния местного иммунитета миндалин: чем он ниже – тем больше вероятность заболеть ангиной. Снижение общего иммунитета, под воздействием переохлаждения, неблагоприятных условий окружающей среды также повышает вероятность заболевания ангиной. Преодолев местные защитные барьеры миндалин, стрептококк начинает размножаться и продуцировать различные вещества, вызывающие воспалительный процесс, который может быть по своему характеру катаральным, фолликулярным, лакунарным и некротическим. Проникновение стрептококков и продуктов их жизнедеятельности по лимфатическим путям в лимфатические узлы вызывает их острое воспаление. При недостаточности барьерной функции тканей, окружающих миндалины, стрептококки могут проникать ткани вокруг миндалины, вызывая их воспаление (так называемый перитонзиллит, перитонзиллярный абсцесс), а при проникновении в кровь могут привести к развитию сепсиса. Всасывающиеся в кровь продукты жизнедеятельности стрептококков вызывают нарушение терморегуляции, а также поражение тканей организма и в первую очередь — центральной и периферической нервной системы, почек, печени, кровеносных сосудов, миокарда, и других. Инкубационный период при ангине составляет 1-2 суток. Начало заболевания острое. Чаще всего среди полного здоровья появляются озноб, общая слабость, головная боль, ломота в суставах, боль в горле при глотании. Озноб продолжается в течение 15-30 мин, затем появляется чувство жара. При тяжелых формах болезни озноб продолжается в течение длительного срока, повторяется и на следующие сутки. Головная боль тупая, не имеет определенной локализации, сохраняется в течение 2-3 суток. Ломота в суставах, в пояснице появляется почти одновременно с ознобом и сохраняется в течение 1-2 суток. Боль в горле, вначале незначительная, беспокоит только при глотании, затем постепенно усиливается, становится постоянной, достигает максимальной выраженности на вторые сутки. Сыпи при ангине не бывает. Миндалины при ангине увеличены, с желто-белым гнойным налетом или белыми пузырьками (фолликулами).
Рожа – это не экспрессивное слово, а еще одно заболевание, вызываемое стрептококком. Заболевание имеет как общие признаки инфекции — головная боль, повышение температуры тела до 39-40˚, озноб, слабость, мышечная боль, так и специфический — воспалительное поражение участков кожи. Участок пораженной кожи возвышается над здоровой, имеет яркую равномерную (красную) окраску и четкие границы. В зависимости от тяжести заболевания поражение кожи может ограничиться участком красноты, но, в тяжелых случаях, могут появляться и пузыри и кровоизлияния. Воспаление костного мозга, распространяющееся на все слои кости называют остеомиелитом. Стрептококк может являться его причиной в 6-8% случаев. Заболевание проявляется гнойным поражением костного мозга. Вещество кости отмирает, образуется гнойник, который вскоре прорывается наружу.Крайним проявлением стрептококковой инфекции является сепсис. Это заболевание развивается у людей с резко сниженным иммунитетом. Из первичного очага возбудитель разносится кровью по организму, появляются новые и новые очаги инфекции – гнойники в печени, почках, головном мозге, легких, костях, суставах и т.д. Заболевание может принимать молниеносные формы, с гибелью больного в течение 2-3 дней, но может и длиться годами (так называемый хрониосепсис). Диагностика стрептококковой инфекции Диагноз стрептококковой инфекции ставится на основании симптомов заболевания. Для уточнения характера заболевания (степени реакции организма), а также исключения возможных осложнений больному проводят анализы крови, мочи, электрокардиографию. Для уточнения вида возбудителя проводятся бактериологические исследования – посевы биологического материала с очагов инфекции (напр., мазки с миндалин, очагов на коже, мокроты из легких). Устанавливая диагноз, врач должен отличать заболевания стрептококковой природы от дифтерии (поражение миндалин, похожее на ангину), краснухи и кори (сыпь, похожая на таковую при легких формах скарлатины), инфекционного мононуклеоза (ангина), дерматитов и экземы (сходны с поражением кожи при роже). Стрептококк лечение Лечение стрептококковой инфекции проводится с использованием антибиотиков пенициллинового ряда: бензилпенициллин, ампициллин, бициллин-3 или бицилли-5 на третьи-четвертые сутки после начала лечения пенициллином. Устойчивость против пенициллиновых антибиотиков стрептококки приобрести не способны. При аллергии на пенициллины может быть назначен антибиотик эритромицинового ряда (эритромицин, олеандомицин). Препараты группы сульфаниламидов (сульфадиметоксин, ко-тримоксазол) и тетрациклинов (тетрациклин, доксициклин) не эффективны и не рекомендуются для лечения, их применение может привести к бессимптомному носительству (носитель будет заражать окружающих). К концу лечения антибиотиками назначаются препараты нормализующие микрофлору кишечника (линекс, бактисубтил). Для выведения токсинов из организма необходимо обильное питье до 3-х литров жидкости в сутки (чай, морс, фруктовые соки или просто вода). С лечебной и общеукрепляющей целью принимают витамин С, обладающий способностью укреплять стенки кровеносных сосудов и участвовать в выведении токсинов. Комбинированные препараты с парацетамолом типа колдрекс, терафлю использовать можно, но кратковременно, так как при их применении может возникать видимость благополучия, что служит причиной отказа от лечения и возникновения осложнений. Препараты для полоскания глотки не способны воздействовать не только на стрептококк, находящийся в глубине тканей, но и на поверхности. Поэтому полоскание применяется скорее в гигиенических, чем в лечебных целях. Полоскание более предпочтительно, чем пастилки для рассасывания, так как в первом случае возбудитель вымывается и выводится наружу, а во втором проглатывается. Диета больного человека должна быть легкоусвояемой (организму не надо тратить лишние силы на расщепление пищи), с достаточным количеством витаминов. Народные способы лечения стрептококковой инфекции Народные способы лечения стрептококковой инфекции принесут большую пользу больному человеку, однако в качестве единственного или самостоятельного способа лечения не годятся. Принимая решение об отказе от традиционных (с антибиотиками) способов лечения, человек должен понимать, что берет на себя ответственность за возможное возникновение тяжелых осложнений инфекции. Препараты, применяемые в народной медицине, представлены в основном отварами и настоями лекарственных растений. Это настои ягод, содержащие большое количество витаминов (шиповник, клюква, малина) – их употребление укрепляет защитные силы организма и способствует быстрому выведению токсинов, эту же цель преследует употребление отваров растений с мочегонными свойствами (брусничный лист, толокнянка). Отвары растений, обладающими вяжущими, противовоспалительными и антибактериальными свойствами (кора дуба, кора ивы, ромашка, череда) применяются как внутрь, так и наружно в качестве полосканий и примочек. Тепловые процедуры, например, баню с использованием веников и отваров лекарственных трав, можно проводить в период выздоровления, только без излишеств: перегрев также плохо влияет на организм, как и переохлаждение, механическое воздействие на очаг на коже может привести к обострению процесса. Если рецепт лечения покажется сложным, сомнительным, то от него стоит отказаться в пользу простых проверенных средств. Применяя народные методы, не стоит вдаваться в крайности: так некоторые «народные целители» предлагают использовать в качестве лечения примочки с мочой и даже свежий навоз. Профилактика стрептококковой инфекции заключается в соблюдении правил личной гигиены, гигиены жилища и общественных мест. Закаливание и занятия спортом способствуют укреплению защитных свойств организма. Здоровое, полноценное питание немаловажный компонент защиты от любых заболеваний. Вредные привычки: табакокурение и злоупотребление алкоголем снижают эффективность не только общих и местных защитных барьеров, но и отрицательно влияют на исход заболевания, увеличивая риск осложнений. Своевременная обработка микротравм (например, раствором йода) снизит риск проникновения и развития возбудителя в ране. Если в ближайшем окружении есть больные стрептококковой инфекцией, то они должны быть изолированы на время лечения. Консультация врача . Есть ли прививка от стрептококковой инфекции? Нет, вакцину от бета-гемолитического стрептококка не разрабатывали. Есть вакцина от его «родственника» пневмококка. Можно ли заболевать скарлатиной два раза? Можно, но это скорее в теории. На практике это бывает крайне редко Какая длительность курса приема антибиотика? Нельзя ли отменить пораньше?Стандартный курс антибиотикотерапии составляет 7-10 дней. По усмотрению врача курс может быть сокращен до 5 дней, либо продлен до 2 недель. Самостоятельно сокращать курс настоятельно не рекомендуется. Что эффективней полоскание горла или спреи?Оба способа большой лечебной значимости не имеют. Полоскание более предпочтительно, с гигиенической целью, для удаления продуктов воспаления. В состав спреев часто входят малоэффективные при стрептококковых инфекциях сульфаниламиды. В какие сроки могут возникать осложнения стрептококковой инфекции?Осложнения могут возникать в срок от 1-2 дней до 4 недель. наблюдение за переболевшим и щадящий режим могут продолжаться на срок до 3 месяцев Будьте здоровы Вы и Ваши детки! http (13436) karapyziki.net |
г.Самара, ул. Димитрова 131 [email protected] |
 |





 -спирали и
-спирали и  -слои.
-слои. тупых" концов. После секвенирования фрагменты амплифицировали, после чего соединяли в нуклеотидную последовательность гибридного белка путем их сплавления методом полимеразной цепной реакции (ПЦР). После заключительного этапа синтеза гибридного гена путем лигирования фрагментов искусственный ген клонировали в вектор pGEM-T по рестрикционным сайтам KpnI и SacI. Полученный ген был фланкирован дополнительными рестрикционными сайтами EcoRI на 5
тупых" концов. После секвенирования фрагменты амплифицировали, после чего соединяли в нуклеотидную последовательность гибридного белка путем их сплавления методом полимеразной цепной реакции (ПЦР). После заключительного этапа синтеза гибридного гена путем лигирования фрагментов искусственный ген клонировали в вектор pGEM-T по рестрикционным сайтам KpnI и SacI. Полученный ген был фланкирован дополнительными рестрикционными сайтами EcoRI на 5 -конце и XhoI на 3
-конце и XhoI на 3 (mrr-hsdRMS-mcrBC)
(mrr-hsdRMS-mcrBC)  80dlacZ
80dlacZ - rpsL nupG методом электропорации.
- rpsL nupG методом электропорации.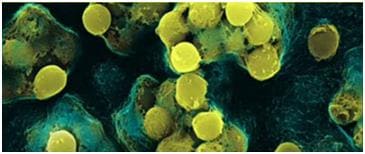
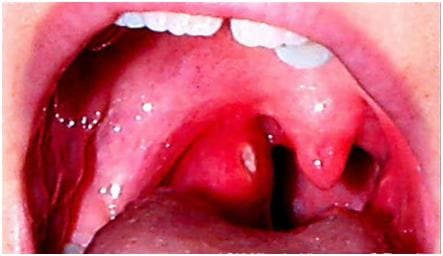
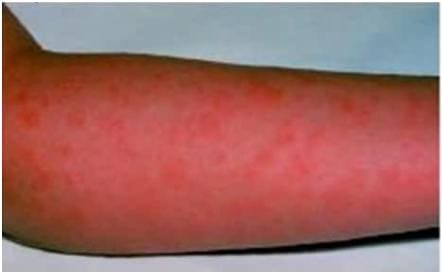
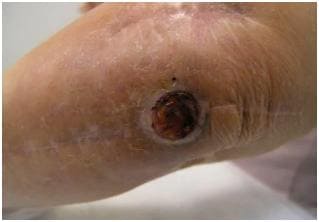 Рожа – это не экспрессивное слово, а еще одно заболевание, вызываемое стрептококком. Заболевание имеет как общие признаки инфекции - головная боль, повышение температуры тела до 39-40˚, озноб, слабость, мышечная боль, так и специфический - воспалительное поражение участков кожи. Участок пораженной кожи возвышается над здоровой, имеет яркую равномерную (красную) окраску и четкие границы. В зависимости от тяжести заболевания поражение кожи может ограничиться участком красноты, но, в тяжелых случаях, могут появляться и пузыри и кровоизлияния.
Рожа – это не экспрессивное слово, а еще одно заболевание, вызываемое стрептококком. Заболевание имеет как общие признаки инфекции - головная боль, повышение температуры тела до 39-40˚, озноб, слабость, мышечная боль, так и специфический - воспалительное поражение участков кожи. Участок пораженной кожи возвышается над здоровой, имеет яркую равномерную (красную) окраску и четкие границы. В зависимости от тяжести заболевания поражение кожи может ограничиться участком красноты, но, в тяжелых случаях, могут появляться и пузыри и кровоизлияния. Мы все слышали о ангине скарлатине, но не задумывались об инфекции которая вызывает эти болезни — стрептококк — давайте поговорим о ней.Стрептококки — это целое семейство микроорганизмов. Под микроскопом они выглядят, как цепочка шариков. Среди этого семейства есть неопасные для человека, однако несколько видов вызывают довольно большое количество опасных заболеваний от пищевых отравлений до гнойных процессов практически в любой точке организма.
Мы все слышали о ангине скарлатине, но не задумывались об инфекции которая вызывает эти болезни — стрептококк — давайте поговорим о ней.Стрептококки — это целое семейство микроорганизмов. Под микроскопом они выглядят, как цепочка шариков. Среди этого семейства есть неопасные для человека, однако несколько видов вызывают довольно большое количество опасных заболеваний от пищевых отравлений до гнойных процессов практически в любой точке организма.











