 |
|
||||||||||
|
Прививка против лептоспироза для: лошадей, свиней, собак, коров, кошек. Вакцина лептоспирозВакцина против лептоспироза: инструкция по применению, дозировкиЛептоспироз относится к числу распространенных болезней, заболеть ей могут не только собаки, но и люди. Особенно часто недуг встречается в дикой природе, так как главным источником болезни являются именно грызуны. Согласно статистическим исследованиям, лептоспироз – нередкий диагноз среди домашних животных, заражение может произойти контактным или алиментарным путем при употреблении, а также попадании на поврежденную кожу и слизистые оболочки зараженной стоячей воды. При этом смертность среди питомцев составляет около 65-90%.
В настоящее время единственный способ защиты организма животного от инфицирования спирохетами лептоспироза – плановая вакцинация крупного рогатого скота, собак, лошадей и свиней. Подобные мероприятия направлены на выработку иммунитета от недуга, продолжительность составляет от шести месяцев до года. Для создания активного типа иммунного ответа против лептоспироза всех предрасположенных к болезни особей рекомендуется прививать, если они:
Патологический процесс и у собак, и у человека имеет острое начало с появлением сильного озноба, поднятием температуры, пожелтением кожи и склер, а также покраснением глаз без симптомов развития конъюнктивита. Также пациенты могут отмечать у себя головные боли, чувство усталости, ломоту в суставах и чувство жажды. Если больному не будет вовремя оказана помощь, тогда заболевание очень быстро переходит в тяжелую форму с развитием ряда осложнений в виде поражения печени, почек, лептоспирозного миокардита и верхних дыхательных путей. Часто страдает центральная нервная система, симптомы нарушения на практике проявляются менингитом и энцефалитом.
Лептоспироз – причина возникновения признаков полиорганной недостаточности, в большинстве клинических случаев и является предпосылкой для летального исхода. В настоящий момент для предупреждения инфицирования недугом разработаны меры пассивной профилактики, а именно запрет купания в стоячих водоемах, особенно, если там могут водиться крысы, а также ограничение контакта с дикими собаками, защита продуктов питания от грызунов в подвалах и хранилищах, работа в перчатках с землей. Но наиболее эффективным методом предупреждения заражения есть вакцинация сельскохозяйственного скота и домашних любимцев от болезни, особенности проведения и график должен быть составлен местным ветеринаром. Общая информацияСегодня для активной профилактики недуга используется поливалентная вакцина «ВГНКИ» против лептоспироза. Предназначается для иммунизации таких представителей фауны, как собаки (особенно охотничьи породы), обитатели зоопарков, пушные зверьки. Существует два типа вакцины:
Во время вакцинации свиней и представителей собачьего семейства пользуются 1-м вариантом вакцины, тогда как в процессе прививания иммунитета против лептоспироза рогатому скоту используют препарат 2-ого типа. Других животных и пушных зверьков принято прививать суспензией, содержащия лептоспиры серогрупп, определенных у зараженных обитателей конкретного хозяйственного предприятия или открытых участков местности.
Лекарство внешне представляет собой прозрачный жидкий состав с хлопьевидным грязно-белым осадком, при взбалтывании хорошо растворяется, превращаясь в однородную взвесь, склонную медленно оседать. Раствор заключен в емкости-флаконы, укупоренные пробками с резины и укрепленные алюминиевыми накладками. Каждая такая герметически закрытая емкость может содержать 17 и 34 (если речь идет о вакцине 1-го типа) или 10 и 20 (2-й тип) профилактических доз. Срок годности вакцины при соблюдении всех правил, регламентирующих условия хранения препарата и его транспортировку, составляет 12 месяцев. По истечению данного временного промежутка (засекается от даты производства, указанной на этикетке) профилактический раствор применять запрещается. Хранить противолептоспирозную прививку необходимо в сухости, где нет доступа солнечному свету, при температуре от 2 до 150 С. Запрещается использовать, если он находится во флаконах сомнительного происхождения без этикетки или указания срока производства, а также при разгерметизации упаковки или, когда остатки профилактической жидкости не использовались на протяжении 12 часов после открытия емкости. Нельзя использовать растворы, механические примеси и нерастворимые при встряхивании хлопья. Непригодные открытые флаконы подлежат обеззараживанию путем 30-ти минутного кипячения и утилизации. Перед использованием емкости с вакциной следует хорошо встряхнуть, до образования гомогенного состава. Биологические свойстваЭффективная вакцина содержит в 1 мл не менее 70 миллионов ослабленных лептоспир каждой из патогенных серогрупп. Ветеринары убеждают, что прививка является абсолютно безвредным и не обладает терапевтическими свойствами, так как предназначен исключительно для профилактики недуга.
Введение прививки обеспечивает образование реактивного ответа уже на 14-20 день после инъекции, они сохраняется у молодых собак на протяжении полугода, а у взрослых особей – не более 12 месяцев. Продолжительность коллостральной протекции у потомства, рожденного от привитых самок, составляет: у ягнят и поросят – около 6 недель, у телят – не более 10-12 недель. Применение прививки дает возможность:
Вакцинирование с помощью ВГНКИ в соответствии с инструкцией и в рекомендуемых дозах не вызывает развитие побочных эффектов и не вредит организму. Особенности примененияВГНКИ предназначен для вакцинирования от лептоспироза собак самых разных видов. С ее помощью иммунизируют крупный рогатый скот, лошадей и верблюдов, а также ослов по достижении ими полтора месячного возраста. Других животных, включая пушных зверьков, рекомендуется прививать уже от месяца и старше. Предупреждение лептоспироза у собак нуждается в первичном введении иммунологического средства в возрасте 8-9 недель, так как до этого времени щенки сохраняют коллостральный иммунитет, полученный с молоком самки. Однако следует учитывать, что напряженная защита от лептоспироза у собак формируется лишь через 14 суток после повторного введения суспензии, то есть в возрасте 1 года. В следствии образования иммунной защиты у собак, они могут смело посещать парки, открытые пространства и места обитания диких зверей. Вакцинации не следует подвергать собак, с повышенными температурными показателями тела или болеющими другими инфекционными заболеваниями, а также самки в последний месяц беременности и первые семь суток после рождения потомства. Прививка вводится интрамышечно и однократно, кроме случаев прививания поросят от 30 до 90 дней, их организм нуждается в двукратном введении раствора. Таблица 1. Схема вакцинации с указанием рекомендованных доз
В целях образования коллострального ответа применение вакцины должно выглядеть следующим образом:
Перед использованием флакона его нужно взболтать, пока в них не образуется однородная суспензия. Прививать собак разрешено только одноразовыми шприцами или инвентарем для многоразового пользования, прошедший необходимую термическую обработку. Для каждого животного следует брать отдельную стерильную иглу. Место инъекции обязательно должно быть обработано 70% спиртовым раствором.
Ветеринары предупреждают, что при отказе соблюдении графика прививания и нарушении условий хранения раствора повышаются риски появления клинических симптомов заболевания или абортов лептоспирозного происхождения. При передозировке возникновение симптомов недуга не наблюдается. На прививки у собак наблюдаются кратковременные патологические реакции:
Как правило, подобные проявления являются временными и самостоятельно проходят, через 1-2 дня, поэтому не нуждаются во врачебном контроле или медикаментозной коррекции. Запрещается прививать следующие категории животных:
Кровь вакцинированных и ревакцинированных зверей не исследуют на предмет лептоспироза в реакции микроагглютинации в течение 8 недель после инъекции. Относительно крупного скота, то этот временной показатель следует увеличить до 90 дней. Мясо и внутренности здорового скота, который был вакцинирован согласно плану, используется в промышленности без ограничений и независимо от времени иммунизации. В момент внепланового убоя поголовья с признаками поствакционных осложнений рекомендовано пользоваться специальным руководством с проведением осмотра убитых животных и санитарно-ветеринарной экспертизы мяса. Личные профилактические меры
При работе с вакцинными средствами следует строго следовать всем рекомендациям и инструкциям, соблюдая все правила индивидуальной безопасности, предусмотренные для персонала, который имеет дело с прививочными материалами и лекарственными средствами. Не смотря на то, что в процессе применения вакцины, специалисту не нужны дополнительные средства защиты, ему необходимо грамотно вести себя, исключая риски попадания биологического материала на кожные и слизистые покровы. В случае попадания капелек вакцины на эпидермальные покровы или оболочки глаз, тогда эти участки нужно немедленно промыть достаточным количеством проточной воды. В случае неосторожного поведения с препаратом, который привел к его введению человеку, место укола необходимо обработать йодным раствором или спиртом. При оказании первой помощи пострадавшему человеку следует обязательно обратиться во врачебное заведение для дальнейшего обследования. privivkumne.ru ВАКЦИНА ПОЛИВАЛЕНТНАЯ "ВГНКИ" ПРОТИВ ЛЕПТОСПИРОЗА ЖИВОТНЫХ . Справочник Видаль 'ВЕТЕРИНАРИЯ' 2004. Описание лекарственного средства. |
Описание лекарственного препарата:
ВАКЦИНА ПОЛИВАЛЕНТНАЯ "ВГНКИ" ПРОТИВ ЛЕПТОСПИРОЗА ЖИВОТНЫХ / NNN
Описание препарата основано на официально утвержденной инструкции по применению и утверждено компанией-производителем для издания 2004 г.
|
| Вакцины | Показатели | ||||||
| Вид вакцинируемых животных | Типы и варианты вирусов, вызывающих заболевание ящуром | Возраст вакцинируемых животных. Профилактическая вакцинация | Возраст вакцинируемых животных. Вынужденная вакцинация | Формирование иммунитета после вакцинации | Продолжительность иммунитета | Срок годности вакцины | |
| Сорбированная моно- и поливалентная (из вируса, выращенного в клетках ВНК-21) | КРС, буйволы, яки, овцы, козы | А, О, С, Азия-1, САТ- 1, САТ-2, САТ-3 | С 4 мес | С 1-го дня (двукратно с интервалом 10...20 дней) | Через 21 день | 6 мес | 18 мес |
| Универсальная сорбированная моно- и поливалентная (из вируса, выращенного в клетках ВНК-21) | КРС, буйволы, яки, овцы, козы | А, О, С, Азия-1, САТ- 1, САТ-2, САТ-3 | Крупный рогатый скот — с 4 мес, свиньи, овцы, козы — с 2 мес | С 1-го дня (однократно удвоенной дозой в две точки) | Через 21 день | 12 мес | 18 мес |
| Эмульсионная моно- и поливалентная (из вируса, выращенного в клетках ВНК-21) | Свиньи | А, О, С, Азия-1, САТ- 1, САТ-2, САТ-3 | С 2...3 мес | С 1-го дня (двукратно, через 10...14 дней) | Через 21 день | 6 мес | 18 мес |
| Вакцина из вируса ящура, культивируемого на эпителии крупного рогатого скота | КРС, буйволы, яки, овцы, козы | Моно-, би- и трехвалентные О, А, С | С 4 мес | С 1-го дня (двукратно, через 10...20 дней) | Через 21 день | 6 мес | 18 мес |
| Генно-инженерная инактивированная вакцина против ящура с/х-ных животных | Все виды восприимчивых животных | А, О, С, Азия-1, САТ- 1, САТ-2, САТ-3 | С 1-го дня, в том числе на фоне колострального иммунитета | С 1-го дня (однократно) | На 1-5 день | 18-24 мес | 24 мес |
Методика применения вакцины
Вакцину вводят строго подкожно крупному рогатому скоту, якам и буйволам в области средней трети шеи, овцам и козам - с внутренней стороны бедра в дозах, указанных на этикетках флаконов.
При проведении прививок необходимо соблюдать правила асептики и антисептики.
На месте введения вакцины поверхность кожи тщательно дезинфицируют 70-процентным раствором этилового спирта. Многоразовые шприцы и иглы перед применением стерилизуют кипячением; для каждого животного используют отдельную иглу.
Порядок применения вакцин
Вакцину применяют с профилактической целью и вынужденно в неблагополучном пункте и в угрожаемой по ящуру зоне при уточнении типа вируса.
В хозяйствах, где вакцину данного серотипа ранее не применяли, иммунизируют всех животных независимо от возраста, а также нарождающийся в течение месяца молодняк.
Ревакцинацию проводят через 2 мес., а затем взрослое поголовье иммунизируют через каждые 6 мес. после первой прививки, молодняк до 18-месячного возраста - через каждые 3 мес. после второй прививки.
Иммунитет у первично привитых животных наступает к 21-му дню, причем при соблюдении интервалов между ревакцинацией и последующими иммунизациями иммунитет к данному серотипу поддерживается постоянно.
Молодняк, родившийся от иммунизированных животных, вакцинируют с 4-месячного возраста, а в последующем по п. 3.2 настоящего Временного наставления.
Лептоспироз
Определение болезни
Остро протекающая природно-очаговая болезнь животных многих видов и человека, проявляющаяся кратковременной лихорадкой, гемоглобинурией или гематурией, геморрагиями, желтушным окрашиванием и очаговыми некрозами слизистых оболочек и кожи, атонией желудочно-кишечного тракта, абортами, маститами, рождением нежизнеспособного потомства, периодической офтальмией и менингоэнцефалитами, снижением продуктивности животных.
Характеристика возбудителя
Возбудители болезни относятся к роду Leptospira (от гр. leptos — легкий, speria — виток). Критерием для классификации патогенных лептоспир служит их антигенный состав. Идентифицировано более 230 сероваров патогенных лептоспир, объединенных на основании антигенного родства в 23 серологические группы. На территории России обнаружено около 30 сероваров. Наиболее часто встречаются следующие: Icterohaemorrhagiae, Canicola, Pomona, Grippotyphosa, Sejroe, Hardjo, Tarassovi.
Лептоспиры — микроорганизмы спиралевидной формы, размером 6-24 х 0,2 мкм. Число завитков спирали достигает 20. Концы микроба изогнуты в виде крючков, что делает их легко узнаваемыми при микроскопии.

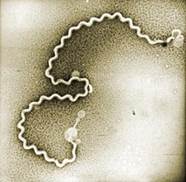
Под микроскопом в темном поле зрения и так называемой раздавленной капле лептоспиры имеют вид тонких, оживленно и разнообразно движущихся серебристых нитей. Лептоспиры культивируются в жидких и плотных питательных средах, содержащих сыворотку крови кролика или барана, сывороточный альбумин, жирные кислоты, многоатомные спирты, витамины группы В. Факторами патогенности лептоспир являются экзо- и эндотоксины, плазмокоагулаза, липаза, фибринолитический фермент, эстераза и др.
Лептоспиры по степени устойчивости к действию факторов внешней среды, физических и химических средств приравниваются к вегетативным формам бактерий. Чувствительны к тетрациклину, пенициллину и стрептомицину.
Исследование
Основанием для подозрения на неблагополучие хозяйства по лептоспирозу служат клинические признаки и патологоанатомические изменения, характерные для этой болезни, обнаружение специфических антител в крови животных. Диагноз лептоспироза во всех случаях должен быть подтвержден лабораторными исследованиями.
Лабораторную диагностику лептоспироза животных проводят в соответствии с действующими Санитарными и ветеринарными правилами. Она основана на комплексе микробиологических и иммунологических методов, которые используются в различных комбинациях. Бактериологические методы исследований включают прямую микроскопию биоматериала, полимеразную цепную реакцию (ПЦР), выделение чистых культур и идентификацию возбудителя, дифференциацию патогенных лептоспир от сапрофитных и биопробу.
Из серологических методов наиболее широко применяется реакция микроагглютинации лептоспир (РМА), которая, кроме того, позволяет определить серогруппу возбудителя. Материалом для прижизненной диагностики служат кровь и моча, для посмертной — трупы мелких животных. От трупов крупных животных и абортированных плодов берут сердце, кусочки паренхиматозных органов, почку, транссудат грудной и брюшной полостей, перикардиальную и спинномозговую жидкости, мочевой пузырь и желудок с содержимым. Патматериал должен быть взят и исследован в течение 6 ч в летнее время и 10-12ч зимой или при условии хранения его в охлажденном состоянии.
По результатам лабораторных исследований хозяйство (ферму, отделение, предприятие, гурт и т. д.) считают неблагополучным по лептоспирозу в одном из следующих случаев:
- культура лептоспир выделена из патологического материала;
- лептоспиры обнаружены при микроскопическом исследовании патологического материала;
- антитела обнаружены в сыворотке крови более чем у 20 % обследованных животных в титре 1: 50 у невакцинированных, 1: 100 и более у вакцинированных.
При выявлении меньшего числа положительных реакций проводят микроскопию мочи. При отрицательном результате микроскопии мочи повторное исследование сыворотки крови и мочи ранее исследованных животных проводят через 15-30 дней. Обнаружение лептоспир или антител при повторном исследовании у животных, не имевших их при предыдущем исследовании, или нарастание титра антител в 4 раза и более свидетельствуют о неблагополучии хозяйства.
Лептоспироз считают причиной аборта (мертворождения) при обнаружении: лептоспир в органах (тканях, жидкостях) плода или околоплодных водах; антител к лептоспирам в сыворотке крови плода в РМА в разведении 1: 5 (с антигеном 1 : 10) и более. Лептоспироз считают причиной гибели животных при наличии клинических признаков и патологоанатомических изменений, характерных для этой инфекции, подтвержденных обнаружением лептоспир в крови или паренхиматозных органах (кроме почек). При дифференциальной диагностике лептоспироза крупного и мелкого рогатого скота следует исключить бруцеллез, пироплазмидозы, злокачественную катаральную горячку, кампилобактериоз, трихомоноз, сальмонеллез, пневмоэнтериты смешанной этиологии и листериоз.
Вакцинация
Переболевание лептоспирозом сопровождается формированием вначале нестерильного, а затем (по окончании срока лептоспироносительства) стерильного иммунитета высокой специфичности, напряженности и значительной продолжительности.
Для создания активного иммунитета всех восприимчивых к лептоспирозу животных вакцинируют:
- в неблагополучных по лептоспирозу хозяйствах;
- в откормочных хозяйствах, где поголовье комплектуют без обследования на лептоспироз;
- при выпасании животных в зоне природного очага лептоспироза;
- при выявлении в хозяйстве животных, сыворотка крови которых реагирует в РМА;
- в районах с отгонным животноводством.
В зависимости от эпизоотической обстановки и вида животных для специфической иммунопрофилактики применяют различные (более 16) поливалентные и ассоциированные вакцины. Для пассивной иммунизации и лечения больных лептоспирозом животных выпускают гипериммунные сыворотки. Иммунитет у животных после введения сыворотки наступает через 4-6 ч и сохраняется 6-8 сут.
Используемые вакцины:
Бешенство
Определение болезни
Бешенство – (лат. — Lyssa; англ. — Rabies; водобоязнь, гидрофобия) — особо опасная острая зооантропонозная болезнь теплокровных животных всех видов и человека, характеризующаяся тяжелым поражением центральной нервной системы, необычным поведением, агрессивностью, параличами и летальным исходом.
Характеристика возбудителя
Бешенство вызывает пулевидной формы РНК-вирус семейства Rhabdoviridae, рода Lyssavirus. Ранее все штаммы вируса бешенства рассматривались как единые в антигенном отношении. В настоящее время установлено, что вирус бешенства имеет четыре серотипа: вирус 1-го серотипа выделен в разных частях света; вирус 2-го серотипа выделен из костного мозга летучей мыши в Нигерии; вирус 3-го серотипа выделен от землеройки и человека; вирус 4-го серотипа выделен от лошадей, комаров и москитов в Нигерии и еще не классифицирован.
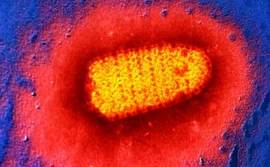
Все варианты вируса в иммунологическом отношении родственны. Эпизоотические штаммы вируса бешенства по вирулентности и другим свойствам разделяют на пять групп.
К 1-й группе относятся усиленные штаммы с высокой вирулентностью, коротким инкубационным периодом болезни (1-2 дня) и постоянным образованием телец Бабеша—Негри.
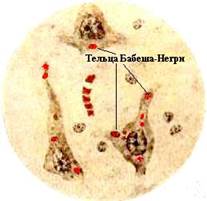
Во 2-ю группу входят три варианта вирусов: а) так называемый Уло-Фато, выделенный от собак, встречается в Африке и характеризуется внезапным изменением поведения и развитием параличей; б) выделенный от крупного рогатого скота в Кадейросе, передаваемый летучими мышами; в) выделенный от погибших людей во время эпидемии бешенства на острове Троице в 1929 г.
К 3-й группы отнесены штаммы, выделенные от песцов и собак при так называемом диковании в северных районах России и Канады.
В 4-ю и 5-ю группы включены вирусы, выделенные от человека. Центральная нервная система является избирательным местом нахождения возбудителя бешенства. В наибольшем титре вирус обнаруживали в головном мозге (аммоновых рогах, мозжечке и продолговатом мозге). После поражения центральной нервной системы возбудитель проникает во все внутренние органы и кровь, кроме сальника, селезенки и желчного пузыря. Вирус постоянно обнаруживают в слюнных железах и тканях глаз.
Культивируют путем интрацеребральных пассажей на кроликах и белых мышах и в ряде культур клеток.
По устойчивости к химическим дезинфицирующим средствам возбудитель бешенства относится к устойчивым (вторая группа). Низкие температуры консервируют вирус, и в течение всей зимы он сохраняется в мозге зарытых в землю трупов животных. Вирус термолабилен: при 60оС инактивируется через 10 мин, а при 100°С — моментально. Ультрафиолетовые лучи убивают его за 5-10 мин. В гниющем материале сохраняется в течение 2-3нед. Аутолитические процессы и гниение вызывают гибель возбудителя в головном мозге трупов в зависимости от температуры через 5-90 дней. Наиболее эффективны следующие дезинфицирующие средства: 2%-ные растворы хлорамина, щелочей или формалина, 4%-ный раствор пероксида водорода, виркон С 1:200 и др.
Вакцинация
Животные, вакцинированные против бешенства, продуцируют вируснейтрализующие, комплемент-связывающие, преципитирующие, антигемагглютинирующие и литические (разрушающие клетки, зараженные вирусом в присутствии комплемента) антитела. Механизм поствакцинального иммунитета окончательно не расшифрован. Полагают, что вакцинация вызывает биохимические изменения, снижающие чувствительность нервных клеток к вирусу.
Сущность искусственной иммунизации при бешенстве сводится к активной выработке антител, которые нейтрализуют вирус в месте проникновения его в организм до внедрения в нервные элементы или при вынужденной иммунизации нейтрализуют вирус на пути к центральной нервной системе. Активизируются также Т-лимфоциты, ответственные за продукцию интерферона. Поэтому при данной болезни возможна постинфекционная вакцинация: вакцинный штамм, проникая в нервные клетки раньше, чем полевой, заставляет их вырабатывать интерферон, который инактивирует вирус дикого бешенства, и антитела, блокирующие специфические клеточные рецепторы.
В ветеринарной практике в настоящее время применяют как живые тканевые и культуральные, так и инактивированные антирабические вакцины (до 84 разновидностей антирабических вакцин в 41 стране мира). Антирабические вакцины классифицируют на три группы: мозговые, которые изготавливают из мозговой ткани животных, инфицированных фиксированным вирусом бешенства; эмбриональные, в которых вируссодержащим компонентом является ткань куриных и утиных эмбрионов; культуральные антирабические вакцины, изготавливаемые из вируса бешенства, репродуцированного в первично-трипсинизированных или перевиваемых клетках ВНК-21/13.
В РФ разработана инактивированная антирабическая вакцина из штамма Щелково-51, репродуцированного в культуре клеток ВНК-21, обладающая высокой иммунизирующей активностью. Для профилактических и вынужденных прививок крупного и мелкого рогатого скота, лошадей, свиней применяют жидкую культуральную («Рабиков») антирабическую вакцину. Разработана универсальная вакцина — для крупного рогатого скота, лошадей, овец, свиней, собак, кошек. В настоящее время ведется работа над созданием генноинженерных (рекомбинантных) вакцин.
Сибирская язва
Определение болезни
Сибирская язва (лат. — Febris carbunculosa; англ. — Anthrax) — особо опасная, острая септическая болезнь животных многих видов и человека, вызываемая Bacillus anthracis, характеризующаяся септицемией, поражением кожи, кишечника, легких, лимфатических узлов и гибелью заболевших животных
Характеристика возбудителя
Возбудитель сибирской язвы — Bacillus anthracis — крупная неподвижная грамположительная спорообразующая аэробная палочка рода Bacillus, семейства Bacillaceae. В организме восприимчивых животных и человека, а также при росте на богатых белком искусственных питательных средах образует капсулу, что характерно для вирулентных штаммов. Споры образуются при неблагоприятных для жизнедеятельности вегетативной формы условиях — вне организма. В невскрытых трупах споры не образуются. Спорообразование обеспечивает сохранение В. athracis как вида.
В мазках из патологического материала бациллы антракса расположены одиночно или попарно, реже — короткими цепочками; в мазках из культур обнаруживают длинные цепочки. В мазках концы палочек в цепочках выглядят обрубленными, а вид цепочек напоминает бамбуковую трость. В. anthracis хорошо растет на обычных питательных средах.
Бациллы антракса обладают сложной антигенной структурой (выделены оболочечный, соматический и капсульный антигены). В организме восприимчивых животных и человека они продуцируют специфический экзотоксин, включающий иммуногенный (протективный) антиген,
воспалительный и летальный факторы.
Вегетативные формы микроба малоустойчивы. В мягких тканях невскрытого трупа они разрушаются под действием протеолитических ферментов через 7 сут, свежее молоко обладает бактериостатическими свойствами в течение 24 ч. При 60°С погибают через 15 мин, при 100°С — мгновенно, под действием прямых лучей солнца — через несколько часов, быстро гибнут при воздействии общепринятыми дезинфицирующими средствами. При —10°С вегетативные клетки выживают 24 дня, в замороженном мясе при —15оС — до 15 дней.
Споры возбудителя сибирской язвы чрезвычайно устойчивы — не погибают в разлагающемся трупном материале, годами сохраняются в воде, десятками лет — в почве. Сухой жар при 120...140°С убивает их через 2...4 ч, а автоклавирование при 120°С — через 5... 10 мин, кипячение — через 15... 30 мин.
По устойчивости к химическим дезинфицирующим средствам споры возбудителя сибирской язвы относятся к особо устойчивым (4-я группа). Для дезинфекции применяют растворы хлорной извести, нейтрального гипохлорита кальция или препарата ДП-2 с содержанием активного хлора 8%; 10%-ный горячий гидроксид натрия, 10%-ный одно-хлористый йод, 37%-ный формальдегид в форме аэрозоля, 20%-ный раствор пероксида водорода с добавлением 5%-ной уксусной кислоты в форме аэрозоля, 7%-ный раствор пероксида водорода, 3%-ный раствор йодеза, бромистый метил, ОКЭБМ
Утилизация вакцины
Утилизацию вакцины, не прошедшей контроль, оставшейся после использования, а также с истекшим сроком годности проводят путем автоклавирования в течение 2 ч при температуре 134°С и давлением 2 атм. с соблюдением требований ГОСТ 17.0.0.01.
Трихофития
Определение болезни
Трихофития (лат. - Trichofitosis, Trochophytia; трихофитоз, стригущий лишай) - грибная болезнь, характеризующаяся появлением на коже резко ограниченных, шелушащихся участков с обломанными у основания волосами или развитием выраженного воспаления кожи, с выделением серозно-гнойного экссудата и образованием толстой корки.
Возбудители болезни
Грибы, относящиеся к роду Trichophyton: Т. verrucosum, Т. mentagrophytes и Т. equinum. Основным возбудителем трихофитии у парнокопытных является Т. verrucosum (faviforme), у лошадей — Т. equinum, у свиней, пушных зверей, кошек, собак, грызунов — Т. Mentagrophytes (gypseum), реже другие виды. Новый вид возбудителя выделен у верблюдов — Т. sarkisovii. В мазках из патологического материала все виды грибов рода Trichophyton имеют большое сходство. Прямые с перегородками гифы мицелия располагаются рядами по длине волоса, а в чешуйках эпителия мицелий ветвящийся, распадающийся на споры, круглые или овальные, в виде цепочек. У основания волоса они нередко образуют чехол, находясь как снаружи, так и внутри волоса. На питательных средах (сусло-агар, агар Сабуро и др.) при температуре 25-28 °С возбудители на 6-40-й день образуют врастающие в субстрат плоские, складчатые, кожистые колонии белого, серого, кремового или темно-желтого цвета. Цвет зависит от вида возбудителя, способности к образованию пигмента, интенсивности его образования и характера распределения в колонии. Молодые культуры имеют более нежную окраску. При микроскопии выявляют разные по форме и величине споры (макро- и микроконидии, артро- и хламидоспоры) и мицелий, характерные для каждого вида. Возбудитель паразитирует в волосах и на коже в виде разветвленного септированного мицелия, который распадается на споры. Находясь под защитой роговых масс волоса, грибы сохраняют свою вирулентность до 4-7 лет, а спора - до 9-12 лет. В помещении последние могут сохраняться годами и переноситься по воздуху. При температуре 60-62 °С возбудитель инактивируется в течение 2 ч, а при 100 оС — в течение 15-20 мин, погибает при воздействии щелочного раствора формальдегида, содержащего 2 % формальдегида и 1 % гидроксида натрия, 10%- ного горячего раствора серно-карболовой смеси при двукратном нанесении через 1 ч.
Вакцинация
Для специфической профилактики с месячного возраста осуществляют вакцинацию телят как в хозяйствах общественной, так и частной собственности.
Всех больных животных, имеющих клинические признаки заболевания изолируют, ставят на привязь и лечат, используя любую из трех имеющихся вакцин: ТФ-130, ТФ-130К или ЛТФ-130. Препараты вводятся внутримышечно с интервалом в 10-14 суток двукратно или трехкратно в двойной дозе по сравнению с профилактической. Иммунитет у привитых телят наступает на 21-30-е сутки после второго введения вакцины и сохраняется не менее чем 7 лет
Если используют вакцину ЛТФ-130, ее разводят из расчета 5 мл растворителя на одну дозу. Место введения выстригают и дезинфицируют 70% этиловым спиртом или 0,5% раствором карболовой кислоты.
Вакцину вводят следующим образом: телятам до 4 месяцев - 10 мл, телятам от 4 до 8 месяцев - 15 мл, животным старше 8 месяцев - 20 мл. Через 10-15 дней после второй инъекции на месте введения образуется корочка диаметром 20 мм, отторжение которой происходит через 20-25 дней. Животным с фолликулярной формой и сильной степенью поражения через 10 дней после второй инъекции вакцину вводят третий раз в тех же дозах. У животных, находящихся в инкубационном периоде, введение вакцины ускоряет проявление клинических признаков болезни, иногда возникают множественные очаги поверхностного характера. Таким животным достаточно ввести однократно лечебную дозу препарата.
При вынужденном убое вакцинированных животных в первые 10 дней после иммунизации мясо используют на общих основаниях после иссечения места инъекции. Через 10 дней после вакцинации убой животных и использование мяса разрешается без ограничений. Молоко от привитых коров также можно использовать.
Туберкулез
Определение болезни
Туберкулез(лат., англ. — Tuberculosis) — тяжелая хроническая болезнь животных многих видов и человека, характеризующаяся образованием в различных органах специфических узелков — туберкулов, подвергающихся казеозному некрозу и обызвествлению.
Биология возбудителя
Возбудитель туберкулеза — Mycobacterium tuberculosis. Род микобактерии включает более 30 различных видов патогенных и непатогенных микроорганизмов. Заболевание туберкулезом вызывают 3 патогенных вида:
1) Mycobacterium tuberculosis (человеческий вид) вызывает заболевание у человека. К
нему восприимчивы также свиньи, кошки, собаки, рогатый скот, пушные звери, а птицы
(кроме попугаев) не восприимчивы;
2) Mycobacterium bovis (бычий вид) вызывает заболевание у всех видов сельскохозяйственных, диких животных, в том числе пушных зверей, а также человека. Птицы не восприимчивы;
3) Mycobacterium avium (птичий вид) вызывает заболевание домашних и диких птиц,
восприимчивы также свиньи; животные других видов и человек заражаются редко.
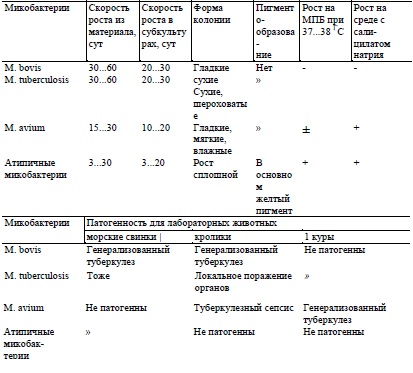
По морфологии и культуральным свойствам микобактерии перечисленных видов во многом сходны между собой. Это тонкие прямые, чаще слегка изогнутые палочки длиной 0,8...5,5мкм, располагающиеся в мазках одиночно или группами. Микобактерии — строгие аэробы, неподвижные, спор не образуют, кислотоспиртоустойчивые; окрашиваются по методу Циля—Нельсена в ярко-красный цвет, тогда как другая микрофлора — в синий цвет. Культивируются на глицериновых МПА, МПБ, яичных и синтетических средах. Растут микобактерии человеческого вида 20...30 сут, бычьего вида — 20...60 сут, птичьего вида — 10...20 сут. При отсутствии роста посевы рекомендуется выдерживать в термостате в течение 3 мес. Видовую принадлежность возбудителя туберкулеза определяют по особенностям роста их на искусственных питательных средах и патогенности отдельных видов возбудителя туберкулеза для лабораторных животных различных видов. В природе кроме туберкулезных существуют условно-патогенные атипичные и сапрофитные микобактерий. Животные, инфицированные ими, могут реагировать на туберкулин для млекопитающих, что вызывает трудности при аллергической диагностике туберкулеза.
Микобактерии весьма устойчивы к воздействиям химических веществ и различных факторов внешней среды. М. bovis в почве и в навозе сохраняет жизнеспособность до 4 лет. В продуктах, полученных от больных животных, возбудитель туберкулеза сохраняется: в молоке до 19 сут, в масле до 300 сут, в сыре 145...200 сут, в мясе замороженном до 1 года, в соленом мясе 60 сут. В трупах крупного рогатого скота и птиц микобактерий сохраняются от 3...6 до 12мес. По данным различных авторов, во влажном состоянии микобактерия туберкулеза погибает при 50оС через 12 ч, при 60°С через 1 ч, при 70°С через 30 мин, при 90°С через 1 мин, при 100 "С мгновенно. Лучшими дезинфицирующими средствами являются 3%-ный щелочной раствор формальдегид (экспозиция 1 ч), взвесь хлорной извести, содержащая 5 % активного хлора, 10%-ный раствор однохлористого йода, 20%-ная взвесь свежегашеной извести (гидроксид кальция), 5%-ный раствор гипохлорида кальция, 1%-ный раствор глутарового альдегида и другие препараты.
Исследование
Диагноз устанавливают на основании анализа эпизоотологических данных, клинических признаков и результатов аллергического, патологоанатомического, гистологического, бактериологического и биологического исследований.
Клинический метод диагностики туберкулеза имеет ограниченное значение, так как в начале заболевания клинические признаки вообще могут отсутствовать. Основной метод прижизненной диагностики туберкулеза — аллергическое исследование. Для исследования применяют аллерген — туберкулин — стерильный фильтрат убитых культур возбудителя туберкулеза двух видов: сухой очищенный (ППД) туберкулин для млекопитающих и ППД-туберкулин для птиц.
Основной метод прижизненной диагностики туберкулеза у животных — аллергическое исследование внутрикожной туберкулиновой пробой. В необходимых случаях применяют глазной метод исследования (офтальмопроба) у крупного рогатого скота одновременно с внутрикожной пробой. Туберкулинизации подвергают крупный рогатый скот (буйволов) с 2-месячного возраста.
Внутрикожная туберкулиновая проба — высокоспецифическая реакция на туберкулез. Однако она зависит от общей иммунореактивности организма. У животных низкой упитанности, старых, глубокостельных, а также при генерализованном туберкулезном процессе реакция на туберкулин может быть слабо выражена или не проявиться (анергия). Следует также учитывать, что иногда возможны неспецифические (пара- и псевдоаллергические) реакции на туберкулин для млекопитающих, обусловленные сенсибилизацией организма микобактериями птичьего вида, возбудителем паратуберкулеза и атипичными микобактериями, а также другими причинами.
Для дифференциации неспецифических реакций применяют симультанную аллергическую пробу, которую проводят одновременно туберкулином для млекопитающих и комплексным аллергеном из атипичных микобактерий (КАМ). Если внутрикожная реакция на введение КАМ выражена более интенсивно, чем на туберкулин млекопитающих, реакцию считают неспецифической, материал от таких животных исследуют на туберкулез лабораторными методами.
Если в благополучном хозяйстве впервые выявляют реагирующих на туберкулин животных, для уточнения диагноза осуществляют убой 3...5 животных с наиболее ярко выраженными реакциями на туберкулин и осматривают внутренние органы и лимфатические узлы. При отсутствии типичных для туберкулеза изменений отбирают кусочки органов и лимфатических узлов, которые направляют в ветеринарную лабораторию на бактериологическое исследование.
Диагноз на туберкулез считается установленным:
1) при выделении культуры возбудителя туберкулеза;
2) при получении положительного результата биологической пробы;
3) у крупного рогатого скота помимо этого диагноз считается установленным при обнаружении в органах или тканях патологических изменений, типичных для туберкулеза.
Бруцеллез
Определение болезни
Бруцеллез — (лат., англ. — Brucellosis; мальтийская лихорадка, болезнь Банга, эпизоотический аборт) — хроническая зоонозная болезнь животных и человека, проявляющаяся у самок в основном абортами, задержанием последа, а у самцов — орхитами и эпидидимитами.
Биология возбудителя
В настоящее время род бруцелл представлен шестью видами, три из которых имеют несколько биоваров.
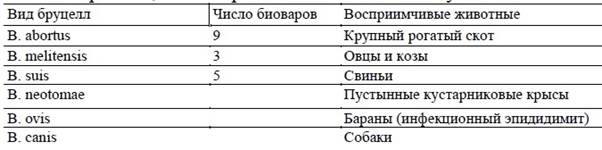
Бруцеллы — мелкие полиморфные микроорганизмы кокковидной, овоидной или палочковидной формы. Они неподвижные, спор не образуют, грамотрицательные, растут на различных питательных средах, но лучше всего — на печеночных средах с добавлением глюкозы, сыворотки или глицерина. Первичные культуры из патматериала растут медленно. Для видовой дифференциации бруцелл учитывают потребности первых генераций их культур в диоксиде углерода, способность к образованию сероводорода, рост в средах с некоторыми анилиновыми красками, агглютинацию моноспецифическими сыворотками, а при определении биоварианта — биохимическую активность и некоторые другие показатели. Установлена L-форма микроорганизмов. Бруцеллы обладают высокой инвазивностью, относятся к внутриклеточным паразитам, имеют глубинный О- и поверхностный S-антигены. Микробы устойчивы во внешней среде, холод их консервирует, в почве они сохраняются около 110 сут, в навозе — от 20 до 70 сут.
Исследование
Диагноз на бруцеллез устанавливают комплексно на основании анализа эпизоотологических данных, клинических признаков, лабораторных и аллергических (у свиней) исследований.
Из эпизоотологических данных учитывают благополучие местности по бруцеллезу, факты приобретения животных из других хозяйств. При клиническом обследовании животных обращают внимание на наличие абортов, задержание последов, эндометритов, а у самцов — бурситов, орхитов.
Для бактериологического исследования в лабораторию посылают патологический материал (плод с плацентой, содержимое бурс, кусочки паренхиматозных органов, кровь, молоко и др.) свежий или консервированный. Одновременно в лабораторию направляют для серологического исследования молоко, сыворотку крови или кровь от абортировавшего или убитого с диагностической целью животного.
Бактериологическая диагностика бруцеллеза предусматривает бактериоскопию мазков из патологического материала и при необходимости постановку биопробы на морских свинках. Бактериоскопия мазков-отпечатков, окрашенных по Граму и специальными методами (по Козловскому, Шуляку—Шину), имеет ориентировочное значение. Выделение культуры бруцелл при посеве биоматериала на специальные питательные среды и положительная биопроба на морских свинках имеют решающее значение при постановке бактериологического диагноза на бруцеллез.
Для массовых профилактических и диагностических прижизненных исследований скота на бруцеллез широко используют РА, РСК, РДСК, РДП и РИД. Применяют также РБП (роз-бенгал проба) и кольцевую реакцию (КР) с молоком коров. Все указанные реакции используют в серологической диагностике бруцеллеза у крупного рогатого скота, яков, зебу, буйволов. Сыворотки крови животных благополучных хозяйств, дающие положительную РБП, сразу же исследуют в РА и РСК для установления титра агглютининов и наличия комплементсвязывающих антител. Кольцевая реакция (КР) с молоком применяется для контроля за благополучием стада по бруцеллезу, положительные результаты необходимо перепроверять по РА, РСК, РДСК. У мелкого рогатого скота, лошадей, верблюдов, оленей используют РА, РСК/РДСК, РБП, а у свиней — аллергический метод.
Диагноз на бруцеллез считают установленным:
1) при выделении культуры бруцелл из биоматериала;
2) при положительной биопробе;
3) при положительных результатах серологических исследований невакциниро-ванных животных в следующих показателях: для крупного рогатого скота (буйволов, яков, зебу), верблюдов и лошадей — РА с наличием антител 200 МЕ/мл и выше, а также при положительных результатах в РИД; для всех видов животных РСК в разведении с
cyberpedia.su
г.Самара, ул. Димитрова 131 [email protected] |
 |







 Состав и форма выпуска: Прозрачная бесцветная жидкость с серо-белым осадком, легко разбивающимся в гомогенную взвесь при встряхивании, образуя медленно оседающую взвесь. В состав препарата входят штаммы Leptospira серогрупп Помона, Тарассови, Гриппотифоза, Сейро. Жидкость расфасована по 100 мл во флаконы, плотно закрытые резиновыми пробками и обкатанные металлическими колпачками.
Состав и форма выпуска: Прозрачная бесцветная жидкость с серо-белым осадком, легко разбивающимся в гомогенную взвесь при встряхивании, образуя медленно оседающую взвесь. В состав препарата входят штаммы Leptospira серогрупп Помона, Тарассови, Гриппотифоза, Сейро. Жидкость расфасована по 100 мл во флаконы, плотно закрытые резиновыми пробками и обкатанные металлическими колпачками.







