|
|
||||||||||
|
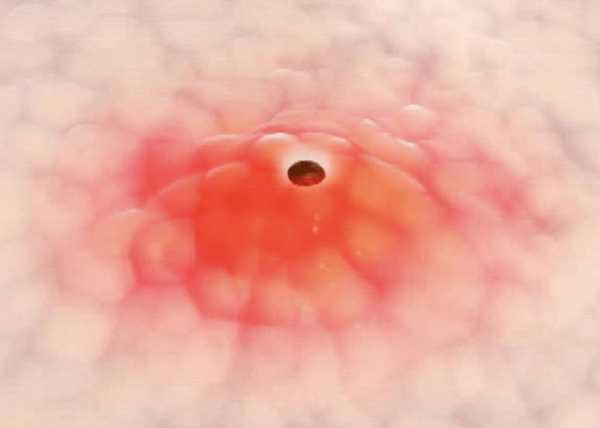
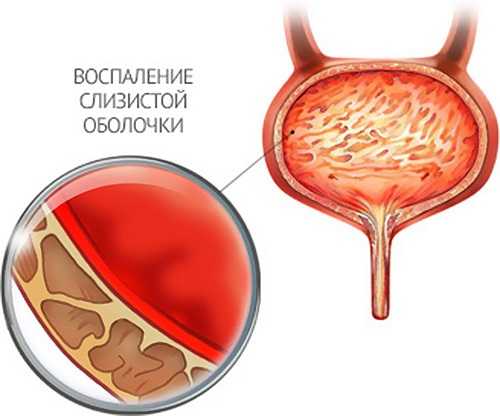
Как наука борется с бактериями, устойчивыми к антибиотикам. Применение антибиотиков привело к возникновению штаммов бактерий устойчивыхБактерии приспосабливаются к антибиотикам | mgzt.ruУченые Института молекулярной генетики РАН изучают свойства устойчивых к антибиотикам микроорганизмов и закономерности их распространения в природе. Об этом нам рассказала ведущий научный сотрудник института доктор биологических наук Софья МИНДЛИН.- К настоящему времени накоплены многочисленные факты, говорящие о том, что интенсивное использование антибиотиков неизбежно приводит к возникновению устойчивых к ним штаммов бактерий. Процесс их возникновения и распространения происходит с огромной скоростью, буквально на глазах исследователей. Для примера: в коллекции Муррея, содержащей 433 штамма кишечной палочки, которые были собраны в 1885-1941 гг., штаммы, устойчивые к антибиотикам, составляли менее 3%. В коллекциях, собранных позднее, содержание таких устойчивых штаммов составляло уже десятки процентов. Из 72 штаммов E.coli из ECOR - коллекции, собранной в период 1973-1983 гг., 18 (25%) были устойчивы по крайней мере к одному антибиотику, и 14 (около 20%) - к двум или более. За какие-нибудь 10-15 лет при продолжающемся интенсивном применении антибиотиков штаммы бактерий, устойчивые одновременно к нескольким различным антибиотикам, практически полностью вытеснили штаммы, устойчивые только к одному из них.Распространение множественной лекарственной устойчивости исследователи наблюдали не только в клинике, но и в сельском хозяйстве, а также среди штаммов бактерий, обитающих в природных источниках. Понимая актуальность проблемы, многие лаборатории мира начиная с конца 70-х годов прошлого столетия, активно включились в работу по изучению моле-кулярно-генетической природы устойчивости к антибиотикам, распространенности в бактериях различных систематических групп. Изучались также механизмы перемещения от одних видов бактерий к другим (так называемый горизонтальный перенос) с помощью различных мобильных элементов (плазмид, транспозонов и интегронов).Устойчивость бактерий к антибиотикам основана на действии различных биохимических механизмов. Большинство из них ученым удалось расшифровать, как, например, реакции энзиматической инактивации молекул антибиотика. Эти механизмы действуют в отношении антибиотиков, которые относятся к самым различным классам химических соединений, таких как бета-лактамы (пенициллины и цефалоспорины), аминогликозиды (стрептомицин, канамицин, гента-мицин), эритромицин, линкомицин и родственные им соединения. Еще один распространенный тип устойчивости связан с изменением структуры молекулы-мишени, с которой связывается антибиотик. В данном случае в результате модификации мишени процесс связывания с ней либо частично, либо полностью нарушается. Подобные механизмы имеют место в отношении антибиотиков, нарушающих функционирование рибосом. К примеру, метилирование рибосомной РНК эффективно защищает бактериальную клетку от летального действия эритромицина. Известна устойчивость микроорганизмов к антибиотикам и другим веществам из-за нарушения проницаемости наружной мембраны бактерий и других механизмов, то есть способы защиты очень разнообразны.Устойчивость бактерий даже к одному антибиотику зависит от действия многих генов. И, следовательно, огромное количество генов задействовано в определении устойчивости к антибиотикам, использующимся в различных областях медицины, ветеринарии и сельского хозяйства. Общее число генов, кодирующих устойчивость к антибиотикам, пока еще неизвестно. Вероятно, оно исчисляется несколькими сотнями. Например, одних только генов устойчивости к тетрациклинам было охарактеризовано более 30, а генов, определяющих устойчивость к макролидным антибиотикам (эритромицину, олеандомицину, линкомицину, стрептограмину), - более 40. Трудности в определении числа генов устойчивости возникают в первую очередь из-за того, что практически идентичным генам часто присваивают разные обозначения, в особенности тогда, когда разные группы исследователей, причем независимо друг от друга, выделяют их из разных бактерий. Но эта ситуация в последние годы постепенно исправляется благодаря интенсивной работе специалистов по систематизации генов устойчивости различных групп и разработке новой номенклатуры.Ученым удалось установить, что детерминанты устойчивости бактерий к антибиотикам, распространившиеся в клинике, происходят по крайней мере из двух источников. Первый из них - это штаммы-продуценты антибиотиков, в основном актиномицеты, содержащие гены устойчивости к собственному антибиотику. Второй - собственные гены микроорганизмов, обеспечивающие нормальный метаболизм бактериальной клетки.Гипотеза о происхождении генов устойчивости к антибиотикам клинических штаммов бактерий от актиномицетов-продуцентов антибиотиков была сформулирована более 30 лет назад. По этой гипотезе, гены устойчивости впервые возникли как необходимый механизм защиты от собственных продуктов метаболизма, а затем попали в геном других бактерий, занимающих различные экологические ниши. Действительно, в геноме многих стрептомицетов-продуцентов были обнаружены гены устойчивости к собственным антибиотикам. Результаты проводимых исследований показали, что гены, гомологичные генам актиномицетов, обнаружены в клинических штаммах бактерий различных систематических групп. Доказательства происхождения генов устойчивости патогенных бактерий от соответствующих генов продуцентов антибиотиков были получены, например, в исследованиях структуры детерминант устойчивости к тетрациклину. Интересно отметить, что тетрациклины начали использовать для лечения кожных инфекций, вызываемых быстрорастущими микобактериями, лишь в конце 70-х годов. Проводимые экспериментальные работы позволяют ученым сделать вывод о том, что по крайней мере часть генов устойчивости, распространившихся в последнее время у клинических штаммов бактерий, произошла от детерминант устойчивости продуцентов антибиотиков (или имеет с ними общее происхождение). Причем можно говорить об очень древнем происхождении этих детерминант. По-видимому, они попали в клетки бактерий, обитающих в организме человека и животных путем горизонтального переноса с помощью таких мобильных элементов микроорганизмов, как плазмиды и транспозоны. Широкое распространение детерминант устойчивости к антибиотикам у клинических штаммов бактерий соотносят, как правило, с присутствием и свойствами различных мобильных элементов. Первоначально в качестве таковых рассматривали именно плазмиды и транспозоны, найденные в бактериях различных систематических групп. Позднее были открыты конъюгативные транспозоны и подробно исследована их роль в переносе генов между грамположительными и грамотрицательными бактериями. Но все-таки основные механизмы, определяющие возникновение и распространение множественно устойчивых штаммов бактерий, и масштабы этого явления стали понятными лишь в последние годы благодаря открытию таких элементов микроорганизмов, как интегроны, и изучению их структуры.Интегроны - природные системы горизонтального переноса генов, обладающие способностью к захвату фрагментов чужеродной ДНК, и, как теперь стало ясно, играющие ключевую роль в распространении генов устойчивости к лекарственным препаратам, а также в эволюции бактериальных геномов. Исследование интегронов в настоящее время переживает настоящий бум. Об этом можно судить по лавинообразному увеличению числа публикаций, посвященных изучению разнообразия интегронов и генных кассет, их функционированию и путям распространения среди клинических штаммов бактерий. Важнейшим свойством интегронов является их способность интегрировать и экспрессировать новые гены. Интегроны состоят из двух частей: интегронной платформы и так называемых кассет или кассетных генов. Более 70 различных кассет содержат гены, определяющие устойчивость к большинству классов антибиотиков, используемых в медицине: бета-лактамам, аминогликозидам, хлорамфениколу, триметоприму, эритромицину и рифампицину.Происхождение генов устойчивости, входящих в состав интегронов, несмотря на многочисленные исследования их структуры и механизмов интеграции, в значительной мере остается загадочным. В отличие от обычных, гены, входящие в состав этих мобильных элементов, лишены собственных промоторов. Поэтому для ученых очень важно знать, имеют ли кассетные гены устойчивости к антибиотикам свои аналоги среди автономно функционирующих генов. Анализ литературных данных свидетельствует о том, что родственные гены могут существовать в двух ипостасях: в виде активных генов и в виде генов кассетных, и следовательно, они должны иметь общее происхождение. В нескольких случаях ученым удалось идентифицировать в составе интегронов кассетные гены, определяющие устойчивость к таким новым антибиотикам, как имипенем, амикацин и нетилмицин.Анализируя литературные данные, ученые Института молекулярной генетики РАН обнаружили несомненную временную связь между введением в лечебную практику новых антибиотиков и возникновением и повсеместным распространением устойчивых к ним клинических штаммов бактерий. При этом было замечено: чем больше проходило времени, тем чаще выделяли штаммы, отмеченные множественной лекарственной устойчивостью, а штаммы, устойчивые к одному или нескольким антибиотикам, встречались всё реже. Параллельно происходили и процессы возникновения и распространения штаммов, несущих детерминанты устойчивости в составе интегронов, а также процессы формирования этих мобильных элементов, содержащих разнообразные наборы кассет.В ряде случаев удалось продемонстрировать зависимость между встречаемостью в составе интегронов генных кассет, определяющих устойчивость к различным антибиотикам, и временем внедрения этих антибиотиков в медицинскую практику. Например, в составе интегронов, обнаруженных при исследовании 59 устойчивых штаммов Enterobacteriaceae, генные кассеты устойчивости к стрептомицину встречались с частотой 81,4%; кассеты устойчивости к хлорамфени-колу - с частотой 30,5%; к канамицину - с частотой 22%. Частота кассет, контролирующих устойчивость к гентамицину, составляла 16,9%. В той же последовательности (1944, 1947, 1957 и 1963 гг.) были открыты названные антибиотики.В 60-70-е годы прошлого века накопилось множество фактов, свидетельствующих о роли плазмид преимущественно крупных, в процессе быстрого распространения в клинике устойчивых штаммов бактерий. И тогда закономерно встал вопрос о происхождении этих плазмид: либо они изначально присутствовали в клетках патогенных бактерий (до применения антибиотиков), а затем просто произошло увеличение их численности, либо они сформировались в условиях интенсивного использования различных антибиотиков. Для ответа на этот вопрос специалистам пришлось повторно исследовать штаммы энтеробактерий из коллекции Муррея, выделенные в годы, предшествующие открытию и применению антибиотиков. Был сделан однозначный вывод о том, что начало процесса возникновения и распространения плазмид с генами лекарственной устойчивости следует приурочить к первым годам использования антибиотиков в медицинской практике.Исследования, выполненные в лабораториях разных стран, показали, что формирование плазмид, несущих гены множественной лекарственной устойчивости, происходило путем внедрения в их ДНК всевозможных мобильных элементов, преимущественно транспозонов и интегронов, и специалистам удалось проследить этапы данного процесса во времени. К примеру, при ретроспективном анализе структуры конъюгативных плазмид Salmonella enterica Typhimurium было установлено, что формирование и повсеместное распространение штаммов сальмонелл, имеющих множественную лекарственную устойчивость, произошло в результате нескольких последовательных актов встраивания интегронов, несущих различные наборы генов устойчивости, в геном этих плазмид.В дальнейшем ученые неоднократно наблюдали, как по мере внедрения в медицинскую практику новых антибиотиков неизменно появлялись плазмиды, содержащие интегроны с генами, обеспечивающими устойчивость бактерий к этим антибиотикам. В плазмидах «современных» штаммов бактерий специалисты обычно обнаруживают элементы, содержащие длинные цепочки генов устойчивости, иногда до 9 генов. В настоящее время благодаря использованию новых молекулярных методов ученым удалось полностью расшифровать молекулярно-генетическую структуру многих сложных плазмид, обнаруженных в устойчивых штаммах бактерий.Анализ данных, полученных в результате многолетних исследований, позволяет сформулировать положение о существовании по крайней мере двух путей происхождения генов устойчивости: от генов продуцентов антибиотиков, в основном актиномицетов, и от собственных генов бактерий, включая клинические штаммы. Первые, несомненно, имеют очень древнее происхождение. По-видимому, первоначально они были локализованы в хромосомах актиномицетов-продуцентов и только впоследствии могли оказаться в составе мобильных элементов, таких как плазмиды и транспозоны.Скорее всего, первыми из микроорганизмов, которые приобрели чужеродные для них гены устойчивости еще в глубокую старину, были почвенные или водные бактерии, обитающие рядом с актиномицетами-продуцентами антибиотиков, в том же микробиоценозе. Бактерии, обитающие в организме человека и животных, приобрели детерминанты устойчивости, вероятнее всего, от бактерий окружающей среды, а за последние 50-60 лет в связи с интенсивным использованием антибиотиков их содержание в популяциях многократно увеличилось.Об очень давнем происхождении детерминант устойчивости говорят такие факты, как высокий уровень дивергенции между генами продуцентов и генами, распространенными в клинических штаммах бактерий, а также результаты исследований обширных семейств родственных генов.В отличие от детерминант устойчивости, происходящих от актиномицетов, детерминанты, происходящие от собственных генов бактерий (некоторые из них), возникли и продолжают возникать в ответ на использование антибиотиков, то есть в самое последнее время. Ученые пришли к выводу, что перенос генов между грамположительными и грамотрицательными бактериями происходит постоянно и с очень высокой частотой в естественной среде обитания бактерий, а не только в лабораторных условиях, как предполагалось еще сравнительно недавно.Уже очевидно, что ведущая роль в формировании блоков генов множественной лекарственной устойчивости принадлежит интегронам. Но, безусловно, ряд важнейших вопросов происхождения и эволюции детерминант устойчивости, в основном касающихся происхождения интегронов и генных кассет, остаются до сих пор недостаточно исследованными. В частности, отсутствуют сведения о существовании интегронов с генами устойчивости в доантибиотическую эру. Пока неизвестно, могли гены акти-номицетов непосредственно включаться в состав мобильных элементов бактерий или нет?Можно лишь надеяться на то, что многие вопросы будут решены в недалеком будущем, поскольку исследования в этой области интенсивно идут во многих лабораториях мира.ПодготовилаТатьяна КУЗИВ,корр. «МГ». www.mgzt.ru Как наука борется с бактериями, устойчивыми к антибиотикам — Российская газетаМы думали, что после открытия пенициллина больше не будем бояться микробов. Но мы ошибались. Это напоминает настоящую войну. Человек изобретает всё новые средства обороны от бактериальных атак. В ответ микроорганизмы совершенствуют оружие, тренируют бойцов, используют средства маскировки и диверсионные группы. Проблема инфекций, устойчивых к антибиотикам, стала настолько серьёзной, что недавно ей посвятили специальное заседание Генеральной Ассамблеи ООН. Согласно представленным данным, из-за лекарственно-устойчивых инфекций ежегодно умирают минимум 700 000 человек. Не поддающиеся истреблению микробы встали в один ряд с глобальным изменением климата и прочими проблемами планетарных масштабов. Зимой 2003 года у Рики Ланнетти, успешного 21-летнего футболиста, начался кашель, а затем тошнота. Через несколько дней мама Рики заставила сына обратиться к врачу. Все симптомы указывали на вирус гриппа, поэтому тот не прописал Рики антибиотики, ведь они убивают бактерии, а не вирусы. Но болезнь не проходила, и мать отвезла Рики в местную больницу - к этому моменту у юноши уже отказывали почки. Ему назначили два сильнодействующих антибиотика: цефепим и ванкомицин. Но меньше чем через сутки Рики умер. Анализы показали, что убийцу звали метициллин-резистентный золотистый стафилококк (MRSA) - токсичная бактерия, устойчивая ко множеству антибиотиков. Такие штаммы, как MRSA, сегодня называют супермикробами. Подобно героям ужастикам, они мутируют и приобретают сверхспособности, позволяющие противостоять врагам - антибиотикам. Конец эры антибиотиковВ 1928 году, вернувшись из отпуска, британский биолог Александр Флеминг обнаружил, что оставленные им по невнимательности чашки Петри с бактериальными культурами заросли плесенью. Нормальный человек взял бы да и выбросил её, но Флеминг принялся изучать, что же случилось с микроорганизмами. И выяснил, что в тех местах, где есть плесень, нет бактерий-стафилококков. Так был открыт пенициллин. Флеминг писал: "Когда я проснулся 28 сентября 1928 года, то, конечно, не планировал совершить революцию в медицине, открыв первый в мире антибиотик, но, полагаю, именно это я и сделал". Британский биолог за открытие пенициллина в 1945-м году получил Нобелевскую премию по физиологии и медицине (вместе с Говардом Флори и Эрнстом Чейном, которые разработали технологию очистки вещества). Современный человек привык к тому, что антибиотики - доступные и надёжные помощники в борьбе с инфекционными болезнями. Ни у кого не вызывает паники ангина или царапина на руке. Хотя лет двести назад это могло привести к серьёзным проблемам со здоровьем и даже к гибели. XX век стал эпохой антибиотиков. Вместе с вакцинацией они спасли миллионы, а может, и миллиарды человек, которые непременно погибли бы от инфекций. Вакцины, слава богу, исправно работают (общественное движение борцов с прививками медики всерьёз не рассматривают). А вот эпоха антибиотиков, похоже, подходит к концу. Враг наступает. Как рождаются супермикробыОдноклеточные существа начали осваивать планету первыми (3, 5 миллиарда лет назад) - и непрерывно воевали друг с другом. Потом появились многоклеточные организмы: растения, членистоногие, рыбы… Те, кто сохранил одноклеточный статус, задумались: а что, если покончить с междоусобицей и начать захват новых территорий? Внутри многоклеточных безопасно и много еды. В атаку! Микробы перебирались из одних существ в другие, пока не добрались до человека. Правда, если одни бактерии были "хорошими" и помогали хозяину, то другие только причиняли вред. Люди противостояли этим "плохим" микробам вслепую: вводили карантин и занимались кровопусканием (долгое время это был единственный способ борьбы со всеми болезнями). И только в XIX веке стало ясно, что у врага есть лицо. Руки стали мыть, больницы и хирургические инструменты - обрабатывать дезинфицирующими средствами. После открытия антибиотиков казалось, что человечество получило надёжное средство борьбы с инфекциями. Но бактерии и другие одноклеточные не захотели покидать тёплое местечко и стали приобретать устойчивость к лекарствам. Супермикроб может по-разному противостоять антибиотику. Например, он способен вырабатывать ферменты, которые разлагают препарат. Иногда ему просто везёт: в результате мутаций становится неуязвимой его мембрана - оболочка, по которой раньше лекарства наносили сокрушительный удар. Устойчивые бактерии рождаются по-разному. Иногда в результате горизонтального переноса генов вредные для человека бактерии заимствуют у полезных средства защиты от лекарств. 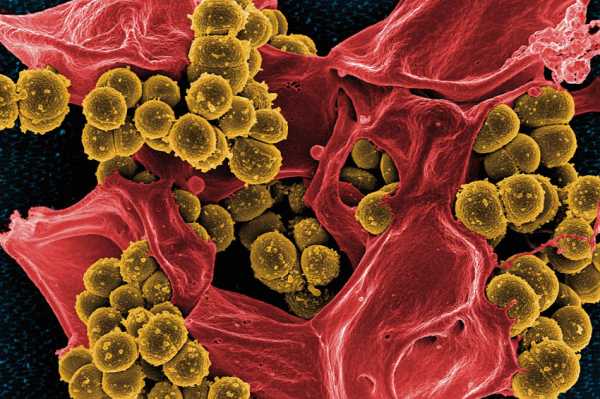 Ещё одно, более реалистичное изображение метициллин-резистентного золотистого стафилококка (MRSA). С каждым годом он распространяется всё шире, особенно внутри больниц и среди людей с ослабленным иммунитетом. По некоторым данным, в США этот микроб ежегодно убивает около 18 тысяч человек (точное число заболевших и умерших определить пока невозможно). Фото: "Кот Шрёдингера" Порой человек сам превращает организм в центр по тренировке бактерий-убийц. Допустим, мы лечим пневмонию с помощью антибиотиков. Врач предписал: принимать лекарство нужно десять дней. Но на пятый всё проходит и мы решаем, что хватит травить организм всякой гадостью и прекращаем приём. К этому моменту мы уже перебили часть бактерий, наименее устойчивых к препарату. Но самые крепкие остались живы и получили возможность размножаться. Так, под нашим чутким руководством заработал естественный отбор. "Лекарственная устойчивость является естественным явлением эволюции. Под воздействием противомикробных препаратов наиболее чувствительные микроорганизмы погибают, а резистентные остаются. И начинают размножаться, передавая устойчивость своему потомству, а в ряде случаев и другим микроорганизмам", - поясняет Всемирная организация здравоохранения. - Возникновению лекарственной устойчивости способствует то, что многие антибиотики можно купить в аптеке без рецепта врача. Да и сами врачи часто перестраховываются и необоснованно выписывают эти препараты. Допустим, поднялась у человека температура - ему тут же антибиотики дают, не сделав анализы и не разобравшись, что её вызвало, - рассказывает профессор ММСУ Юрий Венгеров (врач-инфекционист, доктор медицинских наук, соавтор книг "Инфекционные и паразитарные болезни", "Заразные болезни", "Тропические болезни. Руководство для врачей", "Лекции по инфекционным болезням"). - Особенно активно селекция микробов происходит в больницах. Там контактируют люди с разными инфекциями, там принимают много антибиотиков. В итоге сейчас стала широко распространятся больничная пневмония и другие внутрибольничные инфекции. Речь идёт не только о бактериальных заболеваниях, но и, например, о грибковых. Среди грибов уже 30% приобрели устойчивость к лекарствам. Одноклеточные атакуютОсенью 2016 года в Нью-Йорке идёт заседание Генеральной Ассамблеи ООН, в котором участвуют представители 193 стран, то есть фактически вся планета. Обычно здесь обсуждают вопросы войны и мира. Но сейчас речь не о Сирии, а о микробах, выработавших устойчивость к лекарствам. "Мировые лидеры продемонстрировали беспрецедентное внимание к проблеме сдерживания инфекций, устойчивых к противомикробным препаратам. Имеется в виду формирование у бактерий, вирусов, паразитов и грибков способности сопротивляться действию препаратов, которые раньше использовались для их уничтожения и лечения вызванных ими болезней. Впервые главы государств приняли на себя обязательство предпринять масштабные и координированные действия по борьбе с первопричинами развития устойчивости к противомикробным препаратам сразу в целом ряде сфер, прежде всего в сферах здравоохранения, охраны здоровья животных и сельском хозяйстве. Это лишь четвёртый в истории случай, когда вопрос здравоохранения был поднят Генеральной Ассамблеей ООН", - сообщает сайт ВОЗ. Прогноз мрачный. "Пациентам становится всё сложнее излечиваться от инфекций, поскольку уровень устойчивости патогенных микроорганизмов к действию антибиотиков и, что ещё хуже, антибиотиков резервного ряда стабильно растёт. В сочетании с чрезвычайно медленной разработкой новых антибиотиков это повышает вероятность того, что респираторные и кожные инфекции, инфекции мочевых путей, кровотока могут стать неизлечимыми, а значит, смертельными", - поясняет доктор Недрет Эмироглу из Европейского бюро ВОЗ. - К этому списку заболеваний я бы обязательно добавил малярию и туберкулёз. В последние годы бороться с ними становится всё труднее, поскольку возбудители приобрели устойчивость к лекарствам, - уточняет Юрий Венгеров. Примерно о том же говорит помощник генерального директора ВОЗ по безопасности здравоохранения Кейджи Фукуда: "Антибиотики теряют эффективность, так что обычные инфекции и небольшие травмы, которые излечивались в течение многих десятилетий, сейчас снова могут убивать".  Модель бактериофага, поражающего микроба. Эти вирусы внедряются в бактерий и вызывают их лизис, то есть растворение. Хотя бактериофаги были открыты в начале XX века, только сейчас их стали включать в официальные медицинские справочники. Фото: "Кот Шрёдингера" - Бактерии начали сопротивляться особенно рьяно, когда антибиотики стали в огромных количествах применяться в больницах и в сельском хозяйстве, - уверяет биохимик Константин Мирошников (доктор химических наук, руководитель лаборатории молекулярной биоинженерии Института биоорганической химии им. Академиков М.М. Шемякина и Ю.А. Овчинникова РАН). - Например, чтобы остановить болезни у цыплят, фермеры используют десятки тысяч тонн антибиотиков. Зачастую для профилактики, что позволяет бактериям узнать врага поближе, привыкнуть к нему и выработать устойчивость. Сейчас применение антибиотиков стали ограничивать законодательно. Считаю, что общественное обсуждение таких вопросов и дальнейшее ужесточение закона позволят замедлить рост устойчивых бактерий. Но не остановят их. - Возможности создания новых антибиотиков почти исчерпаны, а старые выходят из строя. В какой-то момент мы окажемся бессильны перед инфекциями, - признаёт Юрий Венгеров. - Тут ещё важно понимать, что антибиотики превращаются в лекарство только тогда, когда существует доза, способная убить микробов, но при этом не навредить человеку. Вероятность найти такие вещества всё меньше и меньше. Враг победил?Всемирная организация здравоохранения периодически публикует панические заявления: мол, антибиотики первого ряда перестают действовать, более современные тоже близки к капитуляции, а принципиально новые препараты пока не появились. Война проиграна? - Бороться с микробами можно двумя способами, - говорит биолог Денис Кузьмин (кандидат биологических наук, сотрудник учебно-научного центра ИБХ РАН). - Во-первых, искать новые антибиотики, воздействующие на конкретные организмы и мишени, ведь именно антибиотики "большого калибра", поражающие разом целый букет бактерий, вызывают ускоренный рост резистентности. Например, можно конструировать лекарства, которые начинают действовать только при попадании внутрь бактерии с определённым обменом веществ. Причём производителей антибиотиков - микробов-продуцентов - нужно искать в новых местах, активнее задействовать природные источники, уникальные географические и экологические зоны их обитания. Во-вторых, следует разрабатывать новые технологии получения, культивирования продуцентов антибиотиков. Эти два способа уже реализуются. Разрабатываются новые методы поиска и проверки антибиотиков. Микроорганизмы, которые могут стать оружием нового поколения, ищут повсюду: в гниющих растительных и животных остатках, иле, озёрах и реках, воздухе… Например, учёным удалось выделить антимикробное вещество из слизи, которая образуется на коже лягушки. Помните древнюю традицию класть лягушку в крынку с молоком, чтобы оно не скисало? Сейчас этот механизм изучили и пытаются довести до медицинской технологии. Ещё пример. Совсем недавно российские учёные из НИИ по изысканию новых антибиотиков им. Г.Ф. Гаузе исследовали жителей съедобных грибов и нашли несколько потенциальных поставщиков новых лекарств. Другим путём пошли учёные из Новосибирска, работающие в российско-американской лаборатории биомедицинской химии ИХБФМ СО РАН. Им удалось разработать новый класс веществ - фосфорилгуанидины (выговорить сложно, да и записать нелегко). Это искусственные аналоги нуклеиновых кислот (точнее, их фрагментов), которые легко проникают в клетку и вступают во взаимодействие с её ДНК и РНК. Такие фрагменты можно создавать под каждый конкретный патоген на основе анализа его генома. Возглавляет проект американец Сидней Альтман (лауреат Нобелевской премии по химии 1989 года (вместе с Томасом Чеком). Профессор Йельского университета. В 2013-м получил российский мегагрант и стал работать в Институте химической биологии и фундаментальной медицины СО РАН). Но самые популярные направления поиска средств против инфекций - это бактериофаги и антимикробные пептиды. Союзники из лужиС высоты птичьего полёта здание ИБХ РАН выглядит как двойная спираль ДНК. А сразу за воротами стоит непонятная скульптура. Табличка поясняет, что это комплекс антибиотика валиномицина с ионом калия посередине. Пятьдесят лет назад сотрудники института поняли, как связываются друг с другом ионы металлов и как проходят потом сквозь оболочку клетки благодаря ионофорам. Сейчас в ИБХ занимаются и другой темой - бактериофагами. Это особые вирусы, которые избирательно атакуют бактерии. Руководитель лаборатории молекулярной биоинженерии Константин Мирошников ласково называет своих подопечных-бактериофагов зверюшками. - Фаги хороши и одновременно плохи тем, что действуют на конкретный патоген. С одной стороны, мы целимся только в те микробы, которые мешают жить, и не беспокоим остальных, а с другой - на поиски нужного фага требуется время, которого обычно не хватает, - улыбается завлаб. И бактерии, и бактериофаги есть в каждой луже. Они постоянно сражаются друг с другом, но уже миллионы лет ни одна сторона не может победить другую. Если человек хочет одолеть бактерий, которые атакуют его организм или картошку на складе, нужно в место размножения бактерий доставить больше соответствующих бактериофагов. Вот метафора, к примеру: когда осваивали побережье Золотых песков в Болгарии, там было много змей, тогда привезли много ежиков и те быстро сместили равновесие фауны. - Два года назад мы начали сотрудничать с агропарком "Рогачёво" под Дмитровом. Генеральный директор организации Александр Чуенко - бывший электронщик и просвещённый капиталист, не чуждый научному подходу, - рассказывает Константин. - Урожай картошки подъедали пектолитические бактерии - мягкая гниль, которая живёт на складах. Если проблему не решать, картофель быстро превращается в тонны вонючей жижи. Обработка картошки фагами как минимум резко замедляет развитие инфекции - продукт дольше сохраняет вкус и товарный вид как в хранилище, так и на полках магазина. При этом фаги атаковали гнилостных микробов и биодеградировали - распались на частицы ДНК, белки и пошли на корм другим микроорганизмам. После успешных испытаний руководство нескольких крупных агрокомплексов заинтересовалось такой биозащитой урожая. - Как вам удалось найти нужные бактериофаги и превратить их в противоядие? - спрашиваю я, поглядывая на игрушечного фага, стоящего на стопке книг. - Для поиска есть классический метод двойного агара. Вначале на первый слой агара в чашке Петри стелите эдакий газон из бактерий, сверху льете воду из лужи и закрываете вторым слоем агара. Через какое-то время на этом мутном газоне появляется чистое пятно, значит, фаг сожрал бактерию. Мы выделяем фаг и изучаем его. Лаборатория Мирошникова вместе с российскими и зарубежными коллегами получила грант РНФ на исследования и диагностику патогенов картофеля. Тут есть над чем работать: растительные бактерии изучены гораздо хуже человеческих. Впрочем, с нашим организмом тоже много неясного. По словам учёных, врачи не так обследуют человека: все анализы и осмотры заточены под антибиотики, а для фаговой терапии нужны другие методы. - Фаготерапия - это не лекарство в нынешнем понимании, а скорее комплексная услуга, которая включает быструю диагностику и подбор нужного средства против конкретного патогена. В России препараты фагов входят в список лекарственных средств, но не упомянуты в методических рекомендациях для терапевтов. Так что врачи, которые в теме, вынуждены применять фаги на свой страх и риск. А в Польше, например, законодательство гласит, что, если пациента нельзя вылечить методами традиционной доказательной медицины, можно применять хоть танцы с бубном, хоть гомеопатию, хоть фаговую терапию. И во вроцлавском институте имени Гиршфельда фаги применяют в качестве персонализированной медицинской помощи. Причём с большим успехом, даже в случае запущенных гнойных инфекций. Применение фагов - научно обоснованный и биологически понятный, хотя и не банальный метод, - подытоживает Мирошников.  Пептиды - это семейство веществ, состоящих из остатков аминокислот. В последнее время учёные всё чаще рассматривают пептиды как основу для будущих лекарств. Речь идёт не только об антибактериальных средствах. Например, в МГУ им. М.В. Ломоносова и НИИ молекулярной генетики РАН был создан пептидный препарат, который нормализует работу мозга, улучшает память, внимание и устойчивость к стрессу. Фото: "Кот Шрёдингера" А вот новость из наукограда Пущино. Учёные из филиала ИБХ РАН, Института теоретической и экспериментальной биофизики РАН и Института биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН исследовали, как фермент бактериофага Т5 действует на кишечную палочку. То есть работали не с самими бактериофагами, а с их белками-ферментами. Эти ферменты разрушают клеточные стенки бактерий - они начинают растворяться и гибнуть. Но у некоторых микробов есть надёжная наружная мембрана, и этот метод на них не действует. В Пущине решили в помощь ферменту привлечь вещества, которые увеличивают проницаемость мембраны. В результате экспериментов на культурах клеток кишечной палочки учёные выяснили, что вместе фермент и агент уничтожают бактерии намного эффективнее, чем по отдельности. Количество выживших клеток удалось уменьшить чуть ли не в миллионы раз относительно контрольного опыта. В качестве вещества-помощника использовали дешёвые распространённые антисептики, такие как хлоргексидин, причём в очень низких концентрациях. Фаги можно использовать не только в качестве лекарства, но и как средство, повышающее эффективность прививок. - В рамках проекта, получившего поддержку Министерства образования и науки России, мы собираемся применить белки бактериофагов для усиления иммуногенных свойств искусственного антигена, - рассказывает микробиолог Андрей Летаров (доктор биологических наук, заведующий лабораторией вирусов микроорганизмов Института микробиологии им. С.Н. Виноградского ФИЦ Биотехнологии РАН). - Для этого фрагменты антигена методами генной инженерии сшивают с некоторыми белками бактериофагов, которые способны собираться в упорядоченные структуры, например в трубочки или сферы. Как объясняет учёный, такие структуры своими свойствами напоминают частицы патогенных вирусов, хотя на самом деле никакой опасности для человека и животных не представляют. Иммунная система гораздо охотнее распознаёт такие вирусоподобные частицы и быстро развивает антительный ответ. Это путь к созданию улучшенной вакцины, которая в дополнение к традиционной долговременной защите будет обеспечивать быстрый защитный эффект для предотвращения распространения заболевания в очаге инфекции. Иммунитет червя и свиньиМладший научный сотрудник учебно-научного центра ИБХ РАН Павел Пантелеев (кандидат химических наук) любит кататься на велосипеде по горам. Ещё он любит изучать морских беспозвоночных, точнее, их антимикробные пептиды, которые ежедневно сражаются с бактериями в организмах живых существ. Пептиды - это младшие братья белков: они тоже состоят из аминокислот, только их там не больше пятидесяти, а в белках сотни и тысячи. - В начале каждой статьи о пептидах пишется примерно такая фраза: "Существует острая необходимость создания новых антибиотиков, потому что старые уже не работают из-за резистентности. А антимикробные пептиды обладают чудесным свойством - резистентность со стороны бактерий вырабатывается к ним с большим трудом ". Учебно-научный центр, в котором я работаю, занимается поиском пептидов, которые позволили бы нам противостоять патогенным микроорганизмам, - говорит Павел. Сегодня известно более 800 таких пептидов, но все они не работают на людях. Лекарства на основе пептидов раз за разом проваливают клинические испытания: не удаётся найти стабильные структуры, которые бы в нужном количестве поступали в нужное место и не вызывали побочных эффектов. Они имеют свойство накапливаться в организме: например, могут убить инфекцию, но не выйти с мочой, а остаться в почках. - Мы изучаем морских кольчатых червей, - рассказывает Павел. - Вместе с коллегами из Института экспериментальной медицины мы выделили из червей Arenicola marina (морской пескожил) два пептида и изучили их. Когда я был аспирантом, мы ещё ездили на Белое море за червями, но в них новых пептидов так и не нашли. Конечно, это может быть связано с несовершенством методики поиска, но, скорее всего, у этого червя действительно только два пептида, и этого достаточно, чтобы защищаться от патогенов. - Почему именно черви, их проще изучать? Дело в том, что существует концепция, согласно которой у древних беспозвоночных система врожденного иммунитета должна быть очень сильной, потому что многие из них живут в не самых благоприятных условиях среды обитания и до сих пор существуют. Сейчас одними из объектов моих исследований являются пептиды мечехвостов. Павел достаёт телефон и показывает нечто с черепашьим панцирем и кучей отвратительных крабьих лапок. Такое можно увидеть только в фильме ужасов или в плохом сне. 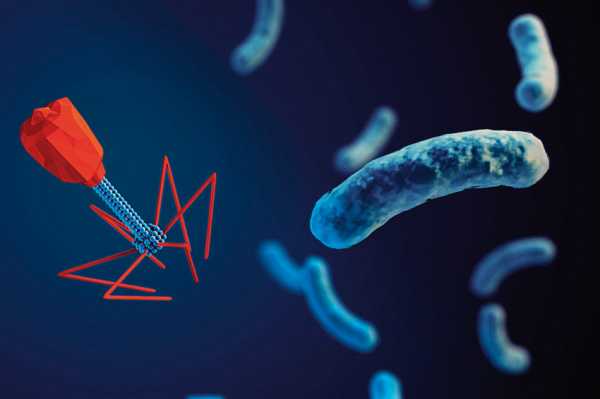 Бактериофаг. Его реальная высота примерно 200 нанометров. Утолщение в верхней части называется головкой. В ней содержится нуклеиновая кислота. Фото: "Кот Шрёдингера" - Однако не важно, что ты изучаешь, червей, мечехвостов или свиней, - продолжает Павел. - У всех организмов ты будешь исследовать одни и те же ткани и клетки, где находятся пептиды. Например, клетки крови - нейтрофилы у млекопитающих или гемоциты у беспозвоночных. Пока неизвестно почему, можно лишь выдвигать гипотезы, в том числе шутливые. Свинья - не особо чистоплотное животное, поэтому ей нужно больше защитников, которые не дадут бактериям из её грязевой ванны заразить организм чем-нибудь. Но есть и универсальный ответ: в каждом конкретном случае пептидов столько, сколько необходимо для защиты организма. - Почему пептиды лучше антибиотиков? - Пептиды хитро устроены. В отличие от антибиотиков, которые, как правило, действуют на определённую молекулярную мишень, пептиды встраиваются в клеточную оболочку бактерии и формируют в ней особые структуры. В конце концов оболочка клетки разрушается под весом пептидов, захватчики проникают внутрь, а сама клетка взрывается и погибает. Кроме того, пептиды действуют быстро, а эволюция структуры мембраны - очень невыгодный и сложный для бактерии процесс. В таких условиях вероятность развития устойчивости к пептидам сводится к минимуму. Кстати, в нашей лаборатории изучают пептиды не только животных, но и растений, например защитные соединения белково-пептидной природы из чечевицы, укропа. На базе отобранных природных образцов мы создаём что-то интересное. Получившееся вещество вполне может быть гибридом - чем-то средним между пептидом червяка и мечехвоста, - уверяет Павел. P. S.Хочется надеяться, что лет через пять, десять или двадцать наступит новая эра борьбы с микробами. Бактерии - существа хитрые и, возможно, создадут в ответ ещё более мощные средства обороны и нападения. Но и наука не будет стоять на месте, так что в этой гонке вооружений победа всё-таки останется за человеком. Человек и бактерии. Метафоры ДрузьяШтатные сотрудники - бактерии, обитающие в нашем организме. По некоторым оценкам, их общая масса составляет от одного до трёх килограммов, а по количеству их больше, чем клеток человека. Они могут быть заняты на производстве (выработка витаминов), в перерабатывающей промышленности (переваривание пищи) и в армии (в нашем кишечнике эти бактерии подавляют рост своих патогенных собратьев). Приглашённые специалисты по пищевому производству - молочнокислые и другие бактерии используются для производства сыра, кефира, йогурта, хлеба, квашеной капусты и других продуктов. Двойные агенты - вообще-то, они враги. Но их удалось завербовать и заставить работать на нужды нашей обороны. Речь идёт о прививках, то есть введении в организм ослабленных вариантов бактерий. Приёмные дети - это уже не бактерии, а части наших клеток - митохондрии. Когда-то они были самостоятельными организмами, но, проникнув сквозь клеточную мембрану, лишились независимости и с тех пор исправно обеспечивают нас энергией. Рабочие-военнопленные - генетически модифицированные бактерии используются для производства лекарств (в том числе - антибиотиков) и многих других полезных веществ. ВрагиОккупанты - все те, кто внедряется в наш организм, паразитирует на нём и приводит к ангине, туберкулёзу, чуме, холере и многим другим заболеваниям. Пятая колона - некоторые бактерии, обитающие в нашем теле или на коже, в обычной ситуации могут быть вполне безвредными. Но когда организм ослаблен, они коварно поднимают восстание и переходят в наступление. Их ещё называют условно-патогенными штаммами. Защитные крепости - колонии бактерий, которые покрывают себя слизью и плёнками, предохраняющими от действия препаратов. Бронированная пехота - среди бактерий, устойчивых к антибиотикам, есть такие, которые умеют делать свои внешние оболочки непроницаемыми для молекул лекарств. Мощь пехоты скрыта в липополисахаридном слое. После гибели бактерий этот слой из жиров и сахара попадает в кровь и может вызвать воспаление или даже септический шок. Тренировочные базы - ситуации, в которых выживают самые устойчивые и опасные штаммы. Такой тренировочной базой для бактериального спецназа может служить организм человека, который нарушает курс приёма антибиотиков. Химическое оружие - некоторые бактерии научились вырабатывать вещества, которые разлагают лекарства, лишая их целебных свойств. Например, ферменты из группы бета-лактамаз блокируют действие антибиотиков из группы пенициллинов и цефалоспоринов. Маскировка - микробы, меняющие внешнюю оболочку и белковый состав так, что лекарства их "не замечают". Троянский конь - некоторые бактерии используют особые приёмчики для поражения врага. Например, возбудитель туберкулёза (Mycobacterium tuberculosis) способен забираться внутрь макрофагов - иммунных клеток, которые отлавливают и переваривают блуждающих болезнетворных бактерий. Суперсолдаты - этим всесильным бактериям не страшны почти никакие лекарства. Рекомендации ВОЗ Десять заповедей антибактериального поведения1. Своевременно проходите вакцинацию. 2. Применяйте противомикробные препараты только в случае их назначения дипломированным врачом. 3. Ещё раз: не занимайтесь самолечением с помощью антибиотиков! 4. Помните, что антибиотики не помогают от вирусов. Лечить ими грипп и многие виды "простуды" не только бесполезно, но и вредно. Вроде бы это проходят в школе, однако во время исследования ВЦИОМ на вопрос "Согласны ли вы с утверждением, что антибиотики убивают вирусы так же хорошо, как и бактерии?" 46% респондентов ответили "да". 5. Принимайте лекарство ровно в тех дозах и столько дней, сколько назначил врач. Не прекращайте приём, даже когда почувствуете себя здоровым. "В случае если вы не доведёте лечение до конца, есть риск, что антибиотики не убьют все бактерии, вызвавшие вашу болезнь, что эти бактерии мутируют и станут устойчивыми. Это происходит не в каждом случае - проблема в том, что мы не знаем, кто может закончить лечение преждевременно и без последствий", - признаются эксперты ВОЗ. 6. Никогда не делитесь антибиотиками. 7. Не используйте назначенные ранее и оставшиеся после приёма антибиотики. 8. Мойте руки. Пейте только чистую воду. 9. Используйте средства защиты при половых актах. 10. Избегайте тесных контактов с больными. Если сами заболели, проявите благородство - не пытайтесь заразить своих одноклассников, сокурсников или коллег. В смысле - сидите дома. rg.ru Смертоноснее рака: всё об устойчивых к антибиотикам бактерияхСмертоноснее рака: всё об устойчивых к антибиотикам бактерияхС момента открытия бактерий антибиотики стали единственным инструментом для лечения инфекционных бактериальных заболеваний. При этом, постоянное использование антибиотиков приводит к возникновению штаммов бактерий, устойчивых к лечению. Какова причина этого явления и как с этим связана пища, которую мы едим? Эксперт Best-IsraMed рассказывает в новой статье для Вас!Если разработка нового антибиотика занимает в среднем десять лет, то новый механизм сопротивления возникает каждые два года. Абсурдность ситуации ставит человечество перед лицом катастрофического будущего, учитывая факт, что антибиотики по-прежнему остаются единственным способом лечения от бактериальных заболеваний. Пока лучшие умы разрабатывают лекарства от рака и болезней сердца, оказывается, есть явление не менее тревожное: борьба с бактериями, устойчивыми к антибиотикам. «Это одна из самых сложных проблем, стоящих сегодня перед медициной», — говорит доктор Пнина Шитрит, руководитель антиинфекционного отделения больницы Меир. Прежде чем мы поговорили с ней о проблеме, доктор Шитрит объясняет: «Антибиотики – первый и самый важный инструмент, помогающий спасать жизни. По сути, с момента открытия пенициллина мы являемся свидетелями настоящей революции в вопросах, касающихся бактериальных инфекций. Если в недалеком прошлом люди умирали от таких заболеваний как пневмония, инфекции мочевыводящих путей или даже простого воспаления горла, вызывавшего осложнения на сердце, то теперь все это можно легко вылечить с помощью антибиотиков». Так в чем же проблема? «Бактерии размножаются очень быстро, в процессе чего возникают мутации, меняющие их генетический материал. Некоторые мутации приводят к сопротивляемости антибиотикам. Фактически, при приеме антибиотиков убиваются бактерии, которые к ним чувствительны, но создается благоприятная среда для развития более устойчивых бактерий. Миллионы бактерий остаются невосприимчивыми, и чем больше мы пользуемся антибиотиками, тем чаще этот процесс происходит», — рассказывает доктор Шитрит.  Для получения консультации пришлите выписку нам на мэил [email protected] WhatsUp/Viber +972504800552 Как распознать устойчивые бактерии? «Более устойчивые бактерии обнаруживаются во время лабораторных испытаний. Поэтому, когда какой-то штамм бактерий вызывает подозрения, проводится больше испытаний для пациентов, наиболее подверженных риску, например, тех, кто нуждается в длительном лечении антибиотиками или продолжительной госпитализации. В таком случае необходима изоляция больного и применение мер предосторожности, таких как гигиена рук и использование специальных халатов и перчаток. К сожалению, бывают редкие случаи, когда никакое лечение антибиотиками не может спасти пациента, но эффективность лечения антибиотиками снижается все еще довольно редко». Каковы причины развития устойчивости у различных бактерий?
«На самом деле, любое использование антибиотиков повышает риск возникновения резистентных бактерий, поэтому важно использовать их с учетом имеющейся информации, даже если это необходимо. Эта ответственность лежит не только на врачах, но и на нас с вами. Мы должны держать руку на пульсе и не спешить с приемом антибиотиков в тех случаях, когда в них нет особой необходимости. Важно внимательно относиться к указаниям врача, а в случае возникновения сомнений рекомендуется обратиться к эксперту в области инфекционных заболеваний», — объясняет доктор Шитрит. По ее мнению, даже некоторые тесты иногда могут усугубить это явление: анализ мочи, например, может показать наличие бактерий даже при отсутствии воспаления, а это приведет к ненужному лечению антибиотиками. «В конечном итоге, важно понять, что чем больше пациентов принимают антибиотики, тем больше риск появления бактерий с резистентным механизмом к различным семьям антибиотиков, потому что бактерии могут передавать генетический материал и формировать устойчивость даже к антибиотикам, отличным от тех, которыми лечат пациента».
Данные известны: примерно 5000 пациентов умирают каждый год от инфекций во время лечения в больницах. «Это явление, в частности, объясняет появление бактерий, устойчивых к антибиотикам, поскольку чем больше инфекций, тем больше врачи вынуждены применять антибиотики. Этот прискорбный факт можно смягчить относительно простыми способами, которые включают строгие правила гигиены для медицинского персонала, который ходит от пациента к пациенту и может стать переносчиком тех же резистентных бактерий».  Для получения консультации пришлите выписку нам на мэил [email protected] WhatsUp/Viber +972504800552
Вы когда-нибудь задумывались, зачем антибиотики используются в пище, которую мы едим? Что ж, по мнению доктора Шитрит, это происходит не только ради здоровья: «Использование антибиотиков в животноводстве, например, вызвано желанием ускорить рост. Животные набирают вес, а поскольку это бизнес, то растут и прибыли». А что происходит в мире? «В Европе и США есть правила, запрещающие использование антибиотиков в пище, а Белый Дом опубликовал документ, касающийся борьбы с резистентными бактериями, где изложено четкое руководство по снижению использования антибиотиков ветеринарными службами. В Израиле в 2007 году было создано национальное подразделение для предотвращения инфекций. Одной из его задач является борьба с бактериями, устойчивыми к антибиотикам. В настоящее время оно активно сотрудничает с ветеринарной службой, но этого по-прежнему недостаточно». Что можно сказать об использовании мяса при домашней готовке? Полезнее ли мясо без антибиотиков? «Не обязательно. Вполне вероятно, что бактерии погибают при приготовлении, а антибиотики разрушаются. Проблема больше в окружающей среде: бактерии попадают на разделочную доску, а эффект, скорее всего, проявится только в долгосрочной перспективе. Фактически, эти бактерии могут привести к уменьшению числа антибиотиков, которые мы сможем использовать в будущем», — говорит доктор Шитрит.  Для получения консультации пришлите выписку нам на мэил [email protected] WhatsUp/Viber +972504800552
В дополнение к вышесказанному доктор Шитрит объясняет, что одной из самых больших проблем сейчас являются фармацевтические компании, которые не торопятся с выпуском новых антибиотиков на рынок. «Зная, что эти препараты могут через несколько лет оказаться неэффективными, они исходят из предположений, что инвестировать в их разработку экономически не выгодно. Если мы не найдем решения, нас ждет катастрофа. Если разработка нового антибиотика занимает в среднем десять лет, то новый резистентный механизм появляется каждые два года. Абсурдность ситуации ставит человечество перед лицом катастрофического будущего, учитывая факт, что антибиотики по-прежнему остаются единственным способом лечения от бактериальных заболеваний. Следовательно, проблему резистентности бактерий необходимо ставить во главе списка приоритетных задач, таких как инвестиции в технологическое развитие, подготовка медицинского персонала и поиск решений, которые могут дать полноценный ответ на настоящее и будущее в лечении антибиотиками». Если у Вас остались вопросы, вы можете задать из через форму обратной связи на сайте или нашим представителям в социальных сетях.https://ok.ru/best.isramed https://vk.com/bestisramed https://www.instagram.com/bestisramed2006/ whatsUP/Viber +972504800552 Будьте здоровы!best-isramed.com Неоправданное применение антибиотиков приведет к появлению супербактерий — Российская газетаВ конце сентября правительство утвердило Стратегию предупреждения распространения антимикробной резистентности в РФ на период до 2030 года, содержащую национальный план борьбы с ней. Проблема устойчивости бактерий к антимикробным препаратам приобретает все большую актуальность, поскольку микроорганизмы формируют различные механизмы устойчивости к антибиотикам гораздо быстрее, нежели человечество создает новые. Мы стоим на пороге ситуации, когда в арсенале врачей не будет антибиотиков для лечения обычных пневмонии или бронхита. Чаще всего врачи сталкиваются с этой ситуацией в отделениях реанимации, особенно если говорить о внутрибольничной инфекции. Госпитальные штаммы микробов сегодня устойчивы к двум и более классам антибиотиков. Именно этот критерий применяют для определения так называемой множественной резистентности. Сегодня она встречается в 95 процентах случаев. В подобных ситуациях врачам приходится использовать стратегию контроля антимикробных препаратов, т.е. применять различные их комбинации, чтобы сохранить эффективность оставшегося небольшого количества антибиотиков. И дело не только в медицине. Сегодня огромное количество антибактериальных препаратов используется в сельском хозяйстве. И если врачи измеряют их дозировки граммами, то аграрии - уже тоннами. Вот почему решать проблему устойчивости необходимо комплексно. Безусловно, необходимо запрещать свободный доступ к антибиотикам - неконтролируемое применение и создает ту самую устойчивость, из-за которой врачам потом нечем лечить больных. Устойчивость к антибиотикам формируется гораздо быстрее, нежели человечество создает новые Очень важна в борьбе с этим явлением роль врача первичного звена. Он должен хорошо знать проблему антимикробной резистентности. У нас достаточно много современной методической литературы, общественные организации проводят большую образовательную работу. Интенсивно развивается и микробиологическая диагностика: если еще 10 лет назад для верификации механизма резистентности нужны были сложные многодневные исследования в специализированных центрах, то сейчас у нас появляются различные методики, которые позволяют идентифицировать резистентность возбудителя всего за несколько часов. Пока это доступно на уровне научно-исследовательских институтов и межклинических лабораторных центров. В обычных используются микробиологические карты, которые делают общественные организации. Любой врач может зайти в них в Интернете и увидеть, какие в его регионе штаммы устойчивы к тем или иным антибиотикам, сопоставить ее с клинической картиной и, исходя из этого, выбрать тот или иной антибиотик. В арсенале врачей ежегодно появляются все новые антимикробные препараты, они довольно быстро включаются и в клинические рекомендации, и в перечни препаратов, которые закупаются за счет бюджета здравоохранения. Но даже если нового препарата нет в перечнях, всегда есть возможность закупать его для конкретного больного - по жизненным показаниям. Однако появление новых антибиотиков может привести к их широкому использованию. А это в свою очередь приводит к очень быстрой потере их эффективности. Поэтому подобные новейшие препараты нужно применять точечно и очень аккуратно. Важно помнить, что антибиотики нельзя применять без контроля врача, необходимо защищать свое здоровье и здоровье близких прививками, в периоды респираторных инфекций пользоваться средствами защиты. И помнить, что даже самая банальная инфекция может стать смертельно опасной, если ее нечем будет лечить. Взгляд Алла Рыжанкова, медицинский руководитель подразделения "Базовые препараты" Pfizer в России: - Антимикробная резистентность - комплексная проблема, которая касается не только практического здравоохранения, но и таких областей, как фармацевтика и сельское хозяйство. Только в активном взаимодействии возможно найти ее решение. В этой связи крайне важно утверждение Стратегии предупреждения распространения антимикробной резистентности в РФ. Она включает в себя такие направления, как развитие лабораторного контроля и мониторинга, внедрение мер по рациональному использованию имеющихся антимикробных препаратов и разработке новых, обучение населения и специалистов, развитие межведомственного и научного взаимодействия. Компания Pfizer активно поддерживает эти инициативы в рамках образовательных и научных проектов в России, а также разрабатывая и внедряя новые антибактериальные препараты. Екатерина Лукьянова, медицинский директор компании MSD в России: - Рост антимикробной резистентности в мире обусловлен широким применением антибактериальных средств и во многих случаях связан с нерациональным их назначением. По данным Центра по контролю и профилактике заболеваний (CDC), в США около трети антибиотиков назначается необоснованно. Инфекции, вызванные микроорганизмами, устойчивыми к нескольким антимикробным препаратам, представляют наибольшую сложность при выборе терапии. Возникновение таких инфекций приводит не только к увеличению времени пребывания пациентов в стационаре, повышению расходов на лечение, но и к росту смертности. Существующие программы по стратегии контроля антимикробной терапии направлены на снижение антибиотикорезистентности в стационаре, и, как следствие, улучшение исходов лечения. Наша компания активно поддерживает подобные инициативы по всему миру, в том числе в России. rg.ru |
г.Самара, ул. Димитрова 131 [email protected] |
 |