|
|
||||||||||
|
Оценка качества природных и полусинтетических антибиотиков. Химические методы оценки качества антибиотиков2.3 Химические и физико-химические методы определения антибиотиков. Анализ качественных и количественных характеристик антибиотиковПохожие главы из других работ:Анализ лекарственных препаратов и лекарственных форм, содержащих п-аминобензосульфамид и его производные (сульфаниламидные препараты) 1.5 Физико-химические методы идентификацииХарактерные особенности имеют УФ-спектры растворов сульфаниламидов. Они широко применяются для идентификации и количественного спектрофотометрического определения сульфаниламидов с использованием таких растворителей, как вода, 0,01 М и 0... Влияние пищевых веществ на функционирование эндокринной системы Физико-химические свойстваПлотность цельной крови зависит главным образом от содержания в ней эритроцитов, белков и липидов. [1,5,8,9... Изучение фотоколориметрических методов анализа лекарственных средств Глава 1: Физико-химические методы анализа.... Кетамин в ветеринарии как средство для наркоза Физико-химические свойстваДериват фенциклидина - кетамина гидрохлорид представляет собой белый кристаллический порошок. Выпускается в виде чуть кислого раствора (рН 3,5-5,5). Кетамин состоит из двух (S- и R-) стереоизомеров. S-изомер в 1... Клозапин и оланзапин Физико-химические свойства. ЛипофильностьВнешний вид: желтый, кристаллический порошок. Растворимость: практически нерастворимые в воде, легко растворим в метилен хлорид, растворим в этаноле (96 процентов). Он растворяется в разбавленной уксусной кислоты... Кровь, ее состав и функции в организме 1.2.3 Физико-химические свойства кровиОбъем крови -- общее количество крови в организме взрослого человека составляет в среднем 6 -- 8% от массы тела, что соответствует 5 --6 л. Повышение общего объема крови называют гиперволемией, уменьшение -- гиповолемией... Лекарственные вещества, их свойства и анализ 3.2 Физико - химические методы анализа... Лекарственные растения – источники витамина С Физико-химические свойстваАскорбиновая кислота по своему строению может быть отнесена к про-изводным углеводов. Она представляет собой 2,3-дидегидротрео-гексоно-1,4-лактон. Благодаря наличию двух асимметрических атомов углерода в положениях 4 и 5... Лекарственные растения, содержащие лигнаны 2.2 Физико-химические свойстваКак правило, это твердые бесцветные или окрашенные кристаллические вещества, хорошо растворимые в спирте, хлороформе, жирных и эфирных маслах; не растворимы в воде (кроме гликозидов). В растениях чаще всего встречаются в форме агликонов... Неводное титрование 2.6 Физико-химические методы титриметрииИнструментальные способы установления точки эквивалентности основаны на оценке изменения физико-химических свойств систем в ходе взаимодействия анализируемых веществ и титрантов: обычно это электрохимические или спектральные свойства... Оценка качества природных и полусинтетических антибиотиков 1.1.1 Химические строение и физико-химические свойстваВ основе строения пенициллинов лежит 6-АПК, которая представляет собой гетероциклическую систему, состоящую из 2 конденсированных колец: четырехчленного - в-лактамного (В) и пятичленного -- тиазолидинового (А) (рис. 2). 6-AПК является дипептидом... Растительные источники танина и их применение в медицине 3. Физико-химические свойстваЖелтовато-белый или слегка коричневый аморфный легкий порошок либо блестящие пластинки (рисунок 2). Обладает вяжущим вкусом и слабым своеобразным запахом [6]. Рисунок 2 - Танин. Внешний вид Очень легко растворим в воде, легко растворим в ацетоне... Современные методы фармацевтического анализа 3.8 Физические и физико-химические методы анализаФизические и физико-химические методы могут быть классифицированы на следующие группы: оптические методы, методы, основанные на поглощении электромагнитного излучения, методы, основанные на испускании излучения, методы... Токсикологическое действие метанола 1. Физико-химические свойстваМетанол - химическая формула: Ch5O / Ch4OH. Молекулярная масса 32.0. Бесцветная, легкоподвижная жидкость с запахом, аналогичным запахом этилового спирта. Температура кипения 65°C Температура плавления - 98°C Относительная плотность (вода = 1): 0... Фармацевтическая химия углеводов Глава 3. Физические свойства и физико-химические методы исследования моносахаридов... med.bobrodobro.ru Оценка качества природных и полусинтетических антибиотиковОЦЕНКА КАЧЕСТВА ПРИРОДНЫХ И ПОЛУСИНТЕТИЧЕСКИХ АНТИБИОТИКОВ Оглавление Общая характеристика производных β-лактамидов и аминогликозидов 1. β- лактамиды 1.1 Пенициллины 1.1.1 Химические строение и физико-химические свойства 1.1.2 Химические свойства и реакции подлинности 1.1.3 Гидроксамовая реакция 1.1.4 Образование пенилловой и пенициленовой кислот, их использование в анализе 1.1.5 Реакция с реактивом Марки 1.1.6 Испытания на чистоту 1.1.7 Методы количественного определения 1.1.8 Спектр противомикробного действия 1.1.9 Фармакокинетика природных пенициллинов 1.1.10. Побочные действия 1.2 Цефалоспорины 1.2.1 Химическое строение и физико-химические свойства 1.2.2 Химические свойства 1.2.3 Фармакокинетика 1.2.4 Побочные действия 2. Аминогликозиды 2.1 Стрептомицина сульфат 2.2 Канамицина моносульфат 2.3 Гентамицина сульфат 2.4 Амикацина сульфат Список литературы Введение Общая характеристика производных β-лактамидов и аминогликозидов β-лактамиды и аминогликозиды относятся к антибиотикам — большой группе органических соединений с различной химической структурой, обладающих выраженной биологической направленной активностью. Антибиотики — это химиотерапевтические вещества, образуемые микроорганизмами или полученные из других природных источников, а также их производные и синтетические продукты, обладающие способностью избирательно подавлять в организме больного возбудителей заболевания или задерживать развитие злокачественных новообразований. Антибиотики отличаются от других лекарственных средств гетерогенностью, т.е. многокомпонентностью состава. Например, аминогликозид гентамицин состоит из 3 компонентов; в солях беизидпенициллина сумма пенициллинов должна быть не менее 96,0%, а содержание бензидпенициллина — не менее 90,0%. Для каждого антибиотика существует фермент, который его инактивирует. Например, ленициллиназа инактивирует природные и некоторые полусинтетические пенициллины. Оценка качества природных и полусинтетических антибиотиков проводится по токсичности, которая определяется биологическими методами на животных. Значительную часть антибиотиков выпускают в виде герметически укупоренных сухих рассыпок вследствие их нестабильности в водных растворах. Антибиотики занимают первое место среди препаратов, вызывающих побочные реакции; это прямая токсичность, дисбактериозы, нефро- и ототоксичность (стрептомицин), аллергические реакции (пенициллин). Поскольку антибиотики в большинстве случаев являются смесями веществ, их активность определяется в единицах действия (ЕД). Метод основан на сравнении угнетения роста тест-микроорганизма определенными концентрациями испытуемого препарата с угнетением роста известными концентрациями стандартного препарата антибиотика. 1. β-лактамиды К β-лактамным антибиотикам относятся пенициллииы и цефалоспорины. Они имеют сходную химическую структуру: содержат β-лактамное кольцо и являются N-ацильными производными соответствующих аминокислот — 6-аминопенииилдановой (пенициллины) и 7-аминоцефалоспорановой или 7-амииодезацетоксицефалоепорановой (цефалоспорины). 1.1 Пенициллины Бензил пенициллин открыт А. Флемингом (1929) и до сих пор широко используется в медицине. К природным пенициллинам относят бензилпенициллин и феноксиметилпенициллин. Бензилпенициллин является довольно сильной кислотой, гигроскопичен, быстро инактивируется и поэтому применяется в виде солей с неорганическими и органическими основаниями. Феноксиметилпенициллин обладает большей устойчивостью, применяется в виде кислоты. Соли бензилпенициллина и феноксиметипенициллина активны в отношении грамположительных микроорганизмов (относительно узкий спектр действия), неустойчивы к действию кислот и пенициллазы. Эти недостатки природных пенициллинов стимулировали поиск новых антибиотиков. В конце 50-х гг. XX столетия начались работы по созданию активных полусинтетических антибиотиков на основе 6-аминопенициллановой кислоты (6-АПК). Ацилирование 6-АПК хлорангидридами различных кислот позволило получить ряд полусинтетических пенициллинов, устойчивых к кислотам, пенициллиназе и имеющих более широкий, спектр действия. Рис. 1. Форма выпуска пенициллинов 1.1.1 Химические строение и физико-химические свойства В основе строения пенициллинов лежит 6-АПК, которая представляет собой гетероциклическую систему, состоящую из 2 конденсированных колец: четырехчленного - β-лактамного (В) и пятичленного — тиазолидинового (А) (рис. 2). 6-AПК является дипептидом, состоящим из L-цистеина и L-валина. Пенициллины отличаются друг от друга строением ацильного остатка в аминогруппе 6-АПК. Рис. 2. Общая формула пенициллинов Пенициллины представляют собой белые или почти белые кристаллические порошки. Пенициллины со свободной карбоксильной группой в 3-м положении (например, феноксиметилпенициллин, ампициллин, амоксициллин) мало растворимы в воде. Соли щелочных металлов (натриевая и калиевая соли бензил пенициллина, натриевые соли оксациллина, ампициллина, динатриевая соль карбенмциллина) легко растворимы в воде; соли органических оснований (новокаиновая соль бензил пенициллина) мало растворимы в воде. Соли бензилпенициллина неустойчивы в растворах и разрушаются при приеме внутрь (в кислой среде), феноксиметилпенициллин более устойчив в кислой среде и может применяться внутрь в виде таблеток. Зависимость между химическим строением и биологическим действием пенициллинов представлена на рис. 3. Рис. 3. Зависимость между химическим строением и биологическим действием пенициллинов 1 - характер радикала определяет степень связывания пенициллина белками; 2 - заместитель в о-положении фенильного радикала влияет на устойчивость к пенициллиназе; 3 - характер связи фенильного радикала с метиленовой группой определяет кислотоустойчивость пенициллинов; 4 - заместитель атома водорода в метиленовой группе определяет спектр действия пенициллина; 5 - расщепление β-лактамной связи приводит к исчезновению свойств антибиотика и появлению аллергического действия; 6 - заместитель в карбоксильной группе дает возможность получения солевых форм пенициллинов; П - пенициллиназа расщепляет β-лактамное ядро; А - амидаза расщепляет амидную связь. 1.1.2 Химические свойства и реакции подлинности Наиболее лабильной частью молекулы пенициллина является β-лактамное кольцо, которое подвергается гидролитическому расщеплению под действием щелочей, кислот, фермента пенициллиназы с потерей биологической активности (рис. 4). Реакция щелочного гидролиза пенициллинов используется в гидроксамовой реакции, в количественном йодометрическом определении пенициллинов. Рис. 4. Щелочи и пениниллиназа гидролизуют β-лактамное кольцо с образованием неактивной пенициллоиновой кислоты 1.1.3 Гидроксамовая реакция Гидроксамовая реакция основана на наличии β-лактамного кольца в молекуле пенициллина. При взаимодействии пенициллинов со щелочным раствором гидроксиламина гидрохлорида происходит реакция гидроксиламинолиза с образованием гидроксамовой кислоты, которая после подкисления образует окрашенные комплексные соли с солями тяжелых металлов: с солями железа (Ш) фиолетового цвета раствор гидроксамата железа (III) и зеленого цвета осадок гидроксамата меди (II) (рис. 5). 1.1.4 Образование пенилловой и пенициленовой кислот, их использование в анализе Под действием кислот пенициллины инактивируются с образованием пенилловой (при рН 2,0) и пеницилленовой (при рН 5,0) кислот. В обоих случаях на 1-м этапе расщепляется β-лактамный цикл с образованием пенициллоиновой кислоты. Гидроксамат железа (III) Гидроксамат меди (II) (красно-фиолетовый раствор) (зеленый осадок) Рис. 5. Гидроксамовая реакция Затем происходит конденсация карбоксильной или амидной группы с гидроксильной группой ацильного радикала (рис. 6). 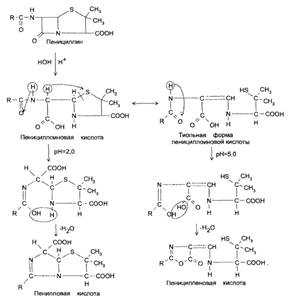 Рис. 6. Образование пенилловой и пенициленовой кислот 1.1.5 Реакция с реактивом Марки Пенициллины с реактивом Марки (раствор формалина в концентрированной серной кислоте) образуют окрашенные продукты. Наиболее характерной эта реакция является для феноксиметилпенициллина (красное окрашивание при комнатной температуре и углубление окраски при нагревании). Реакция протекает за счет феноксиуксусной кислоты, которая образуется из феноксиметилпенициллина при действии концентрированной серной кислоты. Фенол с реактивом Марки образует ауриновый краситель красного цвета. Ампициллин и амоксициллин за счет остатка аминокислоты в ацильной части молекулы дают реакцию с нингидрином и солями меди (II) (с реактивом Фединга или раствором меди сульфата). 1.1.6 Испытания на чистоту Пенициллины могут легко изменяться пол влиянием внешних воздействий, поэтому для них обязательным является испытание на прозрачность и цветность. mirznanii.com Методы количественного определения антибиотиков - Справочник химика 21Из биологических методов количественного определения антибиотиков наибольшее распространение получил метод диф- фузии в агар с турбидиметрическим определением, основанным на измерении концентрации клеток тест-микроба, образующих определенную оптическую плотность среды (мутность) в. результате их роста в присутствии небольшого количества антибиотиков. [c.414]Методы количественного определения антибиотиков [c.166] Методы количественно го определеиия. Для определения активности препаратов пенициллина так же, как и других антибиотиков, применяют биологические, химические и физико-химические методы. [c.419] ПОЛЯРИМЕТРИЯ — метод физикохимического исследования, основанный на измерении вращения плоскости поляризации света оптически активными веществами. Чаще всего такими веществами являются органические соединения с асимметрическим атомом углерода. Измерения производят с помощью поляриметров — оптических приборов, в которых луч света последовательно проходит через систему двух поляризующих призм. Благодаря пропорциональности, существующей между углом вращения и концентрацией оптически активного вешества, поляриметрические измерения используют для количественного определения оптически активного вещества. П. является основным методом контроля в сахарной промышленности по величине угла вращения определяют содержание сахара в растворе. Методы П. используются также для анализа эфирных масел, алкалоидов, антибиотиков и др. Большое значение имеет поляриметрический метод исследования в органической химии, где на основании определения знака и величины вращения плоскости поляризации можно судить о химическом строении и пространственной конфигурации соединения, делать выводы о механизме реакций и др. Для этого в последнее время особенно успешно используется спектрополяри-метрия. [c.201] В этом разделе будут рассмотрены следующие способы обнаружения антибиотиков а) по люминесценции в УФ-свете, б) по поглощению УФ-света и в) по радиоактивности меченых антибиотиков. Все эти методы имеют то преимущество перед биологическими и химическими, что их использование, как правило, не связано с разрушением хроматографируемых веществ и сохраняет хроматограммы, которые можно употреблять для дальнейшей работы (количественных определений, проведения качественных реакций, препаративных целей и т. д.). [c.14] Для количественного определения антибиотиков используются различные методы биологические, химические, физико-химические. [c.414] Диффузионные методы. Количественное определение антибиотиков диффузионными методами основано на способности антибиотических веществ диффундировать в агаровых средах и образовывать зоны, в которых не развиваются используемые тест-организмы. Величина зоны диффузии антибиотика зависит прежде всего от химической природы антибиотического вещества и его концентрации, состава агаровой среды, ее pH, температуры и других факторов, которые необходимо учитывать при анализах. [c.170] Активность образца антибиотика выражают как отношение дозы, которая угнетает рост соответствующего чувствительного микроорганизма, к дозе Международного биологического стандарта. Международного биологического эталонного препарата или Международного химического стандартного образца этого антибиотика, которая дает такую же степень угнетения. В количественном определении можно также использовать вторичные стандартные образцы, активность которых удостоверена соответствующим методом. Количест-ьенное определение основано на сравнении угнетения роста микроорганизмов, вызванного известными концентрациями стандартного образца, с угнетением, вызванным определенными разведениями испытуемого вещества. Этот эффект может быть измерен при помощи метода диффузии, ак описано ниже, или турбидиметрическим методом. [c.165] Существенные экспериментальные трудности, которые до последнего времени ограничивали исследования в области белковой химии, в значительной степени обусловливались отсутствием простых и надежных способов анализа аминокислот. Лишь благодаря развитию за последние два десятилетия ионообменной и распределительной хроматографии удалось разработать автоматический метод количественного анализа аминокислот с использованием окисления аминокислот нингидрином и фотометрирования продуктов реакции [9]. Однако стремительное развитие химии белков и пептидов, среди которых обнаружены важнейшие биорегуляторы и антибиотики, уже сейчас предъявляет новые требования по чувствительности и быстроте анализа. Сложность аппаратурного оформления и дороговизна эксплуатации, безусловно, ограничивают применение автоматического анализатора Мура и Штейна и в значительной степени обусловливают интерес к разработке новых методов аналитического определения аминокислот, свободных от указанных недостатков. [c.252] Дайте характеристику основных биологических, химических, физико-химических и иммунохимических методов количественного определения антибиотиков. [c.182] В последние годы широкое распространение для количественного определения антибиотиков получили химические и физико-химические методы, из которых наибольшее применение имеют фотоколориметрический и спектрофотометрический методы. Последние основаны на использовании определенных свойств антибиотиков цветные реакции, появление или исчезновение характерных полос в УФ- или ИК-областях спектра под воздействием различных реагентов (кислот, щелочей и др.). [c.414] Методы статистической оценки микробиологических количественных определений антибиотиков также описаны во многих национальных и региональных фармакопеях. [c.170] В перечисленных ниже публикациях описаны подходящие методы, которые можно использовать для статистичской оценки микробиологических количественных определений антибиотиков. [c.170] Применение метода хроматографии на бумаге для количественных определений антибиотиков имеет то преимущество, что позволяет проводить оценку содержания отдельных компонентов сложной смеси близких веществ. [c.36] Количественное определение антибиотиков в культуральных жидкостях, готовых препаратах или в разнообразных растворах осуществляют различными методами биологическими, химическими, [c.166] Было установлено, что при непродолжительном кипячении стрептомицина и маннозидострептомицина с водными растворами щелочей образуется мальтол [199—201]. Ввиду того, что в определенных условиях выход мальтола постоянен [199], а мальтол дает характерное окрашивание с солями трехвалентного железа, эта реакция нашла широкое применение для количественного определения антибиотиков группы стрептомицина колориметрическим методом [199—202]. При деструкции стрептомицина щелочами в мальтол превращается только стрептозная часть молекулы [2С0, 201]. Хотя механизм этого интересного превращения еше окончательно не выяснен, Шемякин, Хохлов и Колосов [203] предложили следующую схему образования мальтола из стрепто- [c.101] Количественное определение. Для количественной оценки действия нтибиотика пользуются методом диффузии в агар (рис. 10.7), методом последовательных разведений и некоторыми другими методами. Для проведения теста с диффузией чашки заполняют до определенной высоты агаризованной средой, содержащей суспензию тест-организма. Затем в чашки вносят испытуемые растворы антибиотика. Их помещают в лунки, либо в стеклянный или металлический цилиндр, или же накладывают на агар пропитанные антибиотиком диски из фильтровальной бумаги. При положительной реакции во всех случаях после инкубации становится заметной зона подавления роста тест-организма. Диаметр этой зоны при соблюдении постоянных условий опыта (состав питательной среды, толщина слоя агара, плотность посева, время инкубации, температура и т.д.) пропорционален логарифму концентрации антибиотика (рис. 10.7). [c.339] В настоящее время этот метод используется для разделения, идентификации и количественного определения таких сложных веществ, как смеси углеводородов, ароматических карбоновых кислот, стероидов, гербицидов, пестицидов, антибиотиков, различных красителей и их полупродуктов, алкалоидов, различных компонентов нуклеиновых кислот. [c.69] В частности, сочетание такого высокоразрешающего метода, как хроматография на бумаге, с очень чувствительным и избирательным биоавтографическим методом обнаружения позволяет изучать превращения антибиотиков как в химических реакциях, так и в биологических системах при биосинтезе, в организме животных, человека, растений, в почве и т. д. При помощи хроматографии можно провести количественное определение отдельных компонентов смеси антибиотиков без их препаративного разделения. [c.21] Пиролитическая газовая хроматография является эффективным методом качественного и количественного анализа антибиотиков [246-248]. Изучено около 20 различных антибиотиков [248]. Поскольку антибиотики представляют собой довольно лабильные соединения, то при анализе применили низкотемпературный пиролиз при 375 °С, при этом получены пирограммы, пригодные как для идентификации, так и для количественного анализа. Продукты пиролиза разделяли на колонке 3 м X 3 мм с 5% РРАР на диапорте или на колонке с 2% в изотермическом режиме при 75 °С или нри программировании температуры от 50 до 200 °С (или 230 °С) со скоростью 7,9°С/мин. Близкие по структуре анхибиотики, которые не удавалось ранее идентифицировать традиционными методами бумажной, тонкослойной хроматографии и ИК-спектроскопии, были идентифицированы по пирограммам. Низкотемпературный пиролиз позволил идентифицировать алкилзамещенные производные линкомицина с различным расположением заместителей в молекуле. Некоторые продукты пиролиза идентифицированы с помощью масс-спектрометра, что позволило определить структуру заместителей. На основе обнаруженных характеристических продуктов пиролиза возможно количественное определение антибиотиков. [c.227] Бумажная хроматография относительно мало применяется в исследованиях циркуляции антибиотиков в организме человека и животных. При таких исследованиях, как правило, ограничиваются только количественными определениями, которые, по существу, показывают лишь суммарную биологическую активность всех имеющихся продуктов. Но антибиотики в организме подвергаются превращениям, образовавшиеся при этом продукты могут отличаться от исходных препаратов по антимикробной активности, токсичности, аллергенным свойствам и т, д. Поэтому использование только количественных методов (без выяснения качественной стороны процессов) не всегда позволяет выявить картину циркуляции антибиотиков. Между тем, знание конкретных путей превращения лекарственных веществ в организме со- [c.47] Наиболее щирокое распространение среди биологических методов количественного определения антибиотиков получили метод последовательных разведений, диффузионные и тур-бидиметрические. [c.167] Количественную бумажную хроматографию применяли для определения содержания отдельных компонентов в антибиотической смеси [1, 2, 5, 6, 49, 231, 284, 314, 342—344], при изучении биосинтеза антибиотиков (стр. 38), для количественных определений антибиотиков в кормовых и фармацевтических препаратах [97, 345], в почве [346, 347], при изучении динамики превращений антибиотиков в организме человека [348, 349], при определении удельной радиоактивности меченых препаратов [160, 188]. Описано интересное использование количественной хроматографии антибиотиков для определения небольших количеств хлоридов. Метод основан на способности некоторых штаммов Streptomy es aureofa iens полностью извлекать хлориды из среды, используя их для биосинтеза хлортетрациклина. По количеству хлортетрациклина судили об исходной концентрации хлоридов [350]. [c.36] При изучении антрациклиновых антибиотиков хроматографию на бумаге применяли для решения различных задач изучения гомогенности, классификации препаратов, выделяемых из различных актиномицетов [324, 600, 804—806, 1000—1002], изучения биосинтеза [416], как препаративный метод [305, 306], для количественного определения отдельных компонентов смеси антрациклиновых антибиотиков [373]. [c.157] Многие органические соединения, а также их комплексы с переходными элементами снижают перенапряжение водорода на ртутном электроде. В результате возникают каталитические водородные токи, величина которых в строго контролируемых условиях пропорциональна концентрации катализатора — вещества, снижающего перенапряжение водорода. Катализаторами могут быть многие азот- и серосодержащие органические соединения. Несмотря на все перечисленные сложности, полярография пригодна дпя количественного определения многих органических соединений в весьма сложных объектах. Есть и прямые методы определения электроактивных веществ (определяют следы С Н,К02 в анилине), и косвенные методы, основанные, например, на измерении степени подавления полярографических максимумов. Так можно оценивать молекулярные массы продуктов гидролиза крахмала ипи определять степень загрязнения различных вод природными и синтетическими ПАВ. Современные фармакопеи многих развитых стран рекомендуют полярографические методы определения лек хпвенных прещтов — алкалоидов, гормонов, антибиотиков, витаминов. [c.189] Пропорциональность, существующая между вращением и концентрацией оптически активного вещества, позволяет использовать поляриметрич. измерения для количественного определения оптически активных веществ (естественно, что в этом случае концентрационная зависимость уд. вращения должна быть не слишком велика). В частности П. давно уже является основным методом контроля в сахарной пром-сти по величине угла вращения определяют содержание сахара в р-ре. Кроме того, поляриметрич. методы исиользуются для анализа эфирных масел, алкалоидов, антибиотиков и др. веществ. [c.129] Количественную хроматографию на бумаге проводят двумя способами с разрезанием хроматограмм на части и на целых хроматограммах. В первом случае возможны два варианта всю хроматограмму разрезают на небольшие прямоугольники стандартного размера, которые затем отдельно помещают на агаровую пластинку, засеянную тест-микробом. Одновременно на эту же пластинку помещают контрольные куски хроматографической бумаги такого же размера, на которые нанесен стандартный антибиотик в известных количествах. Сравнивая размер зон подавления в опыте и контроле, можно определить содержание антибиотика в различных участках хроматограммы. Такой метод применяли для пенициллинов [6], стрептомицииов [351], ан-тимицинов [314, 352], геликсинов и эндомицинов [284], т. е. тогда, когда, кроме биоавтографического метода, не было других способов выявления веществ на хроматограммах. Если расположение изучаемого вещества можно определить заранее, то при количественных определениях вырезают только зону расположения антибиотика, вещество затем элюируют подходящим растворителем. Для определения содержания антибиотика чаще всего используют спектрофотометрический метод. Таким образом проводили определение тетрациклинов антибиотики и продукты их деградации выявляли по свечению в УФ-свете, для элюирования использовали фосфатный буфер с pH 4,5 или растворы соляной и серной кислот количественные определения проводили микробиологическими или спектрофотометрическими методами [97, 99, 101, 258, 350—355]. Метимицин и близкие антибиотики обнаруживали на хроматограммах в виде коричневых пятен по- [c.36] chem21.info Методы анализа антибиотиковМетоды анализа антибиотиковСодержание Введение 1. Валидация методики количественного определения антибиотиков 2. Собственное исследование Заключение Список использованной литературы Введение Проблема борьбы с инфекционными заболеваниями не теряет своей актуальности. Несмотря на значительные успехи в области микробиологии и антибактериальной химиотерапии, ситуация усложняется увеличением количества микроорганизмов, резистентных к большому числу противомикробных лекарственных средств. По данным ВОЗ ежегодно на земном шаре переносит инфекционные заболевания более 1 миллиарда человек. На долю этих болезней приходится около 25% всех смертей в мире(*). В Республике Беларусь ежегодно регистрируется 2-2,5 миллиона случаев инфекционных заболеваний, в том числе вызванных бактериями. Одними из наиболее опасных считаются острые инфекционные заболевания дыхательных путей. Особое значение на сегодняшний день во многих странах приобретает, в частности, проблема туберкулеза. В Республике Беларусь показатель заболеваемости туберкулезом составил в 2012 году 39,6 человек на 100 тысяч населения - это на 3,9% ниже по сравнению с 2011 годом. Тем не менее ситуация с туберкулезом в Республике остается напряженной ввиду появления лекарственно устойчивых форм, а также групп риска по данному заболеванию (мигранты, ВИЧ-инфицированные, социально неблагополучные контингенты населения). ВОЗ рекомендована стратегия борьбы с туберкулезом, известная под названием Directly Observed Treatment Strategy (DOTS). В основу стратегии DOTS положены пять основных элементов, в отсутствии каждого из которых она остается малоэффективной. Неотъемлемой частью программы является создание надежной системы поставки высококачественных противотуберкулезных лекарственных препаратов для учреждений здравоохранения, которые обеспечивали бы непрерывность процесса лечения больных туберкулезом. В настоящее время противотуберкулезные препараты делят на препараты 1-ого Со (основного) ряда (изониазид, этамбутол, рифампицин, стрептомицин и другие), используемые для лечения обычного (чувствительного) туберкулеза и 2-ого (резервного) ряда (канамицин, циклосерин, капреомицин), применяемые при наличии резистентности возбудителя к препаратам первого ряда. Высокое качество противотуберкулезных лекарственных средств является гарантией успеха в терапии туберкулеза. Одним из показателей качества средств антимикробной терапии, в том числе используемых при лечении туберкулеза, является количественное содержание или активность действующего вещества. Поэтому разработка методики, обеспечиваюшей стабильное достоверное определение этого показателя, является актуальной задачей. 1. Валидация методики количественного определения антибиотиков Общие сведения о лекарственном средстве Капреомицин. Антибиотик капреомицин был выделен в 1960 году Herr и соавторами из штамма Streptomyces capreolus. Это полипептидный антибиотик, представляющий собой комплекс из 4-х микробиологически активных компонентов, структура которых полностью не установлена. Смесь капреомицинов IA, IB, IIA, IIB имеет примерное процентное отношение 25:67:3:6. Капреомицин - белое вещество. Растворим в воде с образованием бесцветного раствора. Практически нерастворим в большинстве органических растворителей. Применяется в форме капреомицина сульфата с содержанием активного вещества от 700 мкг/мг до 1050 мкг/мг. Капреомицин избирательно активен в отношении Mycobacterium tuberculosis, локализующихся вне- и внутриклеточно. Ингибирует синтез белка в бактериальной клетке, оказывает бактериостатическое действие. Капреомицин применяется при лечении легочных форм туберкулеза, вызванных чувствительными к нему штаммами микобактерий, в том случае, если препараты 1-ого ряда неэффективны или не могут применяться из-за токсического действия, или присутствуют устойчивые к их действию микроорганизмы. Фармакологические и клинические исследования капреомицина были начаты ещё в 60-ых годах XX века. В Национальном медицинском исследовательском центре (Denver, Col, USA) было проведено исследование, целью которого было проанализировать деятельность всех доступных противотуберкулезных препаратов в бульонной культуре in vitro в анаэробных условиях. В результате только капреомицин оказался бактерицидным в этих условиях, его деятельность оказалась на том же уровне, что и у метронидозола, единственного препарата, известного на тот момент эффективностью в отношении бактерии туберкулеза в анаэробных условиях. Этот вывод был подтвержден в 6-ти экспериментах с 3-мя штаммами Mycobacterium tuberculosis. Для изучения бактериостатической активности капреомицина, а также эффективности его при туберкулезной инфекции, вызванной как чувствительными, так и устойчивыми к антибиотикам группы стрептомицина штаммами, в Центральном научно-исследовательском институте туберкулеза (ЦНИИТ) были селекционированы клонированные штаммы, чувствительные и устойчивые к различным концентрациям стрептомицина, канамицина, флоримицина (виомицина) и капреомицина[8]. Опыты in vitro проводили на жидкой среде Школьниковой методом серийных разведений. Была установлена невысокая бактериостатическая активность капреомицина по отношению к исходному чувствительному штамму микобактерий h47Rv. Минимальная подавляющая концентрация (МПК) капреомицина составляла 2 мкг/мл. Она не повышалась при действии капреомицина на штаммы, обладающие различной степенью устойчивости к стрептомицину. МПК стрептомицина при действии на штаммы, устойчивые к различным концентрациям капреомицина, по сравнению с действием его на чувствительный штамм почти не увеличивалась и составляла 0,5 мкг/мл. Таким образом, не было выявлено снижения активности стрептомицина по отношению к капреомициноустойчивым штаммам и активности капреомицина по отношению к стрептомициноустойчивым штаммам. При действии капреомицина на штаммы, устойчивые к 250 мкг/мл канамицина, наблюдалось снижение бактериостатической активности капреомицина по сравнению с действием его на чувствительные штаммы в 8-16 раз. МПК капреомицина при действии его на штаммы, устойчивые к 500 и 1000 мкг/мл канамицина, еще больше увеличивалась и составляла 120 мкг/мл. При действии канамицина на капреомициноустойчивые штаммы наблюдалось четкое снижение его активности по сравнению с действием на чувствительные штаммы. При невысокой: устойчивости штаммов к капреоминину МПК канамицина повышалась в 5-10 раз, при действии же канамицина на высокоустойчивые к капреомицину штаммы его активность снижалась более чем в 100 раз. В целом наблюдалось незначительное снижение активности капреомицина по отношению к высокоустойчивым к канамицину штаммам и резкое снижение активности канамицина по отношению к штаммам, высокоустойчивым к капреомицину. При рассмотрении взаимоотношений между капреомицином и флоримицином наблюдались двустороннее снижение чувствительности для штаммов, обладающих невысокой устойчивостью к антибиотикам, и двусторонняя перекрестная устойчивость для штаммов, обладающих высокой устойчивостью к данным антибиотикам. При действии капреомицина на экспериментальную туберкулезную инфекцию у мышей, вызванную клонированным и чувствительным штаммом RV, выявилась низкая эффективность капреомицина по сравнению с другими препаратами этой группы (индекс эффективности равнялся 5%). Суть испытания состоит в измерении температуры тела кроликов после введения им в ушную вену испытуемых стерильных жидкостей. Испытания проводят на трех кроликах, масса тела которых не отличается более чем на 0,5 кг. Жидкость считают непирогенной, если сумма повышения температуры у трех кроликов не превышает 1,4°С. Если эта сумма находится в пределах 1,5-2,2°С, испытание повторяют на пяти кроликах, а если превышает 2,2°С, то жидкость считается пиро генной. Испытание пирогенности на кроликах отличается определенными трудностями. Поэтому во многие фармакопеи мира (США, Великобритании, Китая и др.) для определения пирогенности ЛС включен так называемый Л АЛ-тест (определение бактериальных эндотоксинов). В его основе лежит способность лизата амебоцитов (клеток крови) мечехвоста специфически реагировать с эндотоксинами грамотрицательных бактерий (липосахаридами). В результате взаимодействия эндотоксина и лизата появляется помутнение прозрачной реакционной смеси или происходит образование твердого геля, что служит подтверждением присутствия эндотоксина. Сырьем для производства ЛАЛ-реагента служит кровь мечехвостов - морских животных, обитающих у берегов Северной Америки, Японии, Китая, Вьетнама. Л АЛ-гест высокоспецифичен по отношению к эндотоксинам грамотрицательных бактерий. Его чувствительность во много раз выше, чем у фармакопейного теста на кроликах, а области применения значительно шире. ЛАЛ-тест применим в производственном (постадийном) контроле содержания эндотоксинов в инъекционных ЛФ, поскольку дает возможность получения результатов в течение 1-2 часов и одновременного испытания большого количества образцов. Кроме того, этот тест обеспечивает надежность и воспроизводимость получения результатов, сочетающихся с простотой используемой методики. Реактив для ЛАЛ-теста предсталяет собой сублимационно высушенный лизат, который готов к использованию после разведения его апирогенной водой. Учитывая преимущества ЛАЛ-теста, подготовлен проект ОФС "Определение содержания бактериальных эндотоксинов" для включения в очередное издание ГФ РФ. Испытание на токсичность проводят на белых мышах обоего пола массой 19-21 г. Испытуемый раствор вводят в хвостовую вену пяти мышам и ведут1 наблюдение за ними в течение 48 час. Если ни одна из подопытных мышей в течение этого срока не погибнет, то ЛП считается выдержавшим испытание на токсичность. В случае гибели хотя бы одной мыши испытания повторяют по определенной схеме и делают окончательное заключение о его токсичности. Испытаниям на микробиологическую чистоту подвергают не стерилизуемые в процессе производства ЛП (таблетки, капсулы, гранулы, растворы, экстракты, мази и др.). Эти испытания имеют своей целью определение состава и количества имеющейся в ЛФ микрофлоры. При этом устанавливается соответствие нормам, ограничивающим микробную обсеме- ненность (контаминацию). Испытание включает количественное определение жизнеспособных бактерий и грибов, выявление некоторых видов микроорганизмов, кишечной флоры и стафилококков. Испытание выполняют в асептических условиях в соответствии с требованиями ГФ XI (в. 2, с. 193) двухслойным агаровым методом в чашках Петри. Испытание на стерильность основано на доказательстве отсутствия в ЛС жизнеспособных микроорганизмов любого вида и является одним из важнейших показателей безопасности ЛС. Этим испытаниям подвергаются все ЛП для парентерального введения, глазные капли, мази и т.д. Для контроля стерильности применяют биогликолевую и жидкую среду Са- буро, используя метод прямого посева на питательные среды. Если ЛС обладает выраженным антимикробным действием или разлито в емкости более 100 мл, то используют метод мембранной фильтрации. Валидация - это подтверждение обоснованности выбора метода анализа для установления норм качества Л С по каждому разделу НД. Она проводится при подготовке проектов НД на новые ЛС или при последующем пересмотре НД. Ва- лидации подвергаются аналитические методы, используемые для идентификации ЛВ, установления содержания в нем различных примесей, количественного определения индивидуальных ЛВ и содержания их в ЛФ, определения вспомогательных веществ и консервантов. Валидация метода анализа предполагает оценку его специфичности, линейной зависимости результатов испытаний, аналитической области методики, правильности, воспроизводимости результатов, предела обнаружения. Ревалидация необходима в тех случаях, когда произошли изменения в синтезе ЛВ, в составе ЛС, в аналитической методике. Параметры аналитического метода, устанавливаемые при его валидации и ревалидации, рассчитываются в соответствии с существующими правилами статистической обработки результатов анализа. Специфичность метода анализа обусловливает его способность достоверно установить наличие ЛВ в присутствии других компонентов (примесей, вспомогательных веществ). Оценка специфичности необходима для методов, используемых при идентификации, определении примесей и количественного содержания Л В. Линейная зависимость аналитических сигналов от концентрации ЛВ устанавливается графически. Оценивается она на основании не менее 5 испытаний, выполненных с помощью используемой аналитической методики. Параметрами, подтверждающими линейную зависимость, являются коэффициент регрессии, угол наклона линии регрессии и остаточная сумма площадей. Аналитическая область методики охватывает интервал между верхним и нижним пределами содержания испытуемого вещества, в котором соблюдается линейная зависимость. При этом данная методика должна обеспечивать определение с требуемыми воспроизводимостью и точностью. Аналитическая область выражается в тех же единицах,что и результаты испытаний с помощью данной методики (проценты, миллионные доли). Правильность (точность) аналитического метода характеризует близость результатов, полученных с помощью данной методики, к истинному значению. При установлении этого параметра для количественного определения субстанций, примесей могут быть использованы стандартные образцы, другие независимые методик! ьные смеси, метод добавок. Правильность оценивается не менее чем на трех повторностях определения для трех аналитических концентраций в пределах аналитической области. Воспроизводимость аналитического метода отражает степень совпадений результатов отдельных испытаний при многократном использовании методики. Она устанавливается при количественном определении не менее 9 аликвот образца и выражается в результате статистической обработки по величинам стандартного отклонения, коэффициента вариации и доверительного интервала. Межлабораторная воспроизводимость аналитического метода показывает степень воспроизводимости результатов испытаний, выполненных по разработанной методике в различных лабораториях на соответствующем оборудовании, разными аналитиками, в разное время. Предел обнаружения - минимальное содержание анализируемого вещества, которое можно обнаружить с помощью данной методики (выражается в процентах или миллионных долях). Устанавливается для химических методов визуально. Для физико-химических методов устанавливается по минимальной концентрации испытуемого вещества, которое может быть достоверно обнаружено или рассчитывается по величине стандартного отклонения и углу наклона калибровочной кривой. Предел количественного определения - минимальное содержание (в процентах) анализируемого вещества, которое может быть определено с достаточной точностью и воспроизводимостью. Устанавливается для любых методов визуально или расчетным путем подобно установлению предела обнаружения. Пригодность системы - интегральная часть аналитических методик, подтверждающая надежность анализа в заданных условиях его проведения. Стандартными образцами (СО) называют вещества, с которыми сравнивают испытуемые ЛС при проведении их анализа физико-химическими или биологическими методами. Условно разделяют СО на химические и биологические, но это не исключает использования одного и того же из них и для физико-химического, и для биологического анализа. В ГФ XI, вып. 2 (с. 60) даны определения терминов "государственные стандартные образцы" (ГСО). "рабочие стандартные образцы" (PCO) и "стандартные образцы веществ-свидетелей" (СОВС). Активность, или содержание вещества (%) в ГСО принимается за 100%, если нет других указаний на этикетке. Выпуск ГСО осуществляют в соответствии с требованиями ФС, которая разрабатывается предприятием-разработчиком. В качестве PCO используют образцы серийных Л В, которые соответствуют требованиям ФС (ФСП). Расчет количественного содержания ЛВ в ЛФ проводят исходя из фактического содержания его в PCO. В качестве СОВС используют ГСО, PCO и вещества, специально изготовленные в порядке, предусмотренном ФС. Применяют СОВС для определения примесей или компонентного состава испытуемых ЛС. Ряд особенностей имеют СО на антибиотики. Среди них имеются как однокомпонентные вещества, так и сложные, состоящие из нескольких компонентов близкой природы (аминогликозиды, полиены), каждый из которых определяет как активность и токсичность, так и физико-химические константы ЛС. При разработке такого СО его активность определяется исходя из количественного содержания в нем действующего ЛВ. Кроме того, при стандартизации антибиотиков имеется тенденция к созданию единого стандарта к группе веществ, сходных по химическому строению. Аттестацией, хранением и реализацией СО занимается НИИКЛС. Он проводит экспертизу всех проектов ФС на ГСО, разработанных предприятиями и организациями, выпускающими эти ГСО. Только после этого они утверждаются МЗ РФ в установленном порядке. Номенклатура ГСО отечественного производства включает около 140 наименований. Они используются при выполнении физико-химических и биологических испытаний более чем 300 ЛС (прежде всего синтетических). Еще более широко используются PCO, представляющие собой образцы серийных ЛВ. Их применение отражено в более 700 ФС для испытаний подлинности, чистоты и количественного определения. . Собственное исследование Валидационная оценка аналитических методик Приказом Министерства здравоохранения и социального развития РФ от 30 октября 2006г. №736 принят Административный регламент Федеральной службы по надзору в сфере здравоохранения и социального развития, который предусматривает в структуре регистрационного досье данные о валидации аналитических методик. Кроме того, в соответствии с ГОСТ Р 52249-2004 "Правила производства и контроля качества лекарственных средств" (раздел 6) отдел контроля качества должен обеспечить валидацию методик контроля качества. Однако, в тоже время, данные документы не регламентируют требования к проведению валидации аналитических методик и испытания. Следует отметить, что в Российской Федерации на сегодняшний день нет собственного однозначного нормативного документа регламентирующего порядок проведения процедуры валидации. Однако, в 2007 году в Российской Федерации издано "Руководство для предприятий фармацевтической промышленности (методические рекомендации) ", которое утверждено и введено в действие решением общего собрания членов Ассоциации российских фармацевтических производителей, а также рекомендовано к использованию Федеральной службой по надзору в сфере здравоохранения и социального развития специалистам, занятым в сфере обращения лекарственных средств. Одна из частей данного руководства посвящена валидации методик анализа лекарственных средств. Официальному признанию методики анализа предшествует процедура её метрологической аттестации. В фармацевтической практике этот процесс называется валидацией, то есть экспериментальное доказательство того, что методика пригодна для решения поставленных задач. В зависимости от характера аналитической методики могут применяться те или иные валидационные характеристики (табл.1). Таблица 1 - Валидационные характеристики основных типов методик Наименование характеристикиТипы методикИспытание на подлинностьПосторонние примесиКоличественное определение:Количественные методикиПределы содержанияОсновного действующего вещества, нормируемых компонентовДействующего вещества в тесте "Растворение"Специфичность**ДаДаДаДаДаЛинейностьНетДаНетДаДаАналитическая областьНетДа*ДаДаПравильностьНетДа*ДаДаПрецизионность: - повторяемость (сходимость) - внутрила-бораторная воспроизводимость Нет Нет Да Да Нет Нет Да Да Да НетПредел обнаружения (чувствительность)НетНет2ДаНетНетПредел количественного определенияНетДаНетНетНетРобастность (устойчивость)Нет***** может определяться при необходимости; **отсутствие специфичности одной аналитической методики может быть компенсировано использованием другой аналитической методики; 1-необходимо только для новых методик, не имеющих аналогов; 2-необходимо в случаях, когда предел обнаружения близок к пределу количественного определения. Для проведения анализа по показателям специфичность, линейность прецензионность и правильность используются растворы модельных смесей следующего состава: Раствор модельной смеси А1. Точные навески левомицетина - субстанции (0,200 г) и таблеточной массы - натрия хлорида (0,200 г) помещают в мерную колбу вместимостью 100 мл, прибавляют 15 мл 0,1 М раствора кислоты хлористоводородной, перемешивают, доводят тем же растворителем до метки, перемешивают. Раствор модельной смеси А2. Точные навески левомицетина - субстанции (0,250 г) и таблеточной массы - натрия хлорида (0,150 г) помещают в мерную колбу вместимостью 100 мл, прибавляют 15 мл 0,1 М раствора кислоты хлористоводородной, перемешивают, доводят тем же растворителем до метки, перемешивают. Модельной смеси А3. Точные навески левомицетина - субстанции (0,300 г) и таблеточной массы - натрия хлорида (0,100 г) помещают в мерную колбу вместимостью 100 мл, прибавляют 15 мл 0,1 М раствора кислоты хлористоводородной, перемешивают, доводят тем же растворителем до метки, перемешивают. Так же используется раствор сравнения который приготавливают следующим образом: Точную навеску СО левомицетина (0,1г) помещают в мерную колбу вместимостью 100 мл, растворяют в 0,1 М растворе кислоты хлористоводородной, доводят 0,1 М раствором кислоты хлористоводородной до метки и перемешивают. Специфичность Под специфичностью методики следует понимать способность достоверно определять анализируемое соединение в присутствии других компонентов образца - лекарственных веществ, вспомогательных веществ и посторонних прим Установление специфичности в тестах "Испытание на подлинность". Для установления специфичности в идентификационных тестах, основанных на качественных реакциях, следует убедиться как в отсутствии по-ложительного эффекта реакции на сопутствующие вещества, так и в возможности ингибирования данной реакции компонентами образца. При доказательстве подлинности спектрофотометрическим методом необходимо убедиться в отсутствии светопоглощения у второго компонента, вспомогательных и сопутствующих веществ. Установление специфичности в тестах "Количественное определение" Методики, используемые для количественного определения также должны подвергаться валидационной оценке по данному критерию. Спектрофотометрический метод. При выполнении анализа спектрофото-метрическим методом нужно подтвердить, что сопутствующие компоненты не мешают определению. Готовят модельные смеси по следующей методике: Раствор модельной смеси А1. Точные навески левомицетина - субстанции (0,200 г) и таблеточной массы - натрия хлорида (0,200 г) помещают в мерную колбу вместимостью 100 мл, прибавляют 15 мл 0,1 М раствора кислоты хлористоводородной, перемешивают, доводят тем же растворителем до метки, перемешивают. Раствор модельной смеси А2. Точные навески левомицетина - субстанции (0,250 г) и таблеточной массы - натрия хлорида (0,150 г) помещают в мерную колбу вместимостью 100 мл, прибавляют 15 мл 0,1 М раствора кислоты хлористоводородной, перемешивают, доводят тем же растворителем до метки, перемешивают. Модельной смеси А3. Точные навески левомицетина - субстанции (0,300 г) и таблеточной массы - натрия хлорида (0,100 г) помещают в мерную колбу вместимостью 100 мл, прибавляют 15 мл 0,1 М раствора кислоты хлористоводородной, перемешивают, доводят тем же растворителем до метки, перемешивают. В модельной смеси 1 с помощью качественных реакций необходимо доказать подлинность каждого компонента лекарственного средства. В модельной смеси 2 с помощью качественных реакций на второй компо-нент подтверждают отсутствие аналитического эффекта у первого компонента. В модельной смеси 3 с помощью качественных реакций на первый компонент подтверждают отсутствие аналитического эффекта у второго компонента. Необходимо провести определение специфичности одного из ингредиентов в тесте "Количественное определение" титриметрическим методом. Для этого используют модельную смесь 2, содержащую только первый ингредиент, определяемый спектрофотометрическим методом. Согласно методике проводят титрование навески модельной смеси 2. Необходимо убедиться, что компонент 1 не титруется в данных условиях. Проводят определение специфичности одного из ингредиентов в тесте "Количественное определение" спектрофотометрическим методом. Для этого используют модельную смесь 3, содержащую только второй ингредиент, определяемый титриметрическим методом. Выводы: ØВ модельной смеси 1 реакции на подлинность компонентов смеси - левомицетин и натрия хлорид дают положительный результат. ØВ модельной смеси 2 реакции на натрия хлорид дают отрицательный результат. ØВ модельной смеси 3 отсутствие аналитического эффекта у качественных реакций на левомицетин. ØКоличественное определение модельной смеси 2 дает понять что количественно левомицетин не обнаруживается методом аргентометрии. ØКоличественное определение модельной смеси 3 дает понять что содержание натрия хлорида нельзя определить с помощью спектрофотометрии. Основываясь на данных выводах можно сделать заключение о специфичности данной методики. Линейная зависимость устанавливается на основании результатов испытаний, которые пропорциональны концентрации анализируемого вещества в образце в пределах аналитической методики. Линейность результатов может быть представлена графически в виде зависимости аналитических сигналов от концентрации вещества (не менее 5). Аналитическая методика должна быть охарактеризована следующими параметрами для подтверждения линейности: коэффициент регрессии, уголнаклона линии регрессии и остаточная сумма площадей. Для установления максимума светопоглощения раствора левомицетина снимают спектр поглощения 0,002% раствора СО в 0,1 М растворе кислоты хлористоводородной. Приготовление раствора описано ниже при построении градуировочного графика. Максимум должен находиться при длине волны 278 нм (например, оптическая плотность Аст=0,295). Точную навеску СО левомицетина (0,10 г) помещают в мерную колбу вместимостью 100 мл, прибавляют 15 мл 0,1 М раствора кислоты хлористоводородной, перемешивают, доводят тем же растворителем до метки, перемешивают. В мерные колбы вместимостью 100 мл последовательно вносят 1,0 мл; 2,0 мл; 3,0 мл; 4,0 мл; 5,0 мл раствора А и доводят 0,1 М раствором кислоты хлористоводородной до метки (получают 0,001%; 0,002%; 0,003%; 0,004% и 0,005% растворы). Измеряют оптическую плотность каждого раствора на спектрофотометре при длине волны 278 нм в кювете с толщиной слоя 10 мм. Раствор сравнения - 0,1 М раствор кислоты хлористоводородной. Таблица 1. Результаты измерения оптической плотности. V 0,02% р-ра (мл)12345С р-ра в % 0,020,040,060,080,1Оптическая плотность 0,0050,0180,0530,070,135 Рисунок Градуировочный график линейной зависимости оптической плотности от концентрации левомицетина. Прецензионность методики характеризуется рассеянием результатов относительно среднего значения. Определение проводят следуя данной методике: Готовят параллельно по три раствора. Растворы Б1, Б2, Б3. В три мерные колбы вместимостью 100 мл переносят по 0,5 мл раствора модельной смеси А2 и доводят 0,1 М раствором кислоты хлористоводородной до метки. Растворы Б4, Б5, Б6. В три мерные колбы вместимостью 100 мл переносят по 1,0 мл раствора модельной смеси А2 и доводят 0,1 М раствором кислоты хлористоводородной до метки. Растворы Б7, Б8, Б9. В три мерные колбы вместимостью 100 мл переносят по 1,5 мл раствора модельной смеси А2 и доводят 0,1 М раствором кислоты хлористоводородной до метки. Измеряют оптическую плотность каждого из 9 приготовленных растворов на спектрофотометре при длине волны 278 нм в кювете с толщиной слоя 10 мм. Раствор сравнения - 0,1 М раствор кислоты хлористоводородной. Параллельно измеряют оптическую плотность СО 0,002% раствора левомицетина. Расчет содержания левомицетина в г/мл проводят по формуле: (1), где: Ах - оптическая плотность исследуемого раствора; Ао - оптическая плотность раствора СО левомицетина; 0,00002 - содержание рибофлавина в г в 1 мл раствора СО. Va - объем аликвоты раствора модельной смеси 2, взятый для разведения, мл. Xi-XiSD= . SD= = 0.00053 RSD = * 100% . RSD = * 100% = 2.7 %0.002136-0,0001450,000000210.00205-0,0000590,0000000590.001990,0000010,0000010.001960,0000310,00000000960.001930,0000610,0000000370.001880,0001110,00000012=0,001991?=0,000014 Вывод: данная методика не превышает стандартное отклонение в 3% следовательно данная методика подходит по показателю прецинзионность. Правильность Правильность (точность) аналитического метода характеризует близость результатов испытаний, полученных данным методом, к истинному значению. При количественном определении лекарственного вещества этот параметр может быть установлена путем применения аналитического метода к анализируемому объекту с использованием стандарта известной степени чистоты или путем сравнение результатов, полученных предлагаемой аналитической методикой, с результатами, которые получены другой независимой методикой, правильность которой известна. В случае количественного определения вещества в лекарственной форме правильность аналитической методики устанавливается по результатам ее применения к анализу модельной смеси, включающей все компоненты лекарственной формы. Правильность методики количественного определения идентифицированных примесных соединений устанавливается по результатам анализа методом добавок. При отсутствии образцов примесных соединений или в тех случаях, когда структура их не установлена, правильность предлагаемой методики их определения должна быть подтверждена результатами анализадругой аналитической методикой с охарактеризованной правильностью. Правильность должна быть оценена на основе не менее 9 определений на минимум 3 уровнях концентраций в пределе аналитической области (например, 3 повторности определения для 3 аналитических концентраций). Для проведения анализа методики по данному показателю необходимо приготовить модельные смеси пропорции которых указаны в таблице 2. Таблица 2. Приготовление модельных смесей таблеток левомицетина. Модельная смесь1 (А1)2 (А2)3 (А3)Навеска левомицетина - субстанции (г)0,2000,2500,300Таблеточная масса - натрия хлорид (г)0,2000,1500,100Средняя масса0,4000,4000,400 Растворы модельных смесей приготавливают аналогично методике специфичность. Растворы Б1, Б2, Б3. В три мерные колбы вместимостью 100 мл переносят по 1,0 мл раствора модельной смеси А1 и доводят 0,1 М раствором кислоты хлористоводородной до метки. Растворы Б4, Б5, Б6. В три мерные колбы вместимостью 100 мл переносят по 1,0 мл раствора модельной смеси А2 и доводят 0,1 М раствором кислоты хлористоводородной до метки. Растворы Б7, Б8, Б9. В три мерные колбы вместимостью 100 мл переносят по 1,0 мл раствора модельной смеси А3 и доводят 0,1 М раствором кислоты хлористоводородной до метки. Измеряют оптическую плотность каждого из 9 приготовленных растворов на спектрофотометре при длине волны 278 нм в кювете с толщиной слоя 10 мм. Раствор сравнения - 0,1 М раствор кислоты хлористоводородной. Параллельно измеряют оптическую плотность СО 0,002% раствора левомицетина. В мерную колбу вместимостью 100 мл вносят 2,0 мл раствора А и доводят 0,1 М раствором кислоты хлористоводородной до метки. мл раствора Б содержит 0,00002 г СО левомицетина. Расчет содержания левомицетина в процентах (открываемость) проводят по формуле: (2), где: Ах - оптическая плотность исследуемого раствора; Ао - оптическая плотность раствора СО левомицетина; ах -масса навеска исследуемого образца левомицетина; ,00002 - содержание левомицетина в г в 1 мл раствора СО. Таблица 3 AхaxR(%)(Ri-)(Ri-)20,3850,20699,864,9624,60,3860,20694,5-0,040,00160,3860,20694,5-0,040,00160,1470,248107,312,4153,760,1520,248108,213,3176,8901520,248108,213,3176,890,2570,29478,8-16,1259,2102590,29482,6-12,3151,290,2590,29482,6-12,3151,29Аст=0,216=94,9 SD= RSD= * 100%. SD= = 11.89 RSD= * 100% = 1.3 % Вывод: полученное значение меньше коэффициента Стьюдента отсюда следует что данная методика соответствует по показателю правильность. Заключение В данной работе изложена суть и важность валидационных оценок, что позволяет оценить важность этого вида контроля над производством лекарственных средств. Так как методики количественного и качественного анализа дают удовлетворительные результаты только при наличии данного вещества или при определенных условиях, то аналитические методики по данным показателям специфичны. Следуя из того что данная методика не превышает стандартное отклонение в 3% она соответствует по показателю прецинзионность. Полученное значение меньше коэффициента Стьюдента отсюда следует что данная методика соответствует по показателю правильность. Список использованной литературы валидация антибиотик лекарственный специфичность 1)Атлас по медицинской микробиологии, вирусологии и иммунологии. Воробьев А.А., Быков А.С. Беликов, В.Г. Фармацевтическая химия. /В.Г Беликов. В 2 ч.: Ч. 1. Общая фармацевтическая химия; Ч. 2. Специальная фармацевтическая химия. Учеб для вузов. - Пятигорск. 2003. стр. 333-339. )Машковский, М.Д. Лекарственные средства: в 2 т./М.Д. Машковский. - 18-е изд., перераб. и доп.- М.: Новая волна, 2010. - 1234 с. )М.В. Гаврилин, И.Я. Куль, Н.В. Благоразумная, Л.Н. Дуккардт, С.П. Сенченко, С.Н. Степанюк, А.Ю.Курегян./Метрологическая аттестация (валидация) методик анализа лекарственных средств.-Пятигорск 2013. )Методы анализа лекарств /Н.П. Максютина. - Киев: Здоровья, 1984. - 224 с. )Лабораторные работы по фармацевтической химии: Учебное пособие/В.Г. Беликов. - 2-е изд. перераб. и доп. - Пятигорск, 2003. - 342 с. )Анализ лекарственных смесей. А.П. Арзамасцев, В.М. Печенников, Г.М.Родионова и др. Москва компания Спутник+, 2000 год. )Фармакопейная статья: "Таблетки левомицетина 0,25. Валидационная оценка методик анализа левомицетина". Государственная фармакопея. СССР. Вып 2 Общие методы анализа. )Фармакопейная статья "Таблетки". Государственная Фармакопея СССР. Вып 2 Общие методы анализа. )Машковский М.Д. Лекарственные средства. издание пятнадцатое переработанное, исправленное и дополненное, Москва Новая волна 2005 год. Теги: Методы анализа антибиотиков Реферат Медицина, физкультура, здравоохранениеПросмотров: 48353Найти в Wikkipedia статьи с фразой: Методы анализа антибиотиковdiplomba.ru |
г.Самара, ул. Димитрова 131 [email protected] |
 |