|
|
||||||||||
|
Пробиотики против вирусов. Антибиотики против вирусов или бактерийПочему антибиотики бессильны против вирусов?То, что антибиотики неэффективны против вирусов, уже давно стало азбучной истиной. Однако, как показывают опросы, 46% наших соотечественников полагают, что вирусы можно убить антибиотиками. Причина заблуждения, вероятно, кроется в том, что антибиотики прописывают при инфекционных заболеваниях, а инфекции привычно ассоциируются с бактериями или вирусами. Хотя стоит заметить, что одними лишь бактериями и вирусами набор инфекционных агентов не ограничивается. Вообще, антибиотиков великое множество, классифицировать их можно по разным медицинским и биологическим критериям: химическому строению, эффективности, способности действовать на разные виды бактерий или только на какую-то узкую группу (например, антибиотики, нацеленные на возбудителя туберкулёза). Но главное объединяющее их свойство — способность подавлять рост микроорганизмов и вызывать их гибель. Чтобы понять, почему антибиотики не действуют на вирусы, надо разобраться, как они работают. 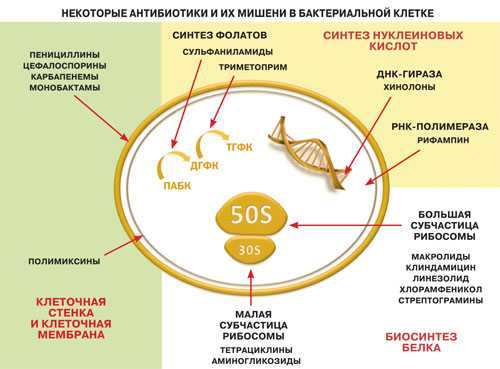 На клеточную стенку действуют бета-лактамные антибиотики, к которым относятся пенициллины, цефалоспорины и другие; полимиксины нарушают целостность мембраны бактериальной клетки.  Клеточная стенка бактерий состоит из гетерополимерных нитей, сшитых между собой короткими пептидными мостиками.  Действие пенициллина на кишечную палочку: из-за пенициллина растущая бактериальная клетка не может достраивать клеточную стенку, которая перестаёт покрывать клетку целиком, в результате чего клеточная мембрана начинает выпячиваться и рваться.Подробнее см.: http://www.nkj.ru/archive/articles/24629/ (Наука и жизнь, Почему антибиотики бессильны против вирусов?) Какие слабые места антибиотики находят у бактерий? Во-первых, клеточная стенка. Любой клетке нужна какая-то граница между ней и внешней средой — без этого и клетки-то никакой не будет. Обычно границей служит плазматическая мембрана — двойной слой липидов с белками, которые плавают в этой полужидкой поверхности. Но бактерии пошли дальше: они кроме клеточной мембраны создали так называемую клеточную стенку — довольно мощное сооружение и к тому же весьма сложное по химическому строению. Для формирования клеточной стенки бактерии используют ряд ферментов, и если этот процесс нарушить, бактерия с большой вероятностью погибнет. (Клеточная стенка есть также у грибов, водорослей и высших растений, но у них она создаётся на другой химической основе.) Во-вторых, бактериям, как и всем живым существам, надо размножаться, а для этого нужно озаботиться второй копией наследственной молекулы ДНК, которую можно было бы отдать клетке-потомку. Над этой второй копией работают специальные белки, отвечающие за репликацию, то есть за удвоение ДНК. Для синтеза ДНК нужен «стройматериал», то есть азотистые основания, из которых ДНК состоит и которые складываются в ней в «слова» генетического кода. Синтезом оснований-кирпичиков опять же занимаются специализированные белки. Третья мишень антибиотиков — это трансляция, или биосинтез белка. Известно, что ДНК хорошо подходит для хранения наследственной информации, но вот считывать с неё информацию для синтеза белка не очень удобно. Поэтому между ДНК и белками существует посредник — матричная РНК. Сначала с ДНК снимается РНК-копия, — этот процесс называется транскрипцией, а потом на РНК происходит синтез белка. Выполняют его рибосомы, представляющие собой сложные и большие комплексы из белков и специальных молекул РНК, а также ряд белков, помогающих рибосомам справляться с их задачей. Большинство антибиотиков в борьбе с бактериями «атакуют» одну из этих трёх главных мишеней — клеточную стенку, синтез ДНК и синтез белка в бактериях. Например, клеточная стенка бактерий — мишень для хорошо известного антибиотика пенициллина: он блокирует ферменты, с помощью которых бактерия осуществляет строительство своей внешней оболочки. Если применить эритромицин, гентамицин или тетрациклин, то бактерии перестанут синтезировать белки. Эти антибиотики связываются с рибосомами так, что трансляция прекращается (хотя конкретные способы подействовать на рибосому и синтез белка у эритромицина, гентамицина и тетрациклина разные). Хинолоны подавляют работу бактериальных белков, которые нужны для распутывания нитей ДНК; без этого ДНК невозможно правильно копировать (или реплицировать), а ошибки копирования ведут к гибели бактерий. Сульфаниламидные препараты нарушают синтез веществ, необходимых для производства нуклеотидов, из которых состоит ДНК, так что бактерии опять-таки лишаются возможности воспроизводить свой геном. Почему же антибиотики не действуют на вирусы? Во-первых, вспомним, что вирус — это, грубо говоря, белковая капсула с нуклеиновой кислотой внутри. Она несёт в себе наследственную информацию в виде нескольких генов, которые защищены от внешней среды белками вирусной оболочки. Во-вторых, для размножения вирусы выбрали особенную стратегию. Каждый из них стремится создать как можно больше новых вирусных частиц, которые будут снабжены копиями генетической молекулы «родительской» частицы. Словосочетание «генетическая молекула» использовано не случайно, так как среди молекул-хранительниц генетического материала у вирусов можно найти не только ДНК, но и РНК, причём и та и другая могут быть у них как одно-, так и двухцепочечными. Но так или иначе вирусам, как и бактериям, как и вообще всем живым существам, для начала нужно свою генетическую молекулу размножить. Вот для этого вирус пробирается в клетку. Что он там делает? Заставляет молекулярную машину клетки обслуживать его, вируса, генетический материал. То есть клеточные молекулы и надмолекулярные комплексы, все эти рибосомы, ферменты синтеза нуклеиновых кислот и т. д. начинают копировать вирусный геном и синтезировать вирусные белки. Не будем вдаваться в подробности, как именно разные вирусы проникают в клетку, что за процессы происходят с их ДНК или РНК и как идёт сборка вирусных частиц. Важно, что вирусы зависят от клеточных молекулярных машин и особенно — от белоксинтезирующего «конвейера». Бактерии, даже если проникают в клетку, свои белки и нуклеиновые кислоты синтезируют себе сами. Что произойдёт, если к клеткам с вирусной инфекцией добавить, например, антибиотик, прерывающий процесс образования клеточной стенки? Никакой клеточной стенки у вирусов нет. И потому антибиотик, который действует на синтез клеточной стенки, ничего вирусу не сделает. Ну а если добавить антибиотик, который подавляет процесс биосинтеза белка? Всё равно не подействует, потому что антибиотик будет искать бактериальную рибосому, а в животной клетке (в том числе человеческой) такой нет, у неё рибосома другая. В том, что белки и белковые комплексы, которые выполняют одни и те же функции, у разных организмов различаются по структуре, ничего необычного нет. Живые организмы должны синтезировать белок, синтезировать РНК, реплицировать свою ДНК, избавляться от мутаций. Эти процессы идут у всех трёх доменов жизни: у архей, у бактерий и у эукариот (к которым относятся и животные, и растения, и грибы), — и задействованы в них схожие молекулы и надмолекулярные комплексы. Схожие — но не одинаковые. Например, рибосомы бактерий отличаются по структуре от рибосом эукариот из-за того, что рибосомная РНК немного по-разному выглядит у тех и других. Такая непохожесть и мешает антибактериальным антибиотикам влиять на молекулярные механизмы эукариот. Это можно сравнить с разными моделями автомобилей: любой из них довезёт вас до места, но конструкция двигателя может у них отличаться и запчасти к ним нужны разные. В случае с рибосомами таких различий достаточно, чтобы антибиотики смогли подействовать только на бактерию. До какой степени может проявляться специализация антибиотиков? Вообще, антибиотики изначально — это вовсе не искусственные вещества, созданные химиками. Антибиотики — это химическое оружие, которое грибы и бактерии издавна используют друг против друга, чтобы избавляться от конкурентов, претендующих на те же ресурсы окружающей среды. Лишь потом к ним добавились соединения вроде вышеупомянутых сульфаниламидов и хинолонов. Знаменитый пенициллин получили когда-то из грибов рода пенициллиум, а бактерии стрептомицеты синтезируют целый спектр антибиотиков как против бактерий, так и против других грибов. Причём стрептомицеты до сих пор служат источником новых лекарств: не так давно исследователи из Северо-Восточного университета (США) сообщили о новой группе антибиотиков, которые были получены из бактерий Streptomyces hawaiensi, — эти новые средства действуют даже на те бактериальные клетки, которые находятся в состоянии покоя и потому не чувствуют действия обычных лекарств. Грибам и бактериям приходится воевать с каким-то определённым противником, кроме того, необходимо, чтобы их химическое оружие было безопасно для того, кто его использует. Потому-то среди антибиотиков одни обладают самой широкой антимикробной активностью, а другие срабатывают лишь против отдельных групп микроорганизмов, пусть и довольно обширных (как, например, полимиксины, действующие только на грамотрицательные бактерии). Более того, существуют антибиотики, которые вредят именно эукариотическим клеткам, но совершенно безвредны для бактерий. Например, стрептомицеты синтезируют циклогексимид, который подавляет работу исключительно эукариотических рибосом, и они же производят антибиотики, подавляющие рост раковых клеток. Механизм действия этих противораковых средств может быть разным: они могут встраиваться в клеточную ДНК и мешать синтезировать РНК и новые молекулы ДНК, могут ингибировать работу ферментов, работающих с ДНК, и т. д., — но эффект от них один: раковая клетка перестаёт делиться и погибает. Возникает вопрос: если вирусы пользуются клеточными молекулярными машинами, то нельзя ли избавиться от вирусов, подействовав на молекулярные процессы в заражённых ими клетках? Но тогда нужно быть уверенными в том, что лекарство попадёт именно в заражённую клетку и минует здоровую. А эта задача весьма нетривиальна: надо научить лекарство отличать заражённые клетки от незаражённых. Похожую проблему пытаются решить (и небезуспешно) в отношении опухолевых клеток: хитроумные технологии, в том числе и с приставкой нано-, разрабатываются для того, чтобы обеспечить адресную доставку лекарств именно в опухоль. Что же до вирусов, то с ними лучше бороться, используя специфические особенности их биологии. Вирусу можно помешать собраться в частицу, или, например, помешать выйти наружу и тем самым предотвратить заражение соседних клеток (таков механизм работы противовирусного средства занамивира), или, наоборот, помешать ему высвободить свой генетический материал в клеточную цитоплазму (так работает римантадин), или вообще запретить ему взаимодействовать с клеткой. Вирусы не во всём полагаются на клеточные ферменты. Для синтеза ДНК или РНК они используют собственные белки-полимеразы, которые отличаются от клеточных белков и которые зашифрованы в вирусном геноме. Кроме того, такие вирусные белки могут входить в состав готовой вирусной частицы. И антивирусное вещество может действовать как раз на такие сугубо вирусные белки: например, ацикловир подавляет работу ДНК-полимеразы вируса герпеса. Этот фермент строит молекулу ДНК из молекул-мономеров нуклеотидов, и без него вирус не может умножить свою ДНК. Ацикловир так модифицирует молекулы-мономеры, что они выводят из строя ДНК-полимеразу. Многие РНК-вирусы, в том числе и вирус СПИДа, приходят в клетку со своей РНК и первым делом синтезируют на данной РНК молекулу ДНК, для чего опять же нужен особый белок, называемый обратной транскриптазой. И ряд противовирусных препаратов помогают ослабить вирусную инфекцию, действуя именно на этот специфический белок. На клеточные же молекулы такие противовирусные лекарства не действуют. Ну и наконец, избавить организм от вируса можно, просто активировав иммунитет, который достаточно эффективно опознаёт вирусы и заражённые вирусами клетки. Итак, антибактериальные антибиотики не помогут нам против вирусов просто потому, что вирусы организованы в принципе иначе, чем бактерии. Мы не можем подействовать ни на вирусную клеточную стенку, ни на рибосомы, потому что у вирусов ни того, ни другого нет. Мы можем лишь подавить работу некоторых вирусных белков и прервать специфические процессы в жизненном цикле вирусов, однако для этого нужны особые вещества, действующие иначе, нежели антибактериальные антибиотики. Однако надо сделать пару уточнений. На самом деле бывает, что при вирусной простуде врачи рекомендуют принимать антибиотики, но это связано с тем, что вирусная инфекция осложняется бактериальной, с теми же симптомами. Так что антибиотики тут нужны, но не для того, чтобы избавиться от вирусов, а для того, чтобы избавиться от «зашедших на огонёк» бактерий. Кроме того, говоря об антибиотиках, подавляющих биосинтез белка, мы упирали на то, что такие антибиотики могут взаимодействовать только с бактериальными молекулярными машинами. Но, например, тетрациклиновые антибиотики активно подавляют работу и эукариотических рибосом тоже. Однако на наши клетки тетрациклины всё равно не действуют — из-за того, что не могут проникнуть сквозь клеточную мембрану (хотя бактериальная мембрана и клеточная стенка для них вполне проницаемы). Отдельные антибиотики, например пуромицин, действуют не только на бактерии, но и на инфекционных амёб, червей-паразитов и некоторые опухолевые клетки. Очевидно, различия между бактериальными и эукариотическими молекулами и молекулярными комплексами, участвующими в одних и тех же процессах, для ряда антибиотиков не так уж велики и они могут действовать как на те, так и на другие. Однако это вовсе не значит, что такие вещества могут быть эффективны против вирусов. Тут важно понять, что в случае с вирусами складываются воедино сразу несколько особенностей их биологии и антибиотик против такой суммы обстоятельств оказывается бессилен. И второе уточнение, вытекающее из первого: может ли такая «неразборчивость» или, лучше сказать, широкая специализация антибиотиков лежать в основе побочных эффектов от них? На самом деле такие эффекты возникают не столько оттого, что антибиотики действуют на человека так же, как на бактерии, сколько оттого, что у антибиотиков обнаруживаются новые, неожиданные свойства, с их основной работой никак не связанные. Например, пенициллин и некоторые другие бета-лактамные антибиотики плохо действует на нейроны — а всё потому, что они похожи на молекулу ГАМК (гамма-аминомасляной кислоты), одного из основных нейромедиаторов. Нейромедиа-торы нужны для связи между нейронами, и добавка антибиотиков может привести к нежелательным эффектам, как если бы в нервной системе образовался избыток этих самых нейромедиаторов. В частности, некоторые из антибиотиков, как считается, могут провоцировать эпилептические припадки. Вообще, очень многие антибиотики взаимодействуют с нервными клетками, и часто такое взаимодействие приводит к негативному эффекту. И одними лишь нервными клетками дело не ограничивается: антибиотик неомицин, например, если попадает в кровь, сильно вредит почкам (к счастью, он почти не всасывается из желудочно-кишечного тракта, так что при приёме перорально, то есть через рот, не наносит никакого ущерба, кроме как кишечным бактериям). Впрочем, главный побочный эффект от антибиотиков связан как раз с тем, что они вредят мирной желудочно-кишечной микрофлоре. Антибиотики обычно не различают, кто перед ними, мирный симбионт или патогенная бактерия, и убивают всех, кто попадётся на пути. А ведь роль кишечных бактерий трудно переоценить: без них мы бы с трудом переваривали пищу, они поддерживают здоровый обмен веществ, помогают в настройке иммунитета и делают много чего ещё, — функции кишечной микрофлоры исследователи изучают до сих пор. Можно себе представить, как чувствует себя организм, лишённый компаньонов-сожителей из-за лекарственной атаки. Поэтому часто, прописывая сильный антибиотик или интенсивный антибиотический курс, врачи заодно рекомендуют принимать препараты, которые поддерживают нормальную микрофлору в пищеварительном тракте пациента. – На клеточную стенку действуют бета-лактамные антибиотики, к которым относятся пенициллины, цефалоспорины и другие; полимиксины нарушают целостность мембраны бактериальной клетки. Сульфаниламиды и триметоприм подавляют превращение пара-аминобензойной кислоты (ПАБК) и дигидрофолата (ДГФК) в тетрагидрофолиевую кислоту (ТГФК), необходимую для синтеза нуклеотидов. Хинолоны действуют на ДНК-гиразу и мешают распутывать ДНК при копировании; рифампин ингибирует фермент, синтезирующий РНК. Тетрациклины, аминогликозиды, макролиды и ряд других антибиотиков подавляют биосинтез белка, взаимодействуя с рибосомами бактерий.– Клеточная стенка бактерий состоит из гетерополимерных нитей, сшитых между собой короткими пептидными мостиками. Такую сшивку выполняет специальный пенициллин-связывающий белок (1—3), но в присутствии пенициллина фермент перестаёт работать, так как антибиотик связывается с его активным центром (4—5). В результате нити клеточной стенки остаются нескреплёнными между собой.– У многих вирусов кроме генома в виде ДНК или РНК и белкового капсида есть ещё дополнительная оболочка, или суперкапсид, которая состоит из фрагментов хозяйских клеточных мембран (фосфолипидов и белков) и удерживает на себе вирусные гликопротеины. С помощью этих гли-копротеинов вирус узнаёт нужную ему клетку, а оболочка помогает ему проникнуть внутрь. Иллюстрация: Gе rard Cohen/Wikimedia Commons. golbis.com Как лечить вирусы и бактерииПочему в одних случаях назначают противовирусные препараты, а в других - антибиотики? Чтобы лечение крохи было эффективным, мама тоже должна в этом разбираться! В большинстве случаев простуду вызывают вирусы. Но иногда за насморком, кашлем и болью в горле могут скрываться другие возбудители - бактерии, микоплазмы, хламидии, грибы и даже несколько патогенных микроорганизмов сразу (так называемые микст-инфекции). Все эти острые респираторные заболевания протекают однотипно. Но врач всегда заметит разницу, от которой и зависит лечебная тактика. Например, против вирусов эффективны средства вроде интерферона, на бактерии действуют антибиотики. При этом вирусную инфекцию глушить антибиотиками бесполезно, а грибковую инфекцию - крайне опасно: от этого лечения патогенные грибы растут, как на дрожжах, угрожая тяжёлым осложнением - микотическим сепсисом (заражением крови). Вот почему назначать ребёнку препарат должен врач. А от мамы требуется только строго соблюдать рекомендации по его применению. Как лечить ОРВИИнтерфероны - это защитные белки, которые организм вырабатывает при вирусной инфекции. Из крови и других биологических жидкостей они переходят в клетки разных органов и тканей и как бы запирают их на замок, не давая вирусам проникнуть. Но у малышей в силу незрелости иммунитета интерферонов ещё маловато, поэтому при гриппе и ОРВИ приходится вводить их дополнительно, закапывая в носик. Причём делать это нужно в первые три дня заболевания, пока возбудители не успели спрятаться в клетки. Чем раньше начато лечение интерферонами, тем оно эффективнее! Педиатры часто прописывают интерферон самым маленьким детишкам, в том числе грудничкам, у которых даже насморк часто протекает с осложнениями - трахеобронхитом, воспалением лёгких, уха и околоносовых пазух, стоматитом. Дело в том, что полость носа у младенцев очень тесная, а её ткани содержат много воды, поэтому, воспалившись, они сильно отекают и мешают воздуху проходить через нос. Крохе приходится дышать поверхностно и часто, ему трудно сосать, а иногда накормить младенца вообще не получается. Вынужденный дышать ртом, младенец заглатывает воздух, из-за этого младенца тревожат газы, вздувается животик, диафрагма снизу поджимает лёгкие, ещё больше затрудняя дыхание. Интерферон всего этого не допустит! Применяют его и при вирусном конъюнктивите (например, при аденовирусной, энтеровирусной и герпетической инфекции), закапывая капли в глаза. У детишек старше года в качестве противовирусного препарата применяется более продвинутая разновидность интерферона, а при вирусных конъюнктивитах -ещё один препарат, где интерферон также является действующим веществом. От ветрянки и герпесаОба заболевания вызывают практически идентичные вирусы, а значит, против них эффективны одни и те же препараты. Ветряную оспу дети переносят легче взрослых. А вот с герпесом всё наоборот: первая встреча с этой инфекцией тем тяжелее, чем младше ребёнок. Кожными высыпаниями в подобных случаях дело не ограничивается - страдает общее состояние малыша, как при тяжелом гриппе. При простом герпесе, ветрянке и опоясывающем лишае врачи назначают противовирусный препарат, выбирая дозировку в зависимости от возраста маленького пациента и диагноза. Этот же препарат выпускают и для наружного применения - его наносят на кожные высыпания. Существует также специальная глазная мазь: ведь коварные пузырьки могут появиться на конъюнктиве и роговице. А ещё есть препарат с более широким спектром действия: он эффективен при этих же заболеваниях, но помимо этого уничтожает вирус кори, гриппа А и В, гепатита А, В и С. Дозу, схему и длительность приёма ребёнку распишет врач. Бактерии не пройдут!В некоторых случаях причиной простуды или ангины у малыша становятся патогенные бактерии, например, стрептококки или стафилококки. Но чаще всего они идут «вторым эшелоном», как осложнения после вирусных инфекций: это гаймориты, бронхиты, отиты, стоматиты и так далее. Чтобы предотвратить эти осложнения, ослабленным детишкам назначают антибиотики. Эти же лекарства помогают, когда такие осложнения всё же развились. «Антибиотик» переводится с латыни как «препятствующий жизни». Разумеется, смысл не о жизни вообще, а о существовании конкретного микроорганизма, вызвавшего болезнь. Но микробы ведь тоже не лыком шиты! Они научились защищаться от антибиотиков, изменяя свои свойства. Поэтому в спорных случаях врачи берут у малыша мазки из носика или горла, высевают возбудителей на питательную среду и проверяют на чувствительность к тому или иному препарату. Тот, что оказал максимальный эффект, назначают ребенку. Антибиотики различаются по широкому и узкому спектру действия, бактерицидные (убивающие микробные клетки) и бактериостатические (всего лишь приостанавливающие их рост и размножение). Но разобраться во всех тонкостях антибактериальной терапии без специального образования невозможно, поэтому назначать такое лечение должен только доктор. А родители ни при каких обстоятельствах не должна давать заболевшему ребенку антибиотики на собственное усмотрение. Толку от такого лечения точно не будет. Зато негативные побочные эффекты в виде диареи, аллергии и прочих «радостей» не заставят себя ждать. Даже подобранный вашим лечащим врачом антибиотик может не подействовать, если давать его малышу не по правилам. Чтобы этого не случилось, прислушайтесь к советам специалистов. Доведите курс лечения до конца. Если антибиотик подобран правильно, симптомы заболевания обычно исчезают в течение нескольких дней, но это не значит, что можно прервать лечение! Давайте ребёнку препарат столько, сколько назначил доктор (как правило, от 5 до 14 дней). После преждевременной отмены лекарства инфекция возобновится с новой силой и потребует более мощного антибиотика. Давайте ребёнку противогрибковые препараты, а также пре- и пробиотики, чтобы не было дисбактериоза (напомните врачу, если он их не выписал!) Дело в том, что антибиотики уничтожают не только вредные бактерии, которые спровоцировали инфекцию, но и полезные микробы, обитающие на коже и слизистых оболочках крохи, в том числе в пищеварительном тракте. А когда «хорошая» микрофлор; погибает, на её место приходит «плохая». В результате развивается дисбактериоз кишечника с неустойчивым стулом, повышенным образованием газов, склонностью к аллергии. Особенно оживляются грибки-кандиды, вызывающие молочницу: они могут спровоцировать канди-дозные опрелости и стоматит не только у младенцев, но и у малышей постарше. Не смешивайте антибиотики с едой и напитками. Обычно детишки с неохотой принимают такие лекарства - ведь большинство антибиотиков горькие на вкус. Вот мамы и стараются спрятать таблетку в конфетку, растолочь и подмешать в кашу или йогурт. Но это ослабляет или вовсе сводит на нет действие этих лекарств! Ни в коем случае не давайте вашему чаду запивать лекарство молоком или соком - только водой. Если в желудке младенца одновременно встретятся молоко (а также ряженка, кефир, йогурт) и антибактериальный препарат (особенно трациклинового ряда), произойдёт нейтрализация лекарства и оно не подействует. Соки, особенно кислые, тормозят разрушение эритромицина и других антибиотиков, отчего они продолжают циркулировать в крови дольше положенного, что ведёт к передозировке. Лучше поинтересуйтесь, выпускают ли прописанный малышу антибиотик в специальной детской форме - в виде вкусного сиропа или суспензии. Если ранее назначенные антибиотики остались у вас неиспользованными, не давайте их крохе, когда он опять заболеет, даже при тех же симптомах. Раз он уже пролечился этими препаратами, то живущие в его организме бактерии успели выработать устойчивость к ним, а значит, эти лекарства не помогут. По-латыни «вирус» значит «яд». Однако сами по себе вирусы не ядовиты. Но они проникают в клетки, встраиваются в их генетический аппарат и заставляют в массовом порядке воспроизводить копии вирусных частиц. Переполненные ими клетки разрываются, мириады новых вирусов поступают в кровь, вызывая интоксикацию (отравление) всего организма с повышением температуры, слабостью, отсутствием аппетита, тошнотой... Вирусные частицы прячутся внутри клеток, куда лекарства (за очень редким исключением) не проникают, а значит, они не могут их достать. Получается, чо самый; надёжный способ профилактики вирусных инфекций - это вакцинация. После прививки в организме младенца вырабатываются специфические защитные белки - иммуноглобулины, которые уничтожают попавший в организм вирус в месте его проникновения и в кровяном русле - перехватывают при попытке добраться до нужных ему клеток. Проблема лишь в том, что вирусы очень изменчивы. Например, тот же грипп постоянно меняет свою антигенную природу, поэтому против него необходимо прививаться каждый год модифицированной вакциной. Но в любом случае позаботиться о прививках нужно было осенью: в разгар простудного сезона делать их бессмысленно. Сейчас вся надежда на противовирусные препараты. Используют интерферон так: содержимое ампулы надо растворить в кипячёной воде и после этого закапывать в носик малышу, предварительно отсосав из неё слизь маленькой резиновой грушей. А если у вас дома есть специальный ингалятор с насадкой для носа, то лучше распылять препарат с его помощью. www.goagetaway.com Пробиотики против вирусовПРОБИОТИКИ КАК АНТИВИРУСНЫЕ СРЕДСТВАЧем опасны вирусы и как защитить себя от них? - Почему сегодня так стремительно появляются новые вирусы инфекции и эпидемии? - В последние годы действительно возникает немало новых вирусных инфекций. Мутацию вирусов и бактерий вызывают многие причины: неблагополучие экологии, повышение радиации, выброс в атмосферу химических веществ. Исследования в Перми, Соликамске и других промышленных городах показали, что только у трети детей иммунная система здорова. А что значит поражение иммунной системы? Известно, что природа опухоли - это ненормальное деление клеток. Попал с выхлопными газами или при выбросе радиации в костный мозг канцероген, разнесся по организму и вызвал активацию вируса, который нарушил деление клеток. Здоровая иммунная система способна убить клетки-мутанты. Ослабленная оказывается бессильной. Установлено, что в 1994-1996 годах, когда промышленность простаивала, иммунная система была крепче. Сегодня "промышленные" отбросы провоцируют болезни. К тому же человечество потребляет огромное количество лекарств. Сочетание многих из них опасно для иммунной системы. Все это на измененном фоне организма приводит к появлению эпидемий. - Что вы подразумеваете под фоном организма? - Это "микробное зеркало" организма. Если мы его не восстановим, то есть не приведем в норму соотношение необходимых микробов в микрофлоре кишечника, кожном покрове, слизистых верхних дыхательных путей, то процесс мутации вирусов будет продолжаться и дальше. А страшные свойства вирусов-мутантов гораздо сильнее, чем у вирусов в исходном, первоначальном состоянии. Например, давно известен микроб, который вызывал ангину, скарлатину, рожистое воспаление. Этот древний микроб в то же время приносил пользу. Он вырабатывал массу ферментов, противостоящих вирусам. В том числе предопухолевым. Этот микроб постепенно исчезает, а следовательно, более опасные и сильные вирусы, не чувствуя противодействия со стороны микробов организма, начинают размножаться невероятно стремительно. Система отношений микробов и вирусов нарушается. - Почему это происходит и есть ли выход? - Большинство бактерий чувствительны к антибиотикам, как к радиации и химическим выбросам. Убивая микробы, мы убрали то необходимое звено, которое противостоит вирусам. Выход один - восстановить микробный баланс человека, восполнить утраченный микробный багаж человека. Современная наука и трудится над тем, как эффективно сорганизовать соотношение микробы - вирусы. Несомненно, что микробы должны доминировать над вирусами. Иначе процесс окажется тупиковым. И здесь несомненную пользу могут и должны оказывать пробиотики. См. также: ПРОБИОТИКИ ПРОТИВ ГРИППА И ПРОСТУДЫ (ОРВИ) Научно доказано, что около 70% иммуномодулирующих клеток человека находятся в желудочно-кишечном тракте. А это значит, что наше здоровье в сезон простуд во многом зависит от благополучия ЖКТ. Современный люди постоянно испытывают негативные воздействия - плохая экология, вода, недостаток сна и неправильное питание. Все это - катастрофа для иммунитета и микрофлоры кишечника, которая постоянно нуждается в защите и восстановлении. «Одним из эффективных методов поддержания здоровья ЖКТ является регулярное употребление пробиотиков, - напоминает д.м.н., профессор Ирина Чукаева, - Особенно кстати это в холодное время года, когда нашему иммунитету приходится выдерживать массированные атаки вирусных инфекций! Пробиотики - живые микроорганизмы, которые при попадании в желудочно-кишечный тракт человека в достаточном количестве, сохраняют свою активность, жизнеспособность и оказывают положительное влияние на здоровье человека. Их польза для иммунитета подтверждена научными исследованиями. К примеру, австралийские ученые подсчитали, что количество дней нетрудоспособности людей с ослабленным иммунитетом, сокращается наполовину, если принимать пробиотики дважды в день. При этом ключевую роль играет регулярность их употребления. Устойчивый эффект возникает на 3-4 неделе. Но не все пробиотические продукты имеют научно-доказанный иммуномодулирующий эффект. Поэтому для надежной защиты от простудных заболеваний в холодное время года не стоит полагаться исключительно на йогурты и кефирчики, купленные в супермаркете. Желательно принимать специально разработанные биологически активные добавки и к их выбору следует отнестись серьезно, посоветоваться с лечащим врачом… Многочисленными клиническими испытаниями было показано, что пробиотики стимулируют иммунную систему человека и укрепляют ее, активируя выработку антител, которые противостоят гриппу. Причем пробиотики нормализуют разные уровни иммунной системы – как местный иммунитет слизистых, так и гуморальный или общий иммунитет. Как показали результаты 10-летних исследований британских ученых, пробиотики укрепляют иммунитет и почти вдвое снижают риск подхватить грипп или ОРВИ даже в разгар (!) эпидемии. Подобные эффекты пробиотиков объясняют их благоприятным действием на иммунную систему. В ранее проведенных исследованиях доказаны различные механизмы влияния бактерий-пробиотиков на иммунитет. В частности, установлено, что бактерии-пробиотики обладают способностью модулировать иммунный ответ через взаимодействие с Toll-подобными рецепторами, а также стимуляцию регуляторных функций дендритических клеток. У бактерий, содержащихся в пробиотиках, есть и оружие для борьбы с вирусами — ферменты ДНКаза и РНКаза. По словам доктора медицины, профессора Майкла Глиссона из Университета Лафборо (Loughborough), чем больше пробиотиков вы употребляете в пищу, тем меньше вероятность заболевания вирусными инфекциями и тем меньше антибиотиков потребуется для лечения бактериальных инфекций, которые также могут возникнуть вследствие ослабления иммунитета… Причем не так важно, в каком виде вы пробиотики получаете. Это могут быть биокефир, йогурт или ферментированный напиток. Главное, чтобы они содержали большое количество полезных бактерий. Стоит отметить, что пробиотики могут сослужить вам добрую службу даже если вы уже заболели и доктор выписал вам антибиотики. Ученые Колледжа Общественного Здравоохранения Джона Хопкинса (США) установили, что прием пробиотиков на 52% сокращает количество случаев диареи, связанных с применением антибиотиков, а также позволяет редуцировать симптомы синдрома раздраженного кишечника и уменьшить желудочные боли. Кстати, недавно был развенчан миф о том, что постоянное употребление пробиотиков может подавить выработку необходимых веществ самим организмом. Врач - гастроэнтеролог, д.м.н. Юрий Успенский поясняет: «Пробиотические препараты не являются лекарством и у подавляющего большинства из них побочных эффектов не имеется. «Перекормить» организм пробиотиками практически невозможно!» См. также: БАКТЕРИИ КИШЕЧНИКА ПРОТИВ ВИРУСОВ(на примере вируса гриппа) Ученые выяснили, что бактерии, живущие в кишечнике, запускают цепь иммунных реакций для противостояния вирусам… См. также тут: Антибиотики мешают иммунитету. Первые данные о том, что бактерии-симбионты могут «дружить» с иммунной системой млекопитающих, были получены в 1950-х годах: у новорождённых мышей уничтожали всех бактерий, в результате иммунная система начинала работать с перебоями. В последнее десятилетие исследователи усердно изучали виляние бактерий на иммунную систему в пищеварительном отделе — доме для большинства бактерий-симбионтов человека и прочих млекопитающих. Удалось установить, что дисбаланс между дружественными и откровенно патогенными бактериями приводит к резкому повышению количества иммунных клеток, ответственных за воспалительную реакцию. Одновременно накапливались данные о том, что влияние бактерий-симбионтов не ограничивается кишечником, а может распространяться и на другие органы. Работа иммунологов из Йельского университета в Нью-Хэйвене (США) эти догадки подтвердила. Исследователи вводили лабораторным мышам антибиотик неомицин, и грызуны становились очень чувствительны к вирусу гриппа, поскольку препарат выбивал из организма лишнюю «бактериальную» линию обороны от этого недуга. У нормальных мышей бактерии, чувствительные к неомицину, активируют так называемую инфламмасому — белковый комплекс, запускающий воспалительную реакцию. Эта инфламмасома стимулирует созревание другого белка иммунного ответа — интерлейкина 1-β. Ну а тот подаёт сигнал древовидным иммунным клеткам о том, что им нужно отправляться в лёгкие. Древовидные клетки берут под козырёк и тем самым обеспечивают иммунный ответ на вторжение вируса. Учёные полагают, что бактерии, ответственные за включение инфламмасомы, обитают в кишечнике и популяция этих бактерий сильно сокращалась под воздействием антибиотика. В качестве практического вывода из работы учёные советуют, во-первых, быть внимательней к своей диете, а во-вторых, не злоупотреблять антибиотиками при вирусных инфекциях: скверные лекарства и питание могут лишить вашу иммунную систему бактериальных помощников. Но вопрос об «истинных намерениях» бактерий всё равно остаётся: как происходит стимуляция иммунной системы бактериями? Целенаправленно в адрес вторгшегося вируса — или это одно из следствий неспецифического, «безразличного» действия микроорганизмов-симбионтов?. См. также: Как кишечные микробы защищают от гриппа Будьте здоровы!
ССЫЛКИ К РАЗДЕЛУ О ПРЕПАРАТАХ ПРОБИОТИКАХ
propionix.ru Почему антибиотики бессильны против вирусов?   ‹ › ‹ › Какие слабые места антибиотики находят у бактерий? Во-первых, клеточная стенка. Любой клетке нужна какая-то граница между ней и внешней средой — без этого и клетки-то никакой не будет. Обычно границей служит плазматическая мембрана — двойной слой липидов с белками, которые плавают в этой полужидкой поверхности. Но бактерии пошли дальше: они кроме клеточной мембраны создали так называемую клеточную стенку — довольно мощное сооружение и к тому же весьма сложное по химическому строению. Для формирования клеточной стенки бактерии используют ряд ферментов, и если этот процесс нарушить, бактерия с большой вероятностью погибнет. (Клеточная стенка есть также у грибов, водорослей и высших растений, но у них она создаётся на другой химической основе.) Во-вторых, бактериям, как и всем живым существам, надо размножаться, а для этого нужно озаботиться второй копией наследственной молекулы ДНК, которую можно было бы отдать клетке-потомку. Над этой второй копией работают специальные белки, отвечающие за репликацию, то есть за удвоение ДНК. Для синтеза ДНК нужен «стройматериал», то есть азотистые основания, из которых ДНК состоит и которые складываются в ней в «слова» генетического кода. Синтезом оснований-кирпичиков опять же занимаются специализированные белки. Третья мишень антибиотиков — это трансляция, или биосинтез белка. Известно, что ДНК хорошо подходит для хранения наследственной информации, но вот считывать с неё информацию для синтеза белка не очень удобно. Поэтому между ДНК и белками существует посредник — матричная РНК. Сначала с ДНК снимается РНК-копия, — этот процесс называется транскрипцией, а потом на РНК происходит синтез белка. Выполняют его рибосомы, представляющие собой сложные и большие комплексы из белков и специальных молекул РНК, а также ряд белков, помогающих рибосомам справляться с их задачей. Большинство антибиотиков в борьбе с бактериями «атакуют» одну из этих трёх главных мишеней — клеточную стенку, синтез ДНК и синтез белка в бактериях. Например, клеточная стенка бактерий — мишень для хорошо известного антибиотика пенициллина: он блокирует ферменты, с помощью которых бактерия осуществляет строительство своей внешней оболочки. Если применить эритромицин, гентамицин или тетрациклин, то бактерии перестанут синтезировать белки. Эти антибиотики связываются с рибосомами так, что трансляция прекращается (хотя конкретные способы подействовать на рибосому и синтез белка у эритромицина, гентамицина и тетрациклина разные). Хинолоны подавляют работу бактериальных белков, которые нужны для распутывания нитей ДНК; без этого ДНК невозможно правильно копировать (или реплицировать), а ошибки копирования ведут к гибели бактерий. Сульфаниламидные препараты нарушают синтез веществ, необходимых для производства нуклеотидов, из которых состоит ДНК, так что бактерии опять-таки лишаются возможности воспроизводить свой геном. Почему же антибиотики не действуют на вирусы? Во-первых, вспомним, что вирус — это, грубо говоря, белковая капсула с нуклеиновой кислотой внутри. Она несёт в себе наследственную информацию в виде нескольких генов, которые защищены от внешней среды белками вирусной оболочки. Во-вторых, для размножения вирусы выбрали особенную стратегию. Каждый из них стремится создать как можно больше новых вирусных частиц, которые будут снабжены копиями генетической молекулы «родительской» частицы. Словосочетание «генетическая молекула» использовано не случайно, так как среди молекул-хранительниц генетического материала у вирусов можно найти не только ДНК, но и РНК, причём и та и другая могут быть у них как одно-, так и двухцепочечными. Но так или иначе вирусам, как и бактериям, как и вообще всем живым существам, для начала нужно свою генетическую молекулу размножить. Вот для этого вирус пробирается в клетку. Что он там делает? Заставляет молекулярную машину клетки обслуживать его, вируса, генетический материал. То есть клеточные молекулы и надмолекулярные комплексы, все эти рибосомы, ферменты синтеза нуклеиновых кислот и т. д. начинают копировать вирусный геном и синтезировать вирусные белки. Не будем вдаваться в подробности, как именно разные вирусы проникают в клетку, что за процессы происходят с их ДНК или РНК и как идёт сборка вирусных частиц. Важно, что вирусы зависят от клеточных молекулярных машин и особенно — от белоксинтезирующего «конвейера». Бактерии, даже если проникают в клетку, свои белки и нуклеиновые кислоты синтезируют себе сами. Что произойдёт, если к клеткам с вирусной инфекцией добавить, например, антибиотик, прерывающий процесс образования клеточной стенки? Никакой клеточной стенки у вирусов нет. И потому антибиотик, который действует на синтез клеточной стенки, ничего вирусу не сделает. Ну а если добавить антибиотик, который подавляет процесс биосинтеза белка? Всё равно не подействует, потому что антибиотик будет искать бактериальную рибосому, а в животной клетке (в том числе человеческой) такой нет, у неё рибосома другая. В том, что белки и белковые комплексы, которые выполняют одни и те же функции, у разных организмов различаются по структуре, ничего необычного нет. Живые организмы должны синтезировать белок, синтезировать РНК, реплицировать свою ДНК, избавляться от мутаций. Эти процессы идут у всех трёх доменов жизни: у архей, у бактерий и у эукариот (к которым относятся и животные, и растения, и грибы), — и задействованы в них схожие молекулы и надмолекулярные комплексы. Схожие — но не одинаковые. Например, рибосомы бактерий отличаются по структуре от рибосом эукариот из-за того, что рибосомная РНК немного по-разному выглядит у тех и других. Такая непохожесть и мешает антибактериальным антибиотикам влиять на молекулярные механизмы эукариот. Это можно сравнить с разными моделями автомобилей: любой из них довезёт вас до места, но конструкция двигателя может у них отличаться и запчасти к ним нужны разные. В случае с рибосомами таких различий достаточно, чтобы антибиотики смогли подействовать только на бактерию. До какой степени может проявляться специализация антибиотиков? Вообще, антибиотики изначально — это вовсе не искусственные вещества, созданные химиками. Антибиотики — это химическое оружие, которое грибы и бактерии издавна используют друг против друга, чтобы избавляться от конкурентов, претендующих на те же ресурсы окружающей среды. Лишь потом к ним добавились соединения вроде вышеупомянутых сульфаниламидов и хинолонов. Знаменитый пенициллин получили когда-то из грибов рода пенициллиум, а бактерии стрептомицеты синтезируют целый спектр антибиотиков как против бактерий, так и против других грибов. Причём стрептомицеты до сих пор служат источником новых лекарств: не так давно исследователи из Северо-Восточного университета (США) сообщили о новой группе антибиотиков, которые были получены из бактерий Streptomyces hawaiensi, — эти новые средства действуют даже на те бактериальные клетки, которые находятся в состоянии покоя и потому не чувствуют действия обычных лекарств. Грибам и бактериям приходится воевать с каким-то определённым противником, кроме того, необходимо, чтобы их химическое оружие было безопасно для того, кто его использует. Потому-то среди антибиотиков одни обладают самой широкой антимикробной активностью, а другие срабатывают лишь против отдельных групп микроорганизмов, пусть и довольно обширных (как, например, полимиксины, действующие только на грамотрицательные бактерии). Более того, существуют антибиотики, которые вредят именно эукариотическим клеткам, но совершенно безвредны для бактерий. Например, стрептомицеты синтезируют циклогексимид, который подавляет работу исключительно эукариотических рибосом, и они же производят антибиотики, подавляющие рост раковых клеток. Механизм действия этих противораковых средств может быть разным: они могут встраиваться в клеточную ДНК и мешать синтезировать РНК и новые молекулы ДНК, могут ингибировать работу ферментов, работающих с ДНК, и т. д., — но эффект от них один: раковая клетка перестаёт делиться и погибает. Возникает вопрос: если вирусы пользуются клеточными молекулярными машинами, то нельзя ли избавиться от вирусов, подействовав на молекулярные процессы в заражённых ими клетках? Но тогда нужно быть уверенными в том, что лекарство попадёт именно в заражённую клетку и минует здоровую. А эта задача весьма нетривиальна: надо научить лекарство отличать заражённые клетки от незаражённых. Похожую проблему пытаются решить (и небезуспешно) в отношении опухолевых клеток: хитроумные технологии, в том числе и с приставкой нано-, разрабатываются для того, чтобы обеспечить адресную доставку лекарств именно в опухоль. Что же до вирусов, то с ними лучше бороться, используя специфические особенности их биологии. Вирусу можно помешать собраться в частицу, или, например, помешать выйти наружу и тем самым предотвратить заражение соседних клеток (таков механизм работы противовирусного средства занамивира), или, наоборот, помешать ему высвободить свой генетический материал в клеточную цитоплазму (так работает римантадин), или вообще запретить ему взаимодействовать с клеткой. Вирусы не во всём полагаются на клеточные ферменты. Для синтеза ДНК или РНК они используют собственные белки-полимеразы, которые отличаются от клеточных белков и которые зашифрованы в вирусном геноме. Кроме того, такие вирусные белки могут входить в состав готовой вирусной частицы. И антивирусное вещество может действовать как раз на такие сугубо вирусные белки: например, ацикловир подавляет работу ДНК-полимеразы вируса герпеса. Этот фермент строит молекулу ДНК из молекул-мономеров нуклеотидов, и без него вирус не может умножить свою ДНК. Ацикловир так модифицирует молекулы-мономеры, что они выводят из строя ДНК-полимеразу. Многие РНК-вирусы, в том числе и вирус СПИДа, приходят в клетку со своей РНК и первым делом синтезируют на данной РНК молекулу ДНК, для чего опять же нужен особый белок, называемый обратной транскриптазой. И ряд противовирусных препаратов помогают ослабить вирусную инфекцию, действуя именно на этот специфический белок. На клеточные же молекулы такие противовирусные лекарства не действуют. Ну и наконец, избавить организм от вируса можно, просто активировав иммунитет, который достаточно эффективно опознаёт вирусы и заражённые вирусами клетки. Итак, антибактериальные антибиотики не помогут нам против вирусов просто потому, что вирусы организованы в принципе иначе, чем бактерии. Мы не можем подействовать ни на вирусную клеточную стенку, ни на рибосомы, потому что у вирусов ни того, ни другого нет. Мы можем лишь подавить работу некоторых вирусных белков и прервать специфические процессы в жизненном цикле вирусов, однако для этого нужны особые вещества, действующие иначе, нежели антибактериальные антибиотики. Однако надо сделать пару уточнений. На самом деле бывает, что при вирусной простуде врачи рекомендуют принимать антибиотики, но это связано с тем, что вирусная инфекция осложняется бактериальной, с теми же симптомами. Так что антибиотики тут нужны, но не для того, чтобы избавиться от вирусов, а для того, чтобы избавиться от «зашедших на огонёк» бактерий. Кроме того, говоря об антибиотиках, подавляющих биосинтез белка, мы упирали на то, что такие антибиотики могут взаимодействовать только с бактериальными молекулярными машинами. Но, например, тетрациклиновые антибиотики активно подавляют работу и эукариотических рибосом тоже. Однако на наши клетки тетрациклины всё равно не действуют — из-за того, что не могут проникнуть сквозь клеточную мембрану (хотя бактериальная мембрана и клеточная стенка для них вполне проницаемы). Отдельные антибиотики, например пуромицин, действуют не только на бактерии, но и на инфекционных амёб, червей-паразитов и некоторые опухолевые клетки. Очевидно, различия между бактериальными и эукариотическими молекулами и молекулярными комплексами, участвующими в одних и тех же процессах, для ряда антибиотиков не так уж велики и они могут действовать как на те, так и на другие. Однако это вовсе не значит, что такие вещества могут быть эффективны против вирусов. Тут важно понять, что в случае с вирусами складываются воедино сразу несколько особенностей их биологии и антибиотик против такой суммы обстоятельств оказывается бессилен. И второе уточнение, вытекающее из первого: может ли такая «неразборчивость» или, лучше сказать, широкая специализация антибиотиков лежать в основе побочных эффектов от них? На самом деле такие эффекты возникают не столько оттого, что антибиотики действуют на человека так же, как на бактерии, сколько оттого, что у антибиотиков обнаруживаются новые, неожиданные свойства, с их основной работой никак не связанные. Например, пенициллин и некоторые другие бета-лактамные антибиотики плохо действует на нейроны — а всё потому, что они похожи на молекулу ГАМК (гамма-аминомасляной кислоты), одного из основных нейромедиаторов. Нейромедиа-торы нужны для связи между нейронами, и добавка антибиотиков может привести к нежелательным эффектам, как если бы в нервной системе образовался избыток этих самых нейромедиаторов. В частности, некоторые из антибиотиков, как считается, могут провоцировать эпилептические припадки. Вообще, очень многие антибиотики взаимодействуют с нервными клетками, и часто такое взаимодействие приводит к негативному эффекту. И одними лишь нервными клетками дело не ограничивается: антибиотик неомицин, например, если попадает в кровь, сильно вредит почкам (к счастью, он почти не всасывается из желудочно-кишечного тракта, так что при приёме перорально, то есть через рот, не наносит никакого ущерба, кроме как кишечным бактериям). Впрочем, главный побочный эффект от антибиотиков связан как раз с тем, что они вредят мирной желудочно-кишечной микрофлоре. Антибиотики обычно не различают, кто перед ними, мирный симбионт или патогенная бактерия, и убивают всех, кто попадётся на пути. А ведь роль кишечных бактерий трудно переоценить: без них мы бы с трудом переваривали пищу, они поддерживают здоровый обмен веществ, помогают в настройке иммунитета и делают много чего ещё, — функции кишечной микрофлоры исследователи изучают до сих пор. Можно себе представить, как чувствует себя организм, лишённый компаньонов-сожителей из-за лекарственной атаки. Поэтому часто, прописывая сильный антибиотик или интенсивный антибиотический курс, врачи заодно рекомендуют принимать препараты, которые поддерживают нормальную микрофлору в пищеварительном тракте пациента. www.nkj.ruuduba.com |
г.Самара, ул. Димитрова 131 [email protected] |
 |

 Рассказывает ведущий специалист в области экологической и радиационной иммунологии, академик, член Президиума Общенационального совета Российской партии жизни, член президиума Российской академии наук, председатель Уральского отделения РАН Валерий Александрович Черешнев.
Рассказывает ведущий специалист в области экологической и радиационной иммунологии, академик, член Президиума Общенационального совета Российской партии жизни, член президиума Российской академии наук, председатель Уральского отделения РАН Валерий Александрович Черешнев. Такими распространенными вирусными заболеваниями как грипп и простуда болеют многие, особенно в эпидемию, но особенно часто - люди со сниженным иммунитетом.
Такими распространенными вирусными заболеваниями как грипп и простуда болеют многие, особенно в эпидемию, но особенно часто - люди со сниженным иммунитетом.