|
|
||||||||||
|
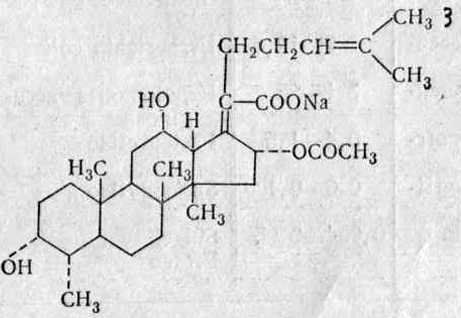
Почему нельзя пить антибиотики меньше 5 дней? Антибиотик 55 нок это антибиотик? - Полезная информация для всехэто лекарство для почек, лечит и мочегонит.... но лучше канефрон, он чуть дороже Фармакологическое действиеАнтибактериальный препарат, производное 8-оксихинолина. Препарат активен в отношении возбудителей инфекции мочевыводящих путей - грамположительных, грамотрицательных бактерий, а также некоторых грибов. К препарату чувствительны Escherichia coli, Ureaplasma urealyticum, Mycoplasma hominis, Candida spp., Torulopsis spp. К препарату непостоянно чувствительны Proteus spp., Staphylococcus spp. К препарату устойчивы Pseudomonas spp., Providencia spp., Klebsiella spp., Enterobacter spp., Serratia spp., анаэробные бактерии. К нитроксолину также установлена чувствительность Streptococcus spp., Corynebacterium diphtheriae, Enteroccocus spp., Salmonella spp., Shigella spp., Neisseria gonorrhoeae, Haemophilus influenzae. Показания Лечение острых, хронических и рецидивирующих инфекций мочевыводящих путей, вызванных грамположительными и грамотрицательными бактериями и грибами, чувствительными к нитроксолину: пиелонефрит; цистит; уретрит; эпидидимит; инфицированная аденома или карцинома предстательной железы. Профилактика инфекций после хирургических и диагностических вмешательств на мочевыводящих путях (катетеризация, цистоскопия, после операций на почках и мочевыводящих путях) . Профилактика рецидивирующих инфекций мочевых путей. Режим дозирования Взрослым препарат назначают по 400-800 мг/сут, разделенные на 4 приема. Средняя суточная доза составляет 400 мг. При необходимости терапию продолжают непрерывно или курсами (2 недели в течение месяца) . В тяжелых случаях дозу можно удвоить; однако она не должна превышать 200 мг 4 раза/сут. Детям старше 5 лет препарат назначают по 200-400 мг/сут, разделенные на 4 приема. Детям с массой тела более 8 кг назначают 200 мг/сут, разделенные на 4 приема. Для пациентов с почечной недостаточностью средней степени тяжести (КК более 20 мл/мин) , печеночной недостаточностью обычную дозу следует уменьшить вдвое (по 50 мг 4 раза/сут) . Таблетки следует принимать перед приемом пищи. Побочное действие Со стороны пищеварительной системы: тошнота, рвота (можно предупредить приемом препарата во время еды) ; редко - изменения уровня трансаминаз и мочевой кислоты в сыворотке крови. Со стороны ЦНС и периферической нервной системы: атаксия, головная боль, парестезии, полиневропатия. Со стороны сердечно-сосудистой системы: тахикардия. Со стороны кроветворной системы: тромбоцитопения. Аллергические реакции: редко - кожная сыпь, быстро проходящая после прекращения терапии. Прочие: в связи с тем, что нитроксолин выводится почками, моча окрашивается в интенсивный желто-красный цвет. Противопоказания катаракта; почечная недостаточность тяжелой степени (КК менее 20 мл/мин) ; тяжелая печеночная недостаточность; беременность; период лактации (грудного вскармливания) ; повышенная чувствительность к нитроксолину или другим компонентам препарата; повышенная чувствительность к хинолинам. Беременность и лактация Препарат противопоказан к применению при беременности и в период лактации (грудного вскармливания) . Особые указания Нитроксолин не следует назначать одновременно с препаратами, содержащими гидроксихинолины или их производные. Необходимо соблюдать осторожность при применении препарата у пациентов с нарушенной функцией почек из-за возможной кумуляции нитроксолина. При длительном или повторном лечении высокими дозами галогенопроизводных гидроксихинолина описаны случаи развития периферического неврита и повреждения зрительного нерва. При применении нитроксолина таких случаев не отмечалось. Не следует назначать курсы лечения более 4 недель без дополнительного обследования функции печени и почек. Передозировка В настоящее время о случаях передозировки препарата 5-НОК не сообщалось. нет.нитроксолин Вспомогательные вещества: кальция гидрофосфат, лактозы моногидрат, крахмал кукурузный, кремния диоксид коллоидный, повидон К25, тальк очищенный, кросповидон, магния стеарат. Состав оболочки: акации камедь, кармеллоза натрия, повидон К25, сахароза, кремния диоксид коллоидный, тальк очищенный, крахмал кукурузный, кальция карбонат, титана диоксид, краситель солнечный закат желтый Е110, краситель желтый хинолиновый Е104. 50 - флаконы пластиковые (1) - пачки картонные. Клинико-фармакологическая группа: Антибактериальный препарат, производное 8-оксихинолина. Уроантисептик info-4all.ru Цефалоспорины 5 поколения в таблетках и ампулах (список)Цефалоспорины 5 поколения относятся к фармакологической группе антибактериальных лекарственных средств. Несведущий в терапии человек может задать вопрос: «А зачем нужно так много антибиотиков? Зачем создавать все новые и новые поколения таких лекарств? Почему не создать одно, но подходящее для лечения любых инфекций?» Давайте разберемся. Что собой представляет антибиотик?Если перевести с латинского языка понятие Antibiotics — борющееся с жизнью, то мы получим саму сущность терапии такими лекарствами. Антибактериальные препараты применяются в терапии заболеваний, вызванных живыми патогенами, как правило, это бактериальная микрофлора. Она достаточно разнообразна. Это могут быть палочки и кокки.
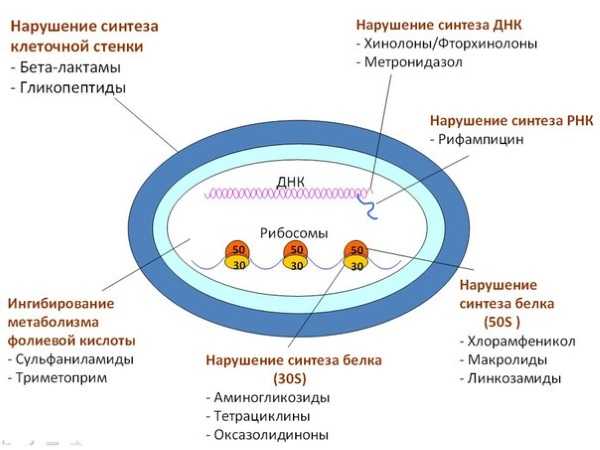
Однако даже наличие бактерий не означает, что любой антибиотик, используемый при лечении, может данный возбудитель уничтожить. Все зависит от специфической характеристики устойчивости его штамма, а также способности противостоять воздействию подобного лекарства. Кроме того, в организме человека обязательно есть и своя микрофлора, которая активно участвует в его жизнедеятельности. Ее гибель не улучшит общее состояние здоровья пациента, а еще более ухудшит. Соответственно, необходимо правильно выбрать лекарство, которое приведет к гибели болезнетворной флоры, а на видовой состав естественной микрофлоры человека не окажет губительного действия. Таким образом, создать один препарат с общим антибактериальным действием просто невозможно. Характеристика антибиотиков цефалоспориновДанные препараты разделены до 5 поколения, однако, все они по своему строению однотипны и в основе своей имеют 7-аминоцефалоспориновую кислоту (7-АЦК). Кроме того, цефалоспорины обладают широким антибактериальным действием, особенно, если сравнивать его с пенициллинами, которые обладают достаточно низкой резистентностью по отношению к β-лактамазам. Тогда почему данный класс антибиотиков разделяется на поколения? В основе такого деления и положена именно чувствительность определенного лекарственного препарата к β-лактамазам. В результате этого и выделяются следующие поколения цефалоспоринов:
Особенности фармакологического действия
В результате этого препарат Зефтера проявляет бактерицидную активность в отношении большого количества грамположительных микроорганизмов. Особенно необходимо подчеркнуть, что данное лекарство способно подавлять рост резистентных к метициллину штаммов золотистого стафилококка. Это дает возможность применять лекарственный препарат для борьбы с внутрибольничными инфекциями. Помимо таких свойств, Цефтобипрол обладает высокой активностью в отношении резистентных к пенициллинам пневмококков и не чувствительным к ампициллину энтерококков.
Фармацевтическое действие после инъекции препарата начинается с биологического трансформирования пролекарства Цефтобипрола медокарила в активную лекарственную форму — Цефтобипрол. Это становится возможным благодаря специфическим катализаторам, находящимся в плазме крови — эстеразам. Метаболизм изначальной химической формы происходит практически полностью, что подтверждается лабораторными исследованиями крови и мочи. Выводится Цефтобипрол через почки с мочой. Основные формы выпуска
Но его положено принимать не перорально, а растворять лидокаином или глюкозой и использовать для инфузионной терапии. Таблетированный вид цефалоспоринов последнего поколения фармацевтическая промышленность пока не производит. Это связано с тем, что при пероральном применении Цефтобипрола медокарила очень трудно добиться необходимой дозировки его в кровеносном русле по причине низкого уровня всасывания лекарства в желудочно-кишечном тракте. Кому показан препарат?Порошок для инъекций Зефтера в основном показан для оказания терапевтической помощи при лечении осложненных инфекционных процессов в области кожных покровов и раневых поверхностей.
Препарат необходимо принимать строго по назначению лечащего врача и не изменять указанную в рецепте дозировку по своему желанию. Ведь он может вызвать аллергические реакции, как и все представители β-лактамных антибактериальных лекарственных средств. Однако это может быть связано не только с самим антибиотиком, но и растворяющим его веществом. Поэтому перед применением его в терапевтических целях необходимо провести кожную аллергическую пробу. При назначении Цефтобипрола медокарила в обязательном порядке учитывают и наличие или отсутствие сопутствующих патологий. Это связано с тем, что данный антимикробный препарат не рекомендован к приему в случае диагностирования у пациента нарушений работы почек или наличия в анамнезе судорожных припадков различного генеза. Как правильно принимать цефалоспорины?Данный препарат принимается следующим образом:
Соблюдая все назначенные предписания и рекомендации специалиста, можно успешно избавиться от развившейся патологии. gidomed.ru Антибиотики 5Антибиотики Антибиотики пришли в нашу жизнь как избавление от инфекций, мучивших человечество тысячи лет. Однако после появления новых мощных препаратов о них заговорили как об «оружии массового поражения, убивающем все живое». Научная дискуссия об антибиотиках в самом разгаре, а нам уже сегодня важно знать, какая антимокробная терапия поможет организму справится с недугом, причинив минимум вреда. Давнее знакомство с этой группой препаратов не мешает применять их неразумно и бессистемно. Злую шутку сыграла с нами привычка некоторых врачей назначать антибиотики по любому поводу, при малейшем намеке на инфекцию. (Конечно, это делается из лучших побуждений, чтобы вылечить быстрее и эффективнее). По оценкам американских ученых, в каждом втором (!) случае антибиотики принимаются неоправданно или без рекомендации врача. Результаты такого «перебора» известны. Антибиотики, подавляющие не только патогенную, но и полезную микрофлору пищеварительного тракта, способствуют появлению дисбактериоза кишечника и аллергии. Ведь нарушенное равновесие в среде микроорганизмов приводит к ослаблению иммунитета и чрезмерному размножению не совсем безобидных одноклеточных грибов. Особенно это характерно для антибиотиков широкого спектра действия. К тому же, болезнетворные микробы оказались на редкость живучими. В процессе совершенствования препаратов выяснилось, что лекарство убивает лишь чувствительных к нему бактерий. Самые сильные из них выживают, причем в их клетках происходит мутация. Получается, что каждый день пополняется армия супермикробов, устойчивых к антибиотикам. Это заставляет ученых создавать все новые препараты, рассчитанные на новые штаммы. Кстати, английские медики решили жестко ограничить массовое увлечение антибиотиками. С недавних пор врачам запрещено выписывать эти лекарства при насморке, кашле, ОРЗ, легких желудочно-кишечных расстройствах и других несерьезных недугах. Если же без антимикробной терапии не обойтись, назначаются минимальные дозы препаратов. Причем, курс лечения подобных инфекций стараются ограничить 3-4 днями (тогда как раньше приходилось «сидеть на антибиотиках» неделю и дольше). Сейчас существуют сотни лекарственных средств, избирательно действующих на возбудителей различных заболеваний. Все ли антибактериальные препараты можно считать антибиотиками? В медицинской литературе термин «антибиотик» нередко используется по отношению ко всем антимикробным средствам. Однако истинными антибиотиками считаются препараты на основе веществ, производимых микроорганизмами или получаемых полусинтетическими способами. Активные компоненты этих лекарств вызывают гибель или останавливают рост болезнетворных микробов, бактерий и некоторых простейших. Не стоит путать антибиотики с синтетическими антибактериальными средствами, которые отличаются от них механизмом воздействия на инфекцию и организм в целом. Известные многим препараты бисептол, фурацилин, фуразолидон, метронидазол, палин, нитроксолин — вовсе не антибиотики. Правда ли, что от любой инфекции можно избавиться с помощью сильнодействующих антибиотиков? Ведь их эффективность доказана и в лечении серьезных заболеваний, и в борьбе с банальным насморком или угрями. Антибиотики бессильны против вирусных и некоторых других инфекционных недугов. Так как большинство простуд и ОРЗ имеют вирусную природу, совершенно бессмысленно пытаться бороться с ними с помощью антибиотиков (например, ампициллина, эритромицина) или других антибактериальных препаратов (бисептола, септрина, сульфаниламидов). То же самое можно сказать о гриппе, кори, кра справиться сама. Сейчас науке становятся известны все новые разрушительные способности антибиотиков. Так может быть отказаться от них вовсе и заменить их другими препаратами? Без антибиотиков не обойтись, если речь идет о жизни и смерти человека. По-прежнему они являются «центровыми» в преодолении сепсиса, интоксикации, туберкулеза. Пока не существует других препаратов, способных так мощно и быстро справиться с инфекцией, угрожающей жизни. Опасаясь возможного вреда от антибиотиков, некоторые игнорируют назначенные врачом препараты даже в тяжелом состоянии. Действительно, отдельные из них могут вызвать побочные эффекты. Однако существуют препараты, которые принимаются параллельно с антибиотиками в качестве прикрытия. Например, супрастин, тавегил и другие противогистаминные средства позволяют заметно снизить риск развития аллергии. Бификол или ацилакт почти на нет сводят вероятность появления дисбактериоза кишечника. К тому же, зависимость от антибиотиков никогда не формируется. Антибиотики незаменимы при остром развитии болезни — ангины и пневмонии, а также при инфекционном воспалении, которое локализуется в закрытых полостях (отит, гайморит, остеомиелит, абсцесс, флегмона). Часто приходится назначать антибиотики людям после хирургических операций. Без применения антибиотиков нередко развиваются серьезные осложнения. Например, если лечение пневмонии или гайморита прошло без участия этих препаратов, могут возникнуть хронические вялотекущие заболевания Существует множество хронических недугов, которые снижают качество жизни человека, но при этом лечатся только с помощью антибиотиков. Это микоплазменная инфекция легких, йерсиниоз, хламидиоз и некоторые другие урогенитальные инфекции. Разумеется, назначая антибиотик, врач должен оценивать показания и противопоказания. Как при назначении гормональных средств и других потенциально опасных препаратов, необходимо хорошо просчитать предполагаемую пользу и риск развития побочных эффектов. Если какой-то антибиотик помог однажды, значит, его можно успешно использовать и при других заболеваниях? Как ни странно, но возбудители заболеваний со схожими симптомами могут быть очень не похожи друг на друга. К тому же, все бактерии имеют разную чувствительность к разным антибиотикам. Допустим, если человек выздоровел после стафилококковой пневмонии с помощью пенициллина, это не значит, что им же нужно лечить появившийся позже кашель. Ведь его причиной может быть не стафилококк, а микоплазма, нечувствительная к пенициллиновым препаратам. Более того, антибиотик, «сработавший» однажды, может не подействовать на того же человека с той же болезнью. Ведь бактерии быстро приспосабливаются к препаратам и при повторном использовании они знают, как выжить при встрече с ними. Антибиотики — препараты, проверенные временем. Неужели, чтобы выбрать подходящий участие врача так необходимо? Надо относиться к назначению антибиотика как к довольно серьезному шагу. Любая самодеятельность здесь неуместна. Чтобы лечение прошло успешно надо выбрать один-единственный препарат, который сработает именно в вашем случае. Дилетантам в фармацевтике, каковыми мы все являемся, очень сложно предусмотреть развитие побочных и токсических эффектов. А они почти всегда появляются при неправильной дозировке и отсутствии «прикрытия», предупреждающего осложнения. Кроме того, своими неграмотными действиями мы пополняем ряды микроорганизмов, устойчивых к конкретному антибиотику. И, наконец, самостоятельно мы вряд ли сможем рассчитать, сколько дней должна длится антимикробная терапия.Некоторые антибиотики не оказывают никакого влияния на внутриутробное и дальнейшее развитие ребенка. Это в основном самые «древние» препараты — пенициллины, эритромицин и некоторые другие. И все-таки в первую половину беременности лучше отказаться и от них, не говоря уже о сильнодействующих средствах. Особенно нежелательно принимать антибиотики с 12 по 17 неделю беременности. В это время плацента только формируется и ребенок не защищен от негативного влияния лекарств, которых принимает будущая мама. Если это возможно, надо перенести антибактериальную терапию на более поздние сроки и провести ее начиная с 20 недели. Когда защитная оболочка окончательно сформируется, врачи начинают выписывать антибиотики в более «вольном» режиме. Существует реестр препаратов, которые могут быть прописаны во время беременности, но есть и такие, которые нельзя принимать в этот период ни в коем случае. Например, фторхиналоны влияют на рост костной системы ребенка и в дальнейшем становятся причиной всевозможных патологий. А препараты тетрациклиновой группы окрашивают зубы ребенка в черный цвет. Конечно, если у беременной женщины случится обострение аппендицита, воспаление почек или пневмония, антибиотики — единственный способ облегчить ситуацию. Правда ли, что антибактериальные препараты, которые не являются к антибиотикам, обладают меньшей «поражающей силой» и воздействуют на организма более мягко? Замечено, что самолечение антибактериальными препаратами — бисептолом, сульфадимезином — гораздо чаще приводит к аллергическим реакциям или дисбактериозу, чем прием антибиотиков. Кроме того, многие синтетические препараты обладают токсическим воздействием на печень и почки. А к сульфаниламидам, например, у микроорганизмов быстро развивается устойчивость. Поэтому их воздействие намного слабее современных антибиотиков. «Плохих» препаратов не существует. Случается, что их назначают не к месту некомпетентные врачи. Да и мы слишком часто берем на себя смелость решать столь непростые вопросы. Может быть, стоит изменить отношение к антибиотикам, которые мы привыкли глотать после каждого чиха и малейшего повышения температуры?
znakka4estva.ru Почему нельзя пить антибиотики меньше 5 дней?Почему нельзя пить антибиотики меньше 5 дней? На самом деле есть антибиотики, которые пьются 3 дня, просто в них идет достаточно большая доза действующего вещества. Хотя большинство антибиотиков действуют по признаку накапливания в организме, поэтому их необходимо пить минимум 5 дней. Если будете пить меньше, то та доза вещества, которую получит организм будет недостаточной для борьбы с микробом, ведь заболевание постепенно прогрессирует и для того, чтобы справиться с ним необходима доза действующего вещества большая. У большинства антибиотиков средний курс приема составляет 5-7 дней (есть, конечно, и антибиотики с трехдневным курсом, просто у них доза действующего вещества в разы больше). Почему нельзя пить антибиотики менее 5 дней? Дело в том, что антибиотик действует путем накопления в крови своего действующего вещества. Чаще всего, это действие оказывается не сразу, а через несколько дней приема. Если не пропить полный, указанный врачом или в инструкции курс, последствия могут быть следующие :
Потому, что за пару дней болезнетворные микробы не все погибают и если прервать лечение, то они выработают к данному лекарству иммунитет и в следующий раз, возможно при этом же заболевании, этот препарат не даст нужного эффекта. Дело в том что многие виды лекарств имеют свой курс, пропив который вы получите желаемый эффект, так как, данные лекарства действуют только накопительно, и не важно антибиотики это, или нет, если приобретаете курс препаратов выпить его нужно полностью как написано в рецепте. А кто вам сказал, что нельзя? Смотря какие антибиотики. Сейчас достаточно большой выбор фармацевтической промышленности. Например, антибиотик АЗИМЕД пьют 3 дня по одной таблетке (500 мг) один раз в день. Все зависит от заболевания. Если нужно поддерживать уровень антибиотика в крови 5 дней, то пьют 5 дней. Есть курсы и в 7 дней, и в 10 дней, и в 14 дней. Антибиотики назначают если сильные 3 дня, если послабее то 5 дней, есть и что надо пропить 7 дней. Когда я врачу задала такой вопрос ответ в ответ он сказал, чтобы полностью убить инфекцию и потом не было осложнений, кажется, что уже выздоровели стало легче и вроде бы можно отменить антибиотики, но может случиться рецидив и пойдет болезнь по второму курсу или осложнение с ухудшением. Спорить с врачом я не стала и давала лекарство ребенку весь курс как положено. Почему антибиотики пьют курсами? А потому, что если не quot;прибитьquot; инфекцию в организме до конца, то она выживет, после прекращения курса размножится и новое поколение микроорганизмов будет уже иметь иммунитет к этому антибиотику, то есть он перестанет действовать. Нужно будет подбирать другой и опять травить организм антибиотиком целый курс - это если ещ подберут... Из-за пациентов, которые не соблюдают установленные врачами курсы лечения, человечество уже получило много новых штаммов микроорганизмов, которые вообще антибиотикам не поддаются, так что это очень серьзно. К примеру, заключнными в тюрьмах и лагерях был quot;выведенquot; лекарственно-устойчивый туберкулз! (ну там несколько другая причина - чтобы не попасть на тяжлые работы, заключнные старались подольше задержаться в больнице и специально нарушали предписания врача, и срывали курсы лечения. Таким образом был выведен штамм микобактерии Коха, который вообще не чувствителен к стрептомицину (основному лекарству от туберкулза)). Действительно большинство антибиотиков требуют не однократного, а курсового приема, например не менее 5 дней. За это время при правильной дозировке антибиотика происходит постепенное накопление его активного вещества в крови человека и следовательно вредные микроорганизмы уничтожаются все с большей эффективностью. Ведь микробы тоже не умирают по мановению волшебной палочки, они также отравляются и какое-то время борются с болезней, то есть с антибиотиком. Чем меньше концентрация антибиотика, тем успешнее эта борьба для микробов. А вот после полного курса приема антибиотика его концентрация достигает такой величины, что ни один микроб не выживает. Ну почти не один. А почему сразу нельзя принять такую дозу антибиотика? Чтобы не отравиться самому и не уничтожить и все полезные микроорганизмы, которые и так сильно пострадают, наравне с болезнетворными. Такова к сожалению неприятная особенность антибиотиков. Антибиотики и их действующее вещество лечебное обладают накопительным эффектом, поэтому часто они помогают не сразу, а лишь спустя несколько дней. Считается, что пять дней - это минимум за который они убьют все микробы, если же их бросить пить раньше, то микробы не умрут, но у них появится иммунитет к этим антибиотикам. и в следующий раз придется пить лекарства сильнее, а это вредно для организма. info-4all.ru Антибиотики: пять развенчанных мифовАвторы: Б. Спилберг Статья в формате PDF. Кажется, что после 80-летнего опыта широкого применения об антибиотиках известнодостаточно много. К сожалению, многое из «известного» – далеко от действительности. Перефразируя Вильяма Ослера, половина того, что мы учили, – ошибочна. Вопрос: какая половина?В этой статье мы попытаемся развенчать пять широко распространенных мифов об антибиотиках и резистентности к ним. Миф 1. Человечество изобрело антибиотики в ХХ веке Первым клинически значимым, эффективным и безопасным для человека антибактериальным препаратом стал пронтозил – сульфаниламидный препарат, синтезированный в 1931 году (E.H. Northey, 1948). Однако пронтозил не был первым в истории антибактериальным средством, как и человек не был автором «идеи». Генетический анализ указывает на то, что бактерии изобрели антибиотики (то есть способы убийства конкурирующих штаммов) и научились вырабатывать механизм антибиотикорезистентности примерно 2-2,5 миллиарда лет назад (B.G. Hall et al., 2004; B. Spellberg et al., 2013). Бактерии убивали друг друга с помощью этого оружия, а также использовали механизмы сопротивления для того, чтобы защитить себя от него. И продолжалось это в 20 миллионов раз дольше, чем мы используем антибиотики. Для иллюстрации этой ситуации вспомним знаменитое исследование 2011 года (K. Bhullar et al., 2012), в ходе которого изучался микробиологический пейзаж геологической формации глубокой пещеры из системы Carlsbad Caverns в Нью-Мексико (США). Данный участок пещеры был изолирован от поверхности планеты в течение 4 млн лет. Разумеется, люди никогда ранее не имели доступа в эту формацию. Исследователи обнаружили на стенах пещеры множество различных типов бактерий. Каждый штамм бактерий был устойчив по крайней мере к одному современному антибиотику; большинство штаммов имели множественную лекарственную устойчивость. Важно отметить, что найденные бактерии были резистентны не только к природным антибиотикам, но и к синтетическим препаратам, включая соединения, не существовавшие до 60-80-х годов прошлого века (в том числе фторхинолоны, даптомицин и линезолид). Комментарий. Два миллиарда лет микробной эволюционной войны привели к тому, что бактерии научились блокировать все возможные биохимические реакции, происходящие во «вражеских» клетках. Соответственно, процесс «защиты» от блокировки веками совершенствовался путем «изобретения» альтернативных биохимических реакций (B. Spellberg et al., 2013). Таким образом, механизмы устойчивости к антибиотикам были широко распространены и отработаны в природе задолго до «антибиотической эры». Резистентность – закон природы и… неизбежность.
Миф 2. Нерациональное использование антибиотиков – прямой путь к антибиотикорезистентности В последние годы получила широкое распространение идея о том, что полное исключение случаев нерационального применения антибиотиков остановит антибиотикорезистентность. Но ведь даже рациональное использование антибиотиков так или иначе способствует селекции резистентности. Однако никто не станет отрицать выдающуюся роль антибиотиков в спасении жизней людей. Другое дело, что применение антибактериальных препаратов без показаний не несет никакой пользы. Комментарий. Важно понимать, что развитие резистентности – процесс неизбежный, даже при строго рациональном использовании антибиотиков. Не вызывает сомнения, что рационально применяемый антибактериальный препарат несет конкретному пациенту и обществу больше пользы, нежели вреда. Нерациональное назначение антибиотика приносит только вред – без каких-либо уравновешивающих его позитивных моментов. По сути, мы должны стремиться искоренить случаи нерационального применения антибиотиков не из-за страха развития резистентности, а потому что такое лечение не принесет абсолютно никакой пользы. А вот навредить вполне может.
Миф 3. Для того чтобы не допустить селекции антибиотикорезистентности, пациенты должны принимать предписанную дозу антибиотика даже после того, как они почувствуют существенное улучшение Истоки этого мифа не до конца понятны, но, по всей видимости, первые упоминания о таком «правиле» датируются 1940-ми годами (L.B. Rice, 2008; B. Spellberg, 2016). Несмотря на широкую распространенность данного мифа и стойкую убежденность в правильности такой тактики, на сегодняшний день отсутствуют какие-либо данные в поддержку идеи, что продолжительная антибиотикотерапия снижает вероятность развития устойчивости к антибактериальным препаратам (B. Spellberg, 2016). Напротив, результаты многих исследований свидетельствуют о том, что длительность антибиотикотерапии прямо коррелирует с вероятностью развития устойчивости патогенов, что, в общем-то, согласуется с основными принципами естественного отбора. Подавляющее большинство исследований, в ходе которых сравнивалась эффективность коротких и длительных курсов антибиотикотерапии при распространенных инфекционных заболеваниях (риносинусит, внегоспитальная пневмония, инфекции мочевыводящих путей, сложные интраабдоминальные инфекции и пр.), демонстрируют идентичную эффективность обеих схем лечения. При этом некоторые исследователи отмечают более низкую вероятность развития устойчивости патогенов к антибиотикам именно при коротких курсах лечения (B. Spellberg, 2016). Комментарий. Этот миф должен быть заменен новым принципом: «Короче – значит лучше». Пациенты должны быть проинформированы о том, что в случае значительного улучшения самочувствия на фоне приема антибиотиков им следует обязательно посоветоваться с лечащим врачом по поводу отмены препарата раньше запланированного срока. Клиницисты также должны быть готовы к этому и не бояться «гибкого» отношения к длительности антибиотикотерапии. Продолжение курса антибиотикотерапии после исчезновения симптомов у пациента с острой инфекцией (разумеется, речь не идет о хронических инфекциях, таких как туберкулез, остеомиелит или актиномикоз) не несет никакой практической пользы, более того, способствует селекции антибиотикорезистентности.
Миф 4. Проявление антибиотикорезистентности является последствием новых мутаций в очаге инфекции Этот миф, вероятно, основывается на том, что рост резистентности к противотуберкулезным препаратам возникает вследствие спонтанных мутаций, развивающихся в ответ на специфическую терапию (T.A. Russo et al., 2016). Однако нельзя забывать, что туберкулезная палочка целым рядом свойств отличается от возбудителей острых бактериальных инфекций. Организм человека не является резервуаром для туберкулезной инфекции, а палочка Коха не относится к нормальной флоре человеческого организма. Таким образом, устойчивость к микобактериям туберкулеза может возникать исключительно в очаге инфекции. Туберкулезные инфильтраты и полости также отличаются крайне высокой плотностью микобактерий (>1012/г). Такое значительное локальное скопление бактерий предрасполагает к возникновению устойчивости к изониазиду или рифампицину даже на основе простой статистической вероятности спонтанных мутаций. Использование «типичных» антибиотиков (в отличие от изониазида, который является строго специфичным для туберкулеза) неизбежно вызывает селекцию резистентности собственной бактериальной флоры человека. В большинстве случаев устойчивость возникает не в очаге инфекции, а среди бактерий в кишечнике или на поверхности кожи в результате генетического обмена носителей механизмов резистентности (например, плазмид, транспозонов, фагов, участков ДНК) (G.A. Pankey, L.D. Sabath, 2004). Повышение устойчивости к антибиотикам нормальной микрофлоры может стать причиной будущих инфекций, а мутировавшие патогены могут передаваться другим людям при контакте с носителем. Комментарий. В большинстве случаев мы не знаем, когда и где у пациента появятся устойчивые к антибиотикам штаммы. Тот факт, что пациент получил длительный курс антибиотиков широкого спектра, который «наверняка уничтожил все патогены в очаге инфекции», не означает, что вы избежали селекции антибиотикорезистентности. Наоборот, весьма вероятно, что после достаточно продолжительного контакта с антибиотиками где-то в организме пациента мутировали штаммы нормальной микрофлоры, получив устойчивость к антибиотикам. Эти штаммы могут в будущем вызывать инфекции или передаваться другим людям, в том числе в стенах лечебного учреждения.
Миф 5. Бактерицидные (БЦ) антибиотики обладают более высокой клинической эффективностью и более низкой вероятностью развития антибиотикорезистентности, чем бактериостатические (БС) препараты Это еще одно широко распространенное клиническое заблуждение, не основанное на каких-либо достоверных данных. Начнем с того, что, вопреки распространенному мнению, БС антибиотики все-таки убивают бактерии, просто они требуют более высоких концентраций в очаге инфекции для реализации своих эффектов. БЦ антибиотик – препарат, для которого минимальная бактерицидная концентрация (МБК) в 4 или менее раз выше минимальной ингибирующей концентрации (MИК) – вот формальное определение «бактерицидности» (G.A. Pankey, L.D. Sabath, 2004). МБК представляет собой такую концентрацию лекарственного средства, которой достаточно для снижения бактериальной плотности в 1000 раз за 24 часа. МИК представляет собой такую концентрацию, которая ингибирует видимый рост за 24 часа. Эти определения весьма условны: почему, к примеру, МБК требует сокращения бактериальной плотности именно в 1000 раз, а не в 100, 500, 5000 или 10 000 раз? Почему за 24 часа? Почему МБК должен быть выше МИК именно в 4 раза, а не в 2, 16 или в 23 раза? И наконец, почему антибиотик, который достигает 1000-кратного сокращения бактериальной плотности, но делает это при МБК, которая в 8 раз выше МИК, считается статическим, даже если он явно убивает бактерии? Учитывая, что эти термины с целью стандартизации были определены соответствующей конвенцией, но при этом не были основаны на конкретных научных принципах, абсолютно не удивляет тот факт, что не существует достоверных доказательств клинического преимущества БЦ антибиотиков перед бактериостатическими. Систематический обзор литературы выявил 28 рандомизированных контролируемых исследований, в ходе которых сравнивалась эффективность БС антибиотиков в сравнениис бактерицидными среди пациентов с инвазивными бактериальными инфекциями. Результаты некоторых из указанных исследований отражены в таблице. Как видим, некоторые исследования демонстрируют преимущество БС антибиотиков, одно – бактерицидных. Большинство же исследователей пришли к выводу, что бактерицидность или бактериостатичность антибиотика – далеко не определяющий момент для его эффективности. Опять-таки, явно некорректно сравнивать, например, линезолид (БС) и бета-лактам (БЦ), доксициклин (БС) и ванкомицин (БЦ) ввиду существенных отличий в спектрах активности и точках приложений данных препаратов. Кроме того, немаловажное значение имеют дозы, в которых используются антибиотики. Таким образом, говорить о том, что БЦ антибиотик априори лучше бактериостатического как минимум не грамотно. Комментарий. Несмотря на то что врачи во всем мире по-прежнему отдают предпочтение БЦ антибиотикам, важно отметить, что последние не имеют явного преимущества в эффективности перед бактериостатическими. Кроме того, нет ни единого научно обоснованного факта, подтверждающего утверждение, что БС антибиотики способствуют селекции антибиотикорезистентности в большей мере, чем бактерицидные. Таким образом, факт бактериостатичности или бактерицидности не должен быть определяющим моментом при назначении пациенту антибиотика.
Информация к размышлению для клиницистов Положить конец войне с бактериями невозможно. Не существует ни единой предпосылки для того, чтобы ждать изобретения «сверхоружия», которое спасет человечество от антибиотикорезистентности. Устойчивость микроорганизмов к антибиотикам – неизбежное явление. Тем не менее очень важно не растрачивать существующий антибактериальный потенциал понапрасну. Антибиотики не должны быть прописаны пациентам, не имеющим признаков бактериальных инфекций. По возможности необходимо использовать антимикробные препараты минимально узкого спектра действия (разумеется, с учетом предполагаемых возбудителей), длительность терапии должна быть индивидуальной для каждой клинической ситуации, не стоит бояться коротких курсов антибиотиков. Перед началом лечения необходимо разъяснять пациентам, что в случае быстрого и резкого улучшения самочувствия важно связаться с лечащим врачом с целью обсуждения возможности отмены антибиотика, даже если курс терапии составил всего несколько дней. Разумеется, речь не идет о хронических инфекциях, таких как туберкулез, остеомиелит, актиномикоз и др. Назначая антибиотик широкого спектра действия, не стоит думать, что гибель абсолютно всех бактерий в очаге инфекции исключит возможность развития антибиотикорезистентности. В очаге – возможно, но не в кишечнике или на коже, где постоянно живет нормальная микрофлора, которая также может подвергаться мутациям и порождать антибиотикоустойчивые штаммы. При выборе антибиотика следует руководствоваться клинической ситуацией, локальными данными об уровнях антибиотикорезистентности и здравым смыслом, но не такими абстрактными понятиями, как бактерицидность или бактериостатичность.
Medscape Infectious Diseases, Оctober 20, 2016.Antibiotics: 5 Myths Debunked. Brad Spellberg. Референтный перевод с англ. Александры Меркуловой
Данная статья была впервые опубликована в 2016 году и вызвала шквал комментариев и вопросов от клиницистов со всего мира. Спустя месяц с момента публикации автор статьи профессор Brad Spellberg (Университет Южной Калифорнии, США) опубликовал ответы на наиболее часто задаваемые вопросы. Приводим некоторые из них. Как быть с инфекциями ротоглотки, вызванными гемолитическим стрептококком группы А? Оправдано ли использование коротких курсов антибиотиков в такой ситуации? В оригинальной статье целенаправленно не упоминались сроки терапии инфекций, обусловленных этим видом стрептококка. Дело в том, что существует множество данных о том, что бактериальный синусит, пневмония или инфекции мочеполовой системы с успехом лечатся короткими курсами антибиотиков. В отношении же стрептококковых тонзиллофарингитов среди ученых единого мнения нет. Тем не менее достаточно очевидно, что короткие курсы терапии пенициллинами могут обусловливать клиническую неэффективность и вызывать рецидивы стрептококкового тонзиллофарингита (J.R. Casey, M.E. Pichichero, 2005). Однако имеются данные о том, что короткие курсы других групп антибиотиков (в частности, цефалоспоринов) могут быть достаточно эффективными в лечении стрептококковых инфекций ротоглотки (M.E. Falagas, 2008). Кроме того, метаанализы не обнаружили различий в частоте возникновения ревматической лихорадки при использовании коротких курсов цефалоспоринов по сравнению со стандартными курсами пенициллина. Однако риск развития ревматизма и кардиальных осложнений делают стрептококковую инфекцию ротоглотки уникальной, именно поэтому в оригинальной статье не упоминалось об этом заболевании. В связи с тем, что ни одно современное исследование не дает однозначного ответа на вопрос: не повышают ли короткие курсы антибиотиков при стрептококковом тонзиллофарингите риск развития осложнений – не стоит рисковать и назначать таким пациентам курсы, длительность которых короче тех, что рекомендуются национальными протоколами. По крайней мере до тех пор, пока в эти протоколы не будут внесены соответствующие изменения.
Если пациент получит антибиотики коротким курсом, очевидно, что у него останется как минимум несколько неиспользованных таблеток. Вполне вероятно, что он воспользуется ими в будущем в порядке самолечения. Как быть в такой ситуации? Безусловно, такой риск существует. Для предотвращения данной ситуации можно рекомендовать изначально не прописывать таблетки в большом количестве – максимум на 5-7 дней приема. На контрольном осмотре, отменяя прием антибиотика досрочно, можно попросить вернуть неиспользованные таблетки, а также предупредить пациента о возможных негативных последствиях самолечения.
Как пациенту понять, что он получил достаточный курс антибиотика? Ключевая мысль заключается в том, что пациент не должен «понимать» этого. В случае резкого и быстрого улучшения самочувствия он должен сообщить об этом лечащему врачу, который, в свою очередь, может сократить курс лечения или, наоборот, продлить прием препарата. Важно помнить, что медицина ХХI века – это «командный вид спорта». Хочется верить, что все врачи в своей работе с пациентами будут использовать принцип сотрудничества, ведь патерналистские времена ХХ века, когда врач считался всезнающим и почти всемогущим, а пациент был безоговорочно подчиняющейся стороной, практически канули в лету. Тем, кто все еще верит в возвышенность положения врача, хочется напомнить, что именно врачи в результате нерационального и широкомасштабного использования антибиотиков спровоцировали нынешний кризис антибиотикорезистентности. Вероятно, врач, назначающий антибиотики «по делу» и без, не имеет морального права заставлять пациента неукоснительно выполнять свои рекомендации. Зато очевидно, что диалог между пациентом и врачом может оказать неоценимую помощь движению в направлении рационализации применения антибиотиков. Именно поэтому, назначая антибактериальный препарат, проведите с пациентом беседу на тему возможной скорой отмены препарата и дайте ему понять, что решение о завершении курса терапии должно быть только совместным. Золотой стандарт эмпирической антибиотикотерапии существует – миф? Не секрет, что львиная доля используемых в мире антибиотиков назначается эмпирически. Эта особенность прежде всего характерна для тяжелых инфекций, когда каждая минута по-настоящему бесценна. В таких ситуациях очень важно не ошибиться, назначив максимально эффективный антибиотик в наиболее рациональной дозе и оптимальной форме выпуска. Несколько лет назад украинские стационары терапевтического и хирургического профилей накрыла настоящая «цефтриаксоновая волна». Этот бета-лактам в прямом смысле назначался бесконтрольно, спрос рождал предложение, вследствие чего отечественный фармацевтический рынок оказался переполнен генериками цефтриаксона с невероятным ассортиментом цены и качества. В это движение включились и врачи поликлинического звена, как будто позабыв на время о том, что в природе существуют таблетированные антибиотики для амбулаторного лечения. Что же происходит сегодня? Все чаще практикующие врачи стационаров с удивлением отмечают, что «старый добрый» цефтриаксон «не работает». Эти замечания подтверждаются и научными публикациями: так, в хирургических стационарах резистентность к цефтриаксону клинических штаммов E. coli достигает 24,5%, S. aureus – 16% (А.Г. Салманов, 2008, 2013). По данным D. Cаlina et al. (2017), устойчивость S. аureus к цефтриаксону в хирургических стационарах достигает 100%, в то время как к левофлоксацину сохраняется практически 100% чувствительность. Именно последний и становится сегодня антибиотиком, на который полагается врач в ситуациях, когда «не работает ничего». Широкий спектр антибактериальной активности, высокий уровень безопасности, низкий уровень резистентности даже у госпитальных штаммов – вот три «кита», обеспечивающие левофлоксацину одну из лидирующих позиций среди многообразия современных антибиотиков. При этом левофлоксацин, безусловно, не является антибиотиком для рутинной амбулаторной практики. Современные европейские руководства по лечению различных заболеваний (EPOS, GOLD, UTI, рекомендации ERS – Европейского респираторного общества и др.) и Национальные клинические протоколы (например, «Острый риносинусит у взрослых и детей», 2016) отмечают высокую эффективность левофлоксацина в терапии различных инфекционных заболеваний, однако относят его к антибиотикам резерва. Это обусловлено необходимостью рационализации использования антибактериальных препаратов в медицине с целью сохранения потенциала имеющихся средств на долгие годы, в том числе и левофлоксацина. Областью применения левофлоксацина сегодня в первую очередь является госпитальная патология. Этот антибиотик высокоэффективен в отношении респираторных инфекций (пневмония, обострения ХОЗЛ, синуситы, отиты и др.), инфекций кожи и мягких тканей (абсцессы, флегмоны, парапроктиты и др.), заболеваний урогенитального тракта (в том числе при пиелонефрите), интраабдоминальных инфекций, бактериемии/септицемии. Препарат активен в отношении многих грамположительных и грамотрицательных микроорганизмов, а также атипичных возбудителей: Enterococcus faecalis, чувствительных к метициллину штаммов Staphylococcus aureus, Streptococcus pyogenes, Acinetobacter baumanii, Escherichia coli, Haemophilus influenzae, Shigella spp., Klebsiella spp. (K. oxytoca, K. pneumoniae), Moraxella catarrhalis, Proteus spp. (P. mirabilis, P. vulgaris), Providencia spp., Brucella spp., Vibrio spp., Chlamydia spp., Pseudomonas spp., Citrobacter spp., Neisseria spp., Campylobacter spp., микобактерий, Helicobacter pylori и ряда других микроорганизмов. Левофлоксацин по сравнению с другими препаратами группы фторхинолонов обладает хорошей переносимостью и низким уровнем развития побочных эффектов, у него наибольший спектр показаний к применению, одобренных Управлением по контролю за продуктами питания и лекарственными средствами США (FDA). Оптимальным для стационарного лечения является парентеральный путь введения. Внутривенные инфузии левофлоксацина обеспечивают быстроту наступления эффекта, хорошую переносимость, возможность использования у пациентов с любым уровнем сознания, 100% комплайентность к терапии. Тем временем на современном фармацевтическом рынке представлено всего несколько препаратов для парентерального применения и содержащих левофлоксацин. Среди них надлежащее качество и возможность оптимизации дозы гарантирует только Лефлоцин® («Юрия Фарм», Украина). Лефлоцин® выпускается в виде раствора для внутривенных инфузий 5 мг/мл во флаконах по 100 и 150 мл, что позволяет обеспечить разовую дозу в 500 или 750 мг соответственно. В целом рациональное использование левофлоксацина – гарантия высокой эффективности. Использование препарата Лефлоцин® – еще и дополнительная возможность ступенчатой терапии (переход на таблетированный левофлоксацин после стабилизации клинической ситуации) и опциональность в выборах дозы и длительности терапии. Широкий спектр активности, крайне низкая вероятность развития аллергических реакций, отсутствие фото-, гепато- и нефротоксичности, невысокий уровень резистентности даже у госпитальных штаммов – максимально приближает Лефлоцин® к званию золотого стандарта эмпирической терапии на госпитальном этапе. Здесь не лишним будет вспомнить поговорку о том, что «не все то золото, что блестит», ведь строгое наличие показаний к началу противомикробной терапии, оптимизация дозового режима, длительности терапии и пути введения, скептическое отношение ко всякого рода мифам об антибиотиках – те обязательные условия, соблюдение которых позволяет считать антибиотикотерапию рациональной. СТАТТІ ЗА ТЕМОЮ Інфекційні захворювання29.12.2017 Пульмонологія та оториноларингологія Лечение риносинуситов: к вопросу выбора интраназальной терапииСегодня украинская оториноларингология переживает интересный период. С одной стороны, отечественные специалисты получили возможность изучить и внедрить в собственную клиническую практику зарубежный опыт, основанный на принципах доказательной медицины. С другой же стороны, современные требования диагностики и лечения заболеваний полости носа существенно отличаются от тех, которые были общепринятыми еще несколько лет назад. Например, сегодня пересматриваются подходы к антибактериальной, противовоспалительной и, конечно же, интраназальной терапии.... 29.12.2017 Пульмонологія та оториноларингологія Достижения современной оториноларингологии: конференция Украинского научного медицинского сообщества врачей-оториноларингологов2-3 октября в Киеве проходила ежегодная традиционная осенняя конференция Украинского научного медицинского сообщества врачей-оториноларингологов с международным участием «Достижения современной оториноларингологии». Двухдневная программа мероприятия включала доклады как ведущих украинских специалистов, так и известных оториноларингологов из Бельгии, Франции, Австрии, Италии, Нидерландов, Египта.... health-ua.com |
г.Самара, ул. Димитрова 131 [email protected] |
 |

 Они могут жить в присутствии кислорода или же существовать и без него. Кроме того, обсеменение может осуществляться еще и патогенными для человека грибами и простейшими микроорганизмами.
Они могут жить в присутствии кислорода или же существовать и без него. Кроме того, обсеменение может осуществляться еще и патогенными для человека грибами и простейшими микроорганизмами.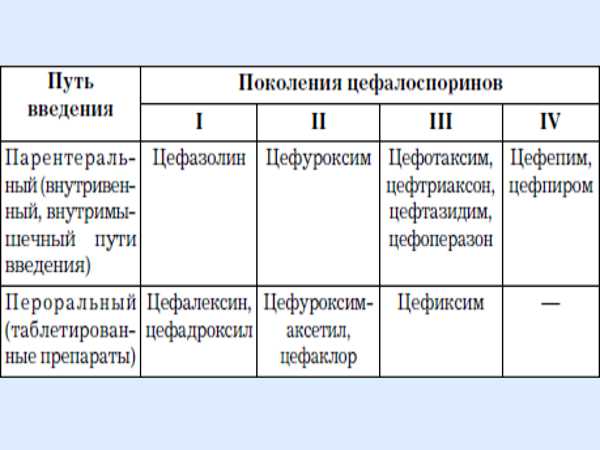
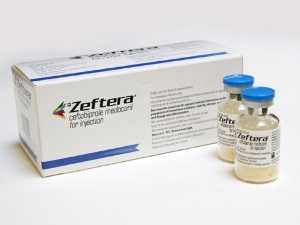 На фармакологическом рынке цефалоспорины последнего пятого поколения представлены лекарственным препаратом Цефтобипрола медокарил, который более известен под коммерческим названием Зефтера. По своей сути — это водорастворимое пролекарство Цефтобипрола. Это значит, что по своему химическому строению оно отличается от Цефтобипрола, однако при попадании в восприимчивый организм и под воздействием его ферментов активное вещество химически изменяется и получает необходимые свойства Цефтобипрола.
На фармакологическом рынке цефалоспорины последнего пятого поколения представлены лекарственным препаратом Цефтобипрола медокарил, который более известен под коммерческим названием Зефтера. По своей сути — это водорастворимое пролекарство Цефтобипрола. Это значит, что по своему химическому строению оно отличается от Цефтобипрола, однако при попадании в восприимчивый организм и под воздействием его ферментов активное вещество химически изменяется и получает необходимые свойства Цефтобипрола. Его можно с успехом применять в терапии инфекционных процессов, вызванных энтеробактериями и неферментирующими палочками, в том числе и псевдомонадами. Такой широкий спектр антибактериальной активности объясняется способностью препарата легко связываться с пенициллин-связывающими белками большинства патогенных микроорганизмов.
Его можно с успехом применять в терапии инфекционных процессов, вызванных энтеробактериями и неферментирующими палочками, в том числе и псевдомонадами. Такой широкий спектр антибактериальной активности объясняется способностью препарата легко связываться с пенициллин-связывающими белками большинства патогенных микроорганизмов. Единственный представитель пятого поколения цефалоспоринов — Зефтера. Он пока выпускается только в виде порошка.
Единственный представитель пятого поколения цефалоспоринов — Зефтера. Он пока выпускается только в виде порошка.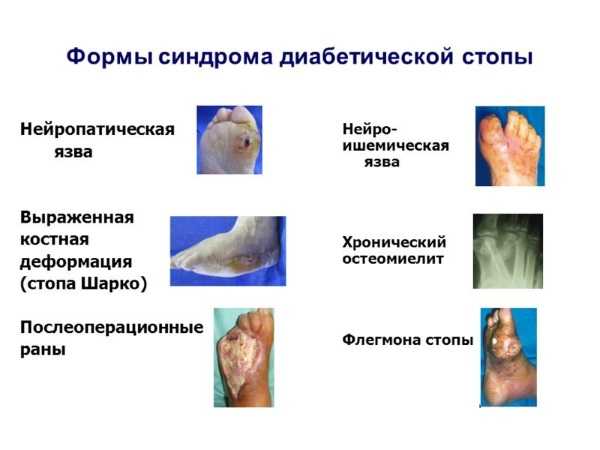 Его рекомендуют при лечении инфицированной диабетической стопы, а также любых нагноений ран в оперативной хирургии.
Его рекомендуют при лечении инфицированной диабетической стопы, а также любых нагноений ран в оперативной хирургии.