|
|
||||||||||
|
Методы исследований аллергии на антибиотики. Аллергическая проба на антибиотикиАнализ на аллергию на антибиотики, способы диагностикиСодержание Антибиотики — сильнейшие лекарственные препараты, направленные на уничтожение определенных видов бактериальной инфекции. При некоторых заболеваниях обойтись без них невозможно. Но многие люди страдают аллергической реакцией на этот вид медикаментов. В основном человек даже не догадывается о наличии этого серьезного заболевания. Сегодня участились случаи возникновения отрицательных реакций на препараты из группы антибиотиков. Причины роста проблемы досконально не изучены. Известно только, что чаще всего страдают люди с генетической предрасположенностью. А так же пациенты со слабой иммунной системой. Анализ на аллергию на антибиотики позволяет выявить аллерген, избежать плачевных последствий в результате приема таких препаратов. Сотрудники здравоохранения настоятельно рекомендуют провести исследования для определения аллергена. В некоторых случаях это спасает жизнь человеку, избавляет от серьезных проблем. Если организм отрицательно реагирует на тот или иной препарат антибиотической группы, то пользы от его использования не будет. При этом заболевание, требующее приема средств этой группы только обостриться. Прибавиться аллергическая реакция. Хорошо если она будет проявляться только кожными высыпаниями. Зачастую такая аллергия провоцирует развитие анафилактического шока. Это опасно для жизни человека. Анализы на аллергию на антибиотики
Способы диагностики заболеванияСуществует несколько методик определения наличия или отсутствия аллергических реакций: 1. Кожные пробы. Дают возможность определить аллергию на антибиотики пенициллинового ряда. Исследование проводят 3 видами теста: скарификационным, подкожным и аппликационным способом. В первом случае на коже скарификатором делают царапину. На нее наносят маленькое количество аллергена. Через некоторое время будет известен результат. Во втором случае небольшое количество вещества вводят под кожу. Аппликационный метод предусматривает ношение на теле бинта, смоченного в потенциальном аллергене на протяжении как минимум 2, а то и 3 дней. Данный способ рекомендуется для определения замедленной аллергической реакции. 2. Провокационные пробы. Метод достаточно опасный, используется в редких случаях. Он способен вызвать не только шоковое состояние, но и обострение отрицательной реакции на антибиотики. Аллерген антибиотиков в таком случае вводиться прямо в организм пациента. Это может привести к тяжелой реакции угрожающей жизни человека. Поэтому проводить его можно только в специальных условиях, под строгим контролем врачей. В медицинском заведении, где проводят такие пробы, обязательно должна быть реанимация. Данный метод применяют в том случае, если традиционные кожные пробы не прояснили ситуацию или расходятся с анамнезом. Тогда для уточнения диагноза проводят провокационные пробы. Несмотря на высокий риск в некоторых случаях обойтись без них невозможно. Установить точный диагноз по результатам анализов может только аллерголог. Он же и назначает лечение, если это необходимо. Аллергия на препараты антибиотического ряда предусматривает полное исключение контакта с опасным веществом. allergiku.com Диагностика аллергических реакций на антибиотикиКлиническая картина, аллергологический анамнез, кожные аллергологические и провокационные пробы составляют основу диагностики АР на антибиотики. Лабораторная диагностика имеет второстепенное значение в связи с недостаточной надежностью. Кожные аллергологические пробы (КП). Применение КП основано на том, что сенсибилизация развивается не к нативной молекуле антибиотика, а к комплексам продуктов биотрансформации препарата с белками плазмы. Поэтому применение нативного антибиотика в качестве антигена чаще всего неинформативно, и требуется использование аллергенов, созданных на основе метаболитов АП. На сегодняшний день детально изучены метаболиты пенициллина и на их основе созданы диагностические аллергены. Для других групп антибиотиков аллергены для постановки КП не разработаны, поэтому КП применяются практически только для диагностики IgE-зависимых АР на пенициллин. В организме 95% пенициллина метаболизируется до пенициллоила, называемого главной детерминантой (рис. 2). Пенициллоил, связанный с полилизином (бензилпенициллоил полилизин), выпускается в виде коммерческого аллергена для постановки КП (Pre-Pen, Schwarz Pharma, США). Минорные детерминанты составляют около 5% метаболитов пенициллина и включают в себя пенициллоат, пенициллоил, пениллоат. В качестве смеси минорных детерминант пенициллина используют щелочной гидролизат пенициллина, последний, с известной долей условности, можно заменить "старыми" (7-14 дней) щелочными растворами бензилпенициллина, но в этом случае может быть не выявлено до 10% положительных реакций. Рис. 2. Строение главной и минорных детерминант пенициллина, E.Middleton, 1993 Большая часть антител, которые вырабатываются в ответ на введение пенициллина, направлена против пенициллоила. Главная детерминанта определяет развитие преимущественно ускоренных и поздних реакций, в частности, крапивницы. Минорные детерминанты, по-видимому, имеют особое значение, в развитии опасных для жизни анафилактических реакций, хотя такие реакции могут развиваться и при сенсибилизации только к пенициллоилу. Антитела к минорным детерминантам ответственны менее чем за 7% положительных КП, однако при проведении КП только с главной детерминантой, может быть пропущено 10-25% потенциально положительных реакций. Положительные результаты КП к смеси минорных детерминант указывает на высокий риск развития анафилактических реакций. В таблицах 7 и 8 приведены показания, противопоказания и методика проведения КП с b-лактамами. КП с главной и минорными детерминантами пенициллина являются сравнительно безопасной процедурой. При постановке КП с пенициллином, АР отмечаются лишь у 4 из более чем 4000 пациентов. Они проявлялись в виде кожного зуда, эритемы и проходили самостоятельно. Риск развития анафилактических реакций при постановке КП возрастает при внутрикожном введении препарата, а также при одновременном применении -блокаторов. Таблица 7. Показания и противопоказания к проведению кожных проб с пенициллином (A. Saxon, 1987, с доп.)
Таблица 8. Кожные пробы с -лактамными антибиотиками (J.A.Anderson, 1992, с доп.)
В настоящее время не существует коммерческих диагностических аллергенов для постановки КП с полусинтетическими пенициллинами, цефалоспоринами или карбапенемами. Однако можно рекомендовать использовать КП с полусинтетическими пенициллинами, цефалоспоринами, имипинемом как дополнение КП с главной и смесью минорных детерминант пенициллина. В этом случае возможно выявление сенсибилизации, обусловленной IgE, антителами не только к -лактамному кольцу, но и к боковым цепям АП. Для диагностики клеточно-опосредованных АР (контактный аллергический дерматит) необходимо использовать аппликационные КП. Провокационные пробы (ПП)проводятся в тех случаях, когда невозможна замена антибиотика, являющегося возможной причиной АР. Учитывая, что ПП потенциально опасны для жизни, при ее проведении следует соблюдать следующие условия:
Как правило, ПП начинают с дозы равной 1% от разовой терапевтической. Затем, если нет проявлений АР, повторно назначают АП с интервалом 15 минут при парентеральном введении или 60 минут при приеме внутрь. При каждом повторном использовании препарата повышают дозу в 10 раз, достигая терапевтической. Если у пациента в течение последнего года имели место тяжелые анафилактические реакции, процедуру постановки ПП необходимо начинать с 0,1% разовой терапевтической дозы. Проведение ПП значительно безопаснее, чем использование полной дозы препарата, кроме того, ПП рассматриваются как метод выбора для диагностики псевдоаллергических реакций. В России, учитывая отсутствие отечественных и зарегистрированных зарубежных диагностических аллергенов для постановки КП, ПП являются единственным достаточно информативным способом диагностики лекарственной аллергии. Подъязычный тест заключается в применении АП под язык в дозе 1/8 таблетки или 2-3 капли испытуемого препарата. Развитие общих или местных реакций наблюдают в течение 20 минут, а затем еще в течение 1-3 часов (А.Д.Адо, 1975). Однако, очевидны существенные ограничения метода: он применим только в тех случаях, когда при сенсибилизации образуются антитела к нативной молекуле испытуемого препарата. Такие ситуации крайне редки, например, сенсибилизация к нативной молекуле пенициллина развивается менее чем у 1% пациентов. Тест торможения естественной миграции лейкоцитов (ТТЕМЛ) in vivo сводится к подсчету в камере Горяева числа лейкоцитов в изотоническом растворе NaCl после полоскания им и испытуемым препаратом полости рта. Сначала проводят полоскание изотоническим раствором NaCl, затем раствором испытуемого АП, затем проводят еще два полоскания через 15 и 30 минут и подсчитывают количество лейкоцитов в последней порции. Тест считается положительным, если число лейкоцитов снизилось на 30% и более. Ограничения использования данного метода аналогичны как и для подъязычного теста, причины торможения миграции лейкоцитов при наличии аллергии немедленного типа остаются пока неясными (В.И.Пыцкий, 1991). Корреляция результатов ТТЕМЛ с клиникой требует дальнейшего изучения. studfiles.net Аллергические реакции на антибиотики - Медицинский портал «health-ua.org»Удельный вес аллергических реакций (АР) на антибиотики в общей структуре нежелательных лекарственных реакций (НЛР) невелик. Так, кожные АР, которые наиболее распространены при антибиотикотерапии, составляют всего 2,2% среди всех НЛР. Тем не менее АР являются серьезными НЛР, поскольку сопровождаются относительно высокой заболеваемостью и смертностью [1]. Л.В. Богун, И.Г. Березняков, Харьковская медицинская академия последипломного образования Лекарственный препарат инициирует развитие иммунологических НЛР посредством образования гаптенов [2]. Согласно этой теории, небольшие по размерам молекулы лекарства могут становиться иммуногенами (т.е. веществами, способными вызывать специфический иммунный ответ) только после ковалентного связывания с макромолекулами белков [2]. Тип реакции гиперчувствительности зависит от характера иммунного ответа и места образования антигенов. Например, клеточный иммунитет играет ведущую роль в реакциях гиперчувствительности замедленного типа (макулопапулезная сыпь, буллезная экзантема), а IgЕ-опосредованные реакции являются реакциями немедленного типа (крапивница, анафилаксия) [3]. Подробная классификация и механизм развития АР представлены в таблице 1. Диагностика АР. Наиболее значимый фактор риска развития АР на антибиотик – наличие АР на антибиотик данного класса в прошлом. Особенно большую роль играет наличие в прошлом АР на пенициллин и цефалоспорины. У больных с АР на пенициллин риск развития АР на любой лекарственный препарат повышен примерно в 3 раза [4]. Наличие атопических заболеваний, таких как аллергический ринит, бронхиальная астма или атопический дерматит, не является независимым фактором риска развития АР на β-лактамные антибиотики. Однако если анафилактическая реакция развивается, то пациенты с атопическими заболеваниями, особенно с бронхиальной астмой, имеют худший прогноз вследствие более тяжелого течения АР и большей частоты летального исхода [5]. Доказано, что такие сопутствующие патологии, как ВИЧ-инфекция, муковисцидоз, инфекционный мононуклеоз, предопределяют более высокую вероятность развития АР [6-8]. При подозрении на аллергию к антимикробному препарату следует прежде всего убедиться в ее иммунологическом характере и исключить другие НЛР с неиммунологическими механизмами развития. Важное значение придается также правильной оценке собственно АР – механизма ее развития и тяжести течения. Гипердиагностика АР может привести к снижению эффективности антимикробной терапии, повышению стоимости лечения и формированию резистентности микроорганизмов за счет необоснованной смены антимикробного препарата, иногда с заменой его на менее эффективный. Вместе с тем точное установление типа реакции и ее тяжести определяет дальнейшую тактику ведения больного, в частности выбор антимикробного препарата. Именно поэтому у пациентов с АР на антибиотики необходим тщательный сбор анамнеза болезни. Следует точно описать симптомы (крапивница, кожный зуд, ангионевротический отек, нарушения дыхания) и их тяжесть (умеренно выраженные или угрожающие жизни), четко установить время начала развития реакции и ее связь с приемом препарата. При этом необходимо зафиксировать все лекарственные средства, которые больной принимал на момент начала АР, поскольку она может быть вызвана не только антимикробным препаратом. Следует тщательно собрать сведения о переносимости всех антимикробных препаратов в прошлом. Наличие АР на многие классы антимикробных препаратов существенно суживает возможности антибактериальной терапии у таких больных. Сведения об отсутствии АР на те или иные антибиотики в прошлом не только существенно облегчают выбор антимикробных препаратов для лечения пациента, но иногда ставят под сомнение сам факт наличия АР на антибиотик. На панели 1 приведены вопросы, позволяющие с достаточной степенью достоверности подтвердить аллергический характер НЛР и выявить основной механизм ее развития, прежде всего анафилаксию – наиболее опасный и представляющий угрозу для жизни вид АР. Необходимо тщательно фиксировать в медицинской документации все случаи НЛР, имевшиеся у больного, что существенно облегчает трактовку лекарственных АР в дальнейшем. Клинические проявления АР на антибиотики чрезвычайно разнообразны по симптоматике, тяжести течения и тропности к различным органам и системам. Это зависит от вида антибиотика, заболевания, по поводу которого он назначается, и иммунологического состояния пациента (панель 2). Наиболее частыми АР при антибактериальной терапии являются кожные проявления – макулопапулезная сыпь, крапивница и кожный зуд [9]. Эти реакции развиваются, как правило, через несколько дней или недель после начала приема препарата, в течение которых происходит сенсибилизация организма. В случаях повторного контакта с лекарством характерно более быстрое возникновение АР, иногда в течение нескольких часов или даже минут [10]. Значительно реже аллергия на антибиотики проявляется в виде лихорадки, эозинофилии и других симптомов, не связанных с поражением кожных покровов [11]. Например, комбинация амоксициллина с клавулановой кислотой может вызывать печеночный холестаз, а высокие дозы пенициллинов и цефалоспоринов – гемолиз и цитопению вследствие образования специфических для этих препаратов антител [12]. Тяжелые аллергические IgE-опосредованные реакции по типу анафилаксии, к счастью, встречаются редко. И хотя теоретически анафилаксия может развиться в ответ на введение любого антибиотика, документально зарегистрирована только частота случаев анафилаксии в ответ на введение пенициллина: 1 случай на 5-10 тысяч курсов пенициллинотерапии [13]. Под анафилаксией подразумевают тяжелую системную АР. Единого определения для нее пока не существует, так как она имеет множество проявлений, причем ведущие компоненты выделить трудно. Многие клиницисты пользуются рабочим определением анафилаксии, согласно которому под этим термином понимают наличие хотя бы одного из двух тяжелых симптомов: нарушения дыхания (вследствие отека гортани или астмы) или гипотензии (обморок, коллапс, потеря сознания). Данный подход имеет существенный недостаток, поскольку умеренно выраженные проявления анафилаксии (генерализованная крапивница, ангионевротический отек и ринит) при отсутствии нарушений дыхания и гипотензии выпадают за рамки ее определения, хотя принадлежат к тому же типу реакций гиперчувствительности немедленного типа. В основе анафилаксии лежит взаимодействие аллергена со специфическими IgE, связывание IgE с Fc-рецепторами тучных клеток и базофилов, что приводит к активации и дегрануляции тучных клеток с высвобождением медиаторов (в том числе гистамина) и секреции вновь образующихся медиаторов, которые синтезируются с большой скоростью. Быстрое поступление в системный кровоток большого количества медиаторов приводит к повышению проницаемости капилляров и отеку слизистых оболочек с соответствующими клиническими проявлениями (табл. 2). Тактика лечения АР зависит прежде всего от механизма ее развития, т.е. от того, является ли она реакцией замедленного или немедленного типа. Для выявления реакций немедленного типа, т.е. IgE-опосредованных по типу анафилаксии, проводят кожную пробу. Отрицательный результат кожной пробы не означает отсутствие IgE, за исключением кожной пробы с пенициллином, отрицательные результаты которой действительно свидетельствуют о низком риске развития реакций немедленного типа. Причина этого кроется в отсутствии четких данных об иммуногенных структурах большинства лекарственных средств, каковыми также могут быть неидентифицированные метаболиты антибиотиков или продукты их распада. Именно поэтому для подавляющего большинства антибактериальных препаратов в настоящее время не существует диагностических тестов, апробированных in vivo и in vitro, которые позволяли бы выявить все специфические для этих антибиотиков IgE [3]. И хотя отдельные структурные компоненты антибиотика могут использоваться при постановке кожных проб, отрицательный результат следует интерпретировать не как отсутствие IgE к данному препарату, а как следствие недостаточной чувствительности применяемой методики или скорее как результат неадекватного выбора с точки зрения иммуногенности структурного компонента антибиотика [14]. Кожные пробы обладают высокой диагностической точностью для выявления АР на пенициллин, поскольку клинически значимые антигенные детерминанты пенициллина хорошо изучены. К ним относятся основной антиген пенициллина – пенициллоила полилизин и несколько второстепенных антигенных детерминант. Кожную пробу проводят с пенициллоила полилизином в сочетании с раствором пенициллина G 10 тыс. ЕД в 1 мл или со смесью второстепенных антигенов, из которых чаще всего используют 0,01М раствор бензила пенициллоата, бензила пениллоата и бензил-n-пропиламина [15]. Вначале выполняют кожную скарификационную пробу с нанесением полной тестовой дозы, и если ее результаты отрицательны через 15 мин, то еще одну тестовую дозу вводят внутрикожно. Увеличение диаметра волдыря на 3 мм и более по сравнению с контролем при наличии эритемы свидетельствует о положительной реакции. По результатам кожной пробы пенициллинспецифические IgE выявляются менее чем у 20% больных с АР на пенициллин в анамнезе [16]. Отрицательный результат кожной пробы свидетельствует либо о том, что предшествующие АР не были опосредованы IgE, либо об отсутствии таких антител в настоящее время; в любом случае назначение пенициллина возможно. При этом риск развития реакций гиперчувствительности немедленного типа минимален (менее 4%) и не отличается от такового у лиц без предшествующих АР на пенициллин в анамнезе [17]. Другие пробы. Кожные пробы не информативны в диагностике АР, механизм развития которых не связан с образованием IgE. В этих случаях возможно применение других диагностических тестов, которые выполняются или в момент развития АР, или сразу же после ее завершения. Положительная проба Кумбса указывает на клеточный механизм образования антител (например, обусловленная пенициллином гемолитическая анемия), а низкие уровни комплемента отражают вовлечение в АР системы комплемента (например, реакция по типу сывороточной болезни при применении миноциклина) [18]. Для подтверждения анафилактического характера НЛР определяют уровень триптазы – нейтральной пептидазы, специфичной для тучных клеток. Повышение ее уровня в сыворотке крови указывает на системную активацию тучных клеток и сохраняется в течение нескольких часов после анафилаксии и других НЛР анафилактоидного типа. Также используют так называемые тесты трансформации лимфоцитов in vitrо, нацеленные на выявление специфических для лекарственного средства Т-лимфоцитов, которые образуются при некоторых реакциях гиперчувствительности. Их положительные результаты свидетельствуют о сенсибилизации больного к препарату, которая может иметь место даже при отсутствии явных клинических проявлений. Описаны положительные результаты этих проб при АР немедленного и замедленного типов в ответ на β-лактамы, сульфаниламиды и хинолоны [19]. Однако перспективы широкого применения данных тестов в клинической практике нуждаются в уточнении. В настоящее время они используются преимущественно для научно-исследовательских целей. Для подтверждения гиперчувствительности к антибиотику можно применять провокационную пробу, заключающуюся во введении 3-6 постепенно увеличивающихся доз до достижения стандартной дозы препарата [20]. Однако эти пробы небезопасны для пациента, так как могут привести к развитию реакций гиперчувствительности немедленного типа (по данным одного из исследований, частота развития таких реакций при провокационных пробах достигает 17,6%) [20]. И хотя эти реакции в подобных случаях обычно протекают сравнительно благоприятно, т.е. менее выражены по длительности и тяжести, однако провокационные пробы могут проводиться только специально обученным медицинским персоналом в отделениях интенсивной терапии, оснащенных оборудованием для сердечно-легочной реанимации. Десенсибилизация к препарату проводится при необходимости использования антибиотика, вызывающего АР гиперчувствительности немедленного типа [15]. Например, существуют ситуации, когда нельзя избежать назначения β-лактамов (бактериальный эндокардит, вызванный энтерококками; абсцесс мозга, бактериальный менингит, большинство инфекций, вызванных стафилококками или синегнойной палочкой, включая остеомиелит и сепсис; листериоз, нейросифилис, сифилис у беременных). Перед выполнением десенсибилизации необходимо отменить β-адреноблокаторы, в т.ч. и в виде глазных капель, а пациенты с бронхиальной астмой должны получать адекватную базисную терапию. Процедура десенсибилизации проводится специально обученным персоналом в отделениях интенсивной терапии, оснащенных аппаратурой для сердечно-легочной реанимации. В течение всей процедуры мониторируется ЭКГ. Десенсибилизацию не следует осуществлять под защитой Н1-блокаторов и глюкокортикоидов, так как эти препараты могут маскировать развитие аллергии. Суть десенсибилизации заключается в постепенном и медленном (в течение нескольких часов) введении возрастающей дозы антибиотика, пока не будет достигнута его полная терапевтическая доза. Начальные дозы обычно составляют несколько микрограммов препарата, путь введения может быть парентеральный или пероральный, причем последний предпочтительнее, поскольку редко приводит к развитию анафилаксии. Дозу препарата удваивают каждые 15-30 мин, и в большинстве случаев терапевтическая доза антибиотика достигается в течение 4-5 ч [15]. Разработаны схемы для проведения как пероральной, так и парентеральной десенсибилизации при АР на β-лактамы (табл. 3, 4). Хотя механизм пероральной десенсибилизации к пенициллину точно неизвестен, однако описаны случаи ее успешного проведения с помощью пенициллина G, карбенициллина, феноксиметилпенициллина [21, 22]. Наиболее вероятным механизмом считается десенсибилизация тучных клеток, тогда как возможная роль ингибирования образования иммуногенных комплексов, истощения тучных клеток или связывания антител класса E не доказана [23]. Десенсибилизация к цефалоспоринам проводится при невозможности их замены антибиотиками другого класса у больных с тяжелыми, опасными для жизни АР на пенициллин или цефалоспорин в анамнезе, а также у лиц с АР и положительной кожной пробой на пенициллин [24]. Схемы десенсибилизации к цефалоспоринам описаны, но не стандартизованы (табл. 5), и опыт их применения существенно невелик по сравнению с пенициллином. Осложнения пероральной десенсибилизации включают умеренный зуд, крапивницу во время процедуры и регистрируются у 5-25% пациентов. Острые реакции требуют назначения соответствующей терапии (антигистаминных препаратов при крапивнице, ингаляционных β-агонистов при бронхоспазме) и снижения дозы и/или увеличения интервалов между приемами антибиотика. В случае развития легких системных реакций (зуд, преходящая крапивница, ринит) дозу препарата, которая вызвала их появление, следует вводить повторно до тех пор, пока пациент не станет переносить ее нормально. Более серьезные реакции, такие как гипотензия, отек гортани, астма, требуют соответствующей терапии и отмены антимикробного препарата. Если десенсибилизацию решают все же продолжить, дозу следует снизить минимум в 10 раз и не изменять до тех пор, пока состояние пациента не стабилизируется. Каким образом достигается переносимость антибиотика после проведения десенсибилизации, точно неизвестно. Полагают, что это происходит за счет антигенспецифической десенсибилизации тучных клеток [25]. По данным ретроспективного исследования [26], десенсибилизация при IgЕ-опосредованной АР на пенициллин была эффективна у 43 из 67 больных (75%), осложнения в виде тяжелых АР во время процедуры (анафилаксия) или спустя несколько дней после ее завершения (реакция по типу сывороточной болезни) развились у 19% пациентов, 3 процедуры были прекращены по причинам, не связанным с АР. Важно подчеркнуть, что состояние десенсибилизации проходит через 24-48 ч, поэтому при повторном применении пенициллина необходимо снова выполнять кожную пробу. Ввиду этого кожную пробу и десенсибилизацию нельзя проводить «на будущее», если предполагается перерыв перед использованием полной дозы препарата. При необходимости повторного назначения пенициллина десенсибилизацию следует проводить снова. Например, у лиц с муковисцидозом поддерживать состояние десенсибилизации можно с помощью длительного перорального применения пенициллина 2 раза в сутки. Как правило, неудачи при десенсибилизации связаны с наличием иных, отличных от IgЕ-опосредованных, НЛР; кроме того, десенсибилизация чаще неэффективна у больных с муковисцидозом [27]. В случаях АР, не связанных с образованием IgЕ, тактика ведения больного зависит от клинических проявлений реакции. Если АР проявляется в виде макулопапулезной сыпи, возможно применение ступенчатой пробной терапии, которая по своей сути сходна с провокационной пробой [15], отличаясь от последней более высокими начальными дозами (миллиграммы вместо микрограммов) и более длительными интервалами между дозами (от нескольких часов до нескольких дней и даже недель вместо 15-30 мин). В течение всего периода ступенчатой пробной терапии за больным тщательно наблюдают для выявления побочных реакций, которые чаще всего протекают в виде кожных изменений. Решение об отмене антибиотика зависит от тяжести побочной реакции: при появлении волдырей или вовлечении в процесс слизистых оболочек препарат следует отменить, а при развитии более легких реакций, таких как макулопапулезная сыпь, ступенчатую пробную терапию можно продолжить на фоне лечения антигистаминными препаратами и/или глюкокортикостероидами. Данный подход, например, оказался достаточно успешным (эффект достигнут у 75% пациентов) при лечении сульфаметоксазолом у больных СПИДом, у которых АР на этот препарат отмечались в 58% случаев [28]. Метод ступенчатой пробной терапии противопоказан при анамнестических указаниях на тяжелые, опасные для жизни АР, даже если механизм их развития и не связан с образованием IgЕ (лекарственная гемолитическая анемия, синдром Стивенса-Джонсона, токсический эпидермальный некролиз и т.д). Однако прогнозировать эффективность данного метода затруднительно. Кроме того, он представляет потенциальную опасность для пациента. Например, описан случай развития анафилаксии на введение 1 г цефалотина у больного, у которого отсутствовали АР на предшествующие более низкие дозы препарата [29]. Следовательно, как и провокационная проба, ступенчатая пробная терапия должна проводиться в специально оборудованных отделениях интенсивной терапии. Частные вопросыАллергия на пенициллин. При подтверждении АР на пенициллин дальнейшее ведение больного возможно по одному из трех вариантов. Первый (наиболее распространенный) заключается в выборе антимикробного препарата другого класса, не принадлежащего к β-лактамам: макролида, фторхинолона, сульфаниламида, гликопептида. Достоинством данного подхода является отсутствие риска перекрестной аллергии; к недостаткам следует отнести выбор менее эффективного антимикробного средства, повышение стоимости лечения, угрозу развития резистентности микроорганизмов (особенно к ванкомицину). Тем не менее этот вариант весьма привлекателен при наличии широкого выбора альтернативных антимикробных препаратов, эффективных в данной клинической ситуации, а также в случаях, когда предшествующие АР на пенициллин протекали тяжело [24]. Второй распространенный подход ведения больных с подтвержденной АР на пенициллин заключается в назначении антибиотика из группы цефалоспоринов. К этому варианту прибегают, если риск АР на цефалоспорин невысок и ниже пользы от применения антибиотика из числа не-β-лактамов или же пользы от дальнейшего обследования пациента. Такой подход основан на известном факте, что тяжелые АР на цефалоспорины развиваются достаточно редко. Хотя авторы Руководства по диагностике и лечению НЛР [28] относятся к данному варианту неодобрительно, к нему прибегают на практике при наличии совокупности следующих условий:
Наконец, третий подход предусматривает использование кожных проб при обследовании пациента с анамнестическими указаниями на аллергию к пенициллину. По данным статистики, частота отрицательных кожных проб на пенициллин у таких больных высока (80-90%). Таким образом, большинству пациентов назначать цефалоспорины можно. К недостаткам этого метода относятся необходимость наличия специальных наборов для проведения кожных проб и соответственно удорожание лечения. Данный вариант показан пациентам с тяжелыми АР на пенициллин в анамнезе, у которых в конкретной клинической ситуации невозможно заменить цефалоспорины на антибиотики других групп. Аллергия на цефалоспорины. Кожные пробы с пенициллином информативны и для больных с АР на цефалоспорины для решения вопроса о возможности применения пенициллина. При отрицательных результатах пробы применение пенициллина возможно, при положительном – назначают антибиотик другой группы (не-β-лактам) или проводят предварительную десенсибилизацию к пенициллину. При АР на данный цефалоспорин назначение этого антибиотика в дальнейшем противопоказано. Риск перекрестных АР на другие цефалоспорины у больных с АР на один из них неизвестен. По некоторым данным, вероятность перекрестной гиперчувствительности невысока [30], поскольку при АР на цефалоспорины образуются преимущественно антитела к боковым цепям цефалоспоринов [31]. Наличие перекрестной аллергии на цефалоспорины и другие β-лактамные антибиотики в какой-то мере можно объяснить строением боковых цепей. Боковые цепи цефамандола, цефалотина и цефалоридина очень сходны по своему строению с таковыми у пенициллина G [32]. Цефалексин сходен по строению с ампициллином, цефадроксил – с амоксициллином, цефтазидим – с азтреонамом. Однако насколько такое структурное сходство повышает риск перекрестной аллергии, неизвестно [24]. Развитие реакций по типу сывороточной болезни на цефаклор связано с наследственно обусловленными дефектами метаболизма, поэтому больные с такой АР на цефаклор могут принимать другие цефалоспорины без риска АР, включая лоракарбеф, сходный по своему строению с цефаклором [33]. Аллергия на сульфаниламиды. У пациентов с АР на сульфаниламидные антимикробные препараты актуален вопрос о возможности использования других сульфаниламидсодержащих препаратов – диуретиков, целекоксиба, производных сульфонилмочевины (пероральные гипогликемические средства). Однако структура антимикробных сульфаниламидов (сульфаметоксазола, сульфадиазина, сульфизоксазола и сульфацетамида) за счет наличия ароматической аминовой группы в позиции N4 и замещающего кольца в позиции N1 отличается от таковой других сульфаниламидсодержащих медикаментов. Таким образом, перекрестная аллергия между этими препаратами маловероятна [34]. Вместе с тем результаты большого обсервацинного исследования показали другое: по сравнению с больными, не имевшими АР в анамнезе, у пациентов с АР на сульфаниламидные антимикробные средства повышен риск развития АР на другие сульфаниламидсодержащие препараты и даже на пенициллин [35]. Такое расхождение теории и практики объясняется следующим: связь между АР на антимикробные сульфаниламиды и другие сульфаниламидсодержащие препараты обусловлена не наличием перекрестной аллергии, а более высокой предрасположенностью данной категории больных к АР в целом [35]. Кроме того, сами результаты данного исследования нужно оценивать с осторожностью: использование закодированных диагнозов АР и ретроспективный характер исследования могли способствовать ошибочной диагностике аллергических и неаллергических НЛР. ЗаключениеБольные с АР на антибиотики в анамнезе требуют тщательного обследования для подтверждения иммунного характера НЛР и выявления типа АР. Вопрос о целесообразности дальнейшего назначения антибиотика, вызвавшего АР, зависит от клинической ситуации и возможности применения препарата другого класса. В ряде случаев при невозможности адекватной замены антибиотика препаратами другой группы допускается применение других антибиотиков этого же класса (при нетяжелых АР в анамнезе, низком риске перекрестной аллергии), а при тяжелых АР в прошлом – проведение специфических методов лечения (десенсибилизация, ступенчатая пробная терапия). Литература
Читайте также www.health-ua.org Проведение внутрикожных аллергических проб — Мегаобучалка
9.7.1. Внутрикожная аллергическая проба с бактериальными аллергенами. Постановку пробы курсанты осваивают при работе с больными в процедурной комнате под контролем преподавателя (ординатора). Курсант самостоятельно производит внутрикожное введение токсоплазмина больным токсоплазмозом или бруцеллина больным бруцеллезом. Предварительно необходимо проверить годность аллергена к применению (степень прозрачности, дата приготовления, срок годности, целость ампулы). Затем приготовить жгут для наложения на конечность выше места введения аллергена (в случае анафилактической реакции жгут немедленно закручивается), а также адреналин, мезатон, преднизолон и коргликон, а также ампулу с 25%-ным раствором глюкозы для оказания неотложной помощи. Кожу внутренней поверхности предплечья больного протереть 70%-ным спиртом и дать ей высохнуть. Наложить на конечность жгут. Слегка оттянув кожу указательным пальцем левой руки, строго внутрикожно ввести туберкулиновым шприцем (отдельным для каждого аллергена) 0,1 мл аллергена. Иглу следует держать срезом вверх. Далее необходимо оценить, согласно прилагаемой к аллергенам инструкции, немедленную, а на следующий день - замедленную реакцию кожи по величине зоны покраснения и отека в месте введения диагностикума, а также с учетом возможного образования регионарного лимфаденита и лимфангоита. Полученные данные записать в историю болезни. 9.7.2. Выявление аллергии к антибиотикам типа пенициллина, стрептомицина. Этот навык курсанты приобретают при лечении больных ангиной в отделении респираторных инфекций. Аллергию к антибиотикам выявляют с помощью целенаправленного аллергологического анамнеза и проведения скарификационной и внутрикожных проб. Перед проведением проб курсант должен выделить следующие группы больных. 1. Лиц, которым назначенные медикаменты и проведение аллергологических проб с ними противопоказаны из-за имевшихся в прошлом аллергических осложнений на данное лекарство. 2. Лиц, у которых данный антибиотик может вызвать аллергическую реакцию (предрасположение к аллергическим реакциям, имеющие так называемую аллергическую конституцию, страдающие дерматомикозом). 3. Лиц, неоднократно принимавших в прошлом данный антибиотик без аллергических осложнений. 4. Лиц, никогда не принимавших планируемый для лечения антибиотик, не страдающих аллергическими реакциями, без аллергической конституции. Больным 2, 3 и 4-й групп сначала производится скарификационная проба, при её отрицательных результатах через 30 минут - внутрикожная. Если скарификационная проба оказалась положительной - проведение внутрикожной пробы с тем же антибиотиком противопоказано. Если внутрикожная проба в течение 30 минут оказалась отрицательной, приступают к лечению, начиная с введения пробной дозы (пенициллина - 5000 ЕД, стрептомицина - 5000 ЕД), которую вводят внутримышечно в нижнюю треть плеча. Если в течение 30 минут состояние не изменилось, приступают к введению полной терапевтической дозы в традиционные места для инъекций. Перед постановкой проб курсант производит разведение антибиотика для пробы. 1 000 000 ЕД антибиотика разводит в 10 мл 0,9%-ного физиологического раствора. Затем из флакона берет 1 мл и разводит в 9 мл 0,9%-ного физиологического раствора. Получен раствор для постановки проб, в 1 мл которого будет содержаться 10 000 ЕД испытываемого антибиотика. Из этого раствора делают пробы. Скарификационная проба. На обработанной 70%-ным спиртом и высохшей коже ладонной поверхности предплечия больного курсант на расстоянии 3 - 4 см друг от друга наносит по капле испытуемого антибиотика (концентрация 10 000 ЕД/мл), а на другую – растворитель препарата (физиологический раствор). Стерильными ланцетами или инъекционными иглами через каплю проводит три скарификационные линии длиной около 10 мм каждая, избегая появления крови. В течение 30 минут наблюдает реакцию больного на препарат. Проба отрицательная - отсутствие гиперемии как в контроле (капля с физиологическим раствором), так и на месте нанесения раствора с испытываемым антибиотиком. Слабо положительная - на месте нанесения раствора с испытуемым антибиотиком развивается волдырь, заметный при натягивании кожи. Проба положительная - волдырь с гиперемией и размером не более 10 мм, заметный без натягивания кожи. Проба резко положительная - волдырь диаметром более 10 мм с гиперемией. Если для инъекции антибиотики разводятся на новокаине, то дополнительно, по вышеописанной методике курсант проводит скарификационную пробу с 0,25%-ным раствором новокаина. Внутрикожная проба. Внутрикожно в области ладонной поверхности предплечья туберкулиновым шприцем вводится 0,1 мл стерильного физиологического раствора; на расстоянии 5 см, с помощью другого шприца столько же испытуемого антибиотика (разведенного на стерильном физиологическом растворе, концентрация - 10 000 ЕД в 1 мл). На другой руке таким же образом, но уже третьим шприцем ставится внутрикожная проба с 0,25%-ным раствором новокаина. Через 30 минут отмечается реакция. Проба отрицательная - появление волдырей, размеры которых не превышают таковых в контроле (1 - 2 мм в диаметре). Слабоположительная - размеры волдыря в 2 раза превышают контрольные. Положительная - волдырьна месте введения антибиотика достигает 15 - 25 мм с эритемой; резкоположительная - размеры волдыря превышают 25 мм в диаметре. Антибиотик можно применять только при отрицательной скарификационной и внутрикожных пробах. Необходимо быть готовым к оказанию неотложной помощи в случае развития анафилактического шока. Для этого курсант заранее проверяет наличие укладки с набором необходимых лекарственных средств (адреналин, супрастин, димедрол, пипольфен, преднизолон, полиглюкин, коргликон), жгута для наложения на конечность выше места введения антибиотика. Через 20 минут курсант осматривает изменение состояния кожи в месте инъекции антибиотика, результаты проб заносит в историю болезни. При положительной реакции сделать запись в истории болезни и мед.книжке (а также на их титульный лист, обведя запись красным карандашом), запрещающую введение этого антибиотика, предупредив об этом больного. megaobuchalka.ru |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
г.Самара, ул. Димитрова 131 [email protected] |
 |

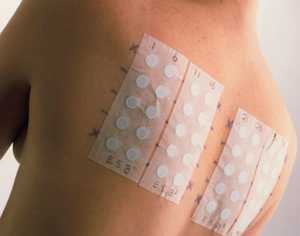 В первую очередь доктор со слов пациента составляет анамнез. По его данным назначаются кожные и провокационные пробы. Это самые распространенные методы. В крайнем случае, если эти исследования не дают точного ответа на вопрос, производится забор крови. Он позволяет выявить точный аллерген.
В первую очередь доктор со слов пациента составляет анамнез. По его данным назначаются кожные и провокационные пробы. Это самые распространенные методы. В крайнем случае, если эти исследования не дают точного ответа на вопрос, производится забор крови. Он позволяет выявить точный аллерген.