|
|
||||||||||
|
Метод серийных разведений антибиотика в агаризованной среде. Метод серийных разведений антибиотиковМетоды изучения антибиотикочувствительностиКритерием чувствительности микроорганизмов к антибиотикам является минимальная концентрация антибиотика, ингибирующая (задерживающая) рост возбудителя при стандартных условиях постановки опыта. При определении лекарственной устойчивости используют чистую культуру возбудителя, выделенную до начала лечения антибиотиками, т. к. под их воздействием рост микроорганизмов полностью угнетен. Изучение чувствительности проводят методом диффузии в агар с применением стандартных дисков или методом серийных разведений в жидких и плотных питательных средах. Метод бумажных дисковИсследуемую бактериальную культуру засевают газоном на питательный агар в чашке Петри. На засеянную поверхность пинцетом помещают на одинаковом расстоянии друг от друга бумажные диски, содержащие определенные дозы разных антибиотиков. Посев инкубируют при 37° С до следующего дня. По диаметру зон задержки роста исследуемой культуры бактерий судят о ее чувствительности к антибиотикам. Для получения достоверных результатов необходимо применять стандартные диски и питательные среды, для контроля которых используются эталонные штаммы соответствующих микроорганизмов. Метод дисков не дает надежных данных при определении чувствительности микроорганизмов к плохо диффундирующим в агар полипептидным антибиотикам (например, полимиксин, ристомицин). Если эти антибиотики предполагается использовать для лечения, рекомендуется определять чувствительность методом серийных разведений. Метод серийных разведенийДанным методом определяют минимальную концентрацию (МИК) антибиотика, ингибирующую рост исследуемой культуры бактерий. Вначале готовят основной раствор, содержащий определенную концентрацию антибиотика (мкг/мл или ЕД/мл) в специальном растворителе или буферном растворе. Из него готовят все последующие разведения в бульоне (в объеме 1 мл), после чего к каждому разведению добавляют 0,1 мл исследуемой бактериальной суспензии, содержащие 106-107 бактериальных клеток в 1 мл. В последнюю пробирку вносят 1 мл бульона и 0,1 мл суспензии бактерий (контроль культуры). Посевы инкубируют при 37° С до следующего дня, после чего отмечают результаты опыта по помутнению питательной среды, сравнивая с контролем культуры. Последняя пробирка с прозрачной питательной средой указывает на задержку роста исследуемой культуры бактерий под влиянием содержащейся в ней минимальной ингибирующей концентрации антибиотика.
Оценку результатов определения чувствительности микроорганизмов к антибиотикам проводят по таблице, которая содержит пограничные значения диаметров зон задержки роста для устойчивых, умеренно устойчивых и чувствительных штаммов, а также значения МИК антибиотиков для устойчивых и чувствительных штаммов. К чувствительным относятся штаммы микроорганизмов, рост которых подавляется при концентрациях препарата, обнаруживаемых в сыворотке крови больного при использовании обычных доз антибиотиков. К умеренно устойчивым относятся штаммы, для подавления роста которых требуются концентрации создающиеся в сыворотке крови при введении максимальных доз препарата Устойчивыми являются микроорганизмы, рост которых не подавляется препаратом в концентрациях, создаваемых в организме при использовании максимально допустимых доз. studfiles.net №6 АНТАГОНИЗМ МИКРОБОВ И АНТИБИОТИКИ• модификация мишени. Фермент-мишень может быть так изменен, что его функции не нарушаются, но способность связываться с химиопрепаратом (аффинность) резко снижается или может быть включен «обходной путь» метаболизма, т. е. в клетке активируется другой фермент, который не подвержен действию данного препарата. • «недоступность» мишени за счет сниженияпроницаемости клеточной стенки и клеточных мембран или«эффлюко-механизма, когда клетка как бы «выталкивает» из себя антибиотик. • инактивация препарата бактериальными ферментами.Некоторые бактерии способны продуцировать особые ферменты, которые делают препараты неактивными (например, бета-лактамазы, аминогликозид-модифицирующие ферменты, хлорамфениколацетилтрансфераза). Бета-лактамазы — это ферменты, разрушающие бета-лактамное кольцо с образованием неактивных соединений. Гены, кодирующие эти ферменты, широко распространены среди бактерий и могут быть как в составе хромосомы, так и в составе плазмиды. Для борьбы с инактивирующим действием бета-лактамаз используют вещества — ингибиторы (например, клавулановую кислоту, сульбактам, тазобактам). Эти вещества содержат в своем составе бета-лактамное кольцо и способны связываться с бета-лактамазами, предотвращая их разрушительное действие на бета-лактамы. При этом собственная антибактериальная активность таких ингибиторов низкая. Клавулановая кислота ингибирует большинство известныхбета-лактамаз. Ее комбинируют с пеницил-линами: амоксициллином, тикарциллином, пиперациллином. Предупредить развитие антибиотикорезистентности у бактерий практически невозможно, но необходимо использовать антимикробные препараты таким образом, чтобы не способствовать развитию и распространению устойчивости (в частности, применять антибиотики строго по показаниям, избегать их использования с профилактической целью, через 10—15 дней ан-тибиотикотерапии менять препарат, по возможности использовать препараты узкого спектра действия, ограниченно применять антибиотики в ветеринарии и не использовать их как фактор роста).
Существуют две модификации метода серийных разведений – определения чувствительности на жидком и густом питательных средах. Метод дает возможность определить МПК препарата для выделенного штамма возбудителя. Для определения антибиотикочутливости по методу серийных разведений в жидкой питательной среде готовят ряд (8-10 и больше) пробирок с двукратными последовательными разведениями препарата.
Среду предварительно разливают в пробирки по 2 мл. В первую добавляют 2 мл раствора антибиотика определенной концентрации, перемешивают и переносят к следующей пробирке, продолжая разведение к предпоследней, из которой удаляют 2 мл смеси. Последняя пробирка служит контролем роста культуры. В том же бульйони, который используют для разведения антибиотиков, готовят суспензию суточной агаровой или бульйоннои культуры бактерий из расчета 105-106 микробных тел в 1 мл в зависимости от вида возбудителя. Потом к каждой пробирке с разведениями, а также к контрольной добавляют по 0,2 мл изготовленной суспензии. При определении чувствительности к пеницилинив пеницилиназоутворюючих стафилококков рекомендуют использовать одновременно большую и малую микробную нагрузку (100, 100000 и выше микробных тел в 1 мл). В зависимости от величины посевной дозы значения МПК препарата может колебаться: при увеличении дозы чувствительность снижается за счет роста количества пеницилинази, что образуется в среде. Пробирки инкубируют в термостате при 37 °С в течение 18-24 год. Результаты учитывают, определяя наличие или отсутствие роста в среде с разными разведениями препарата.
Последняя пробирка, в которой наблюдают задержку роста культуры (прозрачный бульйон), отвечает МПК (минимальной подавляющей концентрации) или МБсК (минимальной бактериостатическойконцентрации) препарата относительно данного микроба и указывает на степень его чувствительности.
Если признаки роста появляются во всех пробирках, исследуемый штамм резистентный к максимальной концентрации препарата, которая была взята в опыт. Отсутствие роста бактерий во всех пробирках, кроме контрольной, свидетельствует, что МПК препарата ниже, чем и, что используется в опыте.
Для определения бактерицидного эффекта антибиотика из нескольких последних пробирок, в которых нет признаков роста, делают висел на секторы агара в чашках Петри. Через 24-48 год инкубации при оптимальной температуре отмечают ту наименьшую концентрацию препарата в пробирке, занял из которой
Принцип метода серийных разведений в плотной питательной среде аналогичен предыдущему. Для этого готовят серию разведений антибиотика в агаре, добавляя один объем, который содержит определенное количество препарата до 9 объемов агара. Для этого удобно разлить агар во флаконы или широкие пробирки по 13,5 мл. Перед постановкой агар расплавляют на водяной бане и после охлаждения до 60-65 °С в каждую пробирку добавляют 1,5 мл соответствующего разведения антибиотика (в бульйоне), тщательным образом перемешивают и выливают в чашку Петри. В контрольную пробирку с агаром вместо раствора антибиотика вносят 1,5 мл дистиллированной воды. Чашку разделяют на секторы, на каждый из которых засевают исследуемый штамм. Посевы делают бактериологической петлей или пастеровской пипеткой. Для посева удобно использовать специальный штамп-репликатор, который позволяет нанести одновременно на поверхность агара 25-50 исследуемых культур. Результаты учитывают после 18-24 год инкубации в термостате при оптимальной температуре.
За МПК (минимальную подавляющую концентрацию) антибиотика для данного штамма принимают ту, при которой отсутствуют признаки роста колоний на поверхности агара (или вместо бляшки есть рост одиночных колоний).
Из двух способов определения антибиотикочутливости микробов до антибиотиков (разведений в густой и жидкой средах) точнее является метод серийных разведений в жидкой среде. Результаты, которые получают с помощью разведений в агаре, менее постоянны. Метод не следует применять при оценке чувствительности тех микробов, которые дают тонкий, разрежен рост на поверхности чашки (стрептококки, пневмококки) или, напротив, имеют тенденцию к ползучему росту (протей). Недостатком методов серийных разведений является их высокая трудоємнисть, что ограничивает использование в обычных бактериологических лабораториях. С целью упрощение было предложено модификацию метода с заменой ряда из 10 пробирок, которые содержат разные количества препарата, тремя концентрациями антибиотика. Первая из них отвечает максимальной, что находится в крови при введении терапевтических доз, вторая – уровню, который наблюдается через Т1/2 (время снижения концентрации антибиотика на 50 %). Третья является минимальной, то есть той, которая равняется МПК для высокочувствительных штаммов. В соответствии с использованными концентрациями антибиотиков исследуемые штаммы можно отнести за уровнем чувствительности до трех основных групп: резистентные (МПК для которых превышает значение максимальной концентрации антибиотика в крови), умеренно чувствительные (значения МПК приближаются к максимальной или средней концентрации) и высокочувствительные (чувствительность которых к антибиотику находится на уровне минимальной концентрации, которая используется в опыте). Такими концентрациями при определении чувствительности к бензилпеницилину является соответственно 0,05-0,2, 0,5 и 2,0 ОД/МЛ, к макролидам – 0,1, 0,5-1,0 и 4,0 мкг/мл, к аминогликозидив – 0,5-1,0, 6,0-8,0 и 15,0-20,0 мкг/мл.
Ускоренные методы определения чувствительности микроорганизмов к антибиотикам. Используя обычные методы, ответ может быть получен через 18-20 год от начала исследования, не учитывая этапов выделения чистой культуры. Это приводит к тому, что в большинстве случаев особенно при затяжном и тяжелом течении болезни, лечение антибиотиками начинают задолго до получения данных лабораторного обследования. В зависимости от принципов, на которых они базируются, ускоренные методы предусматривают: • определение изменений ферментативнои активности микроорганизмов под воздействием антибиотиков; • определение цвета редокс-индикаторов при изменении окислительно восстановительного потенциала во время роста бактерий в питательной среде; • цитологичну оценку изменений морфологии бактериальных клеток под воздействием антибиотиков.
К первой группе принадлежит метод Роджерса, ориентированный на способность антибиотиков подавлять ферментативну активность чувствительных микроорганизмов, которая сопровождается изменением цвета соответствующего индикатора. Суть его заключается в дифференцированном изменении красного цвета фенолового красного на желтый или фиолетовый в зависимости от чувствительности исследуемого штамма. В случае чувствительности к действию антибиотика не происходит разложение глюкозы при культивировании в среде, которое содержит ее и определены концентрации препарата. При этом среда окрашивается в фиолетовый цвет в результате сдвига рН в щелочную сторону. Изменение красного цвета на желтый свидетельствует о расщеплении глюкозы с образованием кислоты в результате роста штамма, резистентного к действию антибиотика. Если к среде прибавить 0,25 % дрожжевого экстракта, результаты могут быть учтенными уже через 2-2,5 год от начала исследования. Следующая группа методов регистрирует изменения окислительно восстановительного потенциала среды в процессе роста микроорганизмов, о чем свидетельствует изменение цвета резазурина,1,3,5-трифенилтетразолия хлорида, 2,6-дихлорфенолиндофенола и других, которые добавляются к среде. Этот метод технически простой, а результаты получают через 2-6 год. Принцип его сводится к тому, который растоплен и охлажден до 50 °С агар засевают исследуемой культурой бактерий из расчета 200 млн. микробных тел, а на поверхность налагают диски с антибиотиками. Чашки инкубируют при оптимальной температуре в течение 3-5 год, потом обрабатывают индикатором и повторно инкубируют при 37 °С в течение 20-30 хв. Результаты учитывают за изменением цвета вокруг дисков с антибиотиками. Если используют 1 % раствор 1,3,5-трифенилтетразолия хлорида, участка агара с бактериальным ростом в результате образования формазану приобретают красный цвет, а зоны притеснения роста вокруг дисков остаются бесцветными. Судить о степени чувствительности микробов к антибиотикам можно с такой же точностью, как и с помощью стандартного метода дисков, однако время исследования уменьшается до 3-5 год. Образование инволюционных форм бактерий под воздействием антибиотиков исследуют под фазово-контрастным или антоптральним микроскопом в специальных микрокапсулах. Они образуются в результате действия бактериостатичних концентраций препарата. Под воздействием суббактериостатичних концентраций, а также при резистентности исследуемого штамма на поверхности агара вырастают нормальные микроколонии. Метод может быть применен для определения чувствительности штаммов кишечной палочки, стафилококков, холерных вибрионов. Полученные даны в большинстве случаев совпадают с теми, которые дают классические методы. За последние годы разработаны многочисленные модификации метода серийных разведений в питательных бульйонах. В частности, экспресс-методы с титрованием антибиотика в объеме 0,25 мл. Выпускаются коммерческие наборы длительного хранения, которые состоят из планшетов из лиофильно высушенными разведениями антибиотика, куда вносится по 0,1 мл суспензии чистой культуры микроорганизмов. Результаты определения антибиотикочутливости можно оценивать визуально (при наличии в среде индикатора) или с помощью спектрофотометров, когда регистрируется изменение оптической плотности среды. Определять чувствительность бактерий к антибиотикам можно и с помощью автоматизированных микробиологических систем (“Autobac MS-2”, “Cobas Micro”, Quantum 2, Sceptor и др.). При их использовании результаты получают уже через 3-10 год. Одно из их преимуществ заключается в том, что они позволяют получать результаты одновременно до 18-20 антибиотиков. Эти методы широко используют в микробиологических лабораториях, они хорошо коррелируют с другими методиками и за их помощью можно не только выбирать рациональную схему антибиотикотерапии, но и проводить эпидемиологический контроль резистентности. Однако при пользовании такими автоматизированными системами частота выявления резистентных штаммов может быть снижена в результате медленного роста устойчивых вариантов. В большинстве подобных систем результаты учитывают путем сравнения роста (или гибели) бактериальных клеток в присутствии антибиотиков с контролем, где есть только микробы. При этих условиях достаточно трудно дифференцировать клетки, которые погибают, от тех, что медленно размножаются. К другим факторам, которые влияют на результаты, принадлежит действие субингибиторних концентраций препаратов на ультраструктуру бактериальных клеток. Они приводят к изменению формы, набухания клеток, которое может сопровождаться изменением оптической плотности суспензии и искажением результатов. В свою очередь, это дает неправильную информацию о чувствительности возбудителей. Таким образом, применение любого метода позволяет определить антибиотикограму возбудителя – спектр его чувствительности и антибиотикостийкости. Все методы определения чувствительности бактерий к антибиотикам имеют свои преимущества и свои недостатки. Потому постоянный контроль за объективностью результатов и соблюдением правил проведения исследований способствуют получению достоверных данных. В большинстве случаев результаты определения антибиотикоустойчивости in vitro совпадают с клиническими последствиями антибиотикотерапии. Случаи разногласия объясняются рядом причин, среди которых чаще всего встречается ошибочная трактовка полученных лабораторных данных. Причиной таких ситуаций может быть использование при посеве не чистой культуры бактерий, а патологического материала. Потому определяется не чувствительность инфекционного агента, а микробной ассоциации, в том числе и сапрофитной флоры. Ошибки встречаются при исследовании содержания двенадцатиперстной кишки, фекалиий, харкотиння, выделений из ран, мочи и тому подобное. Плазмиды делают бактерии нечувствительными к подавляющему большинству антибиотиков, которые используются в клиниках, поскольку кодируют синтез ферментов, которые разрушают препараты. Одним из наиболее исследованных ферментов является бета-лактамаза, которая разрушает антибиотики, которые принадлежат к группе бета-лактамив. Разработано несколько методических приемов, которые позволяют быстро определить ее активность. Один из них заключается в том, что на фильтровальную бумагу размером 2х2 см, который находится в чашке Петри, капают одну каплю 2 % водного раствора крахмала. Потом на эту бумагу наносят петлей агаровую культуру микробов и растирают ее, формируя бляшку диаметром до 5 мм. На ее поверхность наносят рабочий йодный раствор пенициллина. Учет результатов проводят через 10 минут инкубации системы при комнатной температуре. При наличии бета-лактамазы на темно-синем фоне наблюдается ярко выраженная четкая зона просветления вокруг бляшки, которая содержит агаровую культуру микробов. При негативном результате зона просветления отсутствует, а края бляшки нечетки.
Минимальная ингибирующая (биостатическая, подавляющая) концентрация (МИК, МПК) - минимальная концентрация химиотерапевтического или антисептического вещества, вызывающая полноеподавление заметного невооруженным глазом роста данного микроорганизма на средах в стандартныхусловиях опыта. Измеряют в мкг/мл или в ед. действия (ME, ЕД). Устанавливают посевом иссл. к-ры наплотные или жидкие среды, содержащие различные концентрации препарата. Применяют в химиотерапии иантисептике для выбора эффективных у данного б-ного препаратов и их доз.
Эти методы используют для определения биологической активности антибиотиков и их концентрации в тканях макроорганизма. На практике используют два метода. Метод серийных разведений. Готовят ряд разведений эталонного антибиотика на жидкой питательной среде и параллельно исследуемый материал. Во все пробирки вносят тестовый микроорганизм в определенной концентрации. Учитывают результаты по помутнению среды. Определяют концентрацию антибиотика умножением наибольшего разведения исследуемой жидкости, задерживающей рост бактерий, на минимальную концентрацию эталонного антибиотика, задерживающего рост. Метод диффузии в агар. Этот метод точнее, чем метод серийных разведений и чаще используется на практике. Готовят чашку Петри с двумя слоями агара. Первый слой - голодный агар, второй слой состоит из агара в смеси с тест-культурой. После застывания второго слоя агара на его поверхности делают 6 лунок. В половину из них вносят разведения испытуемого раствора, а в остальные – стандартный раствор. Пробы для повышения точности дублируют. Размеры зон задержки роста тест-культуры после инкубации измеряют и производят расчет активности (концентрации) антибиотиков с использованием расчетных таблиц или стандартных кривых. studfiles.net Метод серийных разведений антибиотика в агаризованной среде — МегаЛекцииВ этом случае можно в одном опыте проверить чувствительность к разным концентрациям данного антибиотика нескольких культур микроорганизмов. Различные разведения антибиотика готовят в стерильной агаризованной среде. Для этого в неё добавляют требуемое количество исходного раствора антибиотика, тщательно перемешивают и заливают в стерильные чашки Петри. После застывания агара дно чашки с наружной стороны делят маркером на сектора. Каждую исследуемую культуру засевают штрихом с помощью бактериологической петли на определённый сектор в чашки с разными концентрациями антибиотика. Посев исследуемых культур на чашки с различными концентрациями антибиотика можно сделать с помощью аппликатора, позволяющего засевать одновременно 12-15 культур на одну чашку. Затем чашки помещают в термостат при температуре, оптимальной для роста и развития изучаемых бактерий. Результаты учитывают по наличию или отсутствию роста бактерий в сравнении с ростом на среде в контрольной чашке. Бактерии считаются чувствительными к антибиотику в такой его концентрации, при которой их рост полностью подавляется. Метод Е-тестов Данный метод сочетает в себе достоинства метода серийных разведений и метода дисков. Вместо дисков используются полоски («линейки») фильтровальной бумаги, пропитанные антибиотиком, причем у основания полоски концентрация антибиотика будет минимальной, а на «верхушке» – максимальной. Полоски помещают на поверхность питательного агара, засеянного исследуемой культурой. Если бактерии чувствительны к действию данного препарата, вокруг участков полоски, содержащих его ингибирующие концентрации, возникает эллипсовидная зона задержки роста. Числовое значение концентрации антибиотика у основания этой зоны указывает на МПК данного антибиотика для данной культуры. К чувствительным относятся штаммы микроорганизмов, рост которых подавляется при концентрациях препарата, обнаруживаемых в сыворотке крови больного при использовании обычных доз антибиотиков. К умеренно устойчивым относятся штаммы, для подавления роста которых требуются концентрации, создающиеся в сыворотке крови при введении максимальных доз препарата. Устойчивыми являются микроорганизмы, рост которых не подавляется препаратом в концентрациях, создаваемых в организме при использовании максимально допустимых доз. Количественные методы или методы титрования бактериофагов Титрование бактериофагов проводится с использованием культур чувствительных бактерий в жидких и плотных питательных средах.
Метод титрования бактериофага по Аппельману (на жидкой питательной среде) Готовят десятикратные разведения исследуемого бактериофага в питательном бульоне. Для этого в ряд пробирок разливают по 4,5 мл бульона. В 1-ю пробирку добавляют 0,5 мл исследуемого фага. Тщательно перемешивают и переносят в последующие пробирки (из пробирки в пробирку) по 0,5 мл соответствующего разведения фага с уменьшением его концентрации в десять раз. Получают разведения от 10-1 до 10-9 степени. Затем в пробирки вносят по 1 капле суточной культуры соответствующих бактерий. После инкубации в течение суток определяют титр фага. За титр бактериофага принимают то его максимальное разведение, при котором наблюдается полный лизис культуры (просветление среды). Метод титрования бактериофага по Грациа(на плотной питательной среде) Питательный агар разливают в чашки Петри и подсушивают в термостате. Готовят полужидкий питательный агар по 3–4 мл в пробирке и растапливают его на водяной бане. Делают десятикратные разведения исследуемого бактериофага в изотоническом растворе хлорида натрия. Затем 0,5 мл каждого разведения бактериофага смешивают с таким же объёмом суточной бульонной культуры чувствительных к бактериофагу бактерий и выливают эту смесь в пробирку с полужидким агаром температурой 45°C. Приготовленную смесь быстро выливают на поверхность первого слоя агара в чашке Петри, где она застывает в виде тонкого слоя. После застывания второго слоя агара чашки инкубируют при 37°C в течение суток. Смеси бактериофага, культуры и полужидкого агара делают из разведений фага 102–1010, в зависимости от предполагаемого титра фага. Не заражённые бактериофагом бактерии, размножаясь, образуют сплошной газон роста на поверхности питательного агара. Каждая инфицированная бактериофагом бактерия лизируется и освобождает потомство бактериофага, которое внедряется в интактные клетки бактерий, и весь цикл повторяется. В результате лизиса клеток на сплошном бактериальном газоне появляются «стерильные» пятна или негативные колонии бактериофага. Число этих пятен соответствует количеству фаговых частиц в засеянной смеси. Количество пятнообразующих единиц в 1 мл исходной суспензии бактериофага называется его титром. Фаготипирование бактерий Метод фаготипирования имеет большое значение при эпидемиологических исследованиях, так как позволяет выявить источник и пути распространения возбудителей заболеваний. Определение фаговара выделенной чистой культуры проводят с помощью набора типовых диагностических бактериофагов. Фаговар культуры определяют по тому типовому фагу, который вызвал её лизис. Для проведения фаготипирования исследуемую суточную культуру бактерий засевают «газоном» на поверхность питательного агара в чашки Петри, подсушивают в термостате, делят со стороны дна чашки на квадраты и наносят пипеткой по одной капле соответствующего бактериофага в тест-разведении, указанном на ампуле. В один квадрат бактериофаг не вносят, для контроля роста культуры. Чашку термостатируют при 37оС 18-20 часов, после чего оценивают результат реакции. Положительный результат реакции фаголизиса – лизис культуры в месте нанесения бактериофага («негативные» колонии) при наличии роста в контроле свидетельствует о соответствии культуры бактериофагу и принадлежности с учетом её фаголизабельности к соответствующему виду. Применение бактериофагов Применяемые на практике препараты бактериофагов представляют собой фильтрат бульонной культуры соответствующих микробов, лизированных фагом, содержащий живые частицы фага, а также антигены бактерий, освободившиеся из бактериальных клеток при их лизисе. Полученный препарат – жидкий бактериофаг – должен иметь вид совершенно прозрачной жидкости желтого цвета большей или меньшей интенсивности. Препарат проходит контроль на стерильность (методом посева), безвредность и литическую активность (титр). Диагностические бактериофаги выпускаются как в жидкой, так и в сухой форме, в ампулах. Перед началом работы сухой бактериофаг разводится. Для лечебно-профилактических целей бактериофаги выпускаются в форме таблеток с кислотоустойчивой оболочкой, в жидком виде или в суппозиториях. Таблетированный сухой бактериофаг более стабилен при хранении и удобен при применении. Одна таблетка сухого бактериофага соответствует 20-25 мл жидкого препарата. Срок годности сухого и жидкого препарата составляет 1 год. Жидкий бактериофаг следует хранить при температуре +2 – +100С, сухой – не выше +10С, но его можно хранить в холодильнике и при отрицательной температуре. Принятый внутрь бактериофаг сохраняется в организме в течение 5-7 дней. Как правило, приём бактериофага не сопровождается какими-либо реакциями или осложнениями. Противопоказаний к приему нет. Бактериофаги могут применять также в виде орошений, полосканий, примочек, тампонов. Инъекционные формы бактериофагов можно вводить в стерильные полости – брюшную, плевральную, суставную и в мочевой пузырь. Существует форма выпуска бактериофагов в свечах для ректального применения. Контрольные вопросы Дайте определение понятия «химиотерапевтический препарат». Назовите фамилию учёного, разработавшего теорию химиотерапии. Какие свойства являются определяющими при выборе химиотерапевтического препарата? Что такое бактерицидное и бактериостатическое действие препарата? Что такое химиотерапевтический индекс, напишите его формулу, для чего применяется этот показатель? Укажите первые антиспирохетные препараты, синтезированные Эрлихом. Назовите группы химиотерапевтических препаратов, приведите примеры. Назовите фамилию учёного, впервые получившего антибактериальный препарат, и название препарата. Дайте определение понятию «антибиотик». Назовите фамилии русских учёных, впервые обнаруживших антибактериальные свойства зелёной плесени. Назовите фамилию учёного, изучавшего свойства зелёной плесени и сделавшего попытку выделить пенициллин. Назовите фамилии учёных – зарубежных и отечественных, получивших первый антибиотик из зелёной плесени. Назовите фамилию учёного, впервые получившего стрептомицин. Классификация антибиотиков по происхождению (источнику получения), по химическому составу. Механизм действия антибиотиков: «мишени» (точки приложения различных групп антибиотиков). Что означает понятие «спектр действия» антибиотиков? Назовите антибиотики активные преимущественно по отношению к грамотрицательным бактериям, преимущественно по отношению к грамположительным бактериям, антибиотики широкого спектра действия, противовирусные, противогрибковые, противоопухолевые антибиотики. Методы определения активности антибиотиков; в каких единицах измеряется антибактериальная активность антибиотиков? Основные проявления побочного действия антибиотиков. Виды лекарственной устойчивости микробов по происхождению. Генетические механизмы лекарственной устойчивости. Фенотипические (биохимические, структурные) механизмы лекарственной устойчивости. Методы определения чувствительности бактерий к антибиотикам, техника исследования и оценка результатов. Какие существуют способы предупреждения и преодоления лекарственной устойчивости микробов? Назовите препараты, предназначенные для преодоления лекарственной устойчивости и применяемые в сочетании с антибиотиками. ЗАДАЧА 1. Укажите культуру, наиболее чувствительную к пенициллину, если диаметр зоны задержки роста вокруг диска равняется: кишечная палочка – 0 мм; стафилококк – 15 мм; стрептококк – 30 мм; палочка дифтерии – 13 мм. ЗАДАЧА 2. Выберите наиболее эффективный антибиотик для лечения больного, если при определении лекарственной устойчивости возбудителя методом стандартных дисков установлены диаметры зон задержки роста: пенициллин – 0 мм; стрептомицин – 13 мм; тетрациклин – 28 мм; эритромицин –15 мм. ЗАДАЧА 3. Применение пенициллина для лечения стафилококкового заболевания у больного оказалось неэффективным. Какую можно предположить причину неэффективности пенициллина? Как можно проверить это предположение? Какие методы можно применить для этого? ЗАДАЧА 4. У больного Н. с диагнозом бактериальная дизентерия до начала лечения выделен возбудитель дизентерии, чувствительный ко всем антибиотикам. Больной лечился левомицетином, с другими больными дизентерией не контактировал. На третий день после начала лечения снова выделен возбудитель дизентерии, который оказался устойчивым одновременно к трём антибиотикам: левомицетину, тетрациклину и стрептомицину. Как могла возникнуть множественная лекарственная устойчивость у возбудителя дизентерии в данной ситуации? Как доказать предполагаемый вами механизм возникновения множественной лекарственной устойчивости. Свойства бактериофагов. Природа – к какому царству живых существ относится? Строение - какую форму чаще всего имеет? Какие химические компоненты содержит? Структурные элементы бактериофага. Размеры – в каких единицах измеряется величина бактериофагов? Назовите фамилии учёных, открывших явление бактериофагии. Опишите фазы взаимодействия вирулентного (инфекционного) бактериофага с чувствительной к нему бактериальной клеткой. Как обнаружить действие бактериофага на бактерии в жидкой и плотной питательной среде? Как будет выглядеть положительный результат? Что такое титр бактериофага? Как определяют и обозначают титр бактериофага? Что такое умеренный бактериофаг, профаг, лизогенная культура, лизогенная конверсия, трансдукция? Опишите взаимодействие умеренного бактериофага с бактериальной клеткой. Применение бактериофагов в практической медицине – на каком свойстве оно основано? Назовите бактериофаги, применяющиеся для лечения, для диагностики, для фаготипирования. megalektsii.ru Метод серийных разведенийДанным методом определяют минимальную ингибирующую концентрацию (МИК) антибиотика рост исследуемой культуры бактерий. Вначале готовят основное раствор, содержащий определенную концентрацию антибиотика (мкг/мл ил] ЕД/мл) в специальном растворителе или буферном растворе. Из него готовят во последующие разведения в бульоне (в объеме 1 мл), после чего к каждом; разведению добавляют 0,1 мл исследуемой бактериальной суспензии, содержащие 106-107 бактериальных клеток в 1 мл. В последнюю пробирку вносят 1 мл бульон и 0,1 мл суспензии бактерий (контроль культуры). Посевы инкубируют при 37°С до следующего дня, после чего отмечают результаты опыта по помутнение питательной среды, сравнивая с контролем культуры. Последняя пробирка прозрачной питательной средой указывает на задержку роста исследуемой культуры бактерий под влиянием содержащейся в ней минимальной ингибирующей концентрации антибиотика.
Оценку результатов определения чувствительности микроорганизмов к антибиотикам проводят по таблице, которая содержит пограничные значения диаметров зон задержки роста для устойчивых, умеренно устойчивых и чувствительных штаммов, а также значения МИК антибиотиков для устойчивых и чувствительных штаммов. К чувствительным относятся штаммы микроорганизмов, рост которых подавляется при концентрациях препарата, обнаруживаемых в сыворотке крови больного при использовании обычных доз антибиотиков. К умеренно устойчивым относятся штаммы, для подавления роста которых требуются концентрации создающиеся в сыворотке крови при введении максимальных доз препарата Устойчивыми являются микроорганизмы, рост которых не подавляется препаратом в концентрациях, создаваемых в организме при использовании максимально допустимых доз. Оценка результатов определения чувствительности микроорганизмов к антибиотикам методами дисков и серийных разведений
studfiles.net серийных разведений (11.1), диффузии в агар (11.2)ЦЕЛЬ РАБОТЫ. Овладеть методами определения чувствительности и устойчивости бактерий к антибиотикам. МАТЕРИАЛЬНОЕ ОСНАЩЕНИЕ. Выделенные на предыдущем занятии чистые культуры бактерий, взвесь кала на физиологическом растворе. Для демонстрации: набор антибиотиков, ряд пробирок с МПБ, содержащим серийно разведенный пенициллин и засеянный культурой стафилококка. Стерильные чашки Петри, расплавленный МПА (столбиком), мерные и пастеровские пипетки, пинцеты, спиртовки, стандартные диски с разными антибиотиками. Таблицы, схемы, рисунки. Антибиотики – это лекарственные препараты, обладающие антимикробным действием. Они получили широкое применение для терапии многих болезней животных и человека. С каждым годом расширяется арсенал антибиотических препаратов, выпускаемых промышленностью. Источником получения антибиотиков являются микроскопические грибы (пенициллин), актиномицеты (стрептомицин, тетрациклин), бактерии (грамицидин, полимиксин). Антибиотические вещества извлекают и из клеток растений (фитонциды лука, чеснока) и животных тканей (лизоцим, экмолин). Механизм антагонистического действия антибиотиков сводится к нарушению процессов обмена веществ в микробной клетке. Антибиотики могут оказывать на микроорганизмы бактериостатическое и бактерицидное действия. При бактериостатическом действии антибиотиков подавляет или задерживает рост микроорганизмов, а бактерицидное — вызывает их гибель. Создание большого количества разнообразных антибиотиков вызвано, с одной стороны, поисками все более эффективных лечебных средств, а с другой, тем, что по мере широкого применения антибиотиков их лечебный эффект снижается вследствие возникновения резистентных (устойчивых) форм микробов. Эффективность применения антибиотиков во многом зависит от чувствительности возбудителя болезни к применяемому антибиотику, поэтому возникла необходимость определения чувствительности микроорганизмов к этим препаратам. При определении чувствительности желательно иметь чистые культуры возбудителя, и лишь при необходимости срочного получения ответа используют исследоуемый материал, содержащий всю микрофлору. В лабораторной практике для определения чувствительности бактерий к антибиотикам используют следующие методы. 11.1. Методы серийных разведенийБолее точные результаты можно получить, применяя метод серийных разведений в жидкой среде. Бульон Хоттингера (или другую среду, пригодную для роста данного микроорганизма) разливают по 2 мл в пробирки, расставленные в штативы по 10 в каждом ряду. Готовят раствор антибиотика, содержащий 100 ЕД в 1 мл, и добавляют 2 мл этого раствора в первую пробирку. После тщательного перемешивания новой стерильной мерной пипеткой переносят 2 мл из этой пробирки в следующую и т.д. до девятой пробирки, из которой 2 мл выливают. Десятая пробирка, не содержащая антибиотика, служит контролем роста культуры. Для постановки этого опыта вместо стандартов антибиотиков можно с успехом использовать имеющиеся в продаже препараты, на этикетках которых указано количество единиц во флаконе. Например, если флакон содержит 500 000 ЕД пенициллина, то, добавив в него 10 мл дистиллированной воды, получают раствор, содержащий в 1 мл 50000 ЕД, при дальнейшем разведении в 100 раз получают раствор с концентрацией пенициллина 500 ЕД/мл. Для получения требуемой концентрации 100 ЕД/мл нужно развести этот раствор еще в 5 раз; это разведение делают при помощи бульона и 2 мл полученного раствора вносят в первую пробирку. Таким образом, в первой пробирке концентрация пенициллина 50 ЕД/мл, во второй 25 ЕД/мл и т.д. Если на этикетке препарата дозировка указана в весовых единицах, следует иметь в виду, что для большей части антибиотиков 1 г активного вещества соответствует 1 000 000 ЕД. Из этого расчета и следует разводить антибиотик. Если порошок антибиотика расфасован не мерно и на этикетке указано количество единиц активности в 1 мг, необходимо к точной навеске препарата (20-25 мг), сделанной на аналитических весах, добавить равный объем растворителя, т.е. получить раствор мг/мл, в 1 мл которого содержится столько единиц, сколько их было указано па этикетке. Из этого основного раствора делают дальнейшие разведения по указанной выше схеме. Суточную агаровую культуру испытуемого микроба смывают изотоническим раствором хлорида натрия и, определив концентрацию взвеси по стандарту мутности, разводят до густоты 10 000 микробов в 1 мл. Полученную взвесь по 0,2 мл вносят во все пробирки ряда, начиная с контрольной. Таким образом, во всех пробирках определяют рост после инкубации при 37 °С в течение 18-20 ч. Последняя пробирка с прозрачным бульоном при наличии густого роста в контроле определяет минимальную концентрацию антибиотика, подавляющую рост данного микроорганизма. Таблица 2 studfiles.net Метод серийных разведений в жидкой питательной среде. — КиберПедияХарактеристика метода. Количественный. Определяет активные препараты и их ингибирующие концентрации.Особенности метода. Готовят 8-12 серийных двукратных разведений антибиотика в пробирках с бульоном Мюллер-Хинтона. Техника проведения. Готовят суспензию тест-микроорганизмов 106 КОЕ/мл, вносят суспензию в соотношении 1:1 в Мюллер-Хинтон бульон с различными концентрациями антибиотика (посевная доза 5х105), инкубируют при 350С 18–24 часа.Принцип учета. Микроорганизмы растут на среде, вызывая ее помутнение, если концентрация антибиотика ниже ингибирующей, и не растут - если больше (среда прозрачна).Оценка чувствительности. Определяют МИК тест-культуры и сравнивают со стандартными величинами МИК. Относят тест-культуру к чувствительным, умеренно чувствительным или резистентным. Оценка метода. Метод трудоемкий, требует затрат большого количества сред, посуды, времени. Основной метод регионального или национального мониторинга антиботикорезистнтности. 2.2.2. Метод серийных разведении на плотной питательной среде. Характеристика метода. Количественный. Определяет активные препараты и их ингибирующие концентрации. Особенности метода. Готовят 8-12 серийных двукратных разведений антибиотика в агаре Мюллер-Хинтона.Техника проведения. Готовят суспензию тест-микроорганизмов в концентрации 107 КОЕ/мл и инокулируют по 1-2 мкл (посевная доза 1-2х104) на среды в чашках Петри с последовательными двукратными концентрациями антибиотика, инкубируют
при 350С 18–24 часа. Культуры могут наносить на среду в чашках Петри штампом-репликатором, что позволяет одновременно изучать до 100 культур. Принцип учета. Микроорганизмы растут на среде, если концентрация антибиотика ниже ингибирующей и не растут - если больше.Оценка чувствительности. Определяют МИК антибиотика для тест-культуры и сравнивают со стандартными величинами МИК. Относят тест-культуру к чувствительным, умеренно чувствительным или резистентным. Оценка метода. Метод трудоемкий, требует затрат большого количества сред, посуды, времени. Основной метод регионального или национального мониторинга антибиотикорезистнтности. Выводы.- переписать 1. Формирующаяся устойчивость бактерий к антибиотикам отрицательно влияет на эффективность лечения инфекционных заболеваний 2. Антибитикорезистентность бактерий способствует возращению ранее побежденных инфекционных болезней 3. Наиболее эффективными методами определения антибиотикочуствительности являются: дискодиффузионный метод с использованием диспенсера и Е-тесты (подредактируй, может еще какие выводы добавишь по методам определения и по экологии 1 вывод) ЗАКЛЮЧЕНИЕ. Антибиотики несомненно играют важную роль в нашей жизни, без них невозможно было бы вылечить многие болезни и от них зависят жизни многих людей. Антибиотики произвели революцию в лечебной практике. Среди многочисленных антибиотиков, широко применяемых в качестве химиотерапевтических средств, в наибольших количествах используются пенициллины, цефалоспорины, стрептомицин и другие аминогликозиды, хлорамфеникол, тетрациклины и эритромицин
Кроме того, важное значение имеют бацитрацин, полимиксин, неомицин, нистатин и гризеофульвин. В определенных случаях используют также и другие антибиотики. Но важно помнить, что всё не так просто, как кажется. Антибиотики имеют разрушительную силу, они уничтожают не только вредные, но и полезные бактерии в нашем организме, что приводит к осложнениям, от которых тяжело избавиться. Чтобы подобное не случилось, необходимо очень осторожно принимать антибиотики. Ни в коем случае нельзя заниматься самолечением, потому что все препараты имеют различный спектр действия, и неосведомлённому человеку в этом разобраться сложно, можно сильно навредить себе. Необходим обращаться к врачу, чтобы тот мог определить род заболевания и назначить верный препарат, тем более, что не все заболевания можно вылечить антибиотиками. Например, вирусные заболевания ими не вылечишь. На современном этапе развития человечество ищет новые способы борьбы с бактериями. Разрабатываются новые препараты, наносящие меньше вреда организму. К сожалению это процесс не быстрый, и люди не скоро отойдут от антибиотиков, тем более, что существует множество болезней, которые кроме как антибиотиками не вылечить.
Список используемой литературы.(где интервалы 1., где стр., где Интернет ресурсы- в конце списк
1.Быков А.С., Воробьёв А.А. Атлас по медицинской микробиологии, вирусологии и иммунологии - М. : Медицинское информационное агентство,2008г. 2. Воробьёв А.А. Общая микробиология – М:Медицина,2009г. 3.. Егоров Н.С. Основы учения об антибиотиках. – М.: Высшая школа,2009г. 4.Лабниская А.С. Общая и санитарная микробиология с техникой микробиологических исследований – М.:Медицина,2008г. 5.Лобзин, Ю. В. Практика лабораторных исследований при инфекционных заболеваниях - СПб. : Элби-СПб, 2011г. 6. Поздеев. О. К. Медицинская микробиология - М. : ГЭОТАР-Мед,2010г. 7. Стейниер Р., Эдельберг Э., Ингрэм Дж. Мир микробов – М.2012г.
Приложения последее
ПРИЛОЖЕНИЕ. Приложение 1 Схема определения чувствительности микроорганизмов к антибиотикам диско-диффузионным методом с использованием диспенсера 1.Приготовление бактериальной суспензии исследуемой культуры.
2.Посев подготовленной суспензии сплошным газоном
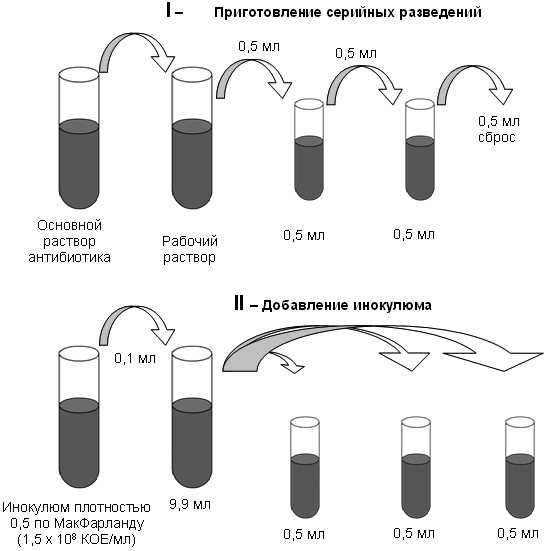
cyberpedia.su Метод серийных разведений в бульонеГлавная / Отдел / Методические рекомендации и обзоры / Методические указания по определению чувствительности микроорганизмов к антибактериальным препаратам / Метод серийных разведений в бульонеРазличают два основных варианта метода серийных разведений в бульоне: макрометод (пробирочный) и микрометод (при величине конечного объема 0,2 мл и меньше). Область применения макрометода из-за низкой производительности ограничивается случаями необходимости оценки чувствительности единичных штаммов. МакрометодПроцедураТестирование проводится в объеме 1 мл каждого разведения АБП с конечной концентрацией исследуемого микроорганизма примерно 5 x 105 КОЕ/мл. Питательная средаПитательный бульон для определения чувствительности разливают по 0,5 мл в каждую пробирку. Количество пробирок определяется необходимым диапазоном разведений АБП и увеличивается на одну для постановки "отрицательного" контроля. Приготовление серийных разведений АБП (рис. 1)Рабочий раствор АБП готовят из основного раствора с использованием жидкой питательной среды. Концентрацию рабочего раствора рассчитывают исходя из необходимой максимальной концентрации в ряду серийных разведений, учитывая фактор разбавления препарата при последующей инокуляции. Затем рабочий раствор в количестве 0,5 мл при помощи микропипетки со стерильным наконечником вносят в первую пробирку, содержащую 0,5 мл бульона. Тщательно перемешивают и новым стерильным наконечником переносят 0,5 мл раствора АБП в бульоне во вторую пробирку, содержавшую первоначально 0,5 мл бульона. Эту процедуру повторяют, пока не будет приготовлен весь необходимый ряд разведений. Из последней пробирки 0,5 мл бульона удаляют. Таким образом, получается ряд пробирок с растворами АБПов, концентрации которых отличаются в соседних пробирках в 2 раза. Одновременно готовятся дополнительные ряды серийных разведений АБП для тестирования контрольных штаммов. Серия разведений обязательно должна включать в себя пограничные концентрации и допустимые диапазоны МПК для контрольных штаммов. Приготовление инокулюма и инокуляцияДля инокуляции используют стандартную микробную взвесь, эквивалентную 0,5 по стандарту МакФарланда, разведенную в 100 раз на питательном бульоне, после чего концентрация микроорганизма в ней составит примерно 106 КОЕ/мл. По 0,5 мл инокулюма вносят в каждую пробирку, содержащую по 0,5 мл соответствующего разведения АБП, и в одну пробирку с 0,5 мл питательного бульона без антибиотика ("отрицательный" контроль). Конечная концентрация микроорганизма в каждой пробирке достигнет необходимой - примерно 5 x 105 КОЕ/мл. Инокулюм должен быть внесен в пробирки с разведениями АБП не позднее 15 - 30 мин. с момента приготовления. ИнкубацияПробирки закрывают стерильными ватно-марлевыми пробками или металлическими колпачками, и все пробирки с тестируемыми штаммами, кроме пробирки "отрицательный" контроль, инкубируются в обычной атмосфере при температуре 35 °С в течение 16 - 20 или 20 - 24 ч (в зависимости от вида тестируемого микроорганизма). Пробирка "отрицательный" контроль помещается в холодильник при + 4 °С, где хранится до учета результатов. Учет результатовДля определения наличия роста микроорганизма пробирки с посевами просматриваются в проходящем свете. Рост культуры в присутствии АБП сравнивается с референтной пробиркой ("отрицательный" контроль), содержащей исходный инокулюм и хранившейся в холодильнике. МПК определяется по наименьшей концентрации АБП, которая подавляет видимый рост микроорганизма.
Рисунок 1. Алгоритм определения чувствительности одной исследуемой культуры к одному АБП методом разведений в жидкой питательной среде. МикрометодПреимуществами микрометода является высокая производительность и возможность длительного хранения заранее приготовленных планшетов. Тестирование проводится при величине конечного объема 0,2 мл и меньше, что позволяет значительно сократить количество расходных материалов. Методика не имеет отличий от макрометода, за исключением используемых объемов питательного бульона с разведениями антибиотиков и инокулюма, но требует дополнительного оснащения лаборатории многоканальными пипетками, 96-луночными планшетами для иммунологических исследований (с плоским дном) со стерильными крышками. Первым этапом является изготовление планшетов, пригодных для хранения. После внесения рабочих растворов антибиотиков в лунки, запаянные в полиэтилен планшеты могут храниться при температуре ниже - 60 °С до момента использования. Повторное замораживание-оттаивание не допускается. Для проведения исследования планшеты после извлечения из холодильника выдерживают до достижения ими комнатной температуры, после чего проводят инокуляцию приготовленной суспензией исследуемого микроорганизма. При проведении инкубации планшет обязательно должен быть закрыт крышкой для предотвращения высыхания содержимого лунок. Учет результатов проводят визуально или спектрофотометрически, сравнивая рост микроорганизма в присутствии АБП с ростом культуры в ячейке без АБП. За МПК принимают минимальную концентрацию, обеспечивающую полное подавление видимого роста исследуемого штамма. Метод серийных микроразведений в бульоне легко поддается модификациям для разработки коммерческих тест-систем. При использовании коммерческих тест-систем следует пользоваться инструкциями изготовителей. Контроль качестваПри постановке методов серийных разведений в бульоне необходимо проводить контроль роста культуры в среде без АБП. Необходимо также контролировать чистоту суспензии микроорганизма, использованной для инокуляции, путем высева на неселективные среды. Каждая партия тестируемых штаммов сопровождается внутренним контролем качества исследования с использованием соответствующих контрольных (референтных) штаммов. Назад www.dntpasteur.ru |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
г.Самара, ул. Димитрова 131 [email protected] |
 |