|
|
||||||||||
|
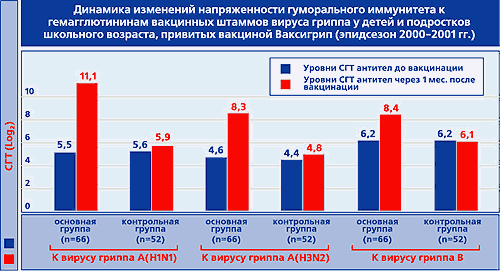
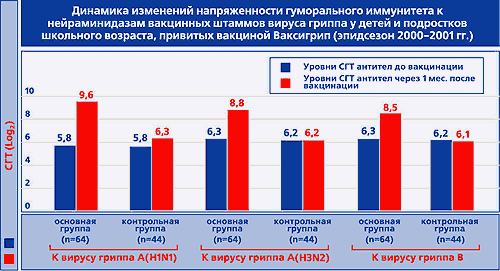
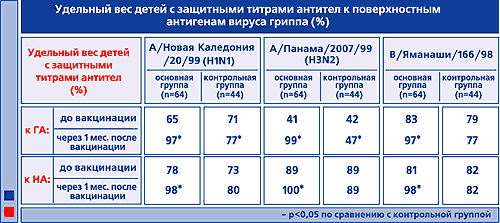
Применение вакцины Ваксигрип у детей с патологией. Ваксигрип вакцинаПрименение вакцины Ваксигрип у детей с патологиейЕ.И. Бурцева, О.В. Шамшева, А.Н. Слепушкин, И.Н. Новикова, В.Ф. Учайкин. Применение вакцины "Ваксигрип" у детей с патологией НИИ вирусологии им. Д.И. Ивановского РАМН, РГМУ, ООО "Диавакс" (Диагностика и вакцины), Москва В России одним из основных специфических средств в борьбе с гриппозной инфекцией является вакцинопрофилактика с использованием живых и инактивированных вакцин [1]. Гриппозные вакцины эффективны не только в плане снижения уровня заболеваемости, но и также в предупреждении развития постгриппозных осложнений и обострений хронических форм сопутствующих заболеваний со стороны сердечно-сосудистой и легочной систем [3,5]. В последние годы в России прошла регистрацию и широко используется гриппозная сплит-вакцина "Ваксигрип", производства фирмы "Пастер Мерье Коннот", Франция. Технология производства вакцины, включающая высокую степень очистки, в отличие от ряда других зарегистрированных в России вакцин, позволяет применять ее начиная с 6-месячного возраста [2]. Результаты предыдущего исследования по изучению специфической активности и защитного эффекта вакцины "Ваксигрип" у детей с соматической патологией в сезоне 1997-98 гг.. сообщались ранее [2,4]. Опыт показал, что двукратное введение вакцины в дозе 0.25 мл создавало защиту от всех трех вакцинных штаммов – A(h2N1), A(h4N2) и В, составив по числу сероконверсий – 78,0%, 71,0% и 81,0% соответственно, а по защищенности – 80,0%, 78,0% и 98,0% при кратности приростов средних геометрических титров антител 7,3, 7,2 и 8,4 соответственно. Кроме того, вакцинация значительно снижала частоту другой инфекционной патологии и обострений хронических заболеваний. Цель настоящего исследования заключалась в оценке прививочных свойств и профилактического эффекта двукратной вакцинации "Ваксигрип" у детей в дозе 0.5 мл. Вакцину "Ваксигрип" изучали в сезоне 1998-99 гг.. в детских домах г.Москвы у детей с поражением ЦНС и нарушениями психического развития в возрасте от 3 лет и старше. Под наблюдением находилось 73 ребенка, привитых вакциной, и 72 контрольной группы. Среди основных диагнозов: задержка психического развития (34 и 51 соответственно), олигофрения (36 и 16 соответственно) и ДЦП (1 и 2 соответственно). С сопутствующими заболеваниями наибольшую группу составили дети, в анамнезе которых был атопический дерматит (15 и 13 соответственно), функциональные изменения со стороны сердечно-сосудистой системы (4 и 5 соответственно), инфекция мочевыводящих путей (7 и 2 соответственно), а также хронические заболевания почек, ЖКТ, легких и др. Практически здоровыми были признаны 2 ребенка в группе привитых и 3 – в контрольной группе. "Ваксигрип" – очищенная инактивированная расщепленная вакцина производства фирмы Пастер Мерье Коннот (Франция) в одной прививочной дозе (0,5 мл) содержит по 15 мкг гемагглютининов вирусов гриппа А/Пекин/262/95 (h2N1), А/Сидней/5/97 (h4N2) и В/Харбин/7/94, рекомендованных ВОЗ для включения в состав гриппозных вакцин в сезоне 1998-99 гг. Вакцину вводили по 0,5 мл внутримышечно двукратно с интервалом 4 недели. Реактогенность вакцины оценивали путем учета общих и местных реакций в течение 4 дней после введения препарата. Об общей реакции судили по повышению температуры тела и изменению общего самочувствия. Среди местных реакций учитывали размеры гиперемии, припухлости и болезненность в месте введения вакцины, а также состояние регионарных лимфоузлов. Иммуногенную активность вакцины оценивали при титровании парных сывороток, взятых до и после вакцинации, в реакции торможения гемагглютинации (РТГА) микрометодом по общепринятой методике. В реакции были использованы антигены из штаммов вирусов гриппа, аналогичные, входящим в состав вакцины – А/Пекин/262/95 (h2N1), А/Сидней/5/97 (h4N2), В/Пекин/184/93. Реакцию ставили с 0,75% взвесью эритроцитов 0(I) группы крови человека. Оценку антигенной активности вакцины проводили по приросту титров антител (в 4 раза и более), динамике уровня средних геометрических титров антител (СГТ), а также уровню иммунологической защиты путем определения удельного веса лиц с титрами специфических антител 1:40 и выше до и после вакцинации. Профилактический эффект вакцинации оценивали путем учета заболеваний, вызванных группой респираторных вирусов, а также обострений хронически протекающих заболеваний в течение 3 месяцев после окончания вакцинации (с 20.12.98-20.03.99). Обработку полученных результатов проводили с использованием методов вариационной статистики. Достоверность различий полученных показателей подтверждали определением критерия Стъюдента (t), считая достоверно значимыми различия при to3 (1). В период наблюдения за переносимостью вакцины после первой вакцинации в группе привитых были зарегистрированы 3 случая жалоб на болезненность в месте инъекции (4,0%) и 1 температурная реакция средней степени выраженности (1,8%). При повторном введении вакцины через 4 недели было отмечено нарушение общего состояния в виде вялости и недомогания у 1 (1,8%) ребенка. При этом отмеченные реакции были непродолжительными и не превышали 1-2 дней. Оценка исходного иммунного ответа к вирусам гриппа А и В до вакцинаций показала, что больше половины обследуемых детей уже имели защитные уровни титров антител (>1:40) к вирусам гриппа А(h4N2) и В (56,0-78,0%). К вирусу гриппа А(h2N1) эти исходные показатели были значительно ниже и составили – 27,0-38,0% (рис. 1). Это связано с различием сроков активизации и начала циркуляции этих штаммов в качестве эпидемических: вирус гриппа А/Сидней/5/97 (h4N2) – с 1997 года, В/Пекин/184/93 – с 1993 года. Вирус гриппа А/Пекин/262/95 (h2N1) в предыдущие годы вызывал эпидемические подъемы заболеваемости только в странах Юго-Восточной Азии, а также спорадические случаи и небольшие вспышки в некоторых странах мира. Таким образом, по своей эпидемической значимости и распространенности он отличался от двух других вирусов. Было выявлено, что двукратная вакцинация стимулировала активную выработку специфических антител таким образом, что число детей с защитными уровнями титров антител к вакцинным вирусам составило 96,0-98,0% при отсутствии такой положительной динамики в контрольной группе, где сравниваемые показатели остались на исходных уровнях (27,0-70,0%). Детальная характеристика антигенных свойств вакцины "Ваксигрип" после двукратного введения представлена в табл. 1. При сравнительной оценке числа сероконверсий в группах серонегативных (1:10 и ниже) и детей с исходно высокими титрами антител 1:20-1:320 не было обнаружено статистически значимых различий между показателями. В целом по группе детей была зарегистрирована сероконверсия в 99,0% к вирусу гриппа А(h2N1), 90,0% к вирусу гриппа А(h4N2) и 92,0% к вирусу гриппа В. По-видимому, второе введение препарата через 4 недели обусловило усиление индивидуальной иммунологической памяти, приведшей к выработке достаточно значимого количества специфических антител. Так, у детей с высокими исходными титрами антител к вакцинным вирусам (1:640-1:1280) прироста не регистрировали, т.к. титрование сывороток в РТГА проводили только до титра 1:1280. В контрольной группе лишь в 2 случаях наблюдали прирост титров к вирусам гриппа А(h2N1) и В, что по-видимому обусловлено перенесенным заболеванием и в целом не влияло на достоверность различий между группами. Анализ динамики уровней СГТ антител и кратности их прироста также подтверждает высокую антигенную активность вакцины "Ваксигрип". В группе привитых отмечали достоверное нарастание титров антител ко всем трем вакцинным штаммам, при наибольшем показателе (32 раза) к новому эпидемическому варианту А(h2N1) и относительно сравнимых к А(h4N2) и В (12 и 8 раз соответственно). В контрольной группе уровни СГТ оставались в период наблюдения практически на исходных уровнях и составили соответственно 11.3-12.1 к вирусу гриппа A(h2N1), 39-34 к вирусу гриппа А(h4N2) и 56-56 к вирусу гриппа В. В целом из 69 привитых детей, обследованных серологически, только в одном случае не было зарегистрировано иммунологических сдвигов (1,4%), в то время как у 54 детей наблюдалось наличие специфических антител ко всем трем вакцинным вирусам (78,3%) и у 14 – к двум из вакцинных штаммов ( 20,3%). Результаты учета заболеваемости детей в течении 3-х месяцев после окончания вакцинации представлены в табл. 2. В группе привитых за весь период было зарегистрировано 6 случаев заболевания (8,2%) с гриппоподобными симптомами (ринит, бронхит, конъюнктивит и др.), в то время как в контрольной группе грипп и ОРВИ перенесли 28 (38,8%) детей. Таким образом, индекс профилактического эффекта (ИЭ) вакцинации был достаточно высоким и составил 4,7, а коэффициент эффективности (КЭ) – 79%. Разница показателей статистически достоверна. Необходимо отметить, что антигенная структура вакцинных штаммов "Ваксигрип" был аналогична циркулирующим эпидемическим вирусам гриппа, два из которых были наиболее активны в сезоне 1998-99 г – А/Сидней/5/97 (h4N2) и В/Пекин/184/93. Таким образом, результатом двукратной вакцинации явилось формирование коллектива с практически 100% иммунной прослойкой. Удельный вес лиц с защитными уровнями титров антител (1:40 и выше) среди привитых составил 96.0-98.0%. Сравнительная оценка прививочных свойств вакцины "Ваксигрип" у детей от 3 лет и старше при введении разной антигенной нагрузки (двукратно по 0.25 мл и двукратно по 0.5 мл) показала более высокую иммуногенную активность 2-ой схемы по числу сероконверсий, кратности прироста титров антител при отсутствии развития дополнительных побочных реакций. ЛИТЕРАТУРА medi.ru Ваксигрип (Vaxigrip) инструкция по применению, описание препарата.Наименование: Ваксигрип (Vaxigrip) НаименованиеВаксигрип (Vaxigrip) Фармакологическое действиеВаксигрип – это вакцина для предупреждения гриппа (инактивированная). Ее использование способствует формированию высокого специфического иммунитета против вируса гриппа. Препарат характеризуется высокой степенью эффективности – 75–92% (у данного числа вакцинированных пациентов определяются защитные титры антител к вирусам гриппа независимо от возрастной категории). Показания к применениюВаксигрип используется с целью предупреждения гриппа у лиц разных возрастных категорий (старше 6 месяцев). Перечисленные ниже нарушения здоровья и другие состояния не являются противопоказанием для введения лекарства:
Способ примененияПрепарат предназначен для внутримышечного/подкожного инъекционного введения. Место введения – дельтовидная мышца либо верхняя треть наружной поверхности плеча (при глубоком подкожном введении). Пациентам младшей педиатрической группы препарат вводится в переднелатеральную поверхность бедра. Схема дозирования и применения Ваксигрипа в зависимости от возрастной категории пациента:
Побочные действияПосле введения вакцины Ваксигрип могут наблюдаться следующие побочные реакции:
ПротивопоказанияВакцинация с использованием Ваксигрипа противопоказана, если у пациента наблюдаются:
БеременностьПроведенные исследования лекарства на животных указали на отсутствие токсического и тератогенного действия на эмбриональное развитие плода. Подтверждена безопасность вакцинации беременных женщин, находящихся во II–III триместрах. Способность проведения вакцинации женщин в I триместре беременности устанавливается лечащим врачом-гинекологом в индивидуальном порядке, учитывая степень риска инфицирования, возможные осложнения при перенесении гриппа, а также токсичность противогриппозных лекарственных средств. Разрешена вакцинация женщинам, находящимся в лактационном периоде. Лекарственное взаимодействиеРазрешено совместное применение Ваксигрипа и других инактивированных вакцин при отсутствии противопоказаний к введению последних. Препараты вводятся в разнообразные участки тела, не разрешается их соединение в одном шприце. Надлежит учитывать способность снижения эффективности лекарства Ваксигрип при одновременном введении глюкокортикостероидов и ЛС, снижающих иммунные процессы в организме. ПередозировкаОтсутствуют сообщения о случаях передозировки вакцины. Это обусловлено тем, что дозирование вакцины происходит строго сотрудником медицинского учреждения, ответственным за проведение инъекции. Форма выпускаВакцина выпускается в форме суспензии для в/м и п/к введения в заранее заполненных шприцах с иглой по 0,5 мл (1 дозировка). 1 шприц в контурно-ячейковой упаковке – картонная пачка. Условия храненияХранить Ваксигрип недопустимо более 3-х лет, и по истечению этого периода остатки партии надлежит утилизировать. Транспортировать и хранить вакцину Ваксигрип нужно строго при t от 2°С до 8°С. Также надлежит не допускать замораживания данного ЛП (в противном случае применение вакцины недопустимо). Состав0,5 мл лекарства содержит: гемагглютинин и нейраминидаза вирусных штаммов: А(h4 N2) – 15 мкг ГА, А(h2 N1) – 15 мкг ГА, B – 15 мкг ГА. Фармакологическая группаНозологическая классификация (МКБ-10)Необходимость иммунизации против гриппа (Z25.1) Действующее веществогемагглютинин и нейраминидаза вирусных штаммов АТХJ07BB02 ПроизводительСанофи Пастер Дополнительная информация о производителеСтрана-производитель – Франция. Информация о регистрацииУдостоверение о госрегистрации №: П N014493/01 от 26.05.08 г. Документ не имеет временных ограничений. ДополнительноВакцина не предназначена для в/в введения. Зачастую Ваксигрип вводится в осенне-зимний период, а также при зафиксированной эпидемической заболеваемости гриппом. Если у пациента наблюдается ОРВИ (острые патологии ЖКТ и др.) в легкой форме, то вакцинация допустима при правильной температуре тела. Перед введением лекарства обязательно пациенту должен быть проведен осмотр врача с измерением температуры тела. Гипертермия считается противопоказанием к вакцинации. Медучреждения, в которых проводится вакцинация, должны иметь в наличии ЛС, используемые в противошоковой терапии (эпинефрин, ГКС и др.). Надлежит учитывать способность искажения результатов серологических тестов при иммуноферментном анализе, проведенных на фоне применения вакцины. Такие изменения возможны из-за выработки IgM. Разрешается содержание в препарате следов гентамицина. После инъекции Ваксигрипа (не менее 30 минут) клиническое состояние пациента должно контролироваться медицинским работником. Обязательным условием введения лекарства считается соблюдение асептических условий, которые проводятся согласно соответствующему протоколу. Руки медперсонала должны быть в медицинских перчатках и обработаны антисептиком. Кожа в месте инъекции должна быть обработана спиртом этиловым с концентрацией 70%. Оставшийся в шприце препарат не подлежит дальнейшему использованию и должен быть утилизирован. Перед применением вакцины должен быть проведен контроль целостности упаковки, правильности маркировки, срока годности и установлено отсутствие нарушений физико-химических свойств вакцины (изменение цвета и прозрачности раствора). Нарушение требований к хранению и транспортировке лекарства считается противопоказанием к его использованию. Не установлено способности лекарства оказывать негативное воздействие на скорость психомоторных реакций, а также внимательность пациента. medprep.info Эффективность вакцины Ваксигрип у детей школьного возрастаЭффективность вакцины Ваксигрип у детей школьного возраста А.Л. Заплатников1, Н.А. Коровина1, Е.И. Бурцева2, Л.Н. Власова2, В.Т. Иванова2, В.И. Далечин1, Г.А. Мингалимова1, А.Н. Слепушкин21 - Российская медицинская академия последипломного образования МЗ РФ, г. Москва.2 - НИИ вирусологии им. Д.И. Ивановского РАМН, г. Москва. Грипп, нанося огромный ущерб как здоровью населения, так и экономике страны в целом, продолжает оставаться одной из актуальных медицинских и социально-экономических проблем отечественного здравоохранения [9]. При этом доказано, что в настоящее время имеется действенный способ профилактики гриппа - активная специфическая иммунизация [3, 15]. Создание эффективных и безопасных гриппозных вакцин стало возможным после фундаментальных исследований по изучению эпидемиологии заболевания, расшифровки морфологического и антигенного строения вируса гриппа, а также определения биологической роли различных структур возбудителя. Так было установлено, что рецепторсвязывающая активность вируса гриппа обеспечивается специализированной гликопротеидной субъединицей оболочки - гемагглютинином (ГА) [13]. Предполагается, что другой суперкапсидный гликопротеид вируса гриппа, нейраминидаза (НA), способствует повышению его вирулентности, а также принимает участие в высвобождении дочерних вирионов из инфицированной клетки [16]. ГА и НA содержат штаммоспецифические антигенные детерминанты вирусов гриппа и инициируют формирование специфической иммунной защиты организма в ответ на гриппозную инфекцию [10]. При этом гуморальная иммунная защита в основном обусловлена синтезом специфических антител к ГА и НА. Антитела к гемагглютинину (анти-ГА), препятствуя прикреплению вируса к мембранным рецепторам клеток-мишеней и нейтрализуя вирусную инвазивность, способствуют повышению специфической резистентности организма к возбудителю гриппа [10]. В свою очередь антитела к нейраминидазе (анти-НА) нарушают процессы репликации вируса, что играет существенную роль в снижении тяжести гриппозной инфекции и предотвращении развития постгриппозных осложнений [6, 10]. Развитие эффективного противогриппозного гуморального иммунитета у привитых людей, так же как и у пациентов при естественной инфекции, связано с адекватной продукцией специфических анти-ГА и анти-НА [10]. Среди широкого круга зарегистрированных и разрешенных к применению в РФ гриппозных вакцин инактивированная гриппозная сплит вакцина Ваксигрип ("Авентис Пастер", Франция) показала высокую эффективность и хорошую переносимость как у взрослых, так и у детей [1, 5, 7, 8]. В многочисленных работах подробно изучены процессы формирования поствакцинального иммунитета к гемагглютининам, входящим в состав вакцины Ваксигрип [1, 7, 8, 12, 14 и др.]. В то же время особенности развития гуморального иммунитета к нейраминидазам при иммунизации Ваксигрипом, несмотря на очевидную важность данного компонента в формировании эффективной поствакцинальной защиты, исследованы в значительно меньшей степени. Поэтому целью настоящей работы являлось комплексное изучение реактогенности, иммуногенности и клинико-эпидемиологической эффективности гриппозной вакцины Ваксигрип, а также особенностей формирования специфического поствакцинального иммунитета к обоим поверхностным антигенам вируса гриппа - гемагглютинину и нейраминидазе. В условиях массовой противогриппозной активной иммунопрофилактики гриппа у школьников (Сергиево-Посадский р-н Московской обл., эпидсезон 2000-2001 гг.) было проведено открытое рандомизированное контролируемое исследование по изучению переносимости, иммуногенности и профилактической эффективности гриппозной инактивированной сплитвакцины Ваксигрип. Осенью 2000 г. после предварительного уточнения клинико-анамнестических данных и в соответствии с рекомендациями Хельсинской декларации по соблюдению этических норм и прав пациентов был проведен отбор 183 школьников в возрасте 7-16 лет, ранее (в 1997 г.) иммунизированных вакциной Ваксигрип. У всех исследуемых изучали напряженность поствакцинального иммунитета к антигенам вирусов гриппа А/Йоганнесбург/82/96(h2N1), А/Нанчанг/933/95(h4N2), В/Пекин/184/93, входивших в состав гриппозных вакцин в эпидемическом сезоне 1997-1998 гг. Методом случайной рандомизации из 183 школьников были отобраны 135 человек и распределены на 2 группы. Из них 70 детей в предэпидемический период гриппа сезона 2000-2001 гг. были привиты вакциной Ваксигрип (основная группа), а 65 детей в эпидсезон 2000-2001 гг. не были иммунизированы и составили контрольную группу. Группы были сопоставимы по возрасту, полу и состоянию здоровья детей. С начала декабря 2000 г. и до конца апреля 2001 г. за детьми, включенными в исследование, проводился клинический, серологический и вирусологический мониторинг. Закончили исследование 127 детей (67 - в основной и 60 - в контрольной группе). Клиническая часть исследования включала динамический контроль за состоянием здоровья детей и, в случае необходимости, оказание им медицинской помощи. Особое внимание уделяли изучению переносимости детьми вакцины Ваксигрип. Реактогенность вакцины оценивалась на основании результатов активного динамического наблюдения за привитыми в течение 5 дней после иммунизации. При этом учитывались как местные (болезненность, гиперемия и инфильтрация в месте инъекции), так и общие реакции (повышение температуры тела, недомогание, головная боль, слабость, ощущение "разбитости", миалгия, артралгия и др.). Установлено, что только у 1 (1,5%) ребенка иммунизация Ваксигрипом сопровождалась нетяжелой общей реакцией в виде субфебрильной температуры, недомогания, головной боли. Симптомы сохранялись в течение 2-х дней с последующим самостоятельным купированием без применения жаропонижающих и анальгетиков. У остальных детей, привитых Ваксигрипом, поствакцинальный период протекал гладко и не требовал обращения за медицинской помощью. Активное наблюдение за вакцинированными в течение 5 дней после прививки позволило у 12,5% детей выявить местные реакции в виде легкой, локализованной в месте инъекции гиперемии, без инфильтрации и других признаков воспаления, не сопровождавшиеся жалобами и не требовавшие терапии. Характер изменений специфического противогриппозного иммунитета в результате вакцинации определяли на основании динамического выявления антител к ГА и НА. Антигемагглютинины (анти-ГА) сыворотки крови определяли при помощи реакции торможения гемагглютинирующей активности (РТГА) с использованием 0,75% взвеси эритроцитов человека 0 (1) группы крови, а антинейраминидазные антитела (анти-НА) - в лектин-тесте с 3% взвесью эритроцитов морской свинки. Постановку РТГА и лектин-теста проводили стандартными методами с использованием вирусов гриппа, подобным вакцинным штаммам эпидемического сезона 2000-2001 (А/Новая Каледония/20/ 99(h2N1), А/Панама/2007/99 (h4N2), В/Яманаши/166/98) [2, 4]. Для анализа иммуногенности вакцины Ваксигрип перед вакцинацией и через 4 недели после нее у детей были взяты пробы капиллярной крови. Иммуногенность вакцины Ваксигрип определяли на основании числа диагностических приростов титров специфических антител к гемагглютинину и нейраминидазе в 4 и более раз, а также по динамике величин средних геометрических титров антител (СГТ) в парных сыворотках и проценту детей, у которых после вакцинации регистрировали защитный титр специфических противогриппозных антител (1:40 и выше). Уровень инфицированности исследуемого контингента эпидемическими штаммами вирусов гриппа определяли титрованием парных сывороток в РТГА с антигенами вирусов гриппа А и В, имевших эпидемическую активность в период наблюдения. Первичный забор крови осуществляли перед началом эпидемического подъема заболеваемости гриппом (конец декабря 2000 г.), последующий - после завершения эпидсезона (конец апреля 2001 г.). Достоверным признаком перенесенной инфекции считали нарастание титров антител в парных сыворотках не менее чем в 4 раза. Дополнительно у заболевших детей с клиническим диагнозом "грипп" для уточнения этиологии проводили вирусологическое исследование носоглоточных смывов, отобранных в первые 3 дня заболевания с последующим заражением культуры клеток МDСК по методике описанной ранее [12]. Для оценки профилактической эффективности вакцины Ваксигрип использовали сравнительный анализ заболеваемости гриппом в исследуемых группах с определением индекса эпидемиологической эффективности. Полученные результаты обрабатывали с помощью методов вариационной статистики с определением критерия достоверности Стьюдента t. Установлено, что среди детей и подростков, привитых Ваксигрипом в 1997 г., через 3 года после иммунизации специфические антитела в защитных титрах сохранялись к вирусу гриппа А/Йоганнесбург/82/96(h2N1) - у 58,7%, к вирусу гриппа А/Нанчанг/933/95(h4N2) - у 88,3% и к вирусу гриппа В/Пекин/184/93 - у 33,3% иссле-дуемых. При этом наиболее высокие СГТ антител (6,8 log2) регистрировали к вирусу гриппа А(h4N2), который имел большую эпидемическую активность в предыдущие эпидемические сезоны. Значительное количество детей (58,7%) с защитным уровнем антител и высокие СГТ антител (5,7 log2) к вирусу гриппа А(h2N1), не имевшего существенного этиологического и эпидемического значения с 1994-1995 гг., вероятно, было обусловлено сохранявшимся поствакцинальным иммунитетом за счет высокого качества прививочных свойств вакцины Ваксигрип. Применение вакцины Ваксигрип в сезоне 2000-2001 приводило к выработке специфических антител к гемагглютининам вакцинных штаммов вируса гриппа в защитных титрах у 97,0-99,0% иммунизированных детей и подростков (табл.1). При этом коэффициент поствакцинального прироста среднегеометрических титров антител к антигенам гемагглютинина вируса гриппа А (h2N1) составил 2 (p У 98-100% привитых школьников вакцинация Ваксигрипом обеспечивала также развитие защитного уровня напряженности гуморального иммунитета к нейраминидазам вакцинных штаммов вируса гриппа (табл.1). Коэффициент прироста СГТ специфических антител к антигенам нейраминидазы вируса гриппа А (h2N1) составил 1,7 (p Иммунизация вакциной Ваксигрип сопровождалась сероконверсией одновременно к ГА и НА вируса гриппа А(h2N1) - у 95,2%, вируса гриппа А (h4N2) - у 85,7% и вируса гриппа В - у 85,7% привитых школьников (pВаксигрип, отмечали одновременную сероконверсию к ГА и НА всех трех вакцинных штаммов вируса гриппа (p Таким образом, представленные результаты свидетельствуют о высокой иммуногенной активности гемагглютининов и нейраминидаз инактивированных вирусов гриппа, входивших в состав вакцины Ваксигрип эпидсезона 2000-2001 гг. Применение Ваксигрипа сопровождалось полноценным формированием защитных уровней антител к обоим поверхностным антигенам всех вакцинных штаммов вируса гриппа у подавляющего большинства привитых и определило развитие у них высокоэффективного противогриппозного поствакцинального иммунитета. Благодаря этому среди школьников, иммунизированных Ваксигрипом, только 8 (11,9%) были инфицированы вирусами гриппа, в то время как в контрольной группе инфицирование вирусом гриппа встречалось достоверно чаще - у 16 детей и подростков (26,7%) (pВаксигрипом только у 2 из 8 инфицированных школьников заболевание сопровождалось клиническими проявлениями в виде нетяжелого катара дыхательных путей, а у остальных детей грипп протекал бессимптомно и выявлялся лишь на основании ретроспективного иммунологического обследования. Среди школьников, иммунизированных вакциной Ваксигрип, в отличие от детей и подростков контрольной группы, не было ни одного случая заболевания гриппом с тяжелым или осложненным течением (pПри вирусологической и серологической расшифровке этиологии гриппа установлено, что как у привитых, так и в контрольной группе заболевание достоверно чаще вызывал вирус гриппа В. Так, в основной группе из 8 случаев инфицирования детей вирусами гриппа, 7 были обусловлены вирусом гриппа В. В этиологической структуре гриппа у школьников контрольной группы также преобладал вирус гриппа В - в 11 случаях из 16. В 1 случае заболевание вызывалось микст-инфекцией (вирус гриппа A(h2N1) + вирус гриппа В). В целом индекс эпидемиологической эффективности вакцинации Ваксигрипом составил 2,2 (pВаксигрип при ее использовании в педиатрической практике. Таким образом, хорошая переносимость, низкая реактогенность, высокая иммуногенность и эпидемиологическая эффективность изучаемого препарата позволяют рекомендовать инактивированную гриппозную сплит вакцину Ваксигрип для применения у детей и подростков при проведении плановой активной иммунизации против гриппа. medi.ru |
г.Самара, ул. Димитрова 131 [email protected] |
 |