|
|
||||||||||
|
Акт-ХИБ. Акт хиб вакцинаАкт-Хиб – инструкция по применению, показания, дозы, аналоги
Форма выпуска и составПрепарат выпускается в форме лиофилизата для приготовления раствора для подкожного и внутримышечного введения. Одна доза содержит 10 мкг столбнячного анатоксина. В качестве растворителя используется четырехпроцентный раствор натрия хлорида. Показания к применению Акт-ХибаПрепарат Акт-Хиб применяется для профилактики гнойно-септических заболеваний (ХИБ-инфекций): менингита, артритов, сепсиса, пневмонии, эпиглоттитов. Допустимо применять Акт-Хиб у детей с трехмесячного возраста. ПротивопоказанияВ инструкции к Акт-Хибу указаны следующие противопоказания:
Прививки проводятся через 2-4 недели после выздоровления. В случае нетяжелой формы кишечной или респираторной инфекции вакцинацию допустимо проводить сразу после того, как температура тела придет в норму. Способ применения и дозировка Акт-ХибаВакцина вводится глубоко подкожно или внутримышечно. Разовая доза препарата – 0,5 мл. Перед введением вакцины следует убедиться, что игла задела кровеносный сосуд. Детям старше 2-х лет вакцину вводят в область дельтовидной мышцы, а детям младше 2-х лет – в среднюю треть переднелатеральной области бедра. Длительность курса вакцинации зависит от возраста ребенка. Если вакцинация начинается в возрасте от 1 года до 5 лет, достаточно однократной инъекции. При начале вакцинации в возрасте от полугода до года: 2 инъекции с интервалом 1 месяц. Ревакцинация проводится однократно в возрасте 18 месяцев. Применение Акт-Хиба у детей в возрасте до полугода подразумевает 3 инъекции с интервалом в 1-2 месяца. Ревакцинация проводится однократно через год после третьей инъекции. Побочные действия Акт-ХибаСогласно инструкции к Акт-Хибу, возможны следующие побочные эффекты от применения препарата:
Особые указанияПрепарат не формирует иммунитет против менингитов иной экологии и инфекций, вызываемых другими серотипами Haemophilus influenzae. Столбнячный белок, входящий в состав Акт-Хиба, не может заменить вакцинацию против столбняка. У детей младше 4 месяцев отмечались единичные случаи периферического отека нижних конечностей после инъекции вакцины с ХИБ-компонентом. Более 50% случаев возникали в течение шести часов. Подобные реакции развивались при введении комбинированных вакцин (против столбняка, коклюша, дифтерии). Отек распространялся на обе нижние конечности или только на одну, в первом случае отек преобладал на той конечности, куда была введена вакцина. Данная реакция может сопровождаться повышением температуры тела, болезненностью, пронзительным плачем, сыпью, изменением цвета кожи. Такие случаи проходили без остаточных явлений, в течение суток после инъекции, и не приводили к неблагоприятным явлениям со стороны дыхательной системы и сердца. Аналоги Акт-ХибаАналогом препарата Акт-Хиб является Хиберикс, также выпускаемый в виде порошка для приготовления раствора для подкожного и внутримышечного введения. Сроки и условия храненияПрепарат Акт-Хиб следует хранить при температуре 2-8 °С (в холодильнике), в недоступном для детей месте. Не замораживать. Срок годности составляет 3 года. spravka03.net ХИБ - инструкция по применению препарата, аннотацияПрепарат: Акт-ХИБ (Act-HIB) Активное вещество: haemophilus influenzae conjugate vaccine (tetanus toxoid conjugate)Код АТХ: J07AG51КФГ: Вакцина для профилактики заболеваний, вызванных Haemophilus influenzae типа bКоды МКБ-10 (показания): B96.3Рег. номер: П №013850/01Дата регистрации: 11.12.08Владелец рег. удост.: AVENTIS PASTEUR (Франция)
ЛЕКАРСТВЕННАЯ ФОРМА, СОСТАВ И УПАКОВКА
* - Haemophilus influenzae type b. Растворитель: 4% р-р натрия хлорида - 0.5 мл. Флаконы (1) в комплекте с растворителем (шприц - 1 шт.) - пачки картонные.
ИНСТРУКЦИЯ ПО ПРИМЕНЕНИЮ ДЛЯ СПЕЦИАЛИСТА.Описание препарата утверждено компанией-производителем в 2010 г.
ФАРМАКОЛОГИЧЕСКОЕ ДЕЙСТВИЕ Вакцина для профилактики гнойно-септических заболеваний, вызванных Haemophilus influenzae типа b. ПОКАЗАНИЯ — профилактика гнойно-септических заболеваний (менингит, сепсис, артриты, эпиглоттиты, пневмонии), вызываемых Haemophilus influenzae типа b (ХИБ-инфекции) у детей с трехмесячного возраста. РЕЖИМ ДОЗИРОВАНИЯ Ввести во флакон с вакциной все содержимое шприца с растворителем, взболтать флакон до полного растворения лиофилизата. Образовавшийся раствор должен быть бесцветным и прозрачным. Вакцину вводят внутримышечно или глубоко подкожно в разовой дозе 0.5 мл. Перед введением необходимо убедиться, что игла не попала в кровеносный сосуд. Дети в возрасте до 2-х лет: введение вакцины осуществляют в среднюю треть переднелатеральной области бедра, У детей старше 2-х лет: введение вакцины осуществляют в область дельтовидной мышцы. Курс вакцинации: При начале вакцинации в возрасте до 6 месяцев: 3 инъекции с интервалом в 1-2 месяца. Ревакцинацию проводят однократно через год после 3-ей вакцинации. При начале вакцинации в возрасте от 6 до 12 месяцев: 2 инъекции с интервалом в 1 месяц. Ревакцинацию проводят однократно в возрасте 18 месяцев. При начале вакцинации в возрасте от 1 года до 5 лет: однократная инъекция.
ПОБОЧНОЕ ДЕЙСТВИЕ В ходе клинических исследований отмечались: Обычно (1-10% и более) местные реакции: болезненность, эритема, припухлость и/или воспаление, уплотнение в месте инъекции, раздражительность, рвота. Возможно (не более чем в 10%) повышение температуры тела, длительный плач. Иногда (не более чем в 1 %) повышение температуры тела выше 39 °С. В ходе практического применения на основании данных пассивного фармаконаблюдения очень редко (менее чем в 0,01% случаев применения) отмечались: — периферический отек нижних конечностей (см. раздел "Особые указания") — реакции гиперчувствительности, фебрильные или афебрильные судороги, крапивница, сыпь и зуд.
ПРОТИВОПОКАЗАНИЯ — острые заболевания, — обострение хронических заболеваний — аллергия к ингредиентам вакцины, особенно к столбнячному анатоксину. — аллергическая реакция на предшествующее введение вакцины для профилактики инфекции, вызываемой Haemophilus influenzae типа b (ХИБ-инфекции). Прививки проводят через 2-4 нед после выздоровления (ремиссии). При нетяжелых формах респираторной и кишечной инфекции вакцинацию возможно проводить сразу же после нормализации температуры.
ОСОБЫЕ УКАЗАНИЯ АКТ-ХИБ не формирует иммунитета против инфекции, вызываемой другими серотипами Haemophilus influenzae, а также против менингитов иной этиологии. Содержащийся в вакцине столбнячный белок, не может рассматриваться как замена вакцинации против столбняка. Иммуносупрессивная терапия или иммунодефицитные состояния могут быть причиной слабого иммунного ответа на введение вакцины. Единичные случаи периферического отека нижних конечностей возникали у детей в возрасте младше 4 мес. после 1-й или 2-й инъекции вакцины, содержащей ХИБ-компонент (71% случаев), более половины случаев возникали в течение 6 ч. Такие реакции развивались при введении ХИБ компонента в составе комбинированных вакцин (например, против дифтерии, коклюша и столбняка). Отек распространялся на одну или обе нижних конечности (с преобладанием отека на конечности, куда была введена вакцина). Данные реакции могут сопровождаться болезненностью, необычным или пронзительным плачем, цианозом или изменением цвета кожи, покраснением, петехиями или преходящей пурпурой, повышением температуры тела, сыпью Эти случаи проходили самостоятельно в течение 24 ч. без каких-либо остаточных явлений, они не связаны с какими-либо неблагоприятными явлениями со стороны сердца и дыхательной системы.
ЛЕКАРСТВЕННОЕ ВЗАИМОДЕЙСТВИЕ АКТ-ХИБ может применяться одновременно с другими вакцинами национального календаря прививок и календаря профилактических прививок по эпидемическим показаниям при условии использования разных шприцев и введения в разные части тела. Врач должен быть информирован о недавно проводившемся либо совпадающем по времени с вакцинацией введении ребенку любого другого лекарственного препарата (в том числе - безрецептурного).
УСЛОВИЯ ОТПУСКА ИЗ АПТЕК По рецепту. УСЛОВИЯ И СРОКИ ХРАНЕНИЯ
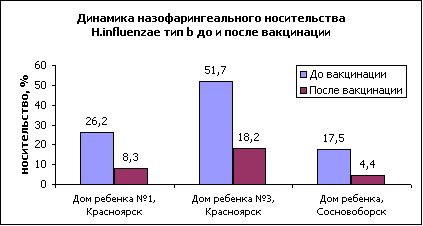
В холодильнике (при температуре от 2 до 8°С). Не замораживать. Хранить в недоступном для детей месте. Срок годности - 3 года. docvita.ru Оценка эффективности вакцины Акт-ХИБ у детей из групп риска | Оценка эффективности вакцины "Акт-ХИБ" у детей из группы риска Л.М. Куртасова2, Л.А. Рузаева1, А.А. Двоеконко1, Г.А. Зарянко1, Н.Н. Опейкина1, В.А. Третьякова1, Н.А. Шакина1, С.В. Ященко11 - Краевой центр по профилактике и борьбе со СПИД, г. Красноярск2 - Красноярская государственная медицинская академия В настоящее время в России обоснованную озабоченность педиатров вызывает проблема гемофильной инфекции [3]. Это связано с ее повсеместным распространением, большим удельным весом тяжелых форм (менингиты, пневмонии, эпиглоттиты), высокой летальностью и многочисленными осложнениями [1,4,5]. По статистическим данным детской инфекционной больницы №1 г. Красноярска на протяжении последних 3-х лет Haemophilus influenzae тип b (ХИБ) является этиологическим фактором в формировании 30,4% гнойных менингитов и 29,8% крупов у детей, госпитализированных для стационарного лечения. При этом следует отметить, что возбудитель поражает в основном детей раннего возраста. Цель настоящего исследования - комплексное изучение реактогенности, клинической и эпидемиологической эффективности вакцины Акт-ХИБ (производство Авентис Пастер, Франция) у детей раннего возраста с поражениями ЦНС. Для реализации поставленной цели были проведены динамические наблюдения за 277 детьми с поражениями ЦНС в возрасте от 3-х месяцев до 4-х лет в специализированных домах ребенка (СДР) закрытого типа в городах: Ачинск, Красноярск, Минусинск, Сосновоборск Красноярского края. Все исследуемые пациенты вакцинировались в период клинической ремиссии. При наличии гипертензионно-гидроцефалического синдрома вакцина вводилась в стадии клинической компенсации. Вакцинацию Акт-ХИБ у 141 ребенка проводили отдельно, у 136 детей - в комбинации с другими вакцинами. В зависимости от сочетания получаемых в один день прививок сформировано 5 групп детей. Для изучения частоты встречаемости ХИБ-носительства было проведено бактериологическое исследование отделяемого из носоглотки у 201 наблюдаемого ребенка в период до вакцинации Акт-ХИБ и через 6 месяцев после иммунизации в 3-х СДР. Отделяемое из носоглотки отбирали с помощью стерильного ватного тампона из нижней носовой раковины обоих носовых ходов, а при необходимости и задней стенки глотки, доставляли в пробирках с "транспортной" средой. Бактериологическое исследование отделяемого из носоглотки проводилось с использованием шоколадного Haemophilus-агара, стрипов API-NH, латекс-теста H. influenzae b; чувствительность к антибактериальным препаратам определялась на стрипах ATB-NH с помощью автоматического анализатора Expression (Bio Merieux, Франция). Идентификация осуществлялась с помощью компьютерной программы APILAB [6]. Для оценки профилактической эффективности вакцины Акт-ХИБ использовали сравнительный анализ заболеваемости (менингит, пневмония, бронхит, отит, синусит, круп) у наблюдаемых детей с определением индекса эпидемиологической эффективности. Полученные результаты обрабатывали с помощью методов вариационной статистики с определением критерия достоверности Стьюдента t. Клиническая часть исследования включала динамический контроль за состоянием здоровья привитых детей. Особое внимание уделяли изучению переносимости детьми вакцины Акт-ХИБ. Реактогенность вакцины оценивалась по результатам активного динамического наблюдения за привитыми в течение 5 дней после вакцинации. При этом учитывались как местные (болезненность, гиперемия и инфильтрация в месте инъекции), так и общие реакции (повышение температуры тела, недомогание, слабость, миалгия и др.). Активное наблюдение за вакцинированными в течение 5 дней после прививки позволило у 9 (3,25%) детей выявить нетяжелые общие реакции, которые сохранялись в течение 1-2-х дней с последующим самостоятельным купированием без применения лекарственных препаратов. У 1 (0,36%) ребенка вакцинация Акт-ХИБ сопровождалась местной реакцией в виде легкой, локализованной в месте инъекции гиперемии, без инфильтрации и других признаков воспаления, не сопровождавшаяся жалобами и не требовавшая терапии. У остальных 267 (96,38%) привитых детей поствакцинальный период протекал гладко и не требовал обращения за медицинской помощью. Из 141 ребенка, привитого вакциной Акт-ХИБ вне сочетания с другими препаратами, у одного (0,71%) отмечалось кратковременное (менее суток) повышение температуры тела до 37,50 и недомогание. Из 136 детей, которые вакцинировались Акт-ХИБ в различных комбинациях с другими прививками, у 8 (5,8%) отмечались общие реакции. У одного ребенка (0,74%) отмечалось недомогание (менее суток) без повышения температуры, у 7 (5,1%) детей зарегистрировано повышение температуры тела до 37,60 в течение 24-36 часов. У двух детей в течение первого дня после вакцинации наблюдали раздражительность, у одного недомогание. При бактериологическом исследовании отделяемого из носоглотки в период до вакцинации было выделено 155 штаммов H. influenzae - от 201 обследованного (77,1%), в том числе типа b гемофильной палочки - 62 штамма. Уровень ХИБ-носительства в наблюдаемых закрытых детских учреждениях составил 30,8%, отдельно по каждому СДР -17,5%, 26,7% и 51,7% (рис. 1).
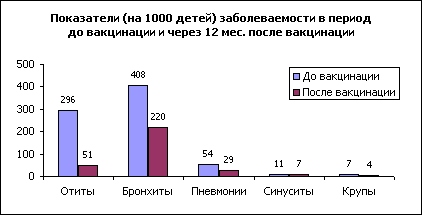
Через 6 месяцев после вакцинации АКТ-ХИБ у наблюдаемых детей было выделено 19 штаммов ХИБ. Уровень носительства составил 9,3%, что в 3,3 раза (р Некоторые биохимические свойства определялись с одинаковым постоянством у всех ХИБ-штаммов. Так, 100% штаммов разлагали глюкозу и образовывали фосфатазу, 100% не разлагали сахарозу, не образовывали липазу, бетагалактозидазу, пролинариламидазу, гаммаглутамилтрансферазу. Вариабельность ряда свойств ХИБ-штаммов свидетельствует о сложности идентификации культур рутинными методами и необходимости использования системы api-NH. На основании биохимических свойств (продукции индола, уреазы и орнитиндекарбоксилазы) H. influenzae дифференцируется на 8 биотипов, определение которых имеет эпидемиологическое значение. Среди изученных нами штаммов встречались все биотипы. Наиболее высокий удельный вес приходится на I-III биотипы. Соответственно, в довакцинальный период - 47,5%, в поствакцинальный период - 63,2%, за счет увеличения в 2,5 раза (р Чувствительность к антибиотикам была изучена к 17 препаратам на стрипах atb-NH. ХИБ-штаммы, выделенные в довакцинальный и поствакцинальный периоды, в 100% случаев чувствительны только к цефотаксиму, гентамицину, рифампицину. В поствакцинальный период увеличился до 100% удельный вес штаммов, чувствительных к следующим антибактериальным препаратам: амоксициллину/клавуланату, цефаклору, цефуроксиму, хлорамфениколу, тетрациклину, пристинамицину, розоксацину; значительно снизился удельный вес штаммов резистентных к амоксициллину (с 54,4% до 16,6%, р В довакцинальный период к эритромицину умеренно устойчивы 52,2% штаммов, все остальные чувствительны, а в поствакцинальный период соответственно 75% (рИ только к одному из 17 изученных препаратов - котримоксазолу выявлено увеличение доли резистентных штаммов с 21,7% до 41,7% (рНи у одного из выделенных штаммов на всем протяжении исследований не выявлена пенициллиназа. Таким образом, установлен высокий уровень ХИБ-носительства (30,8%) в закрытых детских учреждениях, сформированный популяцией полирезистентных к антибактериальным препаратам штаммов. После проведения полного курса вакцинации Акт-ХИБ уровень назофарингиального ХИБ-носительства резко снижается (с 30,8% до 9,3%, рС применением стандартной методики [2] по результатам ежемесячного учета и анализа случаев заболеваемости у наблюдавшихся пациентов была определена профилактическая эффективность вакцины Акт-ХИБ. Общее число случаев заболеваний за год до вакцинации у 277 привитых составило 228 (82%), из них на отиты приходилось 82 (36%) случая, бронхиты - 126 (55%) случаев, пневмонии - 15 (7%) случаев, синуситы - 3 (1%) случая, крупы - 2 (1%) случая (рис.2). Изучение спектра заболеваний через год после вакцинации показало, что общее число инфекционных заболеваний респираторного тракта и ЛОР-органов снизилось в 2,7 раза (с показателя 823,1 на 1000 детей до 310,3, р При сравнении показателей заболеваемости через 1 год у привитых после проведения полного курса вакцинации и в группе непривитых детей индекс эпидемиологической эффективности вакцинации Акт-ХИБ составил 2,2 (pТаким образом, результаты проведенного исследования показали хорошую переносимость, низкую реактогенность и высокую профилактическую эффективность вакцины Акт-ХИБ в группах детей с поражениями ЦНС. Литература:
© Л.М. Куртасова, Л.А. Рузаева, А.А. Двоеконко, Г.А. Зарянко, Н.Н. Опейкина, В.А. Третьякова, Н.А. Шакина, С.В. Ященко, 2003 |
г.Самара, ул. Димитрова 131 [email protected] |
 |

 Акт-Хиб – это вакцина, применяемая для профилактики гнойно-септических заболеваний, вызванных Haemophilus influenzae типа b. Препарат не содержит живых микроорганизмов, благодаря чему заболеть в результате инъекции невозможно.
Акт-Хиб – это вакцина, применяемая для профилактики гнойно-септических заболеваний, вызванных Haemophilus influenzae типа b. Препарат не содержит живых микроорганизмов, благодаря чему заболеть в результате инъекции невозможно.