|
|
||||||||||
|
Анализ на гамма-глобулин (иммуноглобулин). От чего прививка гаммаглобулинГамма-глобулины
10 Просты́е белки́—белки, которые построены из остатковα-аминокислоти при гидролизе распадаются только на аминокислоты. Простые белки по растворимости в воде и солевых растворах условно подразделяются на несколько групп: протамины,гистоны,альбумины,глобулины,проламины,глютелины. Альбумины и глобулины широко распространены в органах и тканях животных. В плазме крови человека в норме содержится 7% белков, представленных преимущественно альбуминами и глобулинами. Альбумины и глобулины – глобулярные белки, различающиеся по растворимости. Необходимо отметить, что само определение «альбумины» и «глобулины» основано на их растворимостивдистиллированной водеи полунасыщенномрастворе(Nh5)2SO4. Однако, как показывают данные табл. 1.6,глобулинырастворимы только в разбавленных солевыхрастворах.
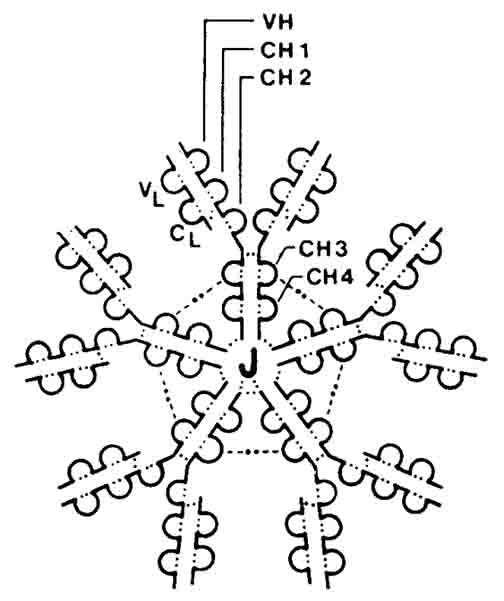
Различную растворимостьальбуминовиглобулиновсыворотки кровираньше широко использовали в клинической практике для их фракционирования и количественного определения. В настоящее время качественный состав и содержание сывороточных белковопределяют с помощьюэлектрофорезанабумагеи в полиакрил-амидномгелев небольшом количествесыворотки крови.Альбуминыиглобулиныотличаются друг от друга также помолекулярной массе– соответственно 40000–70000 и 150000 и более. Глобулины(globulinum; лат. globulus, уменьшительное от globus шар) — общее название белков, растворимых в слабых растворах нейтральных солей, кислот и щелочей, как правило, нерастворимых в дистиллированной воде и выпадающих в осадок при 50% насыщении растворов сульфатом аммония; глобулины составляют около 40% всех белков сыворотки крови человека. Гамма-глобулин - любойбелокБЕЛОК (protein) - органическое соединение, в состав которого входят углерод, водород, кислород и азот (..., присутствующий в плазме крови, который можно идентифицировать по характерной скорости его движения в электрическомполеПОЛЕ - 1) в социологии - изучаемая среда, аудитория, которую опрашивают в ходе полевых исследований (в...Фракция γ-глобулинов является наиболее гетерогенной. Известно множествоантител, различающихся первичной структурой. Электрофоретически они открываются главным образом в γ-глобулиновой и частично в β2-глобулиновой фракциях. К неоднородной группе гамма-глобулинов относятся белки с самой низкой электрофоретической подвижностью. К ним относится большинство защитных веществ крови, многие из которых обладают ферментативной активностью. Так как потребности в белках, выполняющих такие специальные функции, бывают различны, размеры и состав фракции гамма-глобулинов может значительно изменяться. Почти при всехзаболеваниях, особенно воспалительных, содержание гамма-глобулинов в плазме крови повышается. В то же время общее количество белков в плазме обычно остается примерно одинаковым, так как повышение содержания гамма-глобулинов сопровождается уменьшением фракцииальбумина, в результате снижается так называемый альбумин-глобулиновый коэффициент. Почти всегаммаглобулиныГАММАГЛОБУЛИН (gamma globulin) - любой белок, присутствующий в плазме крови, который можно идентифицировать по ...являются иммуноглобулинами Иммуноглобулины. История открытия. Иммуноглобулины представляют собой белки человека (животных), которые обычно обладают свойствами антител, т.е. специфической способностью соединяться сантигеном, который стимулирует их образование. Иммуноглобулины присутствуют в крови, цереброспинальной жидкости, лимфоузлах, селезенке, слюне и других тканях, а так же в видерецепторовна поверхностныхмембранахклеток. Синтезируются они в В-лимфоцитах, содержат углеводные группировки и могут рассматриваться как гликопротеины. По электрофоретической подвижности иммуноглобулины относятся в основном к гамма-глобулинам и бета2-глобулинам. Биологическая роль иммуноглобулинов в организме связана с участием в процессах иммунитета. Их защитная функция обусловлена способностью специфически взаимодействовать с антигенами.До середины 50-х годов прошлого столетия о структурной организации иммуноглобулинов ничего не знали. Первый шаг в этом направлении сделал английский иммунохимик Р.Портер в 1959 г. Он показал, что при обработке очищенных иммуноглобулинов протеолитическими ферментами образуются три фрагмента, два из которых взаимодействуют с антигеном (патогеном) и потому названы антигенсвязывающими (Fab), и один, неспособный к такому взаимодействию (Fc). Но это ничего не говорило о причинах их специфичности по отношению к разным антигенам. Для получения информации о молекулярных основах вариабельности нужно было значительное количество полностью идентичных белков. Сывороточные иммуноглобулины, в массе образующиеся после иммунизации, не давали такой возможности, поскольку они - производные нескольких клеточных клонов, каждый из которых продуцирует белки только одного класса и только одной, свойственной ему, специфичности. Иначе говоря, иммуноглобулины, выделяемые от иммунизированных животных, есть смесь молекул с разной специфичностью и разной принадлежностью к тому или иному классу. Необходима была экспериментальная модель, позволяющая работать с одним клоном, образующим иммуноглобулины только одной специфичности и только одного класса. Природа предоставила такую возможность - злокачественно трансформированные плазматические клетки больных миеломой. В настоящее время существует большой набор клонированных плазмоцитов человека и животных, продуцирующих соответствующие миеломные белки. Строение.(см. пример: строение IgG) Изучение аминокислотной последовательности иммуноглобулинов выявило принципиальные особенности в их строении. Молекулы иммуноглобулинов симметричны. Они построены из "легких" (около 220 аминокислотных остатков, молекулярная масса 25000 для IgG) и "тяжелых" (450-600 аминокислотных остатков, молекулярная масса для IgG- 50000) полипептидных цепей (соотв. L- (light) и Н-цепи (heavy)),скрепленныхдисульфидными связямии нековалентными взаимодействиями. Вантителахчеловека обнаружено два вида легких цепей ( и ) и пять видов тяжелых цепей( и ), отличающихсяаминокислотной последовательностью. Тяжелые цепи, характерные для каждого из классов и подклассов иммуноглобулинов, содержат по одному или более олигосахаридному фрагменту (степень гликозилированности отражается на биологических свойствах иммуноглобулинов). Р Две тяжелые (Н) цепи с мол. весом 50 кД и две легкие (L) с мол. весом 25 кД объединены в единую молекулу с помощью ковалентных дисульфидных связей. Каждая цепь содержит вариабельную область (VL и VH для L- и H-цепей соответственно) и константную (С), подразделяющуюся у Н-цепей на гомологичные участки (домены): Ch2, Ch3, CН3. L-цепь имеет один константный участок - CL. От взаимодействия VH- и VL-областей зависит специфичность иммуноглобулинов как антител. В аминокислотной последовательности V-доменов имеются гипервариабельные участки, характеризующиеся частой заменой аминокислот от белка к белку, и более консервативные. Между СН1 и СН2 доменами Н-цепи находится шарнирная область, обеспечивающая подвижность антигенсвязывающего Fab-фрагмента. СН2-домен служит местом присоединения углеводов и связывания комплемента. СН3-домен взаимодействует с Fc-рецептором (не способным связывать антиген) на поверхности клеток, принимающих участие в иммунологических реакциях. Лёгкие цепи различных видов отличаются друг от друга С - концевой последовательностью аминокислот. С - концевая половина полипептидной цепи имеет постоянную аминокислотную последовательность, а ее N - концевая часть - вариабельную. Каждый постоянный (Сl) и вариабельный (Vl) участок легкой цепи включает 107-110 аминокислотных остатков. Тяжелые цепи построены их четырех участков - VH, C1H, C2H, C3H. Вариабельные участки их состоят приблизительно из 110-114 аминокислотных остатков, постоянные - 330. В вариабельной части полипептидных цепей находятся определенные, так называемые "гипервариабельные участки", с наибольшим числом аминокислотных замен. В легких цепях они расположены между 24-34; 52-55; 89-97 аминокислотными остатками. Гипервариабельные участки тяжелых цепей занимают аналогичные положения, но точная локализация их пока не установлена. Строение постоянных областей тяжелых цепей определяет эффекторные функции молекул к поверхностям макрофагов, В-лимфоцитов, тучных клеток, а также проникновение через плацентарную мембрану. Гибкость молекул иммуноглобулинов, обеспечивающая приспособляемость к различным конфигурациям молекул антигена, обусловливается также наличием особого "шарнирного участка" в середине тяжелых цепей, содержащего много остатков аминокислоты пролина и препятствующего образованию вторичной структуры. Шарнирная область чувствительна к протеолитическим ферментам. При расщеплении ими (например, папаином) иммуноглобулин распадается на два идентичных Fab-фрагмента и один Fc-фрагмент. В настоящее время на основании изучения первичной структуры полипептидных цепей выдвинута так называемая "доменная" гипотеза строения иммуноглобулинов, согласно которой молекулу иммуноглобулинов можно разбить на участки с относительно независимыми конфигурациями в виде глобул. Каждый домен состоит приблизительно из 100-110 аминокислотных остатков и имеет одну дисудьфидную связь, которая связывает участки цепей, образуя петлю из 60 аминокислотных остатков. Молекулыиммуноглобулинов связанные с поверхностьюлимфоцитов, имеют дополнительные гидрофобные "хвосты" на С-концах тяжелых цепей, которые встроены вмембраныклеток. Пептидные цепи иммуноглобулинов и рядабелковклеточных мембран(антигеныгистосовместимости,рецепторыдляантигеновТ-лимфоцитов) по своей первичной структуре сходны между собой, что указывает на общее эволюционное происхождение всех этихбелков. Связывание с антигенами. На N-концах тяжелых и легких цепей расположены те самые вариабильные области, которые в сочетании и образуют антигенсвязывающую структуру - паратоп в составе Fab-фрагмента. Три или четыре домена со стороны С-концов тяжелых цепей составляют константную часть молекулы - Fc-фрагмент (не связывают антиген). Fc-Фрагмент состоит из четырех или шести доменовдвух тяжелых цепей и определяет такие свойства иммуноглобулинов, как связывание имикомплемента, возможность проникать черезплаценту, присоединяться кклетками фиксироваться вкоже. Поскольку в состав молекулы иммуноглобулина входят две легкие и две тяжелые цепи, они формируют два паратопа (области, контактирующие с антигеном) в составе двух Fab-фрагментов, т.е. антитело бивалентно: может соединиться с двумя идентичными антигенными эпитопами. Этому способствует наличие шарнирной области между первым и вторым доменами константного фрагмента тяжелых цепей, благодаря которой обеспечивается возможность пространственной ориентации Fab-фрагментов для связывания с антигенными эпитопами. Комплекс с антигеном образуется в результате нековалентных взаимодействий, характер которых может варьировать в зависимости от специфичности антитела- связи могут быть ионными, вандерваальсовыми, водородными, при помощи солевых мостиков и гидрофобных взаимодействий.. Сила связывания с антигеном увеличивается на несколько порядков, если молекула антитела реагирует сразу двумя (или более) областями связывания с несколькими детерминантами одной молекулы антигена. Каждая индивидуальная клетка вырабатывает антитела только одной специфичности по правилу "одна клетка " одно антитело" (Петров , 1987). Это означает, что в клетке активно функционируют только один вариант гена VH, один - гена СH и по одному соответствующему гену одной из легких цепей. Все остальные структурные гены выключены. В каждой отдельно взятой антитело- образующей клетке из всего множества структурных генов иммуноглобулинов функционирует их минимальное количество, необходимое для синтеза антител одной специфичности и одного типа. Таким образом, в основе многообразия специфичности антител лежит функционирование в лимфоидной системе большого количества клеток и их потомков - клонов клеток - продуцентов одного вида антител. Следовательно, количество специфичностей антител соответствует количеству клонов клеток-антителопродуцентов, различающихся генами, функционирующими в них. Генетика. Особенностью этих полипептидных цепей является отсутствие единого гена, кодирующего структуру всей полипептидной цепи. Всякий раз сборка такого гена происходит из отдельных сегментов. Этим обеспечивается бесконечное разнообразие структур молекул антител, способных распознать любую существующую в природе структуру антигена. Иными словами, набор (репертуар) специфических участков связывания в популяции иммуноглобулинов организма столь широк, что на любой попадающий в организм антигенный эпитоп (участок связывания) обязательно найдется строго комплементарный паратоп в составе антиген-связывающего фрагмента (Fab - фрагмента) какого-то иммуноглобулина. Поэтому говорят, что легкие и тяжелые пептидные цепи каждого класса иммуноглобулинов построены из двух основных областей - вариабельной и постоянной. Все их антигенные детерминанты кодируются тремя несцепленными группами аутосомных генов. Одна группа кодирует тяжелую цепь того или иного класса, другая - легкуюk-типа, третья – легкую-типа.Так как полипептидные цепи состоят из двух различных участков - вариабельного (V) и постоянного (С), каждая из трех групп генов включает набор генов вариабельной - V и постоянной областей -С-гены. Таким образом, синтез каждой полипептидной цепи молекулы иммуноглобулина контролируется двумя структурными генами, а не одним, как при синтезе других белков. Один ген кодирует вариабельную область цепи, другой- постоянную. Причем существуют многие гены для вариабельных областей полипептидной цепи, что связано с многообразием специфических активных центров. Классификация. Семейство иммуноглобулинов у высших позвоночных включает в себя несколько классов;
у человека их известно пять (G, М, A, D, Е). Классы иммуноглобулинов делятся на подклассы. Все классы иммуноглобулинов отличаются друг от друга количественным содержанием углеводного компонента. Наиболее богаты углеводами иммуноглобулины М, А, Е и Д (7,5 - 12,0%). В молекулах IgG содержится около 2,9% углеводов. В составе иммуноглобулинов обнаружены манноза, галактоза, галактозамин, глюкозамин, фукоза и сиаловая кислота. У молекул IgG, IgD, IgE и IgA (молекула IgA построена подобно молекуле IgG) 2 активных центра, у молекул IgM - 10. рис2: схемы строения различных иммуноглобулинов. Иммуноглобулины класса G. IgG представляет собой наиболее изученное антитело, в большом количестве присутствующее в сыворотках крови всех млекопитающих и птиц. IgG составляет около 70-80% от общего содержания иммуноглобулинов. Молекулярная масса - 150 000 - 160 000 (Незлин, 1972). Молекула иммуноглобулина G- построена из двух тяжелых и двух легких полипептидных цепей, соединенных дисульфидными связями. Характерны тяжелые а следовательно, и антигенными и биологическими свойствами полипептидные цепи. IgG человека существует в виде 4 подклассов (G1, G2, G3, G4), отличающихся строением постоянных участков тяжелых цепей, а следовательно, и антигенными и биологическими свойствами. Подклассы различаются количеством дисульфидных связей, соединяющих тяжелые цепи: в молекулах G1 и G4 их по 2, в G2, - 4, а в G3, -5. IgG1 составляет 70% от общего содержания IgG, а IgG2, IgG3, IgG1 18, 8 и 3%, соответственно. У всех изученных видов животных найдены два подкласса IgG: относительно медленно передвигающиеся в электрическом поле G2 и более подвижные G1. Их молекулы имеют различные антигенные и биологические свойства, а также способность к перевариванию протеолитическими ферментами. Расшифрована первичная структура обеих цепей иммуноглобулина G1(Edelman, 1973). Тяжелые цепи его состоят из одной вариабельной области - VH и 3 постоянных участков - Сн1, Сн2 и Сн3. Длину вариабельных областей составляют 114, а постоянных - 330 аминокислотных остатков, легкие из областей V1, СL. С помощью электронной микроскопии (Valentine, Jreen, 1967), выяснено, что молекула иммуноглобулина G имеет V-образную форму, при этом Fab фрагменты образуют "лапки" молекулы , а Fc- фрагмент - ее "хвост". Она имеет два активных центра, находящихся в вариабельной части молекулы, а именно на кончиках Fab фрагментов. У человека только IgG способен проникать через плаценту и попадать в кровеносную систему плода, обеспечивая тем самым пассивный иммунитет новорожденных в ранний постнатальный период. Влияние на организм: Повышение: - аутоиммунные заболевания (системная красная волчанка, ревматоидный артрит, синдром Шегрена), саркоидоз - паразитарные болезни - хронические инфекции - внутриматочные контрацептивы Снижение: - иммунодефицит - иммуносупрессивная терапия
Иммуноглобулины класса А. Рис. 3. Строение иммуноглобулина А (димер). IgA циркулирует в сыворотке в виде мономеров или димеров. Мономер с молекулярной массой 160 кДа. Существует также димерная форма IgA. Характерен для секретов организма (слюна, слезы, пот, молозиво, пищеварительный сок, выделения слизистых поверхностей). В сыворотке крови его содержание незначительно и составляет 10-15% от общего количества сывороточных иммуноглобулинов. Тем не менее, считается, что среди иммуноглобулинов всех классов IgA синтезируется в наибольших количествах (больше, чем IgG). В сутки у человека продуцируется до 3 г IgA. Тяжелая α-цепь построена из вариабельного домена, трех константных доменов и шарнирного участка. У человека известны два подкласса — IgAl и IgA2. Сывороточный IgA обычно представлен мономером. Димер IgA может связываться с поли-иммуноглобулиновым рецептором на базо-латеральной поверхности эпителиальных клеток и в комплексе с этим рецептором проникать в эпителиальные клетки. Внутри эпителиальной клетки такой комплекс подвергается протеолизу и через апикальную поверхность эпителиальной клетки секретируется образовавшийся комплекс димера IgA с фрагментом полиглобулинового рецептора, который получил название «секреторный компонент». Таким образом в состав секретов слизистых попадает секреторный IgA SIgA, который обеспечивает местный иммунитет слизистых, препятствуя процессам адгезии и адсорбции возбудителей (бактерий и вирусов) на чувствительных клетках. Уровень продукции IgA значительно выше, чем у других классов иммуноглобулинов, так как у него короткий полупериод жизни и значительная часть его секретируется в виде SIgA. IgA в сыворотке крови человека содержится в относительно большем количестве, чем IgМ и составляет около 19% от общего количества иммуноглобулинов (Hobby, 1971). В сыворотке крови многих видов животных, в частности овец и крупного рогатого скота, IgM преобладает над IgA. Значительное количество этого белка обнаружено в лимфе, где концентрация его в 2-18 раз выше, чем в крови (Стефани, 1971). Антитела найдены и в содержимом кишечника и фекалиях, 80% которых приходится на долю IgА. Секреторный IgA обладает выраженной бактерицидностью, антивирусными и антитоксическими свойствами, активирует комплемент, стимулирует фагоцитоз, играет решающую роль в реализации резистентности к инфекции. Влияние на организм: Повышение: - хронические заболевания печени - хронические инфекции, особенно ЖКТ и дыхательных путей - ревматоидный артрит и другие ревматические заболевания Снижение: - иммунодефицит
Иммуноглобулины класса М. IgМ - один из высокомолекулярных белков сыворотки крови и имеет молекулярную массу около 1 млн, константу седиментации 19 Se. Молекула IgМ состоит из 5 субъединиц, каждая из которых напоминает молекулу IgG (рис. 2). Субъединица состоит из двух тяжелых и двух легких цепей с молекулярными массами 23 000 и 60 000 соответственно, (- цепь состоит из 5 доменов VH, С1(- С4(, легкая - изVL, и СL. Молекула 1IgM имеет 10 активных центров, расположенных в Fab областях ( Прокопенко, Равич- Щербо, 1974, Литмен , Гуд, 1981). Рис. 4. Схема строения молекулы IgМ
IgМ содержит около 10% углеводов., функция которых обусловлена с образованием макромолекулы IgM из 7 S субъединиц к формированием пространственной структуры молекулы (Каверзнева, 1984). IgМ по рваному реагирует на восстановление 2- меркаптоэтанолом: при мягком он распадается на 5-7 S субъединиц, а при более глубоком на тяжелые и легкие полипептидные цепи. Важнейшее свойство молекулы IgМ, необходимое для ее функционирования - конформационная подвижность при изменении условий внешней среды. При электрофорезе IgМ передвигается быстрее иммуноглобулинов класса G во фракции (2- глобулинов. Найдено 2 подкласса IgМ, с различными антигенными свойствами (Гауровец, 1969, Бернет, 1971, Незлин , 1972, Кульберг , 1975). Сывороточная концентрация IgM составляет 0,5-2 мг/мл (~5 % от общего количества сывороточных иммуноглобулинов). На мембране В-лимфоцитов присутствует мономерная форма IgM, выполняющая функцию основной составляющей В-клеточного рецептора. IgM- антитело первичного иммунного ответа, так как синтезируется первым после антигенной стимуляции. Через несколько дней синтез IgМ переключается на IgG, а позже -на IgА. IgM синтезируется раньше других классов в онтогенезе, может продуцироваться в организме плода в ответ на внутриутробную инфекцию. IgM в основном имеет внутрисосудистую локализацию, небольшое количество его обнаружено в тканевых жидкостях, но в слизистых выделениях он обычно отсутствует (Jonas, 1972). У большинства же животных (кроме кроликов) IgM через плаценту проходить не может ( Маслянко , 1973). Является маркерм остроты процесса. После появления более поздних антител – IgG, его количество падает. К этому классу иммуноглобулинов относятся изогемагглютинины групп крови: антиА, анти-В Влияние на организм: Повышение: - вирусная инфекция - ранний период бактериальной или паразитарной инфекции - ревматоидный артрит, саркоидоз и др Снижение: - иммунодефицит - потеря белка (патология ЖКТ, ожоги)
Иммуноглобулины класса D. IgD изучен недостаточно. Впервые он охарактеризован как четвертый класс иммуноглобулинов D.Rowe, G.Fahey(1965). Его молекулярная масса около 180000. Молекула IgD состоит из двух легких и двух тяжелых полипептидных цепей, связанных дисульфидными мостиками. Мономер. Тяжелая цепь IgD построена из одного вариабельного и трех константных доменов. Содержится в сыворотке в исчезающих количествах. Функция сывороточного IgD неизвестна. На поверхности В-лимфоцитов присутствует мембранная форма IgD, входящая в состав В-клеточного рецептора. Содержание в сыворотке не превышает 1% от общего количества иммуноглобулинов. Они не проходят через плаценту и относятся к коротко-живущим. Вопрос о форме участия IgD в иммунных процессах оставался недостаточно ясным вплоть до 2000 г. Тем не менее, показано, что в сыворотке ею концентрация повышается с возрастом: достигая максимума к 10 годам, а в 15-летнем возрасте соответствует концентрации, отмечаемой у взрослого человека. Содержание увеличивается у больных бронхиальной астмой, ревматическими заболеваниями, болезнью Ходжкина, иммунодефицитными синдромами, хронической лимфатической лейкемией, системной красной волчанкой. Понижен процент при лимфомах. Кроме того, IgD обнаружены как антитела к пенициллину, инсулину, тиреоидину, белкам молока и дифтерийному токсину Иммуноглобулины класса Е. IgE впервые идентифицирован K. Ishisaka, Молекулярная масса IgЕ 190 000, константы седиментации8 S. Молекула IgE также состоит из двух легких и двух тяжелых полипептидных цепей, молекулярная масса которых 22 600 и 72 500 соответственно. Содержание углеводов свыше 12%. studfiles.net Сыворотки, вакцины, гамма-глобулиныЛечебные сыворотки. Эти препараты содержат антитела против токсинов и микробов. Они готовятся из сыворотки крови животных или человека, у которых предварительно вырабатывают иммунитет к определенному возбудителю или токсину. Чаще используют антитоксические сыворотки: противостолбнячную, пртиводифтерийную, противогангренозную, противоботулиническую. Для профилактики анафилактического шока сыворотки вводят дробно, по методу Безредко. Сыворотки хранят в холодильнике при температуре 2 – 10С. Очень важно соблюдать режим хранения сывороток и целостность ампул. Перед введением необходимо проверить наименование сыворотки, срок годности, внешний вид, состояние ампулы, дозу, затем подогреть до 37-38С. Схема введения сывороток
Гамма глобулины – белковая фракция сыворотки крови, выполняющая функцию антител. Их рекомендуется назначать совместно с антибиотиками и химиотерапевтическими препаратами. Это улучшает эффект лечения. Целесообразно вводить гамма глобулины при отсутствии в них специфических антител (нормальный человеческий иммуноглобулин), они оказывают стимулирующее воздействие на обменные и иммунные процессы. Гамма глобулины могут быть также специфического действия: противолептоспирозный, противосибиреязвенный, коревой, гриппозный и др. Большие дозы гамма глобулина вводят по схеме Безредко, т.е. дробно. ВакцинотерапияВ основе механизма действия вакцин лежит стимуляция защитных сил организма. Вакцины назначают при хронических процессах (бруцеллез, туляремия), для профилактики рецидивов (брюшной тиф). Применяют вакцину в разгар болезни в сочетании с антибиотиками. Для лечения используют убитые вакцины. Их можно вводить подкожно, накожно, внутримышечно и даже внутривенно. Реакции на ведение вакцины могут быть местными, очаговыми и общими. Для снижения реактивности организма на введение вакцины ее вводят курсами, назначенная доза вводится двухэтапно с интервалом в полтора-два часа. При серотерапии могут быть осложнения: 1) анафилактический шок;2) сывороточная болезнь. Анафилактический шок отличается бурным, нередко молниеносным течением. У пациента возникает беспокойство, страх, через несколько минут – потеря сознания с развитием острой сердечно-сосудистой недостаточности, нарастает дыхательная недостаточность в результате бронхоспазма, отека и стеноза гортани, может развиться отек легких. Сывороточная болезнь развивается через 7 – 12 дней после лечения сывороткой (ботулизм, дифтерия). Проявляется повышением температуры тела, увеличением лимфатических узлов, крапивницей, болью в суставах и их отеком, отеком лица. doctor-i.ru как его производят, насколько он эффективен против клещейГаммаглобулин – это лекарственный препарат, который содержит противобактериальные, или антивирусные антитела. Одной из разновидностей гаммаглобулинов являются иммуноглобулины.
Гаммаглобулин противоклещевой, или иммуноглобулин, является основным средством профилактики против клещевого энцефалита. Клещевой энцефалитЭто вирусное заболевание, которое поражает центральную нервную систему. Переносчиками этого очень серьезного заболевания являются клещи, которых в весенне-летний период невероятное количество в лесах и парках. Инкубационный период у клещевого энцефалита 1-3 недели. Начинается заболевание с высокой температуры и сильной головной боли. Если вас укусил клещ, то не впадайте в панику. Самое главное в борьбе с энцефалитом – это выиграть время, когда вирус уже попал в кровь, но еще нет симптомов болезни. Для этих целей и применяют этот гаммаглобулин. Применение гаммаглобулина снижает вероятность возникновения заболевания. При выезде на природу нужно соблюдать меры предосторожности, одеваться так, чтобы клещи не могли попасть под одежду и проводить тщательный осмотр тела, чтобы вовремя выявить клеща. ИммуноглобулинГаммаглобулин против клещей вводят в первые часы после того, как присосался клещ. Иммуноглобулин получают из крови людей, переболевших энцефалитом. Как и всякий препарат крови, гаммаглобулин имеет высокую цену и побочные эффекты. Поэтому ни в коем случае не вводите это лекарство самостоятельно. Для производства иммуноглобулина требуется кровь с высоким титром антител к вирусу, при этом доноры не должны быть носителями гепатита, ВИЧ и других инфекций. Поэтому изготовить иммуноглобулин крайне сложно. Данные о пользе гаммаглобулина весьма противоречивы. В Европе, например, гаммаглобулин не применяют как профилактическое средство, отдавая предпочтение вакцинации. Ни одно средство экстренной профилактики не сравнится по эффективности с вакцинацией. Видео-материалы по теме статьиВакцина от клещей: Как защититься от клещей: Энцефалитный клещ: Самые эффективные методы защиты от клещей: webdiana.ru Гаммаглобулин | все вопросы и ответы о "Гаммаглобулин" | 03.ruГаммаглобулин
Перейти в Каталог лекарств Вернуться в Каталог медицинских терминов
А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Э Я
Гаммаглобулин - (gamma globulin) - любой белок, присутствующий в плазме крови, который можно идентифицировать по характерной скорости его движения в электрическом поле (см. Электрофорез). Почти все гаммаглобулины являются иммуноглобулинами. Инъекция гаммаглобулина обеспечивает человеку временную защиту от гепатита А; кроме того, недавно было установлено, что в результате этих инъекций уменьшается вероятность поражения венечных артерий болезнью Кавасаки. См. также Глобулин.;
Найдено в 98-и вопросах: инфекционист 16 апреля 2018 г. / Оксана Здравствуйте Уважаемые специалисты. Сыну 7 лет, взяли мазок из зева :нашли золотистый стафилоккок. Назначили антистафилоккоковый гаммаглобулин. делать 5 дней.Лечится ли он открыть гематолог 27 апреля 2016 г. / Карина / МоскваДобрый день, в анализе гамма глобулин повышен 24,9. М-градиент составляет 22,4 % = 16,4 г/л, альбумин 55,1. Остальне белки в норме. Написано моноклональная секреция Gлямбда (16,4… открыть 27 апреля 2016 г. / КаринаДобрый вечер, спасибо. Инфекционный мононуклеоз может быть из-за присутствия ВЭБ? Гаммаглобулин снижается, 1,5 мес назад был 26, сейчас 24. смотреть инфекционист 28 ноября 2007 г. / OlgaЗдравствуйте! Может ли из- за филяриоза развиться уевит глаза. Лечат ли в России филяриоз? Можно ли сдать анализ на микрофилярии в Омске. Если нет, то где? Заранее благодарю… открыть (еще 6337 сообщений) Последние 5: 1 марта 2016 г. / ЛинаВ Инвитро или подобной сдайте на гаммаглобулин на IgE, и общий, нужна эозинофилия какая. смотреть педиатр 7 сентября 2015 г. / Жадыра... .Дочке 4года.мазок из зева и носа:нашли золотистый стафилоккок 10'6. пропили сумамед.сдаем повторно через месяц опять 10'6.теперь назначили антистафилоккоковый гаммаглобулин если не ошибаюсь.5 дней по 3 мг.что мне делать в этой ситуации?лечится ли оно? открыть детский ЛОР 4 сентября 2015 г. / Жадыра... .Дочке 4года.мазок из зева и носа:нашли золотистый стафилоккок 10'6. пропили сумамед.сдаем повторно через месяц опять 10'6.теперь назначили антистафилоккоковый гаммаглобулин если не ошибаюсь.5 дней по 3 мг.что мне делать в этой ситуации?лечится ли оно? открыть детский ЛОР 4 сентября 2015 г. / Жадыра... .Дочке 4года.мазок из зева и носа:нашли золотистый стафилоккок 10'6. пропили сумамед.сдаем повторно через месяц опять 10'6.теперь назначили антистафилоккоковый гаммаглобулин если не ошибаюсь.5 дней по 3 мг.что мне делать в этой ситуации?лечится ли оно? открыть инфекционист 27 мая 2015 г. / Айнур... у гинеколога, в жк. Также я прохожу курс лечения противотуберкулезнымипрепаратами и мне вводили препарат гаммаглобулин, в инструкции указано, что он может влиять на результаты серологических исследований, вернее давать ложноположительные результаты, это ... открыть аллерго-иммунолог 12 января 2015 г. / Лена / Краснодар... отменили из-за роста билирубина. В стадии ремиссии поллиноза также рекомендуется проведение курса иммунотерапии гистаглобином и гаммаглобулином. Гаммаглобулин вводят предсезонно (за 1-2 недели до цветения), внутримышечно в дозе 1,5 мл 2 раза в неделю, ... открыть инфекционист 10 января 2015 г. / Лена / Краснодар... отменили из-за повышения билирубина, частые боли в области печени и ЖКТ. Стоим на учете у инфекциониста (пьем желчегонные). Удалены аденоиды и миндалины. Можно ли уколоть гаммаглобулин? Если да, то какой? Не скажется ли это на наследственности? Спасибо. открыть 12 января 2015 г. / ЛенаВ стадии ремиссии амброзийного поллиноза также рекомендуется проведение курса иммунотерапии гистаглобином и гаммаглобулином. Гаммаглобулин вводят предсезонно (за 1-2 недели до цветения), внутримышечно в дозе 1,5 мл 2 раза в неделю, всего 5 инъекций. Что ... смотреть 10 января 2015 г. / Лена... уровень билирубина), который подтвержден московской клиникой (анализировали каплю крови - синдром подтвердился). Аллергия замучила, иммунитет слабый, вялость, тошнота, холодные конечности... Гаммаглобулин для улучшения состояния.., поднятия иммунитета... смотреть 10 января 2015 г. / Александров Павел АндреевичЗдравствуйте! На учете с каким заболеванием? Для чего гаммаглобулин? С ув., Александров П.А. смотреть венеролог 16 октября 2012 г. / Владимир… / ТашкентЗдравствуйте!У меня куча вопросов. 1)Цитомегаловирус.Врач в КВД назначил мне гаммаглобулин антистафилококковый .Разве вирусы лечат антибактериальными препаратами?… открыть (еще 10 сообщений) Последние 5: 19 августа 2014 г. / Аноним... был в том же КВД наверное)) абсолютно тот же диагноз и назначение. 150$ на выписанные препараты (за гаммаглобулин в основном) в бесплатном (!!!) КВД насторожили, обратился к знакомым врачам, и нашёл ваш пост. Постараюсь теперь распространить информацию о ... смотреть www.03.ru ГАММАГЛОБУЛИН - это... Что такое ГАММАГЛОБУЛИН? ГАММАГЛОБУЛИНГАММАГЛОБУЛИН, один из белковых компонентов плазмы крови у млекопитающих. Примерно на 85% состоит из АНТИТЕЛ КРОВИ. Временно повышает ИММУНИТЕТ у пациентов, которые перенесли определенные болезни, например, корь. Научно-технический энциклопедический словарь.
Смотреть что такое "ГАММАГЛОБУЛИН" в других словарях:
dic.academic.ru нормы, повышенный и пониженный уровеньПроверка на гамма-глобулин используется для выяснения уровня иммуноглобулинов в крови. Иммуноглобулины также называются «иммунные гамма-глобулины». Иммуноглобулиновые антитела вырабатываются в организме в ответ на чужеродные вещества, такие как бактерии, вирусы и раковые клетки. Виды антителЕсть 5 различных видов антител, вырабатываемых организмом: IgA, IgG, IgM, IgE, IgD. Каждый из них помогает в защите организма от специфических инфекций и заболеваний. Низкий уровень антител может повысить восприимчивость организма к болезням.
Гамма-глобулин находится в плазме крови. Действуя совместно с антителами, он защищает человека от инфекций и болезней. Таким образом, поддерживать нужный уровень гамма-глобулина необходимо для здорового образа жизни. Мы заболеваем тогда, когда наша иммунная система не может справиться с возбудителем болезни. Анализ крови на гамма-глобулин проводится для проверки наличия антител (также называемых иммуноглобины или иммунные гамма-глобулины) в плазме крови. Их уровень укажет на присутствие вирусов, бактерий или вызывающих рак клеток. Это исследование является диагностической процедурой, помогающей врачам при постановке диагноза и разработке лечения. Следует отметить, что этот анализ выполняется только в случае подозрения на серьезные заболевания. Результаты проверкиАнализ на гамма-глобулин в крови проводится после взятия ее образца из вены. Затем от него отделяется сыворотка, которую и проверяют на антитела. Нормальные результаты находятся в следующих рамках:
Результаты анализа на гамма-глобулин необходимы для проверки состояния здоровья и диагностирования различных заболеваний, а все осложнения процедуры забора крови связаны с проколом кожи (гематома, кровотечение и прочие). Гамма-глобулин, извлеченный из крови различных людей, можно комбинировать и использовать для повышения иммунитета и лечения инфекций. Это особенно полезно тем пациентам, чья иммунная система слаба. Этим людям вводятся антитела из крови доноров, перенесших инфекционные заболевания, такие как гепатит, ветряная оспа, корь. Такая процедура, называемая иммуноглобулиновой терапией, позволяет предотвратить эти заболевания. Она проводится как внутривенная инъекция гамма-глобулина в вену или мышцу. Уровни гамма-глобулинаГлобулин и альбумин являются сывороточными белками плазмы крови, продуцируемыми иммунной системой или печенью. Их соотношение в крови относительно постоянно – 1,5–2,3. Глобины делят на альфа-1-глобулины, альфа-2-глобулины, бета-глобулины и гамма-глобулины. Эти компоненты можно отделить и откалибровать в лаборатории. Соотношение белков обоих альбуминов и глобулинов очень важно при диагностировании инфекционных заболеваний. Содержание белка может увеличиться по следующим причинам:
Содержание белка может снизиться из-за:
Как проводится анализ на гамма-глобулинДля проведения проверки на иммуноглобулин берется образец крови из вены. Нормальные значения таковы:
Чтение контрольных значений уровня иммуноглобулинаВысокое или низкое значение не являются нормой и может быть признаком основного заболевания. Высокое значения иммуноглобулина A может быть признаком множественной миеломы, цирроза печени, хронического гепатита, ревматоидного артрита и системной красной волчанки – СКВ. Низкое значение IgA может быть признаком повреждения почек, некоторых типов лейкемии и энтеропатии. Высокий уровень IgG может быть признаком СПИДа, рассеянного склероза и хронического гепатита. Низкое значения иммуноглобулина G может быть признаком макроглобулинемии, нефротического синдрома и некоторых видов лейкемии. Высокий показатель IgM может быть признаком макроглобулинемии, вирусного гепатита, поражения почек, мононуклеоза, паразитарных инфекций и повреждения почек. Низкое значение иммуноглобулина M может быть признаком множественной миеломы, некоторых видов лейкемии и унаследованных иммунных заболеваний. Высокий уровень иммуноглобулина E может быть признаком астмы, паразитарных инфекций и атопического дерматита. В то время как низкое значения IgE является показателем болезни, называемой синдром атаксии-телеангиэктазии или синдром Луи-Бар. Это редкое заболевание, которое влияет на движение мышц. Видеоdoctor-test.ru |
г.Самара, ул. Димитрова 131 [email protected] |
 |

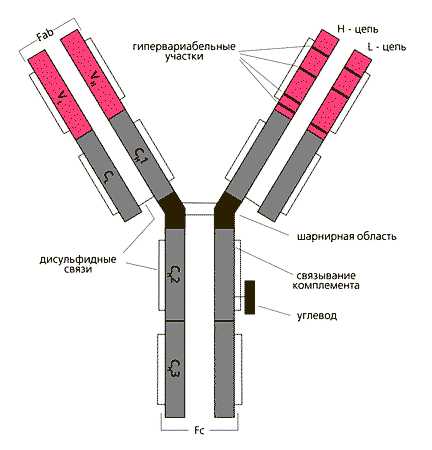 ис.1.Строение иммуноглобулина G.
ис.1.Строение иммуноглобулина G.