|
|
||||||||||
|
Рациональная антибактериальная терапия: средства и тактика. Энтерококки лечение антибиотикамиЭнтерококки - МедицинаЭнтерококки, которых долгое время считали патогенными только для определенных групп населения, за последние 20 лет стали распространенными возбудителями внутрибольничных инфекций, представляющих много проблем. Прежде энтерококков вместе со Streptococcus bovis и Streptococcus equinus включали в группу D по классификации Лансфилд, но сейчас они выделены в отдельный род. Эти микроорганизмы характеризуются частой устойчивостью к антибиотикам. Энтерококки — грамположительные, каталазаотрицательные факультативные анаэробы, которые располагаются попарно, в виде коротких цепочек. Большинство энтерококков не вызывает гемолиза на агаре с добавкой овечьей крови (относится к у-гемолитическим бактериям), хотя встречаются и а- и в-гемолитические штаммы. От основной части стрептококков, входящих в классификацию Лансфилд, энтерококки могут расти в присутствии желчи и гидролизовать эскулин. Кроме того, энтерококки растут на средах, содержащих 6,5% натрия хлорида, и могут гидролизировать L-пирролидонил-Р-нафтиламид (PYR-peакция) — это используется в лабораториях, чтобы отличить энтерококки от стрептококков группы D. Вид энтерококка определяют по способности ферментировать различные углеводы. Энтерококки входят в состав нормальной микрофлоры ЖКТ у людей и животных. Они также могут обнаруживаться в секрете полости рта, зубном налете, колонизировать верхние дыхательные пути, кожу и влагалище. Преобладающий вид — E.faecalis, как правило, колонизация им происходит на 1-й неделе жизни. К моменту наступления половой зрелости бактерионосительство E.faecalis обнаруживается практически у всех людей. Колонизация E.faecium менее распространена; эта бактерия высевается примерно у 25 % взрослых. ПатогенезВозбудителем 80-90% энтерококковых инфекций служит Е. faecalis, почти все оставшиеся случаи обусловлены E.faecium. Прочие виды энтерококков (Е. gaUinarium, Е. cassiliflavus) редко становятся причиной системных инфекций, одна заслуживают внимания из-за своей генетически Условленной устойчивости к ванкомицину. В типичном случае инфекция вызывается энтерококками входящими в состав микрофлоры больного. По данным недавних исследований, внутрибольничное распространение энтерококков занимает важное место в развитии вспышек инфекции. Обычно энтерококки не проявляют агрессивных свойств и вызывают инфекции лишь у детей с иммунодефицитами или поврежденными слизистыми оболочками. То, что энтерококки внезапно стали частой причиной внутрибольничных инфекций, произошло преимущественно из-за их устойчивости к тем антибактериальным средствам, которые обычно используются в стационарах. Помимо генов, обеспечивающих устойчивость к антибактериальным средствам, у энтерококков есть несколько факторов вирулентности. По-видимому, склонность данных бактерий вызывать эндокардит и инфекции мочевых путей обусловлена наличием факторов адгезии. Многие штаммы также продуцируют цитолизин, который имеется у многих клеток организма-хозяина. На экспериментальных моделях эндокардита, перитонита и эндофтальмита было показано, что цитолизин имеет большое значение для вирулентности энтерококков. Цитолизин выделяется при достижении большой концентрации бактерий, поскольку его секреция регулируется по механизму кооперативной чувствительности. К остальным факторам вирулентности относятся субстанция агрегации, желатиназа, внеклеточные радикалы кислорода и внеклеточный поверхностный протеин. Устойчивость к антибактериальным средствамЭнтерококки высокоустойчивы к цефалоспоринам и полусинтетическим пенициллинам (например, нафциллину, оксациллину, метициклину), умеренно устойчивы к пенициллинам с широким спектром (тикарциллину, карбенициллину). Из бета-лактамных антибиотиков против энтерококков наиболее активны ампициллин, имипенем и бензилпенициллин. Любой препарат может оказаться бесполезным, если используется в виде монотерапии при тяжелых инфекциях, когда необходимо создать бактерицидную концентрацию. Некоторые штаммы фекального энтерококка продуцируют лактамазу, сходную с выделяемой стафилококками (ген этого фермента находится в плазмиде). Эти штаммы высокоустойчивы к пенициллинам, поэтому для лечения используют комбинацию пенициллина с ингибитором лактамазы либо применяют имипенем или ванкомицин. Всем энтерококкам изначально присуща низкая устойчивость к аминогликозидам, так как последние плохо проникают сквозь бактериальную стенку. Комбинация аминогликозидов с антибиотиками бета-лактамные, гликопептидные), разрушающими бактериальную стенку, увеличивает их проникновение внутрь энтерококков, что ведет к синергичному бактерицидному действию. Однако некоторые штаммы высокоустойчивы к аминогликозидам (МПК > 2000 мкг/мл), поскольку могут изменять или инактивировать данные антибиотики. На высоко- и некоторые умеренно устойчивые штаммы комбинация аминогликозидов с антибиотиками, разрушающими клеточную стенку, не оказывает синергичного действия. Описаны штаммы энтерококков, устойчивые почти к любым антибиотикам, включая тетрациклины, макролиды и хлорамфеникол. Поэтому всегда следует исследовать чувствительность энтерококков к антибиотикам. In vitro энтерококки чувствительны к триметоприм/сульфаметоксазолу, однако in vivo этот препарат малоэффективен и не должен использоваться при энтерококковых инфекциях в качестве основного. Ванкомицин всегда считался средством, действующим на штаммы энтерококков с множественной устойчивостью, но все чаще стали встречаться штаммы, резистентные к нему и другим гликопептидным антибиотикам, включая тейкопламин и даптомицину. Описана как высокая, так и умеренная устойчивость E.faecalis и E.faecium. Высокая устойчивость (МПК > 64 мкг/мл) обычно обусловлена наличием плазмидного гена vanA, который может передаваться при конъюгации. Умеренная устойчивость (МПК 8-256 мкг/мл) связана с хромосомным гомологом vanA — геном vanB. Штаммы, содержащие ген vanB, умеренно устойчивы к ванкомицину и чувствительны к тейкопланину, однако в процессе лечения их устойчивость может повышаться. Полезно:surgeryzone.net Enterococcus Faecalis в моче - энтерококк фекальный Enterococcus-faecalis (энтерококк фекальный) – один из самых распространенных видов бактерий семейства энтеробактер. Его отличительной особенностью является чрезвычайная устойчивость к различным факторам внешней среды. Благодаря этому он стал неотъемлемой частью микрофлоры множества живых существ, включая человека. Но, вместе с тем, в случае чрезмерного размножения, данные микроорганизмы могут вызвать ряд заболеваний. Поэтому их относят к условно-патогенным микробам. Наличие еnterococcus-faecalis в моче может свидетельствовать о развитии таких болезней. Условия, при которых бактерия может стать патогеннойУ здорового человека энтерококк в моче содержаться не должен. В основном эти бактерии обитают в тонком кишечнике, реже – в толстой кишке, половых органах, иногда – в ротовой полости. Но, даже в случае их обнаружения, беспокоиться следует не всегда. Обычно количество этих бактерий в 1 мл урины меньше 105 списывается на несоблюдение правил забора материала для анализа или на другие внешние факторы. Если же количество обнаруживаемых микроорганизмов больше – можно говорить о заболевании.
Развитию энтерококковой инфекции способствует ряд факторов. К ним относятся:
Какие болезни могут развиться
Наличие бактерий в моче называют бактериурией. Заболевания, к которым она приводит, в течение длительного времени могут развиваться без каких-либо явных симптомов. Очень часто энтерококк фекальный обнаруживается у больного случайно, когда возникает необходимость сдать мочу или мазок на анализ. Однако дальнейшее развитие инфекции может привести к более серьезным последствиям. В первую очередь энтерококки могут привести к болезням мочеполовой сферы, таким как цистит, пиелонефрит, аднексит. Их чрезмерное размножение может вызвать и воспалительные процессы во внутренней оболочке сердца – эндокардит. У женщин могут также развиться различные заболевания органов малого таза. Особое внимание на возможные негативные последствия бактериурии следует обращать беременным женщинам. В этот период у них часто случается застой мочи, что приводит к созданию благотворных условий для более интенсивного размножения бактерий. Способствуют этому и изменения в гормональном фоне. В результате, вследствие развития инфекции, могут наступить преждевременные роды, а в особо тяжелых случаях – выкидыш. Поэтому, если в анализах обнаружен энтерококк, следует отнестись к этому с максимальной серьезностью. Чего следует опасаться мужчинамНесмотря на то, что от энтерококковых инфекций больше страдают женщины, относить их к сугубо женским проблемам нельзя. У мужчин также могут возникнуть ситуации, когда в моче будут найдены эти бактерии. Как правило, это происходит в случаях длительного приема антибиотиков, недостаточного внимания к личной гигиене или как осложнение на фоне вирусной инфекции. Точно так же, как и у женщин, наличие инфекции у мужчин приводит к заболеваниям мочеполовой сферы. Однако, в силу анатомических особенностей, мужчины более подвержены заболеваниям нижних мочевых путей. У них может воспалиться мочевой пузырь, мочеточники, или предстательная железа. В самых тяжелых случаях может развиться простатит. Поэтому пренебрегать опасностью при обнаружении энтерококка в моче ни в коем случае нельзя. Симптомы и лечение
Если на начальном этапе заболевания может не ощущаться какой-либо дискомфорт, то, по мере того, как колония энтерококков будет разрастаться, могут возникнуть следующие симптомы:
При выявлении еnterococcus-faecalis в моче в количествах, превышающих норму, откладывать лечение не стоит. При этом категорически не рекомендуется прибегать к самолечению. Стратегия лечебных мероприятий состоит в том, чтобы привести количество бактерий к норме. Однако из-за чрезвычайной живучести энтерококков сделать это непросто. Конкретные меры определяются после того, как четко определена локализация бактерий. Обязательно проводится исследование их чувствительности к медицинским препаратам. Лечение энтерококк фекалис может производиться разными методами. Могут быть назначены антибиотические средства. При этом следует помнить, что антибиотики тетрациклиновой группы в настоящее время против бактерии бессильны. Обычно больным назначают цефтриаксон, ампициллин или гентамицин. Но для беременных женщин использование антибиотиков не подходит. Поэтому для лечения используются бактериофаги, которые более безопасны для кишечника. Выздоровления можно также добиться с помощью восстановления микрофлоры, и при проведении мероприятий, направленных на повышение иммунитета. mochaanaliz.ru Определение чувствительности Enterococcus spp.Главная / Отдел / Методические рекомендации и обзоры / Методические указания по определению чувствительности микроорганизмов к антибактериальным препаратам / Определение чувствительности Enterococcus spp.Энтерококки характеризуются природной устойчивостью ко многим АБП (цефалоспоринам, аминогликозидам), а клиническое значение наблюдаемой in vitro чувствительности к тетрациклинам, хлорамфениколу, макролидам и рифампицину окончательно не определено. Таким образом, перечень препаратов, подлежащих включению в исследование энтерококков, весьма ограничен (таблица 15). При решении вопроса о необходимости определения чувствительности Enterococcus spp. к АБП крайне важно оценить клиническую значимость этих микроорганизмов. Так, энтерококки, выделенные из нестерильных локусов организма, особенно в составе ассоциаций, чаще всего следует рассматривать как контаминирующие или колонизирующие микроорганизмы, соответственно, определять чувствительность таких штаммов к АБП нецелесообразно. Проводить определение чувствительности необходимо для штаммов Enterococcus spp., выделенных из крови и других в норме стерильных жидкостей и тканей организма, а также из мочи. При этом подходы к определению чувствительности этих микроорганизмов и наборы АБП для тестирования несколько различаются в зависимости от источника выделения штаммов (таблица 15). Пенициллин и ампициллинДанные антибиотики являются препаратами выбора для лечения энтерококковых инфекций. Между пенициллином и ампициллином отмечается перекрестная резистентность. Полученные результаты можно экстраполировать на ингибиторо-защищенные аминопенициллины и уреидопенициллины. Поскольку известны случаи резистентности энтерококков к пенициллинам, связанные с продукцией бета-лактамаз, резистентные штаммы следует исследовать на продукцию пенициллиназы в тесте с нитроцефином. АминогликозидыНесмотря на то, что энтерококки обладают природной устойчивостью к аминогликозидам, данный класс АБП широко применяется в комбинированной терапии генерализованных энтерококковых инфекций. Целесообразность таких схем лечения объясняется выраженным синергизмом между аминогликозидами и ампициллином или ванкомицином. Однако синергизм проявляется только в том случае, если МПК аминогликозидов не превосходит 500 мкг/мл для гентамицина и 1000 мкг/мл для стрептомицина. Указанное обстоятельство требует проведения скрининга (методом серийных разведений или ДДМ) на наличие у энтерококков высокого уровня резистентности к стрептомицину и гентамицину. ВанкомицинВанкомицин является препаратом выбора для лечения инфекций, вызванных штаммами, резистентными к бета-лактамам и аминогликозидам. В ряде географических регионов устойчивость энтерококков к ванкомицину является серьезной клинической проблемой. Имеются сообщения о выделении единичных штаммов ванкомицинорезистентных энтерококков и в России. Для выявления устойчивости энтерококков к ванкомицину целесообразно проводить целенаправленный скрининг. ЛинезолидПрепарат является средством выбора для лечения инфекций штаммами, устойчивыми к ванкомицину. Линезолид также рассматривается в качестве альтернативы ванкомицину при лечении инфекций, вызываемых штаммами, устойчивыми к бета-лактамам и аминогликозидам. Другие препаратыВ отношении ванкомицинрезистентных энтеркокков, несмотря на отсутствие убедительных данных, возможно оценивать активность тетрациклинов, хлорамфеникола, эритромицина и рифампина. Для штаммов энтерококков, выделенных при инфекциях мочевыводящих путей, целесообразно исследовать чувствительность к следующим антибиотикам:
Критерии интерпретации результатов определения чувствительности Enterococcus spp. (пограничные значения диаметров зон подавления роста и МПК АБП) приведены в таблице 16. Скрининг для выявления высокого уровня резистентности к аминогликозидам у энтерококковСкрининг можно проводить в агаре или бульоне. Питательная средаАгар или бульон на сердечно-мозговом экстракте. Питательная среда готовится в соответствии с инструкцией производителя. После автоклавирования и охлаждения до 45 - 50 °С в среду асептически добавляют растворы антибиотиков до следующих конечных концентраций:
Приготовление микробной взвеси, инокуляция и инкубацияМикробную взвесь готовят путем суспендирования изолированных колоний из 24-часовой культуры, выращенной на неселективных средах до концентрации 0,5 по Мак-Фарланду. Для скрининга на агаре на поверхность среды наносят 10,0 мкл суспензии. Для скрининга в бульоне в среду вносят инокулюм до конечной концентрации 5 х 105 КОЕ/мл. Инкубацию проводят при температуре 35 °С, для гентамицина - в течение полных 24 ч, для стрептомицина - до 48 ч. Учет результатовИсследуемый штамм рассматривается как резистентный при следующих условиях:
Контроль качества
Скрининг для выявления ванкомицинорезистентности у энтерококковСкрининг осуществляется на агаре. Питательная средаАгар на сердечно-мозговом экстракте. Питательная среда готовится в соответствии с инструкцией производителя. После автоклавирования и охлаждения до 45 - 50 °С в среду асептически добавляют раствор ванкомицина до конечной концентрации 6,0 мг/л. Приготовление микробной взвеси, инокуляция и инкубацияМикробную взвесь готовят путем суспендирования изолированных колоний из 24-часовой культуры, выращенной на неселективных средах до концентрации 0,5 по Мак-Фарланду. Для скрининга на поверхность агара наносят 10,0 мкл суспензии. Инкубацию проводят при температуре 35 °С в течение полных 24 ч. Учет результатовИсследуемый штамм рассматривается как резистентный при росте более 1 колонии на агаре с ванкомицином. Контроль качества
Назад www.dntpasteur.ru Рациональная антибактериальная терапия: средства и тактика : инструкция по применениюЭпидемиология и причины инфекцийОценить частоту госпитальных инфекций в нашей стране сложно из-за отсутствия официальной регистрации подобных заболеваний. В ОРИТ риск развития инфекционных осложнений у больных в 5-10 раз выше, чем в отделениях общего профиля. Четверть от общего числа госпитальных инфекций возникает в реанимационных отделениях. По данным международных многоцентровых исследований средняя распространенность госпитальных инфекций в лечебных учреждениях - 5-10%, а в ОРИТ она достигает 25-49%. Научные работы, посвященные исследованию их этиологии, отражают ситуацию в обследованных стационарах, поэтому их результаты экстраполируют на другие учреждения с большой долей условности. Даже многоцентровые исследования не считают исчерпывающими, хотя они наиболее репрезентативны. Наиболее полноценно изучена структура и этиология инфекций в ОРИТ. По данным многоцентрового исследования EPIC, проведенного в один день в 1417 отделениях 17 стран Европы (с охватом более 10 тыс пациентов), у 44,8% выявили инфекции, причем частота ОРИТ-ассоциированных - 20,6%. Наиболее частыми в ОРИТ были пневмония (46,9%), инфекции нижних дыхательных (17,8%) и мочевыводящих путей (17,6%), ангиогенные (12%) В этиологической структуре доминировали грамотрицательные бактерии семейства Enterobacteriaceae (34,4%), Staphylococcus aureus (30,1%), Pseudomonas aeruginosa (28,7%), коагулазонегативные стафилококки (19,1%), грибы (17,1%). У многих этиологически значимых микроорганизмов выявили устойчивость к традиционным антибиотикам, в частности, распространенность метициллинрезистентных стафилококков составила 60%, в 46% Р aeruginosa была устойчива к гентамицину. Сходные результаты по этиологической структуре инфекций были получены в другом исследовании. Его результаты также подтвердили, что большинству пациентов в ОРИТ (72,9%) с лечебной или профилактической целью назначали антибиотики. Причем наиболее часто - аминогликозиды (37,2%), карбапенемы (31,4%), гликопептиды (23,3%), цефалоспорины (18,0%). Перечень препаратов косвенно подтверждает высокий уровень антибиотикорезистентности возбудителей в ОРИТ. Анализ результатов системы контроля над госпитальными инфекциями США 1992-1997 гг показал превалирование в ОРИТ инфекций мочевыводящих путей (31%), пневмонии (27%), первичных ангиогенных инфекций (19%). Причём 87% первичных ангиогенных инфекций были связаны с центральными венозными катетерами, 86% пневмоний - с ИВЛ, а 95% мочевых инфекций - с мочевыми катетерами. Ведущими возбудителями пневмонии, связанной с ИВЛ (НПИВЛ), были Enterobacteriaceae (64%), Р. aeruginosa (21%), S. aureus (20%), среди возбудителей ангиогенных инфекций - коагулазонегативные стафилококки (36%), энтерококки (16%), S. aureus (13%), грибы (12%) При мочевых инфекциях доминировали грибы и Enterobacteriaceae. На основании первичной локализации очага инфекции можно судить о предполагаемой этиологии заболевания, что, безусловно, служит надежным ориентиром выбора эмпирического режима антибактериальной терапии. Принципы планирования антибактериальной терапии инфекцийУчитывая указанные сложности лечения госпитальных инфекций (тяжесть состояния пациентов, часто их полимикробный характер, возможность выделения при нозокомиальных инфекциях возбудителей с множественной устойчивостью к антибактериальным средствам), необходимо выделить следующие принципы рационального применения антибиотиков в ОРИТ:
Выбор антибактериального препарата можно осуществлять на основании установленной этиологии заболевания и уточненной чувствительности возбудителя к антибиотикам - этиотропная терапия. В ситуациях, когда возбудитель неизвестен, назначение препарата осуществляют на основании эмпирического подхода. В последнем случае антибиотик выбирают исходя из известного перечня микроорганизмов, вызывающих инфекцию определенной локализации, и знания основных тенденций антибиотикорезистентности наиболее вероятных возбудителей. Понятно, что в клинической практике наиболее часто до уточнения этиологии заболевания врач вынужден использовать эмпирический подход. При тяжелых инфекциях следует придерживаться принципа максимальной стартовой эмпирической терапии - назначение препаратов, действующих на максимальное число потенциальных возбудителей заболеваний данной локализации. Придерживаться указанного принципа особенно необходимо при лечении НПИВЛ, перитонита, тяжёлого сепсиса. Поскольку установлено, что в случае неадекватной стартовой терапии достоверно растет риск летального исхода (например, для НПИВЛ - в 3 раза). Под адекватной эмпирической антибактериальной терапией понимают:
Эмпирическая и целенаправленная этиотропная антибактериальная терапияПроведение рациональной антибактериальной терапии госпитальных инфекций в ОРИТ невозможно без современных знаний об этиологической структуре заболеваний и антибиотикорезистентности их возбудителей. На практике это означает необходимость выявления возбудителя микробиологическими методами, определение его антибиотикочувствительности. Обсуждать выбор оптимального антибактериального препарата можно только после проведения указанных исследований. Однако в практической медицине ситуация не так проста, и даже самые современные микробиологические методики часто не в состоянии дать врачу быстрый ответ или даже вообще уточнить возбудителя заболевания. В подобном случае на помощь приходят знания о наиболее вероятных возбудителях конкретных форм госпитальных инфекций, спектре природной активности антибиотиков и уровне приобретенной устойчивости к ним в данном регионе и конкретном стационаре. Последнее условие наиболее важно при планировании антибактериальной терапии госпитальных инфекций в ОРИТ, где наиболее высок уровень приобретенной устойчивости. Поскольку недостаточная оснащенность микробиологических лабораторий и низкий уровень стандартизации исследований по оценке антибиотикочувствительности не позволяют сформировать реальное представление об эпидемиологической ситуации в медицинском учреждении и разработать взвешенные рекомендации по лечению. Этиология инфекционных болезней - основной фактор, определяющий стратегию и тактику антибактериальной терапии. В связи с невозможностью экспрессной диагностики бактериальных инфекций и оценки антибиотикочувствительности их возбудителей назначение антибактериальной терапии в реанимации обычно происходит эмпирически. Несмотря на значительное разнообразие возбудителей инфекций в реанимации, ведущую роль в их этиологии играет лишь ограниченное количество видов бактерий. По признакам общности спектров природной чувствительности к антибактериальным препаратам и механизмов устойчивости их можно объединить в четыре группы:
Перечисленные возбудители - источники более 80% случаев инфекций мочевыводящих и дыхательных путей, интраабдоминальных и области хирургического вмешательства, а также ангиогенных инфекций. Для инфекций различной локализации характерны некоторые особенности этиологии. Например, ангиогенные инфекции чаще всего вызываются стафилококками, а мочевыводящих путей - грамотрицательными микроорганизмами, энтерококки практически не поражают дыхательных путей. Для интраабдоминальных и раневых инфекций свойственно наибольшее этиологическое разнообразие. Приведенные данные могут служить первым ориентиром для выбора эмпирической антибактериальной терапии. Очень простым и, в ряде случаев, крайне полезным исследованием бывает микроскопия мазка из очага инфекции. К сожалению, такому простому методу в большинстве учреждений уделяют крайне мало внимания, несмотря на то что информация о превалировании грамположительной или грамотрицательной флоры крайне важна для выбора антибактериальной терапии. Еще более важная информация может быть получена через сутки после взятия патологического материала и его первичного посева. При хорошо налаженной работе лаборатории, ее связи с клиникой врач может получить ответ на вопрос «Участвуют ли в инфекционном процессе стафилококки, энтерококки, энтеробактерии или Р. aeruginosa?». Зная спектр природной чувствительности перечисленных групп микроорганизмов и особенности распространения резистентности в конкретном учреждении, можно осуществить корректировку антибактериальной терапии и, с высокой степенью вероятности, обеспечить ее адекватность. Наиболее точная коррекция антибактериальной терапии возможна после получения окончательных результатов идентификации возбудителя и оценки его антибиотикочувствительности. Ниже приведены данные о спектре природной чувствительности основных групп возбудителей инфекций в ОРИТ и о препаратах выбора для лечения заболеваний известной этиологии. Выбор антибиотика при лечении инфекций известной этиологииВ разделе основное внимание уделено средствам выбора для лечения тяжелых и госпитальных инфекций. Для лечения внебольничных и легких форм можно применять другие антибактериальные препараты. Streptococcus pyogenesПрепарат выбора - бензилпенициллин. Равно эффективны аминопенициллины, другие ß-лактамы преимуществами не обладают. Приобретенная устойчивость к ß-лактамам не описана. Альтернативные препараты макролиды и линкозамиды (показаны при аллергии к ß-лактамам). Распространенность приобретенной устойчивости варьирует в различных географических регионах. Streptococcus pneumoniaeПрепараты выбора бензилпенициллин (парентерально), амоксициллин (per os) другие ß-лактамы. Распространенность приобретенной устойчивости варьирует в различных географических регионах. При пневмониях, вызванных пенициллинрезистентными пневмококками, бензилпенициллин и амоксициллин эффективны, при менингитах - возможны неудачи. Альтернативные препараты - цефалоспорины III-IV поколений (цефотаксим, цефтриаксон, цефепим), карбапенемы (при менингитах - меропенем), антипневмококковые фторхинолоны. При менингитах, вызванных пенициллинрезистентными пневмококками, возможно применение гликопептидов Streptococcus agalactiaeПрепараты выбора бензилпенициллин, ампициллин, целесообразно комбинировать с аминогликозидами (гентамицин). Приобретенная устойчивость - редкое явление. Альтернативные препараты цефалоспорины III поколения, карбапенемы. Зеленящие стрептококкиПрепараты выбора бензилпенициллин, ампициллин. При эндокардитах и тяжелых генерализованных инфекциях - в комбинации с аминогликозидами (гентамицин). Приобретённая устойчивость - редкое явление. Альтернативные препараты цефалоспорины III поколения, карбапенемы. При аллергии к ß-лактамам можно использовать гликопептиды. Enterococcus faecalisПрепараты выбора - бензилпенициллин или ампициллин в комбинации с гентамицином или стрептомицином - эндокардиты и тяжелые генерализованные инфекции, ампициллин, нитрофураны или фторхинолоны - инфекции мочевыводящих путей. Приобретенная устойчивость встречают к пенициллинам, часто - к аминогликозидам. Альтернативные препараты гликопептиды (целесообразно комбинировать с аминогликозидами), оксазолидиноны. Приобретённая устойчивость к гликопептидам среди штаммов, описанных в России, - редкость. Enterococcus faeciumПрепараты выбора гликопептиды (лучше - в комбинации с аминогликозидами). Однако возможны неудачи в лечении. Приобретенная устойчивость к гликопептидам среди штаммов, описанных в России, - редкость. Альтернативные препараты оксазолидиноны Метициллинчувствительные стафилококкиПрепараты выбора оксациллин, защищенные аминопенициллины, цефалоспорины I поколения. Приобретённая устойчивость при чувствительности к оксациллину одновременная устойчивость к перечисленным выше ß-лактамам неизвестна. Альтернативные препараты фторхинолоны с повышенной активностью в отно-шении грамположительных микроорганизмов (левофлоксацин, моксифлоксацин, гатифлоксацин), оксазолидиноны. При тяжелых инфекциях и аллергии немедленного типа к ß-лактамам можно использовать гликопептиды, но их эффективность ниже. Метициллинрезистентные стафилококкиПрепараты выбора гликопептиды. Приобретенная устойчивость выявлены единичные устойчивые штаммы. Альтернативные препараты оксазолидиноны. Иногда эффективны фторхинолоны, фузидовая кислота, рифампицин, ко-тримоксазол, фосфомицин. Однако схемы лечения ими точно не определены. Corynebacterium diphtheriaeПрепараты выбора макролиды и линкозамиды. Распространенность приобретенной устойчивости изучена недостаточно. Альтернативные препараты бензилпенициллин, рифампицин, тетрациклины. CorynebacteriumjeikeiumПрепараты выбора гликопептиды. Распространенность приобретенной устойчивости изучена недостаточно. Альтернативные препараты не определены. Listeria monocytogenesПрепараты выбора ампициллин, лучше в комбинации с гентамицином. Цефалоспорины неэффективны. Распространенность приобретенной устойчивости изучена недостаточно. Альтернативный препарат - ко-тримоксазол. Клиническое значение выявленной in vitro чувствительности к макролидам, тетрациклинам и хлорамфениколу не определено. Bacillus anthracisПрепараты выбора бензилпенициллин, ампициллин. Цефалоспорины мало эффективны. Приобретенная устойчивость опубликованы единичные сообщения об обнаружении устойчивых штаммов. Альтернативные препараты фторхинолоны, тетрациклины, макролиды, хлорамфеникол. Bacillus cereusПрепараты выбора клиндамицин, ванкомицин. Приобретенная устойчивость изучена недостаточно. Альтернативные препараты гентамицин, ципрофлоксацин. Nocardia asteroidesПрепарат выбора - ко-тримоксазол. Приобретенная устойчивость изучена недостаточно. Альтернативные препараты имипенем + гликопептиды, амикацин + цефалоспорины, миноциклин (их применение недостаточно обосновано). Neisseria meningitidisПрепарат выбора - бензилпенициллин. Приобретенная устойчивость опубликованы единичные сообщения об обнаружении устойчивых штаммов. Альтернативные препараты цефалоспорины III поколения, хлорамфеникол. Haemophilus spp.Препараты выбора аминопенициллины. Приобретенная устойчивость в отдельных регионах распространены устойчивые штаммы, продуцирующие β-лактамазы (их доля в России - менее 5-6%). Альтернативные препараты цефалоспорины III поколения, хлорамфеникол. При локализованных инфекциях - цефалоспорины II поколения, защищенные пенициллины, фторхинолоны. Legionella spp.Препараты выбора эритромицин, азитромицин или кларитромицин (лучше в комбинации с рифампицином). Приобретенная устойчивость отсутствует. Альтернативные препараты фторхинолоны, доксициклин, ко-тримоксазол. Vibrio choleraeПрепараты выбора фторхинолоны. Приобретенная устойчивость описаны единичные случаи. Альтернативные препараты доксициклин, ко-тримоксазол. EnterobacteriaceaeПрепараты выбора при лечении тяжелых инфекций, вызываемых микроорганизмами семейства Enterobacteriaceae, - β-лактамные антибиотики. Однако в зависимости от природной чувствительности отдельных видов необходимо использовать различные препараты. Обосновано также применение аминогликозидов и фторхинолонов. Выбор конкретных препаратов основывают на данных о локализации и тяжести инфекции, распространении устойчивости. Escherichia coli, Proteus mirabilisПрепараты выбора защищённые аминопенициллины, цефалоспорины II-III поколения. Приобретённая устойчивость широко распространена. Альтернативные препараты - фторхинолоны, аминогликозиды, цефалоспорины IV поколения, цефоперазон + сульбактам, карбапенемы (их различные комбинации). Ко всем альтернативным препаратам возможно формирование устойчивости. Однако наименее вероятно - к амикацину, карбапенемам (устойчивость к ним - крайне редкое явление). Klebsiella spp , Proteus vulgaris, Citrobacter diversusПрепараты выбора защищенные аминопенициллины, цефалоспорины II-III поколения. Приобретённая устойчивость широко распространена. Альтернативные препараты фторхинолоны, аминогликозиды, цефоперазон + сульбактам, цефалоспорины IV поколения, карбапенемы (их различные комбинации). Ко всем альтернативным препаратам возможно формирование устойчивости. Однако наименее вероятно - к амикацину, карбапенемам (устойчивость к ним - крайне редкое явление). Enterobacter spp , Citrobacter freundii, Serratia spp , Morganella morganii, Providencia stuartii, Providencia rettgeriПрепараты выбора цефалоспорины III-IV поколения. Приобретенная устойчивость широко распространена. Альтернативные препараты фторхинолоны, аминогликозиды, цефоперазон + сульбактам, цефалоспорины IV поколения, карбапенемы (их различные комбинации). Ко всем альтернативным препаратам возможно формирование устойчивости. Однако наименее вероятно - к амикацину, карбапенемам (есть единичные сообщения об устойчивых штаммах). Shigella spp.Препараты выбора фторхинолоны. Приобретенная устойчивость - единичные случаи. Альтернативные препараты ко-тримоксазол, ампициллин Salmonella spp., в том числе S. typhi (генерализованные инфекции). Препараты выбора фторхинолоны, цефалоспорины III поколения (цефотаксим, цефтриаксон). Приобретенная устойчивость - единичные случаи. Альтернативные препараты хлорамфеникол, ко-тримоксазол, ампициллин. Pseudomonas aeruginosaПрепараты выбора цефтазидим + аминогликозиды. Приобретенная устойчивость широко распространена. Альтернативные препараты защищенные антипсевдомонадные пенициллины (применяют только в комбинации с аминогликозидами), ципрофлоксацин, цефалоспорины IV поколения, карбапенемы, полимиксин В. Возможно развитие устойчивости ко всем альтернативным препаратам. Burkholderia cepaciaПрепараты выбора карбапенемы, ципрофлоксацин, цефтазидим и цефоперазон, уреидопенициллины (в том числе защищенные), ко-тримоксазол и хлорамфеникол. Однако режимы терапии недостаточно обоснованы. Приобретенная устойчивость - достаточно частое явление. При муковисцидозе особенно часто встречают штаммы, устойчивые ко всем указанным препаратам. Stenotrophomonas maltophiliaПрепарат выбора - ко-тримоксазол. Приобретенная устойчивость - относительно редкое явление. Альтернативные препараты тикарциллин + клавулановая кислота, доксициклин и миноциклин, хлорамфеникол. Они могут обладать достаточной активностью, но режимы их использования недостаточно обоснованы. Достаточно часто встречают штаммы, устойчивые к альтернативным препаратам. Acinetobacter spp.Препараты выбора в связи с крайним разнообразием чувствительности штаммов обоснование режимов эмпирической терапии затруднено. Наиболее часто предлагают комбинации карбапенемов или цефтазидима с аминогликозидами (в основном с амикацином), а также фторхинолонов с аминогликозидами. Может оказаться эффективным назначение ампициллина или цефоперазона с сульбактамом (за счет собственной антибактериальной активности последнего). Приобретенная устойчивость ко всем используемым препаратам широко распространена. Clostridium petfringensПрепараты выбора бензилпенициллин, возможно, в комбинации с клиндамицином. Приобретенная устойчивость изучена недостаточно. Альтернативные препараты практически все ß-лактамы, хлорамфеникол, метронидазол. Clostridium difficileПрепарат выбора - метронидазол. Приобретённая устойчивость не описана. Альтернативный препарат - ванкомицин. Actinomyces israelii и другие анаэробные актиномицетыПрепараты выбора бензилпенициллин, аминопенициллины. Приобретенная устойчивость не описана. Альтернативные препараты цефалоспорины III поколения, эритромицин и клиндамицин, доксициклин. PeptostreptococcusПерпарат выбора - бензилпенициллин. Приобретенная устойчивость распространена незначительно. Альтернативные препараты другие ß-лактамы, метронидазол клиндамицин, эритромицин, доксициклин. BacteroidesfragilisПерпарат выбора - метронидазол. Приобретенная устойчивость - крайне редкое явление. Альтернативные препараты клиндамицин, карбапенемы, цефокситин, защищенные пенициллины. ilive.com.ua Ванкомицин-резистентные энтерококки как возбудители внутрибольничных инфекцийГрамположительные энтерококки являются составной частью нормальной микрофлоры кишечника человека и животных. Однако при попадании в раны и стерильные полости организма они могут вызывать раневые инфекции, уретриты, перитониты, внутриполостные абсцессы, а также бактериемии (сепсис) и эндокардиты. По частоте внутрибольничных инфекций (почти 12 %) энтерококки занимают третье место в больницах Германии [1]. Наиболее типичной для энтерококков является инфекция мочевыводящих путей, особенно часто катетер-ассоциированная. При лабораторной диагностике следует быть осторожным при интерпретации бактериологического анализа средней порции мочи, полученной без катетера, так как возможна контаминация. Обнаружение энтерококков в крови или суставной жидкости всегда имеет клиническое значение. В США энтерококки являются третьей по частоте причиной бактериемий (bloodstream infection — BSI) [2]. Характерной клинической картиной у пожилых пациентов с иммуносупрессией является энтерококковый эндокардит, который почти никогда не бывает острым или подострым, скорее напоминает Endocarditis lenta с более частым поражением митрального клапана [3]. Проникновение энтерококков в кровь из кишечника или урогенитального тракта может способствовать возникновению очагов инфекций, не связанных с инвазивными процедурами (менингиты, плевриты, инфекции мягких тканей). Однако энтерококки никогда не вызывали пневмонию. Поэтому нахождение этих микроорганизмов в эндотрахеальном секрете следует рассматривать как артефакт, не имеющий клинического значения [3]. Будучи типичными оппортунистами, не обладающими по сравнению, например, с коагулазоположительными стафилококками (S.aureus) повышенной вирулентностью, но постоянно присутствующими в кишечной микрофлоре, энтерококки приобрели особенное значение в эпоху расцвета антибиотикотерапии. Селективными по отношению к энтерококкам считаются прежде всего современные пероральные цефалоспорины и фторхинолоны. Гликопептиды (в том числе ванкомицин), принадлежащие к числу резервных антибиотиков для метициллин-резистентного стафилококка (MRSA), в свою очередь, оказывают селективное давление, способствующее отбору ванкомицин-резистентных энтерококков. Микробиологическая характеристика и лабораторная диагностикаДолгое время энтерококки относили к роду Streptococcus серогруппы D. Согласно последней классификации, более 30 различных видов энтерококков выделены в самостоятельное семейство Enterococcaceae. Энтерококки представляют собой грамположительные стрепто- или диплококки, являются факультативными анаэробами, неприхотливы к питательным средам, растут в диапазоне температур от 10 до 45 °С. На кровяном агаре образуют мелкие или средние (1–3 мм), белые или сероватые, плоские колонии, иногда с зеленящим гемолизом. В отличие от стафилококков и коринебактерий не образуют каталазу. По биохимическим свойствам энтерококки разделены на 5 групп. Наиболее часто встречающиеся Enterococcus faecalis (80–90 % всех лабораторных изолятов) и Enterococcus faecium (около 10 %) принадлежат ко второй биохимической группе, представители которой разлагают маннозу и аргинин, но не действуют на сорбозу. Эти два вида энтерококков имеют существенные отличия в спектре антибиотикорезистентности (см. ниже), поэтому идентификация вида имеет важное диагностическое значение. Современно оснащенные микробиологические лаборатории с биохимическими анализаторами или современными тест-системами, разумеется, дифференцируют клинически значимый микроорганизм до вида без промежуточных этапов и долгих размышлений. Но для небольших рутинных клинических лабораторий представленная табл. 1, содержащая дифференциально-диагностические признаки важнейших видов энтерококков, будет, надеюсь, не лишней.
Механизмы и методы определения антибиотикорезистентностиЭнтерококки, особенно E.faecium, обладают широким спектром природной (конститутивной; intrinsic) резистентности. Кроме того, они легко приобретают устойчивость ко многим другим антибиотикам. Табл. 2 демонстрирует существенные различия природной и индуцибельной антибиотикорезистентности E.faecalis и E.faecium. Так, например, резистентность к стрептограминам (хинупристин/дальфопристин) у E.faecalis является природным свойством, а E.faecium способен такую устойчивость приобрести, но может быть и чувствительным. Спектр антибиотиков, которые целесообразно включать в антибиотикограмму, также значительно различается. Отсюда вытекает важность видовой дифференциации этих двух наиболее распространенных видов энтерококков.
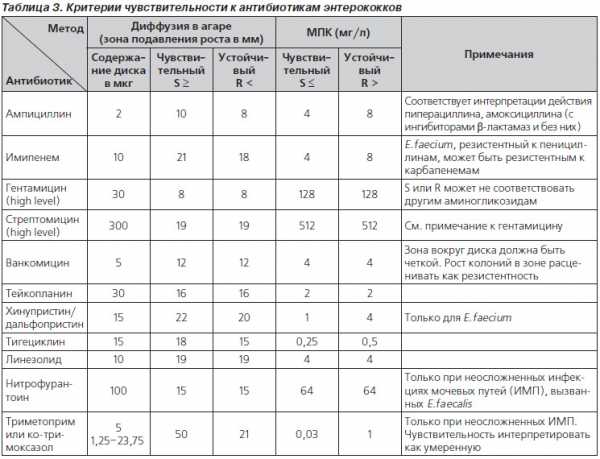
Как уже неоднократно подчеркивалось, определение чувствительности к антибиотикам in vitro требует особо тщательной стандартизации. Важнейший справочный материал каждой рутинной лаборатории — это таблицы интерпретации зон подавления роста для агар-диффузионного метода (в мм) или минимальных подавляющих концентраций (МПК, в мг/л) антибиотиков в жидкой среде. В табл. 3 представлены критерии оценки чувствительности энтерококков к антибиотикам (breakpoint) согласно последним рекомендациям экспертов Европейского комитета по определению чувствительности к антибиотикам (EUCAST) [5]. Обращает на себя внимание практическое отсутствие возможности интерпретировать штамм как умеренно чувствительный ко многим антибиотикам. Например, к важнейшему препарату ванкомицину указана единственная граница (breakpoint): 12 мм для дисков или 4 мг/л для МПК. Для дисков: все, что больше или равно, интерпретируется как чувствительность, все, что меньше, — резистентность; для МПК: все, что меньше или равно, интерпретируется как чувствительность, все, что больше, — резистентность. При определении чувствительности к ванкомицину агар-диффузионным методом особое внимание уделяется четкости границы подавления роста. Если зона ингибиции больше 12 мм, но края нечеткие и в зоне наблюдается рост единичных колоний, штамм энтерококков нельзя расценивать как чувствительный и следует подвергнуть дополнительным методам исследования, например генетическому анализу.
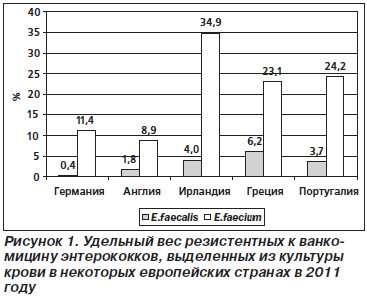
Enterococcus faecalis обычно чувствителен к ампициллину, мезлоциллину, пиперациллину и карбапенемам. Особенность действия аминогликозидов заключается в неэффективности монотерапии в связи с наличием природной резистентности низкого уровня (low level). Но в случае подтверждения in vitro чувствительности к высоким дозам (high level) гентамицина или стрептомицина и к пенициллинам стандартным выбором для лечения инфекций, вызванных E.faecalis, включая эндокардиты, являются ампициллин с гентамицином, которые в комбинации обнаруживают синергический эффект. Enterococcus faecium ко всем вышеперечисленным антибиотикам устойчив. В типичном случае действенны гликопептиды, линезолид, хинупристин/дальфопристин и тигециклин. Природно устойчивы к ванкомицину два довольно редких вида энтерококков: E.gallinarum и E.casseliflavus. E.faecium в последнее время все чаще приобретает устойчивость к тейкопланину и ванкомицину. Описаны единичные штаммы, резистентные к резервным антибиотикам линезолиду и тигециклину. Несмотря на то, что устойчивость к хинолонам не является конститутивной, действие этой группы антибиотиков настолько непостоянно, что они не рассматриваются как препараты выбора для энтерококков и не включены в таблицы EUCAST-breakpoints. Триметоприм как монопрепарат или в комбинации с сульфаметоксазолом (ко-тримоксазол) может быть рекомендован только для лечения неосложненных инфекций мочевыводящих путей. При этом, если при тестировании in vitro энтерококк не проявляет себя резистентным, в антибиотикограмме он должен быть обозначен как умеренно чувствительный. Особое значение придается ванкомицин-резистентным энтерококкам. Различают шесть фенотипов резистентности энтерококков к ванкомицину (от Van A до Van G) [1, 2]. Фенотипы Van A и Van В были впервые описаны в 1988 году и имеют наибольшее клиническое значение. Чаще всего встречается тип Van A, который передается плазмидой и характеризуется высокой резистентностью не только к ванкомицину (МПК = 8–1000 мг/л), но и к тейкопланину (МПК = 4–512 мг/л). Энтерококки с индуцибельным Van В фенотипом резистентны к ванкомицину (МПК = 4–512 мг/л), но чувствительны к тейкопланину (МПК = 0,5–1 мг/л). Фенотип Van С кодируется хромосомными генами двух редких видов энтерококков E.gallinarum и E.casseliflavus, характеризуется довольно низким уровнем ванкомицин-резистентности (МПК = 2–32 мг/л) и обладает типично конститутивным свойством, не способен к индукции или передаче. Остальные 3 фенотипа ванкомицин-резистентности (Van D, Van E и Van G) встречаются очень редко, кодируются хромосомными генами и чаще всего чувствительны к тейкопланину. Излишне говорить, что различные фенотипы резистентности имеют соответствующие генетические маркеры, по которым прослеживают их распространенность и циркуляцию, включая межвидовую передачу генов резистентности. Так, в США был выделен ванкомицин-резистентный Staphylococcus aureus от трех пациентов. В одном из трех случаев была доказана in vivo возможность конъюгативной передачи Van A-гена резистентности от ванкомицин-резистентного E.faecalis (VRE) метициллин-резистентному S.aureus (MRSA) [6]. Распространенность ванкомицин-резистентных энтерококков (VRE)Удельный вес ванкомицин-резистентных энтерококков (VRE) является наряду с MRSA индикатором глобального распространения мультирезистентных возбудителей нозокомиальных инфекций. Сведения о географическом распространении VRE в странах Европы можно получить на сайте Европейской сети надзора за антибиотикорезистентностью (EARS-Net [7]). EARS-Net организована в 1999 году на базе Европейского центра по контролю за заболеваемостью (ECDC). Она собирает и анализирует данные из микробиологических лабораторий 28 европейских стран, определяющих чувствительность к антибиотикам клинически релевантных изолятов (в основном из культуры крови) семи видов бактерий. Для энтерококков ведется отдельная для E.faecalis и E.faecium регистрация резистентности к ампициллину, ванкомицину и высоким дозам (high level) гентамицина. На рис. 1 представлены данные EARS-Net из некоторых европейских стран за 2011 год, которые отчетливо демонстрируют различную степень распространенности ванкомицин-резистентности у этих двух видов энтерококков.
В США, по данным NNIS, за период с 1998 по 2004 г. ванкомицин-резистентные энтерококки (все виды) были изолированы у пациентов отделений реанимации и интенсивной терапии в 13,9 %, у стационарных больных — в 12 % и у амбулаторных больных — в 4 % случаев инфекций (цит. по [2]). Факторы риска приобретения пациентами ванкомицин-резистентных энтерококков мало чем отличаются от любых других мультирезистентных возбудителей внутрибольничных инфекций, в том числе продуцентов b-лактамаз (подробнее см. статью «Беседы с микробиологом» о ESBL-продуцентах // Болезни и антибиотики. 2011, № 2. — С. 13-19). Из особенностей энтерококков следует отметить преимущественное поражение пожилых пациентов, связанное с частотой катетеризации мочевого пузыря и операций в области брюшной полости. По сравнению с грамотрицательными возбудителями энтерококки обладают повышенной устойчивостью во внешней среде, включая высыхание и высокие температуры. Это обстоятельство следует учитывать при планировании гигиенических мероприятий в больницах. Кстати, лаборатории по контролю больничной гигиены в Германии, в частности эффективности дезинфекции, обработки белья, посуды и т.д., используют Enterococcus faecium как тест-штамм. ЗаключениеЭтой статьей мы завершаем цикл, посвященный микроорганизмам из списка ESKAPE, которые, по мнению Американского общества инфекционных болезней (Infectious Diseases Society of America — IDSA), доставляют клиницистам больше всего проблем, связанных с резистентностью к антибиотикам (Болезни и антибиотики. 2011, № 2; 2012, № 1, № 2). Разумеется, проблема лабораторной диагностики внутрибольничных инфекций этим не ограничивается, и микробиологу всегда есть о чем рассказать клиницисту. Однако вопросы должен ставить клиницист. В ожидании вопросов остаюсь в вашем распоряжении, Елена Демиховская, доктор медицинских наук, профессор, ведущий микробиолог ведомства здравоохранения федеральной земли Мекленбург — Верхняя Померания, Росток, Германия. www.mif-ua.com Enterococcus faecalis - что это такое? Симптомы и лечениеЭнтерококки – большое семейство анаэробов и аэробов. То есть эти бактерии способны жить как в среде свободного кислорода, так и в кислотной. Энтерококки очень распространены. Среди бактерий есть безопасные для человека штаммы, которые применяют в пищевой и лекарственной промышленности. Однако определенные их виды опасны для здоровья людей. Особенно они «любят» женский пол. Ранее энтерококки входили в семейство стрептококков класса Д, однако недавно им отвели отдельную классификацию. Сегодня известно около 15 видов изученных бактерий этой группы, однако ученые до сих пор не исследовали и не классифицировали до конца некоторые из них. Повышение энтерококков в анализахВ анализах врачи обращают внимание на enterococcus faecalis. Что это такое? Это бактерия, которая относится к условно-патогенным и при превышении ее нормы способна вызывать патологические состояния. Сегодня мы рассмотрим энтерококк фекальный более подробно и выясним, как его лечить, если он обнаружен в мазке у женщин.
Часто у женщин при взятии мазка на анализы обнаруживается повышенное количество enterococcus faecalis. Что это такое и чем чревато? Относясь к условно-патогенным, они в любом случае находятся в организме, но при увеличении их количества эти бактерии могут вызывать воспаления, если попадают в среду, несвойственную для них – к примеру, мочевыводящие пути или почки, куда они проникают из прямой кишки. В этом случае может наблюдаться бессимптомная бактериурия (повышенное содержание микроорганизма в моче). Во влагалище они могут присутствовать в незначительном количестве. Если же их больше, обычно по причине недостаточной гигиены, они вызывают воспаления. Установлено, что и в моче, и в мазке энтерококки обычно обнаруживаются одновременно либо, после жизнедеятельности во влагалище, они начинают «обживать» и мочеполовые пути, вызывая такие заболевания, как цистит или даже пиелонефрит. Другие причины обнаружения enterococcus faecalis в мазке у женщин – это незащищенные половые контакты и использование чужих средств гигиены или вещей больного. Установлено, что при снижении иммунитета энтерококк, который до этого присутствовал в организме в весьма скромных количествах, начинает разрастаться. Обычно снижение иммунитета происходит на фоне приема антибиотиков или других средств. Каковы симптомы?Женщин, у которых нашли enterococcus faecalis в мазке, беспокоят:
Также женщины страдают от общего плохого самочувствия. Наблюдается снижение работоспособности и быстрая утомляемость. Энтерококк фекальный при беременностиОбнаруженный у беременных enterococcus faecalis - что это такое? У женщин в положении эта бактерия встречается в 5 раз чаще, так как их гормональный фон снижается наряду с иммунитетом. Наличие энтерококка фекального в моче говорит о том, что в мочевыводящих путях есть воспаление, которое требует немедленного вмешательства. Беременным следует очень тщательно подбирать антибактериальную терапию. В первые месяцы после родов грудничок находится под тщательным присмотром врача. У ребенка также может быть обнаружено увеличенное содержание энтерококка в кале. Молодая мать может заразить ребенка и через грудное молоко. Как лечат фекальный энтерококк?Если обнаружен enterococcus faecalis в мазке у женщин, существует определенная схема лечения, которая включает следующие средства. Основная терапия энтероккока фекального, в особенности учитывая его резистентность ко многим видам антибиотиков, заключается в использовании бактериофагов (буквально «уничтожителей бактерий», которые относятся к вирусам). Они встраиваются в клетку бактерии и убивают ее. Бактериофаги превосходят антибиотики меньшим количеством побочных эффектов и безопасностью для кишечника. Их зачастую назначают детям и тем, кто имеет противопоказания к приему более агрессивных средств. Взрослым женщинам, которые не находятся в положении, назначают антибактериальные препараты – "Цефтриаксон", "Ампициллин", "Гентамицин". Энтерококки чувствительны к этим видам лекарств. Дополнительная терапияВ качестве дополнительной терапии показаны витаминно-минеральные комплексы и средства для местного применения – свечи, влагалищные таблетки. Женщинам назначают спринцевание и физиотерапию. Спринцеваться рекомендуется растворами с добавлением в воду перекиси водорода и соды. Они снижают неприятную симптоматику (в частности, выделения) и нормализуют микрофлору влагалища. Основная цель лечения – снизить содержание энтерококков до нормы. Если их количество не превышает ее, то они безопасны для организма и не вызывают никаких неприятных симптомов. Сегодня мы рассмотрели enterococcus faecalis - что это такое, какие симптомы вызывает, и как устраняется эта бактерия. fb.ru Энтерококк (enterococcus). Фекальный энтерококк лечение. Энтерококки у детейРанее энтерококков не выделяли отдельно, а относили к группе стрептококков класса Д, но по современным классификациям их выделили отдельно. Эти микробы относятся к группе грамположительных микробов, их сегодня насчитывается около 15 видов, хотя не все еще хорошо изучены и классифицированы. К основным, на которые врачи обращают особое внимание, относят enterococcus faecalis (фекальный энтерококк) и enterococcus faecium (энтерококк фэциум). Энтерококки являются важнейшими представителями микрофлоры человека и могут влиять на жизнедеятельность, как в положительном, так и в отрицательном плане. О микроорганизме Энтерококки – это мелкие, круглой формы микробы, не образующие капсул и спор, они могут жить в условиях отсутствия кислорода в организме, или в кислородной среде. Поэтому, они широко распространены и достаточно устойчивы к факторам внешней среды. Расти микробы могут при плюсовых температурах, но самыми оптимальными для них являются 37-39 градусов, то есть температура внутри тела. Энтерококк может длительно сохраняться во внешней среде, устойчив к средствам дезинфекции и может жить на различных поверхностях в доме, он хорошо выдерживает кипячение и нагревание. Энтерококки являются достаточно частыми возбудителями различных заболеваний – так, зачастую они повинны в развитии инфекции мочевых и половых путей, инфекций внутри брюшной полости, поражений органов малого таза, а также могут вызывать осложнение раневых процессов, поражений сердца с формированием эндокардита. На долю энтерококка приходится до 10% от всех внутрибольничных инфекций, особенно в отношении мочевых путей, раневых процессов и общих септических процессов. Однако, параллельно этим, энтерококки являются составной частью нормальной микрофлоры человеческого желудочно-кишечного тракта, могут играть важную роль в формировании защитных свойств в области слизистых оболочек тонкого и толстого кишечника и формирования кишечного иммунитета. Энтерококки в основном обитают в области тонкого кишечника, хотя достаточно значительное их количество обитает и в области толстой кишки. Обнаруживают энтерококки и в области мочеиспускательного канала у мужчин и женщин, детей, в области половых органов, а также на слизистых оболочках полости рта. Клинические материалы со всех возможных областей тела человека в подавляющем большинстве своем содержат фекальный энтерококк, и оставшиеся часть составляет энтерококк фэсциум. Все остальные энтерококки никак не относятся к вариантам нормальной микрофлоры кишечника и могут быть либо заносными и непатогенными, либо опасными в плане здоровья. Если определяться с количеством энтерококков в кишечнике, то в среднем от всего объема микрофлоры они составляют около 1%, то есть их в сто с лишним раз меньше, чем бифидофлоры и лактофлоры, у детей нормами энтерококка является его количество в одном грамме фекалий – 10 в 6-10 в 7 степени. Заселение кишечника этими микробами происходит у детей в первые часы жизни, при первых прикладываниях ребенка к груди, у искусственников процесс заселения микробной флорой кишечника идет труднее и дольше, так как они получают микробов с предметов, воздуха и рук персонала. Если рассматривать патогенные свойства энтерококков – то отдельные его штаммы могут вызывать инфекции моче-полового тракта у детей и взрослых, особенно если перед этим пациенты принимали большое количество антибиотиков, препаратов, подавляющих иммунитет или подвергались различным инвазивным методам обследования. Самыми патогенными для детей являются:
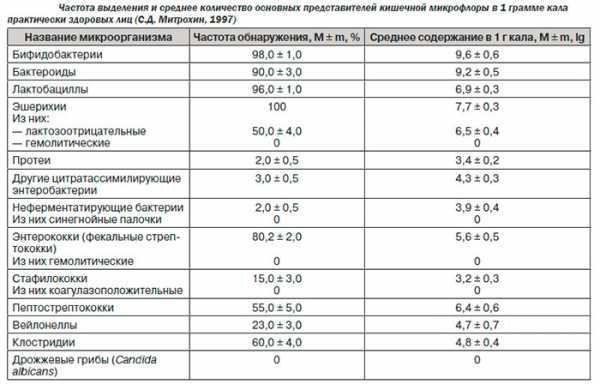
Совершенно несправедливо было бы говорить о том, что энтерококки – это либо нейтральные, либо вредные микробы. Это далеко не так, он активно применяются в различных отраслях промышленности и медицины, принося человеку достаточно большую пользу. Энтерококки активно применяются в синтезе, изготовлении и в составе многих лекарственных препаратов, они входят в состав многих биологически активных добавок и биологических препаратов. Так – энтерококки добавляются как активные ингредиенты некоторых лекарственных препаратов (пробиотики), которые применяют для коррекции микробной флоры кишечника и лечения всеми любимого «дисбактериоза», восстановления нормальной микрофлоры кишечника. Так, энтерококки входят в состав всем известных препаратов бифиформ, линекс, внутри них содержится непатогенный и очень устойчивый к антибиотикам штамм фекального энтерококка, который вытесняет из кишечника патогенные формы других микробов, давая возможность роста нормальной микрофлоры. Также фекальный энтерококк входит в состав всем известного препарата против несварения и диареи – хилак-форте, опять же за счет способности подавлять рост патогенных форм микроорганизмов. В медикаментозные препараты добавляют исходно непатогенные, выведенные искусственным путем штаммы энтерококков, которые предназначаются для использования в пищевой и медицинской промышленности. Эти микробы предназначаются для недлительного пребывания внутри организма человека без нанесения ему никакого вреда. Спустя одну-две недели эти формы энтерококка полностью покидают организм человека. Согласно санпину 2.3.2.2340-08, утвержденному постановлением главного государственного санитарного врача РФ от 18 февраля 2008 г. № 13 вполне разрешается использование в пищевом производстве энтерококков enterococcus durans и enterococcus faecium. Применение энтерококков в пищевой промышленности Применение фекальных энтерококков в пищевой промышленности давно отлажено, их используют как особые закваски за счет способности энтерококка расщеплять молочный сахар (лактозу), что приводит к сбраживанию и скисанию молока. Кроме того, энтерококки активно подавляют рост в молоке болезнетворные микроорганизмы, при этом сами энтерококки достаточно устойчивы к действию органических кислот продуктов, соли и высоких температур. Энтерококки широко применяются в приготовлении сыров, причем в зависимости от штаммов, сыры получаются разных вкусов. Так, при помощи энтерококка производят сыр камамбер, некоторых других и при производстве творога. Патогенные штаммы Энтерококки могут проявлять свою патогенность в местах, которые не типичны для их пребывания. Так, они могут быть опасны при проникновении в мочевыводящие пути их области прямой кишки, особенно если восходящим путем проникают в мочевой пузырь или почки. Иногда возникает состояние асимптомной бактериурии (наличие микробов в моче без признаков инфекции). Беспокойство должно вызвать увеличение количества микробов в моче выше 10 в 5 степени в одном миллилитре средней порции мочи. Во всех остальных случаях можно говорить о дефектах сбора и загрязнении мочи выделениями с половых путей и тары. Если же моча забирается катетером или есть проявления инфекции – тогда диагностическим могут быть любые количества микроба. Особенно актуально наличие микробов в моче у детей и у беременных женщин, так как их иммунитет физиологически снижен. Кроме бессимптомной бактериурии могут быть варианты развития циститов, пиелонефритов, уретритов или простатитов. Если наличие только микробов в моче не всегда требует немедленного лечения. То вот наличие клиники – это сигнал к немедленному началу терапии. Основном виновником инфекций мочевой системы становится именно фекальный энтерококк, другие формы в мочеполовом тракте не встречаются. Такое состояние обычно лечится антибиотиками, которые обладают уротропностью в зависимости от возраста и состояния организма. Энтерококки могут быть в составе нормальной микрофлоры влагалища, но в норме их там насчитывается незначительное количество, не более десятой части процента. Обычно повышение количества энтерококка в мазке говорит о нарушении интимной гигиены и сопровождается развитием клиники вульвитов или вульвовагинитов, особенно у маленьких девочек. Анализ кала Зачастую энтерококки выявляются в анализе кала на микрофлору (анализ на дисбактериоз). В норме у детей:
Если обнаруживается избыточный рост энтерококка, на этот случай существует особая рекомендация приказ минздрава РФ № 231 от 9 июня 2003 г. Об утверждении отраслевого стандарта «протокол ведения больных. Дисбактериоз кишечника». По данным этого приказа при патогенном росте энтерококка показано применение бактериофагов – интести-бактериофаг, жидкий, принимаемый несколько раз в день натощак. Детям его применяют с рождения, но разводят водой, также возможно применение бактериофагов в клизмах. При этом активность бактериофагов к энтерококку ниже, чем при применении антибиотиков, но учитывая высокую устойчивость энтерококка к антибиотикам – бактериофаги более безопасны, у них нет противопоказаний и меньше побочных эффектов. puzkarapuz.ru |
г.Самара, ул. Димитрова 131 [email protected] |
 |





 Enterococcus faecalis в норме находится в ротовой полости и в кишечнике (преимущественно тонкая и толстая кишка) человека. Превышение его нормы встречается как у мужчин, так и у женщин, однако наиболее часто он разрастается у будущих мам, чей организм перестраивается, и потому особенно уязвим. Также наблюдается рост enterococcus faecalis у женщин при злоупотреблении антибиотиками. Врачи считают, что пациенты часто заражаются и при лечении в условиях стационара, так как энтерококк фекальный очень устойчив во внешней среде. Более того, многие антибиотики не оказывают на него никакого губительного воздействия.
Enterococcus faecalis в норме находится в ротовой полости и в кишечнике (преимущественно тонкая и толстая кишка) человека. Превышение его нормы встречается как у мужчин, так и у женщин, однако наиболее часто он разрастается у будущих мам, чей организм перестраивается, и потому особенно уязвим. Также наблюдается рост enterococcus faecalis у женщин при злоупотреблении антибиотиками. Врачи считают, что пациенты часто заражаются и при лечении в условиях стационара, так как энтерококк фекальный очень устойчив во внешней среде. Более того, многие антибиотики не оказывают на него никакого губительного воздействия.