|
|
||||||||||
|
Антибиотики, действующие на уровне трансляции. Рибосомы и антибиотикиРибосомы как точки приложения антибиотиков
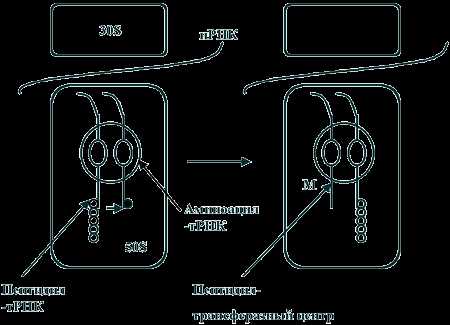
В основе действия многих известных в настоящее время наиболее эффективных антибиотиков лежит блокирование синтеза белка на рибосомах. Высокая эффективность этих замечательных лекарственных препаратов объясняется тем, что они подавляют синтез белка бактериальных 70 S-рибосом, не влияя при этом на рибосомы эукариотических клеток. В других случаях избирательная токсичность антибиотиков обусловлена значительно более высокой проницаемостью бактериальных мембран по сравнению с мембранами животных клеток. Список антибиотиков, действующих на уровне рибосом, весьма велик. Антибиотики действующие на рибосомы подавляют белковый синтез. Нарушение синтеза белка может происходить на всех уровнях, начиная с процесса считывания информации с ДНК и кончая взаимодействием с рибосомами – блокирование связывания транспортной т-РНК с 30S субъединицами рибосом (аминогликозиды), с 50S субъединицами рибосом (макролиды) или с информационной и-РНК (на 30S субъединице рибосом – тетрациклины). Хотя аминогликозидный антибиотик стрептомицин, неомицины и канамицин содержат в своем составе одну общую структурную группу, тем не менее все они связываются с рибосомами по-разному. В результате своеобразного действия стрептомицина рибосомы начинают неправильно считывать код. При этом неправильно считывается главным образом первое основание кодона. в группу антибиотиков действующих на рибосомы входят: – аминогликозиды, – макролиды, – тетрациклины, – фузидин, – линкомицин, – хлорамфеникол (левомицетин), нарушающий синтез белка микробной клеткой на стадии переноса аминокислот на рибосомы. Механизм действия аминогликозидов связан с необратимым угнетением синтеза белка на уровне рибосом у чувствительных к ним микроорганизмов. В отличие от других ингибиторов синтеза белка аминогликозиды оказывают не бактериостатическое, а бактерицидное действие. Аминогликозиды проникают в клетки бактерий путем пассивной диффузии через поры наружной мембраны и путем активного транспорта. Транспорт аминогликозидов через цитоплазматическую мембрану зависит от переноса электронов в дыхательной цепи, этот этап поступления их в клетку, т.н. энергозависимый этап I, является лимитирующим. Транспорт аминогликозидов через цитоплазматическую мембрану замедляется или полностью блокируется в присутствии ионов Ca2+ или Mg2+, в гиперосмолярной среде, при низких значениях pH и в анаэробных условиях. После проникновения в клетку аминогликозиды связываются со специфическими белками-рецепторами на 30S субъединице рибосом бактерий. 30S субъединица состоит из 21 белка и одной молекулы 16S рРНК (рибосомной РНК). Например, в связывании стрептомицина с рибосомами участвуют по крайней мере три белка и, возможно, 16S рРНК. Аминогликозиды нарушают рибосомальный белковый синтез несколькими путями: 1) антибиотики связываются с 30S субъединицей рибосомы и нарушают инициацию синтеза белка, фиксируя комплекс, состоящий из 30S- и 50S- субъединиц, на инициирующем кодоне иРНК; это приводит к накоплению аномальных инициирующих комплексов (т.н. моносомы) и прекращению дальнейшей трансляции; 2) связываясь с 30S субъединицей рибосомы, аминогликозиды нарушают считывание информации с РНК, что приводит к преждевременному окончанию трансляции и отсоединению рибосомного комплекса от белка, синтез которого не завершен; 3) кроме того, аминогликозиды вызывают одиночные аминокислотные замены в растущей полипептидной цепи, в результате чего образуются дефектные белки. Синтезирующиеся аномальные белки, встраиваясь в цитоплазматическую мембрану, могут нарушать ее структуру, изменять проницаемость и ускорять проникновение аминогликозидов внутрь клетки. Этот этап транспорта аминогликозидов — т.н. энергозависимый этап II. В результате постепенного разрушения цитоплазматической мембраны происходит выход из бактериальной клетки ионов, крупных молекул, белков. Бактерицидный эффект аминогликозидов, возможно, объясняется тем, что образование неполноценных полипептидов и угнетение синтеза нормальных белков в микробной клетке приводит к нарушению важных функций клетки, поддерживающих ее жизнеспособность, к нарушению структуры и функции цитоплазматической мембраны бактерий и, в конечном счете, приводит к гибели клетки. Принцип действия макролидов Антимикробное действие макролидов обусловлено нарушением синтеза белка на этапе трансляции в клетках чувствительных микроорганизмов. Молекула антибиотика способна обратимо связываться с каталитическим пептидил-трансферазным центром (P-site) рибосомальной 50S-субъединицы и вызывать отщепление комплекса пептидил-тРНК (представляющего собой растущую пептидную цепь) от рибосомы. При этом нарушается цикличность последовательного присоединения пептидной цепи к пептидил-трансферазному центру (P-site) и акцепторному аминоацил-тРНК-центру (A-site) 50S-субъединицы, то есть ингибируются реакции транслокации и транспептидации . В результате приостанавливается процесс формирования и наращивания пептидной цепи. Связывание макролидов с 50S-субъединицей возможно на любой стадии рибосомального цикла. Выявлено, что 14- и 16-членные макролиды отличаются по особенностям связывания с различными доменами пептидил-трансферазного центра. Рис. 2. Механизм синтеза белка в рибосоме микробной клетки. (M - точка приложения действия макролидов) Механизм действия тетрациклинов Тетрациклины являются специфическими ингибиторами как EF-Tu-промотируемого, так и неэнзиматического связывания аминоацил-тРНК с A-участком бактериальной 70S рибосомы. Тетрациклины подавляют также кодон-зависимое связывание аминоацил-тРНК с изолированной 30S субчастицей бактериальной рибосомы. В соответствии с этим, место специфического связывания тетрациклинов с рибосомой обнаружено на 30S субчастице рибосомы, хотя при более высоких концентрациях они могут связываться также и с 50S субчастицей, обнаруживая побочные действия. Интересно, что когда тройственный комплекс Aa-tRNA•EF-Tu•GTP взаимодействует с 70S рибосомой в присутствии тетрациклиновых антибиотиков, то ГТФ гидролизуется и EF-G•GDP освобождается, но аминоацил-тРНК не остаётся связанной. По-видимому, антибиотик, будучи связан где-то в районе тРНК-связывающего A-участка на 30S субчастице рибосомы, ослабляет сродство участка к тРНК, приводя к её плохому удержанию после ухода EF-Tu. Хотя тетрациклины не действуют на эукариотические клетки из-за непроницаемости их мембран для антибиотика, в эукариотических бесклеточных системах они тоже оказываются сильными ингибиторами, подавляя связывание аминоацил-тРНК с 80S рибосомами. Хлорамфеникол, с одной стороны, подавляет синтез белка на конечном этапе биосинтеза белковой молекулы, а с другой стороны, тормозит освобождение рибосомы от пептида, что также приводит к остановке синтеза белка. Под действием хлорамфеникола немедленно прекращается синтез белка микроорганизмов, синтез нуклеиновых кислот и пептидогликана при этом продолжается, хотя идет с меньшей скоростью. Все это указывает на то, что первичной мишенью действия хлорамфеникола является синтез белка. Нуклеиновые кислоты, синтезированные в присутствии антибиотика, отличаются от кислот, синтезированных при его отсутствии. Показано, что под влиянием антибиотика нарушается нормальный синтез РНК, в то время как синтез ДНК непосредственно не тормозится им. Участок лабильного связывания хлорамфеникола локализован на 50S субчастице рибосом. Хлорамфеникол полностью ингибирует реакцию пуромицина с пептидил-тРНК, выступая его конкурентным ингибитором. При этом синтез пептида полностью прекращается, и он остается связанным с рибосомами. Предполагают, что хлорамфеникол имитирует аминоацильный конец молекулы аминоацил-тРНК, а его дихлорацетамидная группировка соответствует аминоацилу. Местом действия хлорамфеникола является A-участок 50S субчастицы рибосом, где антибиотик конкурирует с аминоацильным концом молекулы аминоацил-тРНК, препятствуя ее вхождению в A-участок, что сопровождается подавлением биосинтеза белка. В нормальном состоянии бактерия синтезирует белки, которые выходят из бактериальной клетки через специальную транспортную систему, образованную микропорами. В момент выхода наружу белковая молекула вытянута и очень похожа на спагетти. Наш организм воспринимает такие белки как токсины, угнетающие, например, наш иммунитет. При введении антибиотиков нарушается синтез белков в бактериальной клетке за счёт того, что хлорамфеникол останавливает рибосому на полпути к полному синтезу белков. В результате в месте, где синтез был прерван, образуется «узел», который уже не даёт пройти белку через микропоры. Чем меньше в бактерии таких микропор, тем раньше она погибнет, так как они быстрее «засорятся» белковыми «узлами». Кроме того, блокировка пор ведёт к выработке молекулярного сигнала стресса, способствующего увеличению концентраций протеиназ, способствующих расщеплению белков внутри клетки и, в частности, гибели бактериальной клетки. Под действием хлорамфеникола нарушение включения аминокислот в белки сопровождается изменением физико-химических свойств рибосом. Антибиотик оказывает влияние на процессы образования и самих рибосомных частиц, приводя к появлению недостроенных рибосом с резко ослабленной способностью к синтезу белка. Таким образом, нарушение синтеза белка под действием хлорамфеникола на конечной стадии его биосинтеза может осуществляться несколькими путями: во-первых, хлорамфеникол может нарушить образование нормально функционирующих рибосом клетки; во-вторых, взаимодействуя с тРНК, антибиотик может нарушить ее связь с рибосомой; в-третьих, возможно образование комплекса антибиотик — рибосома, нарушающего деятельность рибосом. Одним из наиболее возможных путей подавления белкового синтеза под действием хлорамфеникола служит образование ассоциации антибиотика с рибосомами. Эта взаимосвязь происходит мгновенно, не зависит от наличия определенной энергии и времени инкубации, легко обратима. Она может нарушаться при наличии в среде некоторых антибиотиков. Механизм действия фузидиевой кислоты. Фузидиевая кислота ингибирует в микробной клетке синтез белка на уровне рибосом, взаимодействует с фактором элонгации микробной клетки (фактор элонгации G, у прокариот — белок тип 2), который необходим для процесса транслокации на рибосоме при образовании пептидных связей. Под действием фузидиевой кислоты образуется комплекс фактора элонгации с органическими фосфатами клетки, нарушается функция фактора элонгации, гидролиз гуанозинфосфатов и прекращается процесс удлинения пептидной связи и синтез белка. Фузидиевая кислота не нарушает синтез белка в клетках эукариотов, так как они имеют другие типы факторов элонгации (тип 1 и Tu), которые не чувствительны к действию фузидиевой кислоты. В высоких концентрациях фузидиевая кислота ингибирует так же процесс связывания тРНК с донорским участком рибосом. В высоких концентрациях фузидиевая кислота может подавлять репликацию некоторых вирусов, что может быть связано с цитотоксическим действием этих концентраций Линкомицин по антибактериальному действию близок к макролидам. Ингибирует синтез белка на уровне рибосом, действует бактериостатически или бактерицидно (в зависимости от концентрации). Механизм антимикробного действия связан с подавлением синтеза белка, блокирования образования полисомальных функциональных комплексов и трансляции связанных с транспортной РНК аминокислот. Место связывания антибиотика — пептидилтрансферазный центр на 50S субчастице. Линкомицин конкурирует с хлорамфениколом за связывание с рибосомой. По-видимому, он ингибирует взаимодействие акцепторного субстрата с пептидилтрансферазным центром по конкурентному механизму. В 2009 году была получена нобелевская премия за картирование рибосомы. Это позволит ученым в скором времени синтезировать новые, еще более эффективные антибиотики, воздействующие на рибосому. Рибосомы как точки приложения антибиотиков doc4web.ru Рибосомы как точки приложения антибиотиков
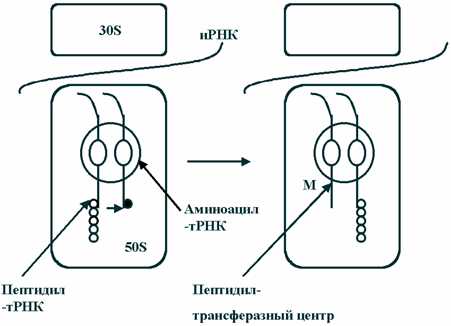
В основе действия многих известных в настоящее время наиболее эффективных антибиотиков лежит блокирование синтеза белка на рибосомах. Высокая эффективность этих замечательных лекарственных препаратов объясняется тем, что они подавляют синтез белка бактериальных 70 S-рибосом, не влияя при этом на рибосомы эукариотических клеток. В других случаях избирательная токсичность антибиотиков обусловлена значительно более высокой проницаемостью бактериальных мембран по сравнению с мембранами животных клеток. Список антибиотиков, действующих на уровне рибосом, весьма велик. Антибиотики действующие на рибосомы подавляют белковый синтез. Нарушение синтеза белка может происходить на всех уровнях, начиная с процесса считывания информации с ДНК и кончая взаимодействием с рибосомами – блокирование связывания транспортной т-РНК с 30S субъединицами рибосом (аминогликозиды), с 50S субъединицами рибосом (макролиды) или с информационной и-РНК (на 30S субъединице рибосом – тетрациклины). Хотя аминогликозидный антибиотик стрептомицин, неомицины и канамицин содержат в своем составе одну общую структурную группу, тем не менее все они связываются с рибосомами по-разному. В результате своеобразного действия стрептомицина рибосомы начинают неправильно считывать код. При этом неправильно считывается главным образом первое основание кодона. в группу антибиотиков действующих на рибосомы входят: – аминогликозиды, – макролиды, – тетрациклины, – фузидин, – линкомицин, – хлорамфеникол (левомицетин), нарушающий синтез белка микробной клеткой на стадии переноса аминокислот на рибосомы. Механизм действия аминогликозидов связан с необратимым угнетением синтеза белка на уровне рибосом у чувствительных к ним микроорганизмов. В отличие от других ингибиторов синтеза белка аминогликозиды оказывают не бактериостатическое, а бактерицидное действие. Аминогликозиды проникают в клетки бактерий путем пассивной диффузии через поры наружной мембраны и путем активного транспорта. Транспорт аминогликозидов через цитоплазматическую мембрану зависит от переноса электронов в дыхательной цепи, этот этап поступления их в клетку, т.н. энергозависимый этап I, является лимитирующим. Транспорт аминогликозидов через цитоплазматическую мембрану замедляется или полностью блокируется в присутствии ионов Ca2+ или Mg2+, в гиперосмолярной среде, при низких значениях pH и в анаэробных условиях. После проникновения в клетку аминогликозиды связываются со специфическими белками-рецепторами на 30S субъединице рибосом бактерий. 30S субъединица состоит из 21 белка и одной молекулы 16S рРНК (рибосомной РНК). Например, в связывании стрептомицина с рибосомами участвуют по крайней мере три белка и, возможно, 16S рРНК. Аминогликозиды нарушают рибосомальный белковый синтез несколькими путями: 1) антибиотики связываются с 30S субъединицей рибосомы и нарушают инициацию синтеза белка, фиксируя комплекс, состоящий из 30S- и 50S- субъединиц, на инициирующем кодоне иРНК; это приводит к накоплению аномальных инициирующих комплексов (т.н. моносомы) и прекращению дальнейшей трансляции; 2) связываясь с 30S субъединицей рибосомы, аминогликозиды нарушают считывание информации с РНК, что приводит к преждевременному окончанию трансляции и отсоединению рибосомного комплекса от белка, синтез которого не завершен; 3) кроме того, аминогликозиды вызывают одиночные аминокислотные замены в растущей полипептидной цепи, в результате чего образуются дефектные белки. Синтезирующиеся аномальные белки, встраиваясь в цитоплазматическую мембрану, могут нарушать ее структуру, изменять проницаемость и ускорять проникновение аминогликозидов внутрь клетки. Этот этап транспорта аминогликозидов — т.н. энергозависимый этап II. В результате постепенного разрушения цитоплазматической мембраны происходит выход из бактериальной клетки ионов, крупных молекул, белков. Бактерицидный эффект аминогликозидов, возможно, объясняется тем, что образование неполноценных полипептидов и угнетение синтеза нормальных белков в микробной клетке приводит к нарушению важных функций клетки, поддерживающих ее жизнеспособность, к нарушению структуры и функции цитоплазматической мембраны бактерий и, в конечном счете, приводит к гибели клетки. Принцип действия макролидов Антимикробное действие макролидов обусловлено нарушением синтеза белка на этапе трансляции в клетках чувствительных микроорганизмов. Молекула антибиотика способна обратимо связываться с каталитическим пептидил-трансферазным центром (P-site) рибосомальной 50S-субъединицы и вызывать отщепление комплекса пептидил-тРНК (представляющего собой растущую пептидную цепь) от рибосомы. При этом нарушается цикличность последовательного присоединения пептидной цепи к пептидил-трансферазному центру (P-site) и акцепторному аминоацил-тРНК-центру (A-site) 50S-субъединицы, то есть ингибируются реакции транслокации и транспептидации . В результате приостанавливается процесс формирования и наращивания пептидной цепи. Связывание макролидов с 50S-субъединицей возможно на любой стадии рибосомального цикла. Выявлено, что 14- и 16-членные макролиды отличаются по особенностям связывания с различными доменами пептидил-трансферазного центра. Рис. 2. Механизм синтеза белка в рибосоме микробной клетки. (M - точка приложения действия макролидов) Механизм действия тетрациклинов Тетрациклины являются специфическими ингибиторами как EF-Tu-промотируемого, так и неэнзиматического связывания аминоацил-тРНК с A-участком бактериальной 70S рибосомы. Тетрациклины подавляют также кодон-зависимое связывание аминоацил-тРНК с изолированной 30S субчастицей бактериальной рибосомы. В соответствии с этим, место специфического связывания тетрациклинов с рибосомой обнаружено на 30S субчастице рибосомы, хотя при более высоких концентрациях они могут связываться также и с 50S субчастицей, обнаруживая побочные действия. Интересно, что когда тройственный комплекс Aa-tRNA•EF-Tu•GTP взаимодействует с 70S рибосомой в присутствии тетрациклиновых антибиотиков, то ГТФ гидролизуется и EF-G•GDP освобождается, но аминоацил-тРНК не остаётся связанной. По-видимому, антибиотик, будучи связан где-то в районе тРНК-связывающего A-участка на 30S субчастице рибосомы, ослабляет сродство участка к тРНК, приводя к её плохому удержанию после ухода EF-Tu. Хотя тетрациклины не действуют на эукариотические клетки из-за непроницаемости их мембран для антибиотика, в эукариотических бесклеточных системах они тоже оказываются сильными ингибиторами, подавляя связывание аминоацил-тРНК с 80S рибосомами. Хлорамфеникол, с одной стороны, подавляет синтез белка на конечном этапе биосинтеза белковой молекулы, а с другой стороны, тормозит освобождение рибосомы от пептида, что также приводит к остановке синтеза белка. Под действием хлорамфеникола немедленно прекращается синтез белка микроорганизмов, синтез нуклеиновых кислот и пептидогликана при этом продолжается, хотя идет с меньшей скоростью. Все это указывает на то, что первичной мишенью действия хлорамфеникола является синтез белка. Нуклеиновые кислоты, синтезированные в присутствии антибиотика, отличаются от кислот, синтезированных при его отсутствии. Показано, что под влиянием антибиотика нарушается нормальный синтез РНК, в то время как синтез ДНК непосредственно не тормозится им. Участок лабильного связывания хлорамфеникола локализован на 50S субчастице рибосом. Хлорамфеникол полностью ингибирует реакцию пуромицина с пептидил-тРНК, выступая его конкурентным ингибитором. При этом синтез пептида полностью прекращается, и он остается связанным с рибосомами. Предполагают, что хлорамфеникол имитирует аминоацильный конец молекулы аминоацил-тРНК, а его дихлорацетамидная группировка соответствует аминоацилу. Местом действия хлорамфеникола является A-участок 50S субчастицы рибосом, где антибиотик конкурирует с аминоацильным концом молекулы аминоацил-тРНК, препятствуя ее вхождению в A-участок, что сопровождается подавлением биосинтеза белка. В нормальном состоянии бактерия синтезирует белки, которые выходят из бактериальной клетки через специальную транспортную систему, образованную микропорами. В момент выхода наружу белковая молекула вытянута и очень похожа на спагетти. Наш организм воспринимает такие белки как токсины, угнетающие, например, наш иммунитет. При введении антибиотиков нарушается синтез белков в бактериальной клетке за счёт того, что хлорамфеникол останавливает рибосому на полпути к полному синтезу белков. В результате в месте, где синтез был прерван, образуется «узел», который уже не даёт пройти белку через микропоры. Чем меньше в бактерии таких микропор, тем раньше она погибнет, так как они быстрее «засорятся» белковыми «узлами». Кроме того, блокировка пор ведёт к выработке молекулярного сигнала стресса, способствующего увеличению концентраций протеиназ, способствующих расщеплению белков внутри клетки и, в частности, гибели бактериальной клетки. Под действием хлорамфеникола нарушение включения аминокислот в белки сопровождается изменением физико-химических свойств рибосом. Антибиотик оказывает влияние на процессы образования и самих рибосомных частиц, приводя к появлению недостроенных рибосом с резко ослабленной способностью к синтезу белка. Таким образом, нарушение синтеза белка под действием хлорамфеникола на конечной стадии его биосинтеза может осуществляться несколькими путями: во-первых, хлорамфеникол может нарушить образование нормально функционирующих рибосом клетки; во-вторых, взаимодействуя с тРНК, антибиотик может нарушить ее связь с рибосомой; в-третьих, возможно образование комплекса антибиотик — рибосома, нарушающего деятельность рибосом. Одним из наиболее возможных путей подавления белкового синтеза под действием хлорамфеникола служит образование ассоциации антибиотика с рибосомами. Эта взаимосвязь происходит мгновенно, не зависит от наличия определенной энергии и времени инкубации, легко обратима. Она может нарушаться при наличии в среде некоторых антибиотиков. Механизм действия фузидиевой кислоты. Фузидиевая кислота ингибирует в микробной клетке синтез белка на уровне рибосом, взаимодействует с фактором элонгации микробной клетки (фактор элонгации G, у прокариот — белок тип 2), который необходим для процесса транслокации на рибосоме при образовании пептидных связей. Под действием фузидиевой кислоты образуется комплекс фактора элонгации с органическими фосфатами клетки, нарушается функция фактора элонгации, гидролиз гуанозинфосфатов и прекращается процесс удлинения пептидной связи и синтез белка. Фузидиевая кислота не нарушает синтез белка в клетках эукариотов, так как они имеют другие типы факторов элонгации (тип 1 и Tu), которые не чувствительны к действию фузидиевой кислоты. В высоких концентрациях фузидиевая кислота ингибирует так же процесс связывания тРНК с донорским участком рибосом. В высоких концентрациях фузидиевая кислота может подавлять репликацию некоторых вирусов, что может быть связано с цитотоксическим действием этих концентраций Линкомицин по антибактериальному действию близок к макролидам. Ингибирует синтез белка на уровне рибосом, действует бактериостатически или бактерицидно (в зависимости от концентрации). Механизм антимикробного действия связан с подавлением синтеза белка, блокирования образования полисомальных функциональных комплексов и трансляции связанных с транспортной РНК аминокислот. Место связывания антибиотика — пептидилтрансферазный центр на 50S субчастице. Линкомицин конкурирует с хлорамфениколом за связывание с рибосомой. По-видимому, он ингибирует взаимодействие акцепторного субстрата с пептидилтрансферазным центром по конкурентному механизму. В 2009 году была получена нобелевская премия за картирование рибосомы. Это позволит ученым в скором времени синтезировать новые, еще более эффективные антибиотики, воздействующие на рибосому. Рибосомы как точки приложения антибиотиков globuss24.ru Антибиотики, действующие на уровне трансляции — МегаЛекцииНа рис. I.21 приведены некоторые широко распространенные антибиотики, являющиеся ингибиторами биосинтеза белка у бактерий. Многие из них находят применение не только как лекарственные средства, но и как превосходные инструменты исследования механизма различных этапов биосинтеза белка. Биохимический анализ мутантов бактерий, устойчивых к действию конкретных антибиотиков, позволяет обнаруживать сайты действия антибиотиков на рибосомах и идентифицировать изменения компонентов системы белкового синтеза под влиянием этих мутаций. Как правило, для возникновения устойчивости к антибиотику достаточно замены одного аминокислотного остатка из ~7500 остатков белков, составляющих бактериальную рибосому. То же самое относится и к ~4500 основаниям рибосомных РНК. В этом случае не только замены одиночных оснований в рРНК, но и модификация (метилирование) единственного основания могут приводить к подобным эффектам. Рассмотрим механизм действия некоторых антибиотиков более подробно.
Рис. I.21. Антибиотики – ингибиторы биосинтеза белка у бактерий
Пуромицин. Этот антибиотик представляет собой производное нуклеозидов и является структурным аналогом 3’-концевой аминоацилированной группировки тРНК. Прямыми экспериментами было показано, что пуромицин конкурентным образом замещает очередную аминоацил-тРНК в A-сайте рибосом в процессе трансляции. Он участвует в акте образования пептидной связи в рибосоме, подменяя при этом очередную аминоацил-тРНК. В ходе реакции транспептидации происходит переброска C-конца растущего пептида от пептидил-тРНК на свободную аминогруппу его аминоацильного остатка, что приводит к освобождению пептидил-пуромицина из рибосом и прекращению биосинтеза белка. Пуромицин одинаково хорошо подавляет биосинтез белка как прокариотическими, так и эукариотическими рибосомами. Хлорамфеникол. Участок лабильного связывания этого антибиотика локализован на 50S субчастице рибосом. Хлорамфеникол полностью ингибирует реакцию пуромицина с пептидил-тРНК, выступая его конкурентным ингибитором. При этом синтез пептида полностью прекращается, и он остается связанным с рибосомами. Предполагают, что хлорамфеникол имитирует аминоацильный конец молекулы аминоацил-тРНК, а его дихлорацетамидная группировка соответствует аминоацилу. Местом действия хлорамфеникола является A-участок 50S субчастицы рибосом, где антибиотик конкурирует с аминоацильным концом молекулы аминоацил-тРНК, препятствуя ее вхождению в A-участок, что сопровождается подавлением биосинтеза белка. В отличие от пуромицина хлорамфеникол ингибирует только бактериальные рибосомы. Сходным механизмом действия обладают антибиотики линкомицин и спарсомицин. Последний делает ассоциацию пептидил-тРНК с P-участком рибосом более прочной. При этом хлорамфеникол и линкомицин способны вытеснять спарсомицин из его комплекса с рибосомами. Фусидовая кислота– антибиотик стероидной природы, блокирует биосинтез белка на стадии транслокации. Его мишенью является не столько сама рибосома, сколько белковый фактор EF2(EF-G), который, как указывалось выше, необходим для GTP-зависимой транслокации. Фусидовая кислота не влияет на взаимодействие фактора EF2(EF-G) и GTP с пре-транслоцированной рибосомой и последующее расщепление GTP. По-видимому, антибиотик препятствует диссоциации указанного комплекса и сопряженной с ней транслокации. По тому же механизму фусидовая кислота подавляет трансляцию эукариотическими рибосомами. Тетрациклины. Антибиотики тетрациклинового ряда специфически связываются с 30S субчастицей рибосом, подавляя реакцию аминоацил-тРНК с рибосомами и свободными 30S субчастицами в присутствии матрицы, но не нарушая связывание самого матричного полинуклеотида. Предполагают, что тетрациклины взаимодействуют с акцепторным тРНК-связывающим участком 30S субчастицы рибосом. Стрептомицин и другие аминогликозидные антибиотики. Стрептомицин (антибиотик углеводной природы) специфически взаимодействует с определенным структурным белком 30S субчастицы рибосом, блокируя стадию инициации трансляции. В присутствии стрептомицина наблюдается стимуляция связывания аминоацил-тРНК, не соответствующих кодонам мРНК, находящимся в данный момент в акцепторном A-участке рибосом. В итоге происходит ошибочное включение аминокислот в полипептидные цепи синтезируемых белков. Это может проявляться в фенотипической супрессии нонсенс-мутаций у мутантных бактерий. Аминогликозидные антибиотики также вызывают неспецифическое связывание матричных полинуклеотидов рибосомами. Следствием является, например трансляция одноцепочечных ДНК рибосомами в бесклеточных системах в присутствии аминогликозидов. Трансляция у эукариот Бактерии обладают единственной универсальной системой трансляции, основные механизмы функционирования которой были кратко рассмотрены выше. В отличие от этого, клетки животных кроме основной системы трансляции, локализованной в цитоплазме, имеют дополнительную систему трансляции митохондрий, которая по ряду свойств приближается к бактериальной. Клетки растений обладают еще одной дополнительной системой биосинтеза белка, функционирующей в хлоропластах. Большинство данных о механизмах биосинтеза белка у эукариот было получено с использованием бесклеточных белоксинтезирующих систем (подробнее о принципах функционирования таких систем см. в разделе 7.4). В последнее время важные результаты о механизмах трансляции у эукариот были получены с использованием стабильно трансформированных клеток животных и растений, выращиваемых в культуре. В ходе этих исследований установлено, что у растений и животных в основном функционируют одни и те же механизмы трансляции. Ниже будут рассмотрены основные молекулярные механизмы, участвующие в трансляции мРНК у эукариот, с привлечением данных, полученных главным образом на дрожжах S. cerevisiae. megalektsii.ru Рибосомы как точки приложения антибиотиков | Антибиотики – это группа соединений природного происхождения или их полусинтетических и синтетических аналогов, обладающих антимикробным или противоопухолевым действием. В основе действия многих известных в настоящее время наиболее эффективных антибиотиков лежит блокирование синтеза белка на рибосомах. Высокая эффективность этих замечательных лекарственных препаратов объясняется тем, что они подавляют синтез белка бактериальных 70 S-рибосом, не влияя при этом на рибосомы эукариотических клеток. В других случаях избирательная токсичность антибиотиков обусловлена значительно более высокой проницаемостью бактериальных мембран по сравнению с мембранами животных клеток. Список антибиотиков, действующих на уровне рибосом, весьма велик. Антибиотики действующие на рибосомы подавляют белковый синтез. Нарушение синтеза белка может происходить на всех уровнях, начиная с процесса считывания информации с ДНК и кончая взаимодействием с рибосомами – блокирование связывания транспортной т-РНК с 30S субъединицами рибосом (аминогликозиды), с 50S субъединицами рибосом (макролиды) или с информационной и-РНК (на 30S субъединице рибосом – тетрациклины). Хотя аминогликозидный антибиотик стрептомицин, неомицины и канамицин содержат в своем составе одну общую структурную группу, тем не менее все они связываются с рибосомами по-разному. В результате своеобразного действия стрептомицина рибосомы начинают неправильно считывать код. При этом неправильно считывается главным образом первое основание кодона. в группу антибиотиков действующих на рибосомы входят: – аминогликозиды, – макролиды, – тетрациклины, – фузидин, – линкомицин, – хлорамфеникол (левомицетин), нарушающий синтез белка микробной клеткой на стадии переноса аминокислот на рибосомы. Механизм действияаминогликозидовсвязан с необратимым угнетением синтеза белка на уровне рибосом у чувствительных к ним микроорганизмов. В отличие от других ингибиторов синтеза белка аминогликозиды оказывают не бактериостатическое, а бактерицидное действие. Аминогликозиды проникают в клетки бактерий путем пассивной диффузии через поры наружной мембраны и путем активного транспорта. Транспорт аминогликозидов через цитоплазматическую мембрану зависит от переноса электронов в дыхательной цепи, этот этап поступления их в клетку, т.н. энергозависимый этап I, является лимитирующим. Транспорт аминогликозидов через цитоплазматическую мембрану замедляется или полностью блокируется в присутствии ионов Ca2+или Mg2+, в гиперосмолярной среде, при низких значениях pH и в анаэробных условиях. После проникновения в клетку аминогликозиды связываются со специфическими белками-рецепторами на 30S субъединице рибосом бактерий. 30S субъединица состоит из 21 белка и одной молекулы 16S рРНК (рибосомной РНК). Например, в связывании стрептомицина с рибосомами участвуют по крайней мере три белка и, возможно, 16S рРНК. Аминогликозиды нарушают рибосомальный белковый синтез несколькими путями: 1) антибиотики связываются с 30S субъединицей рибосомы и нарушают инициацию синтеза белка, фиксируя комплекс, состоящий из 30S- и 50S- субъединиц, на инициирующем кодоне иРНК; это приводит к накоплению аномальных инициирующих комплексов (т.н. моносомы) и прекращению дальнейшей трансляции; 2) связываясь с 30S субъединицей рибосомы, аминогликозиды нарушают считывание информации с РНК, что приводит к преждевременному окончанию трансляции и отсоединению рибосомного комплекса от белка, синтез которого не завершен; 3) кроме того, аминогликозиды вызывают одиночные аминокислотные замены в растущей полипептидной цепи, в результате чего образуются дефектные белки. Синтезирующиеся аномальные белки, встраиваясь в цитоплазматическую мембрану, могут нарушать ее структуру, изменять проницаемость и ускорять проникновение аминогликозидов внутрь клетки. Этот этап транспорта аминогликозидов — т.н. энергозависимый этап II. В результате постепенного разрушения цитоплазматической мембраны происходит выход из бактериальной клетки ионов, крупных молекул, белков. Бактерицидный эффект аминогликозидов, возможно, объясняется тем, что образование неполноценных полипептидов и угнетение синтеза нормальных белков в микробной клетке приводит к нарушению важных функций клетки, поддерживающих ее жизнеспособность, к нарушению структуры и функции цитоплазматической мембраны бактерий и, в конечном счете, приводит к гибели клетки. Принцип действия макролидовАнтимикробное действие макролидов обусловлено нарушением синтеза белка на этапе трансляции в клетках чувствительных микроорганизмов. Молекула антибиотика способна обратимо связываться с каталитическим пептидил-трансферазным центром (P-site) рибосомальной 50S-субъединицы и вызывать отщепление комплекса пептидил-тРНК (представляющего собой растущую пептидную цепь) от рибосомы. При этом нарушается цикличность последовательного присоединения пептидной цепи к пептидил-трансферазному центру (P-site) и акцепторному аминоацил-тРНК-центру (A-site) 50S-субъединицы, то есть ингибируются реакции транслокации и транспептидации . В результате приостанавливается процесс формирования и наращивания пептидной цепи. Связывание макролидов с 50S-субъединицей возможно на любой стадии рибосомального цикла. Выявлено, что 14- и 16-членные макролиды отличаются по особенностям связывания с различными доменами пептидил-трансферазного центра.
Рис. 2.Механизм синтеза белка в рибосоме микробной клетки.(M - точка приложения действия макролидов) Механизм действия тетрациклиновТетрациклины являются специфическими ингибиторами как EF-Tu-промотируемого, так и неэнзиматического связывания аминоацил-тРНК с A-участком бактериальной 70S рибосомы. Тетрациклины подавляют также кодон-зависимое связывание аминоацил-тРНК с изолированной 30S субчастицей бактериальной рибосомы. В соответствии с этим, место специфического связывания тетрациклинов с рибосомой обнаружено на 30S субчастице рибосомы, хотя при более высоких концентрациях они могут связываться также и с 50S субчастицей, обнаруживая побочные действия. Интересно, что когда тройственный комплекс Aa-tRNA•EF-Tu•GTP взаимодействует с 70S рибосомой в присутствии тетрациклиновых антибиотиков, то ГТФ гидролизуется и EF-G•GDP освобождается, но аминоацил-тРНК не остаётся связанной. По-видимому, антибиотик, будучи связан где-то в районе тРНК-связывающего A-участка на 30S субчастице рибосомы, ослабляет сродство участка к тРНК, приводя к её плохому удержанию после ухода EF-Tu. Хотя тетрациклины не действуют на эукариотические клетки из-за непроницаемости их мембран для антибиотика, в эукариотических бесклеточных системах они тоже оказываются сильными ингибиторами, подавляя связывание аминоацил-тРНК с 80S рибосомами. Хлорамфеникол, с одной стороны, подавляет синтез белка на конечном этапе биосинтеза белковой молекулы, а с другой стороны, тормозит освобождение рибосомы от пептида, что также приводит к остановке синтеза белка. Под действием хлорамфеникола немедленно прекращается синтез белка микроорганизмов, синтез нуклеиновых кислот и пептидогликана при этом продолжается, хотя идет с меньшей скоростью. Все это указывает на то, что первичной мишенью действия хлорамфеникола является синтез белка. Нуклеиновые кислоты, синтезированные в присутствии антибиотика, отличаются от кислот, синтезированных при его отсутствии. Показано, что под влиянием антибиотика нарушается нормальный синтез РНК, в то время как синтез ДНК непосредственно не тормозится им. Участок лабильного связывания хлорамфеникола локализован на 50S субчастице рибосом. Хлорамфеникол полностью ингибирует реакцию пуромицина с пептидил-тРНК, выступая его конкурентным ингибитором. При этом синтез пептида полностью прекращается, и он остается связанным с рибосомами. Предполагают, что хлорамфеникол имитирует аминоацильный конец молекулы аминоацил-тРНК, а его дихлорацетамидная группировка соответствует аминоацилу. Местом действия хлорамфеникола является A-участок 50S субчастицы рибосом, где антибиотик конкурирует с аминоацильным концом молекулы аминоацил-тРНК, препятствуя ее вхождению в A-участок, что сопровождается подавлением биосинтеза белка. В нормальном состоянии бактерия синтезирует белки, которые выходят из бактериальной клетки через специальную транспортную систему, образованную микропорами. В момент выхода наружу белковая молекула вытянута и очень похожа на спагетти. Наш организм воспринимает такие белки как токсины, угнетающие, например, наш иммунитет. При введении антибиотиков нарушается синтез белков в бактериальной клетке за счёт того, что хлорамфеникол останавливает рибосому на полпути к полному синтезу белков. В результате в месте, где синтез был прерван, образуется «узел», который уже не даёт пройти белку через микропоры. Чем меньше в бактерии таких микропор, тем раньше она погибнет, так как они быстрее «засорятся» белковыми «узлами». Кроме того, блокировка пор ведёт к выработке молекулярного сигнала стресса, способствующего увеличению концентраций протеиназ, способствующих расщеплению белков внутри клетки и, в частности, гибели бактериальной клетки. Под действием хлорамфеникола нарушение включения аминокислот в белки сопровождается изменением физико-химических свойств рибосом. Антибиотик оказывает влияние на процессы образования и самих рибосомных частиц, приводя к появлению недостроенных рибосом с резко ослабленной способностью к синтезу белка. Таким образом, нарушение синтеза белка под действием хлорамфеникола на конечной стадии его биосинтеза может осуществляться несколькими путями: во-первых, хлорамфеникол может нарушить образование нормально функционирующих рибосом клетки; во-вторых, взаимодействуя с тРНК, антибиотик может нарушить ее связь с рибосомой; в-третьих, возможно образование комплекса антибиотик — рибосома, нарушающего деятельность рибосом. Одним из наиболее возможных путей подавления белкового синтеза под действием хлорамфеникола служит образование ассоциации антибиотика с рибосомами. Эта взаимосвязь происходит мгновенно, не зависит от наличия определенной энергии и времени инкубации, легко обратима. Она может нарушаться при наличии в среде некоторых антибиотиков. Механизм действия фузидиевой кислоты.Фузидиевая кислота ингибирует в микробной клетке синтез белка на уровне рибосом, взаимодействует с фактором элонгации микробной клетки (фактор элонгации G, у прокариот — белок тип 2), который необходим для процесса транслокации на рибосоме при образовании пептидных связей. Под действием фузидиевой кислоты образуется комплекс фактора элонгации с органическими фосфатами клетки, нарушается функция фактора элонгации, гидролиз гуанозинфосфатов и прекращается процесс удлинения пептидной связи и синтез белка. Фузидиевая кислота не нарушает синтез белка в клетках эукариотов, так как они имеют другие типы факторов элонгации (тип 1 и Tu), которые не чувствительны к действию фузидиевой кислоты. В высоких концентрациях фузидиевая кислота ингибирует так же процесс связывания тРНК с донорским участком рибосом. В высоких концентрациях фузидиевая кислота может подавлять репликацию некоторых вирусов, что может быть связано с цитотоксическим действием этих концентраций Линкомицинпо антибактериальному действию близок к макролидам. Ингибирует синтез белка на уровне рибосом, действует бактериостатически или бактерицидно (в зависимости от концентрации). Механизм антимикробного действия связан с подавлением синтеза белка, блокирования образования полисомальных функциональных комплексов и трансляции связанных с транспортной РНК аминокислот. Место связывания антибиотика — пептидилтрансферазный центр на 50S субчастице. Линкомицин конкурирует с хлорамфениколом за связывание с рибосомой. По-видимому, он ингибирует взаимодействие акцепторного субстрата с пептидилтрансферазным центром по конкурентному механизму. В 2009 году была получена нобелевская премия за картирование рибосомы. Это позволит ученым в скором времени синтезировать новые, еще более эффективные антибиотики, воздействующие на рибосому. Рибосомы как точки приложения антибиотиков |
г.Самара, ул. Димитрова 131 [email protected] |
 |

 Антибиотики – это группа соединений природного происхождения или их полусинтетических и синтетических аналогов, обладающих антимикробным или противоопухолевым действием.
Антибиотики – это группа соединений природного происхождения или их полусинтетических и синтетических аналогов, обладающих антимикробным или противоопухолевым действием. Антибиотики – это группа соединений природного происхождения или их полусинтетических и синтетических аналогов, обладающих антимикробным или противоопухолевым действием.
Антибиотики – это группа соединений природного происхождения или их полусинтетических и синтетических аналогов, обладающих антимикробным или противоопухолевым действием.