|
|
||||||||||
|
Российские ученые заткнули рибосому новым антибиотиком. Антибиотики и рибосомыРибосомы как точки приложения антибиотиковАнтибиотики – это группа соединений природного происхождения или их полусинтетических и синтетических аналогов, обладающих антимикробным или противоопухолевым действием. В основе действия многих известных в настоящее время наиболее эффективных антибиотиков лежит блокирование синтеза белка на рибосомах. Высокая эффективность этих замечательных лекарственных препаратов объясняется тем, что они подавляют синтез белка бактериальных 70 S-рибосом, не влияя при этом на рибосомы эукариотических клеток. В других случаях избирательная токсичность антибиотиков обусловлена значительно более высокой проницаемостью бактериальных мембран по сравнению с мембранами животных клеток. Список антибиотиков, действующих на уровне рибосом, весьма велик. Антибиотики действующие на рибосомы подавляют белковый синтез. Нарушение синтеза белка может происходить на всех уровнях, начиная с процесса считывания информации с ДНК и кончая взаимодействием с рибосомами – блокирование связывания транспортной т-РНК с 30S субъединицами рибосом (аминогликозиды), с 50S субъединицами рибосом (макролиды) или с информационной и-РНК (на 30S субъединице рибосом – тетрациклины). Хотя аминогликозидный антибиотик стрептомицин, неомицины и канамицин содержат в своем составе одну общую структурную группу, тем не менее все они связываются с рибосомами по-разному. В результате своеобразного действия стрептомицина рибосомы начинают неправильно считывать код. При этом неправильно считывается главным образом первое основание кодона. в группу антибиотиков действующих на рибосомы входят: – аминогликозиды, – макролиды, – тетрациклины, – фузидин, – линкомицин, – хлорамфеникол (левомицетин), нарушающий синтез белка микробной клеткой на стадии переноса аминокислот на рибосомы. Механизм действия аминогликозидов связан с необратимым угнетением синтеза белка на уровне рибосом у чувствительных к ним микроорганизмов. В отличие от других ингибиторов синтеза белка аминогликозиды оказывают не бактериостатическое, а бактерицидное действие. Аминогликозиды проникают в клетки бактерий путем пассивной диффузии через поры наружной мембраны и путем активного транспорта. Транспорт аминогликозидов через цитоплазматическую мембрану зависит от переноса электронов в дыхательной цепи, этот этап поступления их в клетку, т.н. энергозависимый этап I, является лимитирующим. Транспорт аминогликозидов через цитоплазматическую мембрану замедляется или полностью блокируется в присутствии ионов Ca2+ или Mg2+ , в гиперосмолярной среде, при низких значениях pH и в анаэробных условиях. После проникновения в клетку аминогликозиды связываются со специфическими белками-рецепторами на 30S субъединице рибосом бактерий. 30S субъединица состоит из 21 белка и одной молекулы 16S рРНК (рибосомной РНК). Например, в связывании стрептомицина с рибосомами участвуют по крайней мере три белка и, возможно, 16S рРНК. Аминогликозиды нарушают рибосомальный белковый синтез несколькими путями: 1) антибиотики связываются с 30S субъединицей рибосомы и нарушают инициацию синтеза белка, фиксируя комплекс, состоящий из 30S- и 50S- субъединиц, на инициирующем кодоне иРНК; это приводит к накоплению аномальных инициирующих комплексов (т.н. моносомы) и прекращению дальнейшей трансляции; 2) связываясь с 30S субъединицей рибосомы, аминогликозиды нарушают считывание информации с РНК, что приводит к преждевременному окончанию трансляции и отсоединению рибосомного комплекса от белка, синтез которого не завершен; 3) кроме того, аминогликозиды вызывают одиночные аминокислотные замены в растущей полипептидной цепи, в результате чего образуются дефектные белки. Синтезирующиеся аномальные белки, встраиваясь в цитоплазматическую мембрану, могут нарушать ее структуру, изменять проницаемость и ускорять проникновение аминогликозидов внутрь клетки. Этот этап транспорта аминогликозидов — т.н. энергозависимый этап II. В результате постепенного разрушения цитоплазматической мембраны происходит выход из бактериальной клетки ионов, крупных молекул, белков. Бактерицидный эффект аминогликозидов, возможно, объясняется тем, что образование неполноценных полипептидов и угнетение синтеза нормальных белков в микробной клетке приводит к нарушению важных функций клетки, поддерживающих ее жизнеспособность, к нарушению структуры и функции цитоплазматической мембраны бактерий и, в конечном счете, приводит к гибели клетки. Принцип действия макролидов Антимикробное действие макролидов обусловлено нарушением синтеза белка на этапе трансляции в клетках чувствительных микроорганизмов. Молекула антибиотика способна обратимо связываться с каталитическим пептидил-трансферазным центром (P-site) рибосомальной 50S-субъединицы и вызывать отщепление комплекса пептидил-тРНК (представляющего собой растущую пептидную цепь) от рибосомы. При этом нарушается цикличность последовательного присоединения пептидной цепи к пептидил-трансферазному центру (P-site) и акцепторному аминоацил-тРНК-центру (A-site) 50S-субъединицы, то есть ингибируются реакции транслокации и транспептидации . В результате приостанавливается процесс формирования и наращивания пептидной цепи. Связывание макролидов с 50S-субъединицей возможно на любой стадии рибосомального цикла. Выявлено, что 14- и 16-членные макролиды отличаются по особенностям связывания с различными доменами пептидил-трансферазного центра. 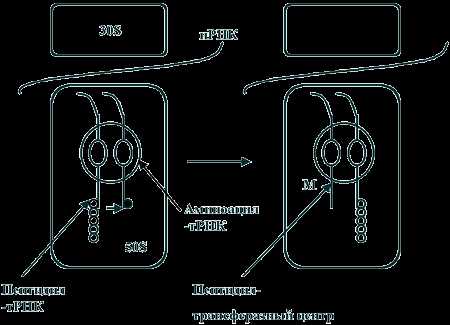 Рис. 2. Механизм синтеза белка в рибосоме микробной клетки. (M - точка приложения действия макролидов) Механизм действия тетрациклинов Тетрациклины являются специфическими ингибиторами как EF-Tu-промотируемого, так и неэнзиматического связывания аминоацил-тРНК с A-участком бактериальной 70S рибосомы. Тетрациклины подавляют также кодон-зависимое связывание аминоацил-тРНК с изолированной 30S субчастицей бактериальной рибосомы. В соответствии с этим, место специфического связывания тетрациклинов с рибосомой обнаружено на 30S субчастице рибосомы, хотя при более высоких концентрациях они могут связываться также и с 50S субчастицей, обнаруживая побочные действия. Интересно, что когда тройственный комплекс Aa-tRNA•EF-Tu•GTP взаимодействует с 70S рибосомой в присутствии тетрациклиновых антибиотиков, то ГТФ гидролизуется и EF-G•GDP освобождается, но аминоацил-тРНК не остаётся связанной. По-видимому, антибиотик, будучи связан где-то в районе тРНК-связывающего A-участка на 30S субчастице рибосомы, ослабляет сродство участка к тРНК, приводя к её плохому удержанию после ухода EF-Tu. Хотя тетрациклины не действуют на эукариотические клетки из-за непроницаемости их мембран для антибиотика, в эукариотических бесклеточных системах они тоже оказываются сильными ингибиторами, подавляя связывание аминоацил-тРНК с 80S рибосомами. Хлорамфеникол , с одной стороны, подавляет синтез белка на конечном этапе биосинтеза белковой молекулы, а с другой стороны, тормозит освобождение рибосомы от пептида, что также приводит к остановке синтеза белка. Под действием хлорамфеникола немедленно прекращается синтез белка микроорганизмов, синтез нуклеиновых кислот и пептидогликана при этом продолжается, хотя идет с меньшей скоростью. Все это указывает на то, что первичной мишенью действия хлорамфеникола является синтез белка. Нуклеиновые кислоты, синтезированные в присутствии антибиотика, отличаются от кислот, синтезированных при его отсутствии. Показано, что под влиянием антибиотика нарушается нормальный синтез РНК, в то время как синтез ДНК непосредственно не тормозится им. Участок лабильного связывания хлорамфеникола локализован на 50S субчастице рибосом. Хлорамфеникол полностью ингибирует реакцию пуромицина с пептидил-тРНК, выступая его конкурентным ингибитором. При этом синтез пептида полностью прекращается, и он остается связанным с рибосомами. Предполагают, что хлорамфеникол имитирует аминоацильный конец молекулы аминоацил-тРНК, а его дихлорацетамидная группировка соответствует аминоацилу. Местом действия хлорамфеникола является A-участок 50S субчастицы рибосом, где антибиотик конкурирует с аминоацильным концом молекулы аминоацил-тРНК, препятствуя ее вхождению в A-участок, что сопровождается подавлением биосинтеза белка. В нормальном состоянии бактерия синтезирует белки, которые выходят из бактериальной клетки через специальную транспортную систему, образованную микропорами. В момент выхода наружу белковая молекула вытянута и очень похожа на спагетти. Наш организм воспринимает такие белки как токсины, угнетающие, например, наш иммунитет. При введении антибиотиков нарушается синтез белков в бактериальной клетке за счёт того, что хлорамфеникол останавливает рибосому на полпути к полному синтезу белков. В результате в месте, где синтез был прерван, образуется «узел», который уже не даёт пройти белку через микропоры. Чем меньше в бактерии таких микропор, тем раньше она погибнет, так как они быстрее «засорятся» белковыми «узлами». Кроме того, блокировка пор ведёт к выработке молекулярного сигнала стресса, способствующего увеличению концентраций протеиназ, способствующих расщеплению белков внутри клетки и, в частности, гибели бактериальной клетки. Под действием хлорамфеникола нарушение включения аминокислот в белки сопровождается изменением физико-химических свойств рибосом. Антибиотик оказывает влияние на процессы образования и самих рибосомных частиц, приводя к появлению недостроенных рибосом с резко ослабленной способностью к синтезу белка. Таким образом, нарушение синтеза белка под действием хлорамфеникола на конечной стадии его биосинтеза может осуществляться несколькими путями: во-первых, хлорамфеникол может нарушить образование нормально функционирующих рибосом клетки; во-вторых, взаимодействуя с тРНК, антибиотик может нарушить ее связь с рибосомой; в-третьих, возможно образование комплекса антибиотик — рибосома, нарушающего деятельность рибосом. mirznanii.com Российские ученые заткнули рибосому новым антибиотиком Клебсазолицин в рибосоме Mikhail Metelev et al / Nature Chemical Biology 2017 Коллектив ученых из институтов Москвы и Санкт-Петербурга в сотрудничестве с университетом Иллинойса (США) предсказал существование, выделил и охарактеризовал новый антимикробный пептид — клебсазолицин. Вещество принадлежит к группе тиазол-оксазол-модифицированных микроцинов и подавляет синтез белка у бактерий. Структурный анализ рибосомы в комплексе с пептидом показал, что антибиотик блокирует выход новосинтезированного белка из рибосомы, действуя как затычка. В группе микроцинов это первый охарактеризованный пептид с таким механизмом действия. Статья опубликована в журнале Nature Chemical Biology. Микроцины («маленькие бактериоцины») — это белковые антибиотики, которые бактерии используют для борьбы друг с другом. Особенностью микроцинов является способ их синтеза. Если более традиционные антибиотики синтезируются специализированными ферментами из низкомолекулярных предшественников, то микроцины кодируются обычными генами и производятся как обычные белки, на рибосоме. Однако исходный короткий пептид при этом всегда подвергается сильной модификации, и только после этого превращается в действующее вещество. Существуют, например, микроцины, в которых остатки цистеина, серина и треонина формируют гетероциклы, они называются тиазол-оксазол-модифицированными микроцинами. Другие микроцины образуют петли из пептидной цепочки. Разные микроцины действуют на разные мишени, среди них есть и бактериальная гираза (фермент, необходимый для поддержания структуры ДНК) и РНК-полимераза. Так как микроцины имеют белковую природу, их последовательность закодирована в геноме. Обычно ген микроцина расположен в одном кластере с генами, кодирующими ферменты для его модификации. По последовательностям этих ферментов можно искать в бактериальных геномах кассеты генов, отвечающих за синтез ранее не известных антимикробных пептидов. Именно такой подход применили исследователи, открывшие клебсазолицин. Ген, кодирующий предполагаемый предшественник микроцина, был найден в составе кластера, обнаруженного в геноме бактерии Klebsiella pneumoniae по гомологии с генным кластером синтеза хорошо изученного микроцина B17 кишечной палочки E.coli. Ученые ввели этот ген и предполагаемые гены микроцин-модифицирующих ферментов в лабораторный штамм E.coli и выделили из ростовой среды биологически активное вещество. Физико-химический анализ показал, что это пептид из 23 аминокислот, из которых первые две замкнуты в цикл. Так как природным продуцентом пептида является Klebsiella, он получил название клебсазолицин. Тест на противомикробную активность показал, что клебсазолицин подавляет рост нескольких штаммов кишечной палочки, патогенных бактерий Yersinia pseudotuberculosis и самой Klebsiella pneumoniae. Таким образом, пептид обладает довольно узким спектром антибактериальной активности. Однако, как показали авторы работы, это связано не с механизмом действия антибиотика, а скорее всего объясняется недостаточно эффективным транспортом внутрь клетки. Исследователи определили, что мишенью клебсазолицина является аппарат синтеза белка, а именно рибосома. Чтобы уточнить механизм его действия, авторы работы в сотрудничестве с американскими коллегами при помощи рентгеноструктурного анализа получили структуру работающей рибосомы (то есть в присутствии матричной и транспортных РНК) в комплексе с антибиотиком.  Выходной канал рибосомы без антибиотика (слева) и в присутствии клебсазолицина (справа) Mikhail Metelev et al / Nature Chemical Biology 2017 Оказалось, что клебсазолицин взаимодействует с каналом рибосомы в том месте, откуда выходит новосинтезированный белок и в буквальном смысле затыкает его. Некоторые макролидные антибиотики, например, эритромицин и стрептограмин Б, работают подобным образом. Тем не менее, клебсазолицин — первый представитель в своей группе, который действует по такому механизму, поэтому его выделили в отдельный новый класс ингибиторов синтеза белка.Функциональный анализ отдельных фрагментов пептида показал, что взаимодействуют с рибосомой только первые 14 аминокислотных остатков, а остальные 9, по-видимому, нужны для проникновения молекулы вещества в клетку. Это означает, что функциональную часть клебсазолицина можно использовать отдельно, в том числе в составе гибридных молекул, более эффективно проникающих в клетки. Сам по себе новый антибиотик скорее всего не будет иметь клинического применения из-за сложностей с проникновением в клетки. По словам одного из авторов статьи, Дмитрия Гилярова, гораздо интереснее открытие самого механизма действия: «важнее всего то, что речь идет об открытии нового "скаффолда", т.е. основы для рационального дизайна модифицированных аналогов клебсазолицина, которые потенциально могут быть активнее и лучше него самого». Новая работа российских ученых является результатом направленного поиска генов, относящихся к метаболизму антимикробных соединений, при помощи компьютерного анализа. Недавно мы писали о новом антибиотике, выделенном из природных источников путем проверки большого количества различных веществ на антимикробную активность. А здесь можно почитать большой материал об антибиотиках и устойчивости к ним.Дарья Спасская nplus1.ru Шпаргалка - Рибосомы как точки приложения антибиотиковАнтибиотики – это группа соединений природного происхождения или их полусинтетических и синтетических аналогов, обладающих антимикробным или противоопухолевым действием. В основе действия многих известных в настоящее время наиболее эффективных антибиотиков лежит блокирование синтеза белка на рибосомах. Высокая эффективность этих замечательных лекарственных препаратов объясняется тем, что они подавляют синтез белка бактериальных 70 S-рибосом, не влияя при этом на рибосомы эукариотических клеток. В других случаях избирательная токсичность антибиотиков обусловлена значительно более высокой проницаемостью бактериальных мембран по сравнению с мембранами животных клеток. Список антибиотиков, действующих на уровне рибосом, весьма велик. Антибиотики действующие на рибосомы подавляют белковый синтез. Нарушение синтеза белка может происходить на всех уровнях, начиная с процесса считывания информации с ДНК и кончая взаимодействием с рибосомами – блокирование связывания транспортной т-РНК с 30S субъединицами рибосом (аминогликозиды), с 50S субъединицами рибосом (макролиды) или с информационной и-РНК (на 30S субъединице рибосом – тетрациклины). Хотя аминогликозидный антибиотик стрептомицин, неомицины и канамицин содержат в своем составе одну общую структурную группу, тем не менее все они связываются с рибосомами по-разному. В результате своеобразного действия стрептомицина рибосомы начинают неправильно считывать код. При этом неправильно считывается главным образом первое основание кодона. в группу антибиотиков действующих на рибосомы входят: – аминогликозиды, – макролиды, – тетрациклины, – фузидин, – линкомицин, – хлорамфеникол (левомицетин), нарушающий синтез белка микробной клеткой на стадии переноса аминокислот на рибосомы. Механизм действия аминогликозидов связан с необратимым угнетением синтеза белка на уровне рибосом у чувствительных к ним микроорганизмов. В отличие от других ингибиторов синтеза белка аминогликозиды оказывают не бактериостатическое, а бактерицидное действие. Аминогликозиды проникают в клетки бактерий путем пассивной диффузии через поры наружной мембраны и путем активного транспорта. Транспорт аминогликозидов через цитоплазматическую мембрану зависит от переноса электронов в дыхательной цепи, этот этап поступления их в клетку, т.н. энергозависимый этап I, является лимитирующим. Транспорт аминогликозидов через цитоплазматическую мембрану замедляется или полностью блокируется в присутствии ионов Ca2+ или Mg2+, в гиперосмолярной среде, при низких значениях pH и в анаэробных условиях. После проникновения в клетку аминогликозиды связываются со специфическими белками-рецепторами на 30S субъединице рибосом бактерий. 30S субъединица состоит из 21 белка и одной молекулы 16S рРНК (рибосомной РНК). Например, в связывании стрептомицина с рибосомами участвуют по крайней мере три белка и, возможно, 16S рРНК. Аминогликозиды нарушают рибосомальный белковый синтез несколькими путями: 1) антибиотики связываются с 30S субъединицей рибосомы и нарушают инициацию синтеза белка, фиксируя комплекс, состоящий из 30S- и 50S- субъединиц, на инициирующем кодоне иРНК; это приводит к накоплению аномальных инициирующих комплексов (т.н. моносомы) и прекращению дальнейшей трансляции; 2) связываясь с 30S субъединицей рибосомы, аминогликозиды нарушают считывание информации с РНК, что приводит к преждевременному окончанию трансляции и отсоединению рибосомного комплекса от белка, синтез которого не завершен; 3) кроме того, аминогликозиды вызывают одиночные аминокислотные замены в растущей полипептидной цепи, в результате чего образуются дефектные белки. Синтезирующиеся аномальные белки, встраиваясь в цитоплазматическую мембрану, могут нарушать ее структуру, изменять проницаемость и ускорять проникновение аминогликозидов внутрь клетки. Этот этап транспорта аминогликозидов — т.н. энергозависимый этап II. В результате постепенного разрушения цитоплазматической мембраны происходит выход из бактериальной клетки ионов, крупных молекул, белков. Бактерицидный эффект аминогликозидов, возможно, объясняется тем, что образование неполноценных полипептидов и угнетение синтеза нормальных белков в микробной клетке приводит к нарушению важных функций клетки, поддерживающих ее жизнеспособность, к нарушению структуры и функции цитоплазматической мембраны бактерий и, в конечном счете, приводит к гибели клетки. Принцип действия макролидов Антимикробное действие макролидов обусловлено нарушением синтеза белка на этапе трансляции в клетках чувствительных микроорганизмов. Молекула антибиотика способна обратимо связываться с каталитическим пептидил-трансферазным центром (P-site) рибосомальной 50S-субъединицы и вызывать отщепление комплекса пептидил-тРНК (представляющего собой растущую пептидную цепь) от рибосомы. При этом нарушается цикличность последовательного присоединения пептидной цепи к пептидил-трансферазному центру (P-site) и акцепторному аминоацил-тРНК-центру (A-site) 50S-субъединицы, то есть ингибируются реакции транслокации и транспептидации. В результате приостанавливается процесс формирования и наращивания пептидной цепи. Связывание макролидов с 50S-субъединицей возможно на любой стадии рибосомального цикла. Выявлено, что 14- и 16-членные макролиды отличаются по особенностям связывания с различными доменами пептидил-трансферазного центра. Рис. 2. Механизм синтеза белка в рибосоме микробной клетки. (M — точка приложения действия макролидов) Механизм действия тетрациклинов Тетрациклины являются специфическими ингибиторами как EF-Tu-промотируемого, так и неэнзиматического связывания аминоацил-тРНК с A-участком бактериальной 70S рибосомы. Тетрациклины подавляют также кодон-зависимое связывание аминоацил-тРНК с изолированной 30S субчастицей бактериальной рибосомы. В соответствии с этим, место специфического связывания тетрациклинов с рибосомой обнаружено на 30S субчастице рибосомы, хотя при более высоких концентрациях они могут связываться также и с 50S субчастицей, обнаруживая побочные действия. Интересно, что когда тройственный комплекс Aa-tRNA•EF-Tu•GTP взаимодействует с 70S рибосомой в присутствии тетрациклиновых антибиотиков, то ГТФ гидролизуется и EF-G•GDP освобождается, но аминоацил-тРНК не остаётся связанной. По-видимому, антибиотик, будучи связан где-то в районе тРНК-связывающего A-участка на 30S субчастице рибосомы, ослабляет сродство участка к тРНК, приводя к её плохому удержанию после ухода EF-Tu. Хотя тетрациклины не действуют на эукариотические клетки из-за непроницаемости их мембран для антибиотика, в эукариотических бесклеточных системах они тоже оказываются сильными ингибиторами, подавляя связывание аминоацил-тРНК с 80S рибосомами. Хлорамфеникол, с одной стороны, подавляет синтез белка на конечном этапе биосинтеза белковой молекулы, а с другой стороны, тормозит освобождение рибосомы от пептида, что также приводит к остановке синтеза белка. Под действием хлорамфеникола немедленно прекращается синтез белка микроорганизмов, синтез нуклеиновых кислот и пептидогликана при этом продолжается, хотя идет с меньшей скоростью. Все это указывает на то, что первичной мишенью действия хлорамфеникола является синтез белка. Нуклеиновые кислоты, синтезированные в присутствии антибиотика, отличаются от кислот, синтезированных при его отсутствии. Показано, что под влиянием антибиотика нарушается нормальный синтез РНК, в то время как синтез ДНК непосредственно не тормозится им. Участок лабильного связывания хлорамфеникола локализован на 50S субчастице рибосом. Хлорамфеникол полностью ингибирует реакцию пуромицина с пептидил-тРНК, выступая его конкурентным ингибитором. При этом синтез пептида полностью прекращается, и он остается связанным с рибосомами. Предполагают, что хлорамфеникол имитирует аминоацильный конец молекулы аминоацил-тРНК, а его дихлорацетамидная группировка соответствует аминоацилу. Местом действия хлорамфеникола является A-участок 50S субчастицы рибосом, где антибиотик конкурирует с аминоацильным концом молекулы аминоацил-тРНК, препятствуя ее вхождению в A-участок, что сопровождается подавлением биосинтеза белка. В нормальном состоянии бактерия синтезирует белки, которые выходят из бактериальной клетки через специальную транспортную систему, образованную микропорами. В момент выхода наружу белковая молекула вытянута и очень похожа на спагетти. Наш организм воспринимает такие белки как токсины, угнетающие, например, наш иммунитет. При введении антибиотиков нарушается синтез белков в бактериальной клетке за счёт того, что хлорамфеникол останавливает рибосому на полпути к полному синтезу белков. В результате в месте, где синтез был прерван, образуется «узел», который уже не даёт пройти белку через микропоры. Чем меньше в бактерии таких микропор, тем раньше она погибнет, так как они быстрее «засорятся» белковыми «узлами». Кроме того, блокировка пор ведёт к выработке молекулярного сигнала стресса, способствующего увеличению концентраций протеиназ, способствующих расщеплению белков внутри клетки и, в частности, гибели бактериальной клетки. Под действием хлорамфеникола нарушение включения аминокислот в белки сопровождается изменением физико-химических свойств рибосом. Антибиотик оказывает влияние на процессы образования и самих рибосомных частиц, приводя к появлению недостроенных рибосом с резко ослабленной способностью к синтезу белка. Таким образом, нарушение синтеза белка под действием хлорамфеникола на конечной стадии его биосинтеза может осуществляться несколькими путями: во-первых, хлорамфеникол может нарушить образование нормально функционирующих рибосом клетки; во-вторых, взаимодействуя с тРНК, антибиотик может нарушить ее связь с рибосомой; в-третьих, возможно образование комплекса антибиотик — рибосома, нарушающего деятельность рибосом. Одним из наиболее возможных путей подавления белкового синтеза под действием хлорамфеникола служит образование ассоциации антибиотика с рибосомами. Эта взаимосвязь происходит мгновенно, не зависит от наличия определенной энергии и времени инкубации, легко обратима. Она может нарушаться при наличии в среде некоторых антибиотиков. Механизм действия фузидиевой кислоты. Фузидиевая кислота ингибирует в микробной клетке синтез белка на уровне рибосом, взаимодействует с фактором элонгации микробной клетки (фактор элонгации G, у прокариот — белок тип 2), который необходим для процесса транслокации на рибосоме при образовании пептидных связей. Под действием фузидиевой кислоты образуется комплекс фактора элонгации с органическими фосфатами клетки, нарушается функция фактора элонгации, гидролиз гуанозинфосфатов и прекращается процесс удлинения пептидной связи и синтез белка. Фузидиевая кислота не нарушает синтез белка в клетках эукариотов, так как они имеют другие типы факторов элонгации (тип 1 и Tu), которые не чувствительны к действию фузидиевой кислоты. В высоких концентрациях фузидиевая кислота ингибирует так же процесс связывания тРНК с донорским участком рибосом. В высоких концентрациях фузидиевая кислота может подавлять репликацию некоторых вирусов, что может быть связано с цитотоксическим действием этих концентраций Линкомицин по антибактериальному действию близок к макролидам. Ингибирует синтез белка на уровне рибосом, действует бактериостатически или бактерицидно (в зависимости от концентрации). Механизм антимикробного действия связан с подавлением синтеза белка, блокирования образования полисомальных функциональных комплексов и трансляции связанных с транспортной РНК аминокислот. Место связывания антибиотика — пептидилтрансферазный центр на 50S субчастице. Линкомицин конкурирует с хлорамфениколом за связывание с рибосомой. По-видимому, он ингибирует взаимодействие акцепторного субстрата с пептидилтрансферазным центром по конкурентному механизму. В 2009 году была получена нобелевская премия за картирование рибосомы. Это позволит ученым в скором времени синтезировать новые, еще более эффективные антибиотики, воздействующие на рибосому. Рибосомы как точки приложения антибиотиков www.ronl.ru Доклад - Рибосомы как точки приложения антибиотиковАнтибиотики – это группа соединений природного происхождения или их полусинтетических и синтетических аналогов, обладающих антимикробным или противоопухолевым действием. В основе действия многих известных в настоящее время наиболее эффективных антибиотиков лежит блокирование синтеза белка на рибосомах. Высокая эффективность этих замечательных лекарственных препаратов объясняется тем, что они подавляют синтез белка бактериальных 70 S-рибосом, не влияя при этом на рибосомы эукариотических клеток. В других случаях избирательная токсичность антибиотиков обусловлена значительно более высокой проницаемостью бактериальных мембран по сравнению с мембранами животных клеток. Список антибиотиков, действующих на уровне рибосом, весьма велик. Антибиотики действующие на рибосомы подавляют белковый синтез. Нарушение синтеза белка может происходить на всех уровнях, начиная с процесса считывания информации с ДНК и кончая взаимодействием с рибосомами – блокирование связывания транспортной т-РНК с 30S субъединицами рибосом (аминогликозиды), с 50S субъединицами рибосом (макролиды) или с информационной и-РНК (на 30S субъединице рибосом – тетрациклины). Хотя аминогликозидный антибиотик стрептомицин, неомицины и канамицин содержат в своем составе одну общую структурную группу, тем не менее все они связываются с рибосомами по-разному. В результате своеобразного действия стрептомицина рибосомы начинают неправильно считывать код. При этом неправильно считывается главным образом первое основание кодона. в группу антибиотиков действующих на рибосомы входят: – аминогликозиды, – макролиды, – тетрациклины, – фузидин, – линкомицин, – хлорамфеникол (левомицетин), нарушающий синтез белка микробной клеткой на стадии переноса аминокислот на рибосомы. Механизм действия аминогликозидов связан с необратимым угнетением синтеза белка на уровне рибосом у чувствительных к ним микроорганизмов. В отличие от других ингибиторов синтеза белка аминогликозиды оказывают не бактериостатическое, а бактерицидное действие. Аминогликозиды проникают в клетки бактерий путем пассивной диффузии через поры наружной мембраны и путем активного транспорта. Транспорт аминогликозидов через цитоплазматическую мембрану зависит от переноса электронов в дыхательной цепи, этот этап поступления их в клетку, т.н. энергозависимый этап I, является лимитирующим. Транспорт аминогликозидов через цитоплазматическую мембрану замедляется или полностью блокируется в присутствии ионов Ca2+ или Mg2+, в гиперосмолярной среде, при низких значениях pH и в анаэробных условиях. После проникновения в клетку аминогликозиды связываются со специфическими белками-рецепторами на 30S субъединице рибосом бактерий. 30S субъединица состоит из 21 белка и одной молекулы 16S рРНК (рибосомной РНК). Например, в связывании стрептомицина с рибосомами участвуют по крайней мере три белка и, возможно, 16S рРНК. Аминогликозиды нарушают рибосомальный белковый синтез несколькими путями: 1) антибиотики связываются с 30S субъединицей рибосомы и нарушают инициацию синтеза белка, фиксируя комплекс, состоящий из 30S- и 50S- субъединиц, на инициирующем кодоне иРНК; это приводит к накоплению аномальных инициирующих комплексов (т.н. моносомы) и прекращению дальнейшей трансляции; 2) связываясь с 30S субъединицей рибосомы, аминогликозиды нарушают считывание информации с РНК, что приводит к преждевременному окончанию трансляции и отсоединению рибосомного комплекса от белка, синтез которого не завершен; 3) кроме того, аминогликозиды вызывают одиночные аминокислотные замены в растущей полипептидной цепи, в результате чего образуются дефектные белки. Синтезирующиеся аномальные белки, встраиваясь в цитоплазматическую мембрану, могут нарушать ее структуру, изменять проницаемость и ускорять проникновение аминогликозидов внутрь клетки. Этот этап транспорта аминогликозидов — т.н. энергозависимый этап II. В результате постепенного разрушения цитоплазматической мембраны происходит выход из бактериальной клетки ионов, крупных молекул, белков. Бактерицидный эффект аминогликозидов, возможно, объясняется тем, что образование неполноценных полипептидов и угнетение синтеза нормальных белков в микробной клетке приводит к нарушению важных функций клетки, поддерживающих ее жизнеспособность, к нарушению структуры и функции цитоплазматической мембраны бактерий и, в конечном счете, приводит к гибели клетки. Принцип действия макролидов Антимикробное действие макролидов обусловлено нарушением синтеза белка на этапе трансляции в клетках чувствительных микроорганизмов. Молекула антибиотика способна обратимо связываться с каталитическим пептидил-трансферазным центром (P-site) рибосомальной 50S-субъединицы и вызывать отщепление комплекса пептидил-тРНК (представляющего собой растущую пептидную цепь) от рибосомы. При этом нарушается цикличность последовательного присоединения пептидной цепи к пептидил-трансферазному центру (P-site) и акцепторному аминоацил-тРНК-центру (A-site) 50S-субъединицы, то есть ингибируются реакции транслокации и транспептидации. В результате приостанавливается процесс формирования и наращивания пептидной цепи. Связывание макролидов с 50S-субъединицей возможно на любой стадии рибосомального цикла. Выявлено, что 14- и 16-членные макролиды отличаются по особенностям связывания с различными доменами пептидил-трансферазного центра. Рис. 2. Механизм синтеза белка в рибосоме микробной клетки. (M — точка приложения действия макролидов) Механизм действия тетрациклинов Тетрациклины являются специфическими ингибиторами как EF-Tu-промотируемого, так и неэнзиматического связывания аминоацил-тРНК с A-участком бактериальной 70S рибосомы. Тетрациклины подавляют также кодон-зависимое связывание аминоацил-тРНК с изолированной 30S субчастицей бактериальной рибосомы. В соответствии с этим, место специфического связывания тетрациклинов с рибосомой обнаружено на 30S субчастице рибосомы, хотя при более высоких концентрациях они могут связываться также и с 50S субчастицей, обнаруживая побочные действия. Интересно, что когда тройственный комплекс Aa-tRNA•EF-Tu•GTP взаимодействует с 70S рибосомой в присутствии тетрациклиновых антибиотиков, то ГТФ гидролизуется и EF-G•GDP освобождается, но аминоацил-тРНК не остаётся связанной. По-видимому, антибиотик, будучи связан где-то в районе тРНК-связывающего A-участка на 30S субчастице рибосомы, ослабляет сродство участка к тРНК, приводя к её плохому удержанию после ухода EF-Tu. Хотя тетрациклины не действуют на эукариотические клетки из-за непроницаемости их мембран для антибиотика, в эукариотических бесклеточных системах они тоже оказываются сильными ингибиторами, подавляя связывание аминоацил-тРНК с 80S рибосомами. Хлорамфеникол, с одной стороны, подавляет синтез белка на конечном этапе биосинтеза белковой молекулы, а с другой стороны, тормозит освобождение рибосомы от пептида, что также приводит к остановке синтеза белка. Под действием хлорамфеникола немедленно прекращается синтез белка микроорганизмов, синтез нуклеиновых кислот и пептидогликана при этом продолжается, хотя идет с меньшей скоростью. Все это указывает на то, что первичной мишенью действия хлорамфеникола является синтез белка. Нуклеиновые кислоты, синтезированные в присутствии антибиотика, отличаются от кислот, синтезированных при его отсутствии. Показано, что под влиянием антибиотика нарушается нормальный синтез РНК, в то время как синтез ДНК непосредственно не тормозится им. Участок лабильного связывания хлорамфеникола локализован на 50S субчастице рибосом. Хлорамфеникол полностью ингибирует реакцию пуромицина с пептидил-тРНК, выступая его конкурентным ингибитором. При этом синтез пептида полностью прекращается, и он остается связанным с рибосомами. Предполагают, что хлорамфеникол имитирует аминоацильный конец молекулы аминоацил-тРНК, а его дихлорацетамидная группировка соответствует аминоацилу. Местом действия хлорамфеникола является A-участок 50S субчастицы рибосом, где антибиотик конкурирует с аминоацильным концом молекулы аминоацил-тРНК, препятствуя ее вхождению в A-участок, что сопровождается подавлением биосинтеза белка. В нормальном состоянии бактерия синтезирует белки, которые выходят из бактериальной клетки через специальную транспортную систему, образованную микропорами. В момент выхода наружу белковая молекула вытянута и очень похожа на спагетти. Наш организм воспринимает такие белки как токсины, угнетающие, например, наш иммунитет. При введении антибиотиков нарушается синтез белков в бактериальной клетке за счёт того, что хлорамфеникол останавливает рибосому на полпути к полному синтезу белков. В результате в месте, где синтез был прерван, образуется «узел», который уже не даёт пройти белку через микропоры. Чем меньше в бактерии таких микропор, тем раньше она погибнет, так как они быстрее «засорятся» белковыми «узлами». Кроме того, блокировка пор ведёт к выработке молекулярного сигнала стресса, способствующего увеличению концентраций протеиназ, способствующих расщеплению белков внутри клетки и, в частности, гибели бактериальной клетки. Под действием хлорамфеникола нарушение включения аминокислот в белки сопровождается изменением физико-химических свойств рибосом. Антибиотик оказывает влияние на процессы образования и самих рибосомных частиц, приводя к появлению недостроенных рибосом с резко ослабленной способностью к синтезу белка. Таким образом, нарушение синтеза белка под действием хлорамфеникола на конечной стадии его биосинтеза может осуществляться несколькими путями: во-первых, хлорамфеникол может нарушить образование нормально функционирующих рибосом клетки; во-вторых, взаимодействуя с тРНК, антибиотик может нарушить ее связь с рибосомой; в-третьих, возможно образование комплекса антибиотик — рибосома, нарушающего деятельность рибосом. Одним из наиболее возможных путей подавления белкового синтеза под действием хлорамфеникола служит образование ассоциации антибиотика с рибосомами. Эта взаимосвязь происходит мгновенно, не зависит от наличия определенной энергии и времени инкубации, легко обратима. Она может нарушаться при наличии в среде некоторых антибиотиков. Механизм действия фузидиевой кислоты. Фузидиевая кислота ингибирует в микробной клетке синтез белка на уровне рибосом, взаимодействует с фактором элонгации микробной клетки (фактор элонгации G, у прокариот — белок тип 2), который необходим для процесса транслокации на рибосоме при образовании пептидных связей. Под действием фузидиевой кислоты образуется комплекс фактора элонгации с органическими фосфатами клетки, нарушается функция фактора элонгации, гидролиз гуанозинфосфатов и прекращается процесс удлинения пептидной связи и синтез белка. Фузидиевая кислота не нарушает синтез белка в клетках эукариотов, так как они имеют другие типы факторов элонгации (тип 1 и Tu), которые не чувствительны к действию фузидиевой кислоты. В высоких концентрациях фузидиевая кислота ингибирует так же процесс связывания тРНК с донорским участком рибосом. В высоких концентрациях фузидиевая кислота может подавлять репликацию некоторых вирусов, что может быть связано с цитотоксическим действием этих концентраций Линкомицин по антибактериальному действию близок к макролидам. Ингибирует синтез белка на уровне рибосом, действует бактериостатически или бактерицидно (в зависимости от концентрации). Механизм антимикробного действия связан с подавлением синтеза белка, блокирования образования полисомальных функциональных комплексов и трансляции связанных с транспортной РНК аминокислот. Место связывания антибиотика — пептидилтрансферазный центр на 50S субчастице. Линкомицин конкурирует с хлорамфениколом за связывание с рибосомой. По-видимому, он ингибирует взаимодействие акцепторного субстрата с пептидилтрансферазным центром по конкурентному механизму. В 2009 году была получена нобелевская премия за картирование рибосомы. Это позволит ученым в скором времени синтезировать новые, еще более эффективные антибиотики, воздействующие на рибосому. Рибосомы как точки приложения антибиотиков www.ronl.ru Антибиотики, нарушающие функции цитоплазматической мембраны (цпм) микроорганизмовК данной группе относятся полимиксины, полиеновые антибиотики (нистатин, леворин, амфотерицин В). Полимиксины. Группа родственных антибиотиков, продуцируемых спорообразующими почвенными бактериями Bacillus polymyxa и др. По химическому строению представляют собой сложные соединения, включающие остатки полипептидов. К данной группе относятся полимиксин М, полимиксин В, которые отличаются друг от друга главным образом фармакологическими свойствами. Антибактериальный спектр этих антибиотиков включает преимущественно грамотрицательные бактерии (кишечная и синегнойная палочки, шигеллы, протей, клебсиеллы). Резистентны к полимиксинам грамположительные бактерии, ми-коплазмы, грибы. На чувствительные бактерии полимиксины оказывают бактерицидное действие, резистентность к ним развивается медленно. Полиеновые антибиотики. К данной группе относятся нистатин, леворин, амфотерицин В, продуцируемые актиномицетами. Антимикробный спектр нистатина и леворина включает дрожжеподобные грибы рода Candida и грибы рода Aspergillus. К амфотерицину В чувствительны возбудители глубоких микозов. Резистентность чувствительных микроорганизмов к данным антибиотикам развивается редко. Механизм антимикробного действия полиеновых антибиотиков связан с адсорбцией на цитоплазматической мембране грибов и взаимодействием с ее стерольным компонентом. Это приводит к повышению проницаемости мембраны, в результате чего клетка обезвоживается, теряет некоторые микроэлементы (калий) и в конечном итоге погибает. Таким образом, чувствительность микроорганизмов к нистатину, леворину и другим полиеновым антибиотикам объясняется наличием стеролов в составе их мембраны, а устойчивость бактерий, спирохет, риккетсий и других микроорганизмов — отсутствием данного компонента. Возникновение резистентности к этим антибиотикам у дрожжеподобных грибов наблюдается редко. Антибиотики, ингибирующие синтез белка на рибосомах бактериальных клетокЭто самая многочисленная группа антибиотиков, включающая разнообразные по своему химическому составу природные соединения, преимущественно продуцируемые актиномицетами. К ним относятся аминогликозидные антибиотики, группа тетрациклина, левомицетин, макролиды и др. Аминогликозидные антибиотикиПервый антибиотик этой группы стрептомицин был выделен 3. Ваксманом с соавторами еще в 1943 г. вслед за пенициллином. В настоящее время в группу включены стрептомицина сульфат, стрептосульфамицина сульфат, дегидрострептомицина сульфат и др. Стрептомицин является сложным органическим основанием, молекула которого состоит из трех частей: стрептидина, стрептозы и N-метилглюкозамина. Антибактериальный спектр стрептомицина и его производных включает большое число видов грамотрицательных бактерий: кишечная палочка, шигеллы, клебсиеллы, бруцеллы, бактерии туляремии, чумы, вибрион холеры. К ним чувствительны гноеродные кокки, в том числе устойчивые к пенициллину. Основной особенностью стрептомицинов является их способность подавлять размножение микобактерии туберкулеза. Механизм антибактериального действия стрептомицина заключается в способности блокировать субъединицу рибосомы 30S, а также нарушать считывание генетического кода. При этом кодоны иРНК неправильно считываются антикодонами тРНК- Например, кодон УУУ, кодирующий фенилаланин, считывается какАУУ, в результате чего его место занимает изолейцин, что приводит к образованию ненужного для бактериальной клетки полипептида. Недостатком стрептомицина является быстрое возникновение к нему резистентных бактерий. К аминогликозидам 1-го поколения наряду со стрептомицином относятся мономицин, неомицин, канамицин; аминогликозиды 2-го поколения — гентамицин, тобрамицин, сизомицин, амикацин (полусинтетическое производное канамицина). Перечисленные антибиотики отличаются друг от друга по химической структуре и фармакологическим свойствам. Антибактериальный спектр этих антибиотиков в основном сходен со стрептомициновым. Однако чувствительность к каждому из них варьирует в зависимости от вида и штамма перечисленных бактерий. Например, к мономицину более чувствительны стафилококки, шигеллы, клебсиеллы, малочувствительны стрептококки, чувствительность протеев широко изменяется. Гентамицин более активен, чем другие аминогликозиды, в отношении протеев, тобрамицин — синегнойной палочки. Сизомицин по антибактериальному спектру близок к гентамицину, но отличается от него более высокой активностью. Амикацин является одним из наиболее активных аминогликозидов. Резистентность бактерий к аминогликозидным антибиотикам в отличие от стрептомицина формируется постепенно. Кроме того, бактерии, резистентные к одному из препаратов группы стрептомицина, приобретают устойчивость и к другим препаратам этой группы, но сохраняют чувствительность к аминогликозидным антибиотикам. Вместе с тем бактерии обычно приобретают перекрестную устойчивость к неомицину, мономицину, канамицину или к гентамицину, тобрамицину, сизомицину. Однако многие из них сохраняют при этом чувствительность к амикацину. studfiles.net Рибосомы как точки приложения антибиотиковАнтибиотики – это группа соединений природного происхождения или их полусинтетических и синтетических аналогов, обладающих антимикробным или противоопухолевым действием.В основе действия многих известных в настоящее время наиболее эффективных антибиотиков лежит блокирование синтеза белка на рибосомах. Высокая эффективность этих замечательных лекарственных препаратов объясняется тем, что они подавляют синтез белка бактериальных 70 S-рибосом, не влияя при этом на рибосомы эукариотических клеток. В других случаях избирательная токсичность антибиотиков обусловлена значительно более высокой проницаемостью бактериальных мембран по сравнению с мембранами животных клеток. Список антибиотиков, действующих на уровне рибосом, весьма велик. Антибиотики действующие на рибосомы подавляют белковый синтез. Нарушение синтеза белка может происходить на всех уровнях, начиная с процесса считывания информации с ДНК и кончая взаимодействием с рибосомами – блокирование связывания транспортной т-РНК с 30S субъединицами рибосом (аминогликозиды), с 50S субъединицами рибосом (макролиды) или с информационной и-РНК (на 30S субъединице рибосом – тетрациклины). Хотя аминогликозидный антибиотик стрептомицин, неомицины и канамицин содержат в своем составе одну общую структурную группу, тем не менее все они связываются с рибосомами по-разному. В результате своеобразного действия стрептомицина рибосомы начинают неправильно считывать код. При этом неправильно считывается главным образом первое основание кодона. в группу антибиотиков действующих на рибосомы входят: – аминогликозиды, – макролиды, – тетрациклины, – фузидин, – линкомицин, – хлорамфеникол (левомицетин), нарушающий синтез белка микробной клеткой на стадии переноса аминокислот на рибосомы. Механизм действияаминогликозидов связан с необратимым угнетением синтеза белка на уровне рибосом у чувствительных к ним микроорганизмов. В отличие от других ингибиторов синтеза белка аминогликозиды оказывают не бактериостатическое, а бактерицидное действие. Аминогликозиды проникают в клетки бактерий путем пассивной диффузии через поры наружной мембраны и путем активного транспорта. Транспорт аминогликозидов через цитоплазматическую мембрану зависит от переноса электронов в дыхательной цепи, этот этап поступления их в клетку, т.н. энергозависимый этап I, является лимитирующим. Транспорт аминогликозидов через цитоплазматическую мембрану замедляется или полностью блокируется в присутствии ионов Ca2+ или Mg2+, в гиперосмолярной среде, при низких значениях pH и в анаэробных условиях. После проникновения в клетку аминогликозиды связываются со специфическими белками-рецепторами на 30S субъединице рибосом бактерий. 30S субъединица состоит из 21 белка и одной молекулы 16S рРНК (рибосомной РНК). Например, в связывании стрептомицина с рибосомами участвуют по крайней мере три белка и, возможно, 16S рРНК. Аминогликозиды нарушают рибосомальный белковый синтез несколькими путями: 1) антибиотики связываются с 30S субъединицей рибосомы и нарушают инициацию синтеза белка, фиксируя комплекс, состоящий из 30S- и 50S- субъединиц, на инициирующем кодоне иРНК; это приводит к накоплению аномальных инициирующих комплексов (т.н. моносомы) и прекращению дальнейшей трансляции; 2) связываясь с 30S субъединицей рибосомы, аминогликозиды нарушают считывание информации с РНК, что приводит к преждевременному окончанию трансляции и отсоединению рибосомного комплекса от белка, синтез которого не завершен; 3) кроме того, аминогликозиды вызывают одиночные аминокислотные замены в растущей полипептидной цепи, в результате чего образуются дефектные белки. Синтезирующиеся аномальные белки, встраиваясь в цитоплазматическую мембрану, могут нарушать ее структуру, изменять проницаемость и ускорять проникновение аминогликозидов внутрь клетки. Этот этап транспорта аминогликозидов — т.н. энергозависимый этап II. В результате постепенного разрушения цитоплазматической мембраны происходит выход из бактериальной клетки ионов, крупных молекул, белков. Бактерицидный эффект аминогликозидов, возможно, объясняется тем, что образование неполноценных полипептидов и угнетение синтеза нормальных белков в микробной клетке приводит к нарушению важных функций клетки, поддерживающих ее жизнеспособность, к нарушению структуры и функции цитоплазматической мембраны бактерий и, в конечном счете, приводит к гибели клетки. Принцип действия макролидов Антимикробное действие макролидов обусловлено нарушением синтеза белка на этапе трансляции в клетках чувствительных микроорганизмов. Молекула антибиотика способна обратимо связываться с каталитическим пептидил-трансферазным центром (P-site) рибосомальной 50S-субъединицы и вызывать отщепление комплекса пептидил-тРНК (представляющего собой растущую пептидную цепь) от рибосомы. При этом нарушается цикличность последовательного присоединения пептидной цепи к пептидил-трансферазному центру (P-site) и акцепторному аминоацил-тРНК-центру (A-site) 50S-субъединицы, то есть ингибируются реакции транслокации и транспептидации . В результате приостанавливается процесс формирования и наращивания пептидной цепи. Связывание макролидов с 50S-субъединицей возможно на любой стадии рибосомального цикла. Выявлено, что 14- и 16-членные макролиды отличаются по особенностям связывания с различными доменами пептидил-трансферазного центра. Рис. 2. Механизм синтеза белка в рибосоме микробной клетки. (M - точка приложения действия макролидов) Механизм действия тетрациклинов Тетрациклины являются специфическими ингибиторами как EF-Tu-промотируемого, так и неэнзиматического связывания аминоацил-тРНК с A-участком бактериальной 70S рибосомы. Тетрациклины подавляют также кодон-зависимое связывание аминоацил-тРНК с изолированной 30S субчастицей бактериальной рибосомы. В соответствии с этим, место специфического связывания тетрациклинов с рибосомой обнаружено на 30S субчастице рибосомы, хотя при более высоких концентрациях они могут связываться также и с 50S субчастицей, обнаруживая побочные действия. Интересно, что когда тройственный комплекс Aa-tRNA•EF-Tu•GTP взаимодействует с 70S рибосомой в присутствии тетрациклиновых антибиотиков, то ГТФ гидролизуется и EF-G•GDP освобождается, но аминоацил-тРНК не остаётся связанной. По-видимому, антибиотик, будучи связан где-то в районе тРНК-связывающего A-участка на 30S субчастице рибосомы, ослабляет сродство участка к тРНК, приводя к её плохому удержанию после ухода EF-Tu. Хотя тетрациклины не действуют на эукариотические клетки из-за непроницаемости их мембран для антибиотика, в эукариотических бесклеточных системах они тоже оказываются сильными ингибиторами, подавляя связывание аминоацил-тРНК с 80S рибосомами. Хлорамфеникол, с одной стороны, подавляет синтез белка на конечном этапе биосинтеза белковой молекулы, а с другой стороны, тормозит освобождение рибосомы от пептида, что также приводит к остановке синтеза белка. Под действием хлорамфеникола немедленно прекращается синтез белка микроорганизмов, синтез нуклеиновых кислот и пептидогликана при этом продолжается, хотя идет с меньшей скоростью. Все это указывает на то, что первичной мишенью действия хлорамфеникола является синтез белка. Нуклеиновые кислоты, синтезированные в присутствии антибиотика, отличаются от кислот, синтезированных при его отсутствии. Показано, что под влиянием антибиотика нарушается нормальный синтез РНК, в то время как синтез ДНК непосредственно не тормозится им. Участок лабильного связывания хлорамфеникола локализован на 50S субчастице рибосом. Хлорамфеникол полностью ингибирует реакцию пуромицина с пептидил-тРНК, выступая его конкурентным ингибитором. При этом синтез пептида полностью прекращается, и он остается связанным с рибосомами. Предполагают, что хлорамфеникол имитирует аминоацильный конец молекулы аминоацил-тРНК, а его дихлорацетамидная группировка соответствует аминоацилу. Местом действия хлорамфеникола является A-участок 50S субчастицы рибосом, где антибиотик конкурирует с аминоацильным концом молекулы аминоацил-тРНК, препятствуя ее вхождению в A-участок, что сопровождается подавлением биосинтеза белка. В нормальном состоянии бактерия синтезирует белки, которые выходят из бактериальной клетки через специальную транспортную систему, образованную микропорами. В момент выхода наружу белковая молекула вытянута и очень похожа на спагетти. Наш организм воспринимает такие белки как токсины, угнетающие, например, наш иммунитет. При введении антибиотиков нарушается синтез белков в бактериальной клетке за счёт того, что хлорамфеникол останавливает рибосому на полпути к полному синтезу белков. В результате в месте, где синтез был прерван, образуется «узел», который уже не даёт пройти белку через микропоры. Чем меньше в бактерии таких микропор, тем раньше она погибнет, так как они быстрее «засорятся» белковыми «узлами». Кроме того, блокировка пор ведёт к выработке молекулярного сигнала стресса, способствующего увеличению концентраций протеиназ, способствующих расщеплению белков внутри клетки и, в частности, гибели бактериальной клетки. Под действием хлорамфеникола нарушение включения аминокислот в белки сопровождается изменением физико-химических свойств рибосом. Антибиотик оказывает влияние на процессы образования и самих рибосомных частиц, приводя к появлению недостроенных рибосом с резко ослабленной способностью к синтезу белка. Таким образом, нарушение синтеза белка под действием хлорамфеникола на конечной стадии его биосинтеза может осуществляться несколькими путями: во-первых, хлорамфеникол может нарушить образование нормально функционирующих рибосом клетки; во-вторых, взаимодействуя с тРНК, антибиотик может нарушить ее связь с рибосомой; в-третьих, возможно образование комплекса антибиотик — рибосома, нарушающего деятельность рибосом. Одним из наиболее возможных путей подавления белкового синтеза под действием хлорамфеникола служит образование ассоциации антибиотика с рибосомами. Эта взаимосвязь происходит мгновенно, не зависит от наличия определенной энергии и времени инкубации, легко обратима. Она может нарушаться при наличии в среде некоторых антибиотиков. Механизм действия фузидиевой кислоты. Фузидиевая кислота ингибирует в микробной клетке синтез белка на уровне рибосом, взаимодействует с фактором элонгации микробной клетки (фактор элонгации G, у прокариот — белок тип 2), который необходим для процесса транслокации на рибосоме при образовании пептидных связей. Под действием фузидиевой кислоты образуется комплекс фактора элонгации с органическими фосфатами клетки, нарушается функция фактора элонгации, гидролиз гуанозинфосфатов и прекращается процесс удлинения пептидной связи и синтез белка. Фузидиевая кислота не нарушает синтез белка в клетках эукариотов, так как они имеют другие типы факторов элонгации (тип 1 и Tu), которые не чувствительны к действию фузидиевой кислоты. В высоких концентрациях фузидиевая кислота ингибирует так же процесс связывания тРНК с донорским участком рибосом. В высоких концентрациях фузидиевая кислота может подавлять репликацию некоторых вирусов, что может быть связано с цитотоксическим действием этих концентраций Линкомицин по антибактериальному действию близок к макролидам. Ингибирует синтез белка на уровне рибосом, действует бактериостатически или бактерицидно (в зависимости от концентрации). Механизм антимикробного действия связан с подавлением синтеза белка, блокирования образования полисомальных функциональных комплексов и трансляции связанных с транспортной РНК аминокислот. Место связывания антибиотика — пептидилтрансферазный центр на 50S субчастице. Линкомицин конкурирует с хлорамфениколом за связывание с рибосомой. По-видимому, он ингибирует взаимодействие акцепторного субстрата с пептидилтрансферазным центром по конкурентному механизму. В 2009 году была получена нобелевская премия за картирование рибосомы. Это позволит ученым в скором времени синтезировать новые, еще более эффективные антибиотики, воздействующие на рибосому. Рибосомы как точки приложения антибиотиков www.coolreferat.com Лекция - Рибосомы как точки приложения антибиотиковАнтибиотики – это группа соединений природного происхождения или их полусинтетических и синтетических аналогов, обладающих антимикробным или противоопухолевым действием. В основе действия многих известных в настоящее время наиболее эффективных антибиотиков лежит блокирование синтеза белка на рибосомах. Высокая эффективность этих замечательных лекарственных препаратов объясняется тем, что они подавляют синтез белка бактериальных 70 S-рибосом, не влияя при этом на рибосомы эукариотических клеток. В других случаях избирательная токсичность антибиотиков обусловлена значительно более высокой проницаемостью бактериальных мембран по сравнению с мембранами животных клеток. Список антибиотиков, действующих на уровне рибосом, весьма велик. Антибиотики действующие на рибосомы подавляют белковый синтез. Нарушение синтеза белка может происходить на всех уровнях, начиная с процесса считывания информации с ДНК и кончая взаимодействием с рибосомами – блокирование связывания транспортной т-РНК с 30S субъединицами рибосом (аминогликозиды), с 50S субъединицами рибосом (макролиды) или с информационной и-РНК (на 30S субъединице рибосом – тетрациклины). Хотя аминогликозидный антибиотик стрептомицин, неомицины и канамицин содержат в своем составе одну общую структурную группу, тем не менее все они связываются с рибосомами по-разному. В результате своеобразного действия стрептомицина рибосомы начинают неправильно считывать код. При этом неправильно считывается главным образом первое основание кодона. в группу антибиотиков действующих на рибосомы входят: – аминогликозиды, – макролиды, – тетрациклины, – фузидин, – линкомицин, – хлорамфеникол (левомицетин), нарушающий синтез белка микробной клеткой на стадии переноса аминокислот на рибосомы. Механизм действия аминогликозидов связан с необратимым угнетением синтеза белка на уровне рибосом у чувствительных к ним микроорганизмов. В отличие от других ингибиторов синтеза белка аминогликозиды оказывают не бактериостатическое, а бактерицидное действие. Аминогликозиды проникают в клетки бактерий путем пассивной диффузии через поры наружной мембраны и путем активного транспорта. Транспорт аминогликозидов через цитоплазматическую мембрану зависит от переноса электронов в дыхательной цепи, этот этап поступления их в клетку, т.н. энергозависимый этап I, является лимитирующим. Транспорт аминогликозидов через цитоплазматическую мембрану замедляется или полностью блокируется в присутствии ионов Ca2+ или Mg2+, в гиперосмолярной среде, при низких значениях pH и в анаэробных условиях. После проникновения в клетку аминогликозиды связываются со специфическими белками-рецепторами на 30S субъединице рибосом бактерий. 30S субъединица состоит из 21 белка и одной молекулы 16S рРНК (рибосомной РНК). Например, в связывании стрептомицина с рибосомами участвуют по крайней мере три белка и, возможно, 16S рРНК. Аминогликозиды нарушают рибосомальный белковый синтез несколькими путями: 1) антибиотики связываются с 30S субъединицей рибосомы и нарушают инициацию синтеза белка, фиксируя комплекс, состоящий из 30S- и 50S- субъединиц, на инициирующем кодоне иРНК; это приводит к накоплению аномальных инициирующих комплексов (т.н. моносомы) и прекращению дальнейшей трансляции; 2) связываясь с 30S субъединицей рибосомы, аминогликозиды нарушают считывание информации с РНК, что приводит к преждевременному окончанию трансляции и отсоединению рибосомного комплекса от белка, синтез которого не завершен; 3) кроме того, аминогликозиды вызывают одиночные аминокислотные замены в растущей полипептидной цепи, в результате чего образуются дефектные белки. Синтезирующиеся аномальные белки, встраиваясь в цитоплазматическую мембрану, могут нарушать ее структуру, изменять проницаемость и ускорять проникновение аминогликозидов внутрь клетки. Этот этап транспорта аминогликозидов — т.н. энергозависимый этап II. В результате постепенного разрушения цитоплазматической мембраны происходит выход из бактериальной клетки ионов, крупных молекул, белков. Бактерицидный эффект аминогликозидов, возможно, объясняется тем, что образование неполноценных полипептидов и угнетение синтеза нормальных белков в микробной клетке приводит к нарушению важных функций клетки, поддерживающих ее жизнеспособность, к нарушению структуры и функции цитоплазматической мембраны бактерий и, в конечном счете, приводит к гибели клетки. Принцип действия макролидов Антимикробное действие макролидов обусловлено нарушением синтеза белка на этапе трансляции в клетках чувствительных микроорганизмов. Молекула антибиотика способна обратимо связываться с каталитическим пептидил-трансферазным центром (P-site) рибосомальной 50S-субъединицы и вызывать отщепление комплекса пептидил-тРНК (представляющего собой растущую пептидную цепь) от рибосомы. При этом нарушается цикличность последовательного присоединения пептидной цепи к пептидил-трансферазному центру (P-site) и акцепторному аминоацил-тРНК-центру (A-site) 50S-субъединицы, то есть ингибируются реакции транслокации и транспептидации. В результате приостанавливается процесс формирования и наращивания пептидной цепи. Связывание макролидов с 50S-субъединицей возможно на любой стадии рибосомального цикла. Выявлено, что 14- и 16-членные макролиды отличаются по особенностям связывания с различными доменами пептидил-трансферазного центра. Рис. 2. Механизм синтеза белка в рибосоме микробной клетки. (M — точка приложения действия макролидов) Механизм действия тетрациклинов Тетрациклины являются специфическими ингибиторами как EF-Tu-промотируемого, так и неэнзиматического связывания аминоацил-тРНК с A-участком бактериальной 70S рибосомы. Тетрациклины подавляют также кодон-зависимое связывание аминоацил-тРНК с изолированной 30S субчастицей бактериальной рибосомы. В соответствии с этим, место специфического связывания тетрациклинов с рибосомой обнаружено на 30S субчастице рибосомы, хотя при более высоких концентрациях они могут связываться также и с 50S субчастицей, обнаруживая побочные действия. Интересно, что когда тройственный комплекс Aa-tRNA•EF-Tu•GTP взаимодействует с 70S рибосомой в присутствии тетрациклиновых антибиотиков, то ГТФ гидролизуется и EF-G•GDP освобождается, но аминоацил-тРНК не остаётся связанной. По-видимому, антибиотик, будучи связан где-то в районе тРНК-связывающего A-участка на 30S субчастице рибосомы, ослабляет сродство участка к тРНК, приводя к её плохому удержанию после ухода EF-Tu. Хотя тетрациклины не действуют на эукариотические клетки из-за непроницаемости их мембран для антибиотика, в эукариотических бесклеточных системах они тоже оказываются сильными ингибиторами, подавляя связывание аминоацил-тРНК с 80S рибосомами. Хлорамфеникол, с одной стороны, подавляет синтез белка на конечном этапе биосинтеза белковой молекулы, а с другой стороны, тормозит освобождение рибосомы от пептида, что также приводит к остановке синтеза белка. Под действием хлорамфеникола немедленно прекращается синтез белка микроорганизмов, синтез нуклеиновых кислот и пептидогликана при этом продолжается, хотя идет с меньшей скоростью. Все это указывает на то, что первичной мишенью действия хлорамфеникола является синтез белка. Нуклеиновые кислоты, синтезированные в присутствии антибиотика, отличаются от кислот, синтезированных при его отсутствии. Показано, что под влиянием антибиотика нарушается нормальный синтез РНК, в то время как синтез ДНК непосредственно не тормозится им. Участок лабильного связывания хлорамфеникола локализован на 50S субчастице рибосом. Хлорамфеникол полностью ингибирует реакцию пуромицина с пептидил-тРНК, выступая его конкурентным ингибитором. При этом синтез пептида полностью прекращается, и он остается связанным с рибосомами. Предполагают, что хлорамфеникол имитирует аминоацильный конец молекулы аминоацил-тРНК, а его дихлорацетамидная группировка соответствует аминоацилу. Местом действия хлорамфеникола является A-участок 50S субчастицы рибосом, где антибиотик конкурирует с аминоацильным концом молекулы аминоацил-тРНК, препятствуя ее вхождению в A-участок, что сопровождается подавлением биосинтеза белка. В нормальном состоянии бактерия синтезирует белки, которые выходят из бактериальной клетки через специальную транспортную систему, образованную микропорами. В момент выхода наружу белковая молекула вытянута и очень похожа на спагетти. Наш организм воспринимает такие белки как токсины, угнетающие, например, наш иммунитет. При введении антибиотиков нарушается синтез белков в бактериальной клетке за счёт того, что хлорамфеникол останавливает рибосому на полпути к полному синтезу белков. В результате в месте, где синтез был прерван, образуется «узел», который уже не даёт пройти белку через микропоры. Чем меньше в бактерии таких микропор, тем раньше она погибнет, так как они быстрее «засорятся» белковыми «узлами». Кроме того, блокировка пор ведёт к выработке молекулярного сигнала стресса, способствующего увеличению концентраций протеиназ, способствующих расщеплению белков внутри клетки и, в частности, гибели бактериальной клетки. Под действием хлорамфеникола нарушение включения аминокислот в белки сопровождается изменением физико-химических свойств рибосом. Антибиотик оказывает влияние на процессы образования и самих рибосомных частиц, приводя к появлению недостроенных рибосом с резко ослабленной способностью к синтезу белка. Таким образом, нарушение синтеза белка под действием хлорамфеникола на конечной стадии его биосинтеза может осуществляться несколькими путями: во-первых, хлорамфеникол может нарушить образование нормально функционирующих рибосом клетки; во-вторых, взаимодействуя с тРНК, антибиотик может нарушить ее связь с рибосомой; в-третьих, возможно образование комплекса антибиотик — рибосома, нарушающего деятельность рибосом. Одним из наиболее возможных путей подавления белкового синтеза под действием хлорамфеникола служит образование ассоциации антибиотика с рибосомами. Эта взаимосвязь происходит мгновенно, не зависит от наличия определенной энергии и времени инкубации, легко обратима. Она может нарушаться при наличии в среде некоторых антибиотиков. Механизм действия фузидиевой кислоты. Фузидиевая кислота ингибирует в микробной клетке синтез белка на уровне рибосом, взаимодействует с фактором элонгации микробной клетки (фактор элонгации G, у прокариот — белок тип 2), который необходим для процесса транслокации на рибосоме при образовании пептидных связей. Под действием фузидиевой кислоты образуется комплекс фактора элонгации с органическими фосфатами клетки, нарушается функция фактора элонгации, гидролиз гуанозинфосфатов и прекращается процесс удлинения пептидной связи и синтез белка. Фузидиевая кислота не нарушает синтез белка в клетках эукариотов, так как они имеют другие типы факторов элонгации (тип 1 и Tu), которые не чувствительны к действию фузидиевой кислоты. В высоких концентрациях фузидиевая кислота ингибирует так же процесс связывания тРНК с донорским участком рибосом. В высоких концентрациях фузидиевая кислота может подавлять репликацию некоторых вирусов, что может быть связано с цитотоксическим действием этих концентраций Линкомицин по антибактериальному действию близок к макролидам. Ингибирует синтез белка на уровне рибосом, действует бактериостатически или бактерицидно (в зависимости от концентрации). Механизм антимикробного действия связан с подавлением синтеза белка, блокирования образования полисомальных функциональных комплексов и трансляции связанных с транспортной РНК аминокислот. Место связывания антибиотика — пептидилтрансферазный центр на 50S субчастице. Линкомицин конкурирует с хлорамфениколом за связывание с рибосомой. По-видимому, он ингибирует взаимодействие акцепторного субстрата с пептидилтрансферазным центром по конкурентному механизму. В 2009 году была получена нобелевская премия за картирование рибосомы. Это позволит ученым в скором времени синтезировать новые, еще более эффективные антибиотики, воздействующие на рибосому. Рибосомы как точки приложения антибиотиков www.ronl.ru |
г.Самара, ул. Димитрова 131 [email protected] |
 |