|
|
||||||||||
|
Промышленная микробиология. Производство вторичных метаболитов. Производство антибиотиковПромышленная микробиология. Производство вторичных метаболитовВторичные метаболиты (идиолиты) - это низкомолекулярные соединения, не требующиеся на стадии роста чистой культуры, однако они необходимы для функционирования зрелой популяции. Часто они выполняют защитную роль при конкуренции с другими микроорганизмами. К ним относятся антибиотики, алкалоиды, гормоны роста растений, токсины.Производство антибиотиковАнтибиотиками называют продукты жизнедеятельности организмов, обладающие антибактериальным действием. Большинство известных в настоящее время антибиотиков являются веществами, выделяемыми различного вида микроорганизмами - бактериями, дрожжами, плесенями, актиномицетами. Антибиотики получены также из животных тканей и высших растений (фитонциды).Идея использования антагонизма между микроорганизмами (так называемого «антибиоза») для подавления болезнетворных микробов принадлежит И. И. Мечникову, положившему в конце прошлого века начало современному учению о лекарственных веществах микробов. Для того чтобы антибиотическое вещество могло быть применено в медицинской практике, необходима совокупность высокой антибактериальной активности и отсутствия токсического действия по отношению к макроорганизму. Из большого числа выделенных и изученных антибиотиков этому важнейшему требованию удовлетворяют очень немногие соединения. В химическом отношении антибиотики - вещества очень разнообразные, хотя некоторые из них представляют целые классы с подобной структурой, например: пенициллины, тетрациклины и др. В настоящее время установлено, что вещества, сходные по химической структуре, сходны и по характеру действия. Так, пенициллины действуют на клеточную стенку бактерий и препятствуют ее синтезу. Некоторое время бактерии еще размножаются, но, лишенные клеточной стенки, скоро погибают. Антибиотик стрептомицин, проникнув в клетку микроба, достигает рибосом (места синтеза белков) и блокирует их деятельность. Актиномицин действует на молекулу ДНК, в результате становится невозможным синтез информационной РНК, переносящей к рибосомам «приказы» ДНК о синтезе белков. Сходное действие проявляет и рифампицин, хотя и несколько иным способом: он снижает активность РНК-полимеразы и РНК не может образовываться. На ДНК действуют и молекулы противоопухолевого антибиотика митомицина С: прочно связываясь с ней, он препятствует дальнейшему синтезу ДНК. При повторных воздействиях молекул антибиотика клетка микроба погибает. Если же антибиотик вводится в недостаточном количестве, то клетки микроба восстанавливаются, и микроб выживает и дает потомство, устойчивое (резистентное) к действию данного антибиотика. Приведенные примеры действия антибиотиков - это лишь отдельные случаи их разнообразного биохимического воздействия на микроорганизмы. Классификация антибиотиковСреди основных принципов классификации антибиотиков рассмотрим следующие: 1. Классификация антибиотиков по биологическому происхождению: а) антибиотики, вырабатываемые микроорганизмами, относящимися к эубактериям; б) антибиотики, образуемые микроорганизмами, принадлежащими к порядку Actinomycetales; в) антибиотики, образуемые цианобактериями; г) антибиотики, образуемые несовершенными грибами; д) антибиотики, образуемые грибами, относящимися к классам базиди-мицетов и аскомицетов; е) антибиотики, образуемые лишайниками, водорослями и низшими растениями; ж) антибиотики, образуемые высшими растениями; з) антибиотики животного происхождения.2. Классификация по спектру биологического действия: а) противобактериальные антибиотики узкого спектра действия, активные преимущественно в отношении грамположительных организмов; б) противобактериальные антибиотики широкого спектра действия; в) противотуберкулезные антибиотики; г) противогрибные антибиотики; д) противоопухолевые антибиотики. 3. Классификация антибиотиков по химическому строению: а) антибиотики ациклического строения; б) антибиотики алициклического строения; в) тетрациклины; г) ароматические антибиотики; д) антибиотики-хиноны; е) антибиотики-кислородсодержащие гетероциклические соединения; ж) антибиотики-азотсодержащие гетероциклические соединения; з) антибиотики-аминогликозиды; и) металлсодержащие антибиотики. Основные этапы промышленного получения антибиотиковПосле установления высоких лечебных свойств первого антибиотика - пенициллина сразу же возникли задачи организации его производства в больших количествах. На первом этапе промышленное получение этого препарата носило примитивный, экономически нерентабельный характер. Выращивание продуцента антибиотика осуществлялось на средах, находящихся в небольших сосудах, при поверхностном культивировании гриба.Процесс развития гриба продолжался 8-10 суток. Такой способ культивирования гриба при большой затрате труда давал весьма низкий выход антибиотика, и себестоимость препарата была соответственно очень высокой. В результате поисков путей наиболее рационального способа производства антибиотика был предложен метод глубинного выращивания гриба в специальных емкостях-ферментаторах при продувании воздуха и перемешивании культуральной жидкости. Современное промышленное получение антибиотиков - это сложная многоступенчатая биотехнологическая схема, состоящая из ряда последовательных стадий: 1. Стадии биосинтеза (образования) антибиотика. Это основная биологическая стадия сложного процесса получения антибиотического вещества. Главная задача на этой стадии - создание оптимальных условий для развития продуцента и максимально возможного биосинтеза антибиотика. Высокая результативность стадии зависит от уровня биосинтетической активности продуцента антибиотика, времени его максимального накопления, стоимости сред для культивирования организма, в том числе стоимости применяемых предшественников, а также общих энергетических затрат на процессы, связанные с развитием продуцента антибиотического вещества. 2. Стадии предварительной обработки культуральной жидкости, клеток (мицелия) микроорганизма и фильтрации (отделение культуральной жидкости от биомассы продуцента). Эффективность стадии во многом определяется составом среды для выращивания продуцента антибиотика, характером его роста, местом основного накопления биологически активного вещества (в культуральной жидкости или внутриклеточно). 3. Стадия выделения и очистки антибиотика. На этой стадии, в зависимости от свойств антибиотика, его химического строения и основного места накопления антибиотического вещества, применяют различные методы выделения и очистки. В качестве основных методов используются экстрация, осаждение, сорбция на ионообменных материалах, упаривание, сушка. Особенность этой технологической стадии определяется тем, что на первой стадии работы имеют дело с небольшой концентрацией (~1 %) антибиотика в обрабатываемом растворе, тогда как на последующих этапах его концентрация увеличивается до 20-30 %. Все это требует применения различных емкостей и объемов используемых реагентов. 4. Стадии получения готовой продукции, изготовления лекарственных форм, расфасовки. Особенность стадии определяется очень высоким требованиям к качеству конечного продукта. В случае выпуска антибиотиков, предназначенных для инъекций, препараты должны быть стерильными; получение таких антибиотических препаратов, приготовление различных лекарственных форм, дозировка (расфасовка) и упаковка должны осуществляться в асептических условиях. Для максимального выхода антибиотика при культивировании продуцента используют комплекс мер, включающих подбор наиболее благоприятных для этих целей питательных сред и режимов культивирования организма. Весь этот комплекс мер включается в понятие «управляемый биосинтез». В промышленных условиях управляемый биосинтез требует строгого соблюдения технологического процесса как на стадии подготовки инокулята, так и на стадии биосинтеза. На стадии подготовки инокулята особое внимание обращают на состав среды, на которой выращивается организм, на возраст клеток или мицелия. На стадии биосинтеза, кроме состава среды, большую роль играют скорость потребления тех или иных компонентов, предшественники, регуляция процесса аэрации культуры, поддержание соответствующих температуры и рН среды и других показателей режима культивирования. В современных условиях производства принимают меры к максимальному снижению себестоимости препаратов путем интенсификации всех стадий технологического процесса и, прежде всего, повышением эффективности первой стадии - биосинтеза антибиотического вещества. Для этого необходимо: а) внедрение в производство наиболее высокопродуктивных штаммов микроорганизмов - продуцентов антибиотиков; б) создание и обеспечение самых благоприятных условий развития продуцента антибиотика на относительно дешевых средах; в) широкое использование математических методов планирования процесса развития организма и электронно-вычислительной техники с целью оптимизации и моделирования условий его культивирования, обеспечивающих максимальный выход антибиотика; г) применение современного оборудования на всех стадиях технологического процесса с автоматизированными контролирующими устройствами основных параметров развития организма и стадий биосинтеза антибиотика. Л.В. Тимощенко, М.В. Чубик medbe.ru 7.2. Производство антибиотиковТехнологический процесс производства антибиотиков представлен на рис. 20. Биосинтез антибиотика осуществляется микроорганизмами на определённом этапе их развития. Эта закономерность характерна для бактерий, мицелиальных грибов (Penicillium chrysogenum, Aspergillus fumi-gatus и др.) и для большинства актиномИцетов, образующих такие антибиотики, как стрептомицин, хлортетрациклин, окситетрациклин и другие. Максимально высокую активность штамма-продуцента способна обеспечить технология рекомбинантных ДНК, так как можно создавать новые антибиотики с уникальной структурой, оказывающие более мощное воздействие на определенные микроорганизмы и обладающие минимальными побочными эффектами. Генно-инженерные подходы используются для увеличения выхода антибиотиков и соответственно снижения стоимости их производства. Примеры промышленных продуцентов основных антибиотиков, используемые в РФ, представлены в табл. 3. При проведении первой стадии технологического процесса (рис. 20) применяют натуральные среды неопределенного состава, к числу которых относят продукты крахмалопаточного производства, агар, желатин, отруби, зерно. Композиция натуральных сред неопределенного состава не является постоянной. Например, агар, получаемый из разных видов морских водорослей, по химическому составу - сложный эфирный комплекс полисахарида с серной кислотой и разнообразными микроэлементами. Агар содержит также жирные кислоты, биотин, тиамин или его компоненты. В картофельной среде с глюкозой и пептоном, при одной и той же партии пептона и химически чистой глюкозы, состав картофельного экстракта зависит от сорта картофеля, места его произрастания, времени уборки, срока и режима хранения и других причин. Поэтому для получения сопоставимых результатов, особенно при изучении физиологических и биохимических особенностей микроорганизма, применяют синтетические среды, в состав которых входят определенные химически чистые соединения, взятые в точно указанных концентрациях. Задача второй стадии — создать оптимальные условия для развития продуцента и максимально возможного биосинтеза необходимого антибиотика. Особенность производства антибиотиков - двухфазный характер развития продуцентов. В первой фазе развития культуры, носящей название тропофазы (фазы сбалансированного роста микроорганизма), идет интенсивное накопление биомассы продуцента. Продуцент синтезирует белки, нуклеиновые кислоты, углеводы, ферменты, и другие БАВ, необходимые для роста микроорганизма; наблюдается быстрое потребление основных компонентов субстрата, интенсивное поглощение кислорода. В культуральной среде может снижаться рН, как результат накопления органических кислот. В тропофазе антибиотик, как правило, не образуется или его количество незначительное. Возможно, в этой фазе синтез ферментов, принимающих участие в образовании антибиотика, подавлен. Во второй фазе - идиофазе (фазе несбалансированного роста микроорганизма) - накопление биомассы замедлено. Культуральная среда уже обеднена компонентами, необходимыми для развития продуцента и обогащена продуктами его жизнедеятельности. В культуре преобладают протеолитические процессы, приводящие к её подщелачиванию. Продукты метаболизма микроорганизма частично используются на построение клеток мицелия, частично - на синтез антибиотика. Максимум биосинтеза антибиотика в культуральной среде наступает, как правило, после максимального накопления биомассы, этот максимум неодинаков у разных микроорганизмов и при разных условиях культивирования. Практика промышленной микробиологии показывает, что процесс получения того или иного продукта жизнедеятельности активнее идет в смешанных культурах, при совместном развитии нескольких видов (чаще двух) микроорганизмов. Совместным культивированием специально подобранных микроорганизмов создают условия, при которых значительно увеличивается образование антибиотиков, как результат активации ряда биохимических процессов. В смешанных культурах ферментативная реакция служит ответом на проявление определенных антагонистических взаимоотношений. При совместном культивировании различных микробов могут возникать своеобразные гибриды этих организмов, обладающие иными свойствами по сравнению с исходными чистыми культурами. С накоплением определенной концентрации антибиотика рост микроорганизмов прекращается (например, Streptomyces griseus прекращает свой рост при концентрации в среде стрептомицина сульфата 0,5%). Из культуральной среды антибиотики выделяют экстракцией органическими растворителями, осаждением, адсорбцией. Очистку антибиотиков проводят повторной заменой растворителя, адсорбционно-хроматографическими методами, ВЭЖХ. От степени чистоты препарата, влажности, температуры, рН растворителя зависит стабильность антибиотика. Затем оценивают антимикробный спектр, стерильность, токсичность, пирогенность, действие на лейкоциты крови и другие показатели. На всех стадиях получения антибиотика строго соблюдается технологическая дисциплина, все процессы осуществляются в асептических условиях. studfiles.net Производство антибиотиковТехнологический процесс производства антибиотиков представлен на рис. 20. Биосинтез антибиотика осуществляется микроорганизмами на определённом этапе их развития. Эта закономерность характерна для бактерий, мицелиальных грибов (Penicillium chrysogenum, Aspergillus fumi-gatus и др.) и для большинства актиномИцетов, образующих такие антибиотики, как стрептомицин, хлортетрациклин, окситетрациклин и другие. Максимально высокую активность штамма-продуцента способна обеспечить технология рекомбинантных ДНК, так как можно создавать новые антибиотики с уникальной структурой, оказывающие более мощное воздействие на определенные микроорганизмы и обладающие минимальными побочными эффектами. Генно-инженерные подходы используются для увеличения выхода антибиотиков и соответственно снижения стоимости их производства. Примеры промышленных продуцентов основных антибиотиков, используемые в РФ, представлены в табл. 3. При проведении первой стадии технологического процесса (рис. 20) применяют натуральные среды неопределенного состава, к числу которых относят продукты крахмалопаточного производства, агар, желатин, отруби, зерно. Композиция натуральных сред неопределенного состава не является постоянной. Например, агар, получаемый из разных видов морских водорослей, по химическому составу - сложный эфирный комплекс полисахарида с серной кислотой и разнообразными микроэлементами. Агар содержит также жирные кислоты, биотин, тиамин или его
компоненты. В картофельной среде с глюкозой и пептоном, при одной и той же партии пептона и химически чистой глюкозы, состав картофельного экстракта зависит от сорта картофеля, места его произрастания, времени уборки, срока и режима хранения и других причин. Поэтому для получения сопоставимых результатов, особенно при изучении физиологических и биохимических особенностей микроорганизма, применяют синтетические среды, в состав которых входят определенные химически чистые соединения, взятые в точно указанных концентрациях. Задача второй стадии — создать оптимальные условия для развития продуцента и максимально возможного биосинтеза необходимого антибиотика. Особенность производства антибиотиков - двухфазный характер развития продуцентов. В первой фазе развития культуры, носящей название тропофазы (фазы сбалансированного роста микроорганизма), идет интенсивное накопление биомассы продуцента. Продуцент синтезирует белки, нуклеиновые кислоты, углеводы, ферменты, и другие БАВ, необходимые для роста микроорганизма; наблюдается быстрое потребление основных компонентов субстрата, интенсивное поглощение кислорода. В культуральной среде может снижаться рН, как результат накопления органических кислот. В тропофазе антибиотик, как правило, не образуется или его количество незначительное. Возможно, в этой фазе синтез ферментов, принимающих участие в образовании антибиотика, подавлен. Во второй фазе - идиофазе (фазе несбалансированного роста микроорганизма) - накопление биомассы замедлено. Культуральная среда уже обеднена компонентами, необходимыми для развития продуцента и обогащена продуктами его жизнедеятельности. В культуре преобладают протеолитические процессы, приводящие к её подщелачиванию. Продукты метаболизма микроорганизма частично используются на построение клеток мицелия, частично - на синтез антибиотика. Максимум биосинтеза антибиотика в культуральной среде наступает, как правило, после максимального накопления биомассы, этот максимум неодинаков у разных микроорганизмов и при разных условиях культивирования. Практика промышленной микробиологии показывает, что процесс получения того или иного продукта жизнедеятельности активнее идет в смешанных культурах, при совместном развитии нескольких видов (чаще двух) микроорганизмов. Совместным культивированием специально подобранных микроорганизмов создают условия, при которых значительно увеличивается образование антибиотиков, как результат активации ряда биохимических процессов. В смешанных культурах ферментативная реакция служит ответом на проявление определенных антагонистических взаимоотношений. При совместном культивировании различных микробов могут возникать своеобразные гибриды этих организмов, обладающие иными свойствами по сравнению с исходными чистыми культурами. С накоплением определенной концентрации антибиотика рост микроорганизмов прекращается (например, Streptomyces griseus прекращает свой рост при концентрации в среде стрептомицина сульфата 0,5%). Из культуральной среды антибиотики выделяют экстракцией органическими растворителями, осаждением, адсорбцией. Очистку антибиотиков проводят повторной заменой растворителя, адсорбционно-хроматографическими методами, ВЭЖХ. От степени чистоты препарата, влажности, температуры, рН растворителя зависит стабильность антибиотика. Затем оценивают антимикробный спектр, стерильность, токсичность, пирогенность, действие на лейкоциты крови и другие показатели. На всех стадиях получения антибиотика строго соблюдается технологическая дисциплина, все процессы осуществляются в асептических условиях.
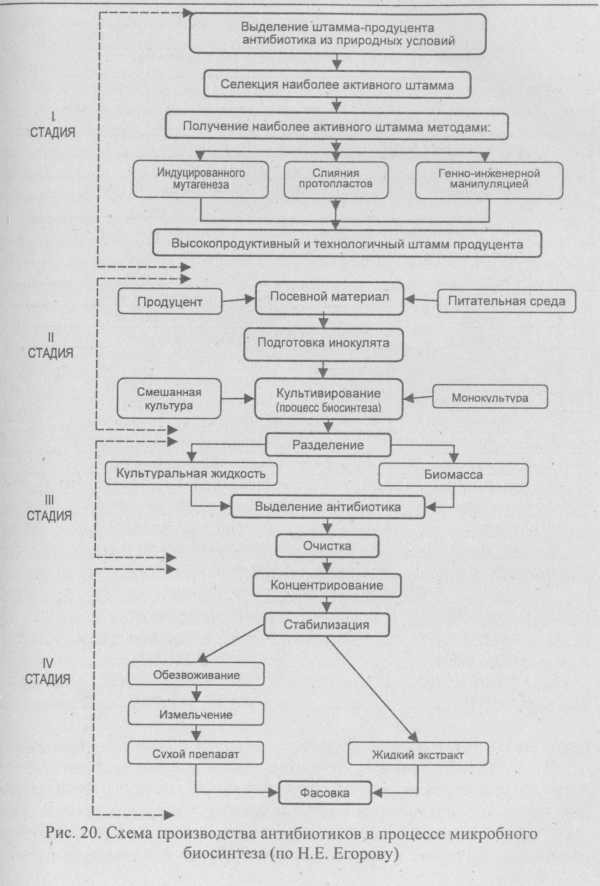
Похожие статьи:poznayka.org Как делается антибиотик - материал, история, используемые, обработка, компоненты, состав, структура, процедура, этапыАнтибиотикАнтибиотики - это химические вещества, которые могут препятствовать росту и содействовать уничтожению вредных микроорганизмов. Они получены из специальных микроорганизмов или других живых систем и производятся в промышленном масштабе с использованием процесса ферментации. Хотя принципы антибиотического действия не были обнаружены до двадцатого века, первое известное использование антибиотиков было в Китае более 2500 лет назад. Сегодня было зарегистрировано более 10 000 антибиотиков. В настоящее время антибиотики представляют собой многомиллиардную индустрию, которая продолжает расти каждый год.Формы антибиотиковАнтибиотики используются во многих формах, каждая из которых предъявляет несколько разных производственных требований. Для бактериальных инфекций на поверхности кожи, глазу или ухе антибиотик можно наносить в виде мази или крема. Если инфекция является внутренней, антибиотик можно проглатывать или вводить непосредственно в организм. В этих случаях антибиотик распространяется по всему организму и доставляется путем абсорбции в кровоток.Антибиотики отличаются химическими свойствами, поэтому верно говорить, что они также различаются по типам инфекций, которые они вылечивают, и способам их лечения. Некоторые антибиотики уничтожают бактерии, влияя на структуру их клеток. Это может произойти одним из двух способов. Во-первых, антибиотик может ослабить клеточные стенки инфекционных бактерий, что приводит к их разрыву. Во-вторых, антибиотики могут вызывать накопление бактериальных клеток, повреждая клеточные мембраны. Другой способ, с помощью которого действуют антибиотики, - это вмешательство в метаболизм бактерий. Некоторые антибиотики, такие как тетрациклин и эритромицин, препятствуют синтезу белка. Антибиотики, такие как рифампин, ингибируют биосинтез нуклеиновой кислоты. Другие антибиотики, такие как сульфонамид или триметоприм, оказывают общее блокирующее действие на клеточный метаболизм. Производство антибиотиковКоммерческое развитие антибиотика - это долгое и дорогостоящее предприятие. Процесс начинается с фундаментальных исследований, направленных на выявление организмов, которые производят антибиотические соединения. На этом этапе тысячи видов подвергаются скринингу на любые признаки антибактериального действия. Когда признак обнаружен, этот биологический вид будет протестирован против множества известных инфекционных бактерий. Если результаты являются многообещающими, организм выращивается в больших масштабах, поэтому можно выделить соединение, ответственное за антибиотический эффект. Это сложная процедура, потому что тысячи антибиотиков уже обнаружены. Часто ученые понимают, что их новые антибиотики не уникальны. Если материал пройдет этот этап, можно провести дальнейшие испытания. Обычно это связано с клиническим тестированием, чтобы доказать, что антибиотик работает у животных и людей и не вреден. Если эти тесты пройдут, Администрация по контролю за продуктами и лекарствами (FDA) должна затем утвердить антибиотик в качестве нового препарата. Весь этот процесс может занять много лет.Крупномасштабное производство антибиотика зависит от процесса ферментации. Во время ферментации вырабатываются большие количества продуцирующего антибиотик организма. Во время ферментации организмы продуцируют антибиотический материал, который затем может быть выделен для использования в качестве лекарственного средства. Для того чтобы новый антибиотик был экономически целесообразным, производители должны иметь возможность получать высокий выход лекарственного средства из процесса ферментации и быть в состоянии легко изолировать его. Обширные исследования обычно требуются до того, как новый антибиотик может быть коммерчески расширен. История антибиотиковХотя наши научные знания о антибиотиках только недавно были основаны, практическое применение антибиотиков существует на протяжении веков. Первое известное использование было китайцами около 2500 лет назад. Уже тогда они обнаружили, что применение плесневого творога сои к инфекциям имеет определенные терапевтические преимущества. Это было настолько эффективно, что стало стандартным лечением. Имеющиеся данные свидетельствуют о том, что в других культурах тоже используются вещества антибиотического типа в качестве терапевтических агентов. Суданско-нубийская цивилизация использовала тип тетрациклинового антибиотика уже в 350 г.н.д. В Европе в средние века в борьбе с инфекцией применялись сырые растительные экстракты и творожные сыворотки. Хотя эти культуры использовали антибиотики, общие принципы антибиотического действия не были поняты до двадцатого века.Кто изобрел антибиотикиРазвитие современных антибиотиков зависело от нескольких ключевых людей, которые продемонстрировали миру, что материалы, полученные из микроорганизмов, могут быть использованы для лечения инфекционных заболеваний. Одним из первых пионеров в этой области был Луи Пастер. В 1877 году он и его коллега обнаружили, что рост болезнетворных бактерий сибирской язвы может быть ингибирован сапрофитными бактериями. Они показали, что большое количество культур сибирской язвы можно назначать животным без каких-либо побочных эффектов, если даны сапрофитные бациллы. В течение следующих нескольких лет другие наблюдения подтверждают тот факт, что некоторые материалы, полученные из бактерий, могут предотвратить рост болезнетворных бактерий. В 1928 году Александр Флеминг внес один из самых важных вкладов в область антибиотиков. В эксперименте он обнаружил, что штамм зеленой пенициллиновой формы ингибировал рост бактерий на пластине агара. Это привело к разработке первого антибиотика современной эпохи, пенициллина. Несколько лет спустя в 1932 году была опубликована статья, в которой предлагается метод лечения инфицированных ран с использованием препарата пенициллина. Хотя эти ранние образцы пенициллина были функциональными, они не были надежными и были необходимы дальнейшие уточнения. Эти улучшения появились в начале 1940-х годов, когда Говард Флори и его коллеги обнаружили новый штамм Penicillium, который обеспечивал высокие урожаи пенициллина. Это позволило широкомасштабное производство пенициллина, который помог запустить современную антибиотическую промышленность. В 1928 году Александр Флеминг внес один из самых важных вкладов в область антибиотиков. В эксперименте он обнаружил, что штамм зеленой пенициллиновой формы ингибировал рост бактерий на пластине агара. Это привело к разработке первого антибиотика современной эпохи, пенициллина. Несколько лет спустя в 1932 году была опубликована статья, в которой предлагается метод лечения инфицированных ран с использованием препарата пенициллина. Хотя эти ранние образцы пенициллина были функциональными, они не были надежными и были необходимы дальнейшие уточнения. Эти улучшения появились в начале 1940-х годов, когда Говард Флори и его коллеги обнаружили новый штамм Penicillium, который обеспечивал высокие урожаи пенициллина. Это позволило широкомасштабное производство пенициллина, который помог запустить современную антибиотическую промышленность.После обнаружения пенициллина искали другие антибиотики. В 1939 году началась работа по выделению потенциальных антибиотических продуктов из почвенных бактерий streptomyces. Примерно в это же время был введен термин «антибиотик». Селман Ваксман и его коллеги обнаружили стрептомицин в 1944 году. Последующие исследования привели к обнаружению множества новых, разных антибиотиков, включая актиномицин, стрептотрицин и неомицин, все продуцируемые Streptomyces. Другие антибиотики, которые были обнаружены с тех пор, включают бацитрацин, полимиксин, виомицин, хлорамфеникол и тетрациклины. С 1970-х годов большинство новых антибиотиков были синтетическими модификациями естественных антибиотиков. Сырье для производства антибиотиковСоединения, которые делают ферментационный бульон, являются основным сырьем, необходимым для производства антибиотиков. Этот бульон представляет собой водный раствор, состоящий из всех ингредиентов, необходимых для размножения микроорганизмов. Как правило, он содержит источник углерода, такой как меласса или соевая мука, оба из которых состоят из сахара лактозы и глюкозы. Эти материалы необходимы в качестве источника пищи для организмов. Азот - еще одно необходимое соединение в метаболических циклах организмов. По этой причине обычно используют аммиачную соль. Кроме того, включены микроэлементы, необходимые для правильного роста организмов, продуцирующих антибиотики. Это такие компоненты, как фосфор, сера, магний, цинк, железо и медь, введенные через водорастворимые соли. Для предотвращения вспенивания во время ферментации используют антипенные средства, такие как сало, октадеканол и силиконы. Как производится антибиотик?Хотя большинство антибиотиков зарождается в природе, они обычно не доступны в количествах, необходимых для крупномасштабного производства.Процесс изготовления антибиотиковПо этой причине был разработан процесс ферментации. Он включает выделение желаемого микроорганизма, заправляющий рост культуры и рафинирование с последующим выделением конечного антибиотического продукта. Важно, чтобы стерильные условия сохранялись на протяжении всего производственного процесса, поскольку загрязнение инородными микробами разрушает ферментацию.Начало процессаПрежде чем начать ферментацию, желаемый организм, продуцирующий антибиотик, должен быть изолирован и его количество должно быть увеличено во много раз. Для этого в лаборатории создается стартовая культура из образца ранее изолированных, охлажденных организмов. Для выращивания исходной культуры образец организма переносят на агарсодержащую пластину. Первоначальную культуру затем помещают в сосуды для встряхивания вместе с пищей и другими питательными веществами, необходимыми для роста. Это создает суспензию, которая может быть перенесена в семенные емкости для дальнейшего роста. Первоначальную культуру затем помещают в сосуды для встряхивания вместе с пищей и другими питательными веществами, необходимыми для роста. Это создает суспензию, которая может быть перенесена в семенные емкости для дальнейшего роста.Сеялки - это стальные резервуары, предназначенные для создания идеальной среды для выращивания микроорганизмов. Они наполнены всеми вещами, необходимыми для того, чтобы выжил и начал процветать конкретный микроорганизм, включая теплую воду и углеводные продукты, такие как лактоза или сахара глюкозы. Кроме того, они содержат другие необходимые источники углерода, такие как уксусная кислота, спирты или углеводороды, а также источники азота, такие как соли аммиака. Факторы роста, такие как витамины, аминокислоты и незначительные питательные вещества, дополняют состав содержимого семенного резервуара. Семенные резервуары оснащены мешалками, которые поддерживают перемещение среды роста, и насос для доставки стерилизованного, отфильтрованного воздуха. Примерно через 24-28 часов материал в семенных резервуарах переносится в первичные ферментационные резервуары. ФерментацияБак для брожения по существу представляет собой более крупную версию стального, семенного резервуара, способного удерживать около 30 000 галлонов ферментационного бульона. Он заполнен теми же средствами роста. Получение антибиотикаБак для брожения обеспечивает благоприятную среду для роста. Здесь микроорганизмы могут расти и размножаться. Во время этого процесса они выделяют большие количества желаемого антибиотика. Баки охлаждаются для поддержания температуры между 73-81 ° F (23-27,2 ° C). Ферментационный бульон постоянно перемешивается, и в него закачивается непрерывный поток стерилизованного воздуха. По этой причине периодически добавляются антипенные агенты. Поскольку регулирование рН жизненно важно для оптимального роста, кислоты добавляют в резервуар по мере необходимости. Баки охлаждаются для поддержания температуры между 73-81 ° F (23-27,2 ° C). Ферментационный бульон постоянно перемешивается, и в него закачивается непрерывный поток стерилизованного воздуха. По этой причине периодически добавляются антипенные агенты. Поскольку регулирование рН жизненно важно для оптимального роста, кислоты добавляют в резервуар по мере необходимости.Изоляция и очисткаЧерез три-пять дней максимальное количество антибиотика будет произведено, и может начаться процесс изоляции. В зависимости от конкретного произведенного антибиотика ферментационный бульон обрабатывается различными способами очистки. Например, для антибиотических соединений, которые являются водорастворимыми, можно использовать ионообменный метод. В этом способе соединение сначала отделяют от отходов органических материалов в бульоне, а затем направляют через оборудование, которое отделяет другие водорастворимые соединения от желаемого.Для выделения маслорастворимого антибиотика, такого как пенициллин, используется способ экстракции растворителем. В этом способе бульон обрабатывают органическими растворителями, такими как бутилацетат или метилизобутилкетон, который может специфически растворять антибиотик. Затем растворенный антибиотик извлекают с использованием различных органических химических средств. В конце этого этапа изготовитель обычно остается с очищенной порошкообразной формой антибиотика, которая может быть дополнительно очищена для различных типов продуктов. РафинированиеАнтибиотики могут принимать различные формы. Их можно продавать в виде растворов для внутривенных введений, в форме капсул или гелей, или они могут продаваться в виде порошков, которые включены в накожные мази. В зависимости от конечной формы антибиотика различные стадии рафинирования могут быть предприняты после первоначальной изоляции. Для внутривенных использований кристаллический антибиотик может быть растворен в растворе, помещен в контейнер, который затем герметично закрывается. Для гелевых капсул порошкообразный антибиотик физически заполняется в нижнюю половину капсулы, затем верхняя половина будет механически вставлена на место.При использовании накожно антибиотик смешивают с мазью. С этого момента антибиотик транспортируется на конечные упаковочные станции. Здесь он складывается и помещается в коробки. Они загружаются на грузовики и транспортируются к различным дистрибьюторам, в больницы и аптеки. Весь процесс ферментации, восстановления и обработки может занять от 5 до 8 дней. Контроль качества антибиотиковКонтроль качества имеет первостепенное значение для производства антибиотиков. Поскольку это связано с процессом ферментации, необходимо предпринять шаги для обеспечения того, чтобы в любой момент во время производства не вводилось абсолютно никакого загрязнения. С этой целью среда и все технологическое оборудование полностью стерилизуются паром. Во время производства качество всех соединений проверяется на регулярной основе. Особое значение имеют частые проверки состояния культуры микроорганизмов во время ферментации. Они выполняются с использованием различных методов хроматографии. Также проверяются различные физические и химические свойства готового продукта, такие как pH, температура культуры и содержание влаги. В Соединенных Штатах производство антибиотиков регулируется Управлением по контролю за продуктами и лекарствами (FDA). В зависимости от применения и типа антибиотика необходимо провести определенное тестирование. Например, FDA требует, чтобы для определенных антибиотиков каждая партия была проверена ими на эффективность и чистоту. Только после того, как они сертифицировали пакет, он может быть продан для общего потребления. Будущее антибиотиковПоскольку разработка нового препарата является дорогостоящим процессом, фармацевтические компании провели очень мало исследований за последнее десятилетие. Однако тревожное развитие патогенных организмов вызвало оживленный интерес к разработке новых антибиотиков. Оказывается, что некоторые из вызывающих заболевание бактерий мутировали и развили устойчивость ко многим стандартным антибиотикам.Это может иметь серьезные последствия для общественного здравоохранения в мире, если не будут обнаружены новые антибиотики или не будут сделаны улучшения в тех, которые доступны. Эта сложная проблема будет в центре внимания исследований на многие годы вперед. health-ambulance.ru Технология производства антибиотиковТехнология производства антибиотиковЛекция. Производство антибиотиков. Схема производства пенициллина (пен.), стрептомицина (стр.), тетрациклина (тет.) Егоров «Основы учения об антибиотиках» Навашин «Производство антибиотиков» Бекер «Биотехнология» стр 239 А/биотики - специальные продукты ж/деятельности м/организмов и их модификации, которые обладают высокой физиол. Активностью по отношению к определенным группам м/орг.(вирусам, биктериям, грибам, водорослям) или к злокачественным опухолям. Нужны в очень малых концентрациях ( обладают высокой специфичностью). Используются в медицине, ветеринарии, с/х, пищевой промышленности как консерванты). Известно около 6000 а/биотиков, которые продуцируются грибами, стрептомицетами (50% а/б), бактериями. В мед.практике испольуются около 100 а/биот. Получают а/биот. путем химической или б/хим. трансформации. Возникают резистентные формы м/орг - нужны новые а/биот. Г+ - пенициллин, эритромицин. Г- тетрациклин, стрептомицин. Могут быть узкого спектра: бензилпен, повобиоцин; широкого спектра - тетрациклин и др. Пенициллин и ценфалоспорин - подавляют синтез клеточной стенки. Г- - пептидогликан - 5-10% от массы. Г+ - 50-90% пептидогликана, он образует многослойную структуру с поперечными сшивками. Пен действует на Г+ бактерии. Но не действует на Г- . Затруднен синтез пептидогликана. Нарушают мембранные функции и ингибирует синтез НК. А/биот-ки подавляют синтез белка: на рибосоме: Тетрациклин ингибирует многоие металлоэнзимы. Не может проходить через мембрану эукариотической клетки. Большие затраты на научные исслед.( разработка а/биот). Селекция более активного штамма. П 5-20 мг/л стрептомицин ¯ мутации g 20-25 г/л современный стрептомицин Спонтан.мут. Использование иммобилизированных клеток и ферментов - для интенсификации. Непрерывная ферментация ( а/биот относятся к вторичным метаболитам, их синтез начинается после лимитации роста продуцентов; клетки выросли). При с.П лимитирующем фактором явл. глюкоза При производстве некоторых а/биот-ков (стрептомицетами) - фосфаты. Ферментация: аэробный процесс. Vо2 = 0,3 - 1,5 мин -1. Прост.рект. с механической мешалкой: V=30-200 м.куб. Системы охлаждения и пеногашения. После ферментации б/массу отделяют на различных фильтрах. Ферментация ¯ Фильтрация (экстракция, УФ, осаждение в виде нерастворимых соединений) ¯ Сушка (лиофильная) Сушка разными методами (лиофильная (сублимация льда в ¯ вакууме), либо распылительная) Лекарственные формы (таблетирование, капсулирование) Пенициллин: азотосодержащий гетероцикл. Пенициллин (бензилпенициллин) и иммобилизатор - бентонит. бП ® 6-АПК (используют для синтеза). Из химических свойств: пенициллинамидаза (катализирует верхнюю реакцию). Его гидролитический распад при pH >7, либо поддержание некоторых факторов. Пенницилоиновая - неактивная дикарбоновая кислота (под действием пеницилллиназа). Обладает склонностью к различным перегруппировкам. Приводит к образованию разных изомеров, которые ответственны за образование аллергии.Пенициллин получают методом глубинного культивирования .Интенсивный синтез пенициллина начинается после накопления большого количества биомассы-мицеллия.При использовании глюкозы и молочной кислоты в среде;рН нейтральный.Бензилпенициллин обр.из предщественников:фенилуксусная кислота Подготовка к ферментации:сначало размножаются споры на пшене во флаконах при 25-27ОС в течении 4-5 суток. Полученным спровым матералом засевают инокуляторы, затем посевные аппараты (12-18 часов). Ферментация. Питательная среда: укурузный экстракт (2-3%), глюкоза (2%) легко усваяемая лактоза - 1% сульат аммония+фосфаты (0,5-1%) производные ФУК - 0,3 - 0,6% Для стабилизации рН - мел. Кашалотовый жир - пеногаситель, регулируе рН. Лактоза обеспечивает полноценный синтез а/биот. Её потребление начинается не сразу. Сначала фаза привыкания, накапливается фермент, способный её расщеплять. При ферментации необходима строгая асептика (посторонняя м/флора продуцирует пенициллазу, инактивирует синтез). Ферментация 100000 ед/мл. ¯ Фильтрация мицелий используется в животноводстве. КЖ 3-6% СВ минеральные в-ва 30-40% 15-30%пенициллина Большое кол-во белка затпр. выб. пен. Для удаленпия белка: 1) обрабатывают солями аллюминия, железа, цинка. 2) Используют коагуляцию с танином. 3) Термическая коагуляция (КЖ нагревают дл 65-70 град.) Для очистки пенициллина используюи экстракцию. Он, как кислота, хорошо растворим в орг.растворителях, а в виде соли - в воде. 1) Пен экстрагирует бутилацетатом, рН=2. Температура 4 град. (перевод в орг. фазу) 2) Раствор карбоната натрия. РН=6,5-7 (перевод в воду 30-50 тыс.ед/мл) 3) Экстракция бутилацетатом 50-70 тыс. Ед/мл Стадии выделения укристалл.солей 1) стадия обезвоживания путем охлаждения до минус 16-18 град с последующей фильтрацией льда. Удаление пигмента загрязнений - АУ. 2) Получ.концентрат 0,6М КОН. РН=6,5, активность 150-250 тыс. Усл.ед/мл. 3) Стерилизующая ф-ция и упаривание под вакуумом с добавлением бутанола (для смесей, кипящих при более низкой темп.) Температура 16-25 гр.,вакуум 5-10 мм.рт.ст. Калиевая соль пенициллина кристализуется. Ее фильтрат промывается бутанолом. Грануляция пасты и сушка в вакуум-сушильном шкафу при 75-80 град. И 10 мм.рт.ст. Цефалоспарин ( -лактановый антибиотик). Гидролиз ®7 А цефалоспариновая к-та не дез-ся пенициллиназой. Стрептомицин (аминогликозидный а/биот). 2 основные гуанидиновые группы. Легко образубт соли с миню кислотами: 3-Cl- гидрат. В медицине часто используют сернокислотную стрептомициновую соль. Сложный полисахарид. Углеводы не только образуют рост м/орг.,но и принимают участие в биосинтезе (глюкоза, крахмал, фруктоза...). Может расти на средах, содержащих белк.N: соевая мука, сухие дрожжи, жмыхи. Добавляются аммонийные соли, фосфор, который способствует усвоению углеводов. Посевной метериал сначала готовят в качалочных колбах, затем переносят в инокулят, затем в большой посевной аппарат, затем в ферментер (70 час). Питательная среда: глюкоза, кукурузнфй экстракт, азот, фосфор, цинк, марганец, магний, железо, аммонийные соли, мел. Аэрация, темп.26-28 град., перемешивание 7-8 суток. 2 фазы развитьия: В трофофазе высокое потребление кислорода, растут клетки. Быстро потребляют питательные в-ва. diplomba.ru сушка, контроль и расфасовка препаратаПосле выделения и химической очистки антибиотика его необходимо высушить, т. е. удалить из препарата свободную и связанную воду. Поскольку большинство антибиотиков в той или иной степени термолабильны, для их высушивания применяют методы, не приводящие к потере биологической активности, не изменяющие цвета препарата. На современном этапе промышленного получения антибиотиков используют следующие методы обезвоживания.Это: • Лиофильная сушка антибиотиков - широко распространенный метод, он проводится при сравнительно низких температурах (-8 - -12 С). • Высушивание с применением распылительной сушилки - прогрессивный метод при работе с большими количествами антибиотика, раствор антибиотика пневматически распыляется до мельчайших капель в камере с потоком нагретого воздуха. Процесс высушивания антибиотиков занимает несколько секунд, при этом даже термолабильные препараты не меняют свойств. • Метод взвешенного слоя (или сушка в вакуум-сушильных шкафах) применяется для высушивания зернистых и пастообразных антибиотических препаратов. Контроль препарата. Готовый антибиотик подвергается тщательному контролю: биологическому и фармакологическому. При биологическом контроле ставится задача выяснения стерильности готового препарата. Для этого обычно используют два метода. Первый связан с инактивацией антибиотика и высевом его в соответствующую питательную среду. Например, биологический контроль бензилпенициллина и полусинтетических препаратов, полученных на его основе, проводится следующим образом. В пробирки, содержащие тиогликолевую среду, вносят фермент пенициллазу в количестве, способном полностью инактивировать пенициллин. Пробирки с пенициллазой выдерживают двое-трое суток при температуре 37 С для контроля стерильности фермента, затем в них вносят раствор пенициллина. Пробирки разделяют на две группы: одну выдерживают при 37 С, а другую - при 24 С в течение пяти суток. Ведут ежедневное наблюдение за возможным развитием микроорганизмов. Второй метод выяснения стерильности антибиотиков определяется тем, что для большинства этих соединений не имеется инактиваторов их биологической активности. Поэтому у изучаемых препаратов выявляют устойчивые к ним формы микроорганизмов, а также определяют возможное присутствие чувствительной микрофлоры. Для определения возможного присутствия в таких препаратах чувствительной к ним микрофлоры раствор антибиотика пропускают через мембранные фильтры с диаметром пор не более 0,75 мк. Фармакологический контроль. К антибиотическим веществам, используемых в медицинской практике, в соответствии с Государственной Фармакопеей предъявляются очень строгие требования. Каждый новый лекарственный препарат, прежде чем он будет разрешен к практическому применению, должен пройти всесторонние испытания на токсичность, пирогенность и другие свойства, жизненно важные для организма. Препарат изучают на разных видах животных в отношении его острой и хронической токсичности (влияние на кровь, ЦНС, дыхание и т. д.). Показатели острой токсичности - один из критериев качества антибиотического вещества. Устанавливают максимально переносимую дозу (МПД) антибиотика; дозу, вызывающую гибель 50 % подопытных животных (LD50) и смертельную дозу (LD100). Только после всестороннего и тщательного изучения препарата он может быть рекомендован к практическому применению. Расфасовка и упаковка антибиотика - завершающий этап работы. Расфасованный и упакованный антибиотик с указанием показателя биологической активности, даты выпуска и срока годности поступает в продажу. Обобщая весь многостадийный и многоступенчатый процесс получения антибиотика, можно отметить, что он включает в себя четыре основные стадии: I стадия - получение соответствующего штамма, продуцента антибио-тика, пригодного для промышленного производства; II стадия непосредственно связана с процессом биосинтеза антибиотика; III стадия - это процессы выделения и очистки образовавшегося в ходе биосинтеза антибиотика; IV стадия включает в себя операции, связанные с концентрацией антибиотика, его стабилизацией и получением готового продукта. Биотехнологический процесс получения антибиотиков можно представить в виде следующей схемы (рис. 4.7).  Рис. 4.7. Схема производства антибиотиков в процессе микробного синтеза
Производство пенициллинов В 1871 г. В .А. Манасеиным было установлено, что зеленая плесень Penicillium glaucum при своем росте уничтожает бактерии, попадающие в культуральную среду. Это свойство Penicillium было тогда же использовано врачом А. Г. Полотебневым, применившим смоченные этой плесенью повязки при лечении гнойных ран и язв.
Рис. 4.7. Схема производства антибиотиков в процессе микробного синтеза
Производство пенициллинов В 1871 г. В .А. Манасеиным было установлено, что зеленая плесень Penicillium glaucum при своем росте уничтожает бактерии, попадающие в культуральную среду. Это свойство Penicillium было тогда же использовано врачом А. Г. Полотебневым, применившим смоченные этой плесенью повязки при лечении гнойных ран и язв. Выдающееся открытие русских ученых не получило широкой известности, и в 1928 г. англичанин Александр Флеминг вторично обнаружил способность плесневого грибка Penicillium угнетать рост микроорганизмов. Было показано, что вызываемая плесенью гибель микробов обусловлена образованием неизвестного органического вещества, названного пенициллином. Однако выделение пенициллина в чистом виде в то же время осуществлено не было, так как он оказался веществом очень лабильным, а применявшиеся методы очистки были несовершенны. В годы Второй мировой войны огромная практическая потребность в эффективных антибактериальных препаратах привлекла к пенициллину внимание широкого круга специалистов, и примерно с 1939 г. начался период интенсивных исследований. Благодаря этому в относительно короткий срок (3-5 лет) англичанами Х. Флори и А. Чэттеном были разработаны способы промышленного получения и очистки пенициллина, изучены его лечебные свойства и методы клинического применения, а также установлена его химическая структура. К пенициллинам относится группа близких по химическим свойствам соединений, содержащих в своей структуре b-лактамное и тиазолидиновые кольца: R может иметь различные значения, в зависимости от типа пенициллина. Например, при R = -Ch3C6H5 - это бензилпенициллин; R = -Ch3-0-C6H5 - это феноксиметилпенициллин и т. д. Наличие карбоксильной группы придает молекуле пенициллина сильные кислотные свойства, поэтому пенициллин легко образует соли со щелочами (Na, K), а также с органическими основаниями, например с дибензилэтилендиамином (препарат - бициллин).Для практических целей медицины пенициллин получают в промышленности путем биосинтеза. Процесс биосинтеза складывается из следующих стадий: 1) выращивания посевного материала (микроорганизмов) в аппаратах малой емкости - инокуляторах; 2) выращивания посевного материала в больших посевных аппаратах; 3) процесса ферментации; 4) выделения антибиотика из культуральной жидкости и его очистки. Важное значение имеет также селекционный подбор высокопроизводительных штаммов плесени, подготовка и стерилизация питательной среды и аппаратуры. Очень важное значение для высокого выхода пенициллина имеет питательная среда, примерный состав которой (в %) следующий: Вместо какурузного настоя успешно применяется мука из хлопковых семян или мясные гидролизаты.Приготовленную питательную среду подвергают стерилизации. Процесс ведут в колоннах непрерывного действия. Далее питательная среда поступает в аппарат-выдерживатель, где охлаждается в течение определенного времени до температуры 23-25 С. Первая стадия процесса - выращивание стандартной колонии штаммов плесени Penicillium chrysogenum - проводится в инокуляторах на питательной среде, где процесс идет ~30 часов. Подготовленный инокулят передают в посевной аппарат, объем которого ~ в 10 раз больше объема инокулятора. В посевном аппарате находится также стерилизованная питательная среда. Процесс роста здесь идет ~15-20 часов, и далее посевной материал передается на ферментацию в большие реакторы - ферментаторы объемом до 100 м на питательную среду. Процесс ферментации идет ~70 часов при температуре 23-24 С, рН среды 6-6,5 и постоянной аэрации воздуха - 1 л воздуха/1 литр питательной среды/1 мин по всему объему ферментатора. Основная задача этого процесса - создание оптимальных условий для развития продуцента и накопления антибиотика. Биосинтез антибиотика - двухфазный процесс. В течение первой фазы происходит быстрый рост и размножение мицелия или бактериальных клеток. Культуральная жидкость в этот период богата углеводами, азотом и неорганическим фосфором. Продукты обмена веществ микроорганизмов, в том числе и антибиотики, находятся в малых количествах. Вторая фаза начинается с момента замедления роста культуры. Протекает она в культуральной жидкости, обогащенной продуктом жизнедеятельности организма с небольшим количеством углеводов и фосфора. В начале этой фазы мицелий обладает максимальной способностью к синтезу антибиотика. Фазы отличаются характером и интенсивностью биохимических реакций. С учетом этих различий подбирают условия, благоприятные для первой и второй фаз развития продуцента. Для увеличения выхода антибиотика в питательную среду вводят «предшественники», т. е. химические вещества, способствующие целенаправленному синтезу антибиотика. Так, в питательную среду при биосинтезе пенициллина вводят «предшественник» фенилацетамид -это увеличивает выход антибиотика более чем в 2 раза. По окончании процесса ферментации культуральную массу передают на процесс выделения антибиотика. Большинство продуцентов при биосинтезе выделяют антибиотик в водную фазу, поэтому процесс выделения антибиотика начинается с разделения твердой и жидкой фаз. Твердая фаза, кроме массы мицелия, содержит значительное количество коллоидных примесей, затрудняющих фильтрование, поэтому культуральную массу предварительно подвергают различным типам коагуляции (электролитической, тепловой, кислотной и т. д.). Наиболее эффективным методом коагуляции культуральной массы является ее обработка флокулянтами (высокомолекулярными полиэлектролитами), например, поли-(4-винил)-бензилтриметиламмонийхлоридом. Оставшийся от фильтрации мицелия водный раствор антибиотика направляют на химическую очистку и выделение. Таким образом, водный раствор пенициллина направляют после фильтрации на экстракцию бутил-ацетатом при рН водной среды, равной 2. При таком значении кислотности среды подавляет кислотная ионизация пенициллина в водной фазе и он переходит в органическую фазу (в бутилацетат). Реэкстракцию пенициллина из бутилацетата проводят слабыми растворами щелочей. Широко применяются сорбционные методы выделения и очистки антибиотиков. В качестве сорбентов широко используются синтетические ионообменные смолы. Сушат пенициллины методом сублимации или распыления. Угроза резистентности Успехи применения бензилпенициллина в лечении болезней, вызванных различными бактериями, были поистине сенсационными. Чувствительными к нему оказались и стафилококки, являющиеся возбудителями очень серьезных заболеваний. Статистические данные показывают, что в 1944 г. число инфекционных больных, вылеченных бензил-пенициллином, было около 99,8 %, однако, уже в 1956 г. этот процент снизился до 65 %, особенно большой процент инфицированных больных, не поддававшихся лечению бензилпенициллином, наблюдался среди работников предприятий, производящих антибиотики, и работников хирургических клиник, широко использующих антибиотики для лечения больных. Почему же именно эти заведения стали рассадниками болезнетворных организмов, устойчивых к действию пенициллина? Уже со времени первого применения пенициллина стало известно, что некоторые стафилококки невосприимчивы к нему. Чувствительные к пенициллину штаммы стафилококков погибают при лечении, остаются резистентные стафилококки, которые начинают размножаться и заполнять опустевшую нишу. И, таким образом, применение пенициллина для лечения заболеваний, вызванных резистентными формами стафилококка, не приведет к положительному результату. Каким же путем избегают гибели стафилококки, резистентные к пенициллину? Было установлено, что они способны обезвредить молекулу пенициллина, изменив его структуру в самом слабом месте. Устойчивые стафилококки вырабатывают фермент, который может разрушить молекулу пенициллина при добавлении к ней молекулы воды. При этом процессе (гидролизе) образуется соединение, безвредное для микробов. Фермент, способствующий реакции «обезвреживания», называется пенициллиназой. Его возникновение вызывается присутствием в среде пенициллина. С 1969 г. стала известна и химическая структура пенициллиназы, вырабатываемой стафилококками. В построении ее молекулы участвуют 257 структурных единиц двадцати аминокислот, соединенных в различной последовательности. Другие бактерии образуют ферменты (ацилазы), которые разрывают связь между основным ядром молекулы бензилпеницилина и ее боковой ацильной группой, образуя биологически неактивную 6-аминопеницилановую кислоту Второе расщепление ученые стали использовать для своих целей как возможность изменить молекулу пенициллина таким образом, чтобы ацилаза не смогла подвергнуть ее гидролизу. Таким способом были получены новые полусинтетические пенициллины.Л.В. Тимощенко, М.В. Чубик medbe.ru |
г.Самара, ул. Димитрова 131 [email protected] |
 |