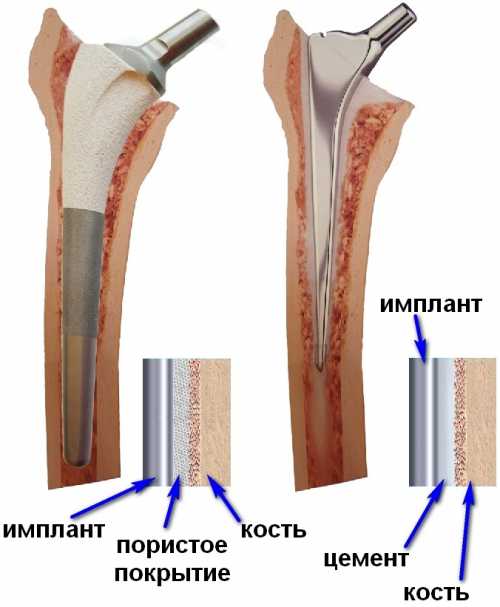
|
|
||||||||||
|
ИНГИБИТОРЫ АНГИОТЕНЗИНПРЕВРАЩАЮЩЕГО ФЕРМЕНТА В ЛЕЧЕНИИ ПОРАЖЕНИЙ ПОЧЕК РАЗЛИЧНОЙ ЭТИОЛОГИИ. Антибиотики и ингибиторы апфОпасные сочетания сердечных лекарственных препаратов(14 голосов: 4.14 из 5)Самыми распространёнными среди населения земного шара являются сердечно-сосудистые заболевания, поэтому достаточно большой процент людей принимает «сердечные» препараты, причём это, как правило, не одно лекарство, а несколько. В этом случае встаёт вопрос о безопасном их сочетании. В этой статье мы расскажем об опасных комбинациях «сердечных» препаратов. Термин «сердечные препараты» достаточно обобщённый и неконкретный. Под это описание подходят лекарства для лечения артериальной гипертензии, стенокардии, инфаркта миокарда, кардиомиопатий, нарушений ритма сердца и проводимости и многие другие. Чтобы внести некоторую ясность, надо оговориться, что в статье пойдёт речь о наиболее широко используемых лекарственных препаратах, влияющих на работу сердца, и об их возможных сочетаниях между собой. Будут рассмотрены следующие группы препаратов: Прим.: все препараты написаны по международному непатентованному названию (МНН). I. Бета-адреноблокаторы: 1. неселективные: пропранолол, карведилол, окспренолол, пиндолол, надолол.2. селективные: атенолол, метопролол, бисопролол, небиволол, талинолол. II. Блокаторы кальциевых каналов (антагонисты кальция): 1. недигидропиридиновые: верапамил, дилтиазем;2. дигидропиридиновые: нифедипин, амлодипин, S-амлодипин, лерканидипин. III. Ингибиторы АПФ: каптоприл, периндоприл, эналаприл, рамиприл, зофенаприл, фозиноприл, лизиноприл. IV. Блокаторы рецепторов ангиотензина-II: лозартан, валсартан, кандесартан, ибресартан, телмисартан. V. Диуретики: 1. тиазидные: гидрохлортиазид, хлорталидон.2. тиазидоподобные: индапамид.3. петлевые диуретики: фуросемид, торасемид.4. калий-сберегающие диуретики: спиронолактон, эплеренон. Прим.: в классификации приведены самые известные представители лекарственных препаратов. Если вы не нашли здесь свой препарат, то узнать, к какой группе он принадлежит можно, заглянув в инструкцию к нему (найти строку «фармакотерапевтическая группа»), либо в справочниках по лекарственным препаратам (Видаль, РЛС, справочник М.Д. Машковского). Рекомендации по лечению артериальной гипертонии от 2013 г., разработанные Европейским Обществом Гипертонии и Европейским Обществом Кардиологов, установили следующие нерациональные (т.е. опасные) комбинации «сердечных» препаратов: 1. бета-адреноблокаторы + недигидропиридиновые блокаторы кальциевых каналов (верапамил, дилтиазем). Эта комбинация является ГРУБОЙ ОШИБКОЙ со стороны врача, так как препараты обеих групп вызывают уменьшение ЧСС. При совместном назначении их суммарный эффект на показатель ЧСС настолько выражен, что могут возникнуть жизнеугрожающие состояния (вплоть до нарушения ритма сердца). Если по стечению обстоятельств пациенту возможно назначение только комбинации бета-адреноблокаторов с блокаторами кальциевых каналов, то из группы последних предпочтение отдают дигидропиридиновым препаратам (нифедипин, амлодипин, лерканидипин). Прим.: комбинация бета-адреноблокаторов и недигидропиридиновых антагонистов кальция иногда применяется для контроля желудочкового ритма при постоянной форме фибрилляции предсердий. НО! Только в этом случае! 2. Ингибитор АПФ + калий-сберегающий диуретик. К калий-сберегающим диуретикам относятся спиронолактон и эплеренон. Как и все диуретики, группа калий-сберегающих препаратов выводит из организма лишнюю жидкость, сохраняя при этом калий в крови. Ингибиторы АПФ тоже способствуют накоплению калия в организме. При сочетании препаратов обеих групп может возникнуть опасное для сердца состояние – гиперкалиемия – способное вызвать остановку сердца в диастоле. Если врач назначил вам препарат любой из этих групп, вам нужно периодически проверять уровень калия (во время подбора дозы раз в неделю, когда подобрана оптимальная доза лекарства – раз в месяц). Норма калия плазмы крови для взрослых составляет 3,5-5,1 ммоль/л. 3. Бета-адреноблокатор и лекарственные препараты центрального действия. К последней группе относятся метилдопа, клонидин, моксонидин, рилменидин. У этих групп сходные механизмы действия, клинические эффекты, и – что самое важное – побочные явления. Из-за взаимного усиления нежелательных эффектов эти две группы не применяют совместно. 4. Ингибитор АПФ и блокатор рецепторов ангиотензина-II. Ранее это сочетание лекарственных препаратов было возможным, но с 2013 г. установлено, что комбинация этих двух групп отрицательно влияет на почки, вызывая в сравнительно короткие сроки почечную недостаточность. В тех же Рекомендациях сказано о возможных, но о менее изученных сочетаниях лекарственных препаратов. Не исключено, что когда-нибудь эти комбинации перейдут в группу рациональных или опасных. К таким сочетаниям относятся следующие: 1. Ингибитор АПФ + бета-адреноблокатор;2. Блокатор рецепторов ангиотензина-II + бета-адреноблокатор;3. Дигидропиридиновые антагонисты кальция + бета-адреноблокаторы. Рациональными и максимально безопасными являются следующие комбиниции препаратов: 1. Диуретик (тиазидный) + блокатор рецепторов ангиотензина-II;2. Диуретик (тиазидный) + антагонист кальция;3. Диуретик (тиазидный) + ингибитор АПФ;4. Блокатор рецепторов ангиотензина-II + антагонист кальция;5. Ингибитор АПФ + антагонист кальция. Это, пожалуй, все особенности наиболее частых комбинаций «сердечных» препаратов. Конечно, в каждом отдельном случае в отношении конкретного препарата имеются свойственные только ему характеристики. Но базисными правилами в назначении нескольких «сердечных» лекарственных препаратов являются вышеизложенные. Автор: терапевт А.В. Косова azbyka.ru ИНГИБИТОРЫ АНГИОТЕНЗИНПРЕВРАЩАЮЩЕГО ФЕРМЕНТА В ЛЕЧЕНИИ ПОРАЖЕНИЙ ПОЧЕК РАЗЛИЧНОЙ ЭТИОЛОГИИ | Преображенский Д.В., Сидоренко Б.А.Для цитирования: Преображенский Д.В., Сидоренко Б.А. ИНГИБИТОРЫ АНГИОТЕНЗИНПРЕВРАЩАЮЩЕГО ФЕРМЕНТА В ЛЕЧЕНИИ ПОРАЖЕНИЙ ПОЧЕК РАЗЛИЧНОЙ ЭТИОЛОГИИ // РМЖ. 1998. №24. С. 3 Ингибиторы АПФ обладают ренопротективным действием, которое не зависит от их антигипертензивного эффекта и наиболее выражено у больных сахарным диабетом I типа и нефропатией. Необходимы дальнейшие исследования, чтобы определить клиническое значение ренопротективных эффектов ингибиторов АПФ у больных с хроническим гломерулонефритом и гипертоническим ангионефросклерозом. Ингибиторы АПФ обладают ренопротективным действием, которое не зависит от их антигипертензивного эффекта и наиболее выражено у больных сахарным диабетом I типа и нефропатией. Необходимы дальнейшие исследования, чтобы определить клиническое значение ренопротективных эффектов ингибиторов АПФ у больных с хроническим гломерулонефритом и гипертоническим ангионефросклерозом. Angiotensin-converting enzyme (ACE) inhibitors have renal protective action that is not associated with their antihypertensive effects and most pronounced in patients with type 1 diabetes mellitus and nephropathy. Further studies are required to assess the clinical value of the renal protective effects of ACE inhibitors in patients with chronic glomerulonephritis and hypertensive angionephrosclerosis. Д.В. Преображенский, Б.А. Сидоренко - Медицинский центр Управления делами Президента Российской Федерации, Москва D. V. Preobrazhensky, V. A. Sidorenko - Medical Center, Administration of Affairs of the President of the Russian Federation, Moscow В развитых странах мира благодаря широкому использованию эффективных антигипертензивных препаратов удалось добиться значительного снижения распространенности таких сердечно-сосудистых осложнений артериальной гипертензии, как мозговой инсульт и ишемическая болезнь сердца (ИБС). Так, в США за период с 1970 по 1994 г. с поправкой на возраст смертность от инсульта уменьшилась примерно на 60% и смертность от ИБС - на 53%. В то же время в последние годы в США наблюдается неуклонный рост числа случаев терминальной почечной недостаточности - почти втрое с 1982 по 1995 г. [1]. Гипертоническая болезнь является одной из главных причин развития терминальной почечной недостаточности (наряду с сахарным диабетом и диффузным гломерулонефритом) в США и странах Западной Европы. Поэтому существует предположение, что наиболее широко используемые антигипертензивные препараты (тиазидные диуретики, b-адреноблокаторы, антагонисты кальция, метилдопа, гидралазин и др.), способные предупреждать развитие мозгового инсульта и острого инфаркта миокарда, возможно, не обладают достаточным ренопротективным действием у больных гипертонической болезнью с исходно нормальной функцией почек [2]. Многочисленные экспериментальные исследования и клинические наблюдения дали основание думать, что ренопротективное действие ингибиторов ангиотензин I - превращающего фермента (АПФ) более выражено, чем у многих других антигипертензивных препаратов. Патофизиология Ингибиторы АПФ не только являются эффективными антигипертензивными средствами, но и оказывают благоприятное действие на внутрипочечную гемодинамику. Они ослабляют вазоконстрикторное действие ангиотензина II на эфферентные (выносящие) артериолы почечных клубочков, что ведет к увеличению почечного плазмотока и снижению повышенного внутриклубочкового давления. Скорость клубочковой фильтрации (СКФ) может снижаться в начале терапии ингибиторами АПФ, однако не изменяется или несколько повышается при их длительном назначении. Ингибиторы АПФ уменьшают экскрецию альбуминов с мочой, что объясняется не только снижением внутриклубочкового давления, но и проницаемости стенки клубочковых капилляров. Они уменьшают реабсорбцию натрия и воды в проксимальных почечных канальцах. Кроме того, снижая секрецию альдостерона, ингибиторы АПФ косвенным образом уменьшают реабсорбцию натрия в обмен на ионы калия в дистальных почечных канальцах. Важную роль в прогрессировании поражения почек до стадии терминальной почечной недостаточности, как полагают, играет активация внутрипочечной ренин-ангиотензиновой системы, основным эффекторным пептидом которой является ангиотензин II. Ангиотензин II, помимо прочего, действует как фактор роста и профиброгенный пептид. Повышенное образование ангиотензина II сопровождается гипертрофией или пролиферацией мезангиальных, канальцевых, интерстициальных и других клеток паренхимы почек, усилением миграции макрофагов/моноцитов и повышенным синтезом коллагена, фибронектина и других компонентов внеклеточного матрикса. Ингибиторы АПФ, уменьшая образование ангиотензина II, ослабляют не только его внутрипочечные гемодинамические эффекты, но и пролиферативные и профиброгенные эффекты этого эффекторного пептида ренин-ангиотензиновой системы [3-5]. При длительном применении ингибиторы АПФ оказывают благоприятное влияние на два основных фактора прогрессирования почечной патологии до стадии терминальной почечной недостаточности - внутриклубочковую гипертензию и тубулоинтенстициальный фиброз. Снижая системное АД и уменьшая протеинурию, ингибиторы АПФ воздействуют на два других фактора прогрессирования поражения почек. Таким образом, ингибиторы АПФ оказывают благоприятное действие на целый ряд патогенетических механизмов прогрессирования поражения почек.
Ингибиторы АПФ и диабетическая нефропатия Наиболее хорошо изучены эффекты ингибиторов АПФ на течение и исходы нефропатии у больных сахарным диабетом I типа. Диабетическая нефропатия - одно из наиболее серьезных поздних осложнений сахарного диабета. Терминальная почечная недостаточность, обусловленная диабетической нефропатией, развивается у 30-35% больных сахарным диабетом I типа и 5-8% больных сахарным диабетом II типа. Таблица 1. Влияние различных антигипертензивных препаратов на уровень системного АД и альбуминурию / протеинурию у больных с диабетической нефропатией (Метаанализ P. Weidmann и соавт. [7])
Под диабетической нефропатией обычно понимают клинический синдром, который развивается у больных сахарным диабетом через 10-15 лет от начала заболевания и характеризуется стойкой протеинурией (> 300 мг/сут), повышенным АД (і140/90 мм рт. ст.) и прогрессирующей дисфункцией почек, проявляющейся снижением СКФ и повышением содержания креатинина в сыворотке крови. На доклинической стадии диабетическая нефропатия проявляется повышенной СКФ (> 130-140 мл/мин) и микроальбуминурией (30-300 мг/сут или 20-200 мкг/мин), АД при этом может быть либо повышенным, либо нормальным. Морфологическую основу диабетической нефропатии у 70% больных сахарным диабетом I типа составляет узелковый или диффузный гломерулосклероз, впервые описанный П. Киммельстилем и К. Уилсоном в 1936 г. Значительно реже специфические поражения почек обнаруживаются при сахарном диабете II типа. По данным A. Grenfill и соавт. [6], у 32% больных сахарным диабетом II типа причиной терминальной почечной недостаточности были неспецифичные для диабета поражения почек, такие, как пиелонефрит, гипертонический ангионефросклероз, гломерулосклероз и сосочковый некроз. Таким образом, у больных сахарным диабетом может встречаться патология почек различной этиологии, а не только диабетический гломерулосклероз типа Киммельстила-Уилсона. Без учета различий в этиологии почечной патологии у больных сахарным диабетом I и II типов трудно понять, почему ингибиторы АПФ способны замедлять прогрессирование диабетической нефропатии при сахарном диабете I типа и довольно малоэффективны при поражении почек у больных сахарным диабетом II типа. Исследования действия первых ингибиторов АПФ каптоприла и эналаприла на клинические проявления диабетической нефропатии у больных сахарным диабетом I типа стали проводить с начала 80-х годов. В 1985 г. появились первые сообщения о том, что ингибиторы АПФ наряду со снижением системного АД уменьшают микроальбуминурию у больных сахарным диабетом I типа. СКФ при этом повышалась или не изменялась. Дальнейшие исследования подтвердили предположение о том, что ингибиторы АПФ обладают антипротеинурическим действием, которое независимо от его системного антигипертензивного эффекта. По выраженности антипротеинурического действия при диабетической нефропатии ингибиторы АПФ превосходят все другие антигипертензивные препараты (табл. 1). С середины 80-х годов проводятся исследования по изучению влияния длительной терапии ингибиторами АПФ на возникновение и прогрессирование диабетической нефропатии. Большая часть исследований выполняется на больных сахарным диабетом I типа, учитывая, что течение диабетической нефропатии при этой форме диабета более предсказуемо. Например, у больных сахарным диабетом I типа и явной нефропатией СКФ уменьшается линейно со скоростью около 1мл/мин за 1 мес. E. Lewis и соавт. [7] изучали эффекты каптоприла (в сравнении с плацебо) у 409 больных сахарным диабетом I типа и явной нефропатией. У 75% больных была артериальная гипертензия. Больные основной группы получали каптоприл в дозе 25 мг 3 раза в день. Больные контрольной группы получали плацебо, но для контроля уровня системного АД допускалось использование любых других антигипертензивных препаратов, за исключением ингибиторов АПФ и антагонистов кальция. Длительность исследования составляла в среднем 3 года. Сывороточные концентрации креатинина удвоились у 25 (12%) из 207 больных, леченных каптоприлом, по сравнению с 43 (21%) из 202 больных, получавших плацебо (р=0,007). Протеинурия уменьшилась на 0,3 г/сут в течение первых 3 мес лечения каптоприлом и оставалась в дальнейшем меньшей, чем в контрольной группе. В группе больных, леченных каптоприлом, было меньше случаев смерти (8 случаев против 14 в контроле) и меньше потребность в проведении программного гемодиализа или трансплантации почки (20 случаев против 31 в контроле). В целом неблагоприятные исходы (смерть, гемодиализ, трансплантация почки) достоверно реже (в среднем на 50%) наблюдались в группе больных с явной диабетической нефропатией, которые получали ингибитор АПФ каптоприл. Таким образом, длительная терапия ингибиторами АПФ значительно замедляет прогрессирование поражения почек у больных сахарным диабетом и явной нефропатией. Не столь убедительные данные были получены при исследовании влияния ингибиторов АПФ на течение скрытой нефропатии у больных сахарным диабетом I типа. По данным G. Viberti и соавт. [8], у больных сахарным диабетом I типа и персистирующей микроальбуминурией, но без артериальной гипертензии, каптоприл предупреждает развитие макроальбуминурии (> 200 мкг/мин). Среди больных, получавших плацебо, экскреция альбуминов с мочой возрастала в среднем на 18,3% в год, а СКФ имела тенденцию к снижению. При лечении каптоприлом ни экскреция альбуминов с мочой, ни СКФ практически не изменялись. Таблица 2. Начальные дозы ингибиторов ангиотензинпревращающего фермента у больных с нормальной и нарушенной функцией почек
В исследовании EUCLID [9] изучались эффекты лизиноприла (в сравнении с плацебо) на прогрессирование поражения почек у 530 больных сахарным диабетом I типа и микроальбуминурией или без нее. Больные основной группы получали лизиноприл (10-20 мг/сут) с целью поддержания диастолического АД на уровне не более 75 мм рт.ст. После 2 лет лечения среди больных с исходной микрокальбуминурией скорость экскреции альбуминов с мочой была недостоверно (в среднем на 50%) ниже в группе больных, леченных лизиноприлом, по сравнению с контрольной группой. Среди больных с нормоальбуминурией не было различий между группами в скорости экскреции альбуминов с мочой в конце исследования. Таким образом, применение ингибиторов АПФ может быть полезным у больных сахарным диабетом I типа не только с явной, но и со скрытой нефропатией. Важное значение имеют данные исследования EUCLID, касающиеся влияния ингибиторов АПФ на прогрессирование диабетической ретинопатии. Прогрессирование диабетической ретинопатии отмечено у 23% больных, получавших плацебо, но лишь у 13% больных, леченных лизиноприлом в течение 2 лет (р<0,02). Данные литературы о влиянии ингибиторов АПФ на поражение почек у больных сахарным диабетом II типа немногочисленны. В мельбурнском исследовании сравнивали эффекты периндоприла и нифедипина-ретард на экскрецию альбуминов с мочой у 27 больных сахарным диабетом I типа и 33 больных сахарным диабетом II типа. У всех больных была микроальбуминурия, но АД было нормальным. Больные были разделены на три группы: одни получали периндоприл (2-8 мг/сут), другие - нифедипинретард (10-40 мг/сут), третьи - плацебо. При сахарном диабете I типа только периндоприл значительно снижал диастолическое АД, не влияя на уровень систолического АД. Нифедипин снижал АД в начале терапии, однако в конце исследования (в среднем 3-4 года) средние уровни АД в группах больных, получавших нифедипин и плацебо, не различались. Макроальбуминурия развилась у 3 (24%) больных, получавших плацебо, 4 (44%) больных, получавших нифедипин, и ни у одного из больных, леченных периндоприлом. При сахарном диабете II типа периндоприл и нифедипин в одинаковой мере снижали АД. Скорость экскреции альбуминов с мочой не изменялась при лечении периндоприлом, но имела тенденцию к увеличению при назначении нифедипина (на 12% в год) и плацебо (на 16% в год). СКФ снижалась в среднем на 3-5 мл/мин в год во всех трех сравниваемых группах [10]. M. Ravid и соавт. [11] в течение нескольких лет наблюдали 108 больных сахарным диабетом II типа и персистирующей микроальбуминурией, но без артериальной гипертензии. Завершили 6-летнее исследование 49 больных, леченных эналаприлом (10 мг/сут), и 45 больных, получавших плацебо. При включении в исследование сывороточный креатинин был в пределах нормы у всех больных. К концу 5-го года наблюдения среди больных, получавших плацебо, сывороточные уровни креатинина повысились в среднем на 15 мкмоль/л, а экскреция альбуминов с мочой увеличилась более чем в 2,5 раза. Напротив, в группе больных, леченных эналаприлом, средние значения сывороточных уровней креатинина и суточной экскреции альбуминов с мочой практически не изменились. Таким образом, у больных сахарным диабетом II типа и персистирующей микроальбуминурией длительное применение ингибиторов АПФ может замедлить прогрессирование дисфункции почек.
Ингибиторы АПФ и недиабетические поражения почек Среди первичных паренхиматозных заболеваний почек различают две основные группы: 1) болезни с преимущественным поражением почечных клубочков (постинфекционный гломерулонефрит, фокальный сегментарный гломерулонефрит, подострый гломерулонефрит с полулуниями, болезнь Берже и др.) и 2) болезни с преимущественным поражением канальцев и интерстициальной ткани (поликистоз почек, хронический интерстициальный нефрит и др.). Факторы риска прогрессирования первичных заболеваний почек до стадии терминальной почечной недостаточности, по-видимому, такие же, как и при диабетической нефропатии. Поэтому вполне понятен интерес к изучению эффектов ингибиторов АПФ у больных с недиабетическими поражениями почек. В многочисленных кратковременных исследованиях показано, что ингибиторы АПФ превосходят другие антигипертензивные препараты по способности уменьшать протеинурию у больных с заболеваниями почек недиабетической этиологии. В трех длительных исследованиях изучалось влияние ингибиторов АПФ на прогрессирование недиабетической нефропатии. По данным Т. Hannedouche и соавт. [13], эналаприл предупреждает развитие терминальной почечной недостаточности у больных с умеренной почечной недостаточностью, обусловленной диффузным гломерулонефритом и поликистозом почек, но неэффективен при интерстициальном нефрите. J. Maschio и соавт. [14] сообщили, что беназеприл (10 мг/сут) предупреждал прогрессирование почечной недостаточности у больных с диабетической нефропатией и гломерулонефритом, но не оказывал ренопротективного действия у больных с поликистозом почек, нефросклерозом и интерстициальным нефритом. Беназеприл был наиболее эффективен у больных с исходной протеинурией более 3 г/сут и СКФ от 45 до 60 мл/мин. Следовательно, применение ингибиторов АПФ оправдано далеко не во всех случаях недиабетической нефропатии. Тем более, что в исследовании J. Maschio и соавт. отмечена более высокая смертность среди больных, леченных беназеприлом, по сравнению с больными, получавшими плацебо (8 случаев смерти против 1 в контрольной группе). В исследовании REIN (Ramipril Efficacy In Nephropathy) продемонстрирован ренопротективный эффект рамиприла (2,5-5 мг/сут) у больных с хроническими заболеваниями почек недиабетической этиологии и протеинурией не менее 3 г/сут. У больных, леченных рамиприлом, значительно уменьшалась протеинурия и гораздо медленнее снижалась СКФ. Ренопротективное действие длительной терапии рамиприлом было особенно выраженным у тех больных, у которых в большей степени уменьшалась протеинурия после 1 мес терапии. Следовательно, в определенной мере можно предсказать эффективность длительной терапии ингибиторами АПФ по степени уменьшения исходной протеинурии после кратковременного курса лечения. Частота случаев смерти и развития нефатальных сердечно-сосудистых осложнений была одинаковой в основной и контрольной группах [15]. По сводным данным 10 длительных рандомизированных исследований, применение ингибиторов АПФ позволяет примерно на 30% снизить риск развития терминальной почечной недостаточности у больных с недиабетическими заболеваниями почек по сравнению с другими антигипертензивными препаратами. Таким образом, при решении вопроса о целесообразности длительного назначения ингибиторов АПФ больным с недиабетическими поражениями почек следует принимать во внимание этиологию почечной патологии и выраженность протеинурии. Ингибиторы АПФ показаны в первую очередь больным с диффузным гломерулонефритом и выраженной протеинурией. По-видимому, не следует использовать ингибиторы АПФ для лечения больных с поликистозом почек и интерстициальным нефритом. Остается открытым вопрос о пользе ингибиторов АПФ у больных с небольшой протеинурией (менее 3 г/сут). Ответ на этот вопрос позволят получить результаты второго этапа исследования REIN, публикация которых вскоре ожидается. Дискутируется вопрос о выборе антигипертензивного препарата для снижения АД у больных с недиабетическими заболеваниями почек. Но необходимость назначения антигипертензивных средств у таких больных не вызывает никаких сомнений. Причем чем более выражена протеинурия, тем ниже должно быть АД. По данным многоцентрового исследования, у больных с протеинурией менее 0,25 г/сут системное АД необходимо поддерживать на уровне не более 130/85 мм рт. ст. У больных с протеинурией от 0,25 до 1 г/сут АД должно быть не более 130/80 мм рт. ст., а у больных с более значительной протеинурией - не более 125/75 мм рт. ст. [16]. Ингибиторы АПФ и поражение почек при гипертонической болезни В настоящее время нет сомнений в том, что ингибиторы АПФ могут улучшать отдаленный прогноз у больных гипертонической болезнью за счет снижения риска развития фатальных и нефатальных сердечно-сосудистых осложнений. Вместе с тем до сих пор нет доказательств, что ингибиторы АПФ более эффективно, чем другие антигипертензивные препараты, предупреждают развитие терминальной почечной недостаточности у больных гипертонической болезнью. Дело в том, что у больных с мягкой и умеренной формами гипертонической болезни нарушение функции почек прогрессирует довольно медленно. Поэтому для того, чтобы оценить эффект какого-либо антигипертензивного препарата на прогрессирование дисфункции почек, необходимо длительное время наблюдать за большими группами больных. Такие крупные рандомизированные исследования, насколько известно, не проводились. В нескольких небольших исследованиях было показано, что у больных гипертонической болезнью СКФ при лечении ингибиторами АПФ снижается медленнее, чем при лечении b-адреноблокаторами. Не выявлено различий в темпах снижения СКФ при лечении каптоприлом и нифедипином-ретард [17, 18]. Основываясь на результатах этих исследований, а также на клинических наблюдениях, было высказано предположение о том, что ренопротективное действие ингибиторов АПФ и антагонистов кальция у больных гипертонической болезнью одинаково и более выражено, чем действие тиазидных диуретиков и b-адреноблокаторов. Прямых доказательств в пользу такого предположения, однако, нет. В любом случае не следует отказываться от применения тиазидных диуретиков и b-адреноблокаторов в пользу ингибиторов АПФ и антагонистов кальция при лечении гипертонической болезни у больных без сопутствующего сахарного диабета. Ведь причиной смерти подавляющего большинства больных с мягкой и умеренной артериальной гипертензией является не терминальная почечная недостаточность, а такие фатальные сердечно-сосудистые осложнения, как мозговой инсульт и острый инфаркт миокарда. Между тем, вне всякого сомнения, и тиазидные диуретики, и b-адреноблокаторы способны в значительной мере предупреждать развитие сердечно-сосудистых осложнений. Факторы риска гипертонической почки (в отличие от диабетической нефропатии) недостаточно изучены. В литературе упоминаются два показателя, которые свидетельствуют о повышенном риске развития гипертонического ангионефросклероза - клубочковая гиперфильтрация и микроальбуминурия. О прогностическом значении клубочковой гиперфильтрации при гипертонической болезни говорится лишь в работе R. Schmieder и соавт. [19]. Недавно было поставлено под сомнение прогностическое значение микроальбуминурии у больных гипертонической болезнью. По данным S. Agewall и соавт. [20], у мужчин с гипертонической болезнью, но без сахарного диабета макроальбуминурия, но не микроальбуминурия сочетается с повышенной смертностью от сердечно-сосудистых причин. При гипертонической болезни прогностическое значение, по-видимому, имеют исходные уровни сывороточного креатинина. По наблюдениям N. Shulman и соавт. [21], 8-летняя смертность у больных гипертонической болезнью с сывороточными концентрациями креатинина более 1,7 мг/дл была втрое выше, чем у больных с более низкими уровнями креатинина. У больных гипертонической болезнью с макроальбуминурией ингибиторы АПФ, по-видимому, более эффективно, чем антагонисты кальция и другие антигипертензивные препараты, уменьшают экскрецию альбуминов с мочой [22]. Что касается больных с микроальбуминурией, то данные литературы о влиянии различных антигипертензивных препаратов на экскрецию альбуминов с мочой довольно разноречивы. Результаты подавляющей части небольших исследований показали, что ингибиторы АПФ значительно уменьшают скорость экскреции альбуминов с мочой у больных гипертонической болезнью с микроальбуминурией. По некоторым наблюдениям, не уступали ингибиторам АПФ по эффективности верапамил, дилтиазем и индапамид. B. Agrawal и соавт. [23] недавно опубликовали результаты исследования влияния 3-месячной терапии различными антигипертензивными препаратами на микроальбуминурию более чем у 6000 больных гипертонической болезнью без сахарного диабета. Ингибиторы АПФ, антагонисты кальция, тиазидные диуретики и b-адреноблокаторы были одинаково эффективны в устранении микроальбуминурии у больных моложе 65 лет. У больных 65 лет или старше b-адреноблокаторы не оказывали влияния на микроальбуминурию, однако ингибиторы АПФ, антагонисты кальция и тиазидные диуретики были в одинаковой мере эффективными. Таким образом, в настоящее время нет достаточно убедительных данных, свидетельствующих о том, что у больных гипертонической болезнью без сопутствующего сахарного диабета ингибиторы АПФ более эффективно, чем другие антигипертензивные препараты, предупреждают развитие или замедляют прогрессирование поражения почек. Тактика лечения ингибиторами АПФ при поражении почек Прежде чем назначать ингибиторы АПФ больным с поражением почек, необходимо провести тщательное клинико-инструментальное обследование с целью уточнения этиологии почечной патологии. Особенно важно исключить так называемую ишемическую нефропатию, обусловленную двусторонним стенозом почечных артерий или стенозом артерии единственной функционирующей почки, которые являются противопоказанием для применения ингибиторов АПФ. Ингибиторы АПФ, по-видимому, бесполезны у больных с поликистозом почек и интерстициальным нефритом. До назначения ингибиторов АПФ следует определить содержание креатинина и калия в сыворотке крови. При обнаружении гиперкреатининемии важно определить СКФ, так как дозу ингибиторов АПФ подбирают с учетом СКФ (табл. 2). Для определения СКФ используются радиоизотопные методы. В повседневной практике СКФ по клиренсу эндогенного креатинина можно рассчитать по формуле Cockcroft - Gault: Эта формула применяется у мужчин. У женщин полученный результат необходимо умножить на 0,85. Ингибиторы АПФ противопоказаны при значительной гиперкалиемии (более 5,5 ммоль/л) и требуют большой осторожности при умеренной гиперкалиемии. В начале терапии ингибиторами АПФ содержание креатинина и калия в сыворотке крови необходимо определять каждые 3 - 5 дней, в дальнейшем - с интервалом в 3 - 6 мес. Дозы ингибиторов АПФ в начале терапии должны быть уменьшены вдвое у пожилых лиц, больных с сопутствующей дисфункцией левого желудочка и получающих (или недавно получавших) диуретики. Дозы ингибиторов АПФ повышают под контролем АД, содержания креатинина и калия в сыворотке крови. У больных с почечной патологией важно периодическое измерение экскреции альбуминов (или белков) с мочой. Описаны случаи увеличения протеинурии после назначения первой дозы ингибитора АПФ; при продолжении терапии ингибиторы АПФ обычно вызывают уменьшение протеинурии, если их доза достаточна для снижения системного АД. Итак, приведенные данные литературы свидетельствуют о том, что ингибиторы АПФ обладают ренопротективным действием, которое не зависит от их антигипертензивного эффекта и наиболее выражено у больных сахарным диабетом I типа и нефропатией. Необходимы дальнейшие исследования, чтобы определить клиническое значение ренопротективных эффектов ингибиторов АПФ у больных с хроническим гломерулонефритом и гипертоническим ангионефросклерозом. Литература: 1. The sixth report of the joint National Committee on prevention, detection, evaluation, and treatment of high blood pressure. Areh Intern Med 1997;157:2413-46. 2. Mimran A. Renal effects of antihypertensive agents in parenchymal renal disease and renovascular hypertension. J Cardiovascul Pharmacol 1992;19(suppl. 6):S45-S50. 3. Omata K, Kanazawa M, Sato T, et al. Therapeutic advantages of angiotensin-converting enzyme inhibitors in chronic renal disease. Kidney Int. 1996;49(suppl. 55):S57-S62. 4. Campanacci L, Fabris B, Fischetti F, et al. ACE inhibition in renal disease: risks and benefits. Clin Exp. Hypertens 1993;15(suppl. 1):173-86. 5. Bakris GL, Williams B. Angiotensin converting enzyme inhibitors and calcium antagonists alone or combined: does the progression of diabetic renal disease differ? J Hypertens 1995;13(suppl. 2):S95-S101. 6. Grenfill A, Bewick M, Parsons V, et al. Non-insulin-dependent diabetes and renal replacement therapy. Diabetic Med 1988;5:172-6. 7. Weidmann P, Boehlen LM, de Conrten M. Pathogenesis and treatment of hypertension associated with diabetes mellitus. Amer Heart J 1993;125:1498-513. 8. Viberti G, Mogensen CE, Groop LC, et al. Effect of captopril on progression to clinical proteinuria in patients with insulin-dependent diabetes mellitus and microalbuminuria. JAMA 1994;271:275-9. 9. The ENCLID study group randomized placebo-controlled trial of lisinopril in normotensive patients with insulin-dependent diabetes and normo-albuminuria or microalbuminuria. Lancet 1997;349:1787-92. 10. Melbourne Diabetic Nephropathy Study Group. Comparison between perindopril and nifedipine in hypertensive and normotensive diabetic patients with microalbuminuria. Brit Med J 1991;302:210-6. 11. Ravid M, Lang R, Rachmani R, Lishner M. Long-term renoprotective effect of angiotensin-converting enzyme inhibition in non-insulin-dependent diabetes mellitus. Arch Intern Med 1996;156;286-9. 12. Bennett PH, Haffner S, Kasiskie BL, et al. Screening and management of microalbuminuria in patients with diabetes mellitus: Recommendation to the scientific advisory board of the National Kidney Foundation from an ad hoc committee of the council on diabetes mellitus of the National Kidney Foundation. Amer J Kidney Dis 1995;25:107-12. 13. Hannedouche T, Landais P, Goldfarb B, et al. Randomized controlled trial of enalapril and-beta blockers in non-diabetic chronic renal failure. Brit Med J 1994;309:833-7. 14. Maschio G, Alberti D, Janin G, et al. Effect of the angiotensin-converting-enzyme inhibitor benazepril on the progression of chronic renal insufficiency. New Engl J Med 1996;334:939-45. 15. The GISEN group (Gruppo Italiano di Studi Epidemiologici in Nefrologia) randomized placebo-controlled trial of effect of remipril on decline in glomerular filtration rate and risk of terminal renal failure in proteinuric, non-diabetic nephropathy. Lancet 1997;349;1857-63. 16. Peterson JC, Adler S, Burkart J, et al. Blood pressure control, proteinuria, and the progression of renal disease. Ann Intern Med 1995;123:754-62. 17. Zucchelli P, Zuccala A, Borghi M, et al. Long-term comparison between captopril and nifedipine in the progression of renal insufficiency. Kidney Int. 1992;42:452-8. 18. Gall MA, Rossing P, Skott P, et al. Placebo-controlled comparison of captopril, metoprolol and hydrochlorothiazide therapy in non-insulin-dependent diabetic patients with primary hypertension. Amer J Hypertens 1992;5:257-65. 19. Schmieder RE, Veelken R, Gatzka CD, et al. Predictors for hypertensive nephropathy: Results of a 6-year follow-up study in essential hypertension. J Hypertension 1994;13:357-65. 20. Agewall S, Wikstrand J, Linngmann S, et al. Usefulness of microalbuminuria in predicting cardiovascular mortality in treated hypertensive men with and without diabetes mellitus. Amer J Cardiol 1997;80:164-9. 21. Shulman NB, Ford CE, Hall WD, et al. Prognostic value of serum creatinine and effect of treatment of hypertension on renal function. Hypertension 1989;13(suppl.1):I-80-I-83. 22. Ter Wee PM, Epstein M. Angiotensin-converting enzyme inhibitors and progression of nondiabetic chronic renal disease. Arch Intern Med 1993;153:1749-59. 23. Agrawal B, Wolf K, Berger A, Inft FC. Effect of antihypertensive treatment on qualitative estimates of microalbuminuria. J Hum Hypertens 1996;10:550-5. Поделитесь статьей в социальных сетях Порекомендуйте статью вашим коллегам www.rmj.ru механизм действия, побочные эффекты, показания и противопоказания При выраженной гипертонии врачи могут назначать своим пациентам препараты, относящиеся к различным лекарственным группам. Очень часто для снижения давления гипертоникам приходится принимать ингибиторы АПФ, механизм действия которых направлен не только оказывают гипотензивный эффект, но и на улучшение работы сердечной мышцы. Чтобы понять, что представляют собой подобные лекарства, больным необходимо подробнее узнать о механизме действия и побочных эффектах И АПФ. Механизм действия Механизм действия ИАПФ заключается в том, что ангиотензин сужает сосуды, нарушает системный кровоток и повышает артериальное давление. Кроме этого, ангиотензин стимулирует продуцирование другого гормона – альдестерона, который провоцирует развитие сосудистых спазмов, задержку жидкости и натрия в организме, учащенное сердцебиение и некоторые другие симптомы, сопровождающие артериальную гипертонию. Механизм образования ангиотензина достаточно сложен и не всегда понятен человеку, имеющему поверхностное представление о биологии и химии. Данное вещество возникает в результате множества химических реакций, протекающих в человеческом организме.  Таблетки Каптоприл Под воздействием адреналина почки начинают продуцировать фермент ренин, который попадает в системный кровоток и там превращается в ангиотензиноген, который также называют ангиотензином I. На следующем этапе ангиотензин I превращается в ангиотензин II (собственно ангиотензин), этому процессу способствует особый ангиотензинпревращающий фермент, на который и воздействуют препараты-ингибиторы. Первые ингибиторы АПФ появились более 40 лет назад. Именно тогда ученым удалось синтезировать Каптоприл, который стал одним из основных средств, назначаемых при повышенном давлении. На смену Каптоприлу пришли Эналаприл, Лизиноприл и другие препараты нового поколения. Анаприлин – адреноблокатор бета-рецепторов первой и второй групп. Прописывают препарат при заболеваниях, которые обусловлены нестабильностью сосудистого тонуса. Таблетки от высокого давления Коронал – надежное лекарственное средство, широко применяемое в кардиологии. Препарат уменьшает проявления гипертонии, ишемической болезни, стенокардии. Терапевтические свойстваЕсли человек, страдающий от гипертонического синдрома, вовремя не обратится к врачу или не станет пить назначенные доктором лекарства, воздействие ангиотензина негативно скажется на состоянии стенок сосудов и сердечной мышцы. Помимо высокого давления, у больного разовьется хроническая сердечная недостаточность, и возникнут серьезные заболевания почек (почечная недостаточность и пр.). Благодаря своему действию, ингибиторы АПФ обладают целым комплексом терапевтических свойств. Препараты, относящиеся к данной группе:
Ингибиторы АПФ могут быть назначены больному при таких патологиях, как:
Выбирать подходящий ингибитор и подбирать суточную дозу препарата для больного может только лечащий врач, самолечение лекарствами, относящимися к данной группе, может спровоцировать тяжелые осложнения для сердца и сосудов. ВидыИнгибиторы АПФ можно разделить на три разновидности по основному действующему веществу, входящему в их состав:
Разные ингибиторы (даже те, которые относятся к одному классу) имеют разное время всасывания в кровь и выведения из организма. При назначении того или иного препарата врач обязательно учитывает свойства лекарств, а также обращает внимание на состояние больного и тяжесть протекания его заболевания. Одними из самых популярных и часто назначаемых являются лекарства, имеющие следующие торговые названия: Капотен, Бензаприл, Зокардис (первое поколение), Эналакор, Диротон, Энап (второе поколение), Моноприл, Фозинап (третье поколение).Побочные действияНесмотря на хорошую переносимость, в некоторых случаях ингибиторы АПФ побочные действия могут спровоцировать, такие как:
Чаще всего побочные эффекты ингибиторов АПФ возникают из-за неправильного приема или передозировки медпрепаратов. Прежде чем, начать лечение, больной должен убедиться в отсутствии противопоказаний к употреблению таких лекарственных средств. Пациенты часто ищут ингибиторы АПФ, не вызывающие кашель. Согласно статистике, у европейцев при приеме ИАПФ побочные эффекты в виде сухого кашля возникают всего у 10% пациентов. Принимать лекарства не рекомендуется при таких заболеваниях и симптомах, как:
Употреблять ИАПФ нельзя маленьким детям, кормящим матерям, беременным женщинам. Будущие мамы должны понимать, что препараты данной группы могут уменьшать количество околоплодных вод, а также негативно воздействовать на плод, вызывая у него задержку роста и развитие врожденных аномалий. Особые указанияЧтобы минимизировать побочные действия ингибиторов АПФ, больные должны соблюдать ряд правил при их приеме:
Оптимальное время приема ингибиторов – натощак за 60 минут до еды (более точную информацию о времени приема препарата больному должен дать лечащий врач). Видео по темеВ данной лекции представлены основные фармакологические аспекты лекарственных средств, действующих на ренин-ангиотензин-альдостероновую систему (ингибиторы АПФ, сартаны и прямые ингибиторы ренина): Ингибиторы АПФ считаются одними из самых действенных препаратов, имеющих выраженное гипотензивное действие. При правильном и регулярном применении такие лекарства помогут понизить давление, восстановят работу почек и нормализуют состояние сердца и сосудов. Как и любые другие медпрепараты, вызывают ингибиторы АПФ побочные эффекты, поэтому нужно относиться к их приему внимательно и не нарушать рекомендации врача. gipertonia.pro Ингибиторы АПФ: сравнение популярных препаратов,
Здравствуйте, дорогие друзья! Сегодня ваш коллега и мой соавтор Антон прислал мне продолжение романа «Война и мир в сердце и сосудах» :-) об антигипертензивных средствах, который мы начали изучать в прошлый раз. Я как увидела, что статья получилась внушительной (не пугайтесь, я разбила ее на две части), налила себе чайку с мелиссой, достала две конфеты «Коровка», чтобы материал усваивался лучше, и приступила к чтению. И вы знаете, оно меня так захватило! Огромное спасибо Антону: так все интересно и понятно объяснил! Погружаясь в таинственный мир человеческого тела, я не перестаю восхищаться, как волшебно устроен Человек. Это же надо было Творцу так все придумать! Одно вещество соединяется с другим, помогает ему в этом третье, при этом что-то расширяется, что-то сужается, что-то выделяется, что-то улучшается. Причем, вся эта фабрика работает, не переставая, и днем, и ночью! В общем, друзья, наливайте себе тоже чаечку или кофеечку для полноты кайфа (если с давлением у вас все ОК) и читайте с чувством, толком, расстановкой. А я передаю слово Антону. — Спасибо, Марина! В прошлый раз мы беседовали с вами о том, как нервная система регулирует артериальное давление, и поговорили о препаратах, которые влияют на этот процесс. Сегодня обсудим факторы, которые регулируют тонус сосудов, то есть речь пойдет о гуморальной регуляции сосудов, которая есть не что иное, как регуляция сигнальными молекулами. Гуморальная регуляция сосудовГуморальная регуляция куда более древняя и поэтому более сложная и в описании, и в понимании. Давайте более подробно рассмотрим вещества, повышающие тонус сосудов. Первое и наиболее известное – адреналин. Это гормон коры надпочечников, который выделяется при воздействии на надпочечник симпатической нервной системы. Механизм его действия связан с влиянием на адренорецепторы, о которых мы уже говорили в прошлый раз. Поэтому вам уже известно, что делать с влиянием адреналина на сосуды. Следующее соединение – ангиотензин II. Это мощное сосудосуживающее соединение, которое образуется в результате цепочки превращений: ангиотензиноген – ангиотензин I – ангиотензин II. Ангиотензиноген — это неактивное соединение, образующееся в печени. Превращения эти катализирует так называемый ангиотензинпревращающий фермент, или просто АПФ. Активность АПФ регулируется, в свою очередь, ренином. Помните? Про него мы говорили в прошлый раз. Это вещество выделяется почкой в ответ на воздействие на нее симпатической иннервации. Кроме того, почка начинает вырабатывать ренин в случае уменьшения количества поступающей к ней крови. Ангиотензин II оказывает влияние еще и на надпочечники, стимулируя выброс альдостерона и кортизола – гормонов, снижающих выведение натрия. Так происходит в норме. Что происходит при стрессе?А теперь представьте себе человека, который испытывает хронический стресс. Например, это наш коллега-первостольник, который ежедневно сталкивается со сложными клиентами. Во время каждой стрессовой ситуации активизируется симпатическая нервная система. Сосуды сужаются, сердце начинает биться чаще, из надпочечников выделяется порция адреналина, почки начинают выделять ренин, который активирует АПФ. В результате повышается количество ангиотензина II, сосуды сужаются еще больше, давление подпрыгивает. Если стресс прошел, активность симпатической нервной системы снижается, и постепенно все приходит в норму. Однако, если стресс повторяется изо дня в день, кровоток почек под влиянием адреналина и ангиотензина II становится все хуже и хуже, почки выделяют еще больше ренина, который способствует еще большему выделению ангиотензина II. Это приводит к тому, что сердцу, чтобы выгнать кровь в суженные артерии, нужно прикладывать все больше и больше сил.
Миокард начинает разрастаться. Но питание увеличивать ему никто не будет, так как растут только мышцы, а не сосуды. Кроме того, от большого количества ангиотензина II из надпочечников выделяется альдостерон, который снижает выведение натрия, а натрий притягивает воду, что повышает объем крови. Наступает момент, когда сердце отказывается работать в таких условиях, начинает «скандалить» — появляются аритмии, снижается его сократительная способность, поскольку сердечная мышца теряет последние силы в попытках перекачать кровь в суженные сосуды. Почки тоже не в восторге: кровоток в них нарушается, нефроны постепенно начинают отмирать. Вот почему гипертоническая болезнь тянет за собой сразу несколько осложнений. А во всем виноват стресс. Недаром гипертонию называют «болезнью невысказанных эмоций». Таким же образом сработает любой фактор, сужающий просвет почечной артерии, к примеру, опухоль, сдавливающая сосуд, или атеросклеротическая бляшка, или тромб. Почка будет «паниковать» оттого, что ей не хватает кислорода и питательных веществ, и примется в огромных порциях выбрасывать ренин. Не сильно я вас загрузил физиологией? Но без понимания этого невозможно понять действие препаратов, к которым я сейчас перехожу. Итак, как на это все безобразие можно повлиять лекарствами? Поскольку центральное звено этой истории ангиотензин II, то нужно как-то уменьшать его количество в организме. Тут на помощь приходят препараты, снижающие активность АПФ, или ингибиторы АПФ (иАПФ). Ингибиторы АПФПрепараты этой группы оказывают также сосудорасширяющее действие, тормозят выведение белка с мочой, оказывают мочегонный эффект (за счет того, что расширяют сосуды, в том числе и почек, и снижают количество альдостерона). Кроме того, они уменьшают выведение калия почками. Доказана эффективность препаратов этой группы при сердечной недостаточности и гипертрофии левого желудочка, поскольку они снижают активность разрастания сердечной мыщцы. Долгое время эта группа препаратов считалась «золотым стандартом» лечения гипертонии. Почему? Смотрите: сосуды расширены, сердцу работа облегчена, почки тоже счастливы.
А еще эти препараты помогали снизить смертность при инфаркте миокарда. Казалось бы, чего еще можно желать? Основной побочный эффект, который отмечают больные, это сухой кашель. Но также ингибиторы АПФ вызывают гипотонию (в случае разового приема больших доз), могут провоцировать появление сыпи, потерю вкусовой чувствительности, импотенцию и снижение либидо, уменьшение содержания лейкоцитов и, кроме того, они гепатотоксичны. В общем, список внушителен, и ингибиторы АПФ свое звание потеряли. Однако в России они по- прежнему относятся к первой линии лечения гипертонии. Давайте познакомимся с ними поближе. Первый препарат, наиболее старый из всей группы, каптоприл, известный под названием КАПОТЕН.
Его рекомендуется принимать до еды, так как пища угнетает его всасывание. Это один из «короткодействующих» иАПФ, действие развивается при приеме внутрь через 30 минут – 1 час, при сублингвальном приеме – через 15-30 минут. Поэтому препарат может применяться как «скорая помощь» при гипертоническом кризе. При этом важно помнить, что за один раз можно принять не больше двух таблеток, в сутки не больше шести. Препарат противопоказан беременным, кормящим, лицам младше 18 лет, людям с почечной недостаточностью, сужением просвета обоих почечных артерий. Из побочных эффектов – сухость слизистых, сухой кашель, повышение активности «печеночных трансаминаз», головная боль, головокружение, могут быть аллергические реакции. Второй препарат - это самый продаваемый и самый известный иАПФ Эналаприл, известный под названиями ЭНАП, ЭНАМ, БЕРЛИПРИЛ, РЕНИТЕК и др. Препарат является пролекарством, то есть при приеме внутрь Эналаприла малеат в печени превращается в активное вещество Эналаприлат. Помимо ингибирования АПФ он оказывает сосудорасширяющее действие, улучшает почечный кровоток, нормализует уровень холестерина в плазме, уменьшает потерю ионов калия, вызванную диуретиками. Прием пищи не оказывает влияния на всасывание препарата. Он начинает действовать через час после приема внутрь, длительность от 12 до 24 часов, это зависит от дозировки. Противопоказан лицам до 18, беременным и кормящим, а также при повышенной чувствительности к иАПФ. Следующий препарат — лизиноприл, или ДИРОТОН. Главная особенность его – он практически не подвергается метаболизму в печени, поэтому значительно реже, чем остальные иАПФ, вызывает сухость слизистых и провоцирует сухой кашель. Также немаловажный плюс препарата и то, что та его часть, которая связалась с АПФ, выводится крайне медленно, что позволяет использовать его один раз в сутки. Препарат уменьшает потерю белка с мочой. Противопоказан лицам до 18, беременным и кормящим. Поговорим теперь о Периндоприле, известном как ПРЕСТАРИУМ, ПРЕСТАРИУМ А и ПЕРИНЕВА.
Престариум и Перинева выпускаются по 4 и 8 мг, а вот Престариум А по 5 и 10 мг. Как оказалось, в Престариуме А содержится периндоприла аргинин, а в Периневе и Престариуме — периндоприла эрбумин. Сравнивая особенности фармакокинетики, понял такую вещь. В соединениях, где представлен периндоприла эрбумин, активным становится примерно 20% от выпитого вещества, а в соединении периндоприла аргинин – около 30%. Вторая немаловажная черта – периндоприл имеет длительный период полувыведения, эффективность его сохраняется в течение 36 часов. А стойкий эффект развивается уже в течение 4-5 дней. Для сравнения у лизиноприла – 2-3 недели, у эналаприла – месяц. Третья особенность препарата – он оказывает антиагрегантное действие, механизм его сложен и связан с образованием простациклина – соединения, уменьшающего способность тромбоцитов к склеиванию между собой и прилипанию к сосудистой стенке. В свете этого шире и показания к применению препарата. Помимо гипертонической болезни, он показан при хронической сердечной недостаточности, стабильной ишемической болезни сердца, для уменьшения риска сердечно-сосудистой катастрофы, профилактики повторного инсульта у пациентов, перенесших сосудистые заболевания головного мозга. Остальные препараты этой группы схожи между собой, отличаются лишь время начала действия и период полувыведения. Поэтому рассматривать отдельно их не буду. И в заключении сегодняшнего разговора одно очень важное предупреждение: Все препараты этой группы снижают выведение калия, и дополнительный прием калийсодержащих препаратов, таких как Аспаркам или Панангин без контроля содержания калия в крови может привести к гиперкалиемии, которая, в свою очередь, приведет к нарушениям сердечного ритма, и, не дай Бог, остановке сердца. Спасибо, Антон! Друзья, как вам понравилась статья? Есть ли вопросы? Есть ли, что добавить? Пишите, не стесняйтесь! До новой встречи на блоге для трудяг фармбизнеса! С любовью к вам, Марина Кузнецова nikafarm.ru Клиническая фармакология ингибиторов АПФ и блокаторов АТ1–ангиотензиновых рецепторов – какие уроки можно из нее извлечь | Добровольский А.В.Для цитирования: Добровольский А.В. Клиническая фармакология ингибиторов АПФ и блокаторов АТ1–ангиотензиновых рецепторов – какие уроки можно из нее извлечь // РМЖ. 2006. №20. С. 1443 Введение Ингибиторы ангиотензинпревращающего фермента (АПФ) применяются уже более 20 лет и в настоящее время являются одними из наиболее широко используемых кардиотропных лекарственных средств. Созданные примерно на десять лет позже блокаторы АТ1–ангиотензиновых рецепторов некоторое время находились «в тени» ингибиторов АПФ, но в последние годы частота их использования в кардиологической практике (в первую очередь для лечения пациентов с артериальной гипертонией и хронической сердечной недостаточностью) неуклонно возрастает. Несмотря на общеизвестные различия в механизме действия на ренин–ангиотензин–альдостероновую систему (РААС), подробное описание которых выходит за рамки настоящей публикации, ингибиторы АПФ и блокаторы АТ1–ангиотензиновых рецепторов оказывают сходное влияние на сердечно–сосудистую систему, имеют практически одинаковые показания к применению1 и часто служат альтернативой друг другу (например, при лекарственной непереносимости). При этом препараты внутри каждой из указанных фармакологических групп, на первый взгляд, представляются весьма схожими (или, по меньшей мере, не столь гетерогенными, как антагонисты кальция и b–адреноблокаторы). Проблема осложняется еще и тем, что на российском медицинском рынке одновременно присутствуют несколько ингибиторов АПФ и блокаторов АТ1–ангиотензиновых рецепторов, что создает предпосылки для частой и нередко неоправданной смены препаратов (например, в случае отсутствия необходимого лекарства в аптеке пациенту с высокой вероятностью предложат его «аналог»). Вместе с тем существуют существенные различия (прежде всего с точки зрения фармакокинетики) как между препаратами внутри каждой из указанных групп, так и между группами в целом. Незнание этих различий может приводить к назначению неадекватных дозировок, предписанию неверного режима приема препарата и, в конечном итоге, к недостижению желаемого терапевтического эффекта. Наконец, ингибиторы АПФ и блокаторы АТ1–ангиотензиновых рецепторов зачастую считаются «безопасными» лекарствами (в отличие от тех же b–адреноблокаторов) и назначаются без должного учета имеющихся у пациента сопутствующих физиологических и патологических состояний. Соответственно, настоящая публикация на основании сравнительного анализа отдельных нечасто обсуждаемых аспектов фармакокинетики и фармакодинамики2 ингибиторов АПФ и блокаторов АТ1–ангиотензиновых рецепторов призвана выявить наиболее существенные с практической точки зрения различия между отдельными препаратами и лекарственными группами, а также сформулировать ориентировочные рекомендации по их использованию в различных клинических ситуациях. Введение Ингибиторы ангиотензинпревращающего фермента (АПФ) применяются уже более 20 лет и в настоящее время являются одними из наиболее широко используемых кардиотропных лекарственных средств. Созданные примерно на десять лет позже блокаторы АТ1–ангиотензиновых рецепторов некоторое время находились «в тени» ингибиторов АПФ, но в последние годы частота их использования в кардиологической практике (в первую очередь для лечения пациентов с артериальной гипертонией и хронической сердечной недостаточностью) неуклонно возрастает. Несмотря на общеизвестные различия в механизме действия на ренин–ангиотензин–альдостероновую систему (РААС), подробное описание которых выходит за рамки настоящей публикации, ингибиторы АПФ и блокаторы АТ1–ангиотензиновых рецепторов оказывают сходное влияние на сердечно–сосудистую систему, имеют практически одинаковые показания к применению1 и часто служат альтернативой друг другу (например, при лекарственной непереносимости). При этом препараты внутри каждой из указанных фармакологических групп, на первый взгляд, представляются весьма схожими (или, по меньшей мере, не столь гетерогенными, как антагонисты кальция и b–адреноблокаторы). Проблема осложняется еще и тем, что на российском медицинском рынке одновременно присутствуют несколько ингибиторов АПФ и блокаторов АТ1–ангиотензиновых рецепторов, что создает предпосылки для частой и нередко неоправданной смены препаратов (например, в случае отсутствия необходимого лекарства в аптеке пациенту с высокой вероятностью предложат его «аналог»). Вместе с тем существуют существенные различия (прежде всего с точки зрения фармакокинетики) как между препаратами внутри каждой из указанных групп, так и между группами в целом. Незнание этих различий может приводить к назначению неадекватных дозировок, предписанию неверного режима приема препарата и, в конечном итоге, к недостижению желаемого терапевтического эффекта. Наконец, ингибиторы АПФ и блокаторы АТ1–ангиотензиновых рецепторов зачастую считаются «безопасными» лекарствами (в отличие от тех же b–адреноблокаторов) и назначаются без должного учета имеющихся у пациента сопутствующих физиологических и патологических состояний. Соответственно, настоящая публикация на основании сравнительного анализа отдельных нечасто обсуждаемых аспектов фармакокинетики и фармакодинамики2 ингибиторов АПФ и блокаторов АТ1–ангиотензиновых рецепторов призвана выявить наиболее существенные с практической точки зрения различия между отдельными препаратами и лекарственными группами, а также сформулировать ориентировочные рекомендации по их использованию в различных клинических ситуациях. Ингибиторы ангиотензин– превращающего фермента Классификация ингибиторов АПФ Общепринятой классификации препаратов в настоящее время не существует. Широкое распространение получила классификация ингибиторов АПФ по их химической структуре, в соответствии с которой выделяют препараты: 1) содержащие сульфгидрильную группу (каптоприл, зофеноприл), 2) содержащие карбоксиалкильную группу (эналаприл, лизиноприл, квинаприл, моэксиприл, периндоприл, рамиприл, трандолаприл, цилазаприл) и 3) содержащие фосфинильную группу (фозиноприл) [1], однако практическое ее значение невелико. Считается, что наличие в химической структуре каптоприла сульфгидрильной группы обусловливает появление таких присущих только этому препарату побочных явлений, как нейтропения, потеря вкусовой чувствительности, неприятный вкус во рту и протеинурия [7]. Другими авторами ингибиторы АПФ в зависимости от физико–химических свойств и особенностей метаболизма разделяются на: 1) липофильные лекарства (каптоприл), 2) липофильные пролекарства с преимущественным выведением через почки (квинаприл, периндоприл), 3) липофильные пролекарства, имеющие два пути элиминации (моэксиприл, рамиприл и др.) и 4) гидрофильные лекарства (лизиноприл) [5]. Однако более существенным здесь является разделение рассматриваемых препаратов на лекарства и пролекарства. Так, среди доступных ингибиторов АПФ только каптоприл и лизиноприл обладают самостоятельной биологической активностью [6]. Остальные препараты являются пролекарствами и приобретают фармакологическую активность только после деэстерификации. Превращение в активные диацидные метаболиты происходит в основном в печени, отчасти в слизистой оболочке органов желудочно–кишечного тракта. Клиническое же значение липофильности/гидрофильности невелико3. Кроме того, ингибиторы АПФ разделяются в зависимости от продолжительности фармакологического действия (см. ниже). Фармакокинетика ингибиторов АПФ Биодоступность Среди ингибиторов АПФ наиболее низкая биодоступность отмечается у трандолаприла (11%) [8], лизиноприла (25–29%) [9,10], моэксиприла (22%) и фозиноприла (32%) [1]. У прочих препаратов рассматриваемый показатель существенно выше. Так, биодоступность каптоприла и квинаприла примерно одинакова и составляет 60–65% [11,12]. Биодоступность эналаприла среди всех ингибиторов АПФ наиболее высока и достигает 60–70% [13,14]. Одним из факторов, определяющих биодоступность препарата, является его взаимодействие с пищей. Известно, что пища уменьшает всасывание каптоприла на 30–40%, поэтому препарат необходимо принимать не менее чем за час до еды [11]. Аналогичным образом (не ранее чем за час до приема пищи) необходимо принимать моэксиприл [15,16]. Прочие ингибиторы АПФ (в частности, эналаприл [17], лизиноприл [10] и квинаприл [12]) характеризуются более стабильной абсорбцией в желудочно–кишечном тракте и могут назначаться как до, так и после еды. Связывание с белками Большинство липофильных ингибиторов АПФ в свободном виде в плазме крови почти не присутствуют и связаны с белками на 80–95% (беназеприл, квинаприл, трандолаприл, моэксиприл, фозиноприл, зофеноприл) [1]. В малой степени связываются с белками лизиноприл (не более чем 5–10%) [10], а также периндоприл (на 20%) и каптоприл (на 30%). Эналаприл и рамиприл занимают промежуточное положение и связаны с белками плазмы крови примерно на 50–60% [1] Период полувыведения и продолжительность действия Следует отметить, что у ингибиторов АПФ не обнаруживается однозначного параллелизма между периодом полувыведения препарата и продолжительностью его фармакологического действия. Так, известно, что у каптоприла период полувыведения составляет всего лишь от 1–2 до 6 часов [8,14]. Однако при длительном применении концентрация препарата в плазме крови и продолжительность действия несколько увеличивается. Считается, что благодаря сульфгидрильной группе каптоприл образует неустойчивые соединения с эндогенными тиолсодержащими веществами (такими, как цистеин и глютатион), которые при уменьшении концентрации рассматриваемого ингибитора АПФ способны отщеплять каптоприл и таким образом являются своеобразным «депо» последнего [11,14]. Период полужизни квинаприла еще меньше, чем у каптоприла, и составляет всего 1–3 часа (в среднем около двух часов) [19]. Однако благодаря своему высокому сродству к тканевым ангиотензинпревращающим ферментам препарат может приниматься два раза в сутки или даже однократно [12]. Средняя продолжительность фармакологического действия характерна для эналаприла (период полувыведения от 2–4 до 11 часов при длительном применении) [14,17], лизиноприла (период полувыведения 7–13 часов) [10], фозиноприла (12–15 часов) [20] и цилазаприла (от 4 до 12 часов) [21–23], хотя по некоторым данным период полувыведения последнего может превышать 24–48 часов и достигать 86 часов [1]. К препаратам с длительном периодом полувыведения относятся периндоприл (27–40 часов) [24–26], рамиприл (23–48 часов) [27], трандолаприл (16–24 часа) [28] и моэксиприл (29–30 часов) [15]. Для всех указанных лекарственных средств характерна также значительная продолжительность фармакологического действия. Таким образом, все ингибиторы АПФ можно разделить на: 1) препараты короткого действия, которые необходимо назначать 3 раза в сутки (каптоприл), 2) препараты со средней длительностью действия, назначаемые 2 раза в сутки (эналаприл, лизиноприл) и 3) препараты длительного действия, которые в большинстве случаев можно принимать один раз в сутки (трандолаприл, рамиприл, периндоприл, моэксиприл, фозиноприл, квинаприл)4 [1]. В завершение данного раздела необходимо отметить, что скорость наступления фармакологического эффекта у подавляющего большинства ингибиторов АПФ невелика, что делает нецелесообразным их применение в ургентных ситуациях (например, для купирования гипертонического криза). Единственным исключением является каптоприл, который оказывает быстрое гипотензивное действие благодаря высокой биодоступности (препарат обнаруживается в крови уже через 15 минут и достигает пиковой концентрации через 45–60 минут после приема внутрь [11]) и наличию собственного фармакологического эффекта. При приеме под язык действие каптоприла развивается еще быстрее, благодаря чему препарат может эффективно применяться сублингвально с целью быстро снижения артериального давления [29]. Экскреция Для всех ингибиторов АПФ характерна почечная элиминация, однако только лизиноприл выводится исключительно почками и лишь в неизмененном виде [10]. Остальные препараты элиминируются не только почками, но и печенью, однако доля печеночной экскреции у разных препаратов различается. Так, эналаприл [13,17] и каптоприл [11] почти полностью выводятся почками. Кроме того, почечным путем экскретируется 60% квинаприлата и 70% периндоприлата (активные метаболиты соответственно квинаприла и периндоприла) [12,25]. Напротив, такие ингибиторы АПФ, как моэксиприл, рамиприл, трандолаприл, фозиноприл и беназеприл, выводятся почками и печенью примерно в одинаковой степени [8]. Лекарственные взаимодействия ингибиторов АПФ Благодаря тому, что метаболизм ингибиторов АПФ происходит в основном без участия цитохрома Р450, рассматриваемые препараты не вступают в клинически значимые взаимодействия с циметидином и варфарином [10,11,17,30]. Нет доказательств того, что ингибиторы АПФ повышают риск дигиталисной интоксикации при их совместном применении с сердечными гликозидами [30, 31]. Клинически значимые фармакокинетические лекарственные взаимодействия ингибиторов АПФ относительно немногочисленны. Так, антациды, содержащие гидроокись магния или алюминия, нарушают всасывание каптоприла и фозиноприла [11]. Экскреция каптоприла нарушается при его совместном применении с пробенецидом, что может сопровождаться существенным повышением содержания указанного ингибитора АПФ в плазме крови [11]. Известно также, что ингибиторы АПФ замедляют выведение из организма солей лития (особенно на фоне терапии диуретиками) и даже могут привести к возникновению литиевой интоксикации [32]. Среди фармакодинамических взаимодействий наибольшее клиническое значение имеют интеракции ингибиторов АПФ с нестероидными противовоспалительными препаратами (НПВП), ацетилсалициловой кислотой и диуретиками. Так, НПВП за счет снижения синтеза простагландинов I2 (простациклина) и E2 уменьшают почечный кровоток, снижают клубочковую фильтрацию и вызывают задержку натрия, ослабляя, таким образом, вазодилатирующий и натрийуретический эффект ингибиторов АПФ и препятствуя реализации гипотензивного действия последних [33–35]. Необходимо помнить, что ацетилсалициловая кислота аналогичным образом взаимодействует с ингибиторами АПФ, причем выраженность ее эффекта возрастает с увеличением дозы [36]. Вместе с тем результаты проведенных исследований показывают, что ацетилсалициловая кислота в суточной дозе не более 300–325 мг не приводит к повышению артериального давления у больных, получающих ингибиторы АПФ [37,38]. Косвенные данные свидетельствуют о том, что ацетилсалициловая кислота может также нивелировать благоприятные гемодинамические изменения и положительное влияние ингибиторов АПФ на выживаемость больных хронической сердечной недостаточностью [39–41], однако этот вопрос до настоящего времени остается открытым. Отдельного рассмотрения заслуживает взаимодействие между ингибиторами АПФ и диуретиками. Известно, что тиазидные диуретики увеличивают экскрецию натрия из организма, активируют РААС и тем самым потенцируют действие ингибиторов АПФ. С другой стороны, калийсберегающее и урикозурическое действие ингибиторов АПФ [10,17], в известной мере ослабляет калийуретический и гиперурикемический эффекты тиазидных и петлевых диуретиков. Таким образом, сочетание различных ингибиторов АПФ с тиазидными диуретиками считается полезным [10,17,19,22,24,42]. Вместе с тем у больных, принимавших диуретики, чаще возникают нарушения функции почек после начала терапии ингибиторами АПФ [1]. Ингибиторы АПФ могут вызывать дилатацию системных и почечных артериол, уменьшать перфузионное давление в клубочках и как результат – снижать скорость клубочковой фильтрации [43]. По этой причине в начале терапии указанными препаратами у больных хронической сердечной недостаточностью, получающих поддерживающие дозы петлевых диуретиков, может наблюдаться задержка жидкости (причем этот эффект выражен тем сильнее, чем выше доза ингибитора АПФ [44]). В связи с этим рекомендуется принимать тиазидные и петлевые диуретики не менее чем за 2 часа до приема ингибитора АПФ [1], а также назначать последние, начиная с малых суточных доз. Калийсберегающие диуретики значительно повышают риск развития гиперкалиемии на фоне терапии ингибиторами АПФ, поэтому следует избегать совместного применения указанных препаратов, особенно для лечения гипертонической болезни. Напротив, в комбинированной терапии хронической сердечной недостаточности совместное применение ингибиторов АПФ со спиронолактоном является весьма полезным [45], однако при этом требуется регулярное мониторирование уровня калия в плазме крови [46]. В завершение необходимо отметить, что комбинация ингибиторов АПФ с антагонистами кальция в терапии гипертонической болезни является очень эффективной (помимо суммации гипотензивного действия, ингибиторы АПФ ослабляют вызванную блокаторами кальциевых каналов активацию РААС и симпато–адреналовой системы и уменьшают рефлекторную тахикардию). Напротив, сочетание ингибиторов АПФ с b–адреноблокаторами является нерациональным ввиду того, что препараты обеих лекарственных групп действуют на разные уровни РААС (как известно, гипотензивный эффект b–адреноблокаторов в значительной степени связан с торможением секреции ренина) [1]. Применение ингибиторов АПФ в особых клинических ситуациях Хроническая почечная недостаточность Как показали проведенные исследования, существует строгая линейная корреляция между клиренсом креатинина и скоростью элиминации большинства ингибиторов АПФ [47]. Это относится в первую очередь к препаратам с преимущественно почечным путем элиминации. Так, у пациентов с хронической почечной недостаточностью замедляется экскреция и повышается сывороточная концентрация каптоприла [11], лизиноприла [10], эналаприла [17] и квинаприла [12], что требует применения указанных препаратов в половинных дозах, если клиренс креатинина составляет менее 30 мл/мин. Хотя фармакокинетика периндоприла при ХПН и не нарушена, отмечается увеличение интенсивности и длительности ингибирования сывороточной АПФ, в связи с чем рекомендуется уменьшить дозу препарата у больных с выраженным нарушением функции почек [48]. Считается, что при ХПН более безопасны препараты со значительной печеночной элиминацией. В частности, установлено, что при нарушении функции почек не замедляется выведение фозиноприла [49–51]. Вместе с тем у пациентов с умеренной и тяжелой почечной недостаточностью рекомендуется уменьшение дозы трандолаприла и моэксиприла [16]. Таким образом, при ХПН любые ингибиторы АПФ необходимо применять в дозах на 25–50% меньших, чем у лиц с сохраненной функцией почек [52]. Гемодиализ Установлено, что каптоприл, периндоприл и эналаприл элиминируются из организма при гемодиализе и перитонеальном диализе. Соответственно, может потребоваться дополнительный прием этих препаратов после экстракорпоральной детоксикации [48]. Другие ингибиторы АПФ (в частности, квинаприл и цилазаприл) при гемодиализе из организма не элиминируются [52]. Печеночная недостаточность Ранее предполагалось, что при печеночной недостаточности может уменьшаться биотрансформация неактивных пролекарств в активные метаболиты5. Однако в ряде исследований было установлено, что нарушение функции печени не влияет на фармакокинетику каптоприла, эналаприла [17], периндоприла [53] и других ингибиторов АПФ. В то же время при тяжелых заболеваниях печени рекомендуется уменьшать дозы препаратов со значительной печеночной элиминацией (в частности, моэксиприла [16]). Таким образом, представляется, что у рассматриваемой категории пациентов наиболее целесообразно применять препараты с почечным путем элиминации (в первую очередь – лизиноприл) [8,10]. Пожилой и старческий возраст6 Фармакокинетика каптоприла и лизиноприла с возрастом не изменяется [11,54]. Вместе с тем у пожилых людей наблюдается некоторое увеличение концентрации периндоприла в плазме крови [25], что может быть отражением более быстрой деэстерификации препаратов, а также уменьшение скорости секреции в связи с возрастным снижением функции почек. В целом пожилой возраст сам по себе не является показанием к уменьшению дозы ингибиторов АПФ, однако следует соблюдать осторожность при использовании высоких дозировок указанных препаратов. Беременность Известно, что ингибиторы АПФ обладают выраженным фетотоксическим действием, способствуют формированию целого ряда пороков развития плода (тубулярная нефропатия, гипоплазия легких и почек, олигогидроамниоз, контрактуры конечностей, недоразвитие затылочной кости с энцефалоцеле или экзэнцефалией), а также являются причиной длительной анурии в раннем постнатальном периоде [58]. В связи с этим применение всех ингибиторов АПФ абсолютно противопоказано во II и III триместрах беременности. При этом ранее считалось, что ингибиторы АПФ не обладают тератогенным действием [59,60], и потому относительно безопасны в первом триместре беременности. Однако в июне 2006 года были опубликованы данные проведенного в США ретроспективного исследования, согласно которым при применении ингибиторов АПФ в первом триместре беременности риск возникновения значительных врожденных пороков повышен в 2,7 раза (95% доверительный интервал 1,72–4,27), пороков развития сердечно–сосудистой системы – в 3,72 раза (95% доверительный интервал 1,89–7,30), пороков развития центральной нервной системы – в 4,39 раза (95% доверительный интервал 1,37–14,02) [61]. Таким образом, применение ингибиторов АПФ следует считать противопоказанным в течение всей беременности. Кроме того, следует, по–видимому, избегать применения ингибиторов АПФ у женщин детородного возраста, не использующих эффективные методы контрацепции, отдавая предпочтение иным гипотензивным средствам [62]. Блокаторы АТ1–ангиотензиновых рецепторов Классификация блокаторов АТ1–ангиотензиновых рецепторов Общепринятой классификации блокаторов АТ1– ангиотензиновых рецепторов не существует. По химической структуре рассматриваемые лекарственные средства делятся на четыре основные группы: 1) бифениловые производные тетразола (лозартан (Вазотенз), ирбесартан, кандесартан, ольмесартан, тазосартан), 2) небифениловые производные тетразола (тельмисартан), 3) небифениловые нететразоловые соединения (эпросартан) и 4) негетероциклические соединения (валсартан, фонсартан) [63]. Кроме того, эти препараты можно классифицировать по особенностям связывания с АТ1–ангиотензиновыми рецепторами. Так, некоторые блокаторы обратимо связываются с рецепторами и могут быть вытеснены из этой связи избытком ангиотензина II. Такие препараты называют конкурентными или преодолимыми (surmountable) блокаторами АТ1–ангиотензиновых рецепторов. К ним относятся лозартан (Вазотенз и др.), эпросартан, а также тазосартан и его активный метаболит энолтазосартан. Другие лекарственные средства (такие, как валсартан, кандесартан, ирбесартан, тельмисартан, а также активный метаболит лозартана EXP–3174) связываются с рецепторами необратимо и не вытесняются избытком ангиотензина II, т.е. являются неконкурентными или непреодолимыми (insurmountable) блокаторами [64]. В настоящее время установлено, что так называемые непреодолимые блокаторы АТ1–ангиотензиновых рецепторов, на самом деле, тоже являются конкурентными, но с очень медленной диссоциацией [65]. Таким образом, в пределах рассматриваемой группы следует выделять препараты с быстро обратимой (rapidly reversible) и медленно обратимой (slowly reversible) блокадой. Первую подгруппу составляют лозартан, эпросартан и тазосартан, а во вторую входят все остальные известные блокаторы АТ1–ангиотензиновых рецепторов (включая фармакологически активный метаболит лозартана) [2]. Наконец, блокаторы АТ1–ангиотензиновых рецепторов можно классифицировать в зависимости от наличия собственного фармакологического действия, а также активных метаболитов. При этом большинство препаратов рассматриваемой группы обладают собственной активностью (т.е сами по себе являются лекарствами). К их числу относятся лозартан (Вазотенз и др.), валсартан, ирбесартан, тельмисартан, эпросартан и тазосартан. При этом у лозартана (Вазотенз) и тазосартана имеются еще и активные метаболиты (соответственно E–3174 и энолтазосартан), которые по своей фармакодинамической активности (E–3174) и продолжительности действия (оба метаболита) превосходят исходные препараты. Только два блокатора АТ1–ангиотензиновых рецепторов (кандесартана цилексетил и ольмесартана медоксомил) являются пролекарствами и превращаются в активные вещества (соответственно кандесартан и ольмесартан) в процессе всасывания в желудочно–кишечном тракте [66,67]. Фармакокинетика блокаторов АТ1–ангиотензиновых рецепторов Биодоступность Наименьшая биодоступность при приеме внутрь отмечается у эпросартана (13,1%) [68], валсартана (23–29%) [69] и ольмесартана медоксомила (28,6%) [67], а наибольшая – у ирбесартана (60–85%) [70] Остальные препараты занимают промежуточное положение, и их биодоступность варьирует от 30 до 60% [63]. Следует иметь в виду, что пища на 40–50% уменьшает всысывание валсартана [63], в связи с чем указанный препарат следует принимать не менее чем за час до еды. При приеме эпросартана во время еды снижается скорость всасывания, однако полнота абсорбции и общая биодоступность не изменяются. Соответственно, эпросартан можно принимать во время приема пищи или после еды [68]. Прочие блокаторы АТ1–ангиотензиновых рецепторов (в частности, лозартан [71] и ирбесартан [70]) могут назначаться вне зависимости от приема пищи. Связывание с белками Все препараты рассматриваемой группы практически полностью связываются с белками крови [63]. При этом даже при применении ирбесартана (препарат, который в наименьшей степени связывается с белком [70]) в свободном виде определяется лишь примерно 10% от общего количества введенной дозы. Период полувыведения и длительность действия К препаратам с малым периодом полувыведения относятся лозартан (1,3–2,5 часов) [72], валсартан (5–7 часов) [69] и эпросартан (5–7 часов) [68]. Более продолжительный период полувыведения характерен для кандесартана цилексетила (около 9 часов) [66] и ольмесартана медоксомила (10–15 часов) [67]. Наиболее длительный период полувыведения отмечается у тельмисартана (16–24 часа) и ирбесартана (11–20 часов) [65,70]. Соответственно, блокаторы АТ1–ангиотензиновых рецепторов разделяются некоторыми авторами на препараты короткого (лозартан, валсартан, эпросартан) и длительного (все остальные) действия [73]. Вместе с тем зависимость между периодом полувыведения и продолжительностью фармакологического действия не является однозначной. В частности, у лозартана имеется активный метаболит E–3174, который характеризуется более продолжительным периодом полувыведения (6–9 часов) и медленно обратимым взаимодействием с ангиотензиновыми рецепторами [72] и благодаря которому препарат можно принимать один раз в сутки. Длительный эффект валсартана также объясняется его непреодолимым связыванием с рецепторами. Таким образом, считается, что практически все существующие в настоящее время блокаторы АТ1– ангиотензиновых рецепторов можно назначать один раз в сутки [63]7. Экскреция Для всех блокаторов АТ1–ангиотензиновых рецепторов характерен преимущественно печеночный путь элиминации. При этом валсартан, тельмисартан и эпросартан почти полностью выводятся из организма с желчью и калом в неизмененном виде, и лишь крайне незначительная их часть метаболизируется в печени и выводится почками [76,77]. Вместе с тем у ряда препаратов отмечается существенная почечная экскреция. В частности, через почки выводится до 30–40% вещества E–3174 (активный метаболит лозартана) [72], около 20% ирбесартана [70], а также до 30–40% кандесартана [66] и ольмесартана [67]. Лекарственные взаимодействия блокаторов АТ1–ангиотензиновых рецепторов Клинически значимые фармакокинетические взаимодействия блокаторов АТ1–ангиотензиновых рецепторов с другими лекарственными препаратами относительно немногочисленны. При этом количество выявленных интеракций у различных препаратов неодинаково и находится в прямой зависимости от интенсивности их печеночного метаболизма. Так, для лозартана характерно наиболее высокое сродство к изоферментам цитохрома P450–2C9 и 3A48 [71] и повышенная вероятность нежелательных лекарственных взаимодействий. В частности, отмечено существенное замедление трансформации лозартана в Е–3174 при его совместном применении с флуконазолом (ингибитор цитохрома P450–2C9) [80]), что может сопровождаться ослаблением фармакологического действия указанного ингибитора АТ1–ангиотензиновых рецепторов [81]. Аналогичные изменения могут наблюдаться при совместном применении лозартана с некоторыми иными медикаментами, в метаболизме которых задействован изофермент цитохрома P450–2C9 (в частности, с фенитоином [82]). Вместе с тем установлено, что такой ингибитор цитохрома P450–2C9, как флувастатин, существенным образом изменяет фармакокинетику лозартана [83]. Эритромицин и грейпфрутовый сок (ингибиторы цитохрома Р450–3A4) также замедляют превращение лозартана в Е–3174, однако их влияние выражено в меньшей степени по сравнению с флуконазолом [84,85]. Напротив, неспецифический индуктор цитохрома Р450 рифампицин значительно ускоряет биотрансформацию и элиминацию лозартана и Е–3174, что c высокой вероятностью приведет к снижению эффекта последнего при совместном применении этих препаратов [84]. Следует подчеркнуть, что для лозартана (Вазотенз и др.) не характерны клинически значимые взаимодействия с кардиотропными лекарственными средствами (т.е. с препаратами, вероятность применения которых одновременно с лозартаном наиболее велика). В частности, установлено, что лозартан не обнаруживает нежелательных фармакокинетических интеракций с гидрохлоротиазидом, варфарином и дигоксином [71,86,87]. Среди прочих блокаторов АТ1–ангиотензиновых рецепторов наибольшим сродством к изоферментам цитохрома P450 обладает ирбесартан [88], однако о наличии у него клинически значимых лекарственных интеракций с ингибиторами и индукторами цитохрома не сообщается9. Установлено также, что ирбесартан не влияет на фармакокинетику варфарина и дигоксина, а также не вступает во взаимодействие с гидрохлоротиазидом, нифедипином, симвастатином и толбутамидом [89,90]. Остальные препараты рассматриваемой группы или вовсе не метаболизируются с участием печеночных систем перекисного окисления (тельмисартан, эпросартан), или же обладают крайне малым сродством к цитохрому P450 (кандесартан, ольмесартан, валсартан) [75,88]. Соответственно, вероятность интеракций этих блокаторов АТ1–ангиотензиновых рецепторов крайне мала. В частности, не выявлено взаимодействия эпросартана с ранитидином [68] и флуконазолом [80], а также валсартана с циметидином [91]. Кроме того, все перечисленные выше препараты не вступают в клинически значимые интеракции с дигоксином, варфарином, антацидными и сахароснижающими препаратами [66,67,80,92,93]. Среди фармакодинамических интеракций блокаторов АТ1–ангиотензиновых рецепторов наибольшее клиническое значение имеет их взаимодействие с мочегонными. Так, тиазидные диуретики увеличивают экскрецию натрия из организма, активируют РААС и тем самым потенцируют действие препаратов, блокирующих рецепторы к ангиотензину II [2]. Вместе с тем блокаторы АТ1–ангиотензиновых рецепторов (как и ингибиторы АПФ) повышают риск нарушения функции почек у пациентов, получающих постоянную диуретическую терапию. Необходимо отметить, что блокаторы АТ1–ангиотензиновых рецепторов (в отличие от ингибиторов АПФ) увеличивают экскрецию калия и могут приводить к выраженной гипокалиемии, особенно при их совместном назначении с петлевыми диуретиками [2]. Напротив, комбинация блокаторов АТ1–ангиотензиновых рецепторов со спиронолактоном (эффективность которой при хронической сердечной недостаточности представляется весьма существенной [94]), часто сопровождается развитием клинически значимой гиперкалиемии [95] и возможна лишь при регулярном контроле уровня калия в плазме крови [46]. Следует также отметить, что по влиянию на выделение мочевой кислоты блокаторы АТ1–ангиотензиновых рецепторов существенно отличаются от ингибиторов АПФ. Так, лозартан является единственным препаратом, который достоверно повышает экскрецию мочевой кислоты у пациентов с гипертонической болезнью [96]. Все остальные блокаторы АТ1–ангиотензиновых рецепторов не обладают урикозурическим действием [76.97,98]. Завершая рассмотрение проблемы лекарственных взаимодействий, следует отметить высокую эффективность совместного применения блокаторов АТ1–ангиотензиновых рецепторов с антагонистами кальция при гипертонической болезни. Блокаторы рецепторов к ангиотензину II и b–адреноблокаторы при совместном применении не ухудшают фармакокинетические показатели друг друга [99,100], однако целесообразность такой комбинации для лечения артериальной гипертонии не представляется очевидной [2]. Что же касается совместного применения блокаторов АТ1–ангиотензиновых рецепторов с ингибиторами АПФ, то несмотря на очевидное сходство в механизмах действия такая комбинация может оказаться полезной при лечении высокорениновых форм артериальной гипертонии, обеспечить дополнительный ренопротективный эффект при хронических заболеваниях почек (в частности, при диабетической нефропатии [101.102]), а также при хронической сердечной недостаточности на фоне систолической дисфунции левого желудочка [2]. Применение блокаторов АТ1–ангиотензиновых рецепторов в особых клинических ситуациях Хроническая почечная недостаточность (ХПН) У блокаторов АТ1–ангиотензиновых рецепторов, имеющих преимущественно печеночный путь элиминации, отсутствует корреляция между клиренсом креатинина и концентрацией препаратов в плазме крови. Соответственно, такие препараты, как валсартан и тельмисартан могут применяться при почечной недостаточности. При среднетяжелой и тяжелой ХПН повышается концентрация эпросартана в плазме крови, однако с учетом преимущественно печеночного пути выведения применение этого препарата при ХПН также считается безопасным [77]. Большую осторожность следует соблюдать при использовании блокаторов АТ1–ангиотензиновых рецепторов, имеющих двойной путь экскреции. Так, при незначительном и умеренном снижении функции почек фармакокинетика кандесартана не изменяется [103], однако при тяжелой почечной недостаточности наблюдается существенное повышение концентрации препарата в плазме крови и удлинение периода его полувыведения [104], что может потребовать уменьшения его дозы. Сходным образом с уменьшением клиренса креатинина повышается содержание в плазме крови ольмесартана [105]. Что же касается лозартана и ирбесартана, то применение этих препаратов в стандартных дозировках является безопасным лишь при незначительной и умеренной почечной недостаточности [70,71,106], в то время как у пациентов с тяжелой ХПН указанные препараты следует применять лишь в низких суточных дозах. Гемодиализ Лозартан и его активный метаболит Е–3174 [71], а также ирбесартан [106], и кандесартан [104] не элиминируются из плазмы крови при гемодиализе. В отличие от указанных препаратов эпросартан обнаруживается в диализате, однако доля элиминируемого таким образом препарата незначительна и нет необходимости в его дополнительном приеме10 [107]. Печеночная недостаточность При нарушениях функции печени следует с особой осторожностью использовать препараты с преимущественно печеночным путем элиминации. Так, установлено, что при применении эпросартана у лиц с заболеваниями печени умеренной тяжести общая концентрация препарата в крови, содержание свободного препарата в крови и степень связывания с белками не изменяются, однако площадь под кривой «концентрация–время» для общего и свободного эпросартана увеличивается соответственно на 40 и 50%, что отражает тенденцию к аккумуляции препарата и может потребовать уменьшения его дозировок [108]. Несколько более безопасными при печеночной недостаточности являются препараты с двойной экскрецией. В частности, при умеренной печеночной недостаточности наблюдается небольшое (на 20%) повышение концентрации препарата кандесартан в плазме крови и незначительное удлинение периода его полувыведения, не требующие коррекции дозы препарата [103,109]. При нарастании печеночной недостаточности компенсаторно увеличивается почечная экскреция ольмесартана, что повышает безопасность использования препарата у пациентов с поражениями печени [105]. Наконец, печеночная недостаточность не изменяет фармакокинетику ирбесартана и лозартана [110], благодаря чему последний может применяться даже при выраженных нарушениях функции печени [71] Пожилой возраст У лиц пожилого и старческого возраста фармакокинетика лозартана и ирбесартана не изменяется [70,71]. В то же время отмечено повышение сывороточных концентрации ольмесартана и удлинение периода его полувыведения у пациентов старших возрастных групп [105]. Кроме того, у больных пожилого и старческого возраста несколько увеличивается период полувыведения кандесартана и примерно на 50% возрастают его максимальная концентрация и площадь под кривой «концентрация–время», что, однако, не сопровождается клинически значимой аккумуляцией препарата [111]. Наконец, установлено, что в старших возрастных группах увеличивается биодоступность эпросартана и, соответственно, повышается его концентрация в плазме крови, что требует осторожности при титровании дозировок этого препарата [112]. Беременность Известно, что блокаторы АТ1–ангиотензиновых рецепторов (как и ингибиторы АПФ) противопоказаны во II и III триместрах беременности в связи с возможностью развития фетотоксического действия (гипоплазия почек, тубулярная нефропатия, олигогидроамниоз, недоразвитие легких, гипоплазия затылочной кости и др.) [113]. При этом тератогенное действие блокаторов АТ1–ангиотензиновых рецепторов до последнего времени считалось не доказанным [114]. Однако учитывая повышенный риск рождения детей с пороками развития у женщин, принимавших в начале беременности ингибиторы АПФ, а также опубликованные в последние годы единичные клинические наблюдения11, тератогенный эффект блокаторов АТ1–ангиотензиновых рецепторов представляется весьма вероятным. Таким образом, применение рассматриваемых препаратов при беременности в целом следует считать противопоказанным. По мнению некоторых авторов, лучше вообще не применять блокаторы АТ1–ангиотензиновых рецепторов у женщин детородного возраста (в особенности не использующих надежные методы контрацепции) [62]. В случае возникновения беременности у женщины, исходно принимавшей блокаторы АТ1–ангиотензиновых рецепторов, рекомендуется немедленно отменить эти препараты, заменив их более безвредными для плода медикаментами, и выполнить ультразвуковое исследование для исключения пороков развития. Сам по себе факт приема блокаторов АТ1–ангиотензиновых рецепторов на ранних сроках беременности не может считаться показанием к ее прерыванию [114]). По– видимому, такой же тактики следует придерживаться и в отношении ингибиторов АПФ. Заключение Ингибиторы АПФ и блокаторы АТ1–ангиотензиновых рецепторов достаточно гетерогенны по своим фармакокинетическим и (в меньшей степени) фармакодинамическим характеристикам. Знание особенностей каждого из препаратов внутри указанных фармакологических групп, безусловно, будет способствовать повышению их эффективности и снижению риска неблагоприятных воздействий на организм больного (особенно при таких распространенных сопутствующих патологических состояниях, как хроническая почечная и печеночная недостаточность). Литература 1. Сидоренко Б.А., Преображенский Д.В. Ингибиторы ангиотензин–превращающего фермента. – М.: ЗАО "Информатик", 1999.; 2. Сидоренко Б.А., Преображенский Д.В. Блокаторы АТ1–ангиотензиновых рецепторов. М.: ЗАО "Информатик", 2001 3. Метелица В.И. Справочник по клинической фармакологии сердечно–сосудистых лекарственных средств / изд. 2–е, перераб. и доп. – М.: Издательство БИНОМ – СПб.: Невский диалект, 2002.– 926 с 4. Белоусов Ю.Б., Моисеев B.C., Лепахин В.К. Клиническая фармакология и фармакотерапия. М,1997;530 с. 5. Opie LH. Angiotensin–converting enzyme inhibitors: scientific basis for clinical use. John Wiley & Sons: New York, 1992 6. Raia JJ Jr, Barone JA, Byerly WG,Angiotensin–converting enzyme inhibitors: a comparative review. DICP. 1990 May;24(5):506–25. 7. Никифоров В.С., Свистов А.С. Современные направления применения ингибиторов ангиотензин–првращающего фермента в клинической практике "ФАРМиндекс–Практик" 2005, вып. 7, стр. 21–31 8. Fischler MP, Follath F. Comparative evaluation of ACE inhibitors: which differences are relevant? Schweiz Med Wochenschr. 1999 Jul 27;129(29–30):1053–60 9. Noble TA Murray KM. Lisinopril: a nonsulfhydryl angiotensin–converting enzyme inhibitor. Clin Pharm. 1988 Sep;7(9):659–69 10. Gomez HJ, Cirillo VJ, Moncloa F. The clinical pharmacology of lisinopril. J Cardiovasc Pharmacol. 1987;9 Suppl 3:S27–34 11. Duchin KL, McKinstry DN, Cohen AI, Migdalof BH. Pharmacokinetics of captopril in healthy subjects and in patients with cardiovascular diseases. Clin Pharmacokinet. 1988 Apr;14(4):241–59 12. Cetnarowski–Cropp AB. Quinapril: a new second–generation ACE inhibitor. DICP. 1991 May;25(5):499–504 13. Vlasses PH, Larijani GE, Conner DP, et al. Enalapril, a nonsulfhydryl angiotensin–converting enzyme inhibitor. Clin Pharm. 1985 Jan–Feb;4(1):27–40 14. Kubo SH, Cody RJ. Clinical pharmacokinetics of the angiotensin converting enzyme inhibitors. A review.Clin Pharmacokinet. 1985 Sep–Oct;10(5):377–91 15. Cawello W, Boekens H, Waitzinger J, Miller U. Moexipril shows a long duration of action related to an extended pharmacokinetic half–life and prolonged ACE inhibition. Int J Clin Pharmacol Ther. 2002 Jan;40(1):9–17 16. Song JC, White CM Clinical pharmacokinetics and selective pharmacodynamics of new angiotensin converting enzyme inhibitors: an update. Clin Pharmacokinet. 2002;41(3):207–24 17. Gomez HJ, Cirillo VJ, Irvin JD. Enalapril: a review of human pharmacology. Drugs. 1985;30 Suppl 1:13–24 18. Piepho RW.Overview of the angiotensin–converting–enzyme inhibitors. Am J Health Syst Pharm. 2000 Oct 1;57 Suppl 1:S3–7 Greenbaum R, Zucchelli P, Caspi A, et al. Comparison of the pharmacokinetics of fosinoprilat with enalaprilat and lisinopril in patients with congestive heart failure and chronic renal insufficiency.Br J Clin Pharmacol. 2000 Jan;49(1):23–31 19. Plosker GL, Sorkin EM Quinapril. A reappraisal of its pharmacology and therapeutic efficacy in cardiovascular disorders. Drugs. 1994 Aug;48(2):227–52 20. Ford NF, Natarajan C, Fulmor IE, et al. Invasive pharmacodynamics of fosinopril in patients with congestive heart failure. J Clin Pharmacol. 1995 Aug;35(8):785–93 21. Louis WJ, Conway EL, Krum H, et al. Comparison of the pharmacokinetics and pharmacodynamics of perindopril, cilazapril and enalapril. Clin Exp Pharmacol Physiol Suppl. 1992;19:55–60 22. Deget F, Brogden RN. Cilazapril. A review of its pharmacodynamic and pharmacokinetic properties, and therapeutic potential in cardiovascular disease. Drugs. 1991 May;41(5):799–820 23. Belz GG, Breithaupt K, Erb K. Review of studies on the clinical pharmacodynamics of cilazapril Drugs. 1991 May;41(5):799–820, J Cardiovasc Pharmacol. 1994;24 Suppl 2:S14–9 24. Todd PA, Fitton A. Perindopril. A review of its pharmacological properties and therapeutic use in cardiovascular disorders. Drugs. 1991 Jul;42(1):90–114 25. Macfadyen RJ, Lees KR, Reid JL. Perindopril. A review of its pharmacokinetics and clinical pharmacology. Drugs. 1990;39 Suppl 1:49–63 26. Louis WJ, Workman BS, Conway EL, et al. Single–dose and steady–state pharmacokinetics and pharmacodynamics of perindopril in hypertensive subjects. J Cardiovasc Pharmacol. 1992 Sep;20(3):505–11 27. Todd PA, Benfield P. Ramipril. A review of its pharmacological properties and therapeutic efficacy in cardiovascular disorders. Drugs. 1990 Jan;39(1):110–35 28. Peters DC, Noble S, Plosker GL. Trandolapril. An update of its pharmacology and therapeutic use in cardiovascular disorders. Drugs. 1998 Nov;56(5):871–93 29. al–Furaih TA, McElnay JC, Elborn JS Sublingual captopril––a pharmacokinetic and pharmacodynamic evaluation. Eur J Clin Pharmacol. 1991;40(4):393–8 30. Shionoiri H. Pharmacokinetic drug interactions with ACE inhibitors. Clin Pharmacokinet. 1993 Jul;25(1):20–58 31. de Mey C, Elich D, Schroeter V, et al.Captopril does not interact with the pharmacodynamics and pharmacokinetics of digitoxin in healthy man. Eur J Clin Pharmacol. 1992;43(4):445–7 32. Teitelbaum M. A significant increase in lithium levels after concomitant ACE inhibitor administration. Psychosomatics. 1993 Sep–Oct;34(5):450–3 33. Juhlin T, Bjorkman S, Hoglund P. Cyclooxygenase inhibition causes marked impairment of renal function in elderly subjects treated with diuretics and ACE–inhibitors.Eur J Heart Fail. 2005 Oct;7(6):1049–56 34. Morgan T, Anderson A. The effect of nonsteroidal anti–inflammatory drugs on blood pressure in patients treated with different antihypertensive drugs. J Clin Hypertens (Greenwich). 2003 Jan–Feb;5(1):53–7 35. Polonia J. Interaction of antihypertensive drugs with anti–inflammatory drugs. Cardiology. 1997;88 Suppl 3:47–51 36. Di Gennaro FP, Cingolani OH, Abbate AF, et al. High doses of aspirin reduce natriuresis in hypertensive patients treated with enalapril. Medicina (B Aires). 2004;64(4):301–5 37. Nawarskas JJ, Townsend RR, Cirigliano MD, Spinler SA Effect of aspirin on blood pressure in hypertensive patients taking enalapril or losartan. Am J Hypertens. 1999 Aug;12(8 Pt 1):784–9 38. Zanchetti A, Hansson L, Leonetti G, et al. Low–dose aspirin does not interfere with the blood pressure–lowering effects of antihypertensive therapy. J Hypertens. 2002 May;20(5):1015–22 39. MacIntrye IM, Jhund PS, McMurray JJ. Aspirin inhibits the acute arterial and venous vasodilator response to captopril in patients with chronic heart failure. Cardiovasc Drugs Ther. 2005 Aug;19(4):261–5 40. Ahmed A. Interaction between aspirin and angiotensin–converting enzyme inhibitors: should they be used together in older adults with heart failure? J Am Geriatr Soc. 2002 Jul;50(7):1293–6 41. Stys T, Lawson WE, Smaldone GC Does aspirin attenuate the beneficial effects of angiotensin–converting enzyme inhibition in heart failure? Arch Intern Med. 2000 May 22;160(10):1409–13 42. Shionoiri H, Naruse M, Minamisawa K, et al. Fosinopril. Clinical pharmacokinetics and clinical potential. Clin Pharmacokinet. 1997 Jun;32(6):460–80 43. Dzau VJ. Renal effects of angiotensin–converting enzyme inhibition in cardiac failure. Am J Kidney Dis. 1987 Jul;10(1 Suppl 1):74–80 44. Motwani JG, Fenwick MK, Morton JJ, Struthers AD. Furosemide–induced natriuresis is augmented by ultra–low–dose captopril but not by standard doses of captopril in chronic heart failure Circulation, Aug 1992; 86: 439 – 445 45. van Vliet AA, Donker AJ, Nauta JJ, Verheugt FW. Spironolactone in congestive heart failure refractory to high–dose loop diuretic and low–dose angiotensin–converting enzyme inhibitor. Am J Cardiol. 1993 Jan 21;71(3):21A–28A 46. Saito M, Takada M, Hirooka K, Isobe F, Yasumura Y. Serum concentration of potassium in chronic heart failure patients administered spironolactone plus furosemide and either enalapril maleate, losartan potassium or candesartan cilexetil. J Clin Pharm Ther. 2005 Dec;30(6):603–10 47. Leblanc JM, Dasta JF, Pruchnicki MC, Schentag JJ Impact of disease States on the pharmacokinetics and pharmacodynamics of Angiotensin–converting enzyme inhibitors. J Clin Pharmacol. 2006 Sep;46(9):968–80 48. Verpooten GA, Genissel PM, Thomas JR, De Broe ME. Single dose pharmacokinetics of perindopril and its metabolites in hypertensive patients with various degrees of renal insufficiency. Br J Clin Pharmacol. 1991 Aug;32(2):187–92 49. Davis R, Coukell A, McTavish D.Fosinopril. A review of its pharmacology and clinical efficacy in the management of heart failure. Drugs. 1997 Jul;54(1):103–16. 50. O'Grady P, Yee KF, Lins R, et al. Fosinopril/hydrochlorothiazide: single dose and steady–state pharmacokinetics and pharmacodynamics. Br J Clin Pharmacol. 1999 Sep;48(3):375–81 51. Greenbaum R, Zucchelli P, Caspi A, et al. Comparison of the pharmacokinetics of fosinoprilat with enalaprilat and lisinopril in patients with congestive heart failure and chronic renal insufficiency. Br J Clin Pharmacol. 2000 Jan;49(1):23–31 52. Hoyer J, Schulte KL, Lenz T. Clinical pharmacokinetics of angiotensin converting enzyme (ACE) inhibitors in renal failure. Clin Pharmacokinet. 1993 Mar;24(3):230–54 53. Tsai HH, Lees KR, Howden CW, Reid JL.The pharmacokinetics and pharmacodynamics of perindopril in patients with hepatic cirrhosis. Br J Clin Pharmacol. 1989 Jul;28(1):53–9 54. Langtry HD, Markham A.Lisinopril. A review of its pharmacology and clinical efficacy in elderly patients. Drugs Aging. 1997 Feb;10(2):131–66 55. Saenz–Campos D, Bayes MC, Masana E, et al. Sex–related pharmacokinetic and pharmacodynamic variations of lisinopril. Methods Find Exp Clin Pharmacol. 1996 Oct;18(8):533–8 56. Massana E, Barbanoj MJ, Moros C, et al. No sex–related pharmacokinetic and pharmacodynamic differences of captopril. Pharmacol Res. 1997 Jul;36(1):41–7 57. Vree TB, Dammers E, Ulc I, et al. Lack of male–female differences in disposition and esterase hydrolysis of ramipril to ramiprilat in healthy volunteers after a single oral dose. ScientificWorldJournal. 2003 Dec 11;3:1332–43 58. Piper JM, Ray WA, Rosa FW. Pregnancy outcome following exposure to angiotensin–converting enzyme inhibitors. Obstet Gynecol. 1992 Sep;80(3 Pt 1):429–32 59. Postmarketing surveillance for angiotensin–converting enzyme inhibitor use during the first trimester of pregnancy––United States, Canada, and Israel, 1987–1995.MMWR Morb Mortal Wkly Rep. 1997 Mar 21;46(11):240–2 60. Burrows RF, Burrows EA.Assessing the teratogenic potential of angiotensin–converting enzyme inhibitors in pregnancy. Aust N Z J Obstet Gynaecol. 1998 Aug;38(3):306–11 61. Cooper WO, Hernandez–Diaz S, Arbogast PG, et al. Major congenital malformations after first–trimester exposure to ACE inhibitors. N Engl J Med. 2006 Jun 8;354(23):2443–51 62. Quan A, Fetopathy associated with exposure to angiotensin converting enzyme inhibitors and angiotensin receptor antagonists. Early Hum Dev. 2006 Jan;82(1):23–8 63. Israili ZH. Clinical pharmacokinetics of angiotensin II (AT1) receptor blockers in hypertension. J Hum Hypertens. 2000 Apr;14 Suppl 1:S73–86 64. Timmermans PB. Pharmacological properties of angiotensin II receptor antagonists. Can J Cardiol. 1999 Nov;15 Suppl F:26F–8F 65. Burnier M, Maillard M. The comparative pharmacology of angiotensin II receptor antagonists. Blood Press Suppl. 2001;1:6–11 66. See S, Stirling AL. Candesartan cilexetil: an angiotensin II–receptor blocker.Am J Health Syst Pharm. 2000 Apr 15;57(8):739–46 67. Laeis P, Puchler K, Kirch W. The pharmacokinetic and metabolic profile of olmesartan medoxomil limits the risk of clinically relevant drug interaction. J Hypertens Suppl. 2001 Jun;19(1):S21–32 68. Tenero D, Martin D, Ilson B, et al. Pharmacokinetics of intravenously and orally administered eprosartan in healthy males: absolute bioavailability and effect of food. Biopharm Drug Dispos. 1998 Sep;19(6):351–6 69. Flesch G, Muller P, Lloyd P. Absolute bioavailability and pharmacokinetics of valsartan, an angiotensin II receptor antagonist, in man.Eur J Clin Pharmacol. 1997;52(2):115–20 70. Brunner HR. The new angiotensin II receptor antagonist, irbesartan: pharmacokinetic and pharmacodynamic considerations. Am J Hypertens. 1997 Dec;10(12 Pt 2):311S–317S 71. Sica DA, Gehr TW, Ghosh S. Clinical pharmacokinetics of losartan. Clin Pharmacokinet. 2005;44(8):797–814 72. Dickstein K, Timmermans P, Segal R. Losartan: a selective angiotensin II type 1 (AT1) receptor antagonist for the treatment of heart failure .Expert Opin Investig Drugs. 1998 Nov;7(11):1897–914 73. Oparil S. Newly emerging pharmacologic differences in angiotensin II receptor blockers.Am J Hypertens. 2000 Jan;13(1 Pt 2):18S–24S 74. Robins GW, Scott LJ.Eprosartan: a review of its use in the management of hypertension. Drugs. 2005;65(16):2355–77 75. Hedner T. The clinical profile of the angiotensin II receptor blocker eprosartan. J Hypertens Suppl. 2002 Jun;20(5):S33–8 76. Muller P, Flesch G, de Gasparo M, et al. Pharmacokinetics and pharmacodynamic effects of the angiotensin II antagonist valsartan at steady state in healthy, normotensive subjects. Eur J Clin Pharmacol. 1997;52(6):441–9 77. Martin DE, Chapelsky MC, Ilson B, et al. Pharmacokinetics and protein binding of eprosartan in healthy volunteers and in patients with varying degrees of renal impairment. J Clin Pharmacol. 1998 Feb;38(2):129–37 78. Yasar U, Forslund–Bergengren C, Tybring G, et al. Pharmacokinetics of losartan and its metabolite E–3174 in relation to the CYP2C9 genotype. Clin Pharmacol Ther. 2002 Jan;71(1):89–98, 79. Lee CR, Pieper JA, Hinderliter AL, et al. Losartan and E3174 pharmacokinetics in cytochrome P450 2C9*1/*1, *1/*2, and *1/*3 individuals. Pharmacotherapy. 2003 Jun;23(6):720–5 80. Kazierad DJ, Martin DE, Blum RA, et al. Effect of fluconazole on the pharmacokinetics of eprosartan and losartan in healthy male volunteers. Clin Pharmacol Ther. 1997 Oct;62(4):417–25 81. Kaukonen KM, Olkkola KT, Neuvonen PJ. Fluconazole but not itraconazole decreases the metabolism of losartan to E–3174. Eur J Clin Pharmacol. 1998 Feb;53(6):445–9 82. Fischer TL, Pieper JA, Graff DW, et al. Evaluation of potential losartan–phenytoin drug interactions in healthy volunteers. Clin Pharmacol Ther. 2002 Sep;72(3):238–46 83. Meadowcroft AM, Williamson KM, Patterson JH, et al. The effects of fluvastatin, a CYP2C9 inhibitor, on losartan pharmacokinetics in healthy volunteers. J Clin Pharmacol. 1999 Apr;39(4):418–24 84. Williamson KM, Patterson JH, McQueen RH, et al. Effects of erythromycin or rifampin on losartan pharmacokinetics in healthy volunteers. Clin Pharmacol Ther. 1998 Mar;63(3):316–23 85. Zaidenstein R, Soback S, Gips M, et al. Effect of grapefruit juice on the pharmacokinetics of losartan and its active metabolite E3174 in healthy volunteers.Ther Drug Monit. 2001 Aug;23(4):369–73 86. De Smet M, Schoors DF, De Meyer G, et al. Effect of multiple doses of losartan on the pharmacokinetics of single doses of digoxin in healthy volunteers. Br J Clin Pharmacol. 1995 Dec;40(6):571–5 87. Kong AN, Tomasko L, Waldman SA Losartan does not affect the pharmacokinetics and pharmacodynamics of warfarin.J Clin Pharmacol. 1995 Oct;35(10):1008–15 88. Unger T, Kaschina E. Drug interactions with angiotensin receptor blockers: a comparison with other antihypertensives. Drug Saf. 2003;26(10):707–20 89. Marino MR, Vachharajani NN. Drug interactions with irbesartan. Clin Pharmacokinet. 2001;40(8):605–14 90. Mangold B, Gielsdorf W, Marino MR. Irbesartan does not affect the steady–state pharmacodynamics and pharmacokinetics of warfarin. Eur J Clin Pharmacol. 1999 Oct;55(8):593–8 91. Schmidt EK, Antonin KH, Flesch G, Racine–Poon A.An interaction study with cimetidine and the new angiotensin II antagonist valsartan.Eur J Clin Pharmacol. 1998 Feb;53(6):451–8 92. Martin DE, Tompson D, Boike SC, et al. Lack of effect of eprosartan on the single dose pharmacokinetics of orally administered digoxin in healthy male volunteers. Br J Clin Pharmacol. 1997 Jun;43(6):661–4 93. Martin DE, DeCherney GS, Ilson BE, et al. Eprosartan, an angiotensin II receptor antagonist, does not affect the pharmacodynamics of glyburide in patients with type II diabetes mellitus.J Clin Pharmacol. 1997 Feb;37(2):155–9 94. Pitt B, Zannad F, Remme WJ, et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. Randomized Aldactone Evaluation Study Investigators. N Engl J Med. 1999 Sep 2;341(10):709–17 95. Juurlink DN, Mamdani MM, Lee DS, et al. Rates of hyperkalemia after publication of the Randomized Aldactone Evaluation Study. N Engl J Med. 2004 Aug 5;351(6):543–51 96. Puig JG, Mateos F, Buno A, et al.Effect of eprosartan and losartan on uric acid metabolism in patients with essential hypertension. J Hypertens. 1999 Jul;17(7):1033–9 97. Ilson BE, Martin DE, Boike SC, et al. The effects of eprosartan, an angiotensin II AT1 receptor antagonist, on uric acid excretion in patients with mild to moderate essential hypertension. J Clin Pharmacol. 1998 May;38(5):437–41 98. Wurzner G, Gerster JC, Chiolero A, et al. Comparative effects of losartan and irbesartan on serum uric acid in hypertensive patients with hyperuricaemia and gout. J Hypertens. 2001 Oct;19(10):1855–60; 99. Czendlik CH, Sioufi A, Preiswerk G Pharmacokinetic and pharmacodynamic interaction of single doses of valsartan and atenolol. Eur J Clin Pharmacol. 1997;52(6):451–9 100. Andrawis NS, Battle MM, Klamerus KJ, et al. A pharmacokinetic and pharmacodynamic study of the potential drug interaction between tasosartan and atenolol in patients with stage 1 and 2 essential hypertension .J Clin Pharmacol. 2000 Mar;40(3):231–41 101. Rossing K, Jacobsen P, Pietraszek L, Parving HH. Renoprotective effects of adding angiotensin II receptor blocker to maximal recommended doses of ACE inhibitor in diabetic nephropathy: a randomized double–blind crossover trial. Diabetes Care. 2003 Aug;26(8):2268–74 102. Fujisawa T, Ikegami H, Ono M, Combination of half doses of angiotensin type 1 receptor antagonist and angiotensin–converting enzyme inhibitor in diabetic nephropathy. Am J Hypertens. 2005 Jan;18(1):13–7 103. Stoukides CA, McVoy HJ, Kaul AF. Candesartan cilexetil: an angiotensin II receptor blocker.Ann Pharmacother. 1999 Dec;33(12):1287–98 104. de Zeeuw D, Remuzzi G, Kirch W. Pharmacokinetics of candesartan cilexetil in patients with renal or hepatic impairment. J Hum Hypertens. 1997 Sep;11 Suppl 2:S37–42 105. von Bergmann K, Laeis P, Puchler K, et al. Olmesartan medoxomil: influence of age, renal and hepatic function on the pharmacokinetics of olmesartan medoxomil. J Hypertens Suppl. 2001 Jun;19(1):S33–40 106. Sica DA, Marino MR, Hammett JL, et al. The pharmacokinetics of irbesartan in renal failure and maintenance hemodialysis. Clin Pharmacol Ther. 1997 Dec;62(6):610–8 107. Kovacs SJ, Tenero DM, Martin DE, et al. Pharmacokinetics and protein binding of eprosartan in hemodialysis–dependent patients with end–stage renal disease. Pharmacotherapy. 1999 May;19(5):612–9 108. Tenero D, Martin D, Chapelsky M, et al. Effect of hepatic disease on the pharmacokinetics and plasma protein binding of eprosartan. Pharmacotherapy. 1998 Jan–Feb;18(1):42–50 109. Hoogkamer JF, Kleinbloesem CH, Ouwerkerk M, et al. Pharmacokinetics and safety of candesartan cilexetil in subjects with normal and impaired liver function. Eur J Clin Pharmacol. 1998 Jun;54(4):341–5 110. Marino MR, Langenbacher KM, Raymond RH, et al. Pharmacokinetics and pharmacodynamics of irbesartan in patients with hepatic cirrhosis. J Clin Pharmacol. 1998 Apr;38(4):347–56 111. Hubner R, Hogemann AM, Sunzel M, Riddell JG. Pharmacokinetics of candesartan after single and repeated doses of candesartan cilexetil in young and elderly healthy volunteers. J Hum Hypertens. 1997 Sep;11 Suppl 2:S19–25 112. Tenero DM, Martin DE, Miller AK, et al. Effect of age and gender on the pharmacokinetics of eprosartan. Br J Clin Pharmacol. 1998 Sep;46(3):267–70 113. Alwan S, Polifka JE, Friedman JM. Angiotensin II receptor antagonist treatment during pregnancy. Birth Defects Res A Clin Mol Teratol. 2005 Feb;73(2):123–30 114. Schaefer C. Angiotensin II–receptor–antagonists: further evidence of fetotoxicity but not teratogenicity. Birth Defects Res A Clin Mol Teratol. 2003 Aug;67(8):591–4 115. Boix E, Zapater P, Pico A, Moreno O. Teratogenicity with angiotensin II receptor antagonists in pregnancy. J Endocrinol Invest. 2005 Dec;28(11):1029–31 Поделитесь статьей в социальных сетях Порекомендуйте статью вашим коллегам www.rmj.ru Медицинский блог врача скорой помощиВ организме человека существуют нейрогуморальные системы, продуцирующие гормоны, одни из которых вызывают сужение сосудов (так называемая прессорная система), другие, наоборот, расширение (депрессорная система). Одной из важнейших прессорных систем является ренин-ангиотензин-альдостероновая (РААС). Ее функция заключается в регуляции баланса жидкости, электролитов, артериального давления и объема крови. Ангиотензин II образуется из ангиотензина I под воздействием АПФ (ангиотензин-превращающего фермента). Более 30 лет известна тесная взаимосвязь между активностью ренин-ангиотензин-альдостероновой системы и частотой развития сердечно-сосудистых осложнений. В течение многих лет ученые вели поиск препаратов, которые ослабляли бы эффект ангиотензина II, тем самым снижая уровень артериального давления. Первым шагом на пути целенаправленного синтеза таких препаратов было получение пептидов, угнетающих АПФ и тем самым снижающих уровень ангиотензина II. Эти пептиды были получены из яда бразильской рябой змеи (Bothrops jararaca), вызывающего у человека коллапс. В 1977 году ученые исследовательской группы компании «Бристол-Майерс Сквибб» Д. Кашман и М. Ондетти создали первый активный ингибитор АПФ — каптоприл. Большой клинический эффект каптоприла пробудил интерес ученых к синтезу новых аналогичных препаратов. В настоящее время известно уже более 100 таких лекарств. Всю эту группу объединяет общий механизм действия, а отдельные препараты отличаются по структуре, длительности действия, путям выведения из организма. Родоначальник этой группы каптоприл (капотен, тензиомин, ангиоприл) эффективен в лечении больных, у которых гипертоническая болезнь сочетается с ишемической болезнью сердца. (Если больные ИБС утратили чувствительность к нитратам (нитронг, изокет, сустак), то применение капотена повышает толерантность (чувствительность) к этим препаратам). Каптоприл быстро всасывается после приема внутрь, однако его следует принимать за час до еды, т.к. прием пищи снижает всасывание препарата. Каптоприл применяют по 25 мг 2—3 раза в сутки. Увеличение дозы выше 100 мг в сутки нецелесообразно ввиду большей вероятности получения побочных эффектов. В такой ситуации лучше сочетать ингибиторы АПФ с диуретиками. Исследования показали, что капотен можно назначать больным с артериальной гипертензией в сочетании с сахарным диабетом, ишемической болезнью сердца, сердечной недостаточностью, легочной патологией. Важно подчеркнуть, что препарат помогает пожилым пациентам с высоким уровнем артериального давления, не ухудшая качества их жизни. Больным, которым впервые прописали капотен, следует после приема первой таблетки измерить артериальное давление через 30 мин., затем через 2 часа. Это необходимо сделать, чтобы изучить чувствительность к препарату и избежать резкого падения артериального давления. Особенно это касается пожилых людей. Следует помнить, что чувствительность к капотену у пациентов может быть различной. Особенностью препарата является постепенное снижение давления, стабилизация которого достигается обычно к первому месяцу регулярного приема. Однако если рассосать капотен, то артериальное давление снижается через 10—15 минут, что используется для купирования гипертонического криза. Выводится капотен почками, поэтому пациентам с заболеваниями мочевыводящей системы, особенно при повышении уровня мочевины и креатинина крови, надо обязательно посоветоваться с врачом, прежде чем начинать лечение капотеном. Следующую группу ингибиторов АПФ представляют так называемые пролекарственные препараты. Для образования фармакологически активного вещества эти препараты должны подвергнуться метаболическому превращению в печени. В отличие от капотена они обладают более длительным действием. Эналаприл, рамиприл, ренитек, периндоприл, трандолаприл, беназеприл вы можете встретить в аптеках республики под различными названиями: энап, энам, ренитек, тритаце, берлиприл, гоптен, престариум, эднит и т.д. Все эти лекарства действуют от 12 до 24 часов, поэтому их надо принимать 1 или 2 раза в день с интервалом в 12 часов. Так как пролонгированные ингибиторы АПФ имеют различную дозировку, то не следует самостоятельно менять препараты. Надо обязательно посоветоваться с врачом и проконтролировать профиль артериального давления при переходе с одного препарата на другой. Фозиноприл (моноприл) — препарат, который имеет два пути выведения из организма: печень и почки. Препарат действует почти сутки и хорошо контролирует утренние подъемы артериального давления. Последнее исследование, проведенное в США, показало, что фозиноприл хорошо снижает уровень артериального давления, улучшает функцию почек, уменьшает гипертрофию миокарда у больных артериальной гипертензией в сочетании с сахарным диабетом. Ингибиторы АПФ хорошо переносятся, однако следует помнить, что при их приеме могут появиться побочные эффекты: сухой кашель, потеря вкусовых ощущений, головная боль, боли в суставах, кожная сыпь, тошнота. При длительном приеме препаратов этой группы возможно снижение уровня лейкоцитов крови, а также появление белка в моче. Поэтому не реже 1 раза в 3 месяца следует контролировать состав крови и мочи. В первые недели приема препаратов возможно повышение уровня трансаминаз (печеночных ферментов) крови. Ингибиторы АПФ противопоказаны при артериальном давлении ниже 90/60 мм рт. ст., беременности, кормлении грудью, состояниях после трансплантации почек, двустороннем стенозе почечных артерий. Очень осторожно следует принимать ингибиторы АПФ после длительного приема мочегонных, а также при других ситуациях, которые связаны с обезвоживанием организма (например, обильное потоотделение, рвота, понос), так как возможно резкое снижение артериального давления. Если предстоит операция с применением общего наркоза, вы также должны предупредить врача, что применяете АПФ. При недостаточном эффекте ингибиторов АПФ их чаще всего комбинируют с диуретиками. Первым таким комбинированным препаратом был капозид, который содержит 50 мг каптоприла и 25 мг гидрохлортиазида. При такой комбинации усиливается гипотензивный эффект препарата, длительность его действия, что позволяет использовать капозид один раз в день. Известно, что при длительной терапии мочегонными их активность снижается, а присоединение капотена усиливает и продлевает действие мочегонных. Вы также уже знаете, что мочегонные могут снизить уровень калия в плазме крови, что проявляется судорогами, мышечной слабостью, усталостью. Капотен (каптоприл), воздействуя на ренин-ангиотензин-альдостероновую систему, поддерживает уровень калия в нормальных пределах. Поэтому при приеме капозида калиевые препараты принимать не надо. Принимают капозид по 1 таблетке раз в день. В заключение хочу еще раз напомнить, что, принимая медикаменты, вы не должны забывать о немедикаментозных методах борьбы с артериальным давлением, что злоупотребление поваренной солью ослабляет эффект ингибиторов АПФ. Поэтому, если вы не ограничите поваренную соль в своей диете, то и эффект от этих препаратов, даже самых новых и дорогих, достигнут не будет. Татьяна Нечесова, заведующая отделом клинической кардиологии БелНИИ кардиологии, кандидат медицинских наук.Опубликовано в журнале «Здоровье и успех», № 5 за 1998 год. Читайте также: как правильно измерять артериальное давление. Материал был полезен? Поделитесь ссылкой: www.happydoctor.ru |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
г.Самара, ул. Димитрова 131 [email protected] |
 |

 Ингибиторами АПФ (данная аббревиатура расшифровывается, как ангиотензинпревращающий фермент) называется группа медпрепаратов, которые способны блокировать образование ангиотензина – гормона, накапливающегося в плазме крови.
Ингибиторами АПФ (данная аббревиатура расшифровывается, как ангиотензинпревращающий фермент) называется группа медпрепаратов, которые способны блокировать образование ангиотензина – гормона, накапливающегося в плазме крови.