|
|
||||||||||
|
Методы определения концентрации антибиотиков в биологических жидкостях и тканях. Зона задержки роста антибиотиковОтсутствие зоны задержки роста микроба вокруг диска - Методы определения чувствительности микробов к антибиотикам - Рациональная антибиотикотерапияОтсутствие зоны задержки роста микроба вокруг диска свидетельствует о том, что испытуемый штамм нечувствителен к данному антибиотику; при зоне диаметром до 10 мм штамм расценивается как малочувствительный. Единичные колонии или тонкая пленка роста внутри зоны задержки роста не учитываются. Размер зон может меняться в зависимости от толщины слоя агара, густоты микробного газона, состава среды. Однако в стандартных условиях опыта по величине зон, образуемых антибиотиком, можно судить о степени чувствительности исследуемого микроба. В практических лабораториях пользуются дисками, выпускаемыми промышленностью. В настоящее время отечественной промышленностью выпускаются диски практически со всеми антибиотиками (смотрите таблицу ниже). Перечень дисков, выпускаемых отечественной промышленностью
* Регистрационные номера пока не установлены. Сроки и температура хранения дисков указаны на этикетке упаковки. Диски, пропитанные малостабильными антибиотиками, такими, как бензилпенициллин, ампициллин, карбенициллин, метициллин, оксациллин, необходимо хранить при температуре 4° С или 14° С. После вскрытия флакон с дисками можно хранить не более недели при 4° С. Перед употреблением флакон с дисками в течение 1 ч оставляют при комнатной температуре для предотвращения образования конденсата на внутренних стенках флакона. Диски с просроченным сроком годности и из флакона, где содержащийся в них силикагель окрашен в розовый цвет, использовать нельзя. Вместо дисков при определении чувствительности микробов методом диффузии в агар могут быть использованы цилиндрики (фарфоровые или металлические или лунки в агаре, в которые закапывают растворы антибиотиков в необходимых концентрациях. «Рациональная антибиотикотерапия»,С.М.Навашин, И.П.Фомина Смотрите также на тему:www.medvyvod.ru Метод диффузии в агар - Общая характеристика антибиотиков - Справочник по антибиотикам - Библиотека доктора - Медкурсор13 января 2012 Метод диффузии в агар (метод дисков). При определении чувствительности микробов методом диффузии в агар на поверхность агара, засеянного испытуемыми микробами, помещают диски, пропитанные антибиотиками. Диски вырабатываются из специального картона — ГОСТ 6722-65, диаметром 6 мм. Содержание антибиотика в диске, указанное на этикетке, соответствует рекомендациям ВОЗ. В стерильные чашки Петри, расположенные на горизонтальной поверхности, разливают по 15 мл плотной питательной среды (перевар Хоттингера с содержанием 110—130 мг% аминного азота). Чашки подсушивают в течение 30 мин при 37° с полуоткрытой крышкой. На поверхность застывшего агара наливают 1 мл 2-миллиардной суспензии испытуемой суточной культуры. Бактериальную взвесь распределяют на поверхности чашки равномерно, а ее избыток удаляют путем отсасывания пастеровской пипеткой. На поверхность засеянного агара пинцетом раскладывают диски с антибиотиками. Каждая чашка может служить для испытания действия 5—6 антибиотиков. Диски раскладывают на расстоянии 2,5 см от центра чашки. Необходимо плотное прилегание диска к поверхности агара. Затем чашки инкубируют в термостате при 37° в течение 16—18 ч. Результаты учитывают путем изменения зон задержки роста микробов вокруг дисков (включая диаметр самого диска). Отсутствие зоны задержки роста микроба вокруг диска свидетельствует о том, что испытуемый штамм не чувствителен к данному антибиотику, при зоне диаметром до 10 мм штамм расценивается как мало чувствительный. Единичные колонии или тонкая пленка роста внутри зоны задержки роста не учитываются. Размер зон может меняться в зависимости от толщины слоя агара, густоты микробного газона, состава среды. Однако в стандартных условиях опыта по величине зон, образуемых антибиотиком, можно судить о степени чувствительности исследуемого микроба. При определении чувствительности возбудителей к тетрациклинам (тетрациклин, хлортетрациклин, окситетрациклин) в связи с полной перекрестной устойчивостью микробов к этим антибиотикам можно применять диски лишь с одним препаратом этой группы. В ответе при этом указывают чувствительность (устойчивость) выделенной культуры к тетрациклинам. Зависимость величины зон от степени чувствительности микроорганизмов
«Справочник по антибиотикам», С.М.Навашин, И.П.Фомина Читайте далее:К числу особых показаний относится применение цефалоридина при лечении бактериальных инфекций у больных с аллергией к пенициллинам. Методы применения цефалоридина Препарат применяют в основном внутримышечно. При тяжелом течении инфекций при необходимости быстрого создания высоких концентраций антибиотика в крови цефалоридин вводят внутривенно (микроструйно или капельным путем). В зависимости от вида возбудителя и тяжести течения болезни суточная… Синонимы: Keflin. Физико-химические свойства 7-(Тиофен-2-ацетамидо) цефалоспорановая кислота (натриевая соль). Суммарная формула C16h26N2О6S2Na. Молекулярный вес 396,4. Белый кристаллический порошок, хорошо растворимый в воде, стабилен в сухом состоянии. В растворе при 37° через 12 ч теряет 11— 23% активности, через 24 ч — около 40%, через 48 ч — 55%. В присутствии человеческой сыворотки при комнатной температуре… По особенностям фармакокинетики цефалотин близок цефалоридину, отличаясь от него высотой создаваемых в крови уровней и большей скоростью выведения из организма. Цефалотин плохо всасывается при приеме внутрь, а основным методом его применения является парентеральное введение (внутримышечное или внутривенное). Максимальный уровень в крови после внутримышечного введения в дозе 500 мг — 1 г обнаруживается через 30 мин… Основным методом применения цефалотина является внутримышечное введение. При инфекциях, обусловленных грамположительными возбудителями, суточная доза антибиотика составляет 2—3 г (разовая доза 500 мг при интервале между введениями 4—6 ч). При заболеваниях, вызываемых грамотрицательными микроорганизмами (вследствие их более низкой чувствительности к антибиотику), антибиотик назначают в суточной дозе 4—6 г, при тяжелом течении инфекций — 12 г и… К этой группе относится ряд природных антибиотиков и многочисленных полусинтетических препаратов, полученных на основе 7-аминоцефалоспоран6вой кислоты (7:АЦК), среди которых наибольшее практическое применение нашли цефалотин, цефалоридин, цефалексин и цефалоглицин. 7-Аминоцефалоспорановая кислота Основными особенностями антибиотиков этой группы являются: широкий спектр антибактериального действия, устойчивость к действию стафилококковой пеницилазы и высокая активность в отношении устойчивых к бензилпенициллину пеницилазообразующих стафилококков;… www.medkursor.ru Регистрация чувствительности к антибиотикам выделенной культуры стафилококка
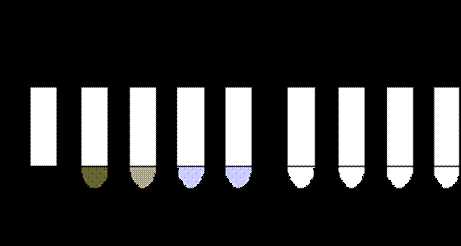
Вывод:_____________________________________________________________________________________________________________________________________________________________________________________________________________________________ 2.а) Метод дисков. Бумажные диски, пропитанные определенными антибиотиками, помещают на газон исследуемой бактериальной культуры в чашке Петри, Посевы инкубируют в течение 16-24 часов, после чего учитывают результаты опыта по образованию зон задержки роста бактерий. По диаметру зон задержки роста ориентировочно судят о степени чувствительности бактерий к антибиотикам (рис. 2). Зона задержки роста до 15 мм указывает на слабую, до 25 мм - на среднюю и свыше 25 мм - на высокую чувствительность. Более точные результаты получают при использовании метода серийных разведений. б)Метод серийных разведений.Этот метод позволяет определить минимальную задерживающую концентрацию антибиотика для данного микроорганизма (МЗК) как на жидких, так и на плотных питательных средах. МПБ разливают по 2 мл в серию пробирок. Готовят основной раствор антибиотика, для чего берут навеску антибиотика и растворяют в дистиллированной воде из расчета 1 мг антибиотика на мл растворителя.
Левомицетин предварительно растворяют в 96° этиловом спирте из расчета 0,25 мл спирта на 1 мг антибиотика; после полного растворения добавляют такое количество дистиллированной воды, чтобы раствор содержал в 1 мл 1 мг антибиотика. Тетрациклин и окситетрациклин растворяют в сантинормальном растворе соляной кислоты из расчета 1 мл на 1 мг антибиотика. Эритромицин сначала растворяют в чистом метиловом спирте из расчета 1 мл на 10 мг эритромицина. После растворения добавляют такое количество дистиллированной воды, чтобы получить раствор, содержащий в 1 мл 1 мг антибиотика. Исходный раствор антибиотика в количестве 2 мл вносят в первую пробирку с МПБ, перемешивают и получают определенную его концентрацию. Из первой пробирки 2 мл разведенного антибиотика переносят во вторую пробирку и после перемешивания переносят 2 мл в третью пробирку и т.д. до предпоследней, откуда 2 мл выливают. Последняя пробирка является контролем, в ней нет антибиотика и она свидетельствует о пригодности среды для роста культуры. После разведения антибиотика во все пробирки вносят по 0,1 мл испытуемой бульонной культуры. Для этого используют 3-4-часовые или 18-часовые культуры, разведенные МПБ в 50 раз. Пробирки помещают в термостат на 12-18 часов, но предварительные результаты можно учитывать через 6-8 часов. По истечении необходимого срока инкубации определяют максимальное разведение антибиотика, которое еще подавляет рост культуры. Концентрация антибиотика в последней пробирке с видимой задержкой роста и представляет собой минимальную задерживающую концентрацию антибиотика (МЗК) или минимальной подавляющей концентрацией (МПК). Штамм считается чувствительным к антибиотикам, если МЗК препарата для данного штамма соответствует концентрации этого препарата, создаваемой в организме. Измеряется МПК в мг/л или мкг/мл (рис. 1). Минимальная подавляющая концентрация (МПК) - наименьшая концентрация антибиотика (мг/л или мкг/мл), которая in vitro полностью подавляет видимый рост бактерий
Рис. 1. Определение значения МПК методом разведения в жидкой питательной среде. в) Определение чувствительности микроорганизма с помощью Е-теста проводится аналогично тестированию диско-диффузионным методом. Отличие состоит в том, что вместо диска с антибиотиком используют полоску Е-теста, содержащую градиент концентраций антибиотика от максимальной к минимальной (рис. 3). В месте пересечения эллипсовидной зоны подавления роста с полоской Е-теста получают значение минимальной подавляющей концентрации (МПК). Несомненным достоинством диффузионных методов является простота тестирования и доступность выполнения в любой бактериологической лаборатории. Однако с учетом высокой стоимости Е-тестов для рутинной работы обычно используют диско-диффузионный метод.
Контрольные вопросы В чем сущность определения чувствительности бактерий к антибиотикам? Какие методы используются для определения чувствительности микроорганизмов к антибиотикам? В чем заключается метод дисков? Как учитывается чувствительность к антибиотикам методом дисков? Что позволяет определить метод серийных разведений? Что означает минимальная подавляющая концентрация? В чем заключаются преимущества и недостатки Е-теста? Какие существуют особенности механизма действия антибиотиков? Какие типы лекарственной устойчивости вы знаете? Что такое антибиотикорезистентность и механизмы ее формирования? Приложение к ЗАНЯТИЮ 13.
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте: zdamsam.ru Допустимые пределы диаметров зон задержки ростаЭталонных штаммов при контроле воспроизводимостиИ точности результатов диско-диффузионного метода(Среда агв)
В заключении к проведенному исследованию должно быть записано, к какой группе микроорганизмов – устойчивые, умеренно устойчивые или чувствительные – относится исследуемая культура, а не размер зоны задержки роста. 3. Ознакомиться с методом серийных разведений определения чувствительность микроорганизмов к антибиотикам (зарисовать). Определить МИК культуры E. coli по таблице 11. Оформить протокол Этот метод является количественным, так как позволяет определить минимальную ингибирующую концентрацию, т.е. наименьшую концентрацию антибиотика, ингибирующую рост исследуемой культуры. Исследование начинают с приготовления основного раствора, из которого готовят все последующие разведения в бульоне (в объеме 1 мл), после чего к каждому разведению добавляют 0,1 мл исследуемой бактериальной суспензии, содержащей 106–107 бактериальных клеток в 1 мл. Для контроля используют посев культуры на бульон без антибиотика. Посевы инкубируют при 37°С 18–20 часов. В контроле появится рост (пробирка станет мутной). Пробирки с прозрачной питательной средой указывают на задержку роста испытуемой культуры, а последняя пробирка с прозрачной питательной средой содержит наименьшую ингибирующую дозу антибиотика, определяющую степень чувствительности испытуемой культуры к антибиотику. Таблица 11 Определение степени чувствительности кишечной палочки к стрептомицину
Примечание: «-» – отсутствие роста; «+» – рост культуры. 4. Изучение препаратов из живых бактерий, применяемых для бактериотерапии и бактериопрофилактики (записать в тетрадь) а) Колибактерин. Действующим началом колибактерина являются живые бактерии антагонистически активного в отношении шигелл Флекснера и Зонне штамма кишечной палочки М-17. Готовят колибактерин из культуры, выращенной в казеиновом бульоне, высушивают путем лиофилизации. Сухой препарат имеет вид крупно- или мелкопористой массы желтоватого цвета. Одна доза содержит не менее 6 млрд. живых микробов. Колибактерин применяют при хронических колитах, дисбактериозе кишечника различной этиологии, долечивании реконвалесцентов после дизентерии и других кишечных заболеваний. б) Бифидумбактерин. Представляет собой высушенную взвесь Bacillus bifidum (штамм № 1). Имеет вид пористой массы беловато-коричневого цвета, при растворении образует непрозрачную гомогенную взвесь. В 1 дозе препарата не менее 10 живых бифидобактерий. Бифидумбактерин применяют при лечении, как детей, так и взрослых. Особенно он показан для лечения детей первого года жизни. Бифидумбактерин применяют: 1) для лечения при затяжных формах дизентерии, хронических колитах, длительных кишечных нарушениях невыясненной этиологии у детей раннего возраста; 2) для лечения при дисбактериозах кишечника, возникших в результате применения антибактериальной терапии и воздействия других факторов; 3) с целью санации реконвалесцентов после перенесенной дизентерии. в) Лактобактерин. Представляет собой лиофилизированную взвесь живых антагонистически активных штаммов лактобактерий. Одна доза представляет собой сухую пористую массу, содержащую не менее 1 млрд. живых микробов. Лактобактерин применяют для лечения взрослых и детей при следующих состояниях, сопровождающихся дисбактериозом и дефицитом в микрофлоре кишечника лактобактерий: 1) при хронических колитах различной этиологии, в том числе постдизентерийных; 2) при дисбактериозах, возникающих в результате применения антибиотиков, сульфаниламидов и по другим причинам; 3) при неспецифическом язвенном колите; 4) с целью санации реконвалесцентов после дизентерии. г) Бификол. Комплексный препарат, состоящий из высушенной взвеси живых антагонистически активных бифидобактерий штамма № 1 и кишечных палочек штамма М-17. Препарат имеет вид пористой массы светло-коричневого цвета. Одна доза содержит не менее 107 живых бифидобактерий и не менее 106 живых кишечных палочек. Показаниями для применения комплексного препарата бификол являются: хронические колиты различной этиологии, дисбактериоз кишечника, обусловленный нарушением анаэробной и аэробной микрофлоры, долечивание реконвалесцентов после перенесенных кишечных инфекций. 5. Подведение итогов занятия – 5 минут ЗАНЯТИЕ 15 ТЕМА. Учение об инфекции. Понятие о патогенности и вирулентности. Измерение силы вирулентности. Факторы вирулентности. Формы инфекции. Экспериментальная инфекция как метод выделения чистых культур Цель занятия. Усвоить понятия «инфекция», «инфекционный процесс», формы инфекции, патогенность, вирулентность и роль их механизмов в патогенезе инфекционных заболеваний Методические указания к практической работе Продолжительность занятия: 3 академических часа (135 минут) Место проведения занятия: учебная аудитория Материально-техническое оснащение – таблицы, стенды, микроскопы, микропрепараты, вакцины Хронометраж практического занятия: 1. Вводное слово преподавателя – 5 мин 2. Проверка исходного уровня знаний (тест-контроль) – 15 мин 3. Разбор теоретических вопросов по теме – 80 мин
4. Выполнение практической работы – 35 мин Практическая работа studfiles.net Основные наборы дисков, которые рекомендуются для определения чувствительности в зависимости от вида выделенной культуры и патологического материала
Предельные значения диаметров зон задержки роста и значения мпк антибиотиков для интерпретации результатов
При определении стойкости к антибиотикам, близким по химическому строению и спектром антибактериального действия, возможно использование диска, пропитанного одним из антибиотиков определенной группы. Так, с помощью диска из бензилпенициллином можно определять чувствительность к бицилину,феноксиметилпенициллину; цефалексиновым – к цефазолину, цефаклору, цефалотину. Однако, не рекомендуется использовать тетрациклиновые диски для определения чувствительности к доксициклину. Сроки и температура хранения дисков указаны на этикетке упаковок. Диски с малостабильными антибиотиками (бензилпенициллином, ампициллином,карбеницилином, метицилином, оксацилином) следует хранить при 4 °С или 14 °С. После того, как флакон с дисками открыто, его хранят в течение недели при 4 °С. Перед применением его в течение 1 год оставляют при комнатной температуре для предупреждения образования конденсата на внутренних стенках флакона. Диски с просроченным сроком хранения, где силикагель имеет розовый цвет, использовать нельзя.
VIDEO
Метод серийных разведений. Показаниями для определения антибиотикочутливости за методом серийных разведений является необходимость получения количественных данных (преимущественно при тяжелом ходу инфекционных процессов) для проведения регулируемой антибиотикотерапии. Установление степени чувствительности микробов к антибактериальным препаратам влияет на выбор антибиотика (например, отказ от лекарств с высокой токсичностью при умеренной степени чувствительности возбудителя к ним), его дозирования (концентрация антибиотика в крови должна в 2-3 разы превышать его минимальную подавляющую концентрацию по отношению к возбудителю) и режим введения. Кроме того, ее количественное определение необходимо также для установления бактерицидного действия избранного препарата (как гарантии быстрого терапевтического эффекта и безрецидивного ходу) по отношению к данному возбудителю. Существуют две модификации метода серийных разведений – определения чувствительности на жидком и густом питательных средах. Метод дает возможность определить МПК препарата для выделенного штамма возбудителя. Для определения антибиотикочутливости по методу серийных разведений в жидкой питательной среде готовят ряд (8-10 и больше) пробирок с двукратными последовательными разведениями препарата.
Определение чувствительности по методу серийных разведений
Среду предварительно разливают в пробирки по 2 мл. В первую добавляют 2 мл раствора антибиотика определенной концентрации, перемешивают и переносят к следующей пробирке, продолжая разведение к предпоследней, из которой удаляют 2 мл смеси. Последняя пробирка служит контролем роста культуры. В том жебульйони, который используют для разведения антибиотиков, готовят суспензию суточной агаровой или бульйоннои культуры бактерий из расчета 105-106 микробных тел в 1 мл в зависимости от вида возбудителя. Потом к каждой пробирке с разведениями, а также к контрольной добавляют по 0,2 мл изготовленной суспензии. При определении чувствительности к пеницилинив пеницилиназоутворюючих стафилококков рекомендуют использовать одновременно большую и малую микробную нагрузку (100, 100000 и выше микробных тел в 1 мл). В зависимости от величины посевной дозы значения МПК препарата может колебаться: при увеличении дозы чувствительность снижается за счет роста количества пеницилинази, что образуется в среде. Пробирки инкубируют в термостате при 37 °С в течение 18-24 год. Результаты учитывают, определяя наличие или отсутствие роста в среде с разными разведениями препарата.
Последняя пробирка, в которой наблюдают задержку роста культуры (прозрачный бульйон), отвечает МПК (минимальной подавляющей концентрации) илиМБсК (минимальной бактериостатической концентрации) препарата относительно данного микроба и указывает на степень его чувствительности.
Если признаки роста появляются во всех пробирках, исследуемый штамм резистентный к максимальной концентрации препарата, которая была взята в опыт. Отсутствие роста бактерий во всех пробирках, кроме контрольной, свидетельствует, что МПК препарата ниже, чем и, что используется в опыте.
Для определения бактерицидного эффекта антибиотика из нескольких последних пробирок, в которых нет признаков роста, делают висел на секторы агара в чашках Петри. Через 24-48 год инкубации при оптимальной температуре отмечают ту наименьшую концентрацию препарата в пробирке, занял из которой
VIDEO
Принцип метода серийных разведений в плотной питательной среде аналогичен предыдущему. Для этого готовят серию разведений антибиотика в агаре, добавляя один объем, который содержит определенное количество препарата до 9 объемов агара. Для этого удобно разлить агар во флаконы или широкие пробирки по 13,5 мл. Перед постановкой агар расплавляют на водяной бане и после охлаждения до 60-65 °С в каждую пробирку добавляют 1,5 мл соответствующего разведения антибиотика (в бульйоне), тщательным образом перемешивают и выливают в чашку Петри. В контрольную пробирку с агаром вместо раствора антибиотика вносят 1,5 мл дистиллированной воды. Чашку разделяют на секторы, на каждый из которых засевают исследуемый штамм. Посевы делают бактериологической петлей или пастеровской пипеткой. Для посева удобно использовать специальный штамп-репликатор, который позволяет нанести одновременно на поверхность агара 25-50 исследуемых культур. Результаты учитывают после 18-24 год инкубации в термостате при оптимальной температуре.
За МПК (минимальную подавляющую концентрацию) антибиотика для данного штамма принимают ту, при которой отсутствуют признаки роста колоний на поверхности агара (или вместо бляшки есть рост одиночных колоний).
Из двух способов определения антибиотикочутливости микробов до антибиотиков (разведений в густой и жидкой средах) точнее является метод серийных разведений в жидкой среде. Результаты, которые получают с помощью разведений в агаре, менее постоянны. Метод не следует применять при оценке чувствительности тех микробов, которые дают тонкий, разрежен рост на поверхности чашки (стрептококки, пневмококки) или, напротив, имеют тенденцию к ползучему росту (протей). Недостатком методов серийных разведений является их высокая трудоємнисть, что ограничивает использование в обычных бактериологических лабораториях. С целью упрощение было предложено модификацию метода с заменой ряда из 10 пробирок, которые содержат разные количества препарата, тремя концентрациями антибиотика. Первая из них отвечает максимальной, что находится в крови при введении терапевтических доз, вторая – уровню, который наблюдается через Т1/2 (время снижения концентрации антибиотика на 50 %). Третья является минимальной, то есть той, которая равняется МПК для высокочувствительных штаммов. В соответствии с использованными концентрациями антибиотиков исследуемые штаммы можно отнести за уровнем чувствительности до трех основных групп: резистентные (МПК для которых превышает значение максимальной концентрации антибиотика в крови), умеренно чувствительные (значения МПК приближаются к максимальной или средней концентрации) и высокочувствительные (чувствительность которых к антибиотику находится на уровне минимальной концентрации, которая используется в опыте). Такими концентрациями при определении чувствительности к бензилпеницилину является соответственно 0,05-0,2, 0,5 и 2,0 ОД/МЛ, к макролидам – 0,1, 0,5-1,0 и 4,0 мкг/мл, к аминогликозидив – 0,5-1,0, 6,0-8,0 и 15,0-20,0 мкг/мл.
Ускоренные методы определения чувствительности микроорганизмов к антибиотикам. Используя обычные методы, ответ может быть получен через 18-20год от начала исследования, не учитывая этапов выделения чистой культуры. Это приводит к тому, что в большинстве случаев особенно при затяжном и тяжелом течении болезни, лечение антибиотиками начинают задолго до получения данных лабораторного обследования. В зависимости от принципов, на которых они базируются, ускоренные методы предусматривают: • определение изменений ферментативнои активности микроорганизмов под воздействием антибиотиков; • определение цвета редокс-индикаторов при изменении окислительно восстановительного потенциала во время роста бактерий в питательной среде; • цитологичну оценку изменений морфологии бактериальных клеток под воздействием антибиотиков.
К первой группе принадлежит метод Роджерса, ориентированный на способность антибиотиков подавлять ферментативну активность чувствительных микроорганизмов, которая сопровождается изменением цвета соответствующего индикатора. Суть его заключается в дифференцированном изменении красного цвета фенолового красного на желтый или фиолетовый в зависимости от чувствительности исследуемого штамма. В случае чувствительности к действию антибиотика не происходит разложение глюкозы при культивировании в среде, которое содержит ее и определены концентрации препарата. При этом среда окрашивается в фиолетовый цвет в результате сдвига рН в щелочную сторону. Изменение красного цвета на желтый свидетельствует о расщеплении глюкозы с образованием кислоты в результате роста штамма, резистентного к действию антибиотика. Если к среде прибавить 0,25 % дрожжевого экстракта, результаты могут быть учтенными уже через 2-2,5 год от начала исследования. Следующая группа методов регистрирует изменения окислительно восстановительного потенциала среды в процессе роста микроорганизмов, о чем свидетельствует изменение цвета резазурина, 1,3,5-трифенилтетразолия хлорида, 2,6-дихлорфенолиндофенола и других, которые добавляются к среде. Этот метод технически простой, а результаты получают через 2-6 год. Принцип его сводится к тому, который растоплен и охлажден до 50 °С агар засевают исследуемой культурой бактерий из расчета 200 млн. микробных тел, а на поверхность налагают диски с антибиотиками. Чашки инкубируют при оптимальной температуре в течение 3-5 год, потом обрабатывают индикатором и повторно инкубируют при 37 °С в течение 20-30 хв. Результаты учитывают за изменением цвета вокруг дисков с антибиотиками. Если используют 1 % раствор 1,3,5-трифенилтетразолия хлорида, участка агара с бактериальным ростом в результате образования формазануприобретают красный цвет, а зоны притеснения роста вокруг дисков остаются бесцветными. Судить о степени чувствительности микробов к антибиотикам можно с такой же точностью, как и с помощью стандартного метода дисков, однако время исследования уменьшается до 3-5 год. Образование инволюционных форм бактерий под воздействием антибиотиков исследуют под фазово-контрастным или антоптральним микроскопом в специальных микрокапсулах. Они образуются в результате действия бактериостатичних концентраций препарата. Под воздействием суббактериостатичнихконцентраций, а также при резистентности исследуемого штамма на поверхности агара вырастают нормальные микроколонии. Метод может быть применен для определения чувствительности штаммов кишечной палочки, стафилококков, холерных вибрионов. Полученные даны в большинстве случаев совпадают с теми, которые дают классические методы. За последние годы разработаны многочисленные модификации метода серийных разведений в питательных бульйонах. В частности, экспресс-методы с титрованием антибиотика в объеме 0,25 мл. Выпускаются коммерческие наборы длительного хранения, которые состоят из планшетов из лиофильно высушенными разведениями антибиотика, куда вносится по 0,1 мл суспензии чистой культуры микроорганизмов. Результаты определения антибиотикочутливости можно оценивать визуально (при наличии в среде индикатора) или с помощью спектрофотометров, когда регистрируется изменение оптической плотности среды. Определять чувствительность бактерий к антибиотикам можно и с помощью автоматизированных микробиологических систем (“Autobac MS-2”, “Cobas Micro”,Quantum 2, Sceptor и др.). При их использовании результаты получают уже через 3-10 год. Одно из их преимуществ заключается в том, что они позволяют получать результаты одновременно до 18-20 антибиотиков. Эти методы широко используют в микробиологических лабораториях, они хорошо коррелируют с другими методиками и за их помощью можно не только выбирать рациональную схему антибиотикотерапии, но и проводить эпидемиологический контроль резистентности. Однако при пользовании такими автоматизированными системами частота выявления резистентных штаммов может быть снижена в результате медленного роста устойчивых вариантов. В большинстве подобных систем результаты учитывают путем сравнения роста (или гибели) бактериальных клеток в присутствии антибиотиков с контролем, где есть только микробы. При этих условиях достаточно трудно дифференцировать клетки, которые погибают, от тех, что медленно размножаются. К другим факторам, которые влияют на результаты, принадлежит действие субингибиторних концентраций препаратов на ультраструктуру бактериальных клеток. Они приводят к изменению формы, набухания клеток, которое может сопровождаться изменением оптической плотности суспензии и искажением результатов. В свою очередь, это дает неправильную информацию о чувствительности возбудителей. Таким образом, применение любого метода позволяет определить антибиотикограму возбудителя – спектр его чувствительности и антибиотикостийкости. Все методы определения чувствительности бактерий к антибиотикам имеют свои преимущества и свои недостатки. Потому постоянный контроль за объективностью результатов и соблюдением правил проведения исследований способствуют получению достоверных данных.
В большинстве случаев результаты определения антибиотикоустойчивости in vitro совпадают с клиническими последствиями антибиотикотерапии. Случаи разногласия объясняются рядом причин, среди которых чаще всего встречается ошибочная трактовка полученных лабораторных данных. Причиной таких ситуаций может быть использование при посеве не чистой культуры бактерий, а патологического материала. Потому определяется не чувствительность инфекционного агента, а микробной ассоциации, в том числе и сапрофитной флоры. Ошибки встречаются при исследовании содержания двенадцатиперстной кишки, фекалиий, харкотиння, выделений из ран, мочи и тому подобное. Плазмиды делают бактерии нечувствительными к подавляющему большинству антибиотиков, которые используются в клиниках, поскольку кодируют синтез ферментов, которые разрушают препараты. Одним из наиболее исследованных ферментов является бета-лактамаза, которая разрушает антибиотики, которые принадлежат к группе бета-лактамив. Разработано несколько методических приемов, которые позволяют быстро определить ее активность. Один из них заключается в том, что на фильтровальную бумагу размером 2х2 см, который находится в чашке Петри, капают одну каплю 2 % водного раствора крахмала. Потом на эту бумагу наносят петлей агаровую культуру микробов и растирают ее, формируя бляшку диаметром до 5 мм. На ее поверхность наносят рабочий йодный растворпенициллина. Учет результатов проводят через 10 минут инкубации системы при комнатной температуре. При наличии бета-лактамазы на темно-синем фоне наблюдается ярко выраженная четкая зона просветления вокруг бляшки, которая содержит агаровую культуру микробов. При негативном результате зона просветления отсутствует, а края бляшки нечетки. Определение концентрации антибиотиков в биологических жидкостях. При тяжелых инфекционных процессах, например, сепсисе иногда придется определять концентрацию антибиотиков в биологических жидкостях, в частности, сыворотке крови, мочи. Для этого используют метод серийных разведений в жидкой среде с глюкозой и индикатором Андреде. В двух параллельных рядах готовят серийные разведения сыворотки и стандарта антибиотика. Потом к каждой пробирке, включая контрольные, добавляют стандартную суспензию тестовых микробов. Пробирки инкубируют в термостате при температуре 37 °С в течение 18год. В тех пробирках, где концентрация антибиотика подавляет микробов, среда остается бесцветной и прозрачной. Если микроорганизмы прорастают, об этом свидетельствует помутнение среды и появление розовой расцветки. Можно использовать также фенол-сироваткове среду с индикатором феноловым красным. В этом случае при отсутствии роста микроорганизмов среда остается красной, а при наличии признаков роста становится мутным и приобретает желтый цвет. Исходя из данных таблицы, раствор стандарта пенициллина задерживает рост тестовых микробов в концентрации 0,025 ЕД/МЛ, а исследуемая сыворотка – в разведении 1:8. Следовательно, содержание пеницилина в сыворотке крови будет равняться 0,2 ОД/МЛ (0,025 ЕД/мл).
Определение концентрации пенициллина в сыворотке крови
studfiles.net Методы определения концентрации антибиотиков в биологических жидкостях и тканяхПри определении концентрации антибиотиков в организме наиболее широко применяют микробиологические методы исследования, основанные на способности антибиотика задерживать рост тест-микроба. Другие методы (физико-химические, радиоиммунологические, ферментные и др.) более точны, занимают меньше времени, но в ряде случаев для их проведения требуется специальное оборудование. Среди микробиологических методов определения концентраций антибиотиков в жидкостях и тканях организма наибольшее распространение получили метод диффузии в агар и метод серийных разведений в жидкой питательной среде. Метод диффузии в агар Метод основан на сравнении степени угнетения поста тест-микроба определенными концентрациями антибиотика в испытуемом материале с угнетением его роста известными концентрациями стандарта антибиотика. Подавление роста тест-микроба осуществляется за счет диффузии антибиотика из исследуемого материала в плотную питательную среду. Рабочими стандартами служат специально изготовленные очищенные образцы антибиотиков, активность которых устанавливают по международным стандартным препаратам. Они сохраняются в запаянных ампулах при температуре 4—10° С. На этикетках указано содержание единиц или микрограммов активного вещества в 1 мг препарата. Антибактериальная активность антибиотиков выражается в единицах действия (ЕД), соответствующих действию определенной весовой части химически чистого препарата на тест-микроб. Для большинства антибиотиков (стрептомицин, антибиотики тетрациклинового ряда, канамицин и т. д.) 1 ЕД соответствует 1 мкг химически чистого препарата, а 1 мг такого препарата содержит 1000 ЕД. Для некоторых антибиотиков единицы действия были введены до получения химически чистых препаратов, в связи с чем их единица действия не соответствует 1 мкг химически чистого вещества (пенициллин, полимиксин, нистатин). Методом диффузии в агар можно определить концентрацию всех антибиотиков, содержащихся в жидкостях (в крови, спинномозговой жидкости, моче, желчи, асцитической жидкости и т. д.) и тканях организма (в легких, печени, почках, мозге, мышцах и др.). Для определения концентрации антибиотика в сыворотке кровь после образования сгустка центрифугируют, сыворотку отсасывают. Приготовленную сыворотку вносят в специальные лунки, изготовленные в агаровых пластинках, или в цилиндрики без разведения (если предполагаемая концентрация антибиотика в крови не превышает контрольную) либо разводят нормальной сывороткой человека или соответствующим каждому антибиотику буферным раствором. «Рациональная антибиотикотерапия»,С.М.Навашин, И.П.Фомина Наибольшее значение разработка ускоренных методов определения концентраций в крови и тканях имеет для антибиотиков группы аминогликозидов. Вследствие незначительного разрыва между терапевтической и токсической концентрацией даже небольшое превышение пограничного уровня концентрации, который составляет для гентамицина и юбрамицина 6—8 мкг/мл, сизомицина — 4—6 мкг/мл, канамицина — 15— 20 мкг/мл, стрептомицина 25—30 мкг/мл, может сопровождаться побочными реакциями (ото-… Для определения концентрации в испытуемом растворе можно использовать таблицы расчета активности антибиотиков (ВНИИА). Эти таблицы содержат числовые изображения кривых, имеющих различные углы наклона. Таблицы используют в сочетании со стандартной кривой. Угол наклона каждой кривой характеризуется разностью диаметров зон на стандартной кривой, создающихся при внесении в цилиндрики или лунки антибиотика в концентрациях, которые различаются в 2… По разности между средней величиной зоны контрольной концентрации, выведенной из всех чашек, и средней величиной зоны контрольной концентрации, определенной из 3 чашек с каждой отдельной концентрацией, находят поправку к величине зоны данной концентрации. Поправку прибавляют к средней величине зоны данной концентрации, если она положительная, и вычитают, если поправка отрицательная. Пример. Средняя величина зоны контрольной концентрации… В связи с тем что линейная зависимость между концентрацией и величиной зон задержки роста тест-микроба обнаруживается лишь в определенном интервале концентраций, растворы стандарта антибиотика должны быть точно подобраны. Для стандарта каждого антибиотика определяют концентрацию раствора, которая обеспечивает образование ж оптимальных зон задержки роста тест-культуры (контрольная концентрация). Такой концентрацией для бензилпенициллина является 1 ЕД/мл, олеандомицина —… Для приготовления растворов стандарта антибиотика делают произвольную, но точную навеску на аналитических весах v Навеску растворяют в соответствующем растворителе (смотрите таблицу ниже) из расчета 1 мг в 1 мл или 1000 ЕД в 1 мл (основной раствор). Дальнейшие разведения готовят путем разведения основных растворов до нужных концентраций. Для улучшения условий диффузии антибиотиков в агар для… Посевная доза тест-микроба должна быть предварительно установлена для каждой серии среды в пределах цифр, указанных в таблице ниже. Увеличение плотности посева может сопровождаться образованием густого микробного «газона» и уменьшением размеров зон задержки роста тест-микроба. При засеве недостаточным количеством микробных клеток на поверхности среды не образуется сплошного роста, зоны не имеют очерченного края и не могут… Для определения концентрации антибиотиков в тканях органы после удаления остатков крови взвешивают и гомогенизируют путем растирания с кварцевым песком или в специальном смесителе. К гомогенату добавляют дистиллированную воду или соответствующий буфер. Полученную взвесь центрифугируют 30 мин при 2500—3000 об/мин. Концентрацию антибиотика определяют в надосадочной жидкости. Для получения воспроизводимых результатов необходима строгая стандартизация опытов. Скорость диффузии… www.medvyvod.ru Дискодиффузный методДискодиффузный метод (ДЦМ) наиболее распространен в лабораторной диагностике, так как он обладает рядом преимуществ — доступность тестирования, низкая себестоимость, возможность определять чувствительность антибиотиков в конкретной клинической ситуации, высокая воспроизводимость результатов. Принцип метода. Диффузия антибиотика в агар приводит к формированию зоны подавления роста микроорганизмов вокруг дисков, которую измеряют линейкой. На поверхность агара в чашке Петри наносят бактериальную суспензию тестируемого микроорганизма определенной плотности; затем помещают диски, содержащие антибиотик, на расстоянии 20…25 мм друг от друга и далее измеряют зону подавления. Выбор средств для тестирования. Международным стандартом среды для тестирования микроорганизмов является среда Мюллера-Хинтона. Стандартами NCCLS (Национального комитета клинических лабораторных стандартов США) предполагается использование именно этой среды или ее стандартизированных модификаций. В большинстве микробиологических ветеринарных и медицинских лабораторий в России для оценки чувствительности выделяемых культур ДЦМ используют среду АГВ. Существенным недостатком этой среды является отсутствие стандартизации по содержанию двухвалентных катионов (кальций, магний, цинк), а также тимина и тимидина. Ввиду этого среда АГВ непригодна для определения антимикробной чувствительности к сульфаниламидам и ко-тримоксазолу в отношении всех микроорганизмов, а также при определении чувствительности Р. aeruginosa к имипенему, амино-гликозидам, фторхинолонам. Для определения чувствительности к макролидам и азитромицину на среде АГВ следует использовать диск с эритромицином. При исследовании S. aureus на чувствительность к оксациллину (для выявления MRSA-штаммов) используется диск с 1 мг оксациллина. Зона задержки роста для чувствительных штаммов S. aureus составляет 13 мм и более, промежуточного уровня — 11…12 мм, устойчивых — 11 мм и менее. При этом следует учитывать, что все чувствительные к оксациллину штаммы стафилококка считаются чувствительными к цефалоспоринам I, II и IV поколения, ингибиторзащищенным пенициллинам и карбапенемам, а все устойчивые к оксациллину штаммы устойчивы ко всем β-лактамам (цефалоспорины, ингибиторзащищснныс пенициллины, карбопенемы) независимо от получаемых при тестировании на чашках зон задержки роста. Для коагулазонегативных стафилококков зоны задержки роста, равные 18 мм и более, характеризуют чувствительность, 17 мм и менее — устойчивость к оксациллину. Тестирование S. pneumoniae на чувствительность к пенициллину на среде АГВ с 5 % дефибринированной бараньей крови возможно при использовании диска с оксациллином (1 мг). При этом штаммы с зоной ингибиции 20 мм и более считаются чувствительными к пенициллину, амоксициллину, цефалоспоринам и карбапенемам. Штаммы с зоной подавления 19 мм и менее могут быть устойчивыми, промежуточно чувствительными или чувствительными. Для их оценки необходимо определять МПК. Непосредственное использование дисков с пенициллином, ампициллином, цефалоспоринами, карбапенемами приводит к ошибкам. В настоящее время отсутствуют сведения о возможности использования среды АГВ для тестирования Enterococcus spp. Постановка ДДМ. Включает несколько этапов. Приготовление чашек с питательной средой. Приготовление чашек Петри с плотной питательной средой связано с рядом особенностей. Среду готовят в соответствии с инструкцией. Перед заполнением расплавленной средой чашки Петри устанавливают на строго горизонтальную поверхность. Глубина агарового слоя должна быть 4 мм, что достигается внесением 25…30 мл расплавленного агара в чашку диаметром 100 мм или 60…70 мл в чашку диаметром 150 мм. Соблюдение указанных условий связано с тем, что при увеличении толщины слоя агара уменьшается диаметр зон подавления роста в различной степени для разных антибиотиков, что может быть ошибочно расценено как резистентность. В то же время при недостаточной толщине слоя агара может происходить отраженная диффузия антибиотиков от дна чашки; это приводит к формированию больших зон подавления роста, и штамм может быть ошибочно оценен как чувствительный. После заполнения чашки оставляют при комнатной температуре для застывания среды. При использовании свежеприготовленных чашек перед инокуляцией бактериальной взвеси их надо подсушить, что достигается выдерживанием при 37 °С с приоткрытой крышкой в течение 10…20 мин. Хранить их можно в запаянных полиэтиленовых пакетах при 4…8 °С в течение 7…10 сут. Перед использованием их необходимо подсушить. Приготовление суспензии и инокуляция. Бактериальную суспензию исследуемой культуры готовят в свежем бульоне или физиологическом растворе из 16…18-часовых колоний, выросших на плотной неселективной среде, соответствующей потребностям вида (МПА, КА и др.), или 5…6-часовой бульонной культуре. Плотность приготовленной суспензии должна соответствовать (1…2) ∙ 108 КОЕ/мл Е. coli. Такую плотность можно получить без особой погрешности при разведении в 2 раза бактериальной суспензии оптической плотности 5 ед. стандарта ГИСК им. Л. А. Тарасевича. В течение 15 мин после приготовления 1…2 мл суспензии наносят на поверхность агара, равномерно распределяя покачиванием, и удаляют избыток жидкости пипеткой. Приоткрытые чашки подсушивают при комнатной температуре в течение 10…15 мин. Более удобно использование стерильных ватных тампонов. Тампон погружают в приготовленную суспензию, избыток влаги удаляют, отжимая его о стенку пробирки. Инокуляцию на поверхность питательной среды проводят штриховыми движениями, периодически поворачивая чашку Петри на 60°. Наложение дисков и инкубация. На поверхность питательной среды не позднее чем через 15…20 мин после инокуляции накладывают диски с антибиотиками, но только при отсутствии неадсорбированных остатков бактериальной суспензии. Диски размещают с помощью стерильного пинцета. Расстояние от края чашки и между дисками должно быть 15…20 мм. Таким образом, на одну чашку диаметром 100 мм приходится не более 6 дисков. Они должны равномерно соприкасаться с поверхностью агара, для чего их следует аккуратно прижать пинцетом. Диск нельзя перекладывать на другое место. Испорченный заменяют другим диском. Чашки непосредственно после наложения дисков помещают в термостат и инкубируют 18…20 ч при 37 °С кверху дном. Увеличение времени между нанесением дисков на поверхность среды и началом инкубации приводит к «преддиффузии» антибиотика и увеличению диаметра зоны ингибиции роста. Учет результатов. После инкубации рост на поверхности чашки должен быть сплошной и равномерный. Наличие отдельных колоний свидетельствует о том, что суспензия бактерий была недостаточно густой. В этом случае исследование следует повторить. Измеряют зону задержки роста (а не гемолиза) с обратной стороны чашки линейкой на темном фоне в отраженном свете. На кровяном агаре измерение осуществляют с верхней поверхности агара при закрытой крышке. За зону ингибиции принимают участок полного отсутствия роста, видимый невооруженным глазом. Двойная зона является чаще всего результатом использования смешанной культуры, что требует ее рассева для очистки и повторного тестирования. Не следует обращать внимание на очень мелкие колонии, выявляемые в пределах зоны ингибиции роста только при особых условиях освещения или увеличения, и едва заметный налет у края зоны. Крупные колонии, выявляемые в пределах четкого участка подавления роста, свидетельствуют о наличии посторонней микрофлоры или различной резистентности клеток популяции, что требует повторного исследования. При оценке антибиотикочувствительности роящихся штаммов протея зона задержки роста может быть затянута тонкой вуалеобразной пленкой, которая не мешает установлению границы зоны. При оценке резистентности к сульфаниламидам и их комбинациям с триметопримом на среде Мюллера—Хинтона границу зоны задержки роста следует учитывать при уровне ингибиции роста 80 %. При оценке результатов антибиотикочувствительности стафилококков в отношении оксациллина следует учитывать и самые мелкие колонии в пределах четкой зоны ингибиции роста. Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter. www.activestudy.info |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
г.Самара, ул. Димитрова 131 [email protected] |
 |