|
|
||||||||||
|
Антибиотики в педиатрии. Почему детей лечат неправильно? Антибиотики педиатрияАнтибиотики, разрешенные для лечения в педиатрииАнтибактериальные средства – это лекарственные препараты, которые лечат инфекционные заболевания, вызванные бактериями. Их великое множество, и для лечения взрослого больного у врача есть большой выбор. Однако, для лечения маленьких пациентов список антибиотиков крайне невелик. Это можно объяснить тем, что препарат, прежде чем сможет продаваться и применяться у людей, должен пройти большое количество серьезных клинических испытаний. Если для проведения клинических исследований на взрослых людях всегда есть испытуемые, то мало кто из родителей согласится, чтобы не полностью изученный препарат применялся у их ребенка, а без согласия родителей проведение исследований не возможно. В результате многие современные эффективные антибиотики не разрешены для применения у детей только потому, что не было проведено серьезных клинических испытаний. В нашей стране официальным документом, где прописано, можно ли принимать данный антибиотик ребенку или нет и если можно, то с какого возраста, является инструкция по медицинскому применению лекарства. Это бумажный вкладыш внутри упаковки с лекарством. Если вашему малышу 3 года, а доктор прописал вам антибиотик, в инструкции к которому есть информация, что он разрешен с 7 или 18 лет, значит исследований на таких маленьких детях не было, и вы сильно рискуете. Поэтому вы должны обсудить этот вопрос с вашим лечащим врачом и не начинать лечение. Среди всех антибиотиков, существующих в мире, для лечения детей можно выделить всего 3 группы: Антибиотики пенициллинового ряда
Препараты группы цефалоспориновЦефиксим (Супраск) – очень эффективный антибиотик резерва, то есть, как и амоксиклав, он должен назначаться как альтернатива амоксициллину, если лечение последним не дало эффекта. Существует в таблетках и порошке для приготовления суспензий. Принимается 1-2 раза в день, в зависимости от показаний. Если у вашего ребенка есть аллергия на пенициллиновые антибиотики, то и от этого препарата стоит отказаться, так как может быть перекрестная реакция. Остальные цефалоспорины применяются в виде инъекции или инфузий, поэтому для домашнего лечения не подходят. В основном назначаются в стационаре. Препараты группы макролидовАзитромицин (Сумамед, Хемомицин и др.) – эффективный антибактериальный препарат, существует в виде таблеток или порошка для приготовления суспензии. Удобен тем, что применяется 1 раз в день и курс приема препарата короткий – 3-5 дней, в зависимости от клиники. Является препаратом выбора у тех малышей, которые не переносят лечения пенициллиновыми антибиотиками или цефалоспоринами (чаще всего это аллергия). Остальные макролиды у детей не применяют. Другие группы антибиотики либо запрещены у детей, либо очень токсичны, либо на них не проводились исследования у этой категории пациентов. Следовательно, они не применяются. Данная статья не инструкция для читателей, как самостоятельно выбирать себе антибактериальный препарат. Она носит исключительно ознакомительный характер. Назначать лечение должен только врач. medaboutme.ru Особенности антибиотикотерапии у детей раннего возрастаВ первые дни болезни, когда не идентифицирован возбудитель, можно только предполагать, какая флора ответственна за возникновение болезни. Поэтому антибиотики назначают «вслепую», ориентируясь на данные гемограммы и очаг воспаления. Выбор препаратов должен учитывать его влияние на колонизационную резистентность, токсичность, побочные эффекты. Все антибактериальные препараты делят на две группы: 1. Подавляющие колонизационную резистентность желудочно-кишечного тракта:
2. Не подавляющие колонизационную резистентность желудочно-кишечного тракта:
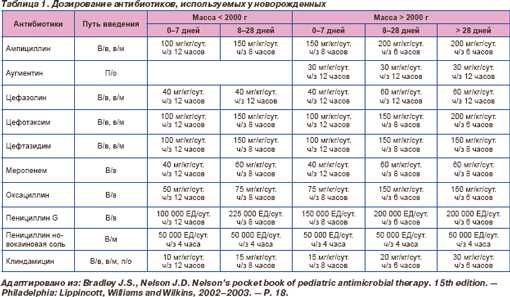
Назначение детям первых недель жизни антибиотиков, метаболизируюгцихся в печени: эритромицин, линкомицин, тетрациклины, сульфаниламиды — противопоказано. Поскольку большинство тяжелых форм гнойно-септических заболеваний вызывается грамотрицательной или смешанной флорой, в интересах больного назначается массивная антибактериальная терапия. Предпочтение отдается препаратам цефалоспоринового ряда, вводимых внутривенно, и препаратам группы аминогликозидов — внутримышечно. Суточная доза цефалоспоринов, согласно инструкции, в среднем составляет 50—100 мг/кг массы тела, вводится 2 раза в сутки, ряд аминогликозидов: амикацин — 10 мг/кг в/в и в/м; гентамицин 4—5 мг/кг; канамицин — 20 мг/кг вводится не дольше 5—7 дней. В указанных дозах нефротоксичного и ототоксичного эффекта не отмечается. Удлинение срока лечения аминогликозидами до 10—14 дней показано при менингите. Комбинированное применение препаратов предупреждает формирование устойчивых возбудителей. Имеются и противоположные мнения исследователей, имеющих антибиотикограммы в первые 2—3 часа госпитализации. Длительность антибиотикотерапии определяется индивидуально и заканчивается при исчезновении клинических и лабораторных признаков инфицирования больного. Помимо положительного действия, антибиотики являются иммунодепрессантами, токсично влияют на многие незрелые органы и системы маленького ребенка, в короткие сроки способствуют развитию дисбактериоза. Учитывая тяжесть состояния и клинику, индивидуально выбирают и назначают антибиотики, способ их введения, кратность и число назначаемых препаратов. При отсутствии эффекта через 48 часов рекомендуется заменить один из антибиотиков или добавить внутривенно метрогил. При стабильном улучшении состояния больного оставляют один антибиотик, ориентируясь также на лабораторные признаки санации организма. Дети с ЛГИ обычно получают антибиотики в течение 10—14 дней; с сепсисом — 18—23 дня, но это средние сроки, которые строго индивидуальны в каждом конкретном случае. Необоснованное удлинение курса антибиотикотерапии приводит к осложнениям со стороны кожи, сердца, желудочно-кишечного тракта, гемопоэтической системы, обмена воды и электролитов, иммунным нарушениям, нервно-гуморальным изменениям, инфекционным осложнениям и смене возбудителя. Характеристика антибактериальных препаратов дана в таблице 1. Таблица 1 Средние дозы антибиотиков, используемых в педиатрии (при нормальной функции почек и печени)
К ятрогенным воздействиям относят назначение антибиотиков без параллельного принятия биопрепаратов, что ведет к развитию дисбактериоза. Первые клинические признаки дисбактериоза появляются на 3—4 день антибиотикотерапии: молочница, вздутие живота, нарушение стула, чаще — разжижение стула. Неприятного запаха патологических примесей в стуле при дисбактериозе нет. Дефекация может сопровождаться выделением отдельно от стула струи «воды». Вокруг анального кольца, в паховых складках обнаруживается грибковая сыпь, похожая внешне на потницу, но крупнее и возвышающаяся над поверхностью кожи, шелушащаяся. С течением времени дисбактериоз проявляется резким вздутием живота и стойкими запорами. Лечение дисбактериоза. Грибковые поражения кожи обрабатываются раствором соды, нистатиновой, левориновой мазью, клотримазолом. Через рот назначается раствор канамицина в суточной дозе, биопрепараты даются длительное время. Снижается условно-патогенная аэробная флора в кишечнике путем метода деконтаминации — орального применения некоторых антибиотиков: гентамицина — 10 мг/кг, канамицина — 50 мг/кг, полимиксина— 100 тыс. ЕД/кг (препараты не всасываются через кишечную стенку). Осложнения дисбактериоза: кишечный сепсис, грибковый менингит. Эффективно включение в комплекс иммунотерапии человеческого лейкоцитарного интерферона — ЧЛИ — в дозе 10 000 ед/кг массы (суточная доза). Синтетический препарат — реоферон, интрон в дозе 100 000 ЕД/кг массы. У новорожденных внутримышечное введение препарата можно заменить интраректальным, при котором он всасывается в полую вену, минуя воротную, что предотвращает инактивацию интерферона в печени. Усиливает действие интерферона введение витамина Е, являющегося протектором интерферона и хорошим антиоксидантом. Суточная доза для новорожденных— 0,3 мл внутримышечно. У детей старше года возможно назначение капсул витамина Е. Лысенков С.П., Мясникова В.В., Пономарев В.В. Неотложные состояния и анестезия в акушерстве. Клиническая патофизиология и фармакотерапия medbe.ru Антибактериальные препараты в педиатрии | Интернет-издание "Новости медицины и фармации"Данная работа посвящена применению антибактериальных препаратов у детей. Антибиотики являются одними из наиболее широко используемых медикаментов в педиатрической практике, при этом чаще всего их назначают по поводу среднего отита [1]. В связи с резко увеличивающимся ростом резистентности микроорганизмов к антибиотикам в последние годы прилагается много усилий для разработки рекомендаций по рациональному их применению, вследствие чего в США снизилась частота назначения антибактериальных средств у детей [1, 2]. Наряду с этим недавно проведенные изменения в законодательстве относительно проведения клинических исследований новых препаратов гарантируют получение большего количества информации о применении новых медикаментов у детей. Данные тенденции могут привести к снижению частоты появления резистентных микроорганизмов и более обоснованному использованию антибактериальных агентов в педиатрии. В этой статье приводятся данные об особенностях применения антибиотиков у детей. Первая часть посвящена принципам фармакокинетики и фармакодинамики в детской популяции. Далее обсуждаются наиболее часто употребляемые в педиатрической практике антибактериальные препараты. Фармакокинетика и фармакодинамика антибиотиков у детейОсобенности фармакокинетики и фармакодинамики ряда антибактериальных препаратов являются ключевыми факторами, определяющими их эффективность. Они должны учитываться при выборе препарата, особенно при назначении детям. Фармакокинетика характеризует всасывание, распределение и выведение препарата, а фармакодинамика — его эффекты, активность или токсичность. К факторам, влияющим на эти параметры, относят гестационный и хронологический возраст, особенности основной и сопутствующей патологии, лекарственные взаимодействия и тканевое распределение. Наряду с этим особенности бактерицидного/бактериостатического действия могут влиять на эффективность некоторых антибиотиков. Существует два основных типа бактерицидного действия антибактериальных средств. Влияние на бактерии таких антибиотиков, как аминогликозиды и фторхинолоны, является концентрационно-зависимым, то есть более высокие концентрации препарата способствуют уничтожению бактерий в большей степени. Такие антибиотики, как β-лактамы, ванкомицин, клиндамицин и макролиды, демонстрируют времязависимую эффективность, то есть чем более продолжительное время сохраняется концентрация выше минимальной подавляющей концентрации (МПК), тем больше эффективность бактериальной эрадикации [3]. Возрастные факторы Фармакокинетика и фармакодинамика антибиотиков зависит от возраста и этапа развития педиатрического пациента. Изменения печеночной и почечной функций, связанные с ростом и развитием ребенка, в том числе приводят к изменениям метаболизма препаратов. Вместе с тем различия в содержании тканевой и межтканевой жидкости, а также в площади поверхности тела обусловливают различное распределение препарата в средах организма [4]. Период новорожденности является великолепным примером влияния этих различий на дозирование определенных антибактериальных препаратов (табл. 1).
Вследствие незрелости экспрессии печеночных ферментов при рождении экскреция билирубина у новорожденных снижена, что приводит к повышению содержания у них неконъюгированного билирубина. Некоторые антибактериальные средства (например, цефтриаксон и сульфаниламиды) могут провоцировать увеличение билирубинемии вследствие «вытеснения» билирубина из связанного с альбумином состояния. Из-за риска билирубиновой энцефалопатии и развития ядерной желтухи от применения этих препаратов у новорожденных с гипербилирубинемией следует воздержаться. Сниженная гломерулярная фильтрация и тубулярная секреция существенно влияют на почечный клиренс ряда антибиотиков. β-лактамы, ванкомицин и аминогликозиды являются примером таких препаратов и требуют корректировки дозы и частоты введения. Поэтому нередко необходим мониторинг ренальной функции и концентраций антибиотиков в сыворотке. Особенности основного заболевания Некоторые хронические заболевания могут повлиять на фармакокинетику и фармакодинамику препарата. Например, у больных муковисцидозом наблюдается увеличение объема распределения лекарства и более быстрая элиминация антибиотиков, часто применяемых при этом заболевании. Так, β-лактамы, аминогликозиды и хинолоны демонстрируют измененную фармакокинетику в данной группе пациентов по сравнению с лицами без муковисцидоза. Лекарственные взаимодействия Назначение некоторых препаратов совместно с антибиотиками может изменить сывороточные концентрации обоих препаратов. Например, взаимодействие макролидов с теофиллином влияет на печеночный метаболизм, что приводит к повышению уровней теофиллина и риску развития токсичности. Макролиды также снижают экскрецию карбамазепина, циклоспорина, варфарина и ингибиторов протеаз [5]. Особые токсические эффекты у детей Тетрациклины могут замедлять рост костной ткани и приводить к окрашиванию зубов у детей младших возрастных групп, поэтому их обычно не используют в возрасте до 8 лет. Несмотря на это, антибиотики тетрациклинового ряда могут использоваться при лечении пятнистой лихорадки скалистых гор (rocky mountain spotted fever) или эрлихиоза в любом возрасте ввиду их высокой эффективности в отношении соответствующих патогенов [6]. Установлено, что обозначенные выше побочные эффекты являются дозозависимыми и кумулятивными, поэтому вероятность развития серьезной токсичности при лечении клещевых инфекций тетрациклинами достаточно невелика. Среди препаратов тетрациклинового ряда доксициклин более предпочтителен для применения у детей, так как неинтенсивно связывается с кальцием. β-лактамные антибиотикиβ-лактамные антибиотики являются основной составляющей арсенала антибактериальных препаратов, применяемых в педиатрии. Данные препараты хорошо переносятся, являются безопасными и весьма эффективными по отношению к большинству бактериальных микроорганизмов, с которыми сталкивается педиатр в своей практике. Пенициллины Пенициллины остаются препаратами выбора при многих инфекциях у детей. Растущая резистентность ограничивает использование природных пенициллинов. Однако создание пенициллинов с расширенным антимикробным спектром, пенициллиназоустойчивых производных и комбинаций пенициллинов с ингибиторами β-лактамаз позволило продолжить широкое применение пенициллинов. Пенициллин G и пенициллин V остаются препаратами первой линии при инфекциях, вызванных чувствительными стрептококками, включая фарингит, вызванный стрептококком группы А. Наряду с этим природные пенициллины являются препаратами выбора при сифилисе, менингококковой инфекции, листериозе, а также при неонатальной инфекции, вызванной стрептококком группы В. Стафилококки, например Staphylococcus aureus, развили резистентность к естественным пенициллинам путем продукции пенициллиназ. Устойчивые к разрушению пенициллиназами полусинтетические пенициллины были созданы путем добавления ацильного радикала к β-лактамному кольцу. Эта группа антибиотиков, представленная такими пенициллиназорезистентными препаратами, как оксациллин, нафциллин, диклоксациллин и метициллин, в силу ряда обстоятельств имеет ограниченное применение в практике. Например, метициллин редко используется в связи с высокой частотой развития интерстициального нефрита при его применении [7]. Диклоксациллин имеет превосходную биодоступность при пероральном приеме, однако обладает плохими органолептическими свойствами. Распространение метициллинрезистентных штаммов S. aureus (MRSA), которые устойчивы также к другим полусинтетическим пенициллинам, тоже ограничивает широкое применение этих препаратов [8, 9]. Коагулазонегативные стафилококки, главные патогены в неонатологических реанимационных отделениях, также преимущественно резистентны к перечисленным выше антибактериальным средствам. Аминопенициллины (ампициллин и амоксициллин) были синтезированы как антибиотики с расширенным спектром действия, включающим, кроме прочего, грамотрицательные бактерии и энтерококки. Изначально аминопенициллины были активны в отношении таких грамотрицательных бактерий, как Escherichia coli, Proteus spp., Salmonella и не продуцирующий β-лактамазу Haemophilus influenzae. Однако в связи с изменением профиля чувствительности к аминопенициллинам во многих географических регионах они перестали быть препаратами первой линии при лечении ряда инфекций, вызванных данными микроорганизмами. Например, ампициллин больше не является терапией первого выбора при сальмонеллезном гастроэнтерите или инфекции мочевой системы, вызванной E. coli, за исключением ситуаций, когда чувствительность к нему подтверждена микробиологически. Резистентность многих штаммов S. pneumoniae к пенициллинам существенно выросла из-за выработки пенициллинсвязывающих протеинов. Однако увеличение дозы аминопенициллинов приводит к повышению сывороточных концентраций препарата, превышающих МПК, что дает необходимый бактерицидный эффект [10]. Например, применение амоксициллина в дозе 80–100 мг/кг/сут. за три приема вместо 40 мг/кг/сут. будет более эффективным при лечении среднего отита или синусита, вызванного пенициллинустойчивыми штаммами S. pneumoniae. Амоксициллин имеет лучшую биодоступность в сравнении с ампициллином при пероральном приеме и является препаратом выбора в случае необходимости применения аминопенициллинов per os. Из-за лучшего всасывания и более удобного применения многие врачи предпочитают использовать амоксициллин вместо пероральных форм пенициллина при лечении стрептококкового фарингита или для профилактики инфекционного эндокардита при проведении инвазивных манипуляций (например, при экстракции зубов) у пациентов высокого риска. Наряду с аминопенициллинами были синтезированы другие группы пенициллинов с расширенным спектром действия — карбоксипенициллины и уреидопенициллины. Побочные эффекты, присущие только этим двум группам антибактериальных препаратов, включают гипокалиемию и гипернатриемию. В основном эти препараты назначаются в педиатрии для лечения инфекций, вызванных Pseudomonas aeruginosa. Карбоксипенициллины представлены карбенициллином и тикарциллином. Карбенициллин был создан подобно ампициллину — путем замещения аминогруппы карбоксильной группой. Дополнительная модификация карбенициллина различными радикалами позволила синтезировать тикарциллин. По сравнению с ампициллином оба препарата имеют антипсевдомонадную активность (тикарциллин в большей степени) и более выраженное действие в отношении других грамотрицательных бактерий. Однако аминопенициллины в сравнении с карбоксипенициллинами сохраняют большую активность в отношении энтерококков. Уреидопенициллины, включающие мезлоциллин, азлоциллин и пиперациллин, также обладают высокой активностью в отношении аэробных грамотрицательных возбудителей, включая синегнойную палочку. Они были синтезированы путем добавления ацильной боковой цепи к ампициллину, благодаря чему имеют меньше побочных эффектов и активны против Enterococcus spp. Пиперациллин имеет также дополнительную пиперазиновую группу. Это наиболее часто используемый препарат в данном классе. Резистентность к пенициллинам реализуется множеством различных механизмов. Основной из них — это продукция β-лактамаз. Их инактивация может быть достигнута с помощью применения ингибиторов β-лактамаз, которые необратимо связываются с данными энзимами, что предотвращает гидролиз пенициллинов. Комбинирование ингибиторов β-лактамаз с некоторыми пенициллинами расширило возможности выбора антибактериальных препаратов в педиатрической практике. Амоксициллин/клавуланат (Аугментин) является наиболее часто используемым препаратом подобного рода у детей. Он имеет дополнительную активность в отношении S. aureus, β-лактамазопродуцирующего H. influenzae и многих анаэробов. Это превосходный препарат для лечения среднего отита, синуситов. Новая форма препарата с более высоким содержанием амоксициллина позволяет использовать амоксициллин/клавуланат для лечения инфекций, вызванных штаммами S. pneumoniae с повышенной устойчивостью к аминопенициллинам. В одном из исследований установлено, что применение амоксициллина/клавуланата в высокодозовом режиме приводило к эрадикации 98 % (в том числе 91 % пенициллинрезистентных) штаммов S. pneumoniae у детей с острым средним отитом [11]. Количество гастроинтестинальных побочных эффектов, ассоциированных с применением клавуланата, не отличалось от такового у первоначальной лекарственной формы [11, 12]. Кроме того, амоксициллин/клавуланат (Аугментин) является прекрасным выбором для лечения инфекций нижних дыхательных путей, при многих инфекционных патологиях кожи и мягких тканей, а также эффективен при укусах животных. Другие комбинированные препараты имеют ограниченное применение в педиатрии. Ампициллин/сульбактам — парентеральный препарат, разрешенный для применения у детей 1 года и старше. Его спектр активности сходен с таковым у амоксициллина/клавуланата. Препарат показан при тонзиллите и лимфадените, пневмонии и инфекции мочевой системы. Он был успешно использован у детей с бактериальным менингитом, хотя его бактерицидная активность уступает цефтриаксону [13, 14]. Он также эффективен при лечении костно-суставных инфекций у детей [15]. Тикарциллин/клавуланат также разрешен для использования у детей, кроме того, имеется опыт успешного эмпирического применения при фебрильной нейтропении [16, 17]. Безопасность и эффективность пиперациллина/тазобактама не установлена для детской популяции. Цефалоспорины Цефалоспорины I поколения Два наиболее часто используемых в педиатрической практике препарата цефалоспоринов I поколения — цефазолин (для парентерального применения) и цефалексин (для применения per os). Они преимущественно используются при инфекциях кожи и мягких тканей, вызванных стрептококками и чувствительными штаммами S. aureus. Данные препараты также эффективны (в более высоких дозах) при лечении инфекций костей и суставов у детей. Оба средства доказали свою безопасность и эффективность у детей. Цефалоспорины II поколения Цефалоспорины II поколения имеют более широкий спектр активности, включая грамотрицательные бактерии. За исключением цефокситина и цефотетана, они не очень активны в отношении анаэробов. К тому же представители этого поколения цефалоспоринов плохо проникают через гематоэнцефалический барьер. Исключением является цефуроксим (существуют доказательства его проникновения в центральную нервную систему), однако его применение при лечении бактериального менингита сопровождалось более поздним эффектом по сравнению с цефтриаксоном и более высокой частотой ототоксичности [18]. Наряду с формой для парентерального применения существует также цефуроксим для перорального использования (цефуроксим аксетил — зиннат), который можно назначать детям от 2 месяцев. Данный препарат показан при лечении фарингита, среднего отита и инфекций нижних дыхательных путей, мягких тканей, мочевой системы. Другими пероральными цефалоспоринами II поколения являются цефаклор и цефпрозил. Применение цефаклора, однако, связано с развитием ряда побочных эффектов, ограничивающих его использование в педиатрии [19]. Цефпрозил имеет спектр активности, подобный таковому у цефуроксима аксетила. Цефалоспорины III поколения Наиболее широко используемые у детей цефалоспорины III поколения для парентерального применения — цефтриаксон, цефотаксим и цефтазидим — имеют большую активность в отношении Enterobacteriaceae по сравнению с цефалоспоринами II поколения. Они активны в отношении пенициллинрезистентного S. pneumoniae, Haemophilus, Neisseria, и Moraxella spp. и не активны в отношении энтерококков, Bacteroides и Listeria. Эти препараты по антистафилококковой активности, однако, уступают другим поколениям цефалоспоринов и полусинтетических пенициллинов. Цефтриаксон удобен для применения, так как требует однократного внутримышечного или внутривенного введения при большинстве инфекций. Хорошее связывание цефтриаксона с альбумином может приводить к «вытеснению» билирубина, поэтому его не используют у новорожденных с гипербилирубинемией. Цефтриаксон создает высокую пиковую концентрацию в сыворотке и высокоэффективен против большинства резистентных инфекций, вызванных S. pneumoniae. Однако с учетом роста количества малочувствительных штаммов микроорганизмов при эмпирическом лечении бактериального менингита рекомендуется комбинирование цефалоспорина III поколения с ванкомицином. Другие препараты в сочетании с цефалоспоринами III поколения также могут быть эффективными [20]. Цефотаксим обладает аналогичным с цефтриаксоном спектром действия и не имеет ограничений для применения у новорожденных. Цефтазидим является единственным цефалоспорином III поколения, к которому может быть чувствительна синегнойная палочка. В целом препараты этой группы переносятся хорошо. Как и при использовании других β-лактамов, возможно развитие агранулоцитоза, тромбоцитопении, псевдомембранозного колита и реакций гиперчувствительности. Применение цефтриаксона также может быть сопряжено с появлением обратимого билиарного сладжа и в редких случаях — фатальной гемолитической анемии [21, 22]. Препаратами данного класса для перорального применения являются цефподоксим, цетибутен, цефдинир и цефиксим. Цефподоксим удобен для дозирования (один или два раза в сутки), однако обладает неприятным вкусом. Цефдинир имеет более широкий спектр действия, сравнимый с цефалоспоринами I поколения по влиянию на S. aureus и стрептококки. Он назначается 2 раза в сутки и имеет приятный вкус. Цефтибутен — также пероральный цефалоспорин III поколения со спектром действия, как у цефподоксима. Он разрешен для применения при синуситах и среднем отите у детей от шести месяцев. Пероральные цефалоспорины II и III поколений мало эффективны в случаях инфекций, вызванных умеренно или высоко резистентными к пенициллину пневмококками. Цефалоспорины IV поколения Цефалоспорины IV поколения представляют собой двуполярные ионные структуры, являющиеся слабыми индукторами выработки β-лактамаз. Они также имеют низкую аффинность к β-лактамазам и более быстро проникают в грамотрицательные бактерии. Считается, что это ограничивает рост резистентности грамотрицательных микроорганизмов к данным препаратам. Цефепим является единственным одобренным антибактериальным препаратом этого поколения. Он высоко а ктивен в отношении грамположительных бактерий, включая метициллинчувствительный S. aureus, β-гемолитический стрепто кокк и некоторые коагулазонегативные стафилококки. Он также обладает наивысшей активностью среди всех цефалоспоринов в отношении пенициллин-резистентных пневмококков и очень высокой активностью против H. influenzae, Neisseria spp., Pseudomonas spp. и Enterobacteriaceae [23, 24]. В недавнем сообщении о результатах программы антимикробного мониторинга SENTRY представлены данные о том, что 10 % штаммов P. aeruginosa резистентны к цефепиму [25]. Данная программа также продемонстрировала, что цефепим сохраняет свою активность против AmpC β-лактамаз, хотя в нескольких других исследованиях цефепим был менее активен, чем карбапенемы, в отношении бактерий, продуцирующих широкий спектр β-лактамаз [26–29]. Цефепим одобрен для применения у детей 2 месяцев и старше. Он показан для лечения фебрильной нейтропении, пневмонии, инфекций кожи и мягких тканей, а также мочевой системы. Он хорошо проникает в ткани, включая мозговые оболочки. Кроме того, препарат также продемонстрировал сравнимую с цефтазидимом безопасность и эффективность при монотерапии нейтропенической лихорадки у детей с онкологической патологией [30, 31]. Побочными эффектами, описанными при использовании цефепима, являются головная боль, желудочно-кишечные проявления, местные реакции и сыпь, появляющиеся у менее 2 % пациентов. Более серьезными побочными эффектами могут быть энцефалопатия и судороги. Карбапенемы Основная структура этих препаратов подобна пенициллину. Однако их высокая эффективность может быть объяснена некоторыми структурными особенностями. Например, алкил-тиоловая боковая цепь дает карбапенемам антисинегнойную активность, а благодаря наличию гидроксиэтиловой боковой цепи они нечувствительны к большинству β-лактамазных фермен тов. Карбапенемы имеют наиболее широкий антибактериальный спектр среди всех применяемых сегодня антибиотиков. Они активны против грамположительных бактерий (за исключением метициллинрезистентного стафилококка) и Enterococcus faecium, многих анаэробных и грамотрицательных возбудителей, включая продуцирующих широкий спектр β-лактамаз. Показательно, что из 10 сравнивавшихся антибактериальных препаратов меропенем продемонстрировал наибольшую активность в отношении грамотрицательных микроорганизмов. К тому же в одном из исследований установлено, что в течение последних нескольких лет наблюдается увеличение количества меропенемчувствительных штаммов P. aeruginosa [32]. Первым карбапенемом, разрешенным для применения у взрослых, был имипенем/циластатин. Ограниченный опыт применения у детей и развитие судорог при лечении менингита не дает возможности широко применять его в педиатрической практике [33]. Меропенем разрешен для применения у детей с 3 месяцев жизни. Он обладает большей антипсевдомонадной активностью, чем имипенем, однако менее активен в отношении грамположительных возбудителей. Возможно применение этого препарата при менингите, фебрильной нейтропении, пневмонии, внутриабдоминальных инфекциях, а также инфекциях кожи и костно-суставной системы. У детей меропенем остается препаратом выбора при наличии бактерий, продуцирующих широкий спектр β-лактамаз, а также продуцирующих AmpC β-лактамазы. Применение карбапенемов должно быть ограничено случаями наиболее серьезных инфекций ввиду того, что их использование ассоциируется с существенным ростом количества полирезистентных микроорганизмов [34, 35]. Монобактамы Последними представителями β-лактамов являются монобактамы. Азтреонам — это единственный существующий моноциклический β-лактам. Из-за особенностей своей структуры он связывается преимущественно с пенициллинсвязывающими протеинами грамотрицательных бактерий. Спектр его противомикробной активности сходен с аминогликозидами. Он достаточно высоко активен в отношении грамотрицательных возбудителей, включая P. aeruginosa. Грамположительные бактерии и анаэробы резистентны к азтреонаму. Азтреонам можно применять у детей с 9-го месяца жизни [37]. Показания к его назначению включают инфекции нижних дыхательных путей, мочевой системы, септицемию и внутриабдоминальные инфекции, вызванные чувствительными к данному препарату возбудителями. Азтреонам является альтернативой аминогликозидам в сочетании с другими антибиотиками ввиду его меньшей нефро- и ототоксичности. Наконец, в ряде случаев он может быть заменой β-лактамам, потому что только 1 % лиц с аллергией к β-лактамам имеют гиперчувствительность к азтреонаму [38]. МакролидыЭритромицин является природным макролидом. Он имеет плохую биодоступность и много гастроинтестинальных побочных эффектов. Структурные модификации этого вещества позволили синтезировать соли эритромицина с лучшими показателями биодоступности. Дальнейшие модификации привели к появлению новых макролидов, таких как азитромицин и кларитромицин, которые лучше переносятся и более удобно дозируются. В прошлом эритромицин был основным альтернативным препаратом у детей с аллергией на пенициллин при стрептококковом фарингите, синусите и остром среднем отите. В последнее время наблюдается рост резистентности к макролидам у S. pneumoniae и H. influenzae [39]. К тому же азитромицин не продемонстрировал преимуществ в сравнении с плацебо при лечении острого среднего отита, вызванного пенициллинрезистентными бактериями [40]. Макролиды активны в отношении чувствительных штаммов Streptococcus pneumoniae, Staphylococcus aureus, Moraxella catarrhalis и Streptococcus pyogenes, а новые макролиды еще и против Haemophilus influenzae. Азитромицин обладает наибольшей грамотрицательной активностью среди всех макролидов и эффективнее других против Shigella и Salmonella [41, 42]. Эритромицин использовался в качестве препарата первой линии при лечении коклюша и хламидийной инфекции у новорожденных. Однако была отмечена связь между его применением и увеличением частоты развития гипертрофического пилоростеноза, в связи с чем многие врачи предпочитают назначать азитромицин вместо эритромицина [43, 44]. Из-за медленного высвобождения из тканей азитромицина имеет длительный период полувыведения. Пятидневный курс азитромицин или семидневный курс кларитромицина лучше переносится и сопоставим по эффективности с применением эритромицина на протяжении 14 дней при лечении коклюша [46]. Подвержены воздействию макролидов такие атипичные патогены, как Mycoplasma pneumoniae, Legionella spp., Chlamydia spp., Ureaplasma urealyticum и Listeria spp. Кларитромицин и азитромицин активны против многих нетуберкулезных микобактерий. Таким образом, макролиды имеют достаточно ограниченное использование при большинстве бактериальных инфекций в педиатрической практике, за исключением фарингита, вызванного β-гемолитическим стрептококком группы А. У детей с острым средним отитом, синуситами или внебольничной пневмонией маловероятно инфицирование атипичной флорой. Использование макролидов у детей с перечисленной патологией должно ограничиваться случаями аллергии к пенициллинам. Несмотря на это, они остаются превосходными антибактериальными средствами против атипичных микроорганизмов. Новые макролиды имеют более широкий спектр действия, более удобное дозирование и могут применяться парентерально (азитромицин и кларитромицин). ЛинкозамидыКлиндамицин является полусинтетическим ингибитором синтеза протеинов. Он активен в отношении грамположительных и анаэробных бактерий, однако аэробные и грамотрицательные микроорганизмы к нему не чувствительны. Клиндамицин хорошо проникает в жидкости, ткани и кости. Высокая частота развития антибиотикассоциированного псевдомембранозного колита ограничивает его применение в последние годы. Тем не менее использование клиндамицина в некоторых ситуациях становится более частым из-за роста количества внегоспитальных инфекций, вызванных метициллинрезистентными микроорганизмами. В ряде сообщений указывается, что чувствительность их к клиндамицину превышает 90 % [47–49]. Клиндамицин также эффективен при лечении детей с инвазивными формами заболеваний, вызываемыми этими патогенами [50]. С учетом того что частота штаммов метициллинрезистентного стафилококка достигает 50 % всех S. aureus во многих популяциях, клиндамицин может стать препаратом первой линии при эмпирическом лечении инфекций, предположительно вызванных стафилококками. АминогликозидыАминогликозиды являются бактерицидными ингибиторами белкового синтеза. Они преимущественно используются при лечении грамотрицательных бактериальных инфекций. Активность аминогликозидов в отношении грамположительных бактерий ограничена, однако они обладают некоторой активностью против S. aureus и действуют синергично против энтерококков при совместном назначении с пенициллинами или ванкомицином. В педиатрии аминогликозиды остаются ключевыми препаратами при грамотрицательном неонатальном сепсисе, осложненных инфекциях мочевой системы, инфекциях при муковисцидозе и эмпирическом лечении фебрильной нейтропении. Три наиболее часто используемых у детей аминогликозидов представлены гентамицином, тобрамицином и амикацином. В целом тобрамицин имеет большую антипсевдомонадную активность, а амикацин более активен в отношении резистентных грамотрицательных возбудителей. Амикацин и редко стрептомицин используются при стартовой терапии туберкулеза у детей, они также активны против других микобактерий. Ототоксичность и нефротоксичность являются наиболее значимыми побочными эффектами. В исследованиях, однако, не удалось продемонстрировать устойчивую корреляцию между применением аминогликозидов и снижением слуха у детей [51–53]. Несмотря на это, общепринятым подходом является оценка слуха у пациентов, длительно принимающих аминогликозиды. Риск нефротоксичности у детей также был продемонстрирован как низкий [54]. В связи с тем что аминогликозиды — это концентрационнозависимые антибиотики, их бактерицидный эффект зависит от создания адекватной пиковой концентрации. В исследованиях у взрослых были доказаны преимущества по эффективности и безопасности однократного применения аминогликозидов. Однако для подобных рекомендаций в педиатрической практике требуется проведение специальных исследований у детей [55, 56]. ГликопептидыВанкомицин относится к классу гликопептидов, которые активны преимущественно против грамположительных бактерий. Он ингибирует синтез бактериальной стенки. В целом ванкомицин хорошо переносится, однако описаны гастроинтестинальные побочные эффекты, гипотензия и сердечно-сосудистые нарушения при быстром введении, кожные реакции, тромбофлебит и, редко, ототоксичность. Синдром красного человека (то есть гипотензия в сочетании с гиперемией лица, шеи и груди) — это еще одно побочное явление, встречающееся при быстром введении ванкомицина. Подобные проявления являются, вероятно, гистаминзависимыми и купируются введением антигистаминных препаратов и глюкокортикоидов, а также снижением скорости инфузии. Ванкомицин чаще других антибактериальных препаратов используется при инфекциях, вызванных метициллинрезистентным стафилококком, коагулазонегативными стафилококками, ампициллинрезистентными энтерококками, а также Bacillus и Corynebacterium spp. Ванкомицин стал одним из важнейших антибактериальных препаратов, используемых в комбинации с другими антибиотиками: 1) для стартовой терапии ряда внутрибольничных инфекций за счет активности в отношении коагулазо-негативных стафилококков; 2) для лечения бактериального менингита, поскольку обладает активностью против пенициллинрезистентного S. pneumoniae; 3) в некоторых случаях фебрильной нейтропении, вызванной зеленящим стрептококком [58]. Перорально ванкомицин может использоваться при лечении псевдомембранозного колита, вызванного Clostridium difficile. Однако такой подход применяется только в случае неуспешного лечения метронидазолом в качестве препарата первого ряда, чтобы избежать селекции ванкомицинрезистентных энтерококков [59]. Важно строго придерживаться показаний к назначению ванкомицина во избежание роста устойчивости микроорганизмов к данному препарату. К сожалению, в Соединенных Штатах наблюдается увеличение частоты ванкомицинрезистентных штаммов энтерококков, а в последнее время и появление ванкомицинрезистентных штаммов S. aureus [60, 61]. Новые препараты: оксазолидиноны и стрептограминыНа сегодняшний день достаточно распространены полирезистентные штаммы микроорганизмов, такие как ванкомицинрезистентные энтерококки. В связи с этим создаются новые антибактериальные препараты, активные в отношении таких возбудителей. Дальфопристин/квинупристин — стрептограмин, одобренный для применения у пациентов старше 16 лет. Он активен в отношении метициллинрезистентного стафилококка, коагулазонегативных стафилококков, пенициллинрезистентных пневмококков и ванкомицинрезистентного E. faecium, однако неактивен в отношении Enterococcus faecalis. Дальфопристин/квинупристин используется парентерально. К побочным эффектам относят локальные реакции в месте введения, тошноту и рвоту, диарею, головную боль, миалгию и артралгию. Другая группа новых препаратов, активных против мультирезистентных возбудителей — оксазолидиноны. Линезолид является единственным представителем данного класса. Он разрешен к применению у детей, имеются данные о безопасном его применении на первом году жизни [62]. Идут разработки оксазолидинонов с большей антиграмотрицательной и антимикобактериальной активностью. Хотя линезолид — новый препарат, уже описаны резистентные штаммы Enterococcus spp. [63]. Эффективность данных препаратов должна быть сохранена путем ограничения их использования — только в ситуациях полирезистентных патогенов. ХинолоныФторхинолоны являются дериватами налидиксовой кислоты. Они ингибируют репликацию ДНК путем связывания бактериальной топоизомеразы и имеют широкий спектр действия, охватывающий грамположительные и грамотрицательные микроорганизмы, включая пенициллинустойчивые пневмококки, метициллинрезистентные стафилококки, Enterobacteriaceae, M. catarrhalis, β-лактамазопродуцирующий H. influezae, Shigella, Salmonella и Neisseria spp. Они также активны в отношении синегнойной палочки, наибольшая активность среди всех фторхинолонов — у ципрофлоксацина. Атипичные микроорганизмы (микоплазма, хламидия, легионелла, уреаплазма) и штаммы микобактерий также чувствительны к фторхинолонам. Эти препараты не разрешены для применения у детей. Это ограничение связано с риском развития хинолонассоциированных артропатий, обнаруженных в доклинических исследованиях. Тем не менее эти препараты при необходимости иногда используются в педиатрической практике. В США ежегодное количество назначений ципрофлоксацина у пациентов в возрасте младше 18 лет достигает 150 000, из них 20 % — у детей младше 1 года [67]. Комитет по инфекционным болезням Американской академии педиатров очертил клинические ситуации, в которых фторхинолоны могут использоваться у детей: бронхолегочные инфекции на фоне муковисцидоза, осложненные инфекции мочевой системы, хронический гнойный средний отит, полирезистентные грамотрицательные бактериальные инфекции на фоне иммуносупрессии, сальмонеллез и шигеллез, вызванные резистентными штаммами, а также резистентный к лечению туберкулез [68]. Накоплено достаточно данных о безопасном использовании этих препаратов (преимущественно ципрофлоксацина) у детей. Единичные наблюдения и ретроспективные когортные исследования, в основном у детей с муковисцидозом, не продемонстрировали связи с развитием необратимой артропатии [69, 70]. Однако важно понимать, что использование фторхинолонов в педиатрии должно быть ограничено для сохранения их эффективности как препаратов резерва. ВыводыАнтибактериальные препараты относятся к одним из наиболее часто назначаемых лекарственных средств в педиатрической практике. Их правильное использование требует знания фармакокинетики, фармакодинамики и токсического профиля. В целом переносимость детьми антибиотиков достаточно хорошая. К назначению антибактериальных средств нужно подходить с осторожностью для сохранения их эффективности у детей. Предполагается, что арсенал антибиотиков, разрешенных для применения в педиатрии, будет расширяться. По материалам Infect. Dis. Clin N. Am. — 2004. 18 513-531 www.mif-ua.com Антибиотики в педиатрии. Почему детей лечат неправильно? | Здоровье ребенка | ЗдоровьеВ последние годы к нам в клинику стали нередко поступать дети с пневмониями, отитами и другими инфекциями органов дыхания, которые вообще-то должны были проходить лечение амбулаторно. Но, несмотря на терапию антибиотиками, состояние детей ухудшалось и они поступали в стационар. Научный диагнозПочему так происходило? В процессе наблюдения мы выявили, что из 32 больных с типичной пневмококковой пневмонией, начавших лечение до госпитализации, лишь один ребёнок получал амоксициллин (см. таблицу 1)! А остальные дети получали антибиотики из двух других групп: это были макролиды (обычно назначали азитромицин и кларитромицин) и оральные цефалоспорины третьего поколения (цефиксим, цефтибутен). Похожая ситуация была и у детей с острыми средними отитами (см. таблицу 2). Очевидно, что дети с пневмонией и отитами, получавшие адекватные дозы амоксициллина, в госпитализации не нуждались. А вот с макролидами и цефалоспоринами третьего поколения всё было иначе. Мы пришли к выводу, что препараты двух последних групп не стоит назначать при обычных воспалениях лёгких, синуситах, отитах, ангинах. Сами по себе это хорошие лекарства, но их нужно использовать при других заболеваниях. Однако, как это ни прискорбно, врачи при этих заболеваниях прописывают их очень широко. Детей лечили вроде бы современными антибиотиками, но они им не помогали. В поисках причинПочему эти неплохие лекарства оказались неэффективны у многих детей? Подчеркну, всё это были достаточно «сильные» препараты, но бактерии, вызывающие пневмонии, отиты и другие респираторные инфекции (обычно это пневмо- и стрептококки), оказывались к ним резистентны. Не секрет, что антибиотики нередко назначают необоснованно — гораздо чаще, чем нужно. Эти препараты реально спасают жизни, и, возможно, руководствуясь этим, врачи рекомендуют их очень широко, чтобы не пропустить серьёзную инфекцию. Но это не лекарства на всякий случай, так лечить ими нельзя. У нас же дают их при вирусных инфекциях чуть ли не всем детям. Хотя каждый врач прекрасно знает, что против вирусов эти препараты не только бесполезны, но даже вредны. Подавляя привычную флору, они способствуют развитию бактериальных инфекций. И происходит это с самого раннего детства. Ведь в возрасте до года у нас не получали антибиотики только 10 процентов детей, то есть один из десяти. А пропорция должна быть обратная — 90 процентам малышей нет нужды назначать эти лекарства. И как результат — рост устойчивости наиболее частых возбудителей респираторных инфекций (пневмококков и стрептококков) к тем препаратам, которыми врачи злоупотребляют. Хотели как лучше — получилось как всегдаПочему же злоупотребляют именно макролидами и цефалоспоринами? Как сложилась такая ситуация? У врачей есть понятное желание выписывать новые, более «современные» препараты. И когда лет 15–20 назад они стали лечить воспаление лёгких препаратами азитромицина, а это был новый и популярный препарат из группы макролидов, тогда он работал хорошо. К тому же препарат был очень удобен в применении. В силу этих причин антибиотик назначали излишне широко. В результате за эти годы ситуация изменилась, бактерии выработали к нему устойчивость. И сегодня этот макролид стоит использовать только при так называемой атипичной пневмонии, кишечных инфекциях и ряде других болезней. С цефалоспоринами третьего поколения, как нам кажется, ситуация несколько иная. Это препараты новые, дорогие — и, естественно, многие врачи думают, что это залог их высокой эффективности. Но дело в том, что в официальной инструкции к ним даже нет указания, что их нужно назначать при воспалении лёгких. Написано лишь, что они эффективны против пневмококков. Но, как показывает опыт, современные пневмококки, вызывающие отиты и пневмонию, к ним чувствительность потеряли. Так что в большинстве случаев при этих инфекциях толку от них мало. А вот стрептококковую ангину они лечат отлично. Её возбудители к ним чувствительны. Ещё одна проблема, которая приводит к неоправданно широкому использованию антибиотиков, — неправильное поведение родителей. Нередко бывает так, что они самостоятельно и даже без консультации с врачом дают детям (а порой и себе тоже) те препараты, которыми лечились ранее, и часть их осталась в аптечке. Они полагают: если помогло раньше, то почему не поможет и сейчас? Часто они покупают препараты заново — антибиотики относятся к рецептурным лекарствам, но провизоры их часто отпускают свободно, давая советы, которые, как правило, основаны на сведениях, полученных ими давным-давно. В результате рост устойчивости бактерий к антибиотикам у нас в стране просто колоссальный. Такая резистентность в России больше, чем в США и ряде других стран, где проводятся государственные программы снижения неоправданного применения антибиотиков. Например, в 2003–2007 годах во Франции проводилась специальная программа по сокращению применения антибиотиков при острых респираторных заболеваниях. За 4 года там снизили частоту назначения этих лекарств на 26,5%, а у детей 6–15 лет ещё больше — на 35,8%. Как следствие, существенно уменьшился и процент пневмококков, устойчивых к антибиотикам: резистентность к пенициллину снизилась с 47% до 32%, а к макролидам — с 49% до 36%. Естественно, возникает вопрос: чем заменить эти неэффективные антибиотики? Ответ очевиден — средствами, которые сегодня многим кажутся «более простыми» и которые уж точно более дешёвые. Это препараты амоксициллина. Они весьма доступны, и под разными фирменными названиями сегодня продаётся много дженериков, содержащих это активное вещество. К сожалению, такие лекарства врачи почему-то применяют незаслуженно редко, а если и назначают, то часто в недостаточных — малоэффективных — дозах. Например, когда при пневмонии и отитах этот препарат назначали в суточной дозе меньше 45 мг/кг веса, он часто оказывался неэффективным. А вот в более высокой дозе работал отлично (см. таблицы 1 и 2). Рекомендации по лечению антибиотиками детейПри отите, синусите, внебольничной типичной пневмонии, стрептококковом тонзиллите средствами выбора являются оральные препараты амоксициллина или амоксициллина с клавулановой кислотой, а также парентеральные цефалоспорины 2–3-го поколения. При этих респираторных заболеваниях макролиды (особенно 14-,15‑членные — эритромицин, азитромицин и кларитромицин) больше не рекомендуются из-за резистентности к ним пневмококков и гемолитического стрептококка. Для монотерапии макролиды используются только при атипичных пневмониях (микоплазмоз, хламидиоз), а также при инвазивных кишечных и генитальных инфекциях, при хеликобактериозе в составе комплексной терапии. Оральные цефалоспорины 3-го поколения (цефиксим и цефтибутен) используют только для лечения стрептококковой инфекции, а также кишечных и мочевых инфекций. Таблица 1. Эффективность антибиотиков при остром среднем отите, назначаемых в амбулаторных условиях, 2013–2014 гг.
Таблица 2. Эффективность антибиотиков, назначаемых в амбулаторных условиях, при типичной пневмонии, 2013–2014 гг.
www.aif.ru Антибиотики: применение в педиатрииАнтибиотики были открыты еще в 20-х годах ХХ века, и с тех пор эти лекарства совершили настоящий переворот в медицине. Благодаря препаратам удалось спасти тяжелобольных пациентов, и долгое время они назначались практически бесконтрольно. В последние годы ситуация изменилась. В каких случаях сегодня назначаются антибиотики для детей , расскажет IllnessNews. Когда нужны антибиотики Антибиотики — препараты, действующие в основном против бактерий, некоторые виды активны также против грибковых инфекций. Поэтому применять лекарства при любых заболеваниях, считая их просто наиболее сильными медикаментами, нецелесообразно. Проблема выбора правильного лечения чаще всего возникает при респираторных заболеваниях — именно ими несколько раз в год болеют дети. При этом подавляющее большинство ОРЗ начинается с вирусной инфекции, а значит, антибактериальные препараты против нее бессильны. Однако если болезнь лечится неправильно или у ребенка ослаблен иммунитет, начальная ОРВИ может перерасти в бактериальное осложнение — на фоне вирусного заболевания активизируются бактерии. И в этом случае антибиотики будут правильным выбором для адекватной терапии. При этом в современной педиатрии все же врачи предпочитают выбирать выжидательную тактику. Дело в том, что организм может самостоятельно справиться и с бактериальной инфекцией, поэтому антибактериальные препараты назначаются только в крайних случаях. Ребенок с такой болезнью просто находится под постоянным наблюдением врача, и, если ситуация ухудшается или нет заметных улучшений, назначаются антибиотики. Однозначно подтвердить наличие бактериальной инфекции могут только анализы. Однако характерные симптомы должны стать поводом к обращению к врачу и рассмотрению целесообразности приема антибактериальных препаратов:
Лечение пневмонии у детейБактериальная пневмония у детей чаще всего развивается именно как осложнение неправильно пролеченной вирусной инфекции. Однако, по статистике, в возрасте 5-6 лет половина случаев воспаления легких провоцируется вирусами. Позже картина меняется, и уже к подростковому возрасту большинство пневмоний у детей связано с пневмококками или другими бактериями. Поэтому тактика лечения при одном и том же диагнозе может существенно отличаться. Лучше всего для выбора правильной терапии сдать необходимые анализы — исследовать кровь и мокроту. Нужно помнить, что рентгеновский снимок показывает наличие пневмонии , но не определяет ее природу. В том случае если диагноз подтвержден и болезнь вызвана бактериями, лечение антибиотиками назначается немедленно. Течение воспаления легких может быть довольно тяжелым, поэтому выжидательная тактика при таком диагнозе не выбирается. Лечение отита у детей 40-60% случаев отита у детей — это бактериальная инфекция. Именно поэтому раньше при таком диагнозе антибиотики назначались в обязательном порядке. Однако последние исследования показали, что такое лечение не всегда оправдано. Острый отит у детей развивается в первые 24-48 часов после начала болезни. Он отличается такими симптомами:
При этом признаки болезни проходят без лечения антибиотиками у 2/3 пациентов и только приблизительно у 35% они перерастают в серьезные осложнения. Поэтому прием антибактериальных препаратов в первые двое суток после начала заболевания нецелесообразен. Ребенок в это время должен находиться под постоянным контролем врача, и только если маленькому пациенту не станет легче, педиатр назначает антибиотики. Лечение бронхитаВ современной медицинской практике детский бронхит не является показанием к назначению антибактериальных средств. Более того, педиатры настаивают, что воспаление бронхов может провоцироваться не только бактериями или вирусами, но и быть результатом аллергической реакции. Поэтому в основу лечения, кроме лекарств симптоматической терапии, часто включают спазмолитики и антигистаминные средства. Характерными особенностями аллергического бронхита являются:
Такую болезнь недопустимо лечить антибактериальными средствами — антибиотики для детей с аллергией могут вызвать серьезное ухудшение состояния, а вот на сам бронхит никак не повлияют. Оставлять такое недомогание без лечения тоже недопустимо — аллергические реакции опасны тем, что могут привести к бронхиальной астме. Любой бронхит может перерастать в опасные осложнения, например, в возрасте 3-12 лет часто развивается пневмония у детей. Поэтому самолечение воспаления недопустимо. Ребенок должен постоянно находиться под контролем педиатра, который будет регулярно прослушивать дыхательные пути и контролировать течение болезни. Осложнения при лечении антибиотиками В большинстве случаев для лечения респираторных заболеваний назначаются антибиотики широкого спектра действия, а это значит, что они будут убивать не только патогенную, но и полезную микрофлору. Особенно опасны последствия такой терапии для организма ребенка. Прием антибактериальных средств может приводить к таким осложнениям:
Перечень антибиотиков для детейАнтибиотики для детей назначает только врач, самолечение такими препаратами может приводить к тяжелым последствиям. В частности, если родители начинают давать медикаменты на этапе вирусной инфекции, препараты, наоборот, увеличивают риск развития осложнений, ведь существенно влияют на привычную микрофлору ребенка, ослабляют ее. Если по показаниям такие препараты все же необходимы, педиатр чаще всего назначает следующие виды антибиотиков для детей:
illnessnews.ru |
г.Самара, ул. Димитрова 131 [email protected] |
 |