Вакцинация против гепатита В пациентов, страдающих хроническими заболеваниями печени и хроническими вирусными гепатитами | #02/11
В настоящее время установлено, что микст-инфекции гепатит В + гепатит С (ГВ+ГС) достаточно широко распространены среди населения и имеют тенденцию к росту. Они возникают в результате одновременного заражения здорового человека вирусами гепатитов (например, при переливании крови или использовании одной иглы у наркоманов, применяющих психоактивные вещества внутривенно) или при заражении больного хроническим гепатитом другим гепатотропным вирусом. Несмотря на то, что при смешанных формах гепатитов вирус ГВ (ВГВ) может снижать репликативную активность вируса ГС (ВГС), оба вируса усиливают тяжесть поражения печени и риск развития цирроза и первичного рака печени. Так, при гистологических исследованиях печени пациентов с хроническим ГВ (ХГВ) и хроническим ГС (ХГС) и больных с ХГВ, ХГС и хроническим ГD (ХГD) было установлено, что микст-инфекция характеризуется более тяжелым поражением печени по сравнению с таковым при моноинфекции — хроническим вирусным гепатитом С (ХГС) [1]. В другом контролированном исследовании у пациентов, которые были носителями одновременно ВГВ и ВГС, чаще развивался цирроз, в сравнении с больными, страдающими только ГС. Наконец, при наличии ко-инфекций ВГВ и ВГС или ВГВ и ВГD высока вероятность развития фульминантного гепатита [1].
В другом контролированном исследовании у пациентов, которые были носителями одновременно ВГВ и ВГС, чаще развивался цирроз, в сравнении с больными, страдающими только ГС. Наконец, при наличии ко-инфекций ВГВ и ВГС или ВГВ и ВГD высока вероятность развития фульминантного гепатита [1].
В связи с усилением тяжести хронических заболеваний печени (ХЗП) при инфицировании ВГВ, а также наличии высокой частоты случаев смешанных (микст) инфекций, вызванных вирусами ГВ и ГС, вакцинация против гепатита В представляется весьма актуальной. Поэтому Консенсусная комиссия по вопросам лечения ГС, созванная Национальным институтом здоровья США, рекомендует пациентам с хроническим ГС проводить вакцинацию как против ГВ, так и против ГА [1]. В то же время Совещательный комитет по практике иммунизации Центра контроля заболеваемости рекомендует иммунизацию лиц с хроническими заболеваниями печени только вакциной против ГА [1]. Однако поскольку все пациенты с хроническими заболеваниями печени имеют высокий риск тяжелого заболевания печени, то в случае если они будут инфицированы вирусом ГА (ВГА), с угрозой его прогрессирования в конечную стадию — цирроз, и могут в последующем нуждаться в пересадке печени с риском вновь инфицирования ВГВ, целесообразным является вакцинация пациентов с хроническими заболеваниями печени как против ГА, так и против ГВ уже в самом начале заболевания [1].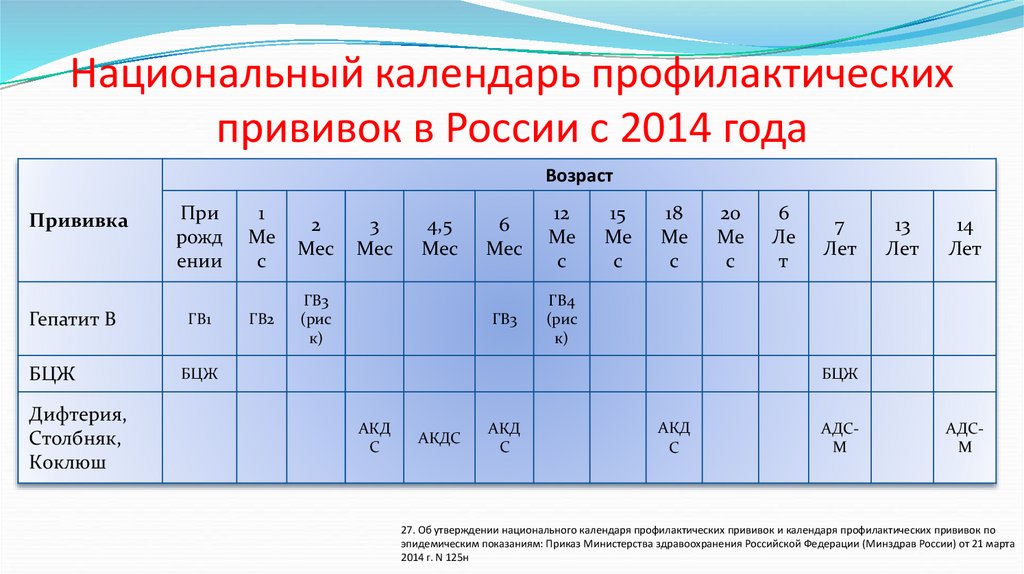
Результаты, полученные отечественными авторами, свидетельствуют о том, что у больных ХЗП и особенно с ХГС снижается эффективность вакцинации против ГВ и антитела (анти-HBs) вырабатываются у них в меньших титрах [2]. При иммунизации против ГВ здоровых лиц и носителей анти-ВГС было выявлено, что в процентном соотношении частота сероконверсий у ответивших на вакцинацию лиц с наличием анти-ВГС была сходной с показателями, зарегистрированными у лиц без анти-ВГС, а спустя три месяца после завершения полного курса вакцинации против ГВ составила 96,4% в обеих группах. Однако у лиц с наличием анти-ВГС интенсивность выработки антител к HBsAg была ниже как после 2-го, так и после 3-го введения вакцины. По окончании курса вакцинации антитела к ВГВ в титре 10–1000 МЕ/л и свыше 1000 МЕ/л были достоверно ниже у лиц с наличием анти-ВГС в сравнении с таковыми у здоровых лиц [2].
Аналогичные данные были получены зарубежными исследователями [1, 3]. В рамках международного исследования по оценке безопасности и иммуногенности вакцины против ГВ у пациентов с разными хроническими заболеваниями печени была проведена вакцинация рекомбинантной вакциной против ГВ — Энджерикс В в дозе 20 мкг по схеме 0, 1 и 6 месяцев Из исследования исключали пациентов, у которых имелись анти-HBs или антитела к вирусу иммунодефицита человека; принимающих иммуносупрессивные препараты в течение последних 6 месяцев; болеющих декомпенсированными заболеваниями печени; получавших интерферон за 3 месяца до начала исследования.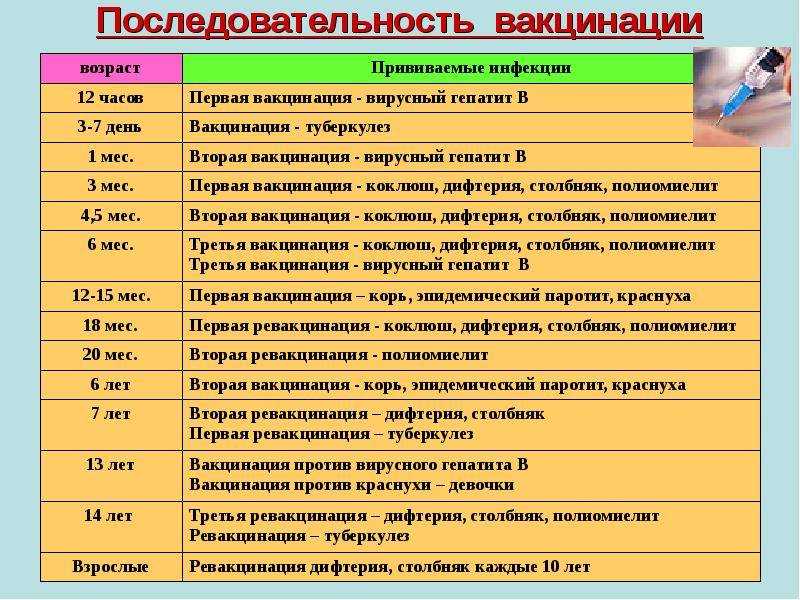 67 больных (21 женщина, 46 мужчин) с хроническим ГС были включены в группу вакцинированных против ГВ, с исследованием образцов сывороток крови через один месяц после введения третьей дозы. У всех пациентов с ГС выработались антитела к поверхностному антигену ВГВ в титрах, превышающих 10 МЕ/л. Среднее геометрическое титров антител составило 1260 МЕ/л, однако таковые были ниже, чем у здоровых взрослых людей [1].
67 больных (21 женщина, 46 мужчин) с хроническим ГС были включены в группу вакцинированных против ГВ, с исследованием образцов сывороток крови через один месяц после введения третьей дозы. У всех пациентов с ГС выработались антитела к поверхностному антигену ВГВ в титрах, превышающих 10 МЕ/л. Среднее геометрическое титров антител составило 1260 МЕ/л, однако таковые были ниже, чем у здоровых взрослых людей [1].
M. Durand с соавторами [3] изучили результаты вакцинации препаратом Энджерикс B 46 больных хроническим гепатитом С (средний гистологический индекс Кноделя активности процесса у больных — 5,7 ± 3,4; серонегативных по НВsAg, анти-HBs и анти-НВс). В сравнении со здоровыми лицами (группа сравнения) поствакцинальные анти-НВs антитела среди больных ХГС выявляли несколько реже (87% и 76% соответственно). Отмечена хорошая переносимость вакцины, а также отсутствие изменений в уровнях концентрации ВГС в течение трех месяцев, прошедших от начала вакцинации.
Существует целый ряд факторов, которые могут влиять на развитие гипореактивности у лиц с хроническим поражением печени, снижая эффективность вакцинации против ГВ:
- иммуносупрессия, вызванная основным заболеванием;
- мужской пол, пожилой возраст, курение, употребление алкоголя;
- длительность и степень поражения печени;
- латентная инфекция, вызванная ВГВ;
- генетически опосредованная слабая «отвечаемость» на ВГВ.

В связи с этим перед исследователями встал вопрос, как преодолеть гипореактивность больных ХЗП и достичь адекватного иммунного ответа организма на введение вакцины. В настоящее время усилиями специалистов разработаны общие рекомендации по применению вакцины против ГВ у больных ХЗП и ВГС-инфицированных лиц, которые содержат следующие основные позиции.
- Увеличение дозы вакцины до 40 мг (вместо стандартных 10–20 мг).
- Применение удлиненной схемы иммунизации (0, 1, 2 и 12 месяцев).
- Введение вакцины независимо от вирусной нагрузки и генотипа ВГС.
- Отмена вакцинации у лиц с циррозом печени (декомпенсированный цирроз является абсолютным противопоказанием) [2].
Опубликованные на сегодняшний день исследования свидетельствуют, что вакцинация против ГВ безопасна и иммуногенна у пациентов с хроническими заболеваниями печени легкой и средней степени тяжести без декомпенсации, однако отмечается слабая иммуногенность вакцины у пациентов с выраженным циррозом и у реципиентов трансплантатов печени. Это подтверждается результатами, полученными при вакцинации пациентов с тяжелыми заболеваниями печени и реципиентов трансплантатов печени, которые получали иммуносупрессивную терапию. Sokal и соавт. проводили иммунизацию перед трансплантацией печени и достигли защиты против ГВ у 73,3% детей с атрезией желчных путей, однако только у 54,6% из них защитные титры антител сохранялись через 1–15 месяцев после трансплантации печени. Большинство этих пациентов получили Хевак В («Пастер», Париж, Франция), и лишь некоторые — Энджерикс В.
Это подтверждается результатами, полученными при вакцинации пациентов с тяжелыми заболеваниями печени и реципиентов трансплантатов печени, которые получали иммуносупрессивную терапию. Sokal и соавт. проводили иммунизацию перед трансплантацией печени и достигли защиты против ГВ у 73,3% детей с атрезией желчных путей, однако только у 54,6% из них защитные титры антител сохранялись через 1–15 месяцев после трансплантации печени. Большинство этих пациентов получили Хевак В («Пастер», Париж, Франция), и лишь некоторые — Энджерикс В.
В исследовании, проведенном в Университете Питтсбурга, ответ на иммунизацию вакциной Гептавакс В в дозе 20 мкг (3 дозы в течение трех последовательных месяцев) колебался в границах от 44% до 54% у пациентов с поражениями печени в терминальной стадии. Chasalani и соавт. оценивали эффект вакцины Энджерикс В в дозе 20 мкг у пациентов, ожидающих трансплантации печени (схема 0, 1 и 2 месяца), и реципиентов трансплантатов печени (схема 0, 1 и 3 месяца). Из 57 пациентов, ожидающих трансплантации, только у 9 (16%) получен положительный результат, при этом пациенты с холестатическими заболеваниями печени имели иммунный ответ значительно чаще, чем пациенты с нехолестатическими заболеваниями (43% против 7% соответственно).
В другом исследовании вакцинации против ГВ реципиентов трансплантатов печени с применением двойной дозы рекомбинантной вакцины 56 из 140 привитых (40%) ответили выработкой анти-HBs антител в титрах > 10 МЕ/л.
Большой практический интерес вызывают терапевтические возможности вакцины против ГВ, особенно при вакцинации лиц, являющихся носителями ГВ-вируса или страдающих хХГВ и/или ХГС, а также влияние ее на иммунологические и биохимические показатели у привитых.
Вакцинотерапия ХГВ основывается на специфическом усилении Т-клеточного ответа у хронически инфицированных больных. Вакцинация способствует пролиферации HВsAg-специфических Т-лимфоцитов, которые, в свою очередь, продуцируют гамма-интерферон и принадлежат к Тх1-типу. Снижение уровня ВГВ ДНК в сыворотке этих пациентов позволяет предполагать, что индукция CD4+ Т-клеточного ответа в ходе вакцинотерапии может играть существенную роль в контроле над виремией [4]. При провeдении мультицентрового контролируемого исследования было показано, что специфическая вакцинотерапия стандартными вакцинами против ГВ способствует снижению репликации ВГВ у 50% хронических вирусоносителей [5, 6].
Возможный терапевтический эффект рекомбинантной вакцины Комбиотех был изучен у 55 носителей ВГВ и больных ХГВ умеренной степени активности, получавших патогенетическую терапию [7]. Часть пациентов (группа сравнения) на фоне общепринятой терапии получала нуклеинат натрия. Критериями включения пациентов в исследование являлись: возраст от 16 до 55 лет, повышение сывороточной активности АЛТ не менее чем в два раза выше верхней границы нормы в течение 6 месяцев до начала исследования. Из наблюдения исключали больных, ранее получавших иммунодепрессанты, стероиды или противовирусные препараты, а также больных, злоупотреблявших алкоголем или наркотиками [7].
Вакцину Комбиотех вводили внутримышечно в область дельтовидной мышцы в объеме 1 мл 1 раз в месяц в течение трех месяцев. Курс терапии нуклеинатом натрия по 0,5 г 3 раза в день составил 5 дней.
Анализ полученных данных позволил установить, что введение вакцины способствовало постепенному снижению активности АЛТ. В группе больных ХГВ, получивших только вакцину, уровень АЛТ за 5 месяцев снизился в 3,9 раза, за то же время в контрольной группе — в 1,2 раза. В группе больных, получивших вакцину и нуклеинат натрия, наблюдалось более существенное снижение уровня АЛТ.
В группе больных, получивших вакцину и нуклеинат натрия, наблюдалось более существенное снижение уровня АЛТ.
Изучение иммунологической активности вакцины выявило, что уже после первой инъекции вакцины у больных ХГВ отмечалось некоторое снижение титра HBsAg, а через два месяца после третьей инъекции вакцины процент больных, у которых HBsAg обнаруживался в довольно высоких титрах (6000 МЕ/л и выше), уменьшился в 1,4 раза (35 ± 11%), соответственно уменьшился и титр антигена (65 ± 11%). В группе хронических носителей HBsAg до лечения вакциной наибольший титр антигена наблюдался у 34 ± 12% больных, а через два месяца после последней инъекции вакцины — лишь у одного носителя. Более того, у одного носителя HBsAg через два месяца после окончания лечения вакциной в сыворотке крови появились антитела к нему в концентрации 11,2 МЕ/л.
В группе больных, пролеченных вакциной и нуклеинатом натрия, только у 10% пациентов после лечения обнаруживался HBsAg в высоких титрах (6000 МЕ/л и выше), что позволило сделать вывод об усилении иммуногенности вакцины нуклеинатом натрия. В этих группах больных (получавших вакцину и нуклеинат натрия) также наблюдалась положительная сероконверсия. Так, у одного больного с ХГВ и у одного носителя HBsAg уже через один месяц после окончания лечения вакциной с адьювантом (нуклеинат натрия) появились антитела к поверхностному антигену в концентрации 15,6 и 12,6 МЕ/л соответственно. Через два месяца после лечения еще у одного носителя HBsAg появились антитела в концентрации 27,2 МЕ/л.
В этих группах больных (получавших вакцину и нуклеинат натрия) также наблюдалась положительная сероконверсия. Так, у одного больного с ХГВ и у одного носителя HBsAg уже через один месяц после окончания лечения вакциной с адьювантом (нуклеинат натрия) появились антитела к поверхностному антигену в концентрации 15,6 и 12,6 МЕ/л соответственно. Через два месяца после лечения еще у одного носителя HBsAg появились антитела в концентрации 27,2 МЕ/л.
В процессе исследования была выявлена вариабельность изменений в показателях иммунного статуса на вводимые дозы вакцины как у больных ХГВ, так и у носителей HBsAg. Первое введение вакцины у больных ХГВ привело к активации иммунологической реактивности, т. е. отмечалось достоверное уменьшение количества Т-супрессоров, увеличение уровня Т-хелперов и иммуноглобулинов классов А, М, G, снижение концентрации нулевых клеток, а второе — к супрессии: снизилось содержание Т-супрессоров, Т-хелперов, IgА. После третьего введения вакцины уровень Т-супрессоров, Т-хелперов, нулевых лимфоцитов и иммуноглобулинов класса IgG вернулся к исходному. У носителей HBsAg первичное введение вакцины обусловило снижение уровня Т-супрессоров, В-клеток, IgМ и увеличение IgA. Авторы считают, что для усиления иммунологического ответа (особенно после второй и третьей инъекции) следует назначать адъюванты [7].
У носителей HBsAg первичное введение вакцины обусловило снижение уровня Т-супрессоров, В-клеток, IgМ и увеличение IgA. Авторы считают, что для усиления иммунологического ответа (особенно после второй и третьей инъекции) следует назначать адъюванты [7].
Таким образом, с помощью введения вакцины против гепатита В, вероятно, можно значительно уменьшить число носителей HBsAg и снизить репликацию ГВ-вируса и активность процесса у больных ХГВ.
Также были оценены безопасность, иммуногенность и возможный терапевтический эффект применения вакцины против ГВ у пациентов с ХГС. Все обследуемые были разделены на три группы: группа I — 26 пациентов с ХГС; группа II — 35 здоровых лиц; группа III — 30 пациентов с ХГС, не получавших вакцины против гепатита В, в качестве контроля. Лицам из I и II групп вводили три дозы (20 мг/доза) рекомбинантной вакцины против ГВ по схеме 0, 1 и 6 месяцев. Для серологического тестирования образцы крови пациентов собирали до и через 1 месяц после каждой дозы вакцины. Пациенты из I и II групп имели протективный уровень анти-HBs после первой дозы вакцины в 30,8% и 17,1% случаев, второй — в 61,5% и 60%, третьей — в 88,5% и 91,4% соответственно. Средние геометрические значения титров анти-HBs в группах также существенно не различались и спустя 7 месяцев после вакцинации составили 360 и 581 МE/мл соответственно. В период вакцинации у пациентов с ХГС отмечалось достоверное снижение уровня АЛТ после трех введений вакцины. По мнению авторов [8], вакцинация против ГВ является безопасной и иммуногенной для пациентов с ХГС. Она не снижает уровень РНК ВГС, но стимулирует снижение уровней АЛТ.
Пациенты из I и II групп имели протективный уровень анти-HBs после первой дозы вакцины в 30,8% и 17,1% случаев, второй — в 61,5% и 60%, третьей — в 88,5% и 91,4% соответственно. Средние геометрические значения титров анти-HBs в группах также существенно не различались и спустя 7 месяцев после вакцинации составили 360 и 581 МE/мл соответственно. В период вакцинации у пациентов с ХГС отмечалось достоверное снижение уровня АЛТ после трех введений вакцины. По мнению авторов [8], вакцинация против ГВ является безопасной и иммуногенной для пациентов с ХГС. Она не снижает уровень РНК ВГС, но стимулирует снижение уровней АЛТ.
Большой интерес представляют данные [9] об эффективности комплексной терапии ХГВ и В+С интерфероном альфа и вакциной против гепатита В. В исследование было включено 20 больных с ХГВ и 8 — с ХГ В+С, в возрасте от 20 до 52 лет (средний возраст 37,9 ± 11,36 года). Низкая активность инфекционного процесса была установлена у 37,5% пациентов, а минимальная — у 64,3%.
Все больные получали вакцину против ГВ (Эувакс В) в дозе 20 мкг или H-B — VAX II в дозе 10 мкг) по схеме 0, 2, 6 месяцев. Первая инъекция вакцины в двойной дозе (Эувакс В в дозе 40 мкг или H-B — VAX II в дозе 20 мкг) делалась до начала терапии альфа-2 бета-интерфероном (Интрон, Schering-Plough) в дозе 3 млн МЕ по схеме: 1 инъекция в 3 дня в течение 4–9 месяцев. Иммунологическое обследование (субпопуляционный профиль лимфоцитов, функции фагоцитоза и сывороточные иммуноглобулины) проводили до начала лечения и каждые 1–2 месяца в ходе лечения до наступления сероконверсии. Сероконверсией (конец лечения) считали исчезновение антигенов ВГВ в крови, исчезновение антител к ВГС (IgM) и Hbcor и появление антител к HВsAg, по данным иммуноферментного анализа (ИФА). Середина лечения характеризовалась появлением антител к НВеAg и отрицательными результатами полимеразной цепной реакции (ПЦР) сыворотки крови на ВГВ или ВГС (что соответствовало вирусологическому ответу). Контрольную группу составили 30 практически здоровых доноров (средний возраст 26,4 ± 4,1 года), у которых были исключены хронические инфекционные заболевания (ВГВ, ВГС, цитомегаловирусная инфекция и хламидиоз).
Первая инъекция вакцины в двойной дозе (Эувакс В в дозе 40 мкг или H-B — VAX II в дозе 20 мкг) делалась до начала терапии альфа-2 бета-интерфероном (Интрон, Schering-Plough) в дозе 3 млн МЕ по схеме: 1 инъекция в 3 дня в течение 4–9 месяцев. Иммунологическое обследование (субпопуляционный профиль лимфоцитов, функции фагоцитоза и сывороточные иммуноглобулины) проводили до начала лечения и каждые 1–2 месяца в ходе лечения до наступления сероконверсии. Сероконверсией (конец лечения) считали исчезновение антигенов ВГВ в крови, исчезновение антител к ВГС (IgM) и Hbcor и появление антител к HВsAg, по данным иммуноферментного анализа (ИФА). Середина лечения характеризовалась появлением антител к НВеAg и отрицательными результатами полимеразной цепной реакции (ПЦР) сыворотки крови на ВГВ или ВГС (что соответствовало вирусологическому ответу). Контрольную группу составили 30 практически здоровых доноров (средний возраст 26,4 ± 4,1 года), у которых были исключены хронические инфекционные заболевания (ВГВ, ВГС, цитомегаловирусная инфекция и хламидиоз).
Сочетанная терапия «вакцина + альфа-2 бета-интерферон» позволила получить подавление вирусной репликации в первые 1–2 месяца от начала лечения у 78,6% больных, сероконверсию HВsAg на анти-HВs — у 96,4%. Исчезновение HВеAg наблюдалось через 6 месяца у всех больных, а анти-HВе через 2–3 месяца от начала лечения появились у всех больных. Наблюдение за пациентами в течение трех лет и более показало, что стойкий ответ на лечение отмечался у 24 (85,7%). К концу лечения нормализовались все популяции лимфоцитов, высоким оставался только уровень лимфоцитов, экспрессирующих рецептор к ИЛ-2 (CD25+), оставались сниженными резервы фагоцитоза и кислородзависимого киллинга [5].
Таким образом, вакцинация против ГВ является актуальной и необходимой больным с ХЗП, пациентам с ХГВ и/или ХГС, носителям ВГВ и/или ВГС, поскольку способствует подавлению вирусной репликации у хронических вирусоносителей, может играть существенную роль в контроле над виремией, значительно повышает эффективность лечения ХВГ.
Литература
- Keeffe E. B. Vaccination against hepatitis A and B in chronic liver disease // Viral Hepatitis Review. 1999. Vol. 5. № 2. С. 77–88.
- Семененко Т. А. Вакцинация против гепатита А и В больных хроническими заболеваниями печени // Медицина для всех. 2001. № 1 (18). С. 25–27.
- Pediatrics. 2001; 107 (4): 626–631.
- Couillin I. et al. Specific vaccine therapy in chronic hepatitis B: induction of T cell proliferative responses specific for envelope antigens // J. Infect. Dis. 1999. 180. P. 15–26.
- Pol S. et al. Immunotherapy of chronic hepatitis B by anti HBV vaccine // Acta Gastroenterolog. Belg. 1998. № 61. P. 228–233.
- Pol S. et al. Specific vaccine therapy in chronic hepatitis B infection // Lancet. 1994. P. 344.
- Борисова В. Н. и др. Применение вакцины против вирусного гепатита В «Комбиотех» в комплексной терапии больных хроническим гепатитом В и носителей вируса гепатита В / Сб.
 Здоровье населения и среда обитания. М.: Медицина,1999. № 6 (75). С. 8–11.
Здоровье населения и среда обитания. М.: Медицина,1999. № 6 (75). С. 8–11. - Lee S. D. et al. Вакцинация против гепатита В пациентов с хроническим гепатитом С // J Мed. Virol. 1999. № 59 (4). С. 463–468.
- Курманова Г. М. Рекомбинантная Hbs-вакцина в комплексной терапии хронического вирусного гепатита В и В+С // Гигиена, эпидемиология и иммунология. 2003. № 3. С. 106–110.
В. П. Афиногенова, кандидат медицинских наук
М. П. Костинов,доктор медицинских наук, профессор
НИИ вакцин и сывороток им. И. И. Мечникова РАМН, Москва
Контактная информация об авторах для переписки: [email protected]
Эпидемиология вирусной инфекции гепатита В и влияние вакцинации на заболевание
1. Всемирная организация здравоохранения. Гепатит B. Доступно по адресу: www.who.int/topics/hepatitis/factsheets/en. По состоянию на 22 июня 2016 г.
По состоянию на 22 июня 2016 г.
2. Документ с изложением позиции ВОЗ в отношении вакцин против гепатита В – октябрь 2009 г. Wkly Epidemiol Rec. 2009; 84: 405–20. [Google Scholar]
3. Schweitzer A, Horn J, Mikolajczyk RT, et al. Оценки распространенности хронического вирусного гепатита В во всем мире: систематический обзор данных, опубликованных между 1965 и 2013. Ланцет. 2015;386(10003):1546–55. [PubMed] [Google Scholar]
4. GBD 2013 Смертность и причины смерти Сотрудники. Глобальная, региональная и национальная возрастно-половая смертность от всех причин и причинно-специфическая смертность по 240 причинам смерти, 1990–2013 гг.: систематический анализ для исследования глобального бремени болезней, 2013 г. . Lancet. 2015;385(9963):117–71. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Franco E, Bagnato B, Marino MG, et al. Гепатит В: эпидемиология и профилактика в развивающихся странах. Мир J Гепатол. 2012; 4:74–80. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Васли А., Крузон-Моран Д., Кунерт В. и соавт. Распространенность инфекции гепатита В в США в эпоху вакцинации. J заразить дис. 2010; 202:192–201. [PubMed] [Google Scholar]
Васли А., Крузон-Моран Д., Кунерт В. и соавт. Распространенность инфекции гепатита В в США в эпоху вакцинации. J заразить дис. 2010; 202:192–201. [PubMed] [Google Scholar]
7. Cohen C, Evans AA, London WT, et al. Недооценка хронического гепатита В в Соединенных Штатах Америки. J Вирусная гепатит. 2008; 15:12–3. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Национальные академии наук, инженерии и медицины. Устранение проблемы общественного здравоохранения, связанной с гепатитом В и С в Соединенных Штатах: отчет о первой фазе. Вашингтон, округ Колумбия: Издательство национальных академий; 2016. [Google Академия]
9. Roberts H, Kruszon-Moran D, Ly KN, et al. Распространенность инфекции, вызванной вирусом хронического гепатита В (ВГВ), в домохозяйствах США: Национальное обследование состояния здоровья и питания (NHANES), 1988–2012 гг. Гепатология. 2016;63(2):388–97. [PubMed] [Google Scholar]
10. Mitchell T, Armstrong GL, Hu DJ, et al. Растущее бремя завозного хронического гепатита В — США, 1974–2008 гг. ПЛОС Один. 2011;6:e27717. [Бесплатная статья PMC] [PubMed] [Google Scholar]
ПЛОС Один. 2011;6:e27717. [Бесплатная статья PMC] [PubMed] [Google Scholar]
11. Комитет Института медицины (США) по профилактике и борьбе с инфекциями вирусного гепатита. В: Grossblatt N, изд. Гепатит и рак печени: национальная стратегия профилактики и борьбы с гепатитами B и C. Вашингтон, округ Колумбия: National Academy Press; 2010. [Google Академия]
12. Weinbaum CM, Williams I, Mast EE и др. Центры по контролю и профилактике заболеваний (CDC) Рекомендации по выявлению и управлению общественным здравоохранением лиц с хронической инфекцией, вызванной вирусом гепатита B. MMWR Recomm Rep. 2008; 57:1–20. [PubMed] [Google Scholar]
13. Kowdley KV, Wang C, Welch S, et al. Распространенность хронического гепатита В среди лиц иностранного происхождения, проживающих в США, по стране происхождения. Гепатология. 2012;56:422–33. [PubMed] [Академия Google]
14. Доступно по адресу: http://www.cdc.gov/nchs/nhanes/about_nhanes.htm. По состоянию на 15 августа 2016 г.
15. Центры по контролю и профилактике заболеваний. Американцы азиатского происхождения и гепатит B. 2013 г. Доступно по адресу: http://www.cdc.gov/features/aapihepatitisb/. По состоянию на 1 мая 2015 г.
16. CDC. Надзор за вирусным гепатитом — США, 2014 г. Атланта, Джорджия: Министерство здравоохранения и социальных служб США, CDC; 2014. Доступно по адресу: http://www.cdc.gov/hepatitis/statistics/2014surveillance/index.htm. [Академия Google]
17. Harris AM, Iqbal K, Schillie S, et al. Рост острого вирусного гепатита В — Кентукки, Теннесси и Западная Вирджиния, 2006–2013 гг. MMWR Morb Mortal Wkly Rep. 2016;65(3):47–50. [PubMed] [Google Scholar]
18. Центры по контролю и профилактике заболеваний. Обновление: рекомендации по предотвращению передачи вируса гепатита В — США. MMWR Morb Mortal Wkly Rep. 1995; 44: 574–5. [PubMed] [Google Scholar]
19. Edmunds WJ, Medley GF, Nokes DJ, et al. Влияние возраста на развитие носительства гепатита В. Proc Biol Sci. 1993;253:197–201. [PubMed] [Google Scholar]
1993;253:197–201. [PubMed] [Google Scholar]
20. Hyams KC. Риски хронизации после острой вирусной инфекции гепатита В: обзор. Клин Инфекция Дис. 1995; 20: 992–1000. [PubMed] [Google Scholar]
21. Доступно по адресу: http://www.cdc.gov/hepatitis/Resources/Professionals/PDFs/ABCTable.pdf. По состоянию на 15 августа 2016 г.
22. Beasley RP, Trepo C, Stevens CE, et al. Е-антиген и вертикальная передача поверхностного антигена гепатита В. Am J Эпидемиол. 1977; 105: 94–98. [PubMed] [Академия Google]
23. МакМахон Б.Дж. Два ключевых компонента борьбы с хроническим гепатитом В у детей: выявление и профилактика. J Педиатр. 2015; 167:1186–1187. [PubMed] [Google Scholar]
24. Marinier E, Barrois V, Larouze B, et al. Отсутствие перинатальной передачи вирусной инфекции гепатита В в Сенегале, Западной Африке. J Педиатр. 1985; 106: 843–9. [PubMed] [Google Scholar]
25. Beasley RP, Hwang LY, Lee GC, et al. Профилактика перинатально передаваемых вирусных инфекций гепатита В с помощью вирусных инфекций гепатита В с помощью иммуноглобулина против гепатита В и вакцины против гепатита В. Ланцет. 1983;2:1099–102. [PubMed] [Google Scholar]
Ланцет. 1983;2:1099–102. [PubMed] [Google Scholar]
26. McMahon BJ, Alward WL, Hall DB, et al. Острая вирусная инфекция гепатита В: связь возраста с клиническими проявлениями заболевания и последующим развитием носительства. J заразить дис. 1985; 151: 599–603. [PubMed] [Google Scholar]
27. Beasley RP, Hwang LY, Lin CC, et al. Заболеваемость вирусными инфекциями гепатита В у детей дошкольного возраста на Тайване. J заразить дис. 1982; 146: 198–204. [PubMed] [Google Scholar]
28. Coursaget P, Yvonnet B, Chotard J, et al. Возрастно-половое исследование хронического носительства вируса гепатита В у детей раннего возраста из эндемичной зоны (Сенегал) J Med Virol. 1987;22:1–5. [PubMed] [Google Scholar]
29. Petersen NJ, Barrett DH, Bond WW, et al. Поверхностный антиген гепатита В в слюне, импетигинозных поражениях и окружающей среде в двух отдаленных деревнях на Аляске. Appl Environ Microbiol. 1976; 32: 572–4. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Bond WW, Favero MS, Petersen NJ, et al. Выживаемость вируса гепатита В после сушки и хранения в течение одной недели. Ланцет. 1981; 1: 550–1. [PubMed] [Google Scholar]
Bond WW, Favero MS, Petersen NJ, et al. Выживаемость вируса гепатита В после сушки и хранения в течение одной недели. Ланцет. 1981; 1: 550–1. [PubMed] [Google Scholar]
31. Центры по контролю и профилактике заболеваний. Рекомендации по профилактике передачи вируса иммунодефицита человека и вируса гепатита В пациентам во время экспозиционно-инвазивных процедур. Рекомендация MMWR, отчет 1991;40(RR-8):1–9. [PubMed] [Google Scholar]
32. Доступно по адресу: http://www.cdc.gov/hepatitis/outbreaks/pdfs/healthcareinvestigationtable.pdf. По состоянию на 15 августа 2016 г.
33. Контроль гепатита В посредством иммунизации: справочное руководство. Доступно по адресу: http://www.who.int/immunization/sage/meetings/2015/october/8_WPRO_Hepatitis_B_Prevention_Through_Immunization_Regional_Reference_Guide.pdf. По состоянию на 15 августа 2016 г.
34. Внедрение вакцины против гепатита В в службы иммунизации детей. Руководство по управлению, включая информацию для медицинских работников и родителей. Доступно по адресу: http://www.wpro.who.int/hepatitis/whovb0131.pdf. По состоянию на 13 мая 2016 г.
Доступно по адресу: http://www.wpro.who.int/hepatitis/whovb0131.pdf. По состоянию на 13 мая 2016 г.
35. Goldstein ST, Zhou FJ, Hadler SC, et al. Математическая модель для оценки глобального бремени болезни гепатита В и воздействия вакцинации. Int J Эпидемиол. 2005; 34: 1329–39. [PubMed] [Google Scholar]
36. Глобальный план действий ВОЗ по охране здоровья работающих (2008–2017 гг.), исходный уровень для реализации. Доступно по адресу: http://www.who.int/occupational_health/who_workers_health_web.pdf. По состоянию на 15 августа 2016 г.
37. Форде К.А., Танапанпанит О., Редди К.Р. Гепатит B и C у афроамериканцев: текущее состояние и сохраняющиеся проблемы. Клин Гастроэнтерол Гепатол. 2014;12(5):738–48. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Маст Э.Э., Марголис Х.С., Фиоре А.Е. и др. Комплексная стратегия иммунизации для устранения передачи вируса гепатита В в США: рекомендации Консультативного комитета по практике иммунизации (ACIP), часть 1: иммунизация младенцев, детей и подростков. MMWR Recomm Rep. 2005; 54:1–31. [PubMed] [Google Scholar]
MMWR Recomm Rep. 2005; 54:1–31. [PubMed] [Google Scholar]
39. Schillie S, Murphy TV, Fenlon N, et al. Обновление: укорочен интервал между поствакцинальными серологическими исследованиями детей, рожденных от матерей, инфицированных гепатитом В. MMWR Morb Mortal Wkly Rep. 2015; 64 (39)): 1118–20. [PubMed] [Google Scholar]
40. Доступно по адресу: http://www.cdc.gov/vaccines/schedules/index.html. По состоянию на 15 августа 2016 г.
41. Mast EE, Weinbaum CM, Fiore AE, et al. Консультативный комитет по практике иммунизации (ACIP) Центры по контролю и профилактике заболеваний (CDC) Комплексная стратегия иммунизации для устранения передачи вируса гепатита B инфекция в США: рекомендации Консультативного комитета по практике иммунизации (ACIP), часть II: иммунизация взрослых. MMWR Recomm Rep. 2006;55(RR-16):1–33. [викторина: CE1–4; Опечатка появляется в MMWR Morb Mortal Wkly Rep 2007;56(42):1114] [PubMed] [Google Scholar]
42. Schreeder MT, Bender TR, McMahon BJ, et al. Распространенность гепатита В в отдельных деревнях эскимосов Аляски. Am J Эпидемиол. 1983; 118: 543–9. [PubMed] [Google Scholar]
Распространенность гепатита В в отдельных деревнях эскимосов Аляски. Am J Эпидемиол. 1983; 118: 543–9. [PubMed] [Google Scholar]
43. Lanier AP, McMahon BJ, Alberts SR, et al. Первичный рак печени у коренных жителей Аляски. 1980–1985 гг. Рак. 1987; 60: 1915–20. [PubMed] [Google Scholar]
44. Livingston SE, Simonetti JP, Bulkow LR, et al. Клиренс е-антигена гепатита В у больных хроническим гепатитом В и генотипами А, В, С, D и F. Гастроэнтерология. 2007; 133:1452–7. [PubMed] [Академия Google]
45. Heyward WL, Bender TR, McMahon BJ, et al. Борьба с инфекцией вирусом гепатита В с помощью вакцины у эскимосов юпик. Демонстрация безопасности, иммуногенности и эффективности в полевых условиях. Am J Эпидемиол. 1985; 121: 914–23. [PubMed] [Google Scholar]
46. McMahon BJ, Rhoades ER, Heyward WL, et al. Комплексная программа по снижению заболеваемости вирусом гепатита В и его последствий среди коренных жителей Аляски. Ланцет. 1987; 2: 1134–6. [PubMed] [Академия Google]
47. McMahon BJ, Schoenberg S, Bulkow L, et al. Серопревалентность вирусных маркеров гепатита В у 52 000 аборигенов Аляски. Am J Эпидемиол. 1993; 138: 544–9. [PubMed] [Google Scholar]
McMahon BJ, Schoenberg S, Bulkow L, et al. Серопревалентность вирусных маркеров гепатита В у 52 000 аборигенов Аляски. Am J Эпидемиол. 1993; 138: 544–9. [PubMed] [Google Scholar]
48. Peng CY, Chien RN, Liaw YF. Декомпенсированный цирроз печени, связанный с вирусом гепатита В: преимущества противовирусной терапии. J Гепатол. 2012 г., август; 57 (2): 442–50. [PubMed] [Google Scholar]
49. Расширенная программа иммунизации (EPI) Департамента иммунизации, вакцин и биологических препаратов. Практика улучшения охвата вакциной против гепатита В при рождении. Женева (Швейцария): Всемирная организация здравоохранения; 2012 г. ВОЗ/IVB/12.11. Доступно по адресу: http://www.who.int/immunization/documents/control/who_ivb_12.11/en/. По состоянию на 13 мая 2016 г. [Google Scholar]
50. Оценка охвата ВОЗ/ЮНИСЕФ, пересмотренная версия за 2014 г. 2015 г. Доступно по адресу: http://apps.who.int/immunization_monitoring/globalsummary/timeseries/tswucoveragebcg.html. По состоянию на 15 августа 2016 г.
51. Центры по контролю и профилактике заболеваний (CDC) Глобальный охват плановой вакцинацией – 2012 г. MMWR Morb Mortal Wkly Rep. 2013;62(43):858–61. [Бесплатная статья PMC] [PubMed] [Google Scholar]
52. Adams D, Fullerton K, Jajosky R, et al. Резюме подлежащих уведомлению инфекционных заболеваний и состояний – США, 2013 г. MMWR Morb Mortal Wkly Rep. 2015;62(53):1–122. [PubMed] [Академия Google]
53. Hill HA, Elam-Evans LD, Yankey D, et al. Охват вакцинацией детей в возрасте 19–35 месяцев на национальном, государственном и выбранном местном уровне – США, 2014 г. MMWR Morb Mortal Wkly Rep. 2015;64(33):889–96. [PubMed] [Google Scholar]
54. Reagan-Steiner S, Yankey D, Jeyarajah J, et al. Национальный, региональный, штатный и выбранный местный охват вакцинацией среди подростков в возрасте 13–17 лет – США, 2014 г. MMWR Morb Mortal Wkly Rep. 2015;64(29):784–92. [Бесплатная статья PMC] [PubMed] [Google Scholar]
55. Williams WW, Lu PJ, O’Halloran A, et al. Надзор за охватом вакцинацией взрослого населения – США, 2014 г. MMWR Surveill Summ. 2016;65(1):1–36. [PubMed] [Google Scholar]
Надзор за охватом вакцинацией взрослого населения – США, 2014 г. MMWR Surveill Summ. 2016;65(1):1–36. [PubMed] [Google Scholar]
56. Alter MJ, Hadler SC, Margolis HS, et al. Изменение эпидемиологии гепатита В в США. Необходимость альтернативных стратегий вакцинации. ДЖАМА. 1990; 263:1218–22. [PubMed] [Google Scholar]
57. Центры по контролю и профилактике заболеваний. Иммунизация медицинского персонала: рекомендации Консультативного комитета по практике иммунизации (ACIP) MMWR Recomm Rep. 2011;60(RR-7):1–45. [PubMed] [Академия Google]
58. Schillie S, Murphy TV, Sawyer M, et al. Руководство CDC по оценке медицинского персонала для защиты от вируса гепатита В и по управлению постконтактным лечением. MMWR Recomm Rep. 2013;62(RR-10):1–19. [PubMed] [Google Scholar]
59. Chien Y-C, Jan C-F, Kuo HS, et al. Национальная программа вакцинации против гепатита В на Тайване: эффективность за 20 лет после ее запуска. Epidemiol Rev. 2006; 28:126–35. [PubMed] [Google Scholar]
60. Stroffolini T, Mele A, Tosti ME, et al. Влияние кампании массовой иммунизации против гепатита В на заболеваемость и факторы риска острого гепатита В в Италии. J Гепатол. 2000;33:980–5. [PubMed] [Google Scholar]
Stroffolini T, Mele A, Tosti ME, et al. Влияние кампании массовой иммунизации против гепатита В на заболеваемость и факторы риска острого гепатита В в Италии. J Гепатол. 2000;33:980–5. [PubMed] [Google Scholar]
61. Факты и цифры о раке. 2016 г. Доступно по адресу: http://www.cancer.org/acs/groups/content/@research/documents/document/acspc-047079.pdf. По состоянию на 15 августа 2016 г.
62. Эль-Сераг Х.Б. Эпидемиология вирусных гепатитов и гепатоцеллюлярной карциномы. Гастроэнтерология. 2012;142:1264–73.e1. [Бесплатная статья PMC] [PubMed] [Google Scholar]
63. McMahon BJ, Bulkow LR, Singleton RJ, et al. Элиминация гепатоцеллюлярной карциномы и острого гепатита В у детей через 25 лет после вакцинации новорожденных против гепатита В и программа догоняющей иммунизации. Гепатология. 2011;54:801–7. [PubMed] [Академия Google]
64. Wichajarn K, Kosalaraksa P, Wiangnon S. Заболеваемость гепатоцеллюлярной карциномой у детей в Кхон Каене до и после Национальной программы вакцинации против гепатита B. Азиатский Pac J Рак Prev. 2008; 9: 507–9. [PubMed] [Google Scholar]
Азиатский Pac J Рак Prev. 2008; 9: 507–9. [PubMed] [Google Scholar]
65. Chang MH, Chen CJ, Lai MS, et al. Всеобщая вакцинация против гепатита В на Тайване и заболеваемость гепатоцеллюлярной карциномой у детей. N Engl J Med. 1997; 336: 1855–9. [PubMed] [Google Scholar]
66. Terrault NA, Bzowej NH, Chang KM, et al. Рекомендации AASLD по лечению хронического гепатита В. Гепатология. 2016;63:261–83. [Бесплатная статья PMC] [PubMed] [Google Scholar]
67. Всемирная организация здравоохранения. Руководство по профилактике, уходу и лечению лиц с хроническим гепатитом В. 2015 г. Доступно по адресу: http://www.who.int/hiv/pub/hepatitis/hepatitis-b-guidelines/en/. По состоянию на 15 августа 2016 г.
68. Liang TJ, Block TM, McMahon BJ, et al. Современные и будущие методы лечения гепатита В: от открытия к излечению. Гепатология. 2015; 62: 1893–908. [Бесплатная статья PMC] [PubMed] [Google Scholar]
69. Bridges CB, Hurley LP, Williams WW, et al. Решение проблем иммунизации взрослых. Am J Prev Med. 2015;49: S455–64. [PubMed] [Google Scholar]
Am J Prev Med. 2015;49: S455–64. [PubMed] [Google Scholar]
70. Sutanto A, Suarnawa IM, Nelson CM, et al. Доставка на дом термостабильных вакцин в Индонезии: выездная иммунизация с помощью предварительно заполненного одноразового инъекционного устройства. Всемирный орган здравоохранения Быка. 1999;77(2):119–26. [Бесплатная статья PMC] [PubMed] [Google Scholar]
71. Chen HL, Lin LH, Hu FC, et al. Влияние материнского скрининга и всеобщей иммунизации на предотвращение передачи ВГВ от матери ребенку. Гастроэнтерология. 2012;142:773–81.e2. [PubMed] [Академия Google]
72. Brown RS, Jr, McMahon BJ, Lok AS, et al. Противовирусная терапия при хронической вирусной инфекции гепатита В во время беременности: систематический обзор и метаанализ. Гепатология. 2016;63:319–33. [PubMed] [Google Scholar]
73. Terrault NA, Bzowej NH, Chang K, et al. Руководство AASLD по лечению хронического гепатита B. Гепатология. 2015 Доступно по адресу: https://www.aasld.org/sites/default/files/guideline_documents/hep28156. pdf. По состоянию на 7 сентября 2016 г. [Бесплатная статья PMC] [PubMed]
pdf. По состоянию на 7 сентября 2016 г. [Бесплатная статья PMC] [PubMed]
74. Bruce MG, Bruden D, Hurlburt D, et al. Уровни антител и защита после вакцины против гепатита В: результаты 30-летнего последующего исследования и реакция на бустерную дозу. J заразить дис. 2016;214(1):16–22. [PubMed] [Google Scholar]
75. Liang X, Bi S, Yang W, et al. Эпидемиологическое серологическое исследование гепатита В в Китае – снижение распространенности ВГВ благодаря вакцинации против гепатита В. вакцина. 2009;27(47):6550–7. [PubMed] [Google Scholar]
76. Hadler SC, Fuqiang C, Averhoff F, et al. Воздействие вакцины против гепатита В в Китае и в китайском проекте ГАВИ. вакцина. 2013;31(Приложение 9): J66–72. [PubMed] [Google Scholar]
77. Kolwaite AR, Xeuatvongsa A, Ramirez-Gonzalez A, et al. Вакцина против гепатита В, хранящаяся за пределами холодовой цепи: пилотное исследование в сельской местности Лаосской Народно-Демократической Республики. вакцина. 2016;34(28):3324–30.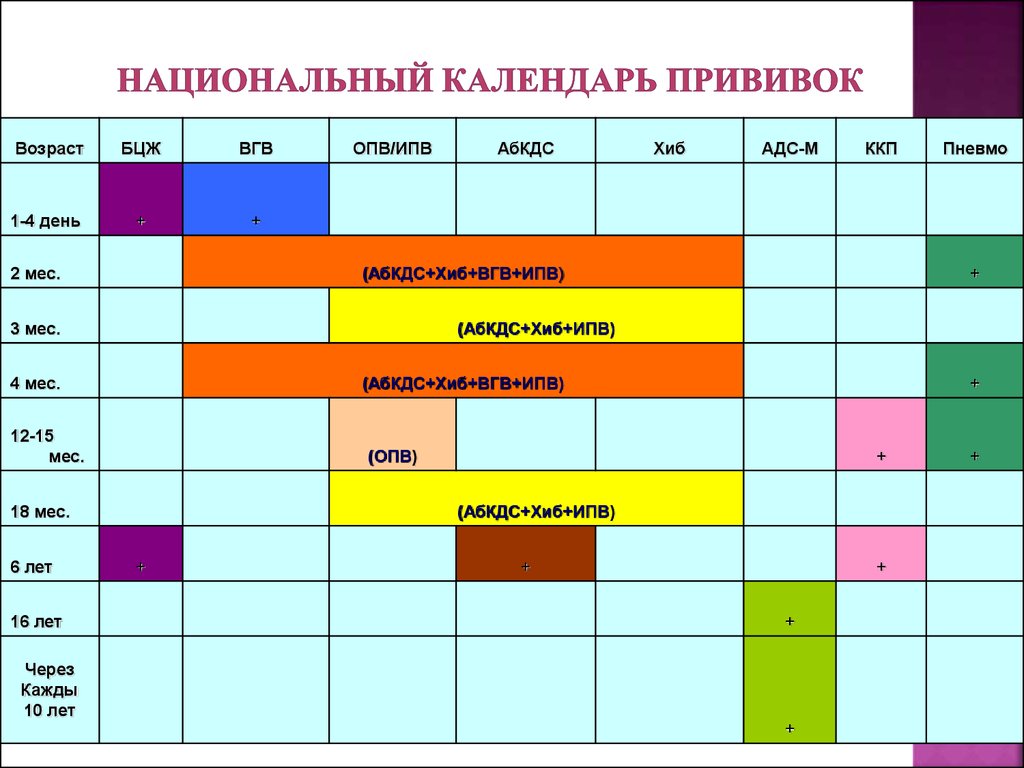 [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
78. Van Damme P, Ward J, Shouval D, et al. Вакцины против гепатита В. В: Плоткин С., Оренштейн В., Оффит П., редакторы. Вакцина. Китай: Сондерс; 2012. С. 183–204. [Google Scholar]
2022 CDC Рекомендации по вакцинации против гепатита B для местного фармацевта
Спонсором этой статьи является Dynavax .
Местные фармацевты и фармацевты занимают уникальное положение на переднем крае ухода за пациентами, чтобы существенно повысить осведомленность о вакцинации и ее доступность, что в конечном итоге способствует улучшению здоровья пациентов и населения. Благодаря доступу фармацевтов к важной информации о пациентах и прямым беседам с пациентами, они могут определить лиц, подходящих для вакциноуправляемых заболеваний, таких как гепатит В, которые могут иметь серьезные острые и хронические последствия для здоровья.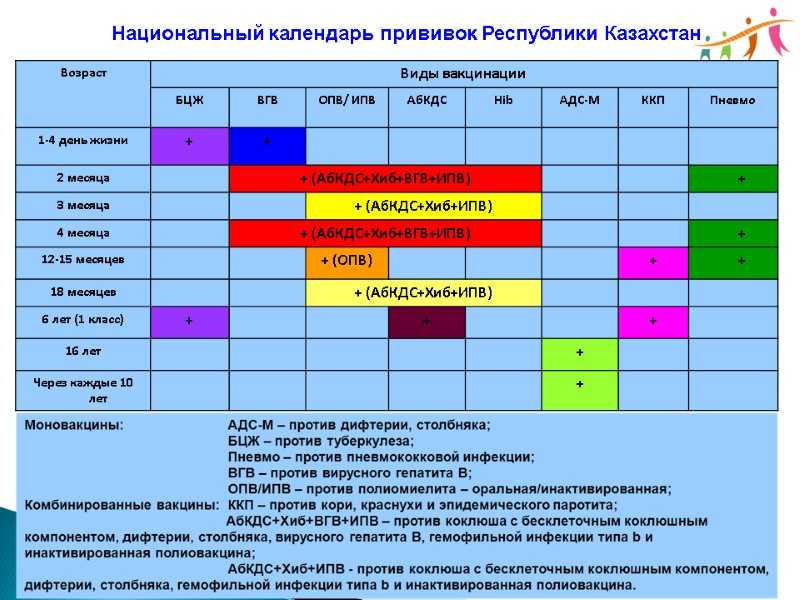 1 Хронический гепатит В может привести к циррозу, раку печени и смерти 1 ; 15% циррозов вызваны вирусом гепатита В (ВГВ). 2
1 Хронический гепатит В может привести к циррозу, раку печени и смерти 1 ; 15% циррозов вызваны вирусом гепатита В (ВГВ). 2
Начиная с 1991 г. младенцев начали вакцинировать против ВГВ при рождении. 3 Несмотря на то, что это привело к резкому снижению показателей инфицирования гепатитом В среди детей, многие взрослые, родившиеся до рекомендации всеобщей вакцинации младенцев от гепатита В 1991 года, остаются незащищенными и подвержены риску заражения.
НОВЫЕ И ОБНОВЛЕННЫЕ РЕКОМЕНДАЦИИ CDC 2022
В феврале 2022 года Центры по контролю и профилактике заболеваний (CDC) рекомендовали всеобщую вакцинацию против гепатита B для всех взрослых в возрасте от 19 до 59 лет. факторы риска инфицирования ВГВ рекомендуются для вакцинации. Это объявление было сделано на фоне роста заболеваемости гепатитом В среди взрослых. 4
Несмотря на то, что эффективные вакцины против гепатита В доступны в Соединенных Штатах на протяжении десятилетий, распространенность случаев острого ВГВ увеличилась на 14% с 2014 по 2019 год. . 1 В 2019 г. более 95% острых инфекций ВГВ возникали у взрослых в возрасте 20 лет и старше. 1
. 1 В 2019 г. более 95% острых инфекций ВГВ возникали у взрослых в возрасте 20 лет и старше. 1
ВАЖНОСТЬ ЗАВЕРШЕНИЯ СЕРИИ ВАКЦИН
Эффективная вакцинация и завершение серии вакцин против гепатита В необходимы для достижения защитного иммунитета. 5,6
Показатели завершения вакцинации против гепатита В субоптимальны. Трехдозовые вакцины против гепатита В (например, Engerix-B [GlaxoSmithKline] и Recombivax HB [Merck]) имеют потенциальные проблемы с завершением серии. 7,8 Только 24,8% взрослых (в возрасте ≥ 19 лет) в 2018 г. получили 3 или более доз серии вакцин против гепатита В. 9 что только 22,3% взрослых из группы высокого риска завершили серию трехдозовой вакцинации против гепатита В. 10
Фармацевты могут подчеркнуть важность завершения серии доз вакцины против гепатита В и могут предложить HEPLISAV-B ® [Вакцина против гепатита В (рекомбинантная, адъювантная)], которая является первой и единственной двухдозовой вакциной против гепатита В. для взрослых, который завершается в течение 1 месяца для защиты взрослых в возрасте 18 лет и старше от инфекции гепатита В. 11
для взрослых, который завершается в течение 1 месяца для защиты взрослых в возрасте 18 лет и старше от инфекции гепатита В. 11
Рекомендация CDC на 2022 год в сочетании с доступностью двухдозовой вакцины в качестве альтернативы трехдозовой вакцине являются важными событиями в стратегическом плане страны по ликвидации гепатита B к 2030 году и помогают защитить тысячи людей. от тяжелой болезни или смерти. 12
HEPLISAV-B [ВАКЦИНА ОТ ГЕПАТИТА B (РЕКОМБИНАТНАЯ), АДЬЮВАНТНАЯ]
HEPLISAV-B показан для профилактики инфекции, вызванной всеми известными подтипами HBV, у взрослых в возрасте 18 лет и старше. 11 См. Рисунок 1 для получения информации о дозировке и применении HEPLISAV-B. 11
Клиническая эффективность
В ходе 5 клинических испытаний 9597 взрослых в возрасте от 18 до 70 лет получили как минимум 1 дозу HEPLISAV-B. 11 Три из этих испытаний были рандомизированными, активно контролируемыми, слепыми, многоцентровыми клиническими испытаниями фазы 3, в которых оценивалась иммуногенность HEPLISAV-B по сравнению с Engerix-B. Взрослые были рандомизированы для получения двух доз вакцины HEPLISAV-B в возрасте 0 и 1 месяца с последующим введением плацебо солевого раствора в возрасте 6 месяцев или трехдозовой вакцинации Engerix-B в возрасте 0, 1 и 6 месяцев. 11
Взрослые были рандомизированы для получения двух доз вакцины HEPLISAV-B в возрасте 0 и 1 месяца с последующим введением плацебо солевого раствора в возрасте 6 месяцев или трехдозовой вакцинации Engerix-B в возрасте 0, 1 и 6 месяцев. 11
Результаты этих 3 клинических испытаний показали, что HEPLISAV-B обеспечивает более быструю и более высокую степень серопротекции (определяется как процент взрослых с концентрацией поверхностных антител против гепатита В не менее 10 мМЕ/мл против поверхностного антигена гепатита В) по сравнению с Engerix-B, в том числе в субпопуляциях с диабетом 2 типа и других известных гипореактивных популяциях. В исследовании взрослых в возрасте от 40 до 70 лет разница между группами в уровне защитного иммунитета на 12-й неделе для HEPLISAV-B и на 32-й неделе для Engerix-B составила 19,6% (95% ДИ, 14,7-24,8). от 40 до 70 ( Рисунок 2 ). 6,11,13
Безопасность
Профиль безопасности HEPLISAV-B был продемонстрирован с использованием данных, полученных из крупнейшей базы данных по безопасности клинических испытаний вакцины против гепатита В (N = 14 238). 14 Наиболее частыми побочными реакциями, о которых сообщалось в течение 7 дней после вакцинации, были боль в месте инъекции (23%-39%), утомляемость (11%-17%) и головная боль (8%-17%). 11
14 Наиболее частыми побочными реакциями, о которых сообщалось в течение 7 дней после вакцинации, были боль в месте инъекции (23%-39%), утомляемость (11%-17%) и головная боль (8%-17%). 11
См. Важная информация по технике безопасности в этой статье.
Процент завершенных серий вакцин с помощью HEPLISAV-B
Гнездовое когортное исследование с участием 10 888 взрослых оценивало уровни завершенных серий вакцин против гепатита В у тех, кто начал серию двухдозовой вакцинации с помощью HEPLISAV-B (n = 4727) и серия из 3 доз вакцины Engerix-B (n = 6161) в Kaiser Permanente, Южная Калифорния. Результаты показали, что значительно меньшее количество взрослых завершили серию вакцин Engerix-B по сравнению с HEPLISAV-B (26% против 45% соответственно; 9).0165 P < .001). В этом исследовании HEPLISAV-B был связан с 77% большей вероятностью завершения по сравнению с Engerix-B. 15
РОЛЬ ФАРМАЦЕВТА
Поскольку внебольничные аптеки являются легкодоступными и удобными местами для иммунизации, фармацевты играют важную роль, помогая укрепить доверие к вакцинам, предоставлять информацию о доступных вакцинах и давать настоятельные рекомендации в поддержка вакцин для снижения числа болезней, которые можно предотвратить с помощью вакцин. Технический персонал аптеки также может быть уполномочен оказывать поддержку, инициируя обсуждение вариантов вакцины против гепатита В.
Технический персонал аптеки также может быть уполномочен оказывать поддержку, инициируя обсуждение вариантов вакцины против гепатита В.
Благодаря тому, что записи о прививках часто легко доступны в аптеке, фармацевты и фармацевты имеют возможность определить взрослых для вакцинации против гепатита B в соответствии с рекомендациями CDC 2022 года на основе их возраста и путем проверки их статуса завершения вакцинации против гепатита B. 4,5,16 Взрослым, которые приходят в аптеку за другими вакцинами (например, против гриппа или опоясывающего лишая), рекомендуется добавить и ввести вакцину против гепатита В во время того же визита.
Информировать людей о том, что трехдозовая вакцинация против гепатита В требуется за 6 месяцев до завершения. HEPLISAV-B — единственная двухдозовая вакцина против гепатита В для взрослых в возрасте 18 лет и старше, которая завершается двумя инъекциями в течение месяца. 11
ПОКАЗАНИЯ
ХЕПЛИСАВ-В показан для профилактики инфекции, вызванной всеми известными подтипами вируса гепатита В, у взрослых в возрасте 18 лет и старше.
ВАЖНАЯ ИНФОРМАЦИЯ О БЕЗОПАСНОСТИ
Не назначайте HEPLISAV-B ®️ лицам с тяжелой аллергической реакцией в анамнезе (например, анафилаксия) после предыдущей дозы любой вакцины против гепатита В или любого компонента HEPLISAV-B ®️ , включая дрожжевые грибки.
Необходимо обеспечить надлежащее медицинское лечение и наблюдение для управления возможными анафилактическими реакциями после введения HEPLISAV-B ®️ .
Лица с ослабленным иммунитетом, в том числе лица, получающие иммуносупрессивную терапию, могут иметь сниженный иммунный ответ на HEPLISAV-B ®️ .
Гепатит В имеет длительный инкубационный период. HEPLISAV-B ®️ не может предотвратить инфекцию гепатита В у лиц, у которых на момент введения вакцины была недиагностированная инфекция гепатита В.
Наиболее частыми побочными реакциями, о которых сообщали пациенты в течение семи дней после вакцинации, были боль в месте инъекции (23–39%), утомляемость (11–17%) и головная боль (8–17%).
Полная Информация о назначении для HEPLISAV-B ®️ , нажмите здесь.
ССЫЛКИ
- Центры по контролю и профилактике заболеваний. Отчет о наблюдении за вирусным гепатитом, США, 2019 г. Май 2021 г. По состоянию на 29 марта 2022 г. Атланта: Министерство здравоохранения и социальных служб США; 2021. https://www.cdc.gov/hepatitis/statistics/2019surveillance/pdfs/
2019HepSurveillanceRpt.pdf - Starr SP, Raines D. Цирроз печени: диагностика, лечение и профилактика. Семейный врач . 2011;84(12):1353-1359.
- Центры по контролю и профилактике заболеваний. Вирус гепатита В: комплексная стратегия ликвидации передачи в Соединенных Штатах посредством всеобщей вакцинации детей: рекомендации Консультативного комитета по практике иммунизации (ACIP). ММВР . 1991;40(№ РР-13):1-19.
- Murthy N, Wodi AP, Bernstein H, McNally V, Cineas S, Ault K. Консультативный комитет по практике иммунизации, рекомендуемый график иммунизации для взрослых в возрасте 19 лет и старше, США, 2022 г.
 MMWR Morb Mortal Wkly Rep . 2022;71(7):229-233. doi:10.15585/mmwr.mm7107a1
MMWR Morb Mortal Wkly Rep . 2022;71(7):229-233. doi:10.15585/mmwr.mm7107a1 - Mast EE, Weinbaum CM, Fiore AE, et al. Комплексная стратегия иммунизации для устранения передачи вируса гепатита В в США: рекомендации Консультативного комитета по практике иммунизации (ACIP), часть II: иммунизация взрослых. MMWR Recomm Rep . 2006;55(RR-16):1-33.
- Шилли С., Веллоцци С., Рейнгольд А. и др. Профилактика вирусной инфекции гепатита В в США: рекомендации Консультативного комитета по практике иммунизации. MMWR Recomm Rep . 2018;67(1):1-31.
- Engerix-B [вакцина против гепатита B (рекомбинантная)] суспензия для инъекций, для внемышечного введения. Информация о назначении. ГлаксоСмитКляйн Биолоджикалз; 2021. https://gskpro.com/content/dam/global/hcpportal/en_US/Prescribing_Information/Engerix-B/pdf/ENGERIX-B.PDF
- Recombivax HB Вакцина против гепатита B (рекомбинантная). Информация о назначении. Мерк Шарп и Доме Корп; 1986-2020 гг. https://www.
 merck.com/product/usa/pi_circulars/r/recombivax_hb/recombivax_pi.pdf
merck.com/product/usa/pi_circulars/r/recombivax_hb/recombivax_pi.pdf - Лу П.Дж., Хунг М.С., Шривастав А. и др. Надзор за охватом вакцинацией среди взрослого населения — США, 2018 г. MMWR Surveill Summ . 2021;70(3):1-26. doi:10.15585/mmwr.ss7003a1
- Bridges CB, Watson TL, Nelson NP, et al. Проблемы с вакцинацией взрослых высокого риска против гепатита В – пилотная программа. Вакцина . 2019;37(35):5111-5120. doi:10.1016/j.vaccine.2019.05.089
- HEPLISAV-B [вакцина против гепатита В [рекомбинантная], адъювантная] раствор для внутримышечных инъекций. Информация о назначении. Корпорация Dynavax Technologies; 2020. По состоянию на 14 марта 2022 г. https://www.heplisavb.com/assets/pdfs/HEPLISAV-B-Prescribing-Information.pdf
- Министерство здравоохранения и социальных служб США. Национальный стратегический план США по борьбе с вирусным гепатитом: план ликвидации (2021–2025 гг.). 2020. Вашингтон, округ Колумбия. https://www.hhs.gov/sites/default/files/Viral-Hepatitis-National-Strategic-Plan-2021-2025.
 pdf
pdf - Jackson S, Lentino J, Kopp J, et al. Иммуногенность двухдозовой исследуемой вакцины против гепатита В, HBsAg-1018, с использованием адъюванта агониста толл-подобного рецептора 9 по сравнению с лицензированной вакциной против гепатита В у взрослых. Вакцина . 2018;36(5):668-674. doi:10.1016/j.vaccine.2017.12.038
- Dynavax Technologies Corporation. Информационный документ Консультативного комитета FDA. HEPLISAV-B™ [вакцина против гепатита В (рекомбинантная), адъювантная] вакцины и родственные биологические продукты. 28 июля 2017 г. По состоянию на 31 марта 2022 г. https://www.fda.gov/media/106639/download
- Bruxvoort K, Slezak J, Huang R, et al. Связь количества доз с завершением серии вакцин против гепатита В у взрослых в США. JAMA Сеть открыта . 2020;3(11):e2027577. doi:10.1001/jamanetworkopen.2020.27577
- Шен А.К., Петерсон А. Фармацевт и аптека превратились в нечто большее, чем аптека на углу: это победа вакцинации и общественного здравоохранения.


 Здоровье населения и среда обитания. М.: Медицина,1999. № 6 (75). С. 8–11.
Здоровье населения и среда обитания. М.: Медицина,1999. № 6 (75). С. 8–11. MMWR Morb Mortal Wkly Rep . 2022;71(7):229-233. doi:10.15585/mmwr.mm7107a1
MMWR Morb Mortal Wkly Rep . 2022;71(7):229-233. doi:10.15585/mmwr.mm7107a1 merck.com/product/usa/pi_circulars/r/recombivax_hb/recombivax_pi.pdf
merck.com/product/usa/pi_circulars/r/recombivax_hb/recombivax_pi.pdf pdf
pdf