Содержание
Ультрикс | Нацимбио
УЛЬТРИКС® – противогриппозная вакцина последнего поколения
- Содержит в своем составе вирусоподобные частицы с презентацией поверхностных антигенов вируса гриппа
- Производится в России с соблюдением требований и норм GMP (надлежащей производственной практики)
- Одобрена для иммунизации детей с 6 месяцев и далее без ограничения по возрасту
- Не содержит консервантов
- Удобная форма выпуска – преднаполненные шприцы и флаконы
Результаты пострегистрационных исследований вакцины
В результате масштабных клинических исследований с участием свыше 10 тысяч добровольцев была доказана эпидемиологическая эффективность и безопасность вакцины:
- Не выявлено наличия общих реакций, нежелательных явлений и серьёзных нежелательных явлений на введение гриппозной вакцины. Отмечена хорошая переносимость гриппозной инактивированной вакцины УЛЬТРИКС®, в том числе в возрастной группе старше 60 лет;
- Установлено, что у лиц у лиц, привитых гриппозной вакциной УЛЬТРИКС®, случаи ОРВИ имели неосложненное течение, а длительность одного случая была короче, чем у не привитых;
- Отмечено снижение заболеваемости ОРВИ среди наблюдаемых лиц, прошедших вакцинацию, в том числе внутри закрытых коллективов;
- Установлено снижение заболеваемости ОРВИ в группе привитых гриппозной вакциной УЛЬТРИКС®, несмотря на «сезонный» рост числа зарегистрированных случаев заболеванием;
- Установлена высокая иммуногенная активность вакцины УЛЬТРИКС®;
- Доказано сохранение протективного уровня антител ко всем трем вакцинным штамма вирусов гриппа не менее 201 дня после вакцинации;
- Отмечена эффективность вакцины УЛЬТРИКС® как в отношении вирусов гриппа, так и прочих острых респираторных вирусных инфекций.

Ирина Фельдблюм,
заведующая кафедрой эпидемиологии с курсом
гигиены и эпидемиологии
ФДПО ГБОУ ВПО ПГМА им. ак. Е.А. Вагнера
Журнал “Ремедиум” №4, 2016 стр.31-33
В клинических исследованиях вакцины «Ультрикс»® принимало участие 10 тысяч добровольцев. Вакцина отлично показала себя и доказала не только эпидемиологическую эффективность, но и безопасность препарата. Помимо этого, установлен протективный уровень антител ко всем трем вакцинным штаммам вирусов гриппа на срок не менее 201 дня
”
Документы
публикации в СМИ
- Рязанский фармзавод «ФОРТ» провёл акцию по профилактическим
прививкам против гриппа
Информационное агентство «МЕДИАРЯЗАНЬ» - Фармацевтическая компания «ФОРТ» провела День вакцинации
Рязанское информационное агентство - Вакцины производства «ФОРТ» показали высокую профилактическую
эффективность и иммуногенность
Новости GMP
Ультрикс — инструкция по применению, дозы, побочные действия, отзывы о препарате Ультрикс: — Энциклопедия лекарств РЛС
Описание препарата Ультрикс® (раствор для внутримышечного введения, 0. 5 мл/доза) основано на официальной инструкции, утверждено компанией-производителем в 2014 году
5 мл/доза) основано на официальной инструкции, утверждено компанией-производителем в 2014 году
Дата согласования: 22.08.2014
Содержание
- Фотографии упаковок
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Характеристика
- Фармакологические (иммунобиологические) свойства
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Отзывы
Фотографии упаковок
22. 08.2014
08.2014
р-р для в/м введ. 0.5 мл/доза, шпр. разов. с игл. 0.5 мл (1 доз) — уп. контурн. яч. — пач. картон.
Действующее вещество
Вакцина для профилактики гриппа [инактивированная] (Vaccine influenza virus inactivated)
ATX
J07BB02 Вирус гриппа инактивированный расщепленный или поверхностный антиген
Фармакологическая группа
МИБП-вакцина
[Вакцины, сыворотки, фаги и анатоксины]
Нозологическая классификация (МКБ-10)
Список кодов МКБ-10
Состав
| Раствор для внутримышечного введения | 1 доза (0,5 мл) |
| вирусы гриппа, культивированные на куриных эмбрионах, инактивированные, расщепленные, представленные штаммами: | |
| A (H1N1) | (15±2,2) мкг гемагглютинина |
| A (H3N2) | (15±2,2) мкг гемагглютинина |
| B | (15±2,2) мкг гемагглютинина |
| вспомогательное вещество: консервант (мертиолят) — 42,5–57,5 мкг или не содержит консервант | |
Антигенный состав вакцины изменяется каждый год в соответствии с эпидемической ситуацией и рекомендациями ВОЗ. |
Описание лекарственной формы
Раствор: опалесцирующая бесцветная жидкость.
Фармакологическое действие
Фармакологическое действие —
иммуностимулирующее.
Характеристика
Вакцина представляет собой смесь высокоочищенных протективных поверхностных и внутренних антигенов вирусов гриппа типа A (H1N1 и H3N2) и типа B.
Фармакологические (иммунобиологические) свойства
Вакцина формирует высокий специфический иммунитет против гриппа типа А и В, хорошо переносится взрослыми. После вакцинации антитела появляются через 8–12 дней, иммунитет сохраняется до 12 мес. Высокая эффективность вакцины обеспечивается наличием в ней как поверхностных, так и внутренних антигенов вируса гриппа.
Показания
Профилактика гриппа. Вакцинация рекомендуется следующим группам лиц:
дети с 6 лет;
студенты высших и средних профессиональных учебных заведений;
работающие взрослые, особенно работники медицинских и образовательных учреждений, сферы транспорта, коммунальной сферы;
лица, страдающие хроническими соматическими заболеваниями;
лица, часто болеющие острыми респираторными заболеваниями;
взрослые старше 60 лет.
Противопоказания
аллергические реакции на предшествующие прививки гриппозными вакцинами;
аллергические реакции на куриный белок и компоненты вакцины;
острые лихорадочные состояния или обострение хронического заболевания;
период грудного вскармливания.
Применение при беременности и кормлении грудью
Сведения отсутствуют. Клинические исследования не проводились.
Способ применения и дозы
В/м, в дельтовидную мышцу.
Вакцину вводят однократно в дозе 0,5 мл.
При нетяжелых ОРВИ, острых кишечных заболеваниях вакцинацию проводят после нормализации температуры. Прививки проводят после выздоровления (ремиссия).
В день прививки вакцинируемые должны быть осмотрены врачом/фельдшером с обязательной термометрией. При температуре выше 37 °C вакцинацию не проводят.
Не пригоден к применению препарат в ампулах или шприцах с нарушенной целостностью или маркировкой, при изменении физических свойств (цветность, прозрачность), при истекшем сроке годности, нарушении требований к условиям хранения.
Ампулы
Перед применением вакцину следует выдержать до комнатной температуры и хорошо встряхнуть.
Вскрытие ампул и процедуру вакцинации осуществляют при строгом соблюдении правил асептики и антисептики: перед вскрытием ампульный нож, шейку ампулы протирают ватой, смоченной 70% этиловым спиртом, вскрывают ампулу, набирают вакцину в шприц одноразового применения и удаляют из шприца остаток воздуха. Спиртом протирают кожу в месте инъекции. Препарат во вскрытой ампуле хранению не подлежит.
Шприцы
Следует встряхнуть шприц непосредственно перед инъекцией. Снять защитную крышку с иглы и удалить воздух из шприца, удерживая его в вертикальном положении иглой вверх и медленно нажимая на поршень.
Побочные действия
Введение вакцины может сопровождаться местными и общими реакциями.
Очень редко — в месте введения могут быть реакции в виде болезненности, покраснения и отека кожи.
Крайне редко — у отдельных лиц возможны общие реакции в виде повышенной утомляемости, головной боли, головокружения, субфебрильной температуры, насморка, фарингита, кашля, артралгии, миалгии, тошноты. Указанные реакции обычно исчезают самостоятельно через 1–3 дня.
Указанные реакции обычно исчезают самостоятельно через 1–3 дня.
В исключительно редких случаях — при высокой индивидуальной чувствительности могут наблюдаться аллергические реакции.
Взаимодействие
Вакцина может применяться одновременно с другими инактивированными вакцинами. При этом должны учитываться противопоказания к каждой из применяемых вакцин, препараты должны вводиться в разные участки тела разными шприцами. Вакцинация пациентов, получающих иммуносупрессивную терапию, может быть менее эффективной.
Особые указания
Не вводить в/в.
В кабинетах, где проводится вакцинация, необходимо иметь ЛС для проведения противошоковых мероприятий и купирования анафилактической реакции.
Вакцинированный должен находиться под наблюдением медработника в течение 30 мин после иммунизации.
Влияние на способность управлять транспортными средствами и работать с механизмами. Сведения отсутствуют.
Форма выпуска
Раствор для внутримышечного введения. В ампулах. 10 амп. в пачке из картона или в контурной ячейковой упаковке в пачке из картона с ножом ампульным или скарификатором. При упаковке ампул с пережимом, имеющим кольцо или точку для вскрытия, нож ампульный или скарификатор не вкладывают.
В ампулах. 10 амп. в пачке из картона или в контурной ячейковой упаковке в пачке из картона с ножом ампульным или скарификатором. При упаковке ампул с пережимом, имеющим кольцо или точку для вскрытия, нож ампульный или скарификатор не вкладывают.
В шприцах инъекционных стерильных однократного применения с иглой инъекционной стерильной однократного применения, с защитным колпачком, 0,5 мл (1 доза) в пачке из картона.
1 шприц инъекционный стерильный однократного применения с иглой инъекционной стерильной однократного применения, с защитным колпачком, в пачке из картона.
На пачке препарата, не содержащего консервант, нанесена предупредительная надпись «Без консерванта».
Производитель
1. ФГУП СПбНИИВС ФМБА России. 198320, Санкт-Петербург, г. Красное Село, ул. Свободы, 52.
2. Филиал ФГУ «48 Центральный научно-исследовательский институт Министерства обороны Российской Федерации» — «Вирусологический центр». 141306, Россия, Московская обл., г. Сергиев Посад-6, ул. Октябрьская, 11.
Октябрьская, 11.
Владелец регистрационного удостоверения: ООО «ФОРТ». 390000, Россия, Рязанская обл., г. Рязань, ул. Новослободская, 20а.
Тел.: (4912) 70-15-00; факс: (4912) 70-15-01.
Рекламации на качество препарата, а также информацию о случаях повышенной реактогенности или развитии осложнений следует направлять в Федеральную службу по надзору в сфере здравоохранения и социального развития (Росздравнадзор) и в адрес ООО «ФОРТ» с указанием номера серии препарата и даты выпуска с последующим представлением медицинской документации.
Условия отпуска из аптек
По рецепту.
Условия хранения
При температуре 2–8 °C (не замораживать).
В соответствии с СП 3.3.2.1248-03.
Хранить в недоступном для детей месте.
Срок годности
1 год.
Не применять по истечении срока годности, указанного на упаковке.
Характеристика инактивированных гриппозных вакцин, используемых в Российской национальной программе иммунизации
. 2020 30 августа; 8 (3): 488.
2020 30 августа; 8 (3): 488.
doi: 10.3390/vaccines8030488.
Михаил Тарасов
1
, Андрей Шанко
1
2
, Лариса Кордюкова
3
, Антон Катлински
4
Принадлежности
- 1 Отдел исследований и разработок ООО «ФОРТ», 119435 Москва, Россия.
- 2 Институт вирусологии имени Ивановского ФГБУ «Федеральный исследовательский центр эпидемиологии и микробиологии им. Н. Ф. Гамалеи», 123098 Москва, Россия.
- 3 Белозерский институт физико-химической биологии МГУ им.
 М.В. Ломоносова, 119991 Москва, Россия.
М.В. Ломоносова, 119991 Москва, Россия. - 4 Член Совета директоров ООО «ФОРТ», 119435 Москва, Россия.
PMID:
32872645
PMCID:
PMC7564049
DOI:
10.3390/вакцин8030488
Бесплатная статья ЧВК
Михаил Тарасов и др.
Вакцины (Базель).
.
Бесплатная статья ЧВК
. 2020 30 августа; 8 (3): 488.
doi: 10. 3390/vaccines8030488.
3390/vaccines8030488.
Авторы
Михаил Тарасов
1
, Андрей Шанко
1
2
, Лариса Кордюкова
3
, Антон Катлински
4
Принадлежности
- 1 Отдел исследований и разработок ООО «ФОРТ», 119435 Москва, Россия.
- 2 Институт вирусологии имени Ивановского Федерального исследовательского центра эпидемиологии и микробиологии им. Н. Ф. Гамалеи, 123098 Москва, Россия.
- 3 Белозерский институт физико-химической биологии Московского государственного университета имени М.
 В. Ломоносова, 119991 Москва, Россия.
В. Ломоносова, 119991 Москва, Россия. - 4 Член Совета директоров ООО «ФОРТ», 119435 Москва, Россия.
PMID:
32872645
PMCID:
PMC7564049
DOI:
10.3390/вакцин8030488
Абстрактный
Фон:
современные стандартные методы контроля качества, используемые для контроля белкового состава инактивированных противогриппозных вакцин, учитывают лишь несколько ключевых эталонных компонентов. Они не позволяют провести тщательную характеристику белковых композиций. В результате наблюдение непредсказуемых вариаций основных вирусных компонентов и примесей клеточных белков в производимых вакцинах, которые могут серьезно влиять на иммуногенность и безопасность таких вакцин, стало актуальной проблемой вакцинологии. Настоящее исследование направлено на проверку более сложного подхода к анализу инактивированных расщепленных гриппозных вакцин, лицензированных в Российской Федерации. Исследуемые лекарственные формы являются наиболее доступными на рынке и включены в Российскую национальную программу иммунопрофилактики.
Настоящее исследование направлено на проверку более сложного подхода к анализу инактивированных расщепленных гриппозных вакцин, лицензированных в Российской Федерации. Исследуемые лекарственные формы являются наиболее доступными на рынке и включены в Российскую национальную программу иммунопрофилактики.
Методы:
жидкостная хроматография с анализом тандемной масс-спектрометрии (ЖХ-МС/МС) в сочетании с безметочным количественным определением белка с помощью алгоритма абсолютного количественного определения на основе интенсивности (iBAQ), а также ряд стандартных методов молекулярного анализа, таких как натрий Были применены электрофорез в полиакриламидном геле с додецилсульфатом (SDS-PAGE), динамическое светорассеяние (DLS) и просвечивающая электронная микроскопия с негативным окрашиванием (TEM).
Полученные результаты:
реализованные методы позволили идентифицировать десятки вирусных белков и белков-хозяев и количественно определить их относительное количество в конечных составах различных коммерчески доступных инактивированных сплит-вакцин против гриппа. Исследование молекулярной морфологии вакцинных препаратов с помощью ПЭМ выявило типичные розетки основных поверхностных белков (гемагглютинина и нейраминидазы). DLS использовали для демонстрации распределения розеток по размерам и для проверки стабильности вакцинных препаратов при повышенных температурах.
Исследование молекулярной морфологии вакцинных препаратов с помощью ПЭМ выявило типичные розетки основных поверхностных белков (гемагглютинина и нейраминидазы). DLS использовали для демонстрации распределения розеток по размерам и для проверки стабильности вакцинных препаратов при повышенных температурах.
Выводы:
комплексный подход, основанный на современных высокопроизводительных аналитических методиках, впервые применен для серии различных коммерчески доступных инактивированных сплит-вакцин против гриппа, лицензированных в России. Исследуемые протоколы могут быть предложены для постмаркетингового контроля качества вакцин. При сравнении различных препаратов выявлено, что вакцины Ультрикс ® и Ультрикс ® Квадри производства ООО «Форт» и трехвалентная вакцина Ваксигрип ® производства фармацевтической компании Санофи Пастер имеют хорошо организованные антигенные розетки, они содержат меньше примесных количеств белков клетки-хозяина и демонстрируют хорошую корреляцию среди наиболее распространенных вирусных белков, выявляемых разными методами.
Ключевые слова:
SDS-СТРАНИЦА; динамическое рассеяние света; электронная микроскопия; инактивированные вакцины против гриппа; масс-спектрометрии; протеомика.
Заявление о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Цифры
Рисунок 1
Количественное определение общего белка в вакцине…
Рисунок 1
Количественное определение общего белка в образцах вакцин на основе анализа белка Лоури (Peterson’s…
фигура 1
Количественное определение общего белка в образцах вакцин на основе анализа белка Лоури (модификация Петерсона) с преципитацией белка. ( A ) Калибровочный график, описывающий зависимость десятичного логарифма поглощения света (при 650 нм) от десятичного логарифма концентрации белка. Кружки представляют значения стандартных растворов альбумина бычьей сыворотки (BSA); сплошная линия и уравнение над ней представляют собой линейную аппроксимацию экспериментальных значений стандартных растворов БСА; р 2 – коэффициент определения линейной аппроксимации экспериментальных значений; пунктирные линии – зависимость концентрации общего белка в вакцинах от их оптической плотности. Общий белок измеряют в четырехкратных разведениях исходных вакцин таким образом, чтобы их концентрации были близки к диапазону концентраций калибровочных растворов БСА. ( B ) Таблица, показывающая результаты измерений общего белка в оригинальных вакцинах и нормативных концентраций гемагглютининов (HA) в соответствии с инструкциями к вакцинам. Цвета вакцин соответствуют цветам пунктирных линий на калибровочной диаграмме. SGU отмечен звездочкой, так как измеренный общий белок в вакцине был меньше нормативной концентрации HA.
( A ) Калибровочный график, описывающий зависимость десятичного логарифма поглощения света (при 650 нм) от десятичного логарифма концентрации белка. Кружки представляют значения стандартных растворов альбумина бычьей сыворотки (BSA); сплошная линия и уравнение над ней представляют собой линейную аппроксимацию экспериментальных значений стандартных растворов БСА; р 2 – коэффициент определения линейной аппроксимации экспериментальных значений; пунктирные линии – зависимость концентрации общего белка в вакцинах от их оптической плотности. Общий белок измеряют в четырехкратных разведениях исходных вакцин таким образом, чтобы их концентрации были близки к диапазону концентраций калибровочных растворов БСА. ( B ) Таблица, показывающая результаты измерений общего белка в оригинальных вакцинах и нормативных концентраций гемагглютининов (HA) в соответствии с инструкциями к вакцинам. Цвета вакцин соответствуют цветам пунктирных линий на калибровочной диаграмме. SGU отмечен звездочкой, так как измеренный общий белок в вакцине был меньше нормативной концентрации HA.
Рисунок 2
SDS-PAGE образцов IIV. Вакцина…
Рисунок 2
SDS-PAGE образцов IIV. Применяемые образцы вакцины ( A ) после восстановления и…
фигура 2
SDS-PAGE образцов IIV. Нанесенные образцы вакцины ( A ) после восстановления и ( B ) после восстановления и обработки пептидом n-гликозидазы F (PNGase F); м, маркер. На каждую дорожку наносили по 32 мкл исходной суспензии каждого препарата. Расщепление белка, улучшенное дегликозилированием. Гликозилированный гемагглютинин (HA)1 (от ~64 до 79 кДа) был локализован вблизи NP (от ~55 до 66 кДа). Гликозилированная HA2 формировала полосу на уровне ~23-25 кДа, близкую к полосе M1 (~26 кДа). После дегликозилирования полоса HA1 сместилась до уровня ~37–47 кДа, а HA2 до уровня ~23 кДа (экспериментальные молекулярные массы согласуются с предыдущими исследованиями [11, 15, 26]).
Рисунок 3
Диаграмма рабочего процесса, показывающая общие…
Рисунок 3
Схема рабочего процесса, показывающая основные этапы масс-спектрометрического количественного протеомного анализа…
Рисунок 3
Схема рабочего процесса, показывающая основные этапы масс-спектрометрического количественного протеомного анализа инактивированных противогриппозных вакцин (ИИВ).
Рисунок 4
Количественный анализ на основе ЖХ-МС/МС без меток…
Рисунок 4
Количественное определение общих белковых групп в IIV на основе ЖХ-МС/МС без маркировки. Круговые диаграммы…
Круговые диаграммы…
Рисунок 4
Количественное определение общих белковых групп в IIV на основе ЖХ-МС/МС без использования меток. Круговые диаграммы основаны на результатах алгоритма абсолютного количественного анализа iBAQ на основе интенсивности. Проценты показывают отношение обозначенных белков к общему белку, измеренному в каждом образце. ( А ) У3; ( Б ) У4; ( С ) СГУ; ( D ) SGF; ( E ) GP; ( Ф ) ВГ.
Рисунок 5
Количественное определение вирусов на основе ЖХ-МС/МС без меток…
Рисунок 5
Количественное определение вирусных белковых групп в ВВГ на основе ЖХ-МС/МС без использования меток. Содержание белка нормализовано до…
Рисунок 5
Количественное определение вирусных белковых групп в IIV на основе ЖХ-МС/МС без использования меток.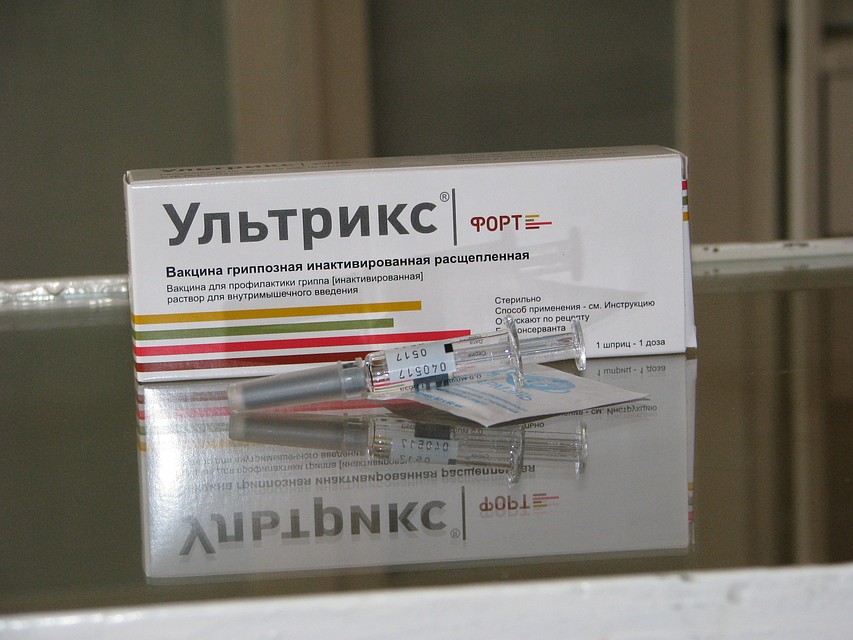 Обилие белка нормировали на содержание общего вирусного белка в соответствующих препаратах.
Обилие белка нормировали на содержание общего вирусного белка в соответствующих препаратах.
Рисунок 6
Просвечивающая электронная микроскопия с отрицательным окрашиванием (ПЭМ)…
Рисунок 6
Просвечивающая электронная микроскопия (ПЭМ) с отрицательным окрашиванием образцов IIV. В каждой строке показаны три репрезентативных…
Рисунок 6
Просвечивающая электронная микроскопия (ПЭМ) с отрицательным окрашиванием образцов IIV. В каждой строке показаны три репрезентативных изображения образца вакцины; образцы ( А ) У3, ( В ) У4, ( С ) СГУ, ( Д ) СГФ, ( Е ) ГП и ( Ф ) ВГ. Масштабные полосы на всех изображениях имеют размер 200 нм.
Рисунок 7
Анализ динамического рассеяния света (DLS)…
Рисунок 7
Анализ динамического светорассеяния (DLS) образцов IIV.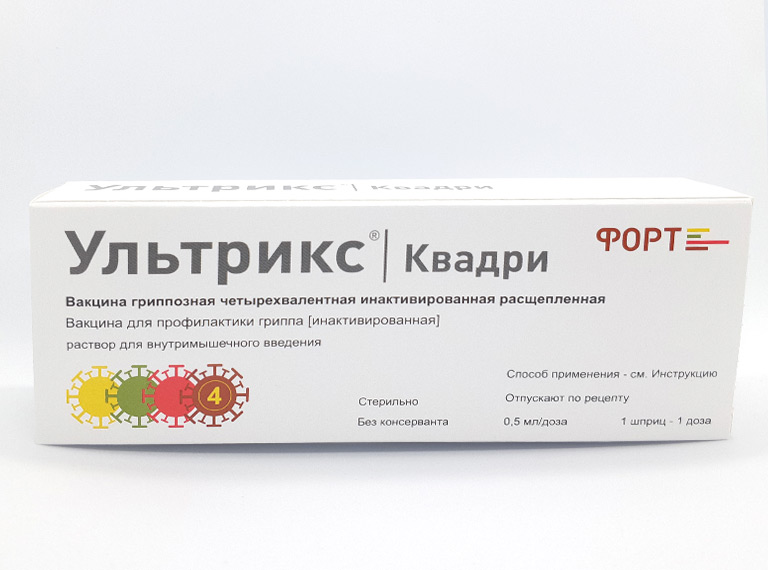 Гранулометрический состав по ( A…
Гранулометрический состав по ( A…
Рисунок 7
Анализ динамического светорассеяния (DLS) образцов IIV. Гранулометрический состав по ( A ) интенсивность и ( B ) объем.
См. это изображение и информацию об авторских правах в PMC
Похожие статьи
Сравнительное иммунологическое исследование на мышах инактивированных гриппозных вакцин, используемых в Российской программе иммунизации.
Шанко А., Шуклина М., Ковалева А., Забродская Ю., Видяева И., Шалджян А., Фадеев А., Коротков А., Зайцева М., Степанова Л., Цыбалова Л., Кордюкова Л., Катлинский А.
Шанко А. и др.
Вакцины (Базель). 2020 12 декабря; 8 (4): 756. дои: 10.3390/вакцин8040756.
Вакцины (Базель). 2020.PMID: 33322762
Бесплатная статья ЧВК.Исследование альтернативных методологий тестирования для характеристики вакцины против вируса гриппа.

Тэй Т., Агиус С., Гамильтон Р., Бодл Дж., Рокман С.
Тай Т. и др.
Hum Вакцина Иммунотер. 2015;11(7):1673-84. дои: 10.1080/21645515.2015.1034914.
Hum Вакцина Иммунотер. 2015.PMID: 26090618
Бесплатная статья ЧВК.Одновременное количественное определение гемагглютинина и нейраминидазы вируса гриппа с использованием масс-спектрометрии с изотопным разведением.
Уильямс Т.Л., Пиркл Дж.Л., Барр Дж.Р.
Уильямс Т.Л. и соавт.
вакцина. 2012 23 марта; 30 (14): 2475-82. doi: 10.1016/j.vaccine.2011.12.056. Epub 2011 22 декабря.
вакцина. 2012.PMID: 22197963
Вакцина против вируса гриппа живая интраназальная — MedImmune вакцины: CAIV-T, вакцина против гриппа живая интраназальная.
[Нет авторов в списке]
[Нет авторов в списке]
Наркотики Р Д. 2003;4(5):312-9. doi: 10.2165/00126839-200304050-00007.
2003;4(5):312-9. doi: 10.2165/00126839-200304050-00007.
Наркотики Р Д. 2003.PMID: 12952502
Обзор.
Иммуногенность и безопасность новой инактивированной четырехвалентной вакцины против гриппа Ваксигрип Тетра: предварительные результаты у детей ≥6 месяцев и взрослых старшего возраста.
Монтомоли Э., Торелли А., Манини И., Джанчекки Э.
Монтомоли Э. и др.
Вакцины (Базель). 2018 8 марта; 6(1):14. doi: 10.3390/vaccines6010014.
Вакцины (Базель). 2018.PMID: 29518013
Бесплатная статья ЧВК.Обзор.
Посмотреть все похожие статьи
Цитируется
Обзор вирусов гриппа и вакцин.
Нуварда РФ, Альхарби АА, Кайзер В.
Нуварда РФ и др.
Вакцины (Базель). 2021 17 сентября; 9(9):1032. doi: 10.3390/vaccines9091032.
2021 17 сентября; 9(9):1032. doi: 10.3390/vaccines9091032.
Вакцины (Базель). 2021.PMID: 34579269
Бесплатная статья ЧВК.Обзор.
Сравнительное иммунологическое исследование на мышах инактивированных гриппозных вакцин, используемых в Российской программе иммунизации.
Шанко А., Шуклина М., Ковалева А., Забродская Ю., Видяева И., Шалджян А., Фадеев А., Коротков А., Зайцева М., Степанова Л., Цыбалова Л., Кордюкова Л., Катлинский А.
Шанко А. и др.
Вакцины (Базель). 2020 12 декабря; 8 (4): 756. дои: 10.3390/вакцин8040756.
Вакцины (Базель). 2020.PMID: 33322762
Бесплатная статья ЧВК.
использованная литература
Информационный бюллетень Всемирной организации здравоохранения о гриппе (сезонном). [(по состоянию на 6 ноября 2018 г.
 )]; Доступно в Интернете: https://www.who.int/news-room/fact-sheets/detail/influenza-(seasonal)
)]; Доступно в Интернете: https://www.who.int/news-room/fact-sheets/detail/influenza-(seasonal)
Юлиано А.Д., Рогуски К.М., Чанг Х.Х., Мускателло Д.Дж., Палекар Р., Темпия С., Коэн С., Гран Дж.М., Шанцер Д., Коулинг Б.Дж. и др. Оценки глобальной смертности от респираторных заболеваний, связанных с сезонным гриппом: модельное исследование. Ланцет. 2018; 391:1285–1300. doi: 10.1016/S0140-6736(17)33293-2.
—
DOI
—
ЧВК
—
пабмед
Грохскопф Л.
 А., Альянак Э., Бродер К.Р., Уолтер Э.Б., Фрай А.М., Джерниган Д.Б. Профилактика сезонного гриппа и борьба с ним с помощью вакцин: рекомендации Консультативного комитета по практике иммунизации — США, сезон гриппа 2019–2020 гг. ММВР. Рекоменд. Отчет 2019; 68: 1–21. doi: 10.15585/mmwr.rr6803a1.
А., Альянак Э., Бродер К.Р., Уолтер Э.Б., Фрай А.М., Джерниган Д.Б. Профилактика сезонного гриппа и борьба с ним с помощью вакцин: рекомендации Консультативного комитета по практике иммунизации — США, сезон гриппа 2019–2020 гг. ММВР. Рекоменд. Отчет 2019; 68: 1–21. doi: 10.15585/mmwr.rr6803a1.—
DOI
—
ЧВК
—
пабмед
Всемирная организация здравоохранения Вакцины против гриппа Документ с изложением позиции ВОЗ — ноябрь 2012 г.
 Rerev. Эпидемиол. хебд. 2012; 87: 461–476.
Rerev. Эпидемиол. хебд. 2012; 87: 461–476.—
пабмед
Принципи Н., Камиллони Б., Эспозито С. Группа по изучению вакцины ESCMID (EVASG) Политика иммунизации против гриппа: что может быть основной причиной различий между странами? Гум. Вакцины Иммунотер. 2018;14:684–692. doi: 10.1080/21645515.2017.1405188.
—
DOI
—
ЧВК
—
пабмед
Производители вакцин изо всех сил пытаются протестировать прививки против нового варианта Covid-19
Производители вакцин сначала должны выяснить, будет ли их вакцина работать против Omicron. If it doesn’t, they say they will tweak their vaccines
If it doesn’t, they say they will tweak their vaccines
buzz
Bookmark
- Share
Bookmark
RYAZAN REGION, RUSSIA — OCTOBER 26, 2021: Workers in an Лаборатория иммунологии и биохимии на биофармацевтическом заводе ФОРТ, компании холдинга «Нацимбио» Ростеха, производящей противогриппозную вакцину Ultrix Quadri. ФОРТ производит более 30 млн доз вакцин против гриппа в год. В 2020 году компания также начала поставки на экспорт. Александр Рюмин/ТАСС
Новый вариант Covid-19 уже обнаружен в Соединенном Королевстве. Основная причина, по которой Омикрон является «вариантом, вызывающим озабоченность», заключается в том, что он имеет такое большое количество мутаций.
Мутации
Большое количество мутаций заставило некоторых ученых полагать, что существующие вакцины не будут столь же эффективны в борьбе с последним вариантом Covid-19, как это было с предыдущими штаммами.
Структурный биолог из Оксфордского университета Джеймс Нейсмит сказал Би-би-си: «Это плохие новости, но это не конец света». Он добавил, что мутации в этом варианте могут сделать его более трансмиссивным, но мы еще недостаточно знаем о том, как мутации работают вместе.
РЯЗАНСКАЯ ОБЛАСТЬ, РОССИЯ — 26 ОКТЯБРЯ 2021 г.: Ампулы с вакциной против гриппа Ultrix Quadri производятся на биофармацевтическом заводе ФОРТ, компании, принадлежащей холдингу Ростех «Нацимбио» (Национальная иммунобиологическая компания). ФОРТ производит более 30 млн доз вакцин против гриппа в год. В 2020 году компания также начала поставки на экспорт. Александр Рюмин/ТАСС (Фото Александра Рюмина\ТАСС через Getty Images)
Новая вакцина для нового варианта?
Вакцина против омикронного варианта Covid-19По словам главного научного консультанта Великобритании Патрика Валланса, они могут быть готовы «всего за 100 дней».
Производители вакцин уже рассматривают возможность создания укола, специально предназначенного для варианта Omicron.
Выступая на пресс-конференции на Даунинг-стрит в минувшие выходные, Валланс сказал, что существует три способа справиться с вариантом Омикрон.
Во-первых, нужно выяснить, дадут ли повторные прививки достаточное количество антител для борьбы с Омикроном.
Второе, по словам Валланса, заключается в том, что производители вакцин уже производят более широкий спектр вакцин, чтобы обеспечить охват потенциальных новых вариантов.
В-третьих, несколько производителей вакцин уже заявили, что они могут изменить свои существующие вакцины, чтобы создать новую специально против Омикрона примерно через 100 дней.
Подробнее
- Африка не получает достаточного количества вакцин от Covid-19, поэтому пытается создать одну из своих собственных
.
Подробнее
- В каких странах разрешены прививки для детей?
Производители вакцин готовы
Опасаясь нового варианта вакцины, несколько стран, включая Великобританию и ЕС, ввели ограничения на поездки в страны южной части Африки, несмотря на то, что Всемирная организация здравоохранения заявила, что это плохая идея.


 М.В. Ломоносова, 119991 Москва, Россия.
М.В. Ломоносова, 119991 Москва, Россия. В. Ломоносова, 119991 Москва, Россия.
В. Ломоносова, 119991 Москва, Россия.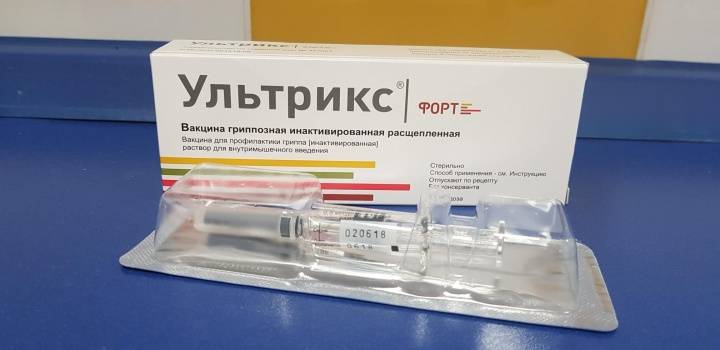
 2003;4(5):312-9. doi: 10.2165/00126839-200304050-00007.
2003;4(5):312-9. doi: 10.2165/00126839-200304050-00007.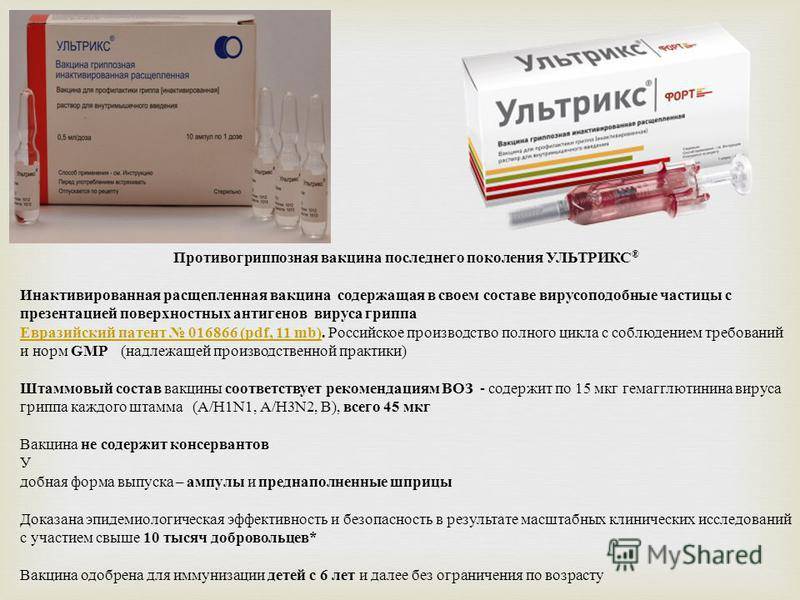 2021 17 сентября; 9(9):1032. doi: 10.3390/vaccines9091032.
2021 17 сентября; 9(9):1032. doi: 10.3390/vaccines9091032. )]; Доступно в Интернете: https://www.who.int/news-room/fact-sheets/detail/influenza-(seasonal)
)]; Доступно в Интернете: https://www.who.int/news-room/fact-sheets/detail/influenza-(seasonal) А., Альянак Э., Бродер К.Р., Уолтер Э.Б., Фрай А.М., Джерниган Д.Б. Профилактика сезонного гриппа и борьба с ним с помощью вакцин: рекомендации Консультативного комитета по практике иммунизации — США, сезон гриппа 2019–2020 гг. ММВР. Рекоменд. Отчет 2019; 68: 1–21. doi: 10.15585/mmwr.rr6803a1.
А., Альянак Э., Бродер К.Р., Уолтер Э.Б., Фрай А.М., Джерниган Д.Б. Профилактика сезонного гриппа и борьба с ним с помощью вакцин: рекомендации Консультативного комитета по практике иммунизации — США, сезон гриппа 2019–2020 гг. ММВР. Рекоменд. Отчет 2019; 68: 1–21. doi: 10.15585/mmwr.rr6803a1..png) Rerev. Эпидемиол. хебд. 2012; 87: 461–476.
Rerev. Эпидемиол. хебд. 2012; 87: 461–476.