Содержание
Риск лихорадки после детской трехвалентной инактивированной противогриппозной вакцины и 13-валентной пневмококковой конъюгированной вакцины
Сохранить цитату в файл
Формат:
Резюме (текст)PubMedPMIDAbstract (текст)CSV
Добавить в коллекции
- Создать новую коллекцию
- Добавить в существующую коллекцию
Назовите свою коллекцию:
Имя должно содержать менее 100 символов
Выберите коллекцию:
Не удалось загрузить вашу коллекцию из-за ошибки
Повторите попытку
Добавить в мою библиографию
- Моя библиография
Не удалось загрузить делегатов из-за ошибки
Повторите попытку
Ваш сохраненный поиск
Название сохраненного поиска:
Условия поиска:
Тестовые условия поиска
Эл. адрес:
адрес:
(изменить)
Который день?
Первое воскресеньеПервый понедельникПервый вторникПервая средаПервый четвергПервая пятницаПервая субботаПервый деньПервый рабочий день
Который день?
ВоскресеньеПонедельникВторникСредаЧетвергПятницаСуббота
Формат отчета:
SummarySummary (text)AbstractAbstract (text)PubMed
Отправить максимум:
1 шт. 5 шт. 10 шт. 20 шт. 50 шт. 100 шт. 200 шт.
Отправить, даже если нет новых результатов
Необязательный текст в электронном письме:
Создайте файл для внешнего программного обеспечения для управления цитированием
Клинические испытания
. 2014 март; 168(3):211-9.
doi: 10. 1001/jamapediatrics.2013.4469.
1001/jamapediatrics.2013.4469.
Мелисса С Стоквелл
1
, Карен Бродер
2
, Филип ЛаРусса
3
, Пейдж Льюис
2
, Надира Фернандес
3
, Девиндра Шарма
2
, Анджела Барретт
3
, Хосе Соса
3
, Клаудия Веллоцци
2
Принадлежности
- 1 Педиатрический факультет Колумбийского университета, Нью-Йорк, Нью-Йорк 2 Департамент народонаселения и здоровья семьи, Школа общественного здравоохранения Мейлмана, Колумбийский университет, Нью-Йорк, Нью-Йорк 3 Нью-Йорк-Пресвитерианская больница, Нью-Йорк.

- 2 Управление безопасности иммунизации, Центры по контролю и профилактике заболеваний, Атланта, Джорджия.
- 3 Педиатрический факультет Колумбийского университета, Нью-Йорк, Нью-Йорк.
PMID:
24395025
PMCID:
PMC6693332
DOI:
10.1001/jamapediatrics.2013.4469
Бесплатная статья ЧВК
Клинические испытания
Melissa S Stockwell et al.
JAMA Педиатр.
2014 март
Бесплатная статья ЧВК
. 2014 март; 168(3):211-9.
2014 март; 168(3):211-9.
doi: 10.1001/jamapediatrics.2013.4469.
Авторы
Мелисса С Стоквелл
1
, Карен Бродер
2
, Филип ЛаРусса
3
, Пейдж Льюис
2
, Надира Фернандес
3
, Девиндра Шарма
2
, Анджела Барретт
3
, Хосе Соса
3
, Клаудия Веллоцци
2
Принадлежности
- 1 Педиатрический факультет Колумбийского университета, Нью-Йорк, Нью-Йорк 2 Департамент народонаселения и здоровья семьи, Школа общественного здравоохранения Мейлмана, Колумбийский университет, Нью-Йорк, Нью-Йорк 3 Нью-Йорк-Пресвитерианская больница, Нью-Йорк.

- 2 Управление безопасности иммунизации, Центры по контролю и профилактике заболеваний, Атланта, Джорджия.
- 3 Педиатрический факультет Колумбийского университета, Нью-Йорк, Нью-Йорк.
PMID:
24395025
PMCID:
PMC6693332
DOI:
10.1001/jamapediatrics.2013.4469
Абстрактный
Важность:
Обсервационное исследование выявило повышенный риск фебрильных судорог в день или через 1 день после вакцинации (дни 0-1) трехвалентной инактивированной гриппозной вакциной (TIV) в сезоне 2010-2011 гг. ; риск был самым высоким при одновременной вакцинации TIV и 13-валентной пневмококковой вакциной (PCV13) у детей в возрасте от 6 до 23 месяцев. Обмен текстовыми сообщениями — это новый метод наблюдения за нежелательными явлениями после иммунизации, который не использовался для исследований безопасности вакцин, основанных на гипотезах.
; риск был самым высоким при одновременной вакцинации TIV и 13-валентной пневмококковой вакциной (PCV13) у детей в возрасте от 6 до 23 месяцев. Обмен текстовыми сообщениями — это новый метод наблюдения за нежелательными явлениями после иммунизации, который не использовался для исследований безопасности вакцин, основанных на гипотезах.
Задача:
Проспективно оценить, были ли у детей, получавших одновременно TIV и PCV13, более высокие показатели лихорадки в дни с 0 по 1, чем у детей, получавших один продукт без другого.
Дизайн, постановка и участники:
Проспективное обсервационное когортное исследование родителей детей в возрасте от 6 до 23 месяцев, набранных из 3 аффилированных с медицинскими центрами клиник в Нью-Йорке с 1 ноября 2011 г. по 5 апреля 2012 г. В общей сложности 530 из 614 подходящих участников (86,3%). зачислен. В ночь после вакцинации (день 0) и в последующие 7 ночей (дни 1-7) родителям присылали сообщения о температуре их ребенка. Мы использовали логарифмическую регрессию для расчета скорректированных относительных рисков (aRR) и избыточного риска лихорадки в дни от 0 до 1 с поправкой на возрастную группу, прошлую вакцинацию против гриппа и одновременное введение выбранных инактивированных вакцин.
Мы использовали логарифмическую регрессию для расчета скорректированных относительных рисков (aRR) и избыточного риска лихорадки в дни от 0 до 1 с поправкой на возрастную группу, прошлую вакцинацию против гриппа и одновременное введение выбранных инактивированных вакцин.
Выдержки:
Получение TIV и/или PCV13.
Основной результат(ы) и мера(ы):
Температура 38°С и выше в дни с 0 по 1 после вакцинации.
Результаты:
В дни с 0 по 1 у детей, получавших ТИВ и ПКВ13 одновременно, отмечались более высокие показатели (37,6%) лихорадки (температура ≥38°C), чем у детей, получавших ТИВ (7,5%; aRR 2,69).; 95% ДИ, 1,30–5,60) или PCV13 (9,5%; aRR, 2,67; 95% ДИ, 1,25–5,66). Избыточный риск лихорадки после TIV и PCV13 составил 20 и 23 на 100 вакцинаций по сравнению с TIV без PCV13 и PCV13 без TIV соответственно. Показатели лихорадки со 2-го по 7-й день были одинаковыми в разных группах. В дни с 0 по 1 подтверждена доставка 74,8% текстовых сообщений; еще для 9,0% статус доставки был неизвестен. Частота ответов составила 95,1% и 90,9% для дней 0 и 1 для подтвержденных доставленных сообщений соответственно.
Показатели лихорадки со 2-го по 7-й день были одинаковыми в разных группах. В дни с 0 по 1 подтверждена доставка 74,8% текстовых сообщений; еще для 9,0% статус доставки был неизвестен. Частота ответов составила 95,1% и 90,9% для дней 0 и 1 для подтвержденных доставленных сообщений соответственно.
Выводы и актуальность:
Одновременное введение TIV и PCV13 было связано с более высоким риском транзиторного повышения температуры, чем введение любой вакцины без другого продукта. Обмен текстовыми сообщениями для проспективной оценки конкретного нежелательного явления вакцины может улучшить долицензионный и постлицензионный мониторинг побочных явлений после иммунизации и заслуживает дальнейшего изучения.
Пробная регистрация:
Clinictrials.gov Идентификатор: NCT01467934.
Заявление о конфликте интересов
w3.org/1999/xlink» xmlns:mml=»http://www.w3.org/1998/Math/MathML» xmlns:p1=»http://pubmed.gov/pub-one»> Раскрытие информации о конфликте интересов: не сообщалось. Цифры
Рисунок 1. Блок-схема исследования
У пациентов…
Рисунок 1. Блок-схема исследования
У пациентов, получающих ТИВ-1, 68% доз ТИВ-1 составляют…
Рисунок 1. Блок-схема исследования
У пациентов, получающих TIV-1, 68% доз TIV-1 являются первой дозой гриппа, полученной пациентом в сезоне 2011–2012 гг., но не обязательно первой дозой, которую когда-либо получал пациент. У пациентов, получающих TIV-1 и PCV13, 96% доз TIV-1 и PVC13 являются первой дозой гриппа, которую когда-либо получал пациент. У пациентов, получающих PCV13, 0,9% получали свою первую дозу, 2,7% — вторую дозу, 16,4% — третью дозу и 80,0% — четвертую дозу. Среди пациентов, получавших TIV и PVC13, 0,9% получали первую дозу PCV13, 5,7% вторую дозу, 65,6% третью дозу и 35,8% по крайней мере четвертую дозу. Среди пациентов, получавших TIV-1 и PCV13, 1,3% получали первую дозу PCV13, 6,4% — вторую дозу, 81,5% — третью дозу и 10,8% — четвертую дозу. Среди пациентов, получавших TIV-2 и PCV13, 0% получали первую дозу, 3,6% вторую дозу, 20,0% третью дозу и 76,3% по крайней мере четвертую дозу. PCV13 означает 13-валентную пневмококковую конъюгированную вакцину; TIV, трехвалентная инактивированная противогриппозная вакцина; TIV-1, первая доза гриппа в этом сезоне; и TIV-2, вторая доза гриппа в этом сезоне.
У пациентов, получающих PCV13, 0,9% получали свою первую дозу, 2,7% — вторую дозу, 16,4% — третью дозу и 80,0% — четвертую дозу. Среди пациентов, получавших TIV и PVC13, 0,9% получали первую дозу PCV13, 5,7% вторую дозу, 65,6% третью дозу и 35,8% по крайней мере четвертую дозу. Среди пациентов, получавших TIV-1 и PCV13, 1,3% получали первую дозу PCV13, 6,4% — вторую дозу, 81,5% — третью дозу и 10,8% — четвертую дозу. Среди пациентов, получавших TIV-2 и PCV13, 0% получали первую дозу, 3,6% вторую дозу, 20,0% третью дозу и 76,3% по крайней мере четвертую дозу. PCV13 означает 13-валентную пневмококковую конъюгированную вакцину; TIV, трехвалентная инактивированная противогриппозная вакцина; TIV-1, первая доза гриппа в этом сезоне; и TIV-2, вторая доза гриппа в этом сезоне.
Рисунок 2. Скорость отклика на мониторинг текстовых сообщений…
Рисунок 2. Частота ответов на текстовые сообщения для мониторинга лихорадки с 0-го по 7-й день
Частота ответов на текстовые сообщения для мониторинга лихорадки с 0-го по 7-й день
Рис. 2. Частота ответов на текстовые сообщения для мониторинга лихорадки с 0-го по 7-й день.
A, Частота ответов на все сообщения независимо от статуса доставки. B, Частота ответов только на сообщения с подтвержденной доставкой.
См. это изображение и информацию об авторских правах в PMC
Похожие статьи
Идентификация сигналов и оценка риска фебрильных судорог у детей после введения трехвалентной инактивированной вакцины против гриппа в рамках Проекта передачи данных по безопасности вакцин, 2010–2011 гг.
Це А., Ценг Х.Ф., Грин С.К., Веллоцци С., Ли Г.М.; Рабочая группа по быстрому анализу цикла VSD по гриппу.
Це А и др.
вакцина. 2012 март 2;30(11):2024-31. doi: 10.1016/j.vaccine.2012.01.027.
doi: 10.1016/j.vaccine.2012.01.027.
вакцина. 2012.PMID: 22361304
Оценка частоты лихорадки после вакцинации детей живым аттенуированным против инактивированного гриппа.
Стоквелл М.С., Бродер К.Р., Льюис П., Джейкоб К., Икбал С., Фернандес Н., Шарма Д., Барретт А., ЛаРусса П.
Стоквелл М.С. и др.
J Pediatric Infect Dis Soc. 2017 сен 1;6(3):e7-e14. дои: 10.1093/jpids/piw028.
J Pediatric Infect Dis Soc. 2017.PMID: 27302328
Бесплатная статья ЧВК.Фебрильные судороги после введения трехвалентной инактивированной вакцины против гриппа в 2010-2011 гг.
Каваи А.Т., Мартин Д., Куллдорф М., Ли Л., Коул Д.В., МакМахилл-Уолравен К.Н., Селвам Н., Селван М.С., Ли Г.М.
Каваи А.Т. и др.
Педиатрия. 2015 г. , октябрь; 136 (4): e848-55. doi: 10.1542/пед.2015-0635. Epub 2015 14 сентября.
, октябрь; 136 (4): e848-55. doi: 10.1542/пед.2015-0635. Epub 2015 14 сентября.
Педиатрия. 2015.PMID: 26371192
Риск лихорадки после одной дозы трехвалентной инактивированной противогриппозной вакцины у детей в возрасте от ≥6 месяцев до <36 месяцев: сравнение опубликованных и неопубликованных исследований.
Kaczmarek MC, Duong UT, Ware RS, Lambert SB, Kelly HA.
Качмарек М.С. и соавт.
вакцина. 2013 4 ноября; 31 (46): 5359-65. doi: 10.1016/j.vaccine.2013.09.005. Epub 2013 19 сентября.
вакцина. 2013.PMID: 24055353
Обзор.
Систематический обзор лихорадки, фебрильных судорог и серьезных нежелательных явлений после введения инактивированных трехвалентных противогриппозных вакцин у детей.
Ли-Ким-Мой Дж.
 , Инь Дж.К., Рашид Х., Хандакер Г., Кинг С., Вуд Н., Макартни К.К., Джонс С., Буй Р.
, Инь Дж.К., Рашид Х., Хандакер Г., Кинг С., Вуд Н., Макартни К.К., Джонс С., Буй Р.
Ли-Ким-Мой Дж. и др.
Евронаблюдение. 2015 18 июня; 20(24):21159. doi: 10.2807/1560-7917.es2015.20.24.21159.
Евронаблюдение. 2015.PMID: 26111238
Обзор.
Посмотреть все похожие статьи
Цитируется
Безопасность совместного введения рутинной детской вакцины по сравнению с раздельной вакцинацией.
Баувенс Дж., де Лузиньян С., Велдесселассие Ю.Г., Шерлок Дж., Кюнцли Н., Бонхёффер Дж.
Бауэнс Дж. и соавт.
BMJ Глоб Здоровье. 2022 сен;7(9):e008215. doi: 10.1136/bmjgh-2021-008215.
BMJ Глоб Здоровье. 2022.PMID: 36162867
Бесплатная статья ЧВК.Профилактика сезонного гриппа и борьба с ним с помощью вакцин: рекомендации Консультативного комитета по практике иммунизации — США, сезон гриппа 2022–2023 гг.

Grohskopf LA, Blanton LH, Ferdinands JM, Chung JR, Broder KR, Talbot HK, Morgan RL, Fry AM.
Grohskopf LA, et al.
MMWR Recomm Rep. 2022 Aug 26;71(1):1-28. doi: 10.15585/mmwr.rr7101a1.
MMWR Recomm Rep. 2022.PMID: 36006864
Бесплатная статья ЧВК.Безопасность совместного введения бациллы Кальметта-Герена (БЦЖ) и вакцины против гриппа.
Вильянуэва П., Вадиа У., Кроуфорд Н.В., Мессина Н.Л., Коллманн Т.Р., Лукас М., Мэннинг Л., Ричмонд П., Питтет Л.Ф., Кертис Н.
Вильянуэва П. и соавт.
ПЛОС Один. 3 июня 2022 г .; 17 (6): e0268042. doi: 10.1371/journal.pone.0268042. Электронная коллекция 2022.
ПЛОС Один. 2022.PMID: 35657850
Бесплатная статья ЧВК.Клиническое испытание.
Совместное введение обычных педиатрических вакцин в Англии часто отклоняется от календаря иммунизации.

Бауэнс Дж., де Лузиньян С., Шерлок Дж., Феррейра Ф., Кюнцли Н., Бонхёффер Дж.
Бауэнс Дж. и соавт.
Вакцина X. 2021, 15 сентября; 9:100115. doi: 10.1016/j.jvacx.2021.100115. электронная коллекция 2021 дек.
Вакцина Х. 2021.PMID: 34622200
Бесплатная статья ЧВК.Профилактика сезонного гриппа и борьба с ним с помощью вакцин: рекомендации Консультативного комитета по практике иммунизации, США, сезон гриппа 2021–2022 гг.
Grohskopf LA, Alyanak E, Ferdinands JM, Broder KR, Blanton LH, Talbot HK, Fry AM.
Grohskopf LA, et al.
MMWR Recomm Rep. 27 августа 2021 г .; 70 (5): 1–28. doi: 10.15585/mmwr.rr7005a1.
MMWR Recomm Rep. 2021.PMID: 34448800
Бесплатная статья ЧВК.
Просмотреть все статьи «Цитируется по»
Типы публикаций
термины MeSH
вещества
Грантовая поддержка
- CC999999/Внутренний CDC HHS/США
- 200-2002-00732/PHS HHS/США
Полнотекстовые ссылки
Информационные системы Silverchair
Бесплатная статья ЧВК
Укажите
Формат:
ААД
АПА
МДА
НЛМ
Добавить в коллекции
- Создать новую коллекцию
- Добавить в существующую коллекцию
Назовите свою коллекцию:
Имя должно содержать менее 100 символов
Выберите коллекцию:
Не удалось загрузить вашу коллекцию из-за ошибки
Повторите попытку
Отправить в
хранения, обработки и кодов NDC для Pneumovax®23 (поливалент пневмококковой вакцины)
Как поставляется
Pneumovax 23. коробка с 10 однодозовыми флаконами, цветная маркировка с фиолетовой крышкой и полосой на этикетках флаконов и картонных коробках.
коробка с 10 однодозовыми флаконами, цветная маркировка с фиолетовой крышкой и полосой на этикетках флаконов и картонных коробках.
NDC 0006-4837-03 — коробка с 10 однодозовыми, предварительно заполненными шприцами Luer-Lok™ с наконечниками, с цветовой маркировкой с фиолетовым штоком поршня и фиолетовой полосой на этикетках шприцев и картонных коробках.
Упомянутые торговые марки являются товарными знаками соответствующих владельцев.
Хранение и обращение
- Хранить при температуре от 2°C до 8°C (от 36°F до 46°F).
- Все вакцины должны быть утилизированы после истечения срока годности.
Пробки флаконов, пробка поршня шприца и колпачок наконечника шприца не изготовлены из натурального каучукового латекса.
По общим вопросам, касающимся надлежащего хранения вакцин компании «Мерк» и обращения с ними, обращайтесь в службу поддержки клиентов компании «Мерк вакцин» по телефону 1-800-MERCK-90 (1-800-637-2590) с понедельника по пятницу с 8:00 до 18:00. 19:00 по восточному времени.
19:00 по восточному времени.
Общие советы
- Если у вас есть вопросы о состоянии вакцины на момент доставки, вам следует немедленно поместить вакцину на рекомендуемое место хранения и позвонить в Центр обслуживания клиентов компании Merck по телефону 1-877-VAX-MERCK (1 -877-829-6372) или позвоните в CDC по телефону 1-800-CDC-INFO (1-800-232-4636).
- Меняйте запасы таким образом, чтобы в первую очередь использовалась самая ранняя вакцина. 2
- Убедитесь, что холодильник подключен к розетке в защищенном месте, где он не может быть случайно отключен. 2
- Записывайте температуру холодильника и морозильной камеры два раза в день в журнал температур. 2
- Важно использовать отдельный стерильный шприц и иглу для каждого отдельного пациента, чтобы предотвратить передачу инфекционных агентов от одного человека к другому.
- Иглы следует утилизировать надлежащим образом. 2
- Все вакцины должны быть утилизированы после истечения срока годности; Вакцины с истекшим сроком годности или поврежденные вакцины для детей (VFC) должны быть возвращены в вашу государственную программу иммунизации.
 2
2 - Для вакцин, которые используются в том виде, в каком они поставляются, разведение не требуется.
- По общим вопросам, касающимся надлежащего хранения и обращения с вакцинами Merck, обращайтесь в службу поддержки клиентов Merck Vaccine по телефону 1-800-MERCK-9.0 (1-800-637-2590), с понедельника по пятницу, с 8:00 до 19:00 по восточному времени.
ref2
Справочный номер
- Центры по контролю и профилактике заболеваний (CDC). Набор инструментов для хранения и обращения с вакцинами. Опубликовано в сентябре 2021 г. По состоянию на 11 ноября 2021 г. https://www.cdc.gov/vaccines/hcp/admin/storage/toolkit/storage-handling-toolkit.pdf
Показания для PNEUOVAX 23
PNEUOVAX ® 23 (поливалентная пневмококковая вакцина) представляет собой вакцину, предназначенную для активной иммунизации для профилактики пневмококковой инфекции, вызываемой 23 серотипами, содержащимися в вакцине (1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19F, 19A, 20, 22F, 23F и 33F).
PNEUMOVAX 23 одобрен для использования у лиц в возрасте 50 лет и старше, а также у лиц в возрасте ≥2 лет с повышенным риском пневмококковой инфекции.
PNEUMOVAX 23 не предотвратит заболевание, вызванное капсульными типами пневмококка, отличными от содержащихся в вакцине.
Закрыть
Выберите информацию о безопасности для PNEUOVAX 23
Не вводите ПНЕВМОВАКС 23 лицам, у которых в анамнезе были реакции гиперчувствительности на какой-либо компонент вакцины.
Отложить вакцинацию PNEUOVAX 23 у лиц с умеренным или тяжелым острым заболеванием.
Не вводите PNEUMOVAX ® 23 (поливалентная пневмококковая вакцина) лицам с историей реакции гиперчувствительности на какой-либо компонент вакцины.
Отложить вакцинацию пневмоваксом 23 у лиц с умеренным или тяжелым острым заболеванием.
Соблюдайте осторожность и надлежащую осторожность при введении PNEUMOVAX 23 лицам с серьезно нарушенной сердечно-сосудистой и/или легочной функцией, у которых системная реакция может представлять значительный риск.
Имеющиеся данные клинических испытаний ПНЕВМОВАКС 23 при беременности на людях не установили наличия или отсутствия риска, связанного с вакциной.
Поскольку пожилые люди могут не переносить медицинские вмешательства так же, как и молодые люди, нельзя исключать более высокую частоту и/или большую тяжесть реакций у некоторых пожилых людей.
Лица с ослабленным иммунитетом, в том числе лица, получающие иммуносупрессивную терапию, могут иметь сниженный иммунный ответ на PNEUMOVAX 23.
PNEUMOVAX 23 может быть неэффективным для предотвращения пневмококкового менингита у пациентов с хронической ликвороподобной утечкой в результате врожденных поражений , переломы черепа или нейрохирургические процедуры.
Наиболее частыми побочными реакциями, о которых сообщалось более чем у 10% субъектов, впервые вакцинированных ПНЕВМОВАКС 23 в ходе клинического испытания, были: боль/болезненность/болезненность в месте инъекции, отек/уплотнение в месте инъекции, головная боль, эритема в месте инъекции. астения и утомляемость, миалгия.
астения и утомляемость, миалгия.
У субъектов в возрасте 65 лет и старше, участвовавших в клиническом исследовании, системные побочные реакции, которые были определены исследователем как связанные с вакциной, были выше после ревакцинации, чем после первоначальной вакцинации.
Вакцинация PNEUMOVAX 23 может не обеспечивать 100%-ную защиту от пневмококковой инфекции.
Перед введением PNEUMOVAX 23 прочтите прилагаемую информацию по назначению. Информация о пациенте также доступна.
PNEUMOVAX ® 23 (поливалентная пневмококковая вакцина) представляет собой вакцину, предназначенную для активной иммунизации для профилактики пневмококковой инфекции, вызываемой 23 серотипами, содержащимися в вакцине (1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19F, 19A, 20, 22F, 23F и 33F).
PNEUMOVAX 23 одобрен для использования у лиц в возрасте 50 лет и старше, а также у лиц в возрасте ≥2 лет с повышенным риском пневмококковой инфекции.



 doi: 10.1016/j.vaccine.2012.01.027.
doi: 10.1016/j.vaccine.2012.01.027.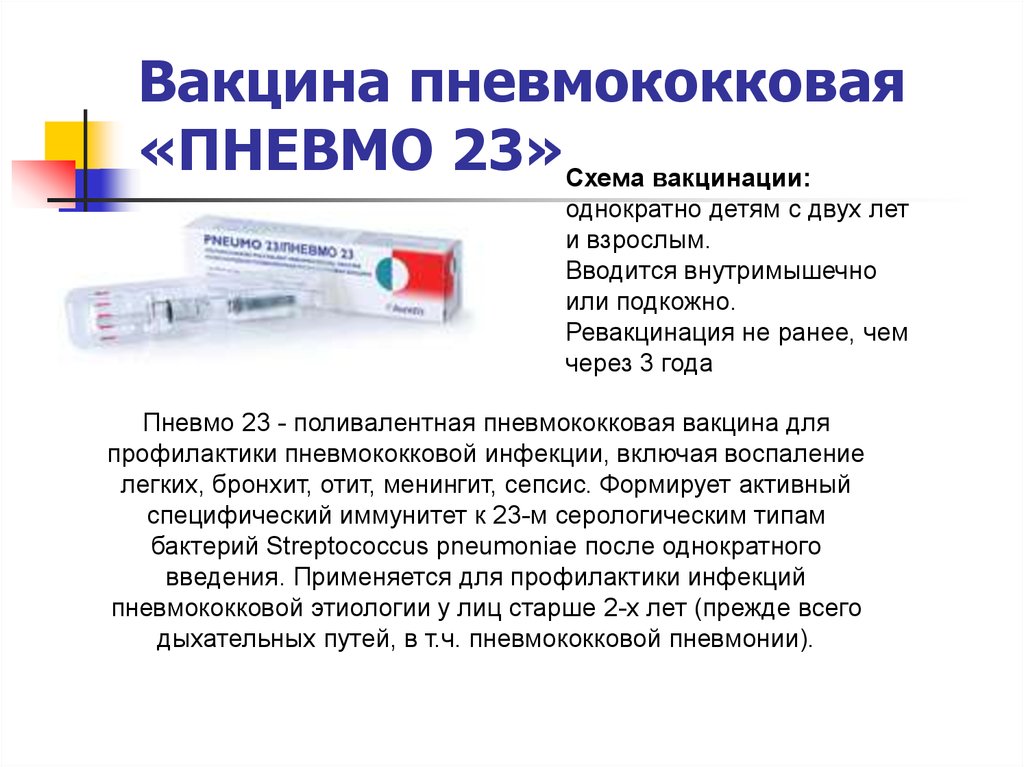 , октябрь; 136 (4): e848-55. doi: 10.1542/пед.2015-0635. Epub 2015 14 сентября.
, октябрь; 136 (4): e848-55. doi: 10.1542/пед.2015-0635. Epub 2015 14 сентября. , Инь Дж.К., Рашид Х., Хандакер Г., Кинг С., Вуд Н., Макартни К.К., Джонс С., Буй Р.
, Инь Дж.К., Рашид Х., Хандакер Г., Кинг С., Вуд Н., Макартни К.К., Джонс С., Буй Р.
 2
2