Содержание
Срочно требуется вакцина для профилактики смертельно опасного стрептококка группы B
Срочно требуется вакцина для профилактики смертельно опасного стрептококка группы B
- Популярные темы
- Загрязнение воздуха
- Коронавирусная болезнь (COVID-19)
- Гепатит
- Данные и статистика »
- Информационный бюллетень
- Факты наглядно
- Публикации
- Найти страну »
- А
- Б
- В
- Г
- Д
- Е
- Ё
- Ж
- З
- И
- Й
- К
- Л
- М
- Н
- О
- П
- Р
- С
- Т
- У
- Ф
- Х
- Ц
- Ч
- Ш
- Щ
- Ъ
- Ы
- Ь
- Э
- Ю
- Я
- ВОЗ в странах »
- Репортажи
- Регионы »
- Африка
- Америка
- Юго-Восточная Азия
- Европа
- Восточное Средиземноморье
- Западная часть Тихого океана
- Центр СМИ
- Пресс-релизы
- Заявления
- Сообщения для медиа
- Комментарии
- Репортажи
- Онлайновые вопросы и ответы
- События
- Фоторепортажи
- Вопросы и ответы
- Последние сведения
- Чрезвычайные ситуации »
- Новости »
- Новости о вспышках болезней
- Данные ВОЗ »
- Приборные панели »
- Приборная панель мониторинга COVID-19
- Основные моменты »
- Информация о ВОЗ »
- Генеральный директор
- Информация о ВОЗ
- Деятельность ВОЗ
- Где работает ВОЗ
- Руководящие органы »
- Всемирная ассамблея здравоохранения
- Исполнительный комитет
- Главная страница/
- Пресс-релизы/
- item/
- Срочно требуется вакцина для профилактики смертельно опасного стрептококка группы B
London School of Hygiene and Tropical Medicine
Mother holding baby
©
Фото
- Глобальное бремя заболеваний, вызванных стрептококком группы B, оказалось значительное выше, чем считалось ранее; ежегодно инфекция вызывает более полумиллиона преждевременных родов, 100 000 случаев смерти новорожденных, не менее 46 000 мертворождений и значительное число случаев инвалидности.

- Бактерия не опасна для большинства беременных, являющихся ее носителями, но может вызывать крайне тяжелые последствия при передаче ребенку во время беременности, на этапе родов или в первые недели жизни.
- Для сокращения смертности, связанной со стрептококками группы B и защиты жизни и здоровья младенцев во всем мире необходимо безотлагательно внедрить новые вакцины.
В новом докладе Всемирной организации здравоохранения (ВОЗ) и Лондонской школы гигиены и тропической медицины (ЛШГТМ) приводятся неутешительные данные о глобальных последствиях для здоровья, вызываемых стрептококком группы B (СГB) – распространенной бактерией, которая может передаваться ребенку в утробе матери, во время рождения или в первые недели жизни и ежегодно вызывает примерно 150 000 случаев младенческой смертности, более полумиллиона случаев преждевременных родов и значительное число случаев хронической инвалидности.
Для сокращения масштабов таких осложнений авторы доклада призывают незамедлительно разработать вакцины для иммунизации матерей против СГВ, подчеркивая, что их потенциально высокую экономическую эффективность и значительные преимущества для здоровья людей во всех регионах мира.
По словам медицинского специалиста Департамента ВОЗ по иммунизации, вакцинам и биологическим препаратам д-ра Филиппа Ламбаха, который является одним из авторов доклада, «в ходе нового исследования было установлено, что стрептококк группы B представляет собой серьезную и недооцененную угрозу выживанию и благополучию новорожденных, вызывая тяжелейшие последствия для огромного числа семей во всем мире. ВОЗ и ее партнеры призывают в кратчайшие сроки разработать вакцину для иммунизации матерей против СГВ, которая принесет гигантскую пользу странам всего мира».
В рамках нового исследования впервые проведена количественная оценка СГВ как значимого фактора преждевременных родов, а также развития таких неврологических расстройств, как детский церебральный паралич, утрата слуха и зрения, которые могут возникать после СГВ-ассоциированных инфекций.
В настоящее время разрабатывается несколько вакцин-кандидатов против СГВ, однако ни одна из них пока не зарегистрирована, хотя поиск вакцин был начат несколько десятилетий назад.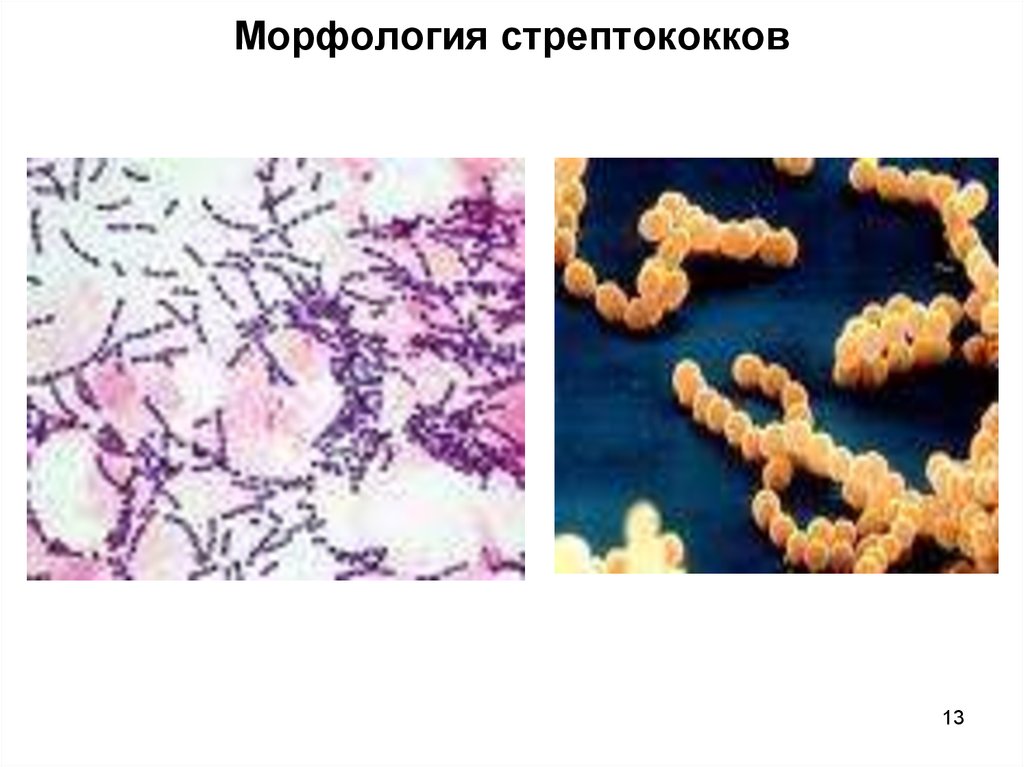
«Инфицирование стрептококком группы B чревато серьезными последствиями для каждой затронутой этой проблемой семьи в любой стране. В предстоящие годы вакцинация матерей может спасти жизнь сотням тысяч младенцев, но с тех пор, как она была предложена 30 лет назад, в мире не было выпущено ни одной вакцины. Настало время защитить вакциной против СГВ наиболее уязвимых граждан мира», – уверена директор Центра по вопросам материнского, подросткового, репродуктивного и детского здоровья (MARCH) при ЛШГТМ профессор Джой Лоун, участвовавшая в подготовке доклада.
Бактерия СГВ присутствует во влагалище в среднем у 15% беременных – это почти 20 млн беременных ежегодно – и, как правило, не проявляет себя никакими симптомами. Впоследствии она может передаваться от беременной женщины плоду в утробе или новорожденному во время родовой деятельности.
В настоящее время при выявлении бактерии в период беременности основным способом предупреждения провоцируемых СГВ заболеваний у новорожденных является профилактика антибиотиками. Однако, поскольку данная мера не позволяет предупредить большинство связанных с СГВ случаев мертворождения, преждевременных родов и заболеваний, вызываемых бактерией после рождения, значительные риски для здоровья сохраняются даже в регионах, где достигнут высокий охват профилактикой.
Однако, поскольку данная мера не позволяет предупредить большинство связанных с СГВ случаев мертворождения, преждевременных родов и заболеваний, вызываемых бактерией после рождения, значительные риски для здоровья сохраняются даже в регионах, где достигнут высокий охват профилактикой.
Важно отметить, что наибольшее бремя СГВ приходится на страны с низким и средним уровнем дохода, где труднее всего организовать скрининг инфекции и ее профилактику на этапе родов, а потребность в вакцине является как нигде острой. Наиболее высокая частота СГВ у матерей наблюдается в странах Африки к югу от Сахары (на которые приходится примерно половина глобального бремени инфекции), а также в Восточной и Юго-Восточной Азии.
«Новая вакцина против СГВ для матерей позволила бы радикально сократить смертность новорожденных и матерей в наиболее неблагополучных странах, особенно в Африке к югу от Сахары, где бремя таких смертей вызывает наибольшую тревогу. Настоятельно призываем все заинтересованные стороны рассматривать это в качестве нравственного императива», – отметила координатор Национальной многосекторальной программы по борьбе со смертностью матерей, новорожденных и детей при Министерстве общественного здравоохранения Камеруна д-р Мартина Луконг Байе, которая также принимала участие в подготовке доклада.
Авторы доклада призывают исследователей, разработчиков вакцин и доноров ускорить разработку эффективной вакцины против СГВ, которую можно было бы вводить беременным во время плановых дородовых обследований.
Согласно оценкам, охват более 70% беременных вакцинацией против СГВ позволит ежегодно предотвращать более 50 000 случаев смерти, связанных с СГВ, а также 170 000 случаев преждевременных родов. По данным доклада, обеспечение ценовой доступности вакцин позволит за нескольких лет добиться ежегодного чистого экономического эффекта от вакцинации матерей против СГВ на уровне 17 млрд долл.
В докладе отмечается дефицит ряда важных данных, не позволяющий достаточно достоверно оценить совокупное бремя обусловленной СГВ смертности и заболеваемости. Так, в целом ряде стран зачастую не всегда проводятся тщательные расследования инфекционных причин мертворождений, в связи с чем реальный вклад СГВ в статистику мертворождений может быть еще больше.
По словам Дебби Форвуд, чья дочь Ада родилась мертвой в результате заражения СГВ, «трудно описать всю тяжесть и глубину горя, которое приносит смерть собственного ребенка, возникающее при этом чувство вины и то, как это навсегда меняет тебя, твою семью и твои отношения. Аду могла спасти только вакцина против СГВ. Когда начнется широкое внедрение вакцины, я буду плакать от чувства несправедливости: она появилась слишком поздно для нее и для других младенцев, безвинно страдающих и умирающих каждый год в ожидании вакцины. Но это будут и слезы радости и надежды на то, что в будущем многие другие младенцы выживут, а их семьи не коснется тот ужас, который приносит смерть ребенка».
Аду могла спасти только вакцина против СГВ. Когда начнется широкое внедрение вакцины, я буду плакать от чувства несправедливости: она появилась слишком поздно для нее и для других младенцев, безвинно страдающих и умирающих каждый год в ожидании вакцины. Но это будут и слезы радости и надежды на то, что в будущем многие другие младенцы выживут, а их семьи не коснется тот ужас, который приносит смерть ребенка».
Доклад был представлен на глобальной конференции ISSAD по СГВ, проводимой ВОЗ и ЛШГТМ со среды, 3 ноября, по пятницу, 5 ноября 2021 г. Конференция призвана мобилизовать усилия исследователей по ликвидации нехватки данных и ускорению научных разработок, направленных на уменьшение бремени этой смертельно опасной бактериальной инфекции во всем мире.
Для получения дополнительной информации и организации интервью просьба обращаться к Тилли Хейнс (Tilly Haynes), [email protected]ЛШГТМ.ac.uk, и Лоре Кинан (Laura Keenan), [email protected] и [email protected].
Мультимедиа
Фотографии и материалы по данному докладу и конференции ISSAD размещены здесь.
Данные о публикациях
Подробная информация о совместном докладе ВОЗ и ЛШГТМ после снятия эмбарго: http://www.who.int/teams/immunization-vaccines-and-biologicals/immunization-analysis-and-insights/vaccine-impact-value/group-b-streptococcus-full-value-of-vaccine-assessment– на английском языке
Подробная информация о статьях в приложении к журналу Clinical Infectious Diseases после снятия эмбарго: https://academic.oup.com/cid/pages/strep-b-worldwide – на английском языке
Во время действия эмбарго доклад и статьи в приложении к журналу Clinical Infectious Diseases можно найти здесь (на английском языке).
Примечания для редакторов
Показатели ежегодного бремени СГВ за 2020 г.
- 19 700 000 беременных с колонизацией влагалища стрептококком группы B
- 518 000 случаев СГВ-ассоциированных преждевременных родов
- 390 000 случаев СГВ у младенцев
- 91 000 случаев смерти новорожденных
- 46 000 и более мертворождений
- 40 000 младенцев, живущих с неврологическими нарушениями после СГВ-ассоциированных инфекций
Информация о докладе и связанных с ним публикациях
В докладе “The global value of Group B streptococcus vaccine” (Глобальная ценность вакцины против стрептококка группы B) приводится обновленная информация о текущих глобальных оценках бремени СГВ, впервые опубликованных ВОЗ и ЛШГТМ в 2017 г. и составляемых при финансовой поддержке Фонда Билла и Мелинды Гейтс. Благодаря поступлению новых данных из Дании и пяти стран с низким и средним уровнем развития (Аргентина, Индия, Кения, Мозамбик и Южная Африка) эти новые оценки впервые включают данные об обусловленных СГВ случаях преждевременных родов, а также о риске нарушений неврологического развития среди перенесших СГВ пациентов.
и составляемых при финансовой поддержке Фонда Билла и Мелинды Гейтс. Благодаря поступлению новых данных из Дании и пяти стран с низким и средним уровнем развития (Аргентина, Индия, Кения, Мозамбик и Южная Африка) эти новые оценки впервые включают данные об обусловленных СГВ случаях преждевременных родов, а также о риске нарушений неврологического развития среди перенесших СГВ пациентов.
Одновременно с докладом в приложении к журналу Clinical Infectious Diseases опубликована серия из девяти статей «Каждая страна, каждая семья: заболевания, вызываемые стрептококками группы B в мире», которая была подготовлена 61 автором из стран шести континентов. В статьях приводятся дополнительные подробные данные об СГВ, а также о чрезвычайных расходах семей в связи с обусловленными СГВ заболеваниями. В двух статьях, подготовленных под руководством ВОЗ, анализируется уровень готовности существующих программ к внедрению вакцины и приводится дополнительная информация о размере рынка и устойчивости спроса на вакцины.
Доклад является первым результатом осуществления Дорожной карты по достижению целей в области борьбы с менингитом на период до 2030 г., разработанной ВОЗ и ее партнерами, включая ЛШГТМ.
Информация о ISSAD
ISSAD2021 (Международный симпозиум по заболеваниям, вызываемым Streptococcus agalactiae) – глобальная конференция «Стрептококк группы B: ускорение научно обоснованных мер в интересах каждой семьи во всем мире». Конференция организована Всемирной организацией здравоохранения, а также Центром вакцин и Центром по вопросам материнского, подросткового, репродуктивного и детского здоровья (MARCH) при Лондонской школе гигиены и тропической медицины. Конференция проводится со среды, 3 ноября, по пятницу, 5 ноября; регистрация на конференцию открыта для всех желающих по адресу ISSAD.org.
Информация о ЛШГТМ
Лондонская школа гигиены и тропической медицины (ЛШГТМ) – ведущий мировой центр научных исследований, послевузовского обучения и повышения квалификации по опросам общественного и мирового здравоохранения. В ЛШГТМ на территории Соединенного Королевства и за рубежом работает более 3500 сотрудников и обучается примерно 5000 студентов, она ежегодно привлекает финансирование на проведение исследований в размере 180 млн фунтов стерлингов и осуществляет свою деятельность по всему миру.
В ЛШГТМ на территории Соединенного Королевства и за рубежом работает более 3500 сотрудников и обучается примерно 5000 студентов, она ежегодно привлекает финансирование на проведение исследований в размере 180 млн фунтов стерлингов и осуществляет свою деятельность по всему миру.
ЛШГТМ является одним из наиболее рейтинговых научно-исследовательских учреждений Соединенного Королевства, работает в партнерстве с двумя университетскими структурами Совета по медицинским исследованиям в Гамбии и Уганде и в 2016 г. была удостоена газетой «Санди таймс» премии «Университет года». Цель нашей работы – укрепление здоровья и справедливости в области здравоохранения в Соединенном Королевстве и во всем мире; сотрудничество с партнерами для эффективного изучения вопросов общественного и мирового здравоохранения и применения полученных знаний в политике и практике.
Следите за нашими новостями на канале @LSHTM в Twitter и слушайте подкаст LSHTM Viral.
www.lshtm.ac.uk
Информация о ВОЗ
ВОЗ основана в 1948 г. и является учреждением системы Организации Объединенных Наций, объединяющим усилия стран, партнеров и людей во имя укрепления здоровья, поддержания безопасности в мире и охвата услугами уязвимых групп населения для того, чтобы каждый имел возможно достичь наивысшего уровня здоровья.
и является учреждением системы Организации Объединенных Наций, объединяющим усилия стран, партнеров и людей во имя укрепления здоровья, поддержания безопасности в мире и охвата услугами уязвимых групп населения для того, чтобы каждый имел возможно достичь наивысшего уровня здоровья.
www.who.int
ВОЗ призывает активизировать разработку вакцин против стрептококка В |
Об этом говорится в докладе, подготовленном Всемирной организацией здравоохранения (ВОЗ) и Лондонской школой гигиены и тропической медицины. Авторы доклада настоятельно призывают разработать вакцины против стрептококка группы B (СГБ), отмечая, что они могут быть рентабельными и принесут огромную пользу людям во всех регионах мира.
«Это новое исследование показывает, что стрептококк группы B является серьезной и недооцененной угрозой новорожденным, приводит к разрушительным последствиям для большого числа семей во всем мире. ВОЗ вместе с партнерами призывает к срочной разработке вакцины для матерей, которая принесет огромную пользу странам во всем мире», – заявил один из авторов доклада, представитель ВОЗ Филипп Ламбах.
В новом докладе впервые были приведены конкретные данные по последствиям СГБ, в том числе цифры по преждевременным родам и смертности новорожденных. В исследовании описаны также неврологические нарушения, в том числе такие как церебральный паралич, потеря слуха и зрения, которые могут возникнуть в результате инфекций, связанных с этой бактерией.
Сейчас в стадии разработки находятся несколько вакцин-кандидатов от СГБ, но все они пока еще недоступны, несмотря на то, что работы ведутся уже несколько десятилетий.
Стрептококки группы B – это бактерии, которые обнаруживаются в нижних отделах кишечника у 10-35 процентов здоровых мужчин и во влагалище и/или нижних отделах кишечника у 10-35 процентов здоровых женщин. Стрептококки группы B не нужно путать со стрептококками группы A, которые вызывают воспаление горла. Бактерия не передается от человека к человеку. Эти микробы являются нормальной частью микрофлоры организма. Однако при определенных условиях стрептококки группы B могут приводить к тяжелым инфекциям, и они особы опасны для рожениц и младенцев.
В среднем 15 процентов всех беременных женщин во всем мире – почти 20 миллионов ежегодно – имеют бактерию во влагалище и, как правило, живут с ней без всяких симптомов. Затем эта бактерия может передаваться от беременной женщины к еще неродившемуся ребенку в утробе матери или к новорожденному во время родов.
Директор Центра репродуктивного здоровья матерей и подростков в Лондонской школе гигиены и тропической медицины и один из авторов доклада профессор Джой Лоун заявила, что инфекция стрептококка группы B является серьезной проблемой для любой страны. По ее словам, вакцинация будущих мам поможет спасти в ближайшие годы жизни сотен тысяч младенцев. Впервые вопрос о необходимости поиска такой вакцины возник еще 30 лет назад, однако ее до сих пор нет.
В настоящее время профилактика антибиотиками, назначаемая женщине во время родов, если бактерия обнаружена во время беременности, является основным средством предотвращения заболевания у новорожденных. Однако даже в регионах с высоким уровнем охвата профилактикой риски для здоровья сохраняются, поскольку антибиотики не могут предотвратить большинство случаев мертворождений и преждевременных родов, связанных с СГБ.
В наибольшей степени страдают женщины и дети в странах с низким и средним уровнем доходов, где не всегда проводятся тесты и не все женщины с бактерией получают антибиотики во время родов. Самые высокие показатели материнского СГБ наблюдаются в Африке к югу от Сахары, а также в Восточной и Юго-Восточной Азии.
Координатор Национальной многоотраслевой программы по борьбе с материнской, новорожденной и детской смертностью при Министерстве здравоохранения Камеруна Мартина Луконг Байе сказала, что разработка безопасной вакцины против СГБ приведет к сокращению младенческой и материнской смертности во многих странах, особенно в Африке к югу от Сахары. Вакцину можно было бы вводить беременным женщинам во время плановых осмотров. Согласно оценкам, появление вакцины поможет предотвратить более 50 тысяч смертей, связанных с СГБ, а также более 170 тысяч преждевременных родов.
Обновленная информация о разработке вакцины против стрептококка группы А
1. Карапетис Дж. Р., Стир А. С., Малхолланд Э. К., Вебер М. Глобальное бремя стрептококковых заболеваний группы А. Ланцет Infect Dis. 2005;5(11):685–94. [PubMed] [Google Scholar]
Р., Стир А. С., Малхолланд Э. К., Вебер М. Глобальное бремя стрептококковых заболеваний группы А. Ланцет Infect Dis. 2005;5(11):685–94. [PubMed] [Google Scholar]
2. Соавторы GMaCoD Глобальная, региональная и национальная возрастно-половая смертность от всех причин и от конкретных причин по 240 причинам смерти, 1990–2013 гг.: систематический анализ глобального бремени болезней Исследование 2013. Ланцет. 2015;385(9963):117–71. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. O’Loughlin RE, Roberson A, Cieslak PR, et al.
Эпидемиология инвазивной стрептококковой инфекции группы А и возможные последствия вакцинации: США, 2000–2004 гг. Клин Инфекция Дис. 2007;45(7):853–62. [PubMed] [Google Scholar]
4. Watkins DA, Johnson CO, Colquhoun SM, et al.
Глобальное, региональное и национальное бремя ревматической болезни сердца, 1990–2015 гг. N Engl J Med. 2017;377(8):713–22. [PubMed] [Google Scholar]
5. Молодой округ Колумбия. Отказ от типоспецифического Streptococcus pyogenes 9Вакцина 0012 для профилактики респираторных инфекций. Мед Булл ВМС США. 1946 (46): 709. [PubMed] [Google Scholar]
Мед Булл ВМС США. 1946 (46): 709. [PubMed] [Google Scholar]
6. Wolfe CK Jr., Hayashi JA, Walsh G, Barkulis SS. Типоспецифический гуморальный ответ у человека на инъекции клеточных стенок и белка М стрептококков группы А 14 типа. J Lab Clin Med. 1963; 61: 459–68. [PubMed] [Google Scholar]
7. Поттер Э.В., Столлерман Г.Х., Сигел А.С. Восстановление типоспецифических антител у человека путем инъекций стрептококковых клеточных стенок. Джей Клин Инвест. 1962;41:301–10. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Massell BF, Michael JG, Amezcua J, Siner M. Вторичный и очевидный первичный ответ антител после вакцинации против стрептококка группы А у 21 ребенка. Приложение микробиол. 1968; 16 (3): 509–18. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. Massell BF, Honikman LH, Amezcua J. Ревматическая лихорадка после стрептококковой вакцинации. Отчет о трех случаях. Джама. 1969; 207(6):1115–9. [PubMed] [Google Scholar]
10. Fox EN, Waldman RH, Wittner MK, et al.
Защитное исследование с вакциной против стрептококка группы А с белком М. Инфекционность человека-добровольца. Джей Клин Инвест. 1973; 52 (8): 1885–92. [Бесплатная статья PMC] [PubMed] [Google Scholar]
11. Polly SM, Waldman RH, High P, et al.
Защитные исследования с вакциной против стрептококка группы А с белком М. II. Заражение добровольцев после местной иммунизации в верхние дыхательные пути. J заразить дис. 1975; 131: 217–24. [PubMed] [Google Scholar]
12. Beachey EH, Stollerman GH, Johnson RH, et al.
Иммунный ответ человека на иммунизацию структурно определенным полипептидным фрагментом стрептококкового М-белка. J Эксперт Мед. 1979;150:862–77. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Maclennan AP. Производство капсул, гиалуроновой кислоты и гиалуронидазы стрептококками группы А и группы С. Журнал общей микробиологии. 1956; 14 (1): 134–42. [PubMed] [Google Scholar]
14. Миколи Ф., Константино П., Адамо Р. Потенциальные мишени для антимикробных гликоконъюгированных вакцин следующего поколения. FEMS Microbiol Rev. 2018;42(3):388–423. [Бесплатная статья PMC] [PubMed] [Google Scholar]
FEMS Microbiol Rev. 2018;42(3):388–423. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Mistou MY, Sutcliffe IA, van Sorge NM. Бактериальная гликобиология: полисахариды клеточной стенки, содержащие рамнозу, у грамположительных бактерий. FEMS Microbiol Rev. 2016;40(4):464–79. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Edgar RJ, van Hensbergen VP, Ruda A, et al.
Открытие модификации глицеринфосфата полисахаридов стрептококковой рамнозы. Химическая биология природы. 2019;15:463–71. [Бесплатная статья PMC] [PubMed] [Google Scholar]
17. Sabharwal H, Michon F, Nelson D, et al.
Углеводы Streptococcus группы A (GAS) в качестве иммуногена для защиты от инфекции GAS. J заразить дис. 2006;193(1):129–35. [PubMed] [Академия Google]
18. Malkiel S, Liao L, Cunningham MW, Diamond B. Зависимый от Т-клеток гуморальный ответ на сопутствующий эпитоп стрептококкового полисахарида, N -ацетилглюкозамин, является перекрестно-реактивным с сердечным миозином. Заразить иммун. 2000;68(10):5803–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Заразить иммун. 2000;68(10):5803–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. van Sorge NM, Cole JN, Kuipers K, et al.
Классический антиген Ланцфилда стрептококка группы А является детерминантой вирулентности, имеющей значение для дизайна вакцины. Клеточный микроб-хозяин. 2014;15(6):729–40. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Rivera-Hernandez T, Pandey M, Henningham A, et al.
Различная эффективность вакцин-кандидатов против стрептококка группы А и полноразмерного белка М в моделях кожных и инвазивных заболеваний. мБио. 2016;7(3):e00618–16. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Walker MJ, Barnett TC, McArthur JD, et al.
Проявления болезни и механизмы патогенеза стрептококка группы А. Clin Microbiol Rev. 2014;27(2):264–301. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Хеннингем А., Гиллен С.М., Уокер М.Дж. Кандидаты против стрептококковой вакцины группы А: потенциал для разработки вакцины для человека В: Chhatwal GS, редактор. Взаимодействия хозяин-возбудитель при стрептококковых заболеваниях. 368
Взаимодействия хозяин-возбудитель при стрептококковых заболеваниях. 368
Гейдельберг: Спрингер; 2012. с. 207–42. [PubMed] [Google Scholar]
23. Davies MR, McIntyre L, Mutreja A, et al.
Атлас вакцин-кандидатов против стрептококка группы А, составленный с использованием крупномасштабной сравнительной геномики. Генетика природы. 2019;51:1035–43. [Бесплатная статья PMC] [PubMed] [Google Scholar]
24. Moreland NJ, Waddington CS, Williamson DA, et al.
Работа над вакциной против стрептококка группы А: отчет о совместном транстасманском семинаре. вакцина. 2014;32(30):3713–20. [PubMed] [Google Scholar]
25. Bensi G, Mora M, Tuscano G, et al.
Мульти высокопроизводительный подход для высокоселективной идентификации вакцин-кандидатов: случай стрептококка группы А. Молекулярная и клеточная протеомика. 2012;11(6):M111.015693. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. Rivera-Hernandez T, Rhyme MS, Cork AJ, et al.
Вакцино-индуцированный ответ Th2-типа защищает от инвазивной инфекции стрептококком группы А в отсутствие опсонизирующих антител. мБио. 2020; В печати. [Статья бесплатно PMC] [PubMed] [Google Scholar]** демонстрирует полезность адъювантов для создания усиленного защитного иммунитета против стрептококка A
мБио. 2020; В печати. [Статья бесплатно PMC] [PubMed] [Google Scholar]** демонстрирует полезность адъювантов для создания усиленного защитного иммунитета против стрептококка A
27. Rivera-Hernandez T, Carnathan DG, Jones S, et al.
Вакцина экспериментальной группы A Streptococcus , которая уменьшает фарингит и тонзиллит в модели приматов, отличных от человека. мБио. 2019;10(2):e00693–19. [Статья бесплатно PMC] [PubMed] [Google Scholar]** Модель приматов, отличных от человека, использовалась для проверки эффективности вакцины StrepA
28. Reglinski M, Gierula M, Lynskey NN, et al.
Идентификация поверхностных антигенов Streptococcus pyogenes , распознаваемых объединенным человеческим иммуноглобулином. Научные отчеты. 2015;5:15825. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Reglinski M, Lynskey NN, Jung Choi Y, et al.
Разработка многокомпонентной вакцины против Streptococcus pyogenes на основе антигенных мишеней ВВИГ. Журнал инфекции. 2016;72(4):450–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2016;72(4):450–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Bi S, Xu M, Zhou Y, et al.
Многокомпонентная вакцина обеспечивает иммунитет против местных и системных инфекций, вызванных стрептококком группы А всех серотипов. mBio.10(6):e02600–19. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Справочная страница CDC Streptococcal [Доступно по адресу: ftp://ftp.cdc.gov/pub/infectious_diseases/biotech/tstransl/.
32. Дейл Дж. Б., Чанг Э. Ю., Ледерер Дж. В. Рекомбинантная четырехвалентная стрептококковая М-протеиновая вакцина группы А. Дж Иммунол. 1993; 151:2188–94. [PubMed] [Google Scholar]
33. Dale JB, Simmons M, Chiang EC, Chiang EY. Рекомбинантная восьмивалентная стрептококковая М-белковая вакцина группы А. вакцина. 1996; 14:944–8. [PubMed] [Google Scholar]
34. Дейл Дж. Б.. Мультивалентная вакцина против стрептококка группы А, предназначенная для оптимизации иммуногенности шести тандемных фрагментов белка М. вакцина. 1999; 17: 193–200. [PubMed] [Академия Google]
[PubMed] [Академия Google]
35. Hu MC, Walls MA, Stroop SD, et al.
Иммуногенность 26-валентной стрептококковой вакцины группы А. Заразить иммун. 2002;70(4):2171–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
36. Dale JB, Penfound TA, Chiang EY, Walton WJ. Новая 30-валентная вакцина на основе белка М вызывает перекрестные опсонические антитела против невакцинных серотипов стрептококков группы А. вакцина. 2011;29(46):8175–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Pastural E, McNeil SA, MacKinnon-Cameron D, et al.
Безопасность и иммуногенность 30-валентной стрептококковой вакцины на основе белка М у здоровых взрослых добровольцев: рандомизированное контролируемое исследование фазы I. вакцина. 2020; 38 (6): 1384–9.2. [PubMed] [Google Scholar]**описание фазы 1 испытаний (первой на людях) новой 30-валентной вакцины на основе белка М: отчеты о четвертом клиническом испытании различных мультивалентных вакцин М
38. Возняк А. , Scioscia N, Garcia PC, et al.
Защитный иммунитет, индуцированный интраназальной поливалентной вакциной, содержащей 10 штаммов Lactococcus lactis, экспрессирующих широко распространенные антигены M-белка, полученные из Streptococcus группы A. Микробиол Иммунол. 2018;62(6):395–404. [Статья бесплатно PMC] [PubMed] [Google Scholar]*уникальный метод отображения М-пептидов на поверхности коменсального организма для введения вакцины через слизистую оболочку
39. Garcia PC, Paillavil BA, Scioscia N, et al.
Клинический и микробиологический ответ мышей на интраназальную инокуляцию Lactococcus lactis, экспрессирующим антигены стрептококка группы А, для использования в качестве антистрептококковой вакцины. Микробиол Иммунол. 2018;62(11):711–9. [PubMed] [Google Scholar]
40. Steer AC, Law I, Matatolu L, et al.
Глобальное распространение стрептококков группы А по типу emm: систематический обзор и последствия для разработки вакцин. Ланцет Infect Dis. 2009;9(10): 611–6. [PubMed] [Google Scholar]
41. Giffard PM, Tong SYC, Holt DC, et al.
Опасения по поводу эффективности 30-валентной вакцины против Streptococcus pyogenes на основе М-белка в регионах с высоким уровнем ревматической болезни сердца. PLoS Negl Trop Dis. 2019;13(7):e0007511. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Абрахам Т., Систла С. Расшифровка молекулярной эпидемиологии стрептококка группы А — взгляд Индии. J Med Microbiol. 2019;68(7):1059–71. [PubMed] [Академия Google]
43. Сандерсон-Смит М., Де Оливейра Д.М., Гульельмини Дж. и соавт.
Систематическая и функциональная классификация Streptococcus pyogenes, которая служит новым инструментом для молекулярного типирования и разработки вакцин. J заразить дис. 2014;210(8):1325–38. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Dale JB, Smeesters PR, Courtney HS, et al.
Основанный на структуре дизайн широкозащитных вакцин на основе белка М против стрептококка группы А. вакцина. 2017;35(1):19–26. [Бесплатная статья PMC] [PubMed] [Google Scholar]
45. Frost HR, Laho D, Sanderson-Smith ML, et al.
Иммунная перекрестная опсонизация внутри кластеров ЭММ после групповой стрептококковой инфекции кожи: расширение сферы типоспецифического иммунитета. Клин Инфекция Дис. 2017;65(9):1523–31. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46. Buffalo CZ, Bahn-Suh AJ, Hirakis SP, et al.
Консервативные паттерны, скрытые в гипервариабельности белка M стрептококка группы А, распознают человеческий C4b-связывающий белок. Нат микробиол. 2016;1:16155. [Бесплатная статья PMC] [PubMed] [Google Scholar]
47. Вариант Гош П., Незаменимость и маскировка в М-белке. Тенденции микробиол. 2018;26(2):132–44. [Статья бесплатно PMC] [PubMed] [Google Scholar] * обзор структур HVR консервативного белка M и потенциал для разработки вакцины
48. Good MF, Pandey M, Batzloff MR, Tyrrell GJ. Стратегическая разработка консервативной области белка М и других кандидатов в качестве вакцин для предотвращения заражения стрептококками группы А. Эксперт Rev Вакцины. 2015;14(11):1459–70. [PubMed] [Академия Google]
49. Guilherme L, Fae KC, Higa F, et al.
Guilherme L, Fae KC, Higa F, et al.
На пути к вакцине против ревматизма. Клин Дев Иммунол. 2006;13(2–4):125–32. [Бесплатная статья PMC] [PubMed] [Google Scholar]
50. Postol E, Sa-Rocha LC, Sampaio RO, et al.
Адсорбированная вакцина против стрептококка группы А: тест на токсичность повторной внутримышечной дозы на мини-свиньях. Научный доклад 2019; 9 (1): 9733. [Бесплатная статья PMC] [PubMed] [Google Scholar]
51. Batzloff MR, Hayman WA, Davies MR, et al.
Защита от стрептококка группы А путем иммунизации J8-дифтерийным анатоксином: вклад J8- и дифтерийного анатоксина в защиту. J заразить дис. 2003;187(10):1598–608. [PubMed] [Google Scholar]
52. Batzloff MR, Hartas J, Zeng W, et al.
Интраназальная вакцинация липопептидом, содержащим конформационно ограниченный консервативный минимальный пептид, универсальный Т-клеточный эпитоп и самоадъювантный липид, защищает мышей от заражения стрептококком группы А и уменьшает колонизацию горла. J заразить дис. 2006;194(3):325–30. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
53. Campbell PT, Frost H, Smeesters PR, et al.
Исследование иммунных реакций стрептококков группы А в эндемичных условиях с особым акцентом на J8. вакцина. 2018;36(50):7618–24. [Бесплатная статья PMC] [PubMed] [Google Scholar]
54. Sekuloski S, Batzloff MR, Griffin P, et al.
Оценка безопасности и иммуногенности вакцины-кандидата против стрептококка группы А (MJ8VAX) в рандомизированном клиническом исследовании. ПЛОС Один. 2018;13(7):e0198658. [Статья бесплатно PMC] [PubMed] [Google Scholar]**первое испытание вакцины против J8 в фазе 1 на людях
55. Nevagi RJ, Dai W, Khalil ZG, et al.
Взаимосвязь структура-активность липопептидных вакцин-кандидатов против стрептококка группы А в самоадъювантной системе доставки на основе триметилхитозана. Eur J Med Chem. 2019;179:100–8. [PubMed] [Google Scholar]*новый состав для доставки вакцины, использующий наночастицы триметилхитозана для связывания анионных пептидов J8, синтезированных таким образом, чтобы содержать полиглутаминовую кислоту и универсальный Т-клеточный эпитоп
56. Nordstrom T, Pandey M, Calcutt A, et al. .
Nordstrom T, Pandey M, Calcutt A, et al. .
Повышение эффективности вакцины путем разработки сложного синтетического пептида, который станет супериммуногеном. Дж Иммунол. 2017;199(8):2794–802. [PubMed] [Google Scholar]
57. Schulze K, Ebensen T, Chandrudu S, et al.
Бивалентные пептидные вакцины слизистых оболочек, вводимые с использованием системы переносчиков LCP, стимулируют защитные иммунные реакции против инфекции Streptococcus pyogenes. Наномедицина. 2017;13(8):2463–74. [PubMed] [Академия Google]
58. Xu Z, Rivera-Hernandez T, Chatterjee O, et al.
Разработка полусинтетической, самоадъювантной вакцины: эффективное сайт-специфическое опосредованное сортазой А конъюгирование лиганда Toll-подобного рецептора 2 FSL-1 с рекомбинантными белковыми антигенами в нативных условиях и применение в модельной вакцине против стрептококка группы А. J Управление выпуском. 2019; 317: 96–108. [PubMed] [Google Scholar]** передовой подход к дизайну вакцины, включающий несколько пептидов Strep AM, мотив сортазы и полигистидиновую метку в рекомбинантном слитом белке, модифицированном с использованием очищенного фермента сортазы для ковалентного связывания TLR, активирующего FSL-1. и одновременно удалить His-метку
и одновременно удалить His-метку
59. Всемирная организация здравоохранения. https://www.who.int/ncds/management/rheumatic-heart-disease-resolution/en/
2018.
60. Vekemans J, Gouvea-Reis F, Kim JH, et al.
Путь к вакцинам против стрептококка группы А: дорожная карта технологий исследований и разработок ВОЗ и предпочтительные характеристики продукта. Клин Инфекция Дис. 2019. [Бесплатная статья PMC] [PubMed] [Google Scholar]*краткое изложение основополагающих документов ВОЗ с изложением дорожной карты и рекомендациями по предпочтительным продуктам для исследователей и промышленности
61. Osowicki J, Azzopardi KI, Baker C, et al.
Контролируемая инфекция человека для вакцинации против Streptococcus pyogenes (CHIVAS): организация исследования инфекции человека, вызванного Streptococcus pharyngitis группы А. вакцина. 2019;37(26):3485–94. [PubMed] [Google Scholar]* описание текущих усилий по созданию модели заражения человека стрептококком А, которая может служить основой для выбора вакцин-кандидатов и, возможно, для установления иммунных коррелятов защиты человека
Вакцина против стрептококка группы А | Праворульное действие
Пробирки NVGH для исследования вакцин
Novartis AG / Flickr
Вакцина против GAS обещает окончательный контроль над ОРЛ, RHD и другими заболеваниями, вызываемыми теми же бактериями. Попытки разработать вакцину против ГАС предпринимались с начала 1920-х годов, и некоторые из них дошли до ранних испытаний на людях. В последние годы ускорился прогресс в создании безопасной, эффективной, доступной и практичной вакцины против ГАС.
Попытки разработать вакцину против ГАС предпринимались с начала 1920-х годов, и некоторые из них дошли до ранних испытаний на людях. В последние годы ускорился прогресс в создании безопасной, эффективной, доступной и практичной вакцины против ГАС.
Консультативный комитет Всемирной организации здравоохранения по разработке продуктов для вакцин (PD-VAC) изучает возможности разработки вакцин против GAS. Кроме того, Инициатива Коалиции по продвижению новых вакцин против стрептококка группы А (CANVAS), финансируемая правительствами Австралии и Новой Зеландии, началась в 2013 году. Ряд вакцин-кандидатов проходят ранние испытания на людях.
Приоритизация, разработка и реализация программ вакцинации — сложная международная задача. Точно так же фундаментальная научная разработка вакцин является узкоспециализированной, дорогостоящей и технически сложной. Эти барьеры могут затруднить взаимодействие местных программ по борьбе с болезнями с установлением глобальных приоритетов в отношении вакцин. На самом деле страны, сообщества и программы контроля являются основными заинтересованными сторонами в разработке вакцин. Участие на местном уровне имеет решающее значение для производства вакцины, которая необходима, принята и одобрена.
На самом деле страны, сообщества и программы контроля являются основными заинтересованными сторонами в разработке вакцин. Участие на местном уровне имеет решающее значение для производства вакцины, которая необходима, принята и одобрена.
Важность участия на раннем этапе на страновом уровне демонстрируется быстрым внедрением некоторых вакцин (ротавирусной и пневмококковой) после лицензирования продукта. Другие, в том числе HiB и гепатит B, получили широкое распространение с длительными задержками. В свете этого опыта ВОЗ разработала Руководство по внедрению вакцин, чтобы помочь странам принять решение о новых вакцинах. Эта модель была расширена и адаптирована для изучения предварительной работы по принятию решений о вакцине против малярии. Необходима аналогичная основа для подготовительного участия в вакцинации против ГАС. Тем временем ключевые темы, адаптированные из малярии, изложены ниже:
Сигнал о спросе на вакцину
Выявление и информирование о потребностях в вакцинах в условиях ограниченных ресурсов имеет решающее значение для обеспечения интереса, финансирования и поддержки со стороны крупных заинтересованных сторон.
