Содержание
Детская городская поликлиника №15
Версия для слабовидящих
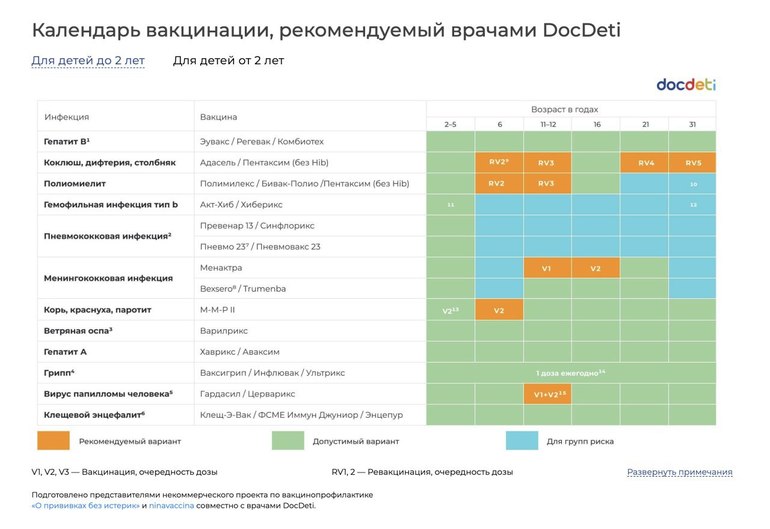
| Региональный календарь детских профилактических прививок | ||||||||||||||||||
| Груднички | Малыши | Дошкольники2 | Школьники3 | |||||||||||||||
| Месяцы | Годы | |||||||||||||||||
| 0 | 1 | 2 | 3 | 4,5 | 6 | 12 | 15 | 18 | 20 | 24 | 3-5 | 6 | 7 | 8-11 | 12-13 | 14 | 15-17 | |
| Туберкулез | 3-7 дн. | RV | ||||||||||||||||
| Вирусный гепатит В | V1 | V2 | V3 | V3 | V4 | |||||||||||||
| V1 | V2 | |||||||||||||||||
| Ротавирусная инфекция | V1 | V2 | V3 | |||||||||||||||
| Пневмококковая инфекция | V1 | V2 | RV | |||||||||||||||
| Коклюш | V1 | V2 | V3 | RV1 | RV2 | |||||||||||||
| Дифтерия | RV3 | |||||||||||||||||
| Столбняк | ||||||||||||||||||
| Полиомиелит | ИПВ | ИПВ | ИПВ | ИПВ | ОПВ | ОПВ | ||||||||||||
| ИПВ | ИПВ | |||||||||||||||||
| Гемофильная инфекция | V1 | V2 | V3 | RV | ||||||||||||||
| Корь | V1 | RV | ||||||||||||||||
| Краснуха | ||||||||||||||||||
| Эпидемический паротит | ||||||||||||||||||
| Менингококковая инфекция | перед поступлением в детские учреждения | |||||||||||||||||
| Вирусный гепатит А | ||||||||||||||||||
| Ветряная оспа | перед поступлением в детские учреждения | |||||||||||||||||
| Грипп | Ежегодно | |||||||||||||||||
| Вирус папилломы человека | Девочки | |||||||||||||||||
| 1 – Делают в родильном доме; 2 — Делают в медицинском кабинете дошкольной организации; 3 – Делают в медицинском кабинете школы | ||||||||||||||||||
| Нужна прививка | ОПВ — живая вакцина | V — плановая вакцинация | ||||||||||||||||
| Нужна прививка детям, входящим в группу риска | ИПВ — инактивированная вакцина | RV — ревакцинация | ||||||||||||||||
| Если ребенок не болел или отсутствуют сведения о прививке | ||||||||||||||||||
0
Расширенное меню
Государственное бюджетное учреждение здравоохранения города Москвы
«Детская городская поликлиника № 15 Департамента здравоохранения города Москвы»
ГБУЗ г. Москвы ДГП №15 ДЗМ
Москвы ДГП №15 ДЗМ
Главный врач: Щукина Ольга Витальевна
Адрес: 127422 г. Москва, ул. Всеволода Вишневского д 4а
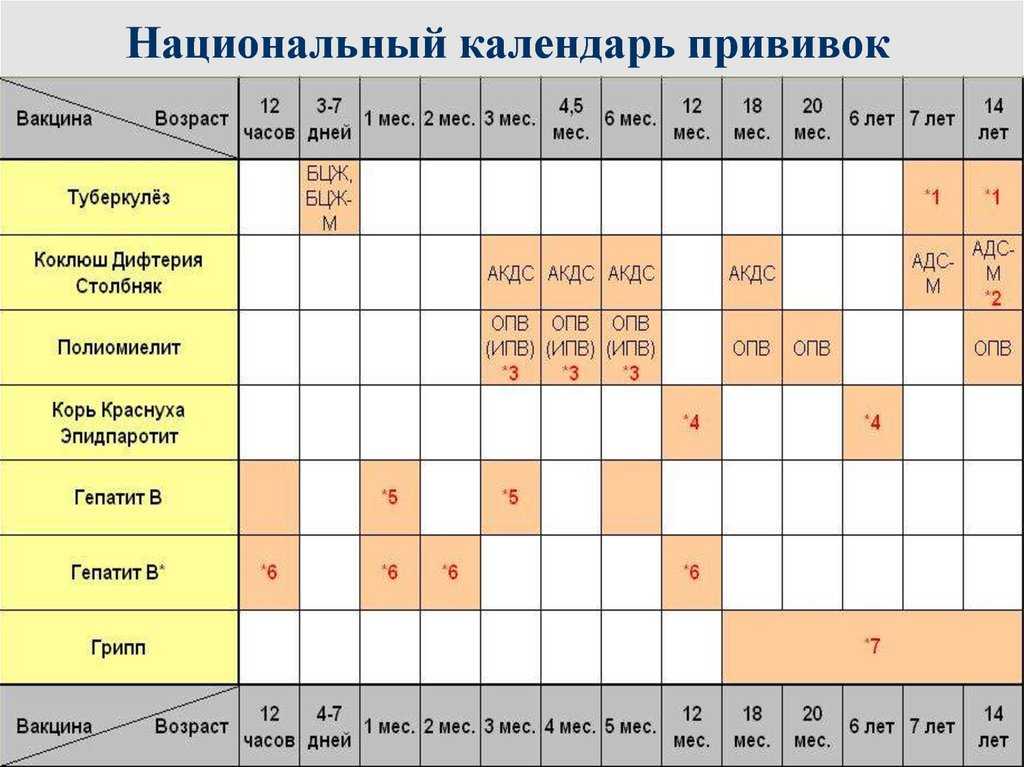
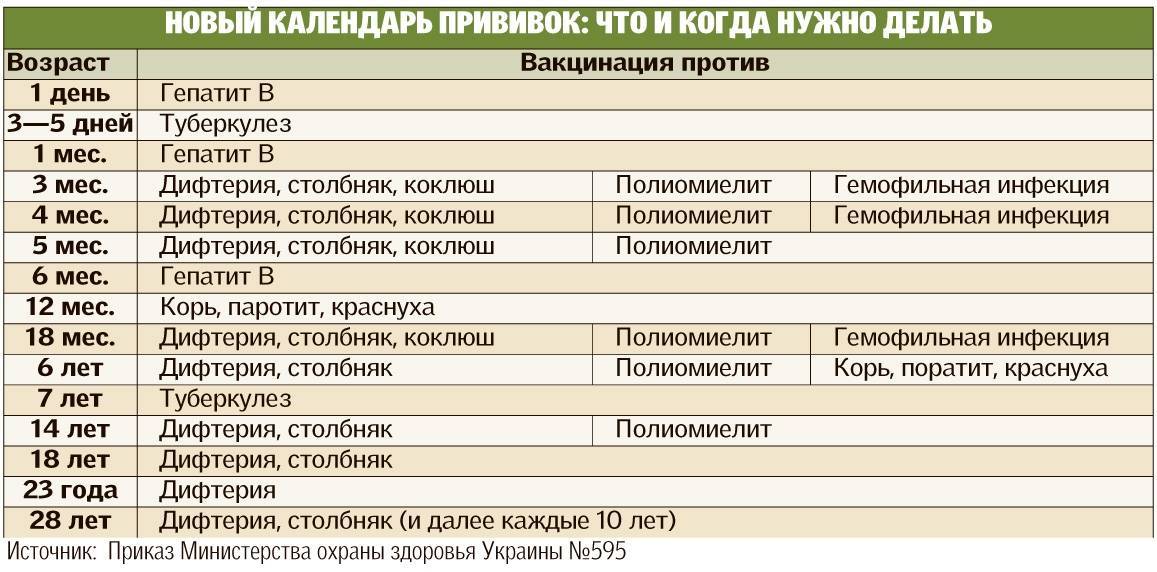
Календарь прививок 2018 Российский Национальный Детский
Календарь прививок 2022 Календарь детских профилактических прививок 2022 В соответствии с приказом МЗ РФ от 6 декабря 2021 | ||
Возраст | Прививка | Примечание (если сроки сдвинулись) |
Новорожденные в первые 24 часа жизни | Первая вакцинация против вирусного гепатита В | |
Новорожденные на 3-7 день жизни | Вакцинация против туберкулеза | |
Дети в 1 месяц | Вторая вакцинация против вирусного гепатита В | Через 1месяц после первой |
Дети в 2 месяца | Первая вакцинация против пневмококковой инфекции | |
Дети в 3 месяца | Первая вакцинация против дифтерии, коклюша, столбняка | |
Первая вакцинация против полиомиелита вакциной ИПВ | ||
Первая вакцинация против гемофильной инфекции (детям из групп риска) | ||
Дети в 4,5 месяца | Вторая вакцинация против дифтерии, коклюша, столбняка | Через 45дней после первой вакцинации |
Вторая вакцинация против полиомиелита вакциной ИПВ | ||
Вторая вакцинация против гемофильной инфекции (детям из групп риска) | Через 45дней после первой вакцинации | |
Вторая вакцинация против пневмококковой инфекции | Через 60дней после первой вакцинации | |
Дети в 6 месяцев | Третья вакцинация против дифтерии, коклюша, столбняка | Через 45дней после второй вакцинации |
Третья вакцинация против полиомиелита вакциной ОПВ | ||
Третья вакцинация против вирусного гепатита В | Через 6 мес. | |
Третья вакцинация против гемофильной инфекции (детям из групп риска) | Через 45дней после второй вакцинации | |
Дети в 12 месяцев | Вакцинация против кори, краснухи, эпидемического паротита | |
Дети в 15 месяцев | Ревакцинация против пневмококковой инфекции | Через 4 месяца после второй вакцинации |
Дети в 18 месяцев | Первая ревакцинация против дифтерии, коклюша, столбняка | Через год после законченой вакцинации |
Первая ревакцинация против полиомиелита вакциной ОПВ | Через 2 мес. после законченой вакцинации | |
Ревакцинация против гемофильной инфекции (детям из групп риска) | Через год после законченой вакцинации | |
Дети в 20 месяцев | Вторая ревакцинация против полиомиелита вакциной ОПВ | Через 2 мес. |
Дети в 6 лет | Ревакцинация против кори, краснухи, эпидемического паротита Третья ревакцинация от полиомиелита | Через 6 мес после вакцинации |
Дети в 6-7 лет | Вторая ревакцинация против дифтерии, столбняка | Через 5 лет после первой ревакцинации |
Дети в 6-7 лет | Ревакцинация против туберкулеза | Детям с отрицательной реакцией Манту |
Дети в 14 лет Взрослые с 18 лет | Третья ревакцинация против дифтерии, столбняка | Через 7лет после второй ревакцинации |
Каждые 10 лет ревакцинация от дифтерии и столбняка с момента предыдущей ревакцинации | ||
Календарь прививок Вакцинация против гемофильной инфекции
Проводится детям, относящимся к группам риска:
с иммунодефицитными состояниями или анатомическими дефектами, приводящими к резко повышенной опасности заболевания гемофильной инфекцией;
с онкогематологическими заболеваниями и/или длительно получающие иммуносупрессивную терапию;
ВИЧ-инфицированным или рожденным от ВИЧ-инфицированных матерей;
находящимся в закрытых детских дошкольных учреждениях (дома ребенка, детские дома, специализированные интернаты (для детей с психоневрологическими заболеваниями и др. ), противотуберкулезные санитарно-оздоровительные учреждения).
), противотуберкулезные санитарно-оздоровительные учреждения).
Примечание.
Курс вакцинации против гемофильной инфекции для детей в возрасте от 3 до 6 месяцев состоит из 3 инъекций по 0,5 мл с интервалом 1-1,5 месяца.
Для детей, не получивших первую вакцинацию в 3 месяца иммунизация проводится по следующей схеме:
для детей в возрасте от 6 до 12 месяцев из 2 инъекций по 0,5 мл с интервалом в 1-1,5 месяца
для детей от 1 года до 5 лет однократная инъекция 0,5 мл.
Ревакцинацию проводят однократно детям, привитым на первом году жизни
Календарь прививок Вакцинация от пневмококковой инфекции
С 1.01.2015 г. в Российский календарь детских профилактических прививок введена прививка от пневмококковой инфекции. Прививка проводится всем детям с 2х месяцев до 5 лет вакциной Превенар.
На первом году жизни вакцинация проводится двукратно с интервалом не менее 2х месяцев, начиная с 2х месяцев, ревакцинация — в 12-15 месяцев. Минимальный интервал между вакцинацией и ревакцинацией — 4 месяца.
Минимальный интервал между вакцинацией и ревакцинацией — 4 месяца.
Если вакцинация этой вакциной проводится после 12 месяцев — прививку делают двукратно с интервалом 2 месяца, ревакцинация не требуется.
После 2х летнего возраста прививку вакциной Превенар делают однократно, ревакцинация не требуется.
В соответствии с приказом от 21 марта 2014 г. N 125н ОБ УТВЕРЖДЕНИИ НАЦИОНАЛЬНОГО КАЛЕНДАРЯ ПРОФИЛАКТИЧЕСКИХ ПРИВИВОК И КАЛЕНДАРЯ ПРОФИЛАКТИЧЕСКИХ ПРИВИВОК ПО ЭПИДЕМИЧЕСКИМ ПОКАЗАНИЯМ
Для сравнения публикую Германский календарь прививок, специально для тех мам, которые считают, что у нас в России прививок больше, чем в других странах.
Влияние моновалентных, бивалентных и трехвалентных оральных полиовирусных вакцин на иммуногенность моновалентной ротавирусной вакцины в сельских районах Бангладеш
Рандомизированное контролируемое исследование
. 2016 15 января; 62 (2): 150-6.
дои: 10. 1093/cid/civ807.
1093/cid/civ807.
Epub 2015 8 сентября.
Деви М Эмперадор
1
, Даниэль Э. Веласкес
1
, Консепсьон Ф Эстивариз
2
, Бен Лопман
1
, Баомин Цзян
1
, Умеш Парашар
1
, Абхиджит Ананд
2
, Халеку Заман
3
Принадлежности
- 1 Отделение вирусных заболеваний.
- 2 Глобальный отдел иммунизации, Центры по контролю и профилактике заболеваний, Атланта, Джорджия.
- 3 Международный центр исследований диарейных заболеваний, Дакка, Бангладеш.

PMID:
26349548
PMCID:
PMC4755336
DOI:
10.1093/сид/цив807
Бесплатная статья ЧВК
Рандомизированное контролируемое исследование
Devy M Emperador et al.
Клин Инфекция Дис.
.
Бесплатная статья ЧВК
. 2016 15 января; 62 (2): 150-6.
дои: 10.1093/сид/цив807.
Epub 2015 8 сентября.
Авторы
Деви М Эмперадор
1
, Даниэль Э. Веласкес
1
, Консепсьон Ф Эстиварис
2
, Бен Лопман
1
, Баомин Цзян
1
, Умеш Парашар
1
, Абхиджит Ананд
2
, Халеку Заман
3
Принадлежности
- 1 Отделение вирусных заболеваний.
- 2 Глобальный отдел иммунизации, Центры по контролю и профилактике заболеваний, Атланта, Джорджия.
- 3 Международный центр исследований диарейных заболеваний, Дакка, Бангладеш.

PMID:
26349548
PMCID:
PMC4755336
DOI:
10.1093/сид/цив807
Абстрактный
Фон:
Известно, что трехвалентная оральная полиомиелитная вакцина (ОПВ) препятствует иммуногенности моновалентной ротавирусной вакцины (RV1). Помехи, вызываемые двухвалентными и моновалентными составами ОПВ, которые в ближайшие годы будут все более широко использоваться во всем мире, не изучались. Мы провели апостериорный анализ для оценки влияния совместного введения различных составов ОПВ на иммуногенность RV1.
Методы:
Здоровые младенцы в Матлабе, Бангладеш, были рандомизированы для получения 3 доз моновалентной ОПВ типа 1 или бивалентной ОПВ типов 1 и 3 в возрасте 6, 8 и 10 или 6, 10 и 14 недель или трехвалентной ОПВ в возрасте 6, 10 лет. и в возрасте 14 недель. Все младенцы получили 2 дозы RV1 примерно в возрасте 6 и 10 недель. Одновременное введение определялось как введение RV1 и ОПВ в один и тот же день; поэтапное введение RV1 и ОПВ с интервалом ≥1 дня. Сероконверсию ротавируса определяли как 4-кратное повышение титра иммуноглобулина А от периода до введения первой дозы RV1 до ≥3 недель после введения второй дозы RV1.
и в возрасте 14 недель. Все младенцы получили 2 дозы RV1 примерно в возрасте 6 и 10 недель. Одновременное введение определялось как введение RV1 и ОПВ в один и тот же день; поэтапное введение RV1 и ОПВ с интервалом ≥1 дня. Сероконверсию ротавируса определяли как 4-кратное повышение титра иммуноглобулина А от периода до введения первой дозы RV1 до ≥3 недель после введения второй дозы RV1.
Полученные результаты:
Не было никаких существенных различий в исходной иммуногенности RV1 среди 409 младенцев, включенных в окончательный анализ. Младенцы, получившие одновременно RV1 и ОПВ, независимо от состава ОПВ, имели меньшую вероятность сероконверсии (47%; 95% доверительный интервал, 39%-54%), чем те, кто получил обе вакцины с интервалом ≥1 дня (63%; 57%-). 70%; P < 0,001). Что касается поэтапного введения, мы не обнаружили доказательств того, что интервал между введением RV1 и ОПВ влиял на иммуногенность RV1.
Выводы:
Совместное введение моновалентной, двухвалентной или трехвалентной ОПВ, по-видимому, снижает иммуногенность RV1.
Регистрация клинических исследований:
NCT01633216.
Ключевые слова:
ОПВ; Ротарикс; оральная вакцина против полиомиелита; ротавирусная вакцина; вмешательство вакцины.
Опубликовано Oxford University Press для Американского общества инфекционистов в 2015 г. Эта работа написана (а) служащими правительства США и является общественным достоянием в США.
Заявление о конфликте интересов
Возможные конфликты интересов. Все авторы: Нет сообщений о конфликтах. Все авторы представили форму ICMJE для раскрытия потенциальных конфликтов интересов. Выявлены конфликты, которые редакция считает относящимися к содержанию рукописи.
Цифры
Рисунок 1
Зачисленные предметы и итоговое исследование…
Рисунок 1
Зарегистрированные субъекты и конечная популяция исследования.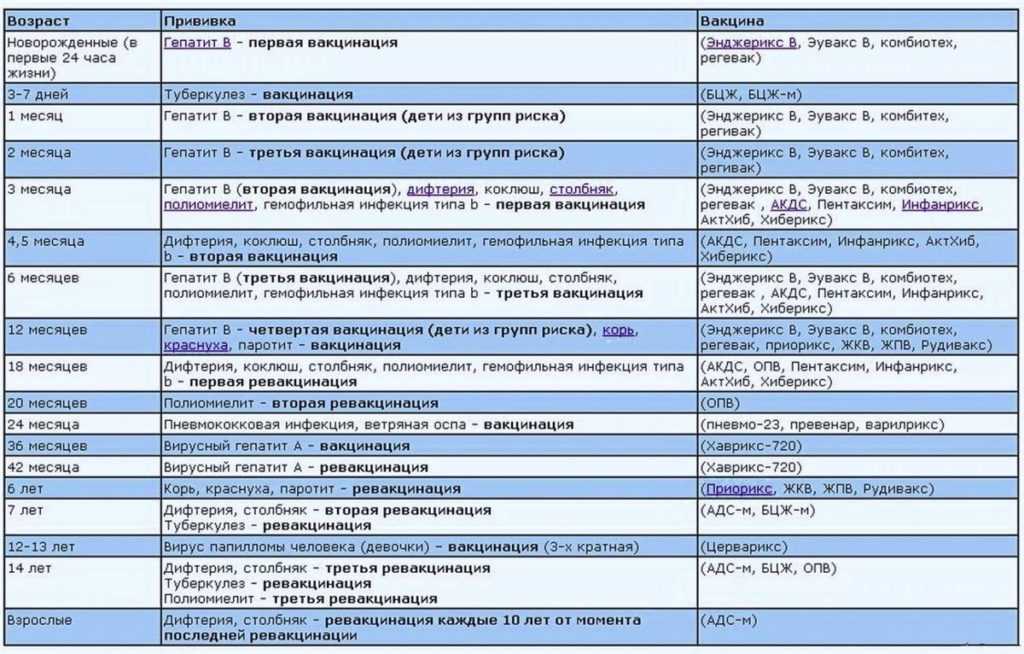 Сокращения: бОПВ, бивалентная оральная полиомиелитная вакцина; мОПВ1,…
Сокращения: бОПВ, бивалентная оральная полиомиелитная вакцина; мОПВ1,…
фигура 1
Зарегистрированные субъекты и конечная популяция исследования. Сокращения: бОПВ, бивалентная оральная полиомиелитная вакцина; мОПВ1, моновалентная оральная полиовакцина типа 1; RV1, моновалентный RV; тОПВ, трехвалентная оральная полиомиелитная вакцина.
Рисунок 2
Ротавирусный иммуноглобулин А (IgA) сероконверсия…
Рисунок 2
Сероконверсия ротавирусного иммуноглобулина А (IgA) и средние геометрические титры (GMT) в группах исследования…
фигура 2
Сероконверсия иммуноглобулина А (IgA) ротавируса и средние геометрические титры (GMT) в группах исследования. A , Сероконверсия IgA ротавируса. Сероконверсию определяли как ≥4-кратное повышение титра IgA от исходного уровня до после введения дозы 2. B , GMT ротавирусного IgA на исходном уровне и после введения дозы 2. Сокращения: бОПВ, бивалентная пероральная полиовирусная вакцина; мОПВ1, моновалентная оральная полиовакцина типа 1; RV1, моновалентная ротавирусная вакцина; тОПВ, трехвалентная оральная полиомиелитная вакцина.
A , Сероконверсия IgA ротавируса. Сероконверсию определяли как ≥4-кратное повышение титра IgA от исходного уровня до после введения дозы 2. B , GMT ротавирусного IgA на исходном уровне и после введения дозы 2. Сокращения: бОПВ, бивалентная пероральная полиовирусная вакцина; мОПВ1, моновалентная оральная полиовакцина типа 1; RV1, моновалентная ротавирусная вакцина; тОПВ, трехвалентная оральная полиомиелитная вакцина.
Рисунок 3
Ротавирусный иммуноглобулин А (IgA) сероконверсия…
Рисунок 3
Показатели сероконверсии ротавирусного иммуноглобулина А (IgA) в зависимости от времени между введением…
Рисунок 3
Показатели сероконверсии ротавирусного иммуноглобулина А (IgA) по промежутку времени между введением моновалентной ротавирусной вакцины (RV1) и пероральной полиовирусной вакцины (ОПВ) (независимо от порядка введения вакцины). A , Показатели сероконверсии по промежутку времени между первыми дозами RV1 и ОПВ. B , Показатели сероконверсии по промежутку времени между вторыми дозами RV1 и ОПВ.
A , Показатели сероконверсии по промежутку времени между первыми дозами RV1 и ОПВ. B , Показатели сероконверсии по промежутку времени между вторыми дозами RV1 и ОПВ.
См. это изображение и информацию об авторских правах в PMC
Похожие статьи
Показатели сероконверсии антиротавирусного IgA у детей, получающих сопутствующую пероральную вакцину против полиомиелита: вторичный объединенный анализ данных испытаний фазы II и III из 33 стран.
Бейкер Дж.М., Тейт Дж.Е., Леон Дж., Хабер М.Дж., Лопман Б.А.
Бейкер Дж.М. и др.
ПЛОС Мед. 30 декабря 2019 г.; 16(12):e1003005. doi: 10.1371/journal.pmed.1003005. Электронная коллекция 2019 декабрь.
ПЛОС Мед. 2019.PMID: 31887139
Бесплатная статья ЧВК.Клиническое испытание.
Иммуногенность четырех доз оральной полиовирусной вакцины при совместном введении с вакциной против ротавируса новорожденных (RV3-BB).

Коули Д., Сари Р.М., Хэндли А., Уоттс Э., Бахтиар Н.С., Ат Тобари Дж., Сатрия К.Д., Богданович-Сакран Н., Нирвати Х., Орсини Ф., Ли К.Дж., Кирквуд К.Д., Соэнарто Ю., Бинс Дж.Е.
Коули Д. и др.
вакцина. 20 ноября 2019 г.; 37 (49): 7233-7239. doi: 10.1016/j.vaccine.2019.09.071. Epub 2019 10 октября.
вакцина. 2019.PMID: 31607604
Бесплатная статья ЧВК.Клиническое испытание.
Одновременное применение пероральной пятивалентной реассортантной ротавирусной вакцины человека и крупного рогатого скота и пероральной полиомиелитной вакцины.
Ciarlet M, Sani-Grosso R, Yuan G, Liu GF, Heaton PM, Gottesdiener KM, Arredondo JL, Schödel F.
Сиарлет М. и соавт.
Pediatr Infect Dis J. 27 октября 2008 г. (10): 874–80. дои: 10.1097/INF.0b013e3181782780.
Pediatr Infect Dis J. 2008.PMID: 18756184
Клиническое испытание.

Влияние пероральных вакцин против полиомиелита на эффективность моновалентных и пятивалентных ротавирусных вакцин.
Патель М., Стил А.Д., Парашар УД.
Патель М. и др.
вакцина. 2012 27 апреля; 30 Приложение 1:A30-5. doi: 10.1016/j.vaccine.2011.11.093.
вакцина. 2012.PMID: 22520134
Обзор.
Снижение эффективности живых аттенуированных пероральных ротавирусных вакцин в странах с низким уровнем дохода: причины и способствующие факторы.
Веласкес, Делавэр, Парашар У, Цзян Б.
Веласкес Д.Э. и соавт.
Эксперт Rev Вакцины. 2018 фев; 17 (2): 145-161. дои: 10.1080/14760584.2018.1418665. Epub 2017 Декабрь 29.
Эксперт Rev Вакцины. 2018.PMID: 29252042
Бесплатная статья ЧВК.Обзор.
Посмотреть все похожие статьи
Цитируется
Ротавирусы: от патогенеза к борьбе с болезнями – критический обзор.

Оматола CA, Оланиран АО.
Оматола К.А. и соавт.
Вирусы. 2022 22 апреля; 14 (5): 875. дои: 10.3390/v14050875.
Вирусы. 2022.PMID: 35632617
Бесплатная статья ЧВК.Обзор.
Иммунитет к энтеровирусам.
Локхарт А., Мусида Д., Парса Р.
Локхарт А. и др.
Иммунитет. 2022 10 мая; 55 (5): 800-818. doi: 10.1016/j.immuni.2022.04.007.
Иммунитет. 2022.PMID: 35545029
Обзор.
Вакцины для профилактики ротавирусной диареи: используемые вакцины.
Бергман Х., Хеншке Н., Хангерфорд Д., Питан Ф., Ндвандве Д., Канлифф Н., Соарес-Вайзер К.
Бергман Х. и др.
Cochrane Database Syst Rev. 2021 Nov 17;11(11):CD008521. doi: 10.1002/14651858.CD008521.pub6.
Кокрановская система базы данных, ред. 2021 г.
2021 г.PMID: 34788488
Бесплатная статья ЧВК.Обзор.
Ротавирусная инфекция, болезни и эффективность вакцин у детей с недоеданием: обзор литературы.
Бернетт Э., Парашар У. Д., Тейт Д. Э.
Бернетт Э. и др.
Pediatr Infect Dis J. 1 октября 2021 г .: 40 (10): 930-936. doi: 10.1097/INF.0000000000003206.
Pediatr Infect Dis J. 2021.PMID: 34117200
Бесплатная статья ЧВК.Обзор.
Эффективность лицензированных ротавирусных вакцин и разработка ротавирусных вакцин нового поколения: обзор.
Ван Ю, Ли Дж, Лю П, Чжу Ф.
Ван Ю и др.
Hum Вакцина Иммунотер. 2021 4 марта; 17 (3): 880-896. doi: 10.1080/21645515.2020.1801071. Epub 2020 23 сентября.
Hum Вакцина Иммунотер. 2021.PMID: 32966134
Бесплатная статья ЧВК.
Обзор.
Просмотреть все статьи «Цитируется по»
Типы публикаций
термины MeSH
вещества
Грантовая поддержка
- CC999999/Внутренний CDC HHS/США
- 00846/PHS HHS/США
ПРАЙМ PubMed | Показатели сероконверсии антиротавирусного IgA у детей, получающих сопутствующую пероральную вакцину против полиомиелита: вторичный объединенный анализ данных испытаний фазы II и III из 33 стран
Резюме
ИСТОРИЯ ВОПРОСА основной причиной тяжелой диареи среди детей раннего возраста. Дальнейший прогресс в снижении бремени болезней частично сдерживается недостаточной эффективностью вакцины в определенных условиях.
 Ранние испытания показали, что пероральная полиомиелитная вакцина (ОПВ) при одновременном введении с ротавирусной вакциной снижает уровень сероконверсии ротавируса после введения первой дозы ротавируса с умеренным или незначительным вмешательством после завершения полного курса ротавирусной вакцины. Наше исследование было направлено на определение ряда характеристик на индивидуальном уровне, включая сопутствующее введение ОПВ, которые влияют на иммуногенность ротавирусной вакцины в условиях высокой и низкой детской смертности, с учетом факторов на индивидуальном уровне и на уровне страны. Наша основная гипотеза заключалась в том, что введение ОПВ одновременно с ротавирусной вакциной снижает иммуногенность ротавирусной вакцины.
Ранние испытания показали, что пероральная полиомиелитная вакцина (ОПВ) при одновременном введении с ротавирусной вакциной снижает уровень сероконверсии ротавируса после введения первой дозы ротавируса с умеренным или незначительным вмешательством после завершения полного курса ротавирусной вакцины. Наше исследование было направлено на определение ряда характеристик на индивидуальном уровне, включая сопутствующее введение ОПВ, которые влияют на иммуногенность ротавирусной вакцины в условиях высокой и низкой детской смертности, с учетом факторов на индивидуальном уровне и на уровне страны. Наша основная гипотеза заключалась в том, что введение ОПВ одновременно с ротавирусной вакциной снижает иммуногенность ротавирусной вакцины.
МЕТОДЫ И РЕЗУЛЬТАТЫ
Были проанализированы объединенные индивидуальные данные клинических испытаний фазы II и III моновалентной ротавирусной вакцины (RV1) Rotarix компании GlaxoSmithKline, включая 7280 вакцинированных младенцев (в возрасте 5-17 недель после введения первой дозы вакцины). ) из 22 испытаний и 33 стран/территорий (5 стран/территорий с высокой, 13 с умеренно низкой и 15 с очень низкой детской смертностью). Были исследованы два стандартных маркера иммунного ответа, включая сероконверсию антиротавирусного иммуноглобулина А (IgA) (определяемую как появление сывороточных антиротавирусных антител IgA у субъектов, первоначально серонегативных) и титр сывороточного антиротавирусного IgA, оба были получены примерно через 4–12 недель после введения последней вакцины против ротавируса. доза вакцины. Логистическая регрессия со смешанным эффектом и линейная регрессия со смешанным эффектом логарифмически преобразованных данных использовались для определения предикторов сероконверсии на индивидуальном уровне и на уровне страны (дихотомические) и титра антител (непрерывные) соответственно. Младенцы в условиях высокой детской смертности имели более низкие шансы сероконверсии по сравнению с младенцами в условиях низкой детской смертности (отношение шансов [ОШ] = 0,48, 95% доверительный интервал [ДИ] 0,43–0,53, p < 0,001).
) из 22 испытаний и 33 стран/территорий (5 стран/территорий с высокой, 13 с умеренно низкой и 15 с очень низкой детской смертностью). Были исследованы два стандартных маркера иммунного ответа, включая сероконверсию антиротавирусного иммуноглобулина А (IgA) (определяемую как появление сывороточных антиротавирусных антител IgA у субъектов, первоначально серонегативных) и титр сывороточного антиротавирусного IgA, оба были получены примерно через 4–12 недель после введения последней вакцины против ротавируса. доза вакцины. Логистическая регрессия со смешанным эффектом и линейная регрессия со смешанным эффектом логарифмически преобразованных данных использовались для определения предикторов сероконверсии на индивидуальном уровне и на уровне страны (дихотомические) и титра антител (непрерывные) соответственно. Младенцы в условиях высокой детской смертности имели более низкие шансы сероконверсии по сравнению с младенцами в условиях низкой детской смертности (отношение шансов [ОШ] = 0,48, 95% доверительный интервал [ДИ] 0,43–0,53, p < 0,001). Точно так же среди тех, у кого произошла сероконверсия, младенцы в условиях высокой детской смертности имели более низкие титры IgA по сравнению с младенцами в условиях низкой детской смертности (средняя разница [β] = 0,83, 95% ДИ 0,77–0,90, p < 0,001). Вероятность сероконверсии у младенцев, получивших ОПВ одновременно с первой и второй дозами ротавирусной вакцины, была в 0,63 раза выше (ОШ = 0,63, 95% ДИ 0,47–0,84, р = 0,002) по сравнению с младенцами, получившими ОПВ, но не одновременно ни с одной, ни с другой. доза. Напротив, среди младенцев с сероконверсией было обнаружено, что ОПВ, введенная одновременно с первой и второй дозами ротавирусной вакцины, положительно связана с титром антиротавирусного IgA (β = 1,28, 95% ДИ 1,07–1,53, р = 0,009). Наши результаты могут иметь некоторые ограничения с точки зрения обобщаемости для рутинного использования ротавирусной вакцины, поскольку анализ был ограничен здоровыми младенцами, получающими RV1 в условиях клинических испытаний.
Точно так же среди тех, у кого произошла сероконверсия, младенцы в условиях высокой детской смертности имели более низкие титры IgA по сравнению с младенцами в условиях низкой детской смертности (средняя разница [β] = 0,83, 95% ДИ 0,77–0,90, p < 0,001). Вероятность сероконверсии у младенцев, получивших ОПВ одновременно с первой и второй дозами ротавирусной вакцины, была в 0,63 раза выше (ОШ = 0,63, 95% ДИ 0,47–0,84, р = 0,002) по сравнению с младенцами, получившими ОПВ, но не одновременно ни с одной, ни с другой. доза. Напротив, среди младенцев с сероконверсией было обнаружено, что ОПВ, введенная одновременно с первой и второй дозами ротавирусной вакцины, положительно связана с титром антиротавирусного IgA (β = 1,28, 95% ДИ 1,07–1,53, р = 0,009). Наши результаты могут иметь некоторые ограничения с точки зрения обобщаемости для рутинного использования ротавирусной вакцины, поскольку анализ был ограничен здоровыми младенцами, получающими RV1 в условиях клинических испытаний.
ВЫВОДЫ
Наши результаты показывают, что ОПВ, вводимый одновременно с RV1, вносил существенный вклад в снижение сероконверсии антиротавирусного IgA, и это влияние было очевидным после введения второй дозы вакцины RV1, как и в исходных клинических испытаниях, на которых основан наш повторный анализ.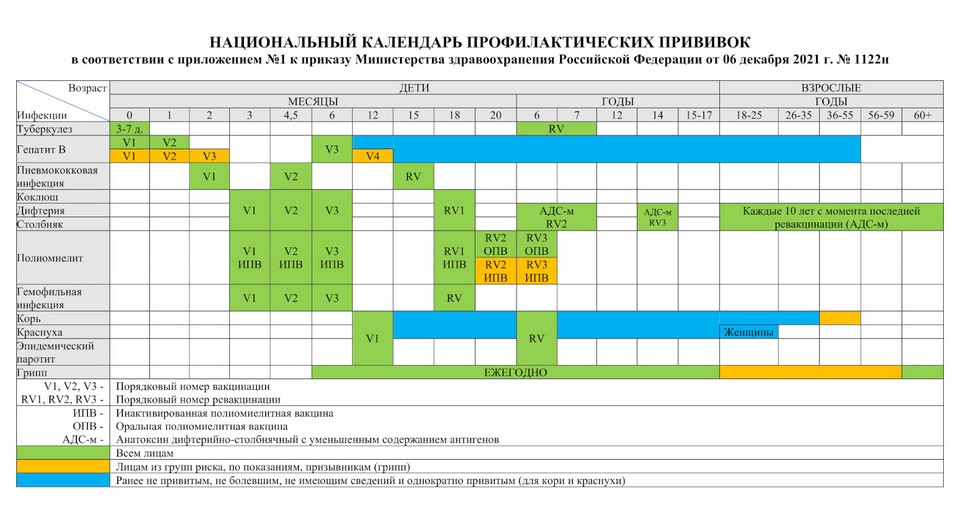 Тем не менее, наши результаты свидетельствуют о том, что предстоящее изъятие ОПВ из календаря иммунизации младенцев во всем мире может улучшить эффективность RV1.
Тем не менее, наши результаты свидетельствуют о том, что предстоящее изъятие ОПВ из календаря иммунизации младенцев во всем мире может улучшить эффективность RV1.
Authors+Show Affiliations
Baker JM
Департамент эпидемиологии, Школа общественного здравоохранения им. Роллинза, Университет Эмори, Атланта, Джорджия, Соединенные Штаты Америки. Отдел вирусных заболеваний, Национальный центр иммунизации и респираторных заболеваний, Центры по контролю и профилактике заболеваний, Атланта, Джорджия, Соединенные Штаты Америки.
Tate JE
Отдел вирусных заболеваний, Национальный центр иммунизации и респираторных заболеваний, Центры по контролю и профилактике заболеваний, Атланта, Джорджия, Соединенные Штаты Америки.
Leon J
Hubert Департамент глобального здравоохранения, Школа общественного здравоохранения им. Роллинза, Университет Эмори, Атланта, Джорджия, Соединенные Штаты Америки.
Haber MJ
Кафедра биостатистики и биоинформатики, Школа общественного здравоохранения им. Роллинза, Университет Эмори, Атланта, Джорджия, Соединенные Штаты Америки.
Lopman BA
Кафедра эпидемиологии, Школа общественного здравоохранения им. Роллинза, Университет Эмори, Атланта, Джорджия, Соединенные Штаты Америки. Отдел вирусных заболеваний, Национальный центр иммунизации и респираторных заболеваний, Центры по контролю и профилактике заболеваний, Атланта, Джорджия, Соединенные Штаты Америки.
MeSH
Antibodies, ViralChildChild, PreschoolFemaleHumansImmunization ScheduleImmunoglobulin AInfantMalePoliovirus Vaccine, OralRotavirusRotavirus InfectionsSeroconversionTreatment Outcome
Pub Type(s)
Clinical Trial, Phase II
Clinical Trial, Phase III
Journal Article
Research Support, N.I.H., Extramural
Поддержка исследований, за пределами США Gov’t
Language
eng
PubMed ID
31887139
Цитирование
Бейкер, Джулия М. и др. «Показатели сероконверсии антиротавирусного IgA у детей, получающих сопутствующую пероральную вакцину против полиомиелита: вторичный объединенный анализ данных испытаний фазы II и III из 33 стран». PLoS Medicine, vol. 16, нет. 12, 2019, стр. e1003005.
и др. «Показатели сероконверсии антиротавирусного IgA у детей, получающих сопутствующую пероральную вакцину против полиомиелита: вторичный объединенный анализ данных испытаний фазы II и III из 33 стран». PLoS Medicine, vol. 16, нет. 12, 2019, стр. e1003005.
Бейкер Дж.М., Тейт Дж.Е., Леон Дж. и др. Показатели сероконверсии антиротавирусного IgA у детей, получающих сопутствующую пероральную вакцину против полиомиелита: вторичный объединенный анализ данных испытаний фазы II и III из 33 стран. PLoS Med . 2019;16(12):e1003005.
Бейкер, Дж. М., Тейт, Дж. Э., Леон, Дж., Хабер, М. Дж., и Лопман, Б. А. (2019). Показатели сероконверсии антиротавирусного IgA у детей, получающих сопутствующую пероральную вакцину против полиомиелита: вторичный объединенный анализ данных испытаний фазы II и III из 33 стран. PLoS Medicine , 16 (12), e1003005. https://doi.org/10.1371/journal.pmed.1003005
Baker JM, et al. Показатели сероконверсии антиротавирусного IgA у детей, получающих сопутствующую пероральную вакцину против полиомиелита: вторичный объединенный анализ данных испытаний фазы II и III из 33 стран.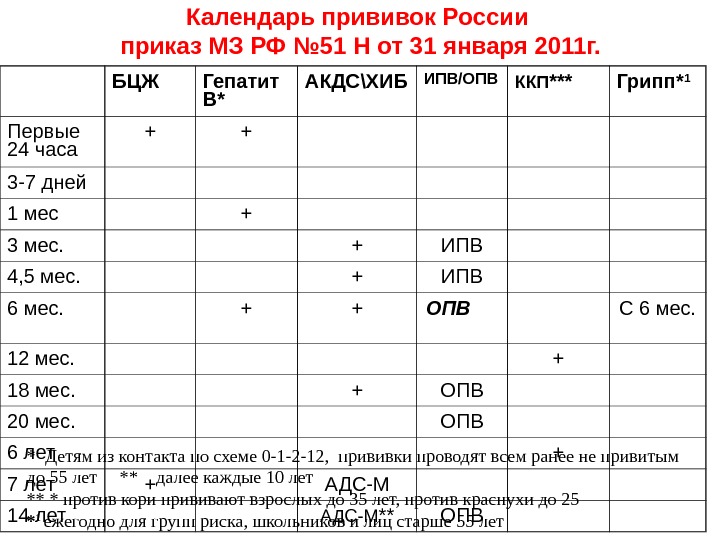 ПЛОС Мед. 2019;16(12):e1003005. PubMed PMID: 31887139.
ПЛОС Мед. 2019;16(12):e1003005. PubMed PMID: 31887139.
* Названия статей в формате цитирования AMA должны быть в регистре предложений
MLAAMAAPAVANCOUVER
TY — JOUR
T1 — Показатели сероконверсии антиротавирусного IgA у детей, получающих сопутствующую пероральную вакцину против полиомиелита: вторичный объединенный анализ данных испытаний фазы II и III из 33 стран.
AU — Бейкер, Джулия М,
AU — Тейт, Жаклин Э,
AU — Леон, Хуан,
AU — Хабер, Майкл Дж,
AU — Лопман, Бенджамин А,
1 год – 2019 год/12/30/
ПЯ — 26.07.2019/получил
PY — 22.11.2019/принято
PY — 2019/12/31/антрез
PY — 31.12.2019/опубликовано
PY – 23 февраля 2020 г./медлайн
СП-е1003005
ЭП-е1003005
JF — PLoS медицина
JO — PLoS Med
ВЛ — 16
ИС — 12
N2 — ПРЕДПОСЫЛКИ: Несмотря на успех ротавирусных вакцин за последнее десятилетие, ротавирус остается основной причиной тяжелых диарейных заболеваний у детей раннего возраста. Дальнейший прогресс в снижении бремени болезней частично сдерживается недостаточной эффективностью вакцины в определенных условиях.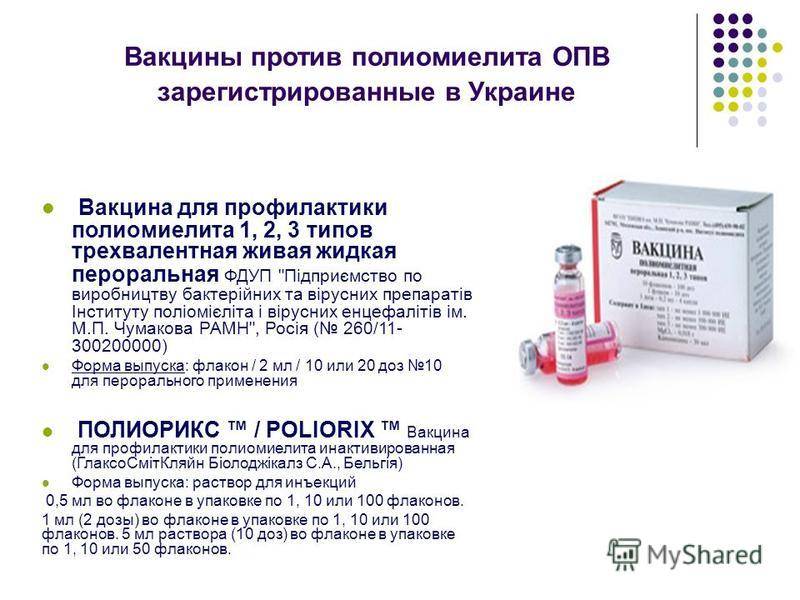 Ранние испытания показали, что пероральная полиомиелитная вакцина (ОПВ) при одновременном введении с ротавирусной вакциной снижает уровень сероконверсии ротавируса после введения первой дозы ротавируса с умеренным или незначительным вмешательством после завершения полного курса ротавирусной вакцины. Наше исследование было направлено на определение ряда характеристик на индивидуальном уровне, включая сопутствующее введение ОПВ, которые влияют на иммуногенность ротавирусной вакцины в условиях высокой и низкой детской смертности, с учетом факторов на индивидуальном уровне и на уровне страны. Наша основная гипотеза заключалась в том, что введение ОПВ одновременно с ротавирусной вакциной снижает иммуногенность ротавирусной вакцины. МЕТОДЫ И РЕЗУЛЬТАТЫ. Были проанализированы объединенные индивидуальные данные клинических испытаний фазы II и III моновалентной ротавирусной вакцины (RV1) Rotarix, проведенные компанией GlaxoSmithKline, включая 7280 вакцинированных детей (в возрасте 5–17 недель после введения первой дозы вакцины) из 22 испытания и 33 страны/территории (5 стран/территорий с высокой, 13 с умеренно низкой и 15 с очень низкой детской смертностью).
Ранние испытания показали, что пероральная полиомиелитная вакцина (ОПВ) при одновременном введении с ротавирусной вакциной снижает уровень сероконверсии ротавируса после введения первой дозы ротавируса с умеренным или незначительным вмешательством после завершения полного курса ротавирусной вакцины. Наше исследование было направлено на определение ряда характеристик на индивидуальном уровне, включая сопутствующее введение ОПВ, которые влияют на иммуногенность ротавирусной вакцины в условиях высокой и низкой детской смертности, с учетом факторов на индивидуальном уровне и на уровне страны. Наша основная гипотеза заключалась в том, что введение ОПВ одновременно с ротавирусной вакциной снижает иммуногенность ротавирусной вакцины. МЕТОДЫ И РЕЗУЛЬТАТЫ. Были проанализированы объединенные индивидуальные данные клинических испытаний фазы II и III моновалентной ротавирусной вакцины (RV1) Rotarix, проведенные компанией GlaxoSmithKline, включая 7280 вакцинированных детей (в возрасте 5–17 недель после введения первой дозы вакцины) из 22 испытания и 33 страны/территории (5 стран/территорий с высокой, 13 с умеренно низкой и 15 с очень низкой детской смертностью). Были исследованы два стандартных маркера иммунного ответа, включая сероконверсию антиротавирусного иммуноглобулина А (IgA) (определяемую как появление сывороточных антиротавирусных антител IgA у субъектов, первоначально серонегативных) и титр сывороточного антиротавирусного IgA, оба были получены примерно через 4–12 недель после введения последней вакцины против ротавируса. доза вакцины. Логистическая регрессия со смешанным эффектом и линейная регрессия со смешанным эффектом логарифмически преобразованных данных использовались для определения предикторов сероконверсии на индивидуальном уровне и на уровне страны (дихотомические) и титра антител (непрерывные) соответственно. Младенцы в условиях высокой детской смертности имели более низкие шансы сероконверсии по сравнению с младенцами в условиях низкой детской смертности (отношение шансов [ОШ] = 0,48, 95% доверительный интервал [ДИ] 0,43–0,53, p < 0,001). Точно так же среди тех, у кого произошла сероконверсия, младенцы в условиях высокой детской смертности имели более низкие титры IgA по сравнению с младенцами в условиях низкой детской смертности (средняя разница [β] = 0,83, 95% ДИ 0,77–0,90, p < 0,001).
Были исследованы два стандартных маркера иммунного ответа, включая сероконверсию антиротавирусного иммуноглобулина А (IgA) (определяемую как появление сывороточных антиротавирусных антител IgA у субъектов, первоначально серонегативных) и титр сывороточного антиротавирусного IgA, оба были получены примерно через 4–12 недель после введения последней вакцины против ротавируса. доза вакцины. Логистическая регрессия со смешанным эффектом и линейная регрессия со смешанным эффектом логарифмически преобразованных данных использовались для определения предикторов сероконверсии на индивидуальном уровне и на уровне страны (дихотомические) и титра антител (непрерывные) соответственно. Младенцы в условиях высокой детской смертности имели более низкие шансы сероконверсии по сравнению с младенцами в условиях низкой детской смертности (отношение шансов [ОШ] = 0,48, 95% доверительный интервал [ДИ] 0,43–0,53, p < 0,001). Точно так же среди тех, у кого произошла сероконверсия, младенцы в условиях высокой детской смертности имели более низкие титры IgA по сравнению с младенцами в условиях низкой детской смертности (средняя разница [β] = 0,83, 95% ДИ 0,77–0,90, p < 0,001). Вероятность сероконверсии у младенцев, получивших ОПВ одновременно с первой и второй дозами ротавирусной вакцины, была в 0,63 раза выше (ОШ = 0,63, 95% ДИ 0,47–0,84, р = 0,002) по сравнению с младенцами, получившими ОПВ, но не одновременно ни с одной, ни с другой. доза. Напротив, среди младенцев с сероконверсией было обнаружено, что ОПВ, введенная одновременно с первой и второй дозами ротавирусной вакцины, положительно связана с титром антиротавирусного IgA (β = 1,28, 95% ДИ 1,07–1,53, р = 0,009). Наши результаты могут иметь некоторые ограничения с точки зрения обобщаемости для рутинного использования ротавирусной вакцины, поскольку анализ был ограничен здоровыми младенцами, получающими RV1 в условиях клинических испытаний. ВЫВОДЫ: Наши данные свидетельствуют о том, что ОПВ, введенная одновременно с RV1, внесла существенный вклад в снижение сероконверсии антиротавирусного IgA, и это влияние было очевидным после введения второй дозы вакцины RV1, как и в исходных клинических испытаниях, на которых основан наш повторный анализ.
Вероятность сероконверсии у младенцев, получивших ОПВ одновременно с первой и второй дозами ротавирусной вакцины, была в 0,63 раза выше (ОШ = 0,63, 95% ДИ 0,47–0,84, р = 0,002) по сравнению с младенцами, получившими ОПВ, но не одновременно ни с одной, ни с другой. доза. Напротив, среди младенцев с сероконверсией было обнаружено, что ОПВ, введенная одновременно с первой и второй дозами ротавирусной вакцины, положительно связана с титром антиротавирусного IgA (β = 1,28, 95% ДИ 1,07–1,53, р = 0,009). Наши результаты могут иметь некоторые ограничения с точки зрения обобщаемости для рутинного использования ротавирусной вакцины, поскольку анализ был ограничен здоровыми младенцами, получающими RV1 в условиях клинических испытаний. ВЫВОДЫ: Наши данные свидетельствуют о том, что ОПВ, введенная одновременно с RV1, внесла существенный вклад в снижение сероконверсии антиротавирусного IgA, и это влияние было очевидным после введения второй дозы вакцины RV1, как и в исходных клинических испытаниях, на которых основан наш повторный анализ.

 после начала вакцинации
после начала вакцинации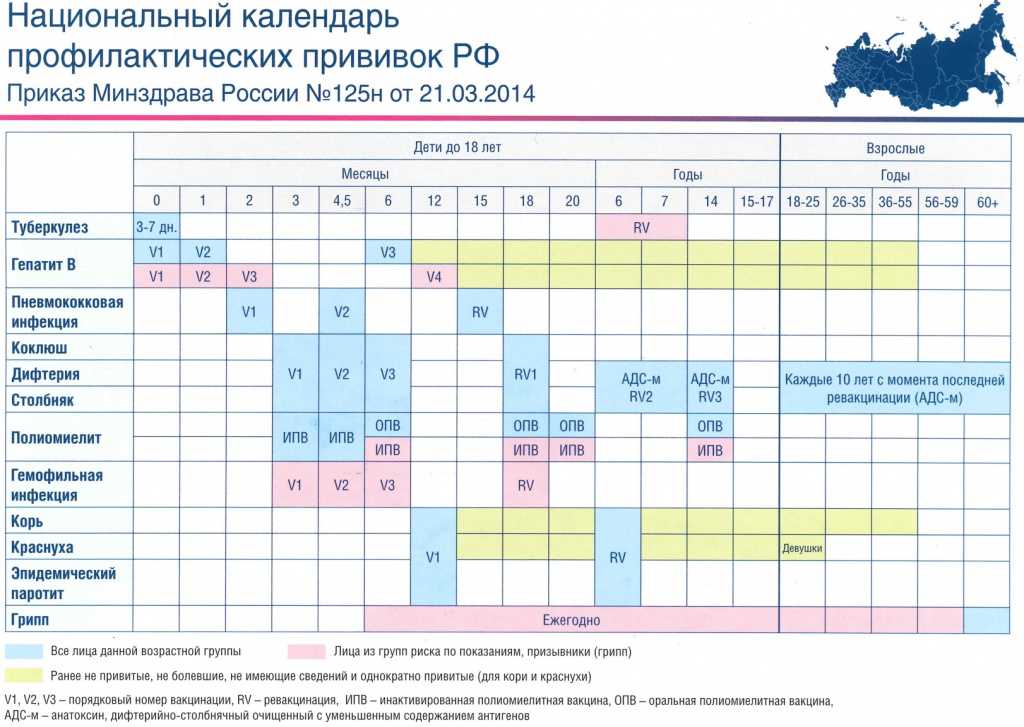 после первой ревакцинации
после первой ревакцинации
 2021 г.
2021 г.