Содержание
Ревакцинация 421 ребенка с побочной реакцией на прививки в анамнезе в специальной службе иммунизации
Текст статьи
Меню статьи
- Статья
Текст - Артикул
информация - Цитата
Инструменты - Поделиться
- Быстрое реагирование
- Артикул
метрика - Оповещения
Артикул
Ревакцинация 421 ребенка с побочной реакцией на прививки в анамнезе в специальной службе иммунизации
Бесплатно
- Майкл Голд,
- Хелен Гудвин,
- Сью Ботам,
- Маргарет Берджесс,
- Margot Nash,
- Ann Kempe
- Южная австралийская иммуманизация Координация Координация Координация, Координационная Координационная Координация, Координационная Координационная Координация, Координационная Координационная Координация, Координационная Координационная Координационная Координация, Координационная Координационная Координационная Координация Координация.
 Услуги, почтовый ящик 6, торговый центр Rundle, Аделаида 5000, Южная Австралия
Услуги, почтовый ящик 6, торговый центр Rundle, Аделаида 5000, Южная Австралия
- Электронная почта доктора Голда: mgold{at}medicine.adelaide.edu.au
Резюме
ПРЕДПОСЫЛКИ В Австралии нежелательные явления после иммунизации (ПППИ), за исключением анафилаксии и энцефалопатии, больше не считаются абсолютным противопоказанием для продолжения вакцинации подозрительной вакциной. Несмотря на эти рекомендации, информации о ревакцинации таких детей мало.
AIMS Для описания повторной вакцинации большого числа детей с НППИ в анамнезе.
МЕТОДЫ Обзор детей, посещающих специальные службы иммунизации в трех австралийских педиатрических центрах третичного уровня.
РЕЗУЛЬТАТЫ В ходе обзора приняли участие 970 детей, из которых 469 имели в прошлом НППИ. Из них у 293 детей наблюдались легкие, а у 176 детей наблюдались серьезные неврологические или аллергические реакции. Большинство (421/469) были ревакцинированы, и только у одного ребенка было серьезное неврологическое событие; это было преходящим и разрешилось спонтанно.
Большинство (421/469) были ревакцинированы, и только у одного ребенка было серьезное неврологическое событие; это было преходящим и разрешилось спонтанно.
ВЫВОДЫ Повторная вакцинация детей, у которых в анамнезе были НППИ, представляется безопасной. Специальная служба иммунизации должна быть частью комплексной программы иммунизации.
- Иммунизация
- Нежелательное явление после иммунизации
- Реакции противника вакцины
http://dx.doi.org/10.1136/adc.83.128
СТАТИСТИКА С ALTMERC.COM
REMPIONS
IR
IR
IR
. Если вы хотите повторно использовать часть или всю эту статью, воспользуйтесь приведенной ниже ссылкой, которая приведет вас к службе RightsLink Центра авторского права. Вы сможете получить быструю цену и мгновенное разрешение на повторное использование контента различными способами.
- иммунизация
- нежелательные явления после иммунизации
- побочные реакции на вакцины
Беспокойство по поводу безопасности вакцин имеет решающее значение для родителей и поставщиков вакцин, особенно в странах, где заболевания, предупреждаемые с помощью вакцин (ВУЗ), встречаются редко.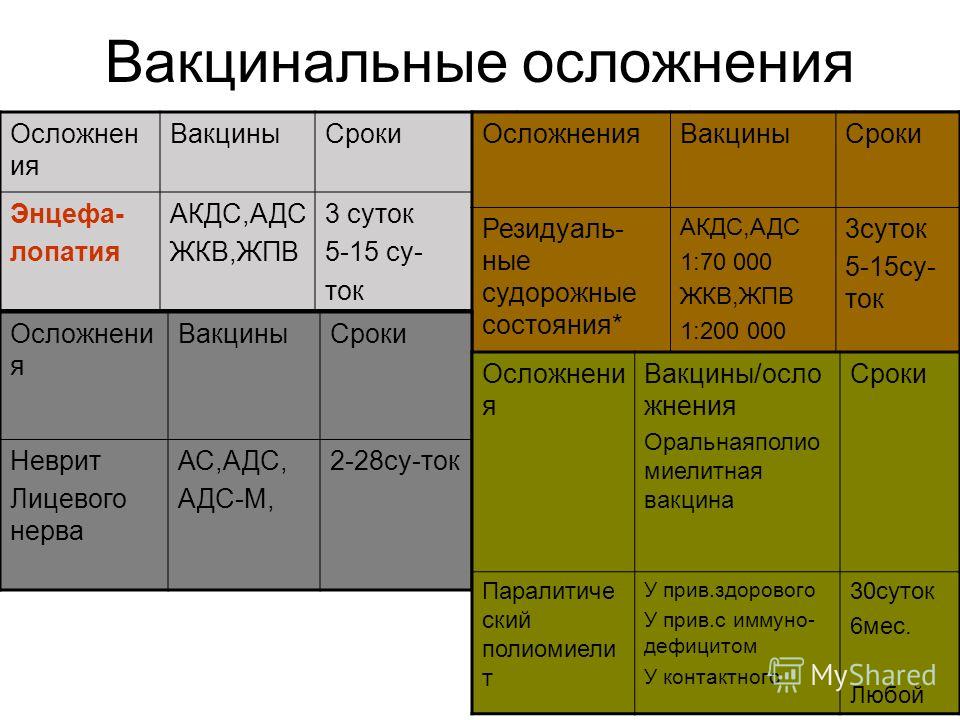 1 Вакцины не лишены риска, а незначительные побочные реакции после вакцинации детей, особенно вакцин, содержащих антигены коклюша, являются обычным явлением.2 К счастью, серьезные побочные реакции возникают редко, и риск заболеваемости от таких реакций намного меньше, чем тот, который может возникнуть после ВД. По иронии судьбы, в то время как опасения по поводу безопасности вакцины возрастали, противопоказания к повторной вакцинации у детей, у которых возникают побочные реакции, были уменьшены. В Австралии и США анафилаксия и энцефалопатия в настоящее время считаются единственными состояниями, которые являются абсолютным противопоказанием для повторной вакцинации подозрительной вакциной. высокая температура, крик, судороги или гипотонический гипореактивный эпизод (ГГЭ) больше не считаются абсолютными противопоказаниями. Несмотря на эти рекомендации, вполне вероятно, что многие дети, у которых возникли такие реакции, не завершают свой график иммунизации. В Австралии коклюшная вакцина часто исключалась из календаря иммунизации до введения бесклеточной коклюшной вакцины, и это нашло отражение в широком использовании комбинированной дифтерийно-столбнячной вакцины5.
1 Вакцины не лишены риска, а незначительные побочные реакции после вакцинации детей, особенно вакцин, содержащих антигены коклюша, являются обычным явлением.2 К счастью, серьезные побочные реакции возникают редко, и риск заболеваемости от таких реакций намного меньше, чем тот, который может возникнуть после ВД. По иронии судьбы, в то время как опасения по поводу безопасности вакцины возрастали, противопоказания к повторной вакцинации у детей, у которых возникают побочные реакции, были уменьшены. В Австралии и США анафилаксия и энцефалопатия в настоящее время считаются единственными состояниями, которые являются абсолютным противопоказанием для повторной вакцинации подозрительной вакциной. высокая температура, крик, судороги или гипотонический гипореактивный эпизод (ГГЭ) больше не считаются абсолютными противопоказаниями. Несмотря на эти рекомендации, вполне вероятно, что многие дети, у которых возникли такие реакции, не завершают свой график иммунизации. В Австралии коклюшная вакцина часто исключалась из календаря иммунизации до введения бесклеточной коклюшной вакцины, и это нашло отражение в широком использовании комбинированной дифтерийно-столбнячной вакцины5.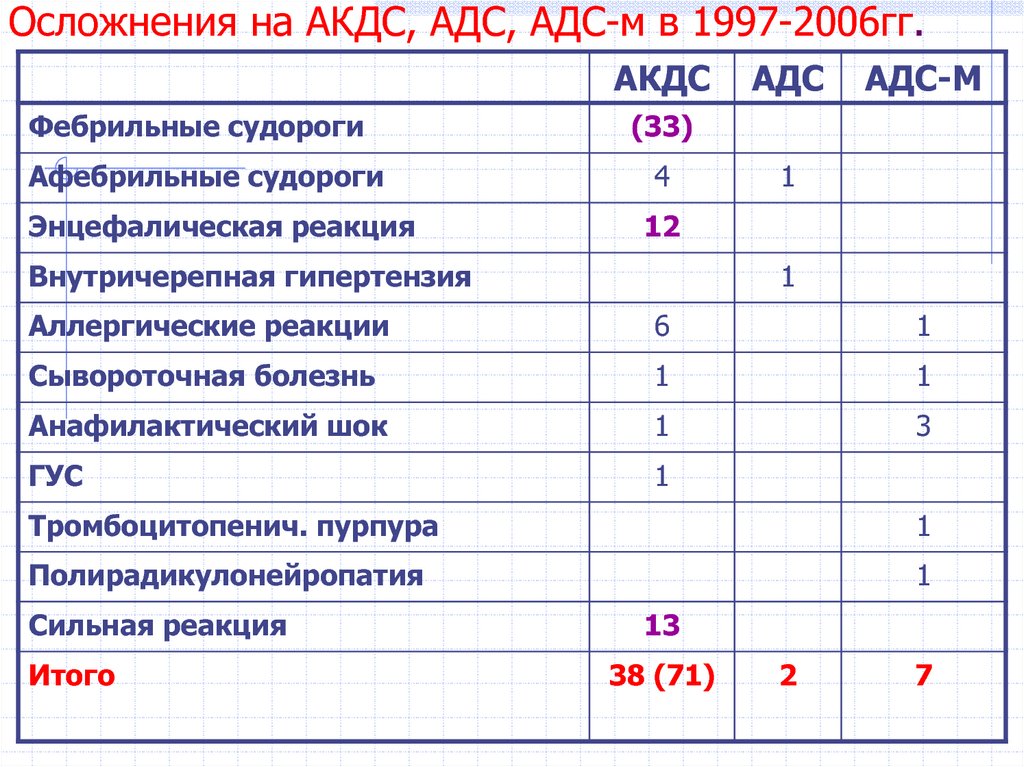 Это вызывает беспокойство, учитывая недавнюю эпидемию коклюша в Австралии. по крайней мере 10 668 случаев, зарегистрированных в 1997,7
Это вызывает беспокойство, учитывая недавнюю эпидемию коклюша в Австралии. по крайней мере 10 668 случаев, зарегистрированных в 1997,7
В конце 1980-х годов в Великобритании были созданы специальные службы иммунизации (SIS) для проверки и пропаганды вакцинации детей с существующими заболеваниями, аллергией на яйца или с предполагаемыми противопоказаниями к вакцинации или с НППИ в анамнезе. 8
,9 В Австралии SIS была впервые создана в 1994 году.10 Однако эти более ранние службы сообщали лишь о небольшом количестве детей и не отражают текущую практику предложения непрерывной вакцинации, включая бесклеточную коклюшную вакцину, тем детям, у которых возникли серьезные реакции, которые были затем рассматривается как сдерживание. Подобные SIS были установлены в трех педиатрических больницах третичного уровня в Австралии. Цель этого отчета состояла в том, чтобы описать повторную вакцинацию большего числа детей, которые посещали эти службы с историей ПППИ.
Методы
Это был ретроспективный обзор детей, посещающих SIS в Южной Австралии (женская и детская больница, Аделаида), Новом Южном Уэльсе (Новая детская больница, Сидней) и Виктории (Королевская детская больница и медицинский центр Монаша, Мельбурн). ). Общий период обзора был с октября 1996 г. по март 1999 г. В то время применялся плановый календарь иммунизации детей против дифтерии, столбняка и коклюша (АКДС), Haemophilus influenzae типа b (HiB) и орального полиомиелита (ОПВ). ) вакцины для введения в возрасте 2, 4 и 6 месяцев. Вакцину против кори, эпидемического паротита и краснухи (MMR) вводили в возрасте 12 месяцев с последующим введением бустерных доз АКДС и HiB в 18 месяцев. В возрасте от 4 до 5 лет вводили АКДС и ОПВ. 19 августа97 трехкомпонентная бесклеточная коклюшная вакцина (Infanrix; SmithKline Beecham, Мельбурн) была лицензирована для использования в Австралии, и к 1999 г. эта вакцина заменила использование цельноклеточной коклюшной вакцины. Тем не менее, с августа 1997 года детям с ПППИ до SIS, связанной с АКДС (цельноклеточный коклюш), предлагалась ревакцинация АКДС (бесклеточный коклюш), если это было целесообразно.
). Общий период обзора был с октября 1996 г. по март 1999 г. В то время применялся плановый календарь иммунизации детей против дифтерии, столбняка и коклюша (АКДС), Haemophilus influenzae типа b (HiB) и орального полиомиелита (ОПВ). ) вакцины для введения в возрасте 2, 4 и 6 месяцев. Вакцину против кори, эпидемического паротита и краснухи (MMR) вводили в возрасте 12 месяцев с последующим введением бустерных доз АКДС и HiB в 18 месяцев. В возрасте от 4 до 5 лет вводили АКДС и ОПВ. 19 августа97 трехкомпонентная бесклеточная коклюшная вакцина (Infanrix; SmithKline Beecham, Мельбурн) была лицензирована для использования в Австралии, и к 1999 г. эта вакцина заменила использование цельноклеточной коклюшной вакцины. Тем не менее, с августа 1997 года детям с ПППИ до SIS, связанной с АКДС (цельноклеточный коклюш), предлагалась ревакцинация АКДС (бесклеточный коклюш), если это было целесообразно.
Каждая SIS рекламировалась на местном уровне как услуга для детей с НППИ в анамнезе или сопутствующим заболеванием, которое могло препятствовать иммунизации. Посещающие детей были направлены медицинским работником (педиатром-консультантом, врачом или практикующей медсестрой). Следующие функции были общими для всех сервисов. Во-первых, все дети были осмотрены педиатром с особым интересом и опытом в области иммунизации. Во-вторых, вакцины вводили в соответствии с рекомендациями, подробно изложенными в руководстве по иммунизации Австралии Национального совета по здравоохранению и медицинским исследованиям.4 Повторная вакцинация подозреваемой вакциной считалась противопоказанной, если исходным событием была анафилаксия или энцефалопатия (для вакцин, содержащих коклюш, корь, антигены эпидемического паротита или краснухи). Всем остальным детям была предложена повторная вакцинация подозреваемой вакциной, если эти вакцины были назревающими, у ребенка не было острого недомогания с лихорадкой (температура тела выше 38,5°C), и ни у ребенка (от MMR и OPV), ни у каких-либо бытовых контактов (для ОПВ) были иммуносупрессивными. Действительное согласие родителей было получено после обсуждения рисков и преимуществ повторной вакцинации.
Посещающие детей были направлены медицинским работником (педиатром-консультантом, врачом или практикующей медсестрой). Следующие функции были общими для всех сервисов. Во-первых, все дети были осмотрены педиатром с особым интересом и опытом в области иммунизации. Во-вторых, вакцины вводили в соответствии с рекомендациями, подробно изложенными в руководстве по иммунизации Австралии Национального совета по здравоохранению и медицинским исследованиям.4 Повторная вакцинация подозреваемой вакциной считалась противопоказанной, если исходным событием была анафилаксия или энцефалопатия (для вакцин, содержащих коклюш, корь, антигены эпидемического паротита или краснухи). Всем остальным детям была предложена повторная вакцинация подозреваемой вакциной, если эти вакцины были назревающими, у ребенка не было острого недомогания с лихорадкой (температура тела выше 38,5°C), и ни у ребенка (от MMR и OPV), ни у каких-либо бытовых контактов (для ОПВ) были иммуносупрессивными. Действительное согласие родителей было получено после обсуждения рисков и преимуществ повторной вакцинации. В-третьих, каждый ребенок наблюдался после вакцинации. Те, кто относился к группе высокого риска, наблюдались в больнице в течение периода от четырех до восьми часов. В редких случаях детей госпитализировали для ночного наблюдения. Наконец, родителям тех детей, которые были иммунизированы, звонили по телефону между 24 и 72 часами после вакцинации и расспрашивали о любых симптомах, развившихся у их ребенка. В Аделаиде и Мельбурне с родителями также связывались через семь дней после вакцинации, в то время как в Сиднее это происходило только в том случае, если во время первого телефонного контакта сообщалось о ПППИ. При последующем наблюдении в Мельбурне была проведена стандартная телефонная анкета, в то время как родителей попросили сообщить о любых нежелательных явлениях в оставшихся двух местах.
В-третьих, каждый ребенок наблюдался после вакцинации. Те, кто относился к группе высокого риска, наблюдались в больнице в течение периода от четырех до восьми часов. В редких случаях детей госпитализировали для ночного наблюдения. Наконец, родителям тех детей, которые были иммунизированы, звонили по телефону между 24 и 72 часами после вакцинации и расспрашивали о любых симптомах, развившихся у их ребенка. В Аделаиде и Мельбурне с родителями также связывались через семь дней после вакцинации, в то время как в Сиднее это происходило только в том случае, если во время первого телефонного контакта сообщалось о ПППИ. При последующем наблюдении в Мельбурне была проведена стандартная телефонная анкета, в то время как родителей попросили сообщить о любых нежелательных явлениях в оставшихся двух местах.
Данные были сопоставлены из каждой службы, включая общее количество пациентов, обратившихся за помощью, их возраст и пол, долю пациентов с ПППИ, характер ПППИ и вакцины, связанные с реакцией, вакцины, введенные в SIS, и исход вакцинации в сервисе. Представленные AEFI были разделены на местные реакции, лихорадку (любой степени), раздражительность, крик (неуточненный), рвоту или диарею. Эти реакции часто происходили одновременно и анализировались вместе. Такие реакции, как судороги (в течение семи дней после введения вакцины), ГЭ, кожная сыпь (обычно уртикарная и не связанная с тромбоцитопенией, анафилаксией или вакцинной виремией) или анафилаксия считались первичными реакциями независимо от любых других зарегистрированных симптомов. HHE определяли как внезапное событие, произошедшее в течение 48 часов после вакцинации, характеризующееся гипотонией, гипореакцией и бледностью при отсутствии известной причины, такой как судороги. симптомы в семидневный период после вакцинации.
Представленные AEFI были разделены на местные реакции, лихорадку (любой степени), раздражительность, крик (неуточненный), рвоту или диарею. Эти реакции часто происходили одновременно и анализировались вместе. Такие реакции, как судороги (в течение семи дней после введения вакцины), ГЭ, кожная сыпь (обычно уртикарная и не связанная с тромбоцитопенией, анафилаксией или вакцинной виремией) или анафилаксия считались первичными реакциями независимо от любых других зарегистрированных симптомов. HHE определяли как внезапное событие, произошедшее в течение 48 часов после вакцинации, характеризующееся гипотонией, гипореакцией и бледностью при отсутствии известной причины, такой как судороги. симптомы в семидневный период после вакцинации.
Результаты
В течение рассматриваемого периода 970 детей приняли участие в трех SIS, из которых 469 (48%) ранее перенесли ПППИ, а остальные имели основное заболевание (включая анафилаксию яиц), что вызвало опасения в отношении иммунизации. Из тех, у кого были ПППИ, 55% были мальчиками со средним возрастом 24 месяца (от 1 до 183 месяцев), что часто указывает на значительную задержку в интервале между ПППИ и повторным осмотром. В таблице 1 представлены сведения о вакцинах, связанных с каждым ПППИ. Из 469дети с ПППИ, 293 (63%) имели в анамнезе местную реакцию, лихорадку, раздражительность, крик, рвоту или диарею после вакцинации. У остальных 176 (37%) детей наблюдались ГГЭ, судороги, кожная сыпь (обычно уртикарная и не связанная с тромбоцитопенией, анафилаксией или вакцинной виремией), анафилаксия, апноэ или ряд других симптомов. У 420/469 (90%) детей ПППИ были связаны с введением вакцины АКДС. Этим детям АКДС вводили отдельно или в сочетании с вакцинами Hib, OPV или против гепатита B (Hep B). Остальные 48/469(10%) НППИ были связаны с введением вакцин DTPa, MMR, HiB, OPV, Hep B и CDT (комбинированная вакцина против дифтерии и столбняка).
В таблице 1 представлены сведения о вакцинах, связанных с каждым ПППИ. Из 469дети с ПППИ, 293 (63%) имели в анамнезе местную реакцию, лихорадку, раздражительность, крик, рвоту или диарею после вакцинации. У остальных 176 (37%) детей наблюдались ГГЭ, судороги, кожная сыпь (обычно уртикарная и не связанная с тромбоцитопенией, анафилаксией или вакцинной виремией), анафилаксия, апноэ или ряд других симптомов. У 420/469 (90%) детей ПППИ были связаны с введением вакцины АКДС. Этим детям АКДС вводили отдельно или в сочетании с вакцинами Hib, OPV или против гепатита B (Hep B). Остальные 48/469(10%) НППИ были связаны с введением вакцин DTPa, MMR, HiB, OPV, Hep B и CDT (комбинированная вакцина против дифтерии и столбняка).
Таблица 1
Подробная информация о предыдущем нежелательном явлении после иммунизации и вакцинах, связанных с этим явлением, у 469 детей, посещавших SIS
После клинического обзора 421/469 (90%) детей были вакцинированы в SIS. В Таблице 2 приведены сведения о вакцинах, введенных каждому ребенку при каждом проявлении ПППИ. Из 421 вакцинированного ребенка 257 получили АКДС и 94 моновалентная бесклеточная коклюшная вакцина с вакцинами против дифтерии, столбняка, Hib, MMR, OPV или Hep B или без них. Сорок восемь (10%) детей не были вакцинированы после клинического обзора. Однако у семи из этих детей (пять с анафилаксией, один с энцефалопатией, один с тромбоцитопенией) дальнейшая вакцинация подозрительной вакциной была противопоказана или не назначалась, а у 18 детей дальнейшие дозы подозрительной вакцины не назначались. Родители только 13 детей отказались от рекомендованных прививок или не явились повторно в службу для их получения.
В Таблице 2 приведены сведения о вакцинах, введенных каждому ребенку при каждом проявлении ПППИ. Из 421 вакцинированного ребенка 257 получили АКДС и 94 моновалентная бесклеточная коклюшная вакцина с вакцинами против дифтерии, столбняка, Hib, MMR, OPV или Hep B или без них. Сорок восемь (10%) детей не были вакцинированы после клинического обзора. Однако у семи из этих детей (пять с анафилаксией, один с энцефалопатией, один с тромбоцитопенией) дальнейшая вакцинация подозрительной вакциной была противопоказана или не назначалась, а у 18 детей дальнейшие дозы подозрительной вакцины не назначались. Родители только 13 детей отказались от рекомендованных прививок или не явились повторно в службу для их получения.
Таблица 2
Подробная информация о вакцинах, введенных 421 ребенку с побочными явлениями после иммунизации в анамнезе, посещавших ШИС
Из 421 вакцинированного ребенка у 350 (83%) не было последующих ПППИ. Семьдесят детей (17%) испытали лихорадку и/или местную реакцию и/или вялость в течение семи дней после вакцинации.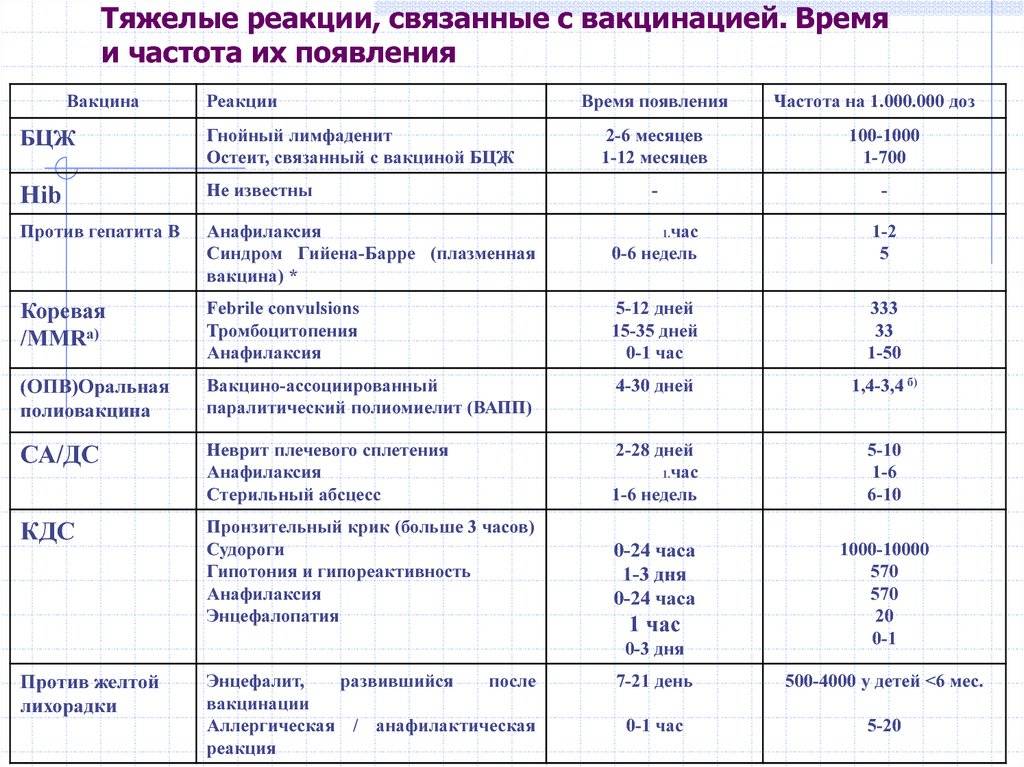 Одному из этих 70 детей потребовалась госпитализация через четыре дня после вакцинации бесклеточной коклюшной вакциной. Впоследствии у этого ребенка была диагностирована крупозная пневмония, состояние которой улучшилось после внутривенного введения пенициллина. Только у одного из 421 ребенка, вакцинированного в рамках SIS, наблюдались значительные ПППИ и, вероятно, развился ГГЭ после ревакцинации. Этот ребенок посетил SIS, потому что у него появились лихорадка, бледность и раздражительность с криком в возрасте 2 месяцев после его первой вакцины DTPw. В возрасте 4 месяцев и после осмотра в SIS он был вакцинирован вакцинами DTPa, HiB и OPV. Примерно через пять часов после прививки он стал бледным и гипотоническим. Это разрешилось спонтанно, госпитализация не потребовалась. После этого случая ребенок получил еще одну вакцину DTPa без каких-либо последствий.
Одному из этих 70 детей потребовалась госпитализация через четыре дня после вакцинации бесклеточной коклюшной вакциной. Впоследствии у этого ребенка была диагностирована крупозная пневмония, состояние которой улучшилось после внутривенного введения пенициллина. Только у одного из 421 ребенка, вакцинированного в рамках SIS, наблюдались значительные ПППИ и, вероятно, развился ГГЭ после ревакцинации. Этот ребенок посетил SIS, потому что у него появились лихорадка, бледность и раздражительность с криком в возрасте 2 месяцев после его первой вакцины DTPw. В возрасте 4 месяцев и после осмотра в SIS он был вакцинирован вакцинами DTPa, HiB и OPV. Примерно через пять часов после прививки он стал бледным и гипотоническим. Это разрешилось спонтанно, госпитализация не потребовалась. После этого случая ребенок получил еще одну вакцину DTPa без каких-либо последствий.
Особый интерес представляла ревакцинация детей с выраженными неврологическими реакциями (ГГЭ, судороги, апноэ). У всех 101 из 130 детей (78%), у которых наблюдались эти реакции после вакцинации коклюшной вакциной, была проведена повторная вакцинация либо цельноклеточной, либо бесклеточной коклюшной вакциной. Все, кроме пяти из этих детей, получали DTPa, и ни у одного из этих детей не было рецидива значительного ПППИ.
Все, кроме пяти из этих детей, получали DTPa, и ни у одного из этих детей не было рецидива значительного ПППИ.
Обсуждение
Информирование родителей об относительных рисках и преимуществах вакцинации имеет важное значение при принятии решения о вакцинации ребенка.12 У детей, перенесших НППИ, поставщикам вакцин и родителям сложно провести такую оценку риска и пользы при рассмотрении вопроса о повторной вакцинации. с подозрительной вакциной. Хотя преимущества иммунизации можно легко определить, оценка риска затруднена. Во-первых, недостаточно информации о риске рецидива ПППИ у таких детей. Во-вторых, плохое понимание патогенеза многих НППИ, отсутствие идентифицируемых факторов риска у отдельных детей и редкое возникновение значительных НППИ еще больше усложняют такие оценки. Клинические исследования вакцины и постмаркетинговый надзор дают представление о частоте побочных реакций среди населения в целом. Они не определяют риск повторных реакций у детей, перенесших НППИ. Информация, представленная в этом отчете, может помочь поставщикам вакцин и родителям более точно определить риск повторной вакцинации детей, перенесших ПППИ.
Информация, представленная в этом отчете, может помочь поставщикам вакцин и родителям более точно определить риск повторной вакцинации детей, перенесших ПППИ.
У большинства детей, которые наблюдались в этих службах, была лихорадка, местная реакция и/или крик, хотя у некоторых наблюдались значительные неврологические реакции (ГГЭ, судороги, апноэ, монопарез и энцефалопатия). Считалось, что цельноклеточный коклюшный компонент вакцины DTPw связан с большинством этих реакций, поскольку реактогенность этой вакцины хорошо документирована. Успешная повторная вакцинация вакциной, содержащей бесклеточную коклюшную вакцину, была проведена у большинства этих детей. Эти результаты также подтверждают недавнее исследование, проведенное в Нидерландах, в котором изучался риск рецидива ГГЭ после повторной вакцинации цельноклеточной коклюшной вакциной.13 В этом исследовании 84 ребенка с ГГЭ в анамнезе получили 236 доз цельноклеточной коклюшной вакцины ни один ребенок не испытывает рецидива. Однако после повторной вакцинации цельноклеточной коклюшной вакциной были зарегистрированы рецидивы ГГЭ, и было предложено избегать повторной вакцинации. 14 Результаты нашего исследования показывают, что бесклеточная коклюшная вакцина является безопасной альтернативой для тех детей, испытали значительные неврологические реакции после введения цельноклеточной коклюшной вакцины. Это согласуется с недавними данными эпиднадзора в Южной Австралии, которые показывают, что легкие и серьезные реакции, а также реакции, требующие медицинского и больничного осмотра, встречались в три раза реже при использовании трехкомпонентной бесклеточной коклюшной вакцины, чем при использовании цельноклеточной коклюшной вакцины.15 В Австралии DTPa в настоящее время заменила АКДСв, и еще предстоит выяснить, можно ли успешно ревакцинировать детей с ПППИ, связанными с введением АКДС, с использованием этой вакцины.
14 Результаты нашего исследования показывают, что бесклеточная коклюшная вакцина является безопасной альтернативой для тех детей, испытали значительные неврологические реакции после введения цельноклеточной коклюшной вакцины. Это согласуется с недавними данными эпиднадзора в Южной Австралии, которые показывают, что легкие и серьезные реакции, а также реакции, требующие медицинского и больничного осмотра, встречались в три раза реже при использовании трехкомпонентной бесклеточной коклюшной вакцины, чем при использовании цельноклеточной коклюшной вакцины.15 В Австралии DTPa в настоящее время заменила АКДСв, и еще предстоит выяснить, можно ли успешно ревакцинировать детей с ПППИ, связанными с введением АКДС, с использованием этой вакцины.
Очевидно, что эта когорта детей является выборочной, поскольку службы не охватывали всех детей, перенесших НППИ. В Австралии охват тремя дозами вакцин, содержащих коклюш, оценивается примерно в 80%, что считается субоптимальным и ниже показателей в Великобритании и США. 16 Точная частота ПППИ в Австралии не была известна и не была известна. сколько детей с ПППИ было направлено в SIS и впоследствии оценено. В идеале службе необходимо будет рассмотреть большую выборку детей, перенесших НППИ, и определить результат ревакцинации. Тем не менее, подавляющее большинство детей, посещающих эти службы, которым была показана вакцинация, были успешно ревакцинированы. Это указывает на то, что родители, посещающие службы, были сильно заинтересованы в продолжении или завершении графика иммунизации своего ребенка. Необходимы дальнейшие исследования, чтобы выяснить, какие факторы определяют, какие родители представлены для рассмотрения, и является ли эта выборка репрезентативной для всех детей, у которых возникло ПППИ.
16 Точная частота ПППИ в Австралии не была известна и не была известна. сколько детей с ПППИ было направлено в SIS и впоследствии оценено. В идеале службе необходимо будет рассмотреть большую выборку детей, перенесших НППИ, и определить результат ревакцинации. Тем не менее, подавляющее большинство детей, посещающих эти службы, которым была показана вакцинация, были успешно ревакцинированы. Это указывает на то, что родители, посещающие службы, были сильно заинтересованы в продолжении или завершении графика иммунизации своего ребенка. Необходимы дальнейшие исследования, чтобы выяснить, какие факторы определяют, какие родители представлены для рассмотрения, и является ли эта выборка репрезентативной для всех детей, у которых возникло ПППИ.
Мы считаем, что SIS должна быть важным компонентом программы иммунизации. Во-первых, SIS способствует продолжению иммунизации детей, перенесших НППИ. У авторов сложилось анекдотическое впечатление, что многие из этих детей не стали бы продолжать иммунизацию по календарю или не обратились бы за наверстывающей вакцинацией, если бы не SIS. Эта задержка повысит риск вакциноуправляемых заболеваний у этих детей и их сообществ. SIS предоставила родителям время для обсуждения относительных рисков и преимуществ повторной вакцинации подозрительной вакциной. Кроме того, родителей заверили, что в случае необходимости их ребенок может наблюдаться и вестись в больнице после вакцинации. Во-вторых, SIS можно использовать для усиления постмаркетингового надзора за ПППИ, тем самым обеспечивая безопасность вакцины. SIS должна поощрять родителей и лиц, предоставляющих вакцины, направлять детей, перенесших серьезные НППИ, в случае, если родителям и/или поставщику вакцин необходимы дополнительные рекомендации. Клинический обзор в SIS дополнительно проясняет истинную природу таких реакций. В-третьих, служба доводит до родителей, поставщиков вакцин и общества в целом важное сообщение о том, что ПППИ действительно возникают, к ним серьезно относятся поставщики медицинских услуг, но редко противопоказаны дальнейшие дозы. Это имеет особое значение для противодействия ложным утверждениям антииммунизационных групп, которые уделяют особое внимание НППИ.
Эта задержка повысит риск вакциноуправляемых заболеваний у этих детей и их сообществ. SIS предоставила родителям время для обсуждения относительных рисков и преимуществ повторной вакцинации подозрительной вакциной. Кроме того, родителей заверили, что в случае необходимости их ребенок может наблюдаться и вестись в больнице после вакцинации. Во-вторых, SIS можно использовать для усиления постмаркетингового надзора за ПППИ, тем самым обеспечивая безопасность вакцины. SIS должна поощрять родителей и лиц, предоставляющих вакцины, направлять детей, перенесших серьезные НППИ, в случае, если родителям и/или поставщику вакцин необходимы дополнительные рекомендации. Клинический обзор в SIS дополнительно проясняет истинную природу таких реакций. В-третьих, служба доводит до родителей, поставщиков вакцин и общества в целом важное сообщение о том, что ПППИ действительно возникают, к ним серьезно относятся поставщики медицинских услуг, но редко противопоказаны дальнейшие дозы. Это имеет особое значение для противодействия ложным утверждениям антииммунизационных групп, которые уделяют особое внимание НППИ. 17 Наконец, SIS должна способствовать активизации текущих исследований, касающихся клинического ведения и обследования детей с ПППИ. Потенциальные преимущества SIS для общественного здравоохранения и отдельных лиц необходимо учитывать при планировании комплексной программы иммунизации.
17 Наконец, SIS должна способствовать активизации текущих исследований, касающихся клинического ведения и обследования детей с ПППИ. Потенциальные преимущества SIS для общественного здравоохранения и отдельных лиц необходимо учитывать при планировании комплексной программы иммунизации.
Благодарности
Мы благодарны Линди Харкнесс, Клэр Найда и Мэгги Осборн за помощь Специальной службе иммунизации (Южная Австралия).
Ссылки
- ↵
- Chen R,
- Hibbs B
(1998) Безопасность вакцин: текущие и будущие проблемы. Pediatr Ann 27:445–454.
- ↵
- Decker MD,
- Edwards KM,
- Steinhoff MC,
- и др.
(1995) Сравнение 13 бесклеточных коклюшных вакцин: побочные реакции. Педиатрия 96 (прил. 3): 557–566.
- ↵
- Австралийский педиатрический колледж
(1994) Программное заявление.
 Противопоказания к иммунизации против коклюша. J Paediatr Child Health 30:310–311.
Противопоказания к иммунизации против коклюша. J Paediatr Child Health 30:310–311. - ↵
- Национальный совет по здравоохранению и медицинским исследованиям
(1997) Австралийский справочник по иммунизации (AGPS, Канберра), 6-е изд.
- ↵
- Burgess M,
- McIntyre P,
- Heath T
(1998) Переосмысление противопоказаний к вакцинации. Med J Aust 168:476–477.
- ↵
- Консультативный комитет по практике иммунизации
(1994) MMWR Morb Mortal Wkly Rep 43:24–25.
- ↵
- O’Brien E,
- D’Souza R,
- Gillroy N,
- и др.
(1999) Статус заболевания в Австралии, подлежащий уведомлению, 1997 г. Commun Dis Intell 23:1–27.

- ↵
- Ko MLB,
- Rao M,
- Teare L,
- и др.
(1995) Результат направления в районную консультационную клинику иммунизации. Commun Dis Rep 5:R146–R149.
- ↵
- Newport MJ,
- Conway SP
(1993) Опыт работы специализированной службы консультирования по иммунизации детей. J Заразить 26:295–300.
- ↵
- Andrews RM,
- Kemp AE,
- Sinn KK,
- Herceg A
(1998 г.) Med J Aust 168:491–494.
- ↵
- Braun MM,
- Terracciano G,
- Salive ME,
- и др.
(1998) Отчет семинара общественного здравоохранения США по гипотоническому гипореактивному эпизоду (HHE) после иммунизации против коклюша.
 Педиатрия 102:e52.
Педиатрия 102:e52. - ↵
- Ball LK,
- Evans G,
- Bostrom A
(1998) Рискованный бизнес: проблемы информирования о рисках, связанных с вакцинами. Педиатрия 101:453–458.
- ↵
- Vermeer-de Bondt PE,
- Labadie J,
- Rumke HC
(1998) Частота рецидивов коллапса после вакцинации цельноклеточной коклюшной вакциной. BMJ 316:902–903.
- ↵
- Tozzi AE,
- Ciofi Delgi Atti ML,
- Salmaso S,
- Anemona A
(1988). Повторные вакцинации целых клеток следует избегать после гипотонической гипотевики. БМЖ 317:604.
- ↵
- Gold M,
- Osbourne M,
- Kempe A
(1999) Сравнение серьезных побочных реакций на цельноклеточные и бесклеточные вакцины против коклюша в Южной Австралии.
 Med J Aust 171:285.
Med J Aust 171:285. - ↵
- Lister S,
- McIntyre PB,
- Burgess MA,
- O’Brien ED
9009)19: систематический обзор иммунизации детей в Австралии19:90–1998. Commun Dis Intell 23:145–170.
- ↵
- Leask JA,
- Chapman S
(1998) «Попытка обмануть природу»: репортаж в прессе о борьбе с иммунизацией 1993–1997 гг. Aust NZ J Общественное здравоохранение 22:17–26.
Статьи по ссылкам
Читать полный текст или скачать PDF:
Подписаться
Войти под своим именем пользователя и паролем
Для личных счетов ИЛИ управляющих корпоративными счетами
Имя пользователя *
Пароль *
Забыли данные для входа? Зарегистрировать новую учетную запись?
Забыли имя пользователя или пароль?
Реакции на прививку от столбняка — Справочный центр по травмам от вакцины
Побочные эффекты прививки от столбняка обычно легкие, такие как болезненность или умеренная лихорадка, однако у людей, получивших прививку, сообщалось о серьезных побочных эффектах.
Какова реакция на прививку от столбняка?
Реакция на прививку от столбняка — обычное дело. Легкие побочные эффекты очень распространены, с ними сталкивается примерно каждый четвертый ребенок.
Возможные побочные эффекты включают:
- умеренную лихорадку
- припухлость и/или покраснение в месте инъекции
- болезненность или болезненность в месте инъекции
- нервозность у младенцев
- безутешный плач 90 90 припадки
9 лихорадка (температура выше 101 F)
Серьезные побочные эффекты прививки от столбняка
Профилактика столбняка сопряжена с риском. Наши юристы по травмам, полученным в результате прививок, в компании Sadaka Law добились компенсации за следующие травмы от вакцины против столбняка:
ОРЭМ (острый диссеминированный энцефаломиелит)
ОРЭМ или острый диссеминированный энцефаломиелит — еще один синдром, поражающий нервную систему. Это обычно происходит медленнее, с периодом до месяца между вакцинацией и первыми симптомами. Ранние симптомы, в том числе потеря зрения, паралич и потеря координации движений, вызваны хроническим воспалением головного и спинного мозга. ОРЭМ также может вызывать потерю внимания, симптомы, подобные аутизму, и другие поведенческие изменения.
Ранние симптомы, в том числе потеря зрения, паралич и потеря координации движений, вызваны хроническим воспалением головного и спинного мозга. ОРЭМ также может вызывать потерю внимания, симптомы, подобные аутизму, и другие поведенческие изменения.
Копните немного глубже о вакцине DTaP или связанной с вакциной Tdap ADEM
Анафилаксия, возникающая в течение 4 часов
Анафилаксия — это острая, тяжелая и потенциально летальная системная реакция. Признаки и симптомы анафилаксии после введения противостолбнячной вакцины проявляются через несколько минут или часов после инъекции. Если у вас была аллергическая реакция на предыдущую вакцину против столбняка, побочный эффект может быть смертельным.
Симптомы включают синюшность (цианоз), головокружение или обмороки из-за низкого кровяного давления (гипотензия), ненормальный сердечный ритм и проблемы с дыханием. Смерть обычно наступает от недостатка воздуха.
Подробнее об анафилаксии, связанной с прививкой от столбняка
Плечевой неврит / плечевое сплетение / синдром пастора Тернера
Плечевой неврит — это состояние, возникающее в результате повреждения нервов в плечевом сплетении. Плечевое сплетение представляет собой пучок нервов в плече, который передает движения и сенсорные сигналы от спинного мозга к рукам и кистям. Считается, что неврит плечевого сустава вызван атакой иммунной системы организма.
Плечевое сплетение представляет собой пучок нервов в плече, который передает движения и сенсорные сигналы от спинного мозга к рукам и кистям. Считается, что неврит плечевого сустава вызван атакой иммунной системы организма.
Плечевой неврит является известным побочным эффектом противостолбнячной вакцины. Симптомы обычно появляются через 2–28 дней после прививки от столбняка. Плечевой неврит начинается с сильной боли, за которой следует слабость, которая может привести к атрофии мышц. Распространенное уродство, связанное с невритом плечевого сустава, называется крыловидностью лопатки, что представляет собой деформацию лопаток.
Что такое истощение мышц после прививки от столбняка?
Атрофия мышц после прививки от столбняка обычно вызывается плечевым невритом. Плечевой неврит — это потеря мышечной ткани из-за повреждения нервов, иннервирующих мышцы. Это может привести к слабости и атрофии (сокращению) пораженных мышц. Лечение обычно направлено на облегчение симптомов и сохранение функции. В тяжелых случаях может потребоваться хирургическое вмешательство, чтобы уменьшить давление на нервы или расслабить мышцы, которые напряглись или застыли на месте.
В тяжелых случаях может потребоваться хирургическое вмешательство, чтобы уменьшить давление на нервы или расслабить мышцы, которые напряглись или застыли на месте.
Раскопайте немного глубже плечевой неврит, связанный с прививкой от столбняка
Энцефалопатия или энцефалит
Как энцефалопатия, так и энцефалит представляют собой нарушения в работе мозга, влияющие на функционирование организма. Энцефалопатия — это термин, который используется для описания резкого изменения функции мозга. Подобный приступ может быть типом энцефалопатии. Энцефалит — это воспаление головного мозга, вызывающее резкое изменение функции мозга.
Энцефалопатия, связанная с прививкой от столбняка, начинается в течение 72 часов после инъекции. Основным симптомом является значительное изменение психического состояния, не связанное с приемом лекарств, например психоз. У детей может быть значительно снижен уровень сознания. Приступ можно расценивать как энцефалопатию.
Вызывает ли вакцина против столбняка судороги?
Национальная программа возмещения вреда, нанесенного вакциной, признает, что вакцина против столбняка может вызвать судороги в течение 72 часов после введения.
Покопайтесь немного глубже в энцефалопатии, связанной с прививкой от столбняка
Синдром Гийена-Барре
Синдром Гийена-Барре — еще один редкий, но доказанный побочный эффект, поражающий нервную систему. Слабость может сопровождаться потерей рефлексов или параличом. Низкое кровяное давление и потеря зрения также характерны для этой неизлечимой болезни. Любая легкая реакция на прививку от столбняка, связанная с этими более серьезными реакциями, должна быть немедленно доведена до сведения врача.
Покопайтесь немного глубже в GBS, связанном с противостолбнячной вакциной
Травма плеча в результате введения вакцины (SIRVA)
Травма плеча в результате введения вакцины на сегодняшний день является наиболее распространенной побочной реакцией на все вакцины, включая столбнячную. SIRVA возникает, когда человек получил вакцину против столбняка слишком высоко в плече. Содержимое вакцины вводят в пространство под дельтовидной мышцей, называемое субдельтовидной бурсой. Это вызывает сильную боль и ограниченный диапазон движений. Появление симптомов происходит в течение 48 часов после инъекции.
Это вызывает сильную боль и ограниченный диапазон движений. Появление симптомов происходит в течение 48 часов после инъекции.
Копните немного глубже в связи с прививкой от столбняка SIRVA
Вазовагальный обморок
Вазовагальный обморок — это временная потеря сознания, вызванная внезапным падением артериального давления. Обморок, или обморок, является известным побочным эффектом вакцин, включая вакцину против столбняка. Симптомы обычно начинаются в течение 1 часа после введения.
Что такое вакцина против столбняка?
Столбняк — серьезное заболевание, и противостолбнячная вакцина предотвращает его. Прививки от столбняка объединяются с прививками от коклюша и дифтерии в одну вакцину, то есть DTaP или Tdap.
Противостолбнячная часть вакцины защищает от яда, создаваемого инфекцией бактерий, называемых Clostridium tetani . Столбнячная бактерия вырабатывает яд или токсин, вызывающий судороги, а также блокировку мышц шеи и челюсти, также известную как «тризм челюсти». Лобная челюсть может затруднить открытие рта или глотание. Часть противостолбнячной вакцины содержит столбнячный анатоксин, который представляет собой инактивированную версию яда, выделяемого бактериями.
Лобная челюсть может затруднить открытие рта или глотание. Часть противостолбнячной вакцины содержит столбнячный анатоксин, который представляет собой инактивированную версию яда, выделяемого бактериями.
Коклюшная часть вакцины широко известна как вакцина против коклюша. Коклюш — это высококонтагиозная инфекция, локализующаяся в легких и вызываемая бактериями, называемыми 9.0115 Bordetella pertussis . Кашель сильный и быстрый до тех пор, пока в легких не останется воздуха. Коклюшная часть содержит только часть бактерий, а не целые бактерии.
Дифтерия является очень опасным заболеванием и вызывается бактерией под названием Corynebacterium diphtheriae . Он смертелен в 10% случаев и поражает нервную систему. Это не легко излечимо.
Изменение конструкции вакцины против коклюша
Прививка от коклюша изменила конструкцию после того, как выяснилось, что тип коклюшной вакцины, которую используют производители, вызывает серьезные травмы. Производители переработали коклюшную часть, чтобы уменьшить серьезные побочные эффекты, связанные с цельноклеточным коклюшем. Новый, переработанный продукт называется бесклеточной коклюшной вакциной.
Новый, переработанный продукт называется бесклеточной коклюшной вакциной.
Таким образом, вы часто будете видеть вакцины против дифтерии, столбняка и коклюша, известные как DTaP* (против дифтерии, столбняка и бесклеточного коклюша) или Tdap* (против столбняка, дифтерии и бесклеточного коклюша), а также вакцину против столбняка, дифтерии и коклюша. вообще недоступен.
*Заглавные буквы в названиях вакцин обозначают дозу конкретного компонента. Таким образом, заглавная буква Т означает, что в вакцине Tdap содержится больше столбняка, чем дифтерии и бесклеточного коклюша.
Какие типы противостолбнячных вакцин существуют?
DT, Td обеспечивает защиту от дифтерии и столбняка.
DTaP и Tdap обеспечивают защиту от дифтерии, столбняка и коклюша.
Реакции иногда включают аллергические реакции. Реакции на прививку от столбняка могут возникнуть и после бустерной инъекции, что часто упускается из виду в научных исследованиях и новостных сообщениях.
Кому следует избегать прививки от столбняка?
Вы не должны вводить вакцины против дифтерии, столбняка и коклюша:
- Пациенты, у которых развилась тяжелая аллергическая реакция (например, анафилаксия) после введения предыдущей дозы
- Лица с тяжелой аллергией на любой компонент вакцины
- Пациенты, у которых развилась энцефалопатия в течение 7 дней после введения предыдущей дозы АКДС , DTaP или Tdap
Когда следует сделать прививку от столбняка?
Вакцина против столбняка является частью графика детских прививок, который публикуется комитетом Центров по контролю и профилактике заболеваний (CDC). График включает четыре инъекции, которые делают в возрасте от 2 месяцев до 4-6 лет. Затем в 11-12 лет делают бустер. Взрослые обычно имеют возможность получать одну бустерную дозу каждые десять лет.
График включает четыре инъекции, которые делают в возрасте от 2 месяцев до 4-6 лет. Затем в 11-12 лет делают бустер. Взрослые обычно имеют возможность получать одну бустерную дозу каждые десять лет.
CDC рекомендует прививку от столбняка в следующем возрасте:
- 1 прививка от столбняка в 2 месяца
- 1 в 4 месяца
- 1 в 6 месяцев
- Повторная прививка в возрасте от 15 до 18 месяцев в возрасте
- Еще одна ревакцинация против столбняка в возрасте от 4 до 6 лет
Центры по контролю и профилактике заболеваний США (CDC) рекомендует проводить частую вакцинацию против дифтерии, столбняка и бесклеточного коклюша. Помимо младенцев и детей, CDC рекомендует:
- Подросткам вводят разовую дозу вакцины Tdap.
- Беременным женщинам однократная доза Tdap во время каждой беременности, предпочтительно в начале гестационного периода с 27 по 36 неделю.
- Взрослые, нуждающиеся в ревакцинации.
Если вы пострадали от прививки от столбняка, существует программа компенсации.

 Услуги, почтовый ящик 6, торговый центр Rundle, Аделаида 5000, Южная Австралия
Услуги, почтовый ящик 6, торговый центр Rundle, Аделаида 5000, Южная Австралия  Противопоказания к иммунизации против коклюша. J Paediatr Child Health 30:310–311.
Противопоказания к иммунизации против коклюша. J Paediatr Child Health 30:310–311. 
 Педиатрия 102:e52.
Педиатрия 102:e52. 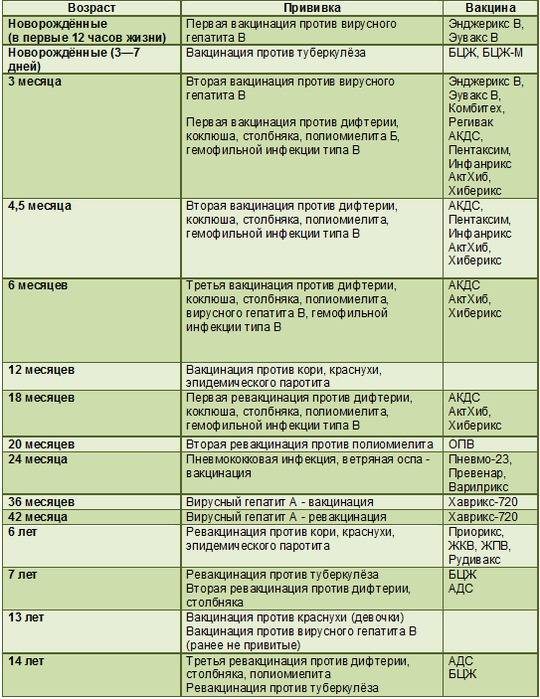 Med J Aust 171:285.
Med J Aust 171:285.