Содержание
Вакцинация в ревматологии: эволюция взглядов на проблему
АБЦ — абатацепт
АВРЗ — аутовоспалительные ревматические заболевания
АТ — антитела
БПВП — базисные противовоспалительные препараты
ГИБП — генно-инженерные биологические препараты
ГКС — глюкокортикостероиды
ДИ — доверительный интервал
и-α-ФНО — ингибиторы α-фактора некроза опухолей
КПО — коэффициент постиммунизационного ответа
МТ — метотрексат
ОШ — отношение шансов
Пн — пневмония
ППВ — пневмококковая полисахаридная вакцина
РА — ревматоидный артрит
РЗ — ревматические заболевания
РТМ — ритуксимаб
СИ — сочетанные инфекции
СКВ — системная красная волчанка
ТЦЗ — тоцилизумаб
На протяжении всей истории человечества инфекционные болезни представляли наибольшую угрозу здоровью и жизни людей. Эпидемии буквально опустошали города и страны в древние времена и ставили на грань вымирания целые народы. Люди испытывали панический страх перед возникновением и распространением тех или иных эпидемий. Именно этим страхом были обусловлены предпринимаемые людьми особые меры (сжигание трупов умерших, их одежды и жилища, «закрытие» городов и т. д.), которые по сути являлись прообразом противоэпидемических мер, применяемых в современных условиях.
Люди испытывали панический страх перед возникновением и распространением тех или иных эпидемий. Именно этим страхом были обусловлены предпринимаемые людьми особые меры (сжигание трупов умерших, их одежды и жилища, «закрытие» городов и т. д.), которые по сути являлись прообразом противоэпидемических мер, применяемых в современных условиях.
В ушедшем в историю ХХ веке развернута беспрецедентно активная борьба с инфекционными заболеваниями. Он принес целую серию блестящих открытий и достижений в данной области. Однако в наступившем XXI веке общемедицинская и социальная значимость инфекционных болезней сохраняются по-прежнему. Как свидетельствуют данные Всемирной организации здравоохранения, с инфекционными и паразитарными заболеваниями связана четвертая часть летальных исходов во всем мире. Данный показатель увеличивается до 35% при учете роли инфекций в неинфекционных клиниках. Нарастающее количество новых неизвестных ранее инфекционных болезней, возрождение считавшихся ликвидированными нозологий, установление инфекционной этиологии целого ряда заболеваний — все это стало предметом повседневного внимания врачей различного профиля, включая ревматологов. Процесс эволюции инфекционной патологии открывает новые аспекты рассматриваемой проблемы, что обусловливает необходимость пересмотра ранее существовавших подходов к диагностике, лечению и профилактике.
Процесс эволюции инфекционной патологии открывает новые аспекты рассматриваемой проблемы, что обусловливает необходимость пересмотра ранее существовавших подходов к диагностике, лечению и профилактике.
Несомненного внимания в современной ревматологии заслуживает проблема сочетанных инфекций (СИ), формирование которых обусловлено как самим РЗ, так и необходимостью применения препаратов иммуносупрессивного действия. СИ существенно влияют на заболеваемость и летальность, особенно при диффузных заболеваниях соединительной ткани. На протяжении последних 40 лет известно о высокой частоте СИ, которые осложняют течение ревматоидного артрита (РА). При этом у пациентов с РА СИ развиваются в 1,5 раза чаще, чем у в популяции, и занимают второе место (после активности болезни) в ряду причин летальных исходов этих больных [1].
Последние десятилетия ознаменовались существенными изменениями в ревматологии, обусловленными главным образом активным и нарастающим внедрением генно-инженерных биологических препаратов (ГИБП) в клиническую практику. Однако накопление мирового клинического опыта позволило констатировать, что применение данных лекарственных средств сопровождается увеличением риска развития инфекционных осложнений различной этиологии и локализации. В настоящее время повышенный риск развития СИ относится к нежелательным явлениям, специфичным для всех ГИБП.
Однако накопление мирового клинического опыта позволило констатировать, что применение данных лекарственных средств сопровождается увеличением риска развития инфекционных осложнений различной этиологии и локализации. В настоящее время повышенный риск развития СИ относится к нежелательным явлениям, специфичным для всех ГИБП.
В структуре инфекционных осложнений у больных РЗ лидирующее место занимают пневмонии (Пн), на долю которых приходится 22—67% случаев [2—5]. В ретроспективном когортном исследовании, выполненном в Великобритании, показано статистически значимое увеличение риска развития инвазивной пневмококковой инфекции (включая Пн) среди стационарного контингента больных РА (отношение шансов — ОШ 2,47 при 95% доверительном интервале — ДИ от 2,41 до 2,52), системной красной волчанкой — СКВ (ОШ 5,0 при 95% ДИ от 4,6 до 5,4), узелковым полиартериитом (ОШ 5,0 при 95% ДИ от 4,0 до 6,0), системной склеродермией (ОШ 4,2 при 95% ДИ от 3,8 до 4,7), синдромом Шегрена (ОШ 3,2 при 95% ДИ от 2,9 до 3,5), анкилозирующим спондилитом (ОШ 1,96 при 95% ДИ от 1,07 до 3,3) [6].
Частота Пн у больных РА составляет 2,4—8,3%, или 5,9—17 случаев на 1000 человеко-лет. В исследовании, выполненном в НИИ ревматологии им. В.А. Насоновой, в качестве факторов риска развития Пн у пациентов с РА фигурировали высокая активность воспалительного процесса (ОШ 15,5 при 95% ДИ от 5,3 до 45,1; р<0,001), наличие хронических заболеваний легких (ОШ 7,4 при 95% ДИ от 1,4—39,9; р=0,01), отсутствие приема базисных противовоспалительных препаратов — БПВП (ОШ 5,6 при 95% ДИ от 2,3 до 14,1; р<0,001) и применение глюкокортикостероидов (ГКС) в качестве монотерапии (ОШ 6,4 при 95% ДИ от 1,8 до 23,1; р=0,005). Следует отметить, что при сочетании первого и третьего факторов риск развития Пн увеличивался до 19,3 [7]. Летальность от Пн среди больных РЗ в целом колеблется от 11 до 22%, при РА — от 8 до 22% [2, 3, 5, 8—12].
Многочисленные проблемы, обусловленные как Пн, так и инфекциями в целом в ревматологии и иных отраслях клинической медицины, нельзя решить только путем использования большого количества антиинфекционных препаратов, которые доступны в настоящее время. Следовательно, в ближайшей перспективе важная роль будет отведена созданию, совершенствованию и быстрому (по возможности) внедрению в клиническую практику вакцин различной направленности.
Следовательно, в ближайшей перспективе важная роль будет отведена созданию, совершенствованию и быстрому (по возможности) внедрению в клиническую практику вакцин различной направленности.
История свидетельствует, что вакцинация представляет собой один из наиболее эффективных методов преду-преждения инфекций и принадлежит к важнейшим достижениям медицинской науки XX века. Однако, по мнению многих практикующих врачей, наличие большинства хронических заболеваний, в первую очередь аутоиммунного генеза, рассматривается как противопоказание к иммунизации.
Главными вопросами, сдерживающими до последнего времени широкое применение вакцинации у больных ревматологического профиля, были следующие:
1. Возможно ли ослабление иммунного ответа на вакцину под влиянием механизмов, обусловливающих повышенную восприимчивость больных РЗ к инфекциям.
2. Не может ли активация иммунной системы, вызванная вакцинацией, привести к возникновению заболевания аутоиммунной природы или обострению имеющегося РЗ.
В течение многих десятилетий утверждали, что ответной реакцией на вакцинацию в условиях длительной моноклональной активации иммунокомпетентных клеток могут быть разнообразные нарушения в работе механизмов, ответственных за иммунологическую толерантность к аутологичным структурам макроорганизма. Поэтому вакцинация — замечательный подарок человечеству от Эдварда Дженнера и Луи Пастера — длительное время рассматривалась как своего рода троянский конь.
Авторами своеобразного аудита, выполненного в Великобритании и Франции, показано, что доля больных РЗ, охваченных вакцинацией против пневмококковой инфекции и гриппа, была крайне низкой (субоптимальной) и составляла 37 и 28% соответственно [13, 14]. В международном одномоментном исследовании COMORA, которое включало более 4500 больных РА, эти показатели еще ниже — 25,3 и 17,2% соответственно [15]. Полагают, что отсутствие рекомендаций лечащих врачей является ведущей причиной низкого охвата вакцинацией ревматологических пациентов [13—15].
В настоящее время механизмы формирования поствакцинальных аутоиммунных заболеваний полностью не раскрыты. По мнению отдельных исследователей, предположительными «виновниками» упомянутого процесса могут быть содержащиеся в вакцинах адъюванты и микробные агенты [16, 17]. При этом ведущая роль в развитии аутоиммунных реакций в ответ на действие инфектогена отводится феномену антигенной (или молекулярной) мимикрии. Сущность данного феномена заключается в том, что если у компонентов вакцины и макроорганизма имеются общие антигенные детерминанты, то инициируемый иммунный ответ может в результате привести к формированию перекрестных реакций с подобными аутоантигенами тканей, поражаемых у человека. Отличительной особенностью данного феномена является сохранность аутоиммунных реакций даже после того, как возбудитель и его антигены будут удалены из макроорганизма. Предполагается, что в развитии данного эффекта задействованы изменение антигенной структуры белковых молекул «хозяина», экспрессия «спящего» гена, высвобождение из клеток неизмененного белка в большом количестве (вирусопосредованная токсичность), высокая локальная концентрация цитокинов. Указанные механизмы способны предопределить аутоиммунный процесс как в сочетании, так и по отдельности.
Указанные механизмы способны предопределить аутоиммунный процесс как в сочетании, так и по отдельности.
По мнению некоторых авторов, массовая вакцинация привела к снижению частоты инфекционных болезней и, следовательно, произошло переключение с аутоиммунитета, обусловленного Th3, на Th2-иммунный ответ. Это и явилось причиной увеличения распространенности аутоиммунной патологии [18, 19]. Однако имеющиеся в литературе публикации позволяют констатировать отсутствие существенного отрицательного влияния вакцинации на активность воспалительного процесса и характер течения РЗ.
Как отмечалось ранее, инфекции дыхательных путей являются наиболее значимыми в плане заболеваемости и летальности у пациентов с Р.З. Этим обстоятельством объясняется преимущественное изучение эффективности и переносимости вакцин, действие которых направлено на предупреждение инфекций указанной локализации при РЗ. В конце 70-х годов XX века в ходе Национальной программы по иммунизации против гриппа, проводимой в США, выполнены 5 аналогичных по структуре исследований [20—24]. Цель этих работ состояла в оценке эффективности и безопасности моно- и бивалентной вакцин против гриппа у пациентов с СКВ в неактивной фазе заболевания. Высокая иммуногенность вакцины продемонстрирована у большинства больных, показатели сероконверсии не отличались от таковых в контрольной группе. У 4 (3,2%) из 125 больных СКВ, получивших вакцину, и у 1 (4,8%) пациента из 21 без вакцинации наблюдали обострение заболевания.
Цель этих работ состояла в оценке эффективности и безопасности моно- и бивалентной вакцин против гриппа у пациентов с СКВ в неактивной фазе заболевания. Высокая иммуногенность вакцины продемонстрирована у большинства больных, показатели сероконверсии не отличались от таковых в контрольной группе. У 4 (3,2%) из 125 больных СКВ, получивших вакцину, и у 1 (4,8%) пациента из 21 без вакцинации наблюдали обострение заболевания.
В 1984 г. продемонстрирована серологическая безопасность (отсутствие поствакцинальной поликлональной В-клеточной активации) 23-валентной пневмококковой полисахаридной вакцины (ППВ) у 18 пациентов с СКВ. При этом частота позитивного ответа на вакцину у больных оказалась сопоставимой с таковой у лиц контрольной группы — 83 и 100% соответственно [25].
После иммунизации указанной вакциной у 73 больных СКВ возрастание титров специфического антипневмококкового IgG в 2 раза и более отмечено в 85,7% случаев. При дальнейшем наблюдении в течение 3 мес случаи обострения заболевания или другие нежелательные явления не зарегиcтрированы [26].
В редакционной статье журнала «Journal of Rheumatology» профессор из Мексики U. Mercado [27] отмечает, что «…безопасность и иммуногенность вакцин против пневмококка и вируса гриппа, о которых впервые сообщалось в конце 70-х годов XX века, теперь при СКВ подтверждена. Доказательств обострения болезни не получено. У больных СКВ формируются протективные антитела (АТ), несмотря на активность болезни и применение иммуносупрессоров. Следует отметить, что гуморальный иммунный ответ на эти вакцины является антигенспецифическим и не зависит от продукции анти-ДНК-АТ, а индукция аутоиммунного феномена является редким событием».
В настоящее время активно изучаются иммуногенность и безопасность вакцинации у пациентов с РА, которые получают терапию БПВП и ГИБП.
В ходе многоцентрового двойного слепого исследования протективный уровень АТ, который определяли после введения вакцины против гриппа у больных РА, получавших терапию адалимумабом, был аналогичен таковому в плацебо-контроле (98 и 94,55% соответственно). Этими же авторами показано, что протективные уровни АТ после введения 23-валентной ППВ в указанных группах статистически значимо не различались (85,9 и 81,7% соответственно) [28].
Этими же авторами показано, что протективные уровни АТ после введения 23-валентной ППВ в указанных группах статистически значимо не различались (85,9 и 81,7% соответственно) [28].
В исследовании M. Kapetanovic и соавт. [29], которое включало 149 больных РА, постиммунизационный ответ был более выражен у пациентов, находившихся на лечении биологическими препаратами (инфликсимаб, этанерцепт), по сравнению с группами, которые получали комбинированную терапию (р=0,037) или МТ в отдельности (р<0,001).
Сравнительное исследование японских авторов, включавшее 190 больных РА, было посвящено изучению иммуногенности и безопасности 23-валентной ППВ. Среди больных, получавших ТЦЗ, показатели поствакцинального ответа были аналогичны таковым в контроле. В то же время метотрексат (МТ) оказывал выраженное ингибирующее влияние на поствакцинальный ответ (р=0,009). В большинстве случаев переносимость вакцины была хорошей, у 12 больных наблюдались слабовыраженные постинъекционные локальные реакции [30].
По данным исследования VISARA, положительный гуморальный ответ на 23-валентную пневмококковую вакцину наблюдали в 60% случаев среди больных РА, которые получали комбинированное лечение тоцилизумабом (ТЦЗ) и МТ, и 71% — при монотерапии М.Т. Учитывая полученные результаты, авторами рекомендуется иммунизация названной вакциной до начала лечения ТЦЗ [31].
В ходе многоцентрового контролируемого сравнительного исследования C. Bingham и соавт. [32] оценивали иммуногенность и безопасность столбнячного анатоксина (Т-клеточнозависимый антиген) и 23-валентной ППВ (Т-независимый антиген) у больных РА, которые получали ритуксимаб (РТМ) в сочетании с МТ или МТ в отдельности (группа контроля). Иммунизацию вышеназванными вакцинами осуществляли через 6 и 7 мес соответственно от начала терапии РТМ. В обеих группах наблюдали аналогичный ответ после введения противостолбнячной вакцины. В то же время в группе больных, получавших РТМ, спустя 4 нед после иммунизации доля пациентов с поствакцинальным ответом к каждому из 12 серотипов пневмококка значительно снизилась. У этих же больных отмечали снижение поствакцинального ответа на определенное количество серотипов пневмококка и постиммунизационных средних геометрических титров антипневмококкового IgG по сравнению с таковыми у больных, получавших МТ в отдельности. Обострение Р.А. или развитие тяжелых инфекций не отмечены ни в одном случае [32]. Выраженное ингибирующее влияние РТМ в отношении гуморального ответа на пневмококковую вакцину отмечают и другие исследователи [33, 34]. Авторы едины во мнении, что у больных РА, получающих терапию РТМ, вакцинация против пневмококковой инфекции рассматривается как безопасная, однако в целях повышения постиммунизационного ответа ее следует выполнять перед началом анти-В-клеточной терапии.
У этих же больных отмечали снижение поствакцинального ответа на определенное количество серотипов пневмококка и постиммунизационных средних геометрических титров антипневмококкового IgG по сравнению с таковыми у больных, получавших МТ в отдельности. Обострение Р.А. или развитие тяжелых инфекций не отмечены ни в одном случае [32]. Выраженное ингибирующее влияние РТМ в отношении гуморального ответа на пневмококковую вакцину отмечают и другие исследователи [33, 34]. Авторы едины во мнении, что у больных РА, получающих терапию РТМ, вакцинация против пневмококковой инфекции рассматривается как безопасная, однако в целях повышения постиммунизационного ответа ее следует выполнять перед началом анти-В-клеточной терапии.
Эффективность и безопасность пневмококковой вакцины изучали в рамках исследования ARRIVE у 21 больного РА, которые получали абатацепт (АБЦ) в дозе 10 мг/кг в комбинации с М.Т. Иммунизацию осуществляли за 7 дней до очередного введения АБЦ. Через месяц после вакцинации позитивный ответ на ≥1 серотип вакцины наблюдали у 81% больных, ≥2 — у 71%, ≥3 — у 48%, ≥4 — у 33% [35]. Шведские авторы также отмечают ингибирующее влияние АБЦ на гуморальный поствакцинальный ответ. Эксперты Французского общества ревматологов полагают, что временное прекращение терапии АБЦ за 3 мес до любой вакцинации является оптимальным вариантом. Однако при наличии явной необходимости иммунизацию инактивированными вакцинами можно выполнить в любое время [36].
Шведские авторы также отмечают ингибирующее влияние АБЦ на гуморальный поствакцинальный ответ. Эксперты Французского общества ревматологов полагают, что временное прекращение терапии АБЦ за 3 мес до любой вакцинации является оптимальным вариантом. Однако при наличии явной необходимости иммунизацию инактивированными вакцинами можно выполнить в любое время [36].
K. Winthrop и соавт. [37] изучали влияние тофацитиниба — ТОФА (10 мг 2 раза в сутки) на гуморальный ответ после иммунизации 23-валентной ППВ у больных РА. В группе «наивных» (т.е. не получавших препарат ранее) больных, вакцинированных на 28-й день от начала лечения ТОФА, уровни АТ, определяемые через 35 дней после вакцинации, были ниже, чем в контроле (45,1 и 68,4% соответственно). Одновременное применение МТ понижало долю ответивших на вакцину до 31,6% (в контроле 61,8%). В группах больных, которых вакцинировали на фоне продолжающейся терапии ТОФА или после двухнедельного перерыва в приеме препарата, данные показатели составили 75 и 84,6% соответственно, а с учетом приема МТ — 65,5 и 80% соответственно. Отмечая существенное ингибирующее влияние исследуемого препарата (особенно в сочетании с МТ) на поствакцинальный гуморальный ответ, авторы подчеркивают целесообразность назначения пневмококковой вакцины до начала лечения ТОФА [37].
Отмечая существенное ингибирующее влияние исследуемого препарата (особенно в сочетании с МТ) на поствакцинальный гуморальный ответ, авторы подчеркивают целесообразность назначения пневмококковой вакцины до начала лечения ТОФА [37].
Абсолютное большинство исследований по оценке иммуногенности различных вакцин являются краткосрочными (1—3 мес). В то же время представляется несомненно важной оценка продолжительности протективного поствакцинального ответа на протяжении более длительного времени для решения вопроса о сроках ревакцинации. В работе шведских исследователей проанализированы данные по иммуногенности 7-валентной пневмококковой конъюгированной вакцины у 163 больных РА, получавших различные схемы терапии. Через 1,5 года после вакцинации протективные уровни АТ сохранялись у 40% больных РА, получавших лечение МТ, 32% у получавших ингибиторы α-фактора некроза опухолей (и-α-ФНО), 20% у получавших МТ + и-α-ФНО. В качестве факторов риска быстрого снижения уровней поствакцинальных АТ выделены длительность болезни (p=0,011), индекс HAQ (p=0,02), низкий исходный уровень АТ (p<0,001), а также применение и-α-ФНО (p=0,024). Авторами высказывается предположение о целесообразности более ранних сроков пневмококковой ревакцинации больных РА по сравнению с общей популяцией (в последнем случае — 5 лет) [38]. Однако, во-первых, эти данные нуждаются в подтверждении в рамках других исследований. Во-вторых, пока неизвестно, в какой степени показатели иммуногенности коррелируют с клинической эффективностью вакцин у больных РЗ в целом и РА в частности. В-третьих, показано, что корреляции между уровнем поствакцинальных АТ и защитой от пневмококковых инфекций значительно варьируют в различных популяциях в зависимости от серотипов возбудителя и локализации инфекций [39].
Авторами высказывается предположение о целесообразности более ранних сроков пневмококковой ревакцинации больных РА по сравнению с общей популяцией (в последнем случае — 5 лет) [38]. Однако, во-первых, эти данные нуждаются в подтверждении в рамках других исследований. Во-вторых, пока неизвестно, в какой степени показатели иммуногенности коррелируют с клинической эффективностью вакцин у больных РЗ в целом и РА в частности. В-третьих, показано, что корреляции между уровнем поствакцинальных АТ и защитой от пневмококковых инфекций значительно варьируют в различных популяциях в зависимости от серотипов возбудителя и локализации инфекций [39].
В 2011 г. EULAR опубликовала рекомендации по вакцинации больных с аутовоспалительными ревматическими заболеваниями (АВРЗ), подготовленные с учетом результатов клинических исследований и мнения экспертов. Согласно преамбуле эффективность вакцины трактуется как ее способность генерировать или усиливать протективный иммунный ответ макроорганизма. Однако, по мнению авторов, истинная клиническая эффективность не всегда коррелирует с иммунным ответом in vitro. Это следует учитывать при интерпретации данных научной литературы.
Однако, по мнению авторов, истинная клиническая эффективность не всегда коррелирует с иммунным ответом in vitro. Это следует учитывать при интерпретации данных научной литературы.
Эксперты EULAR настоятельно рекомендуют проводить иммунизацию вакцинами против гриппа и пневмококковой инфекции всем пациентам с АВРЗ вследствие высокого риска летальных исходов, обусловленных инфекционными заболеваниями дыхательных путей. При этом вакцинация показана даже больным с ожидаемым субоптимальным ответом [40, 41].
Ряд авторов полагают, что вакцинацию у больных РЗ следует выполнять до назначения ГИБП с целью достижения оптимального постиммунизационного ответа. По мнению экспертов EULAR, вакцинация возможна на фоне лечения как БПВП, так и и-α-ФНО. Однако, как уже указывалось, больные АВРЗ, которые являются кандидатами для терапии РТМ, должны быть вакцинированы до начала лечения. Если такая терапия уже проводится, то вакцинировать больного следует по меньшей мере через 6 мес от начала анти-В-клеточной терапии, но не ранее чем за 4 нед до следующего курса [42—44].
В настоящее время безопасность противогриппозных и пневмококковых вакцин продемонстрирована при некоторых РЗ. В частности, в результате проведенного в Швеции эпидемиологического исследования EIRA не выявлено увеличения числа случаев развития или обострения РА (с включением как позитивных, так и негативных к АТ к циклическому цитруллиновому пептиду форм) на протяжении пятилетнего периода от момента иммунизации наиболее распространенными вакцинами. Авторы настоятельно подчеркивают необходимость довести до сведения работников здравоохранения полученные результаты, с тем чтобы инициировать проведение иммунизации больных РА в соответствии с национальными программами по вакцинации [45].
Рабочая группа экспертов EULAR также предложила перспективный план работ по этой проблеме. В него включены формирование регистров вакцинированных больных АВРЗ (при этом наибольшее внимание уделено эффективности и безопасности иммунизации), выполнение проспективных исследований, цель которых изучение этиологии и частоты инфекций у этих больных, влияние инновационных методик на распространенность инфекций, которые могут быть предупреждены путем вакцинации, и т. д. Представляют несомненный интерес разработка и внедрение в клиническую практику разнообразных схем антибиотикопрофилактики, действие которой будет направлено на дальнейшее снижение заболеваемости и летальности, ассоциированных с инфекцией у больных РЗ.
д. Представляют несомненный интерес разработка и внедрение в клиническую практику разнообразных схем антибиотикопрофилактики, действие которой будет направлено на дальнейшее снижение заболеваемости и летальности, ассоциированных с инфекцией у больных РЗ.
С учетом изложенного существует настоятельная потребность в проведении подобных исследований в российской популяции пациентов. Однако в отечественной литературе до последнего времени имелись единичные подобные работы [46], которые выполнены с привлечением лишь педиатрического контингента больных.
Результаты исследования, выполняемого в НИИР им. В.А. Насоновой, позволяют сделать следующие выводы.
В ходе открытого проспективного сравнительного исследования, включавшего 110 испытуемых, проживающих на территории Российский Федерации, которых наблюдали в течение 1 года, показаны достаточная иммуногенность и высокая безопасность 23-валентной ППВ у больных Р.А. Это свидетельствует о возможности вакцинации пациентов с РА, получающих терапию БПВП, комбинированную терапию и-α-ФНО +БПВП, а также ГКС.
У больных РА выявлена выраженная положительная иммунная реакция на изучаемую вакцину, заключавшаяся в статистически значимом нарастании уровней пневмококковых АТ (p<0,05) и коэффициента постиммунизационного ответа — КПО (p<0,05). Доля ответивших на пневмококковую вакцину среди больных РА составила 61%, в контроле — 70%.
Применение МТ, лефлуномида и комбинированной терапии (и-α-ФНО + МТ) статистически значимо не влияет на постиммунизационный ответ у больных Р.А. Частота ответов на вакцину к годовому сроку наблюдения составила 61, 65 и 70% соответственно.
Терапия ГКС не оказывает негативного влияния на показатели поствакцинального иммунного ответа в течение 12 мес наблюдения. КПО у больных РА, получавших терапию ГКС и без таковой, статистически значимо не различались (3,47±0,78 и 2,8±0,36 соответственно; р>0,05).
По данным моновариантного анализа, включавшего 21 признак, клинически значимыми факторами риска негативного ответа на вакцину у больных РА через 12 мес наблюдения являлись отрицательные результаты на промежуточных этапах контроля через 1 мес (ОШ 5,47 при 95% ДИ от 1,3 до 22,9) и 3 мес (ОШ 4,49 при 95% ДИ от 1,6 до 12,7).
У пациентов с РА отмечено благоприятное течение поствакцинального процесса: в 65% — бессимптомное, в 35% наблюдались общие реакции слабой и средней степени выраженности. При этом типичные поствакцинальные реакции претерпели полное обратное развитие в течение суток без дополнительных мероприятий и не требовали изменения схем лечения РА.
Клинически значимая положительная динамика индекса DAS28 у больных РА (4,32 и 3,31 на первом и четвертом визитах соответственно; p<0,001) свидетельствует об отсутствии негативного влияния вакцинации на активность болезни.
Преобладание больных РА со средней и высокой степенью активности (84,7%) на исходном этапе исследования и клинически значимая положительная динамика индекса DAS28 на фоне противоревматической терапии позволяют констатировать безопасность вакцинации пациентов с РА с высокой и умеренной активностью процесса [47].
Таким образом, вопросы СИ при РЗ, сохраняют значение по-прежнему. При этом весьма важной, но крайне мало разработанной и практически не получившей освещение в отечественной литературе представляется проблема Пн, которая лидирует в структуре серьезных СИ у больных Р. З. Исходя из изложенного крайне своевременно и необходимо выполнение на территории РФ единой научной программы, состоящей из серии исследовательских работ, затрагивающих различные стороны данной проблемы, в том числе эффективность и безопасность вакцинации, с последующей подготовкой клинических рекомендаций по ведению этих больных. Данные литературы по указанной проблематике свидетельствуют, что вакцинация представляет собой мощнейший метод пре-дупреждения инфекционных заболеваний, которые являются крайне важной проблемой для пациентов с Р.З. Вакцинация необходима даже для больных, у которых ожидается субоптимальный ответ. «Повышает вакцинация частоту аутоиммунных заболеваний или нет, каково влияние нарастающего числа схем вакцинации, иммунизация в различных возрастных группах, риски совпадающих во времени ассоциаций — это по-прежнему вопросы для обсуждения. В настоящее же время с целью устранения разногласий в медицинском обществе и средствах массовой информации необходимо придерживаться рекомендаций, обеспечивая строгий надзор за их выполнением и сообщая о возможных побочных эффектах» [48].
З. Исходя из изложенного крайне своевременно и необходимо выполнение на территории РФ единой научной программы, состоящей из серии исследовательских работ, затрагивающих различные стороны данной проблемы, в том числе эффективность и безопасность вакцинации, с последующей подготовкой клинических рекомендаций по ведению этих больных. Данные литературы по указанной проблематике свидетельствуют, что вакцинация представляет собой мощнейший метод пре-дупреждения инфекционных заболеваний, которые являются крайне важной проблемой для пациентов с Р.З. Вакцинация необходима даже для больных, у которых ожидается субоптимальный ответ. «Повышает вакцинация частоту аутоиммунных заболеваний или нет, каково влияние нарастающего числа схем вакцинации, иммунизация в различных возрастных группах, риски совпадающих во времени ассоциаций — это по-прежнему вопросы для обсуждения. В настоящее же время с целью устранения разногласий в медицинском обществе и средствах массовой информации необходимо придерживаться рекомендаций, обеспечивая строгий надзор за их выполнением и сообщая о возможных побочных эффектах» [48]. Несомненно, что в целях отработки более четких показаний к вакцинации, определения временных интервалов для ревакцинации, оценки эффективности и безопасности различных вакцин (в первую очередь против гриппа и пневмококковых), а также изучения влияния на результаты иммунизации различных противоревматических препаратов у больных РЗ необходимы дальнейшие многоцентровые крупные исследования [49].
Несомненно, что в целях отработки более четких показаний к вакцинации, определения временных интервалов для ревакцинации, оценки эффективности и безопасности различных вакцин (в первую очередь против гриппа и пневмококковых), а также изучения влияния на результаты иммунизации различных противоревматических препаратов у больных РЗ необходимы дальнейшие многоцентровые крупные исследования [49].
Авторы заявляют об отсутствии конфликта интересов.
Диффузная кожная реакция после пневмококковой вакцины PPV-23: гиперчувствительный васкулит, связанный с иммунизацией
Текст статьи
Меню статьи
- Статья
Текст - Артикул
информация - Цитата
Инструменты - Поделиться
- Быстрое реагирование
- Артикул
метрика - Оповещения
Изображения в…
Диффузная кожная реакция после пневмококковой вакцины PPV-23: гиперчувствительный васкулит, связанный с иммунизацией
Бесплатно
- http://orcid.
 org/0000-0002-5596-4726abuelmagd abdalla1,
org/0000-0002-5596-4726abuelmagd abdalla1, - Salim Sebaoui2 и
- Shafeeq Alraqi1
- 9 1 9009,
- ,
- ,
- ,
- ,
- ,
- ,
- ,
- ,
- ,
- ,
- ,
- ,
- ,
- ,
- ,
- ,
- ,
- ,
- ,
- , 9001, 9001, 9009, 9004, 9001, 9001, 9009, 9009, 9009,
- ,
- , 9001, а также
- 2 Неотложная медицина, Университетская больница Mater Misericordiae, Дублин 7, Ирландия
- Переписка с доктором Абуэльмагдом Абдаллой; dr_abuelmagd{at}icloud.com
http://dx.doi.org/10.1136/bcr-2020-234714
Статистика с Altmetric.com
Запросить разрешения
Если вы хотите повторно использовать что-либо или все это статьи, пожалуйста, используйте приведенную ниже ссылку, которая приведет вас к сервису RightsLink Центра защиты авторских прав. Вы сможете получить быструю цену и мгновенное разрешение на повторное использование контента различными способами.
- васкулит
- дерматология
- иммунология
Описание
76-летний мужчина обратился в наше отделение неотложной помощи с 7-дневной историей кожной сыпи и зуда и впоследствии был госпитализирован с возможным небольшим сосудом васкулит. При дальнейшем допросе он признался, что впервые получил пневмококковую вакцину за 3 дня до появления симптомов. Он также получил свою вакцину против сезонного гриппа одновременно, которую он регулярно получал в течение последних 10 лет без каких-либо реакций. Он отрицал какие-либо другие специфические симптомы, кроме сыпи, которая началась вокруг места инъекции, а затем распространилась на большую часть его тела (кроме головы и шеи). В анамнезе у него были хроническая обструктивная болезнь легких, гипертония, мерцательная аритмия и металлический аортальный клапан, а также активное курение. Его лекарства оставались неизменными в течение предыдущих 2 лет.
Его клиническое обследование показало нормальные показатели жизнедеятельности без лихорадки или недомогания. При осмотре его кожи была обнаружена диффузная сыпь на всех конечностях и туловище (рис. 1–3). Кожные высыпания представляли собой сочетание пятнисто-папулезных, петехиальных, пурпурных и экхимозных поражений с несколькими рассеянными геморрагическими волдырями. Небольшие некротические поражения также отмечены на его правом среднем пальце (рис. 1В).
При осмотре его кожи была обнаружена диффузная сыпь на всех конечностях и туловище (рис. 1–3). Кожные высыпания представляли собой сочетание пятнисто-папулезных, петехиальных, пурпурных и экхимозных поражений с несколькими рассеянными геморрагическими волдырями. Небольшие некротические поражения также отмечены на его правом среднем пальце (рис. 1В).
Рисунок 1
Обе верхние конечности, левая (A) и правая (B).
Рисунок 2
Обе нижние конечности спереди (А) и сзади (В).
Рисунок 3
Передняя и задняя часть туловища.
Лабораторные исследования выявили нейтрофильный лейкоцитоз, повышенный уровень С-реактивного белка и незначительное снижение лимфоцитов и эозинофилов. Аутоиммунный и вирусный скрининг был отрицательным, включая нормальные уровни иммуноглобулинов и комплемента при отсутствии циркулирующих криоглобулинов. Исследование мочи не показало ни эритроцитов, ни белка. Его биопсия кожи (пункция) выявила выраженный папиллярный отек дермы и выраженную поверхностную и среднедермальную периваскулярную лимфоцитарную инфильтрацию с многочисленными эозинофилами, но отрицательной прямой иммунофлюоресценцией. Было сочтено, что результаты согласуются с реакцией кожной гиперчувствительности на возможную лекарственную реакцию, которая в данном случае пневмококковая вакцина была наиболее вероятным триггером, учитывая последовательность событий и отсутствие других преципитантов. Пациентка получала преднизолон 40 мг ежедневно и цетиризин 10 мг, что привело к значительному клиническому улучшению.
Его биопсия кожи (пункция) выявила выраженный папиллярный отек дермы и выраженную поверхностную и среднедермальную периваскулярную лимфоцитарную инфильтрацию с многочисленными эозинофилами, но отрицательной прямой иммунофлюоресценцией. Было сочтено, что результаты согласуются с реакцией кожной гиперчувствительности на возможную лекарственную реакцию, которая в данном случае пневмококковая вакцина была наиболее вероятным триггером, учитывая последовательность событий и отсутствие других преципитантов. Пациентка получала преднизолон 40 мг ежедневно и цетиризин 10 мг, что привело к значительному клиническому улучшению.
Пневмококковая полисахаридная вакцина содержит 23 наиболее распространенных и инвазивных штамма пневмококка (Pneumovax 23). Гиперчувствительный васкулит — это кожный васкулит мелких сосудов, опосредованный отложением иммунных комплексов, который вызывается различными факторами, такими как лекарственные препараты, инфекции, новообразования, или в сочетании с другими воспалительными состояниями или заболеваниями соединительной ткани. 1 Однако причина может оставаться неясной примерно в 30% случаев. –50% случаев.2
1 Однако причина может оставаться неясной примерно в 30% случаев. –50% случаев.2
Диагноз обычно подтверждается пункционной биопсией свежего поражения, в идеале от 24 до 48 часов для гистопатологии и от 8 до 24 часов для прямой иммунофлуоресценции.3 Популяция 2014 г. Исследование, проведенное в США, оценило заболеваемость в 45 случаев на миллион в год.4 Различные васкулиты были зарегистрированы в связи с многочисленными вакцинациями, классическим кожным васкулитом и обычно в течение 10 дней.5 Тяжелые формы системного васкулита после пневмококковой вакцины также были зарегистрированы. сообщалось, включая болезнь Кавасаки, ревматическую полимиалгию, васкулит ЦНС и смешанную криоглобулинемию II типа. риск вызвать тяжелые местные и системные реакции, а также вспышки заболевания у стабильных пациентов с болезнью Бехчета, вызванной пневмококковой вакциной,8 9когорта, как правило, настоятельно рекомендуется пройти иммунизацию против вакциноуправляемых инфекций.10
Пункты обучения
Васкулит, вторичный по отношению к иммунизации, встречается редко, но о нем все чаще сообщается, и его следует учитывать при дифференциальной диагностике возможных реакций на лекарства.

Несмотря на то, что иммунизация рекомендуется для подгрупп, включая пожилых пациентов с множественными сопутствующими заболеваниями, иногда она может привести к значительной заболеваемости.
Благодарности
Отделение клинической фотографии Университетской больницы Mater Misericordiae.
Каталожные номера
- ↵
- Kevil CG,
- Bullard DC
. Роль молекул адгезии лейкоцитов/эндотелиальных клеток в патогенезе васкулита. Am J Med 1999;106:677–87.doi:10.1016/S0002-9343(99)00132-1
- ↵
- Patel-Cohen M
9003
3. Гиперчувствительный васкулит: предпосылки, патофизиология, этиология, 2018. Доступно: https://emedicine.medscape.com/article/1083719-overview#a7
- ↵
- Demirkesen C
. Подход к кожным васкулитам с особым акцентом на васкулит мелких сосудов.
 Curr Opin Rheumatol 2017; 29: 39–44.doi: 10.1097/bor.0000000000000346
Curr Opin Rheumatol 2017; 29: 39–44.doi: 10.1097/bor.0000000000000346 - ↵
- ARORA A,
- Whiter DA,
- Gonzalez-Santiaga Tm, et al Al и Alt. 99949949949949949949949 9003 9003 9003 9003 9003. Заболеваемость лейкоцитокластическим васкулитом с 1996 по 2010 год: популяционное исследование в округе Олмстед, штат Миннесота. Mayo Clin Proc 2014;89:1515–24.doi:10.1016/j.mayocp.2014.04.015
- ↵
- Bonetto C,
- Trotta F,
- Felicetti P, et al
. Васкулит как нежелательное явление после иммунизации – систематический обзор литературы. Вакцина 2016; 34: 6641–51.doi: 10.1016/j.vaccine.2015.09.026
- ↵
- Felicetti P,
- Trotta F,
- .0033 . Спонтанные сообщения о васкулите как о нежелательном явлении после иммунизации: описательный анализ трех международных баз данных.
 Vaccine 2016;34:6634–40.doi:10.1016/j.vaccine.2015.09.027
Vaccine 2016;34:6634–40.doi:10.1016/j.vaccine.2015.09.027 - ↵
- Eid S,
- Callen JP
9 9.00009 Смешанная криоглобулинемия II типа после введения гриппозной и пневмококковой вакцины. JAAD Case Rep 2019;5:960–2.doi:10.1016/j.jdcr.2019.08.014
- ↵
- Hügle T,
- Bircher A,
- Walker UA
. Перезагрузка стрептококковой гиперчувствительности: тяжелый воспалительный синдром при болезни Бехчета после введения 23-валентной полисахаридной вакцины Streptococcus pneumoniae. Ревматология 2012; 51: 761–2.doi: 10.1093/ревматология/KER388
- ↵
- Saeidinejad M,
- Kardash S,
- Connel L
- . Болезнь Бехчета и тяжелая воспалительная реакция на 23-валентную пневмококковую полисахаридную вакцину: описание случая и обзор литературы. Scott Med J 2018: 119–21.
 doi: 10.1177/0036933018801215
doi: 10.1177/0036933018801215 - ↵
- Furer V,
- Rondaan C,
- HEIJSTEK MW, et Als
3
93. Обновление рекомендаций EULAR по вакцинации взрослых пациентов с аутоиммунными воспалительными ревматическими заболеваниями, 2019 г. Ann Rheum Dis 2020;79:39–52.doi:10.1136/annrheumdis-2019-215882
Сноски
Авторы рукописи AA и SS; SA пересмотрел и одобрил сценарий. Все авторы разделяли клиническое ведение этого пациента.
Финансирование Авторы не объявили о специальном гранте для этого исследования от какого-либо финансирующего агентства в государственном, коммерческом или некоммерческом секторах.
Конкурирующие интересы Не заявлено.
Согласие пациента на публикацию Получено.
Происхождение и рецензирование Не введен в эксплуатацию; рецензируется внешними экспертами.
Читать полный текст или скачать PDF:
Подписаться
Войдите под своим именем пользователя и паролем
Для личных счетов ИЛИ управляющих корпоративными счетами
Имя пользователя *
Пароль *
Забыли данные для входа? Зарегистрировать новую учетную запись?
Забыли имя пользователя или пароль?
Реакции, подобные сывороточной болезни, после пневмококковой вакцинации
Бин-Сюань Чунг, Вэй-Тин Лю, По-Вэй Чен
Опубликовано:
10 сентября 2021 г.
(см. историю)DOI:
10.7759/куреус.17877Цитируйте эту статью как:
Чанг Б., Лю В., Чен П. (10 сентября 2021 г.) Реакции, подобные сывороточной болезни, после пневмококковой вакцинации. Куреус 13(9): e17877. дои: 10.7759/cureus.17877Abstract
Сывороточная болезнь или реакции, подобные сывороточной болезни (SSLR), представляют собой редкое осложнение, которое проявляется у людей после вакцинации. В этом клиническом случае мы представляем пациента с типичными симптомами SSLR после пневмококковой вакцинации. Хронология этого заболевания и наш диагностический процесс подробно задокументированы. Также рассматривается литература, связанная с сывороточной болезнью и SSLR.
Введение
Пневмококковая вакцинация защищает от Streptococcus pneumoniae (S. pneumoniae) , который является наиболее распространенным патогеном, вызывающим внебольничную пневмонию на Тайване. Пневмококковая вакцинация очень распространена, поскольку она является частью календаря иммунизации детей, а также показана пожилым людям и взрослым с состояниями здоровья, которые подвергают их повышенному риску пневмококковой инфекции или ее осложнений.
 Сывороточная болезнь представляет собой иммунный ответ, вызванный реакцией гиперчувствительности III типа [1], которая связана с гетерологичным воздействием на сыворотку агентов, таких как вакцина против бешенства, противоядие и мышиные моноклональные антитела [2-4]. Реакции, подобные сывороточной болезни (SSLR), патофизиология которых до конца не изучена, представляют собой реакции на лекарства, инфекции и вакцины, которые вызывают симптомы, сходные с сывороточной болезнью. Вакцино-индуцированные SSLR встречаются редко, и сообщалось лишь о нескольких случаях вызванных пневмококковой вакциной SSLR [5,6]. В этом отчете мы представляем первый случай SSLR после пневмококковой вакцинации у иммунокомпетентного взрослого.
Сывороточная болезнь представляет собой иммунный ответ, вызванный реакцией гиперчувствительности III типа [1], которая связана с гетерологичным воздействием на сыворотку агентов, таких как вакцина против бешенства, противоядие и мышиные моноклональные антитела [2-4]. Реакции, подобные сывороточной болезни (SSLR), патофизиология которых до конца не изучена, представляют собой реакции на лекарства, инфекции и вакцины, которые вызывают симптомы, сходные с сывороточной болезнью. Вакцино-индуцированные SSLR встречаются редко, и сообщалось лишь о нескольких случаях вызванных пневмококковой вакциной SSLR [5,6]. В этом отчете мы представляем первый случай SSLR после пневмококковой вакцинации у иммунокомпетентного взрослого.Представление клинического случая
63-летний мужчина с диабетом II типа, гипертонией и дислипидемией поступил в наше отделение неотложной помощи с внезапно возникшей болью в левом паху в течение одного дня. Девятью днями ранее он впервые в жизни получил 13-валентную пневмококковую конъюгированную вакцину (Prevnar 13; Pfizer Inc.
 , Бруклин, Нью-Йорк). Через неделю на нижних конечностях появились двусторонние высыпания, которые на следующий день постепенно распространились на область туловища. На месте инъекции (середина левой дельтовидной мышцы) кожной сыпи обнаружено не было. В анамнезе у пациента не было аллергии на какие-либо продукты питания или лекарства. На девятый день у него появились боли в левом паху, которые мешали ему ходить. Таким образом, он был направлен в нашу больницу.
, Бруклин, Нью-Йорк). Через неделю на нижних конечностях появились двусторонние высыпания, которые на следующий день постепенно распространились на область туловища. На месте инъекции (середина левой дельтовидной мышцы) кожной сыпи обнаружено не было. В анамнезе у пациента не было аллергии на какие-либо продукты питания или лекарства. На девятый день у него появились боли в левом паху, которые мешали ему ходить. Таким образом, он был направлен в нашу больницу.При осмотре температура тела 38,2 °С, частота пульса 100 ударов в минуту, частота дыхания 15 вдохов в минуту, артериальное давление 126/53 мм рт.ст. Его левое бедро не выявило опухоли или локального жара; однако отмечалась боль при пассивных или активных движениях в левом тазобедренном суставе. Его спина была обширно покрыта эритематозными крапивницами (рис. 1 ), а двусторонние бедра были покрыты эритематозными пятнами (рис. 2 ). Ни одно из поражений кожи не было зудящим или болезненным. Лимфаденопатий не отмечено.

Фигура
1:
Сыпь на спине
На девятый день после вакцинации наблюдались широко распространенные эритематозные уртикарные бляшки географической формы с разбросанными светло-коричневыми пятнами. Некоторые высыпания имели кольцевидную или мишеневидную форму с плоским фиолетовым центром и приподнятой колесообразной каймой, особенно на нижней части спины
Фигура
2:
Сыпь на бедрах и ногах
A. На девятый день после вакцинации были отмечены высыпания на бедрах, состоящие из нескольких эритематозных пятен овальной формы в центре с несколькими пурпурными пятнами точечного размера. B. На 12-й день после вакцинации некоторые высыпания центробежно разрослись с кольцевидной конфигурацией и еще более пурпурными изменениями на двустороннем бедре и голени
Количество лейкоцитов (WBC) составляло 14,8 x 10 3 /мкл, включая 59% нейтрофилов, 5% моноцитов, 20% лимфоцитов и 15% атипичных лимфоцитов. Уровни электролитов, функции почек и печени были нормальными.
 Анализ мочи не выявил пиурии, бактериурии, гематурии, но была обнаружена легкая протеинурия (30 мг/дл). Его уровень С-реактивного белка составил 126,8 мг/л, уровень лактатдегидрогеназы – 232 ЕД/л, уровень ферритина – 862 нг/мл. Более того, его ревматоидный фактор, антитела к циклическому цитруллинированному пептиду, антиядерные антитела, антинейтрофильные цитоплазматические антитела, С3, С4, электрофорез сыворотки и иммунофиксация сыворотки были нормальными. Уровень IgG увеличился до 2740 мг/дл, но уровни IgA и IgM были нормальными.
Анализ мочи не выявил пиурии, бактериурии, гематурии, но была обнаружена легкая протеинурия (30 мг/дл). Его уровень С-реактивного белка составил 126,8 мг/л, уровень лактатдегидрогеназы – 232 ЕД/л, уровень ферритина – 862 нг/мл. Более того, его ревматоидный фактор, антитела к циклическому цитруллинированному пептиду, антиядерные антитела, антинейтрофильные цитоплазматические антитела, С3, С4, электрофорез сыворотки и иммунофиксация сыворотки были нормальными. Уровень IgG увеличился до 2740 мг/дл, но уровни IgA и IgM были нормальными.КТ брюшной полости с контрастным усилением выявило отложение жидкости вокруг левого бедра с усилением синовиального контраста. Также отмечено минимальное отложение жидкости в правом тазобедренном суставе (рис. 3 ). Ни гепатомегалии, ни спленомегалии не выявлено. Мы выполнили артроцентез в левом тазобедренном суставе из-за подозрения на артрит. Синовиальная жидкость, аспирированная из левого тазобедренного сустава, была желтого цвета, мутной, нормальной вязкости.
 Количество синовиальных лейкоцитов 47 681/мкл.0049 3 , в том числе 42% нейтрофилов, 37% макрофагов/моноцитов, 17% лимфоцитов и 4% атипичных лимфоцитов. Также были выполнены биопсии кожи на спине и бедрах.
Количество синовиальных лейкоцитов 47 681/мкл.0049 3 , в том числе 42% нейтрофилов, 37% макрофагов/моноцитов, 17% лимфоцитов и 4% атипичных лимфоцитов. Также были выполнены биопсии кожи на спине и бедрах.Фигура
3:
КТ-изображение артрита левого тазобедренного сустава
На девятый день после вакцинации наблюдался артрит левого тазобедренного сустава с накоплением жидкости и усилением синовиальной оболочки (стрелка); также можно было увидеть минимальное отложение жидкости в правом тазобедренном суставе (указатель стрелки)
КТ: компьютерная томография
Назначены эмпирические антибиотики, включая цефтриаксон и доксициклин. Однако у пациента развились усиливающиеся боли в суставах, в том числе в двустороннем плечевом, тазобедренном и коленном суставах, наряду с персистирующей лихорадкой на второй день госпитализации. УЗИ суставов выявило отложение жидкости во всех вышеперечисленных суставах. Был выполнен артроцентез левого коленного сустава, и результаты были аналогичны результатам аспирации синовиальной жидкости из левого тазобедренного сустава, но с более высоким числом лейкоцитов (106 795/мм 9 ).
 0049 3 , включая 56% нейтрофилов, 19% макрофагов/моноцитов и 25% лимфоцитов). На 3-й день госпитализации отмечалась высокая температура около 39°С и усиливающаяся боль в суставах. Были начаты нестероидные противовоспалительные препараты (НПВП) и стероиды, и лихорадка резко спала в тот же день. Боль в суставах и кожная сыпь также в значительной степени исчезли в последующие несколько дней. Хронология клинического течения пациента показана на рисунке 4 . Последующие культуральные исследования, в том числе бактериальные, вирусные, грибковые и туберкулезные тесты из крови и синовиальной жидкости, были отрицательными, как и ВИЧ и Neisseria gonorrhoeae Тесты на нуклеиновые кислоты. Патология кожи на бедрах и спине выявила поверхностный и глубокий, периваскулярный и периаднексальный нейтрофильный дерматит, которые были совместимы с SSLR. Имелись также признаки васкулита среднего размера (рис. 5 ).
0049 3 , включая 56% нейтрофилов, 19% макрофагов/моноцитов и 25% лимфоцитов). На 3-й день госпитализации отмечалась высокая температура около 39°С и усиливающаяся боль в суставах. Были начаты нестероидные противовоспалительные препараты (НПВП) и стероиды, и лихорадка резко спала в тот же день. Боль в суставах и кожная сыпь также в значительной степени исчезли в последующие несколько дней. Хронология клинического течения пациента показана на рисунке 4 . Последующие культуральные исследования, в том числе бактериальные, вирусные, грибковые и туберкулезные тесты из крови и синовиальной жидкости, были отрицательными, как и ВИЧ и Neisseria gonorrhoeae Тесты на нуклеиновые кислоты. Патология кожи на бедрах и спине выявила поверхностный и глубокий, периваскулярный и периаднексальный нейтрофильный дерматит, которые были совместимы с SSLR. Имелись также признаки васкулита среднего размера (рис. 5 ).На 10-й день госпитализации боль в суставах почти полностью утихла, а УЗИ суставов выявило лишь минимальное скопление жидкости.
 Пациент был выписан с низкими дозами пероральных НПВП и стероидов. При контрольном осмотре через месяц никаких последствий не отмечено.
Пациент был выписан с низкими дозами пероральных НПВП и стероидов. При контрольном осмотре через месяц никаких последствий не отмечено.Фигура
4:
Динамика SSLR у пациента
Дозировка цефтриаксона: 2 г/день; дозировка доксициклина: 200 мг/сутки; дозировка эторикоксиба: 90 мг/сут; дозировка стероида: метилпреднизолон 40 мг/день в течение 12-15 дней, преднизолон 20 мг/день в течение 16-23 дней, 10 мг/день после 24 дня до амбулаторного наблюдения через месяц
SSLRs: реакции, подобные сывороточной болезни ; НПВП: нестероидные противовоспалительные препараты
Фигура
5:
Образец биопсии кожи
Биопсия кожи, взятая из одной эритематозной или фиолетовой папулы на спине
A. При сканировании определяются поверхностные и глубокие периваскулярные и периаднексальные плотные воспалительно-клеточные инфильтраты. B. Плотный смешанный лимфоцитарно-нейтрофильный инфильтрат, окружающий эккринные железы, связанный с некрозом нескольких эпителиальных клеток секреторных клубков (200х).
 C. В кожно-подкожном переходе имеется умеренно плотный периваскулярный воспалительный инфильтрат с ядерной пылью и отложением фибрина в нескольких средних кровеносных сосудах (400x)
C. В кожно-подкожном переходе имеется умеренно плотный периваскулярный воспалительный инфильтрат с ядерной пылью и отложением фибрина в нескольких средних кровеносных сосудах (400x)Обсуждение
Наш пациент, 63-летний мужчина, поступил с артритом левого тазобедренного сустава, который прогрессировал до полиартрита в крупных суставах, включая двусторонние плечевые, тазобедренные и коленные суставы. Симптомы сочетались с кожной сыпью на ногах и туловище с обеих сторон и синдромом системной воспалительной реакции. Первоначальный дифференциальный диагноз: полиартикулярный септический артрит; аутоиммунные системные заболевания, такие как болезнь Стилла у взрослых, ревматоидный артрит и системная красная волчанка; и кристаллический артрит. Количество синовиальных лейкоцитов у него было высоким, особенно при второй аспирации в левом коленном суставе (106,79).5/мм 3 ), но концентрация нейтрофилов составляла всего 40-50%. Помимо бактериальной инфекции, мы также рассматривали вирусные, туберкулезные и грибковые инфекции.
 Однако полиартикулярный септический артрит редко возникает у иммунокомпетентных взрослых. Его уровень HbA1c был ниже 7, и он никогда не получал иммунодепрессантов. У него и его семьи не было врожденного иммунодефицита или оппортунистических инфекций. Симптомы как полиартрита, так и лихорадки не уменьшились после эмпирического введения антибиотиков, а последующие отчеты о культуре не выявили присутствия какого-либо патогена. Таким образом, диагноз полиартикулярного септического артрита был менее вероятен. У пациента не было аутоиммунных заболеваний в анамнезе, а аутоиммунные титры показали отрицательные результаты. Критерии Ямагучи для болезни Стилла у взрослых не были выполнены. Кристаллический артрит также был исключен после микроскопического исследования синовиальной жидкости. Дифференциальный диагноз кожной крапивницы с артритом включал аутоиммунную кожную сыпь, кожную сыпь, связанную с инфекцией, кожную сыпь, связанную с вакцинацией, или болезнь Стилла у взрослых. Поскольку последующие отчеты о биопсии кожи соответствовали SSLR, сывороточная болезнь или SSLR вызывали серьезные подозрения.
Однако полиартикулярный септический артрит редко возникает у иммунокомпетентных взрослых. Его уровень HbA1c был ниже 7, и он никогда не получал иммунодепрессантов. У него и его семьи не было врожденного иммунодефицита или оппортунистических инфекций. Симптомы как полиартрита, так и лихорадки не уменьшились после эмпирического введения антибиотиков, а последующие отчеты о культуре не выявили присутствия какого-либо патогена. Таким образом, диагноз полиартикулярного септического артрита был менее вероятен. У пациента не было аутоиммунных заболеваний в анамнезе, а аутоиммунные титры показали отрицательные результаты. Критерии Ямагучи для болезни Стилла у взрослых не были выполнены. Кристаллический артрит также был исключен после микроскопического исследования синовиальной жидкости. Дифференциальный диагноз кожной крапивницы с артритом включал аутоиммунную кожную сыпь, кожную сыпь, связанную с инфекцией, кожную сыпь, связанную с вакцинацией, или болезнь Стилла у взрослых. Поскольку последующие отчеты о биопсии кожи соответствовали SSLR, сывороточная болезнь или SSLR вызывали серьезные подозрения. Учитывая, что неделю назад он подвергался вакцинации в анамнезе, а уровни C3 и C4 были нормальными, в конце концов был поставлен диагноз пневмококковой вакцино-индуцированной SSLR.
Учитывая, что неделю назад он подвергался вакцинации в анамнезе, а уровни C3 и C4 были нормальными, в конце концов был поставлен диагноз пневмококковой вакцино-индуцированной SSLR.Диагностика сывороточной болезни или SSLR является сложной задачей, поскольку она основана на исключении, симптомах и временной зависимости между появлением симптомов и воздействием триггеров. Термин «сывороточная болезнь» был впервые описан фон Пирке и Шиком, которые проиллюстрировали побочные эффекты у пациентов, получавших лошадиную сыворотку для лечения дифтерии и скарлатины в 18 веке [7]. Сывороточная болезнь вызывает отложение иммунокомплексов в кровеносных сосудах и тканях, что активирует классический путь комплемента, а затем вызывает повреждение тканей. Уровни комплемента в сыворотке С3 и С4 обычно снижаются [1]. Типичными симптомами сывороточной болезни являются лихорадка, сыпь и боль в суставах. Симптомы обычно развиваются через одну-две недели после воздействия триггеров, но могут начаться и раньше, если такое воздействие не является первым в своем роде.
 Симптомы могут длиться от нескольких недель до месяцев, и пациенты обычно хорошо реагируют на антигистаминные препараты или НПВП. В тяжелых случаях может потребоваться введение стероидов. В редких и крайне тяжелых случаях для сокращения времени до выздоровления может быть использован плазмаферез. В некоторых случаях, когда триггеры нельзя отменить, плазмаферез может предотвратить сывороточную болезнь [8,9].]. Сывороточная болезнь, как правило, является доброкачественным заболеванием и обычно проходит самостоятельно.
Симптомы могут длиться от нескольких недель до месяцев, и пациенты обычно хорошо реагируют на антигистаминные препараты или НПВП. В тяжелых случаях может потребоваться введение стероидов. В редких и крайне тяжелых случаях для сокращения времени до выздоровления может быть использован плазмаферез. В некоторых случаях, когда триггеры нельзя отменить, плазмаферез может предотвратить сывороточную болезнь [8,9].]. Сывороточная болезнь, как правило, является доброкачественным заболеванием и обычно проходит самостоятельно.По сравнению с сывороточной болезнью, SSLR не образуют иммунных комплексов, и у пациентов наблюдаются нормальные уровни C3 и C4, поскольку система комплемента не активирована [10]. SSLR обычно развиваются после введения антибиотиков, таких как цефаклор, пенициллин, метронидазол, ципрофлоксацин и кларитромицин [11-15]. SSLR, вызванные вакциной, встречаются редко, но сообщалось о случаях, вызванных вакцинами против бешенства, гриппа и пневмококка [5, 6, 16, 17]. Однако SSLR, индуцированные пневмококковыми вакцинами, все еще относительно редки по сравнению с теми, которые индуцированы вакцинами против бешенства и гриппа, и большинство случаев SSLR, индуцированных вакцинами, обнаруживаются у детей.
 Протокол лечения SSLR такой же, как и при сывороточной болезни.
Протокол лечения SSLR такой же, как и при сывороточной болезни.На Тайване доступны два типа пневмококковых вакцин, а именно пневмококковая конъюгированная вакцина (PCV13 или Prevnar 13) и пневмококковая полисахаридная вакцина (PPSV23 или Pneumovax 23, Merck & Co., Inc., Кенилворт, Нью-Джерси). Prevnar 13, который использовался у нашего пациента, содержит капсульный полисахарид 13 серотипов S. pneumoniae , конъюгированный с нетоксичным мутантом дифтерийного токсина CRM 197 для усиления иммунных реакций. Общие побочные эффекты Prevnar 13 включают местные реакции, лихорадку, усталость, сыпь, мышечную боль и диарею. Большинство местных реакций и системных побочных эффектов имеют легкую или среднюю степень тяжести. В предыдущем исследовании сообщалось, что тяжелые нежелательные явления в течение одного месяца после инъекции вакцины были редкими (7%) и не были статистически значимыми по сравнению с группой плацебо [18]. В нашем обзоре литературы мы заметили, что вызванные пневмококковой вакциной SSLR в основном возникают у детей и только у одного ВИЧ-инфицированного взрослого [5,6].
 Таким образом, наш случай является первым, в котором задокументирован иммунокомпетентный взрослый с SSLR после вакцинации против пневмококка.
Таким образом, наш случай является первым, в котором задокументирован иммунокомпетентный взрослый с SSLR после вакцинации против пневмококка.Выводы
SSLR обычно развиваются через одну-две недели после первого воздействия триггеров. У пациентов с лихорадкой, кожной сыпью и артритом следует заподозрить наличие сывороточной болезни или SSLR, особенно если временная связь между появлением симптомов и воздействием триггеров постоянна. Хотя SSLR, индуцированные пневмококковой вакциной, встречаются очень редко, они все же могут развиваться у детей и иммунокомпетентных взрослых.
Ссылки
- Lawley TJ, Bielory L, Gascon P, Yancey KB, Young NS, Frank MM: Проспективный клинический и иммунологический анализ пациентов с сывороточной болезнью. N Engl J Med. 1984, 311:1407-13. 10.1056/NEJM198411293112204
- Behera TR, Satapathy DM, Pratap AK, Tripathy RM: Постконтактная профилактика бешенства с помощью ERIG и IDRV у детей. J Коммун Дис. 2011, 43:31-7.

- de Silva HA, Ryan NM, de Silva HJ: Побочные реакции на противоядие от змей, их профилактика и лечение. Бр Дж Клин Фармакол. 2016, 81:446-52. 10.1111/bcp.12739
- Karmacharya P, Poudel DR, Pathak R, et al.: Ритуксимаб-индуцированная сывороточная болезнь: систематический обзор. Семин Артрит Реум. 2015, 45:334-40. 10.1016/j.semarthrit.2015.06.014
- Hengge UR, Scharf RE, Kroon FP, Pfeffer K: Тяжелая сывороточная болезнь после пневмококковой вакцинации у больного СПИДом. Int J STD AIDS. 2006, 17:210-1. 10.1258/095646206775809123
- Wise RP, Iskander J, Pratt RD, Campbell S, Ball R, Pless RP, Braun MM: Послелицензионный надзор за безопасностью 7-валентной пневмококковой конъюгированной вакцины. ДЖАМА. 2004, 292:1702-10. 10.1001/jama.292.14.1702
- von Pirquet C, Schick B: Pediatrics AAo: сывороточная болезнь. Академия педиатрии. 1951, 2:1-5.
- Bayraktar F, Akinci B, Demirkan F, Yener S, Yesil S, Kirmaz C, Comlekci A: Реакции, подобные сывороточной болезни, связанные с аллергией на инсулин III типа в ответ на плазмаферез.
 Диабет Мед. 2009, 26:659-60. 10.1111/j.1464-5491.2009.02733.x
Диабет Мед. 2009, 26:659-60. 10.1111/j.1464-5491.2009.02733.x - Pham PT, Pham PM, Miller JM, Pham PC: Индуцированная поликлональными антителами сывороточная болезнь, проявляющаяся быстро прогрессирующим нисходящим параличом. Трансплантация. 2007, 83:1657. 10.1097/01.tp.0000266948.52547.d4
- Йерушалми Дж., Звулунов А., Халеви С. Реакции, подобные сывороточной болезни. Кутис. 2002, 69:395-7.
- Hebert AA, Sigman ES, Levy ML: Реакции, подобные сывороточной болезни, на цефаклор у детей. J Am Acad Дерматол. 1991, 25:805-8. 10.1016/s0190-9622(08)80973-5
- Паттерсон-Фортин Дж., Харрис С.М., Ниранджан-Азади А., Мелиа М.: Реакция, похожая на сывороточную болезнь, после лечения целлюлита амоксициллином/клавуланатом. BMJ Case Rep. 2016, 2016: bcr2016217608. 10.1136/bcr-2016-217608
- VanCleave HZ, Sanchez AC, Lieberman JA, Ellenburg JT, Mabry WA: Возможная реакция, похожая на сывороточную болезнь, вызванная метронидазолом, у педиатрического пациента. Дж.
 Клин Фарм Тер. 2016, 41:736-8. 10.1111/jcpt.12448
Клин Фарм Тер. 2016, 41:736-8. 10.1111/jcpt.12448 - Guharoy SR: Сывороточная болезнь, вторичная по отношению к применению ципрофлоксацина. Вет Хум Токсикол. 1994, 36:540-1.
- Сохаил М.А., Насир Дж., Икрам У., Дженезе Т. Реакция, похожая на сывороточную болезнь, на кларитромицин. Дж Хосп Мед. 2011, 6:231-2. 10.1002/jhm.884
- Warrington RJ, Martens CJ, Rubin M, Rutherford WJ, Aoki FY: Иммунологические исследования у субъектов с заболеванием, подобным сывороточной болезни, после иммунизации человеческой диплоидноклеточной вакциной против бешенства. J Аллергия Клин Иммунол. 1987, 79:605-10. 10.1016/s0091-6749(87)80156-2
- Bonds RS, Kelly BC: Тяжелая сывороточная болезнь после вакцинации против гриппа h2N1. Am J Med Sci. 2013, 345:412-3. 10.1097/MAJ.0b013e318273de7f
- Bonten MJ, Huijts SM, Bolkenbaas M и др.: Конъюгированная полисахаридная вакцина против пневмококковой пневмонии у взрослых. N Engl J Med. 2015, 372:1114-25. 10.1056/NEJMoa1408544
Реакции, подобные сывороточной болезни, после пневмококковой вакцинации
Информация об авторе
Бин-Сюан Чанг
Кафедра внутренних болезней, Госпиталь Национального университета Ченг Кунг, Медицинский колледж, Национальный университет Ченг Кунг, Тайнань, TWN
Вэй-Тин Лю
Кафедра дерматологии, Госпиталь Национального университета Ченг Кунг, Медицинский колледж, Национальный университет Ченг Кунг, Тайнань, TWN
По-Вэй Чен
Соответствующий автор
Кафедра внутренних болезней, Госпиталь Национального университета Ченг Кунг, Медицинский колледж, Национальный университет Ченг Кунг, Тайнань, TWN
Заявление об этике и раскрытие информации о конфликте интересов
Люди: Согласие было получено или от него отказались все участники этого исследования.
 Конфликты интересов: В соответствии с единообразной формой раскрытия информации ICMJE все авторы заявляют следующее: Информация об оплате/услугах: Этот отчет был профинансирован исследовательскими грантами от Национальной больницы университета Ченг Кунг в Тайнане, Тайвань (NCKUH-11003006 ) и Министерства науки и технологий (МОСТ 110-2314-В-006-091-). Финансовые отношения: Все авторы заявили, что у них нет финансовых отношений в настоящее время или в течение предыдущих трех лет с какими-либо организациями, которые могут быть заинтересованы в представленной работе. Другие отношения: Все авторы заявили об отсутствии других отношений или действий, которые могли бы повлиять на представленную работу.
Конфликты интересов: В соответствии с единообразной формой раскрытия информации ICMJE все авторы заявляют следующее: Информация об оплате/услугах: Этот отчет был профинансирован исследовательскими грантами от Национальной больницы университета Ченг Кунг в Тайнане, Тайвань (NCKUH-11003006 ) и Министерства науки и технологий (МОСТ 110-2314-В-006-091-). Финансовые отношения: Все авторы заявили, что у них нет финансовых отношений в настоящее время или в течение предыдущих трех лет с какими-либо организациями, которые могут быть заинтересованы в представленной работе. Другие отношения: Все авторы заявили об отсутствии других отношений или действий, которые могли бы повлиять на представленную работу.Благодарности
Эта рукопись была отредактирована издательством Wallace Academic Editing.
Информация о артикуле
ДОИ
10.7759/куреус.17877
Цитируйте эту статью как:
Чанг Б.
 , Лю В., Чен П. (10 сентября 2021 г.) Реакции, подобные сывороточной болезни, после пневмококковой вакцинации. Куреус 13(9): e17877. doi:10.7759/cureus.17877
, Лю В., Чен П. (10 сентября 2021 г.) Реакции, подобные сывороточной болезни, после пневмококковой вакцинации. Куреус 13(9): e17877. doi:10.7759/cureus.17877История публикаций
Начало экспертной оценки: 19 августа 2021 г.
Экспертная проверка завершена: 04 сентября 2021 г.
Опубликовано: 10 сентября 2021 г.Авторское право
© Copyright 2021
Chung et al. Это статья с открытым доступом, распространяемая в соответствии с лицензией Creative Commons Attribution License CC-BY 4.0., которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания оригинального автора и источника.Лицензия
Это статья с открытым доступом, распространяемая в соответствии с лицензией Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.

Реакции, подобные сывороточной болезни, после пневмококковой вакцинации
Фигуры и т. д.
Фигура
1:
Сыпь на спине
На девятый день после вакцинации наблюдались широко распространенные эритематозные уртикарные бляшки географической формы с разбросанными светло-коричневыми пятнами. Некоторые высыпания имели кольцевидную или мишеневидную форму с плоским фиолетовым центром и приподнятой колесообразной каймой, особенно на нижней части спины
Скачать полный размер
Фигура
2:
Сыпь на бедрах и ногах
A. На девятый день после вакцинации были отмечены высыпания на бедрах, состоящие из нескольких эритематозных пятен овальной формы в центре с несколькими пурпурными пятнами точечного размера. B. На 12-й день после вакцинации некоторые высыпания центробежно разрослись с кольцевидной конфигурацией и еще более пурпурными изменениями на билатеральном бедре и голени
Скачать полный размер
Фигура
3:
КТ-изображение артрита левого тазобедренного сустава
На девятый день после вакцинации наблюдался артрит левого тазобедренного сустава с накоплением жидкости и усилением синовиальной оболочки (стрелка); также можно было увидеть минимальное отложение жидкости в правом тазобедренном суставе (указатель стрелки)
КТ: компьютерная томография
Скачать полный размер
Фигура
4:
Динамика SSLR у пациента
Дозировка цефтриаксона: 2 г/день; дозировка доксициклина: 200 мг/сутки; дозировка эторикоксиба: 90 мг/сут; дозировка стероида: метилпреднизолон 40 мг/сут в течение 12-15 дней, преднизолон 20 мг/сут в течение 16-23 дней, 10 мг/сут после 24 дня до амбулаторного наблюдения через месяц
SSLRs: реакции, подобные сывороточной болезни; НПВП: нестероидные противовоспалительные препараты
Скачать полный размер
Фигура
5:
Образец биопсии кожи
Биоптат кожи, взятый из одной эритематозной или фиолетовой папулы на спине
A.


 org/0000-0002-5596-4726abuelmagd abdalla1,
org/0000-0002-5596-4726abuelmagd abdalla1,
 Curr Opin Rheumatol 2017; 29: 39–44.doi: 10.1097/bor.0000000000000346
Curr Opin Rheumatol 2017; 29: 39–44.doi: 10.1097/bor.0000000000000346  Vaccine 2016;34:6634–40.doi:10.1016/j.vaccine.2015.09.027
Vaccine 2016;34:6634–40.doi:10.1016/j.vaccine.2015.09.027  doi: 10.1177/0036933018801215
doi: 10.1177/0036933018801215 
 Сывороточная болезнь представляет собой иммунный ответ, вызванный реакцией гиперчувствительности III типа [1], которая связана с гетерологичным воздействием на сыворотку агентов, таких как вакцина против бешенства, противоядие и мышиные моноклональные антитела [2-4]. Реакции, подобные сывороточной болезни (SSLR), патофизиология которых до конца не изучена, представляют собой реакции на лекарства, инфекции и вакцины, которые вызывают симптомы, сходные с сывороточной болезнью. Вакцино-индуцированные SSLR встречаются редко, и сообщалось лишь о нескольких случаях вызванных пневмококковой вакциной SSLR [5,6]. В этом отчете мы представляем первый случай SSLR после пневмококковой вакцинации у иммунокомпетентного взрослого.
Сывороточная болезнь представляет собой иммунный ответ, вызванный реакцией гиперчувствительности III типа [1], которая связана с гетерологичным воздействием на сыворотку агентов, таких как вакцина против бешенства, противоядие и мышиные моноклональные антитела [2-4]. Реакции, подобные сывороточной болезни (SSLR), патофизиология которых до конца не изучена, представляют собой реакции на лекарства, инфекции и вакцины, которые вызывают симптомы, сходные с сывороточной болезнью. Вакцино-индуцированные SSLR встречаются редко, и сообщалось лишь о нескольких случаях вызванных пневмококковой вакциной SSLR [5,6]. В этом отчете мы представляем первый случай SSLR после пневмококковой вакцинации у иммунокомпетентного взрослого. , Бруклин, Нью-Йорк). Через неделю на нижних конечностях появились двусторонние высыпания, которые на следующий день постепенно распространились на область туловища. На месте инъекции (середина левой дельтовидной мышцы) кожной сыпи обнаружено не было. В анамнезе у пациента не было аллергии на какие-либо продукты питания или лекарства. На девятый день у него появились боли в левом паху, которые мешали ему ходить. Таким образом, он был направлен в нашу больницу.
, Бруклин, Нью-Йорк). Через неделю на нижних конечностях появились двусторонние высыпания, которые на следующий день постепенно распространились на область туловища. На месте инъекции (середина левой дельтовидной мышцы) кожной сыпи обнаружено не было. В анамнезе у пациента не было аллергии на какие-либо продукты питания или лекарства. На девятый день у него появились боли в левом паху, которые мешали ему ходить. Таким образом, он был направлен в нашу больницу.
 Анализ мочи не выявил пиурии, бактериурии, гематурии, но была обнаружена легкая протеинурия (30 мг/дл). Его уровень С-реактивного белка составил 126,8 мг/л, уровень лактатдегидрогеназы – 232 ЕД/л, уровень ферритина – 862 нг/мл. Более того, его ревматоидный фактор, антитела к циклическому цитруллинированному пептиду, антиядерные антитела, антинейтрофильные цитоплазматические антитела, С3, С4, электрофорез сыворотки и иммунофиксация сыворотки были нормальными. Уровень IgG увеличился до 2740 мг/дл, но уровни IgA и IgM были нормальными.
Анализ мочи не выявил пиурии, бактериурии, гематурии, но была обнаружена легкая протеинурия (30 мг/дл). Его уровень С-реактивного белка составил 126,8 мг/л, уровень лактатдегидрогеназы – 232 ЕД/л, уровень ферритина – 862 нг/мл. Более того, его ревматоидный фактор, антитела к циклическому цитруллинированному пептиду, антиядерные антитела, антинейтрофильные цитоплазматические антитела, С3, С4, электрофорез сыворотки и иммунофиксация сыворотки были нормальными. Уровень IgG увеличился до 2740 мг/дл, но уровни IgA и IgM были нормальными. Количество синовиальных лейкоцитов 47 681/мкл.0049 3 , в том числе 42% нейтрофилов, 37% макрофагов/моноцитов, 17% лимфоцитов и 4% атипичных лимфоцитов. Также были выполнены биопсии кожи на спине и бедрах.
Количество синовиальных лейкоцитов 47 681/мкл.0049 3 , в том числе 42% нейтрофилов, 37% макрофагов/моноцитов, 17% лимфоцитов и 4% атипичных лимфоцитов. Также были выполнены биопсии кожи на спине и бедрах. 0049 3 , включая 56% нейтрофилов, 19% макрофагов/моноцитов и 25% лимфоцитов). На 3-й день госпитализации отмечалась высокая температура около 39°С и усиливающаяся боль в суставах. Были начаты нестероидные противовоспалительные препараты (НПВП) и стероиды, и лихорадка резко спала в тот же день. Боль в суставах и кожная сыпь также в значительной степени исчезли в последующие несколько дней. Хронология клинического течения пациента показана на рисунке 4 . Последующие культуральные исследования, в том числе бактериальные, вирусные, грибковые и туберкулезные тесты из крови и синовиальной жидкости, были отрицательными, как и ВИЧ и Neisseria gonorrhoeae Тесты на нуклеиновые кислоты. Патология кожи на бедрах и спине выявила поверхностный и глубокий, периваскулярный и периаднексальный нейтрофильный дерматит, которые были совместимы с SSLR. Имелись также признаки васкулита среднего размера (рис. 5 ).
0049 3 , включая 56% нейтрофилов, 19% макрофагов/моноцитов и 25% лимфоцитов). На 3-й день госпитализации отмечалась высокая температура около 39°С и усиливающаяся боль в суставах. Были начаты нестероидные противовоспалительные препараты (НПВП) и стероиды, и лихорадка резко спала в тот же день. Боль в суставах и кожная сыпь также в значительной степени исчезли в последующие несколько дней. Хронология клинического течения пациента показана на рисунке 4 . Последующие культуральные исследования, в том числе бактериальные, вирусные, грибковые и туберкулезные тесты из крови и синовиальной жидкости, были отрицательными, как и ВИЧ и Neisseria gonorrhoeae Тесты на нуклеиновые кислоты. Патология кожи на бедрах и спине выявила поверхностный и глубокий, периваскулярный и периаднексальный нейтрофильный дерматит, которые были совместимы с SSLR. Имелись также признаки васкулита среднего размера (рис. 5 ). Пациент был выписан с низкими дозами пероральных НПВП и стероидов. При контрольном осмотре через месяц никаких последствий не отмечено.
Пациент был выписан с низкими дозами пероральных НПВП и стероидов. При контрольном осмотре через месяц никаких последствий не отмечено. C. В кожно-подкожном переходе имеется умеренно плотный периваскулярный воспалительный инфильтрат с ядерной пылью и отложением фибрина в нескольких средних кровеносных сосудах (400x)
C. В кожно-подкожном переходе имеется умеренно плотный периваскулярный воспалительный инфильтрат с ядерной пылью и отложением фибрина в нескольких средних кровеносных сосудах (400x)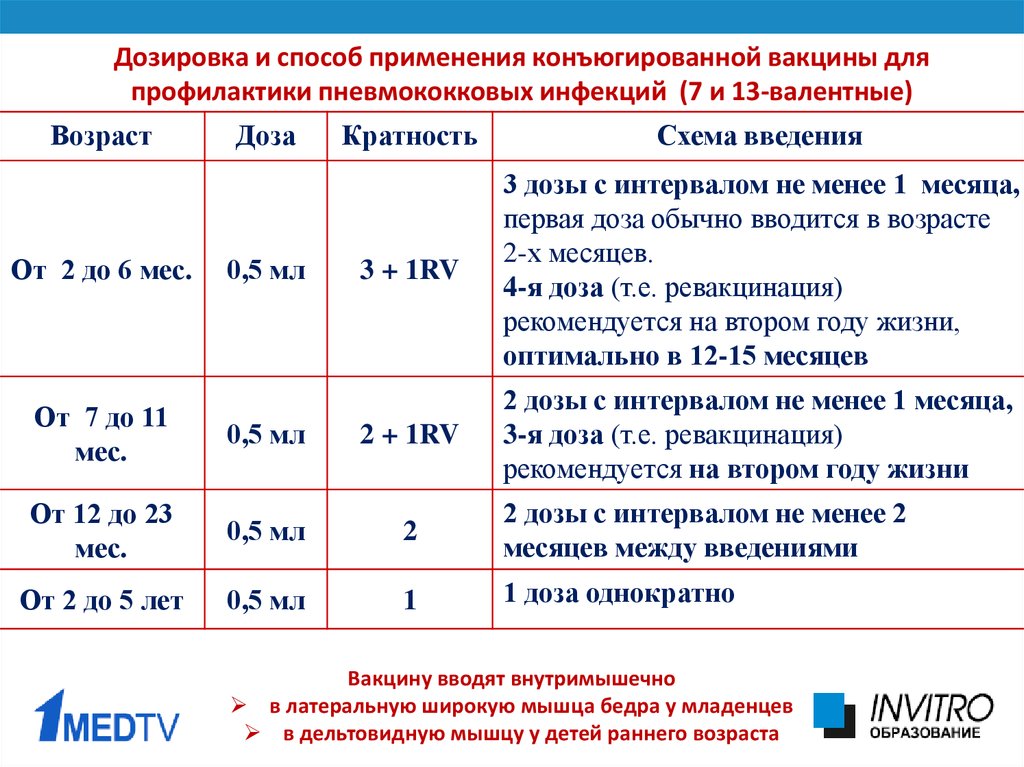 Однако полиартикулярный септический артрит редко возникает у иммунокомпетентных взрослых. Его уровень HbA1c был ниже 7, и он никогда не получал иммунодепрессантов. У него и его семьи не было врожденного иммунодефицита или оппортунистических инфекций. Симптомы как полиартрита, так и лихорадки не уменьшились после эмпирического введения антибиотиков, а последующие отчеты о культуре не выявили присутствия какого-либо патогена. Таким образом, диагноз полиартикулярного септического артрита был менее вероятен. У пациента не было аутоиммунных заболеваний в анамнезе, а аутоиммунные титры показали отрицательные результаты. Критерии Ямагучи для болезни Стилла у взрослых не были выполнены. Кристаллический артрит также был исключен после микроскопического исследования синовиальной жидкости. Дифференциальный диагноз кожной крапивницы с артритом включал аутоиммунную кожную сыпь, кожную сыпь, связанную с инфекцией, кожную сыпь, связанную с вакцинацией, или болезнь Стилла у взрослых. Поскольку последующие отчеты о биопсии кожи соответствовали SSLR, сывороточная болезнь или SSLR вызывали серьезные подозрения.
Однако полиартикулярный септический артрит редко возникает у иммунокомпетентных взрослых. Его уровень HbA1c был ниже 7, и он никогда не получал иммунодепрессантов. У него и его семьи не было врожденного иммунодефицита или оппортунистических инфекций. Симптомы как полиартрита, так и лихорадки не уменьшились после эмпирического введения антибиотиков, а последующие отчеты о культуре не выявили присутствия какого-либо патогена. Таким образом, диагноз полиартикулярного септического артрита был менее вероятен. У пациента не было аутоиммунных заболеваний в анамнезе, а аутоиммунные титры показали отрицательные результаты. Критерии Ямагучи для болезни Стилла у взрослых не были выполнены. Кристаллический артрит также был исключен после микроскопического исследования синовиальной жидкости. Дифференциальный диагноз кожной крапивницы с артритом включал аутоиммунную кожную сыпь, кожную сыпь, связанную с инфекцией, кожную сыпь, связанную с вакцинацией, или болезнь Стилла у взрослых. Поскольку последующие отчеты о биопсии кожи соответствовали SSLR, сывороточная болезнь или SSLR вызывали серьезные подозрения. Учитывая, что неделю назад он подвергался вакцинации в анамнезе, а уровни C3 и C4 были нормальными, в конце концов был поставлен диагноз пневмококковой вакцино-индуцированной SSLR.
Учитывая, что неделю назад он подвергался вакцинации в анамнезе, а уровни C3 и C4 были нормальными, в конце концов был поставлен диагноз пневмококковой вакцино-индуцированной SSLR.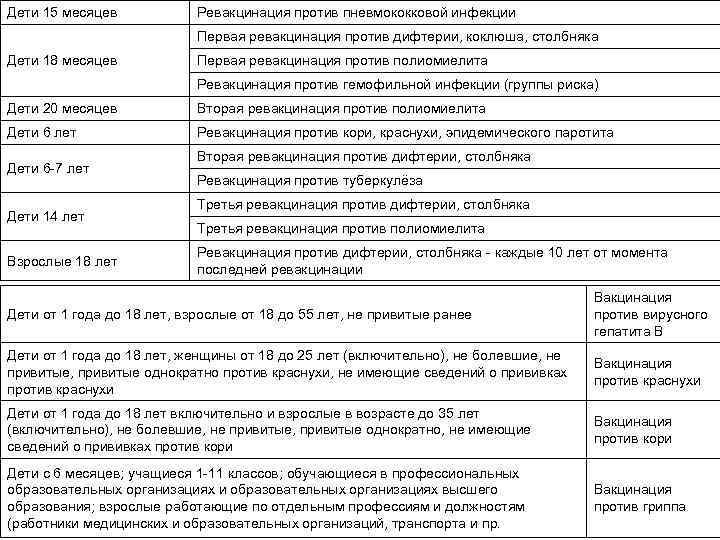 Симптомы могут длиться от нескольких недель до месяцев, и пациенты обычно хорошо реагируют на антигистаминные препараты или НПВП. В тяжелых случаях может потребоваться введение стероидов. В редких и крайне тяжелых случаях для сокращения времени до выздоровления может быть использован плазмаферез. В некоторых случаях, когда триггеры нельзя отменить, плазмаферез может предотвратить сывороточную болезнь [8,9].]. Сывороточная болезнь, как правило, является доброкачественным заболеванием и обычно проходит самостоятельно.
Симптомы могут длиться от нескольких недель до месяцев, и пациенты обычно хорошо реагируют на антигистаминные препараты или НПВП. В тяжелых случаях может потребоваться введение стероидов. В редких и крайне тяжелых случаях для сокращения времени до выздоровления может быть использован плазмаферез. В некоторых случаях, когда триггеры нельзя отменить, плазмаферез может предотвратить сывороточную болезнь [8,9].]. Сывороточная болезнь, как правило, является доброкачественным заболеванием и обычно проходит самостоятельно. Протокол лечения SSLR такой же, как и при сывороточной болезни.
Протокол лечения SSLR такой же, как и при сывороточной болезни. Таким образом, наш случай является первым, в котором задокументирован иммунокомпетентный взрослый с SSLR после вакцинации против пневмококка.
Таким образом, наш случай является первым, в котором задокументирован иммунокомпетентный взрослый с SSLR после вакцинации против пневмококка.
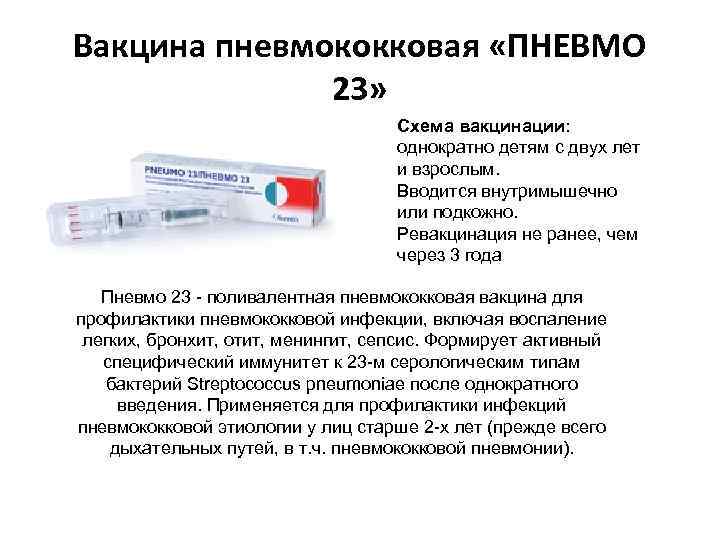 Диабет Мед. 2009, 26:659-60. 10.1111/j.1464-5491.2009.02733.x
Диабет Мед. 2009, 26:659-60. 10.1111/j.1464-5491.2009.02733.x Клин Фарм Тер. 2016, 41:736-8. 10.1111/jcpt.12448
Клин Фарм Тер. 2016, 41:736-8. 10.1111/jcpt.12448 Конфликты интересов: В соответствии с единообразной формой раскрытия информации ICMJE все авторы заявляют следующее: Информация об оплате/услугах: Этот отчет был профинансирован исследовательскими грантами от Национальной больницы университета Ченг Кунг в Тайнане, Тайвань (NCKUH-11003006 ) и Министерства науки и технологий (МОСТ 110-2314-В-006-091-). Финансовые отношения: Все авторы заявили, что у них нет финансовых отношений в настоящее время или в течение предыдущих трех лет с какими-либо организациями, которые могут быть заинтересованы в представленной работе. Другие отношения: Все авторы заявили об отсутствии других отношений или действий, которые могли бы повлиять на представленную работу.
Конфликты интересов: В соответствии с единообразной формой раскрытия информации ICMJE все авторы заявляют следующее: Информация об оплате/услугах: Этот отчет был профинансирован исследовательскими грантами от Национальной больницы университета Ченг Кунг в Тайнане, Тайвань (NCKUH-11003006 ) и Министерства науки и технологий (МОСТ 110-2314-В-006-091-). Финансовые отношения: Все авторы заявили, что у них нет финансовых отношений в настоящее время или в течение предыдущих трех лет с какими-либо организациями, которые могут быть заинтересованы в представленной работе. Другие отношения: Все авторы заявили об отсутствии других отношений или действий, которые могли бы повлиять на представленную работу. , Лю В., Чен П. (10 сентября 2021 г.) Реакции, подобные сывороточной болезни, после пневмококковой вакцинации. Куреус 13(9): e17877. doi:10.7759/cureus.17877
, Лю В., Чен П. (10 сентября 2021 г.) Реакции, подобные сывороточной болезни, после пневмококковой вакцинации. Куреус 13(9): e17877. doi:10.7759/cureus.17877
