Содержание
Прививки (вакцинация): мифы и реальность
Работа человеческого иммунитета сложна, а её сбои грозят тяжёлыми последствиями. Поэтому вокруг прививок возникает много мифов и заблуждений. Отделить факты от вымысла нам поможет врач-иммунолог из «Клиники Эксперт» Смоленск Ульяна Владимировна Чемова.
Работа человеческого иммунитета сложна, а её сбои грозят тяжёлыми последствиями. Поэтому вокруг прививок возникает много мифов и заблуждений. Отделить факты от вымысла нам поможет врач-иммунолог из «Клиники Эксперт» Смоленск Ульяна Владимировна Чемова.
— Ульяна Владимировна, расскажите, пожалуйста, о действии прививок.
— Это сложный процесс, но объяснить его в общих чертах вполне возможно. При попадании в организм обезвреженных (убитых или ослабленных) микроорганизмов лимфоциты активизируются. Для борьбы с антигеном вырабатываются иммуноглобулины. Вырабатываются и антитела и плазматические лимфоциты – клетки памяти. И если человеку придётся вновь столкнуться с теми же болезнетворными микроорганизмами, но уже не ослабленными, благодаря клеткам памяти иммунный ответ будет сильнее и быстрее. Скорее всего, человек не заболеет вовсе. Если же заболеет, болезнь будет протекать намного легче, риск осложнений у привитых людей ниже.
Скорее всего, человек не заболеет вовсе. Если же заболеет, болезнь будет протекать намного легче, риск осложнений у привитых людей ниже.
— Существует идея, что естественный иммунитет способен сопротивляться любым инфекциям, а прививки его ослабляют. Прививки действительно вредны для иммунитета?
— Есть два вида иммунитета: врождённый и адаптивный. Врождённый начинает действовать сразу при появлении ребёнка на свет. Он не обладает специфичностью: организм одинаково реагирует на все микроорганизмы, с которыми взаимодействует. Этот вид иммунитета заложен генетически, на него нельзя повлиять.
Последний случай оспы в Европе
зарегистрирован в 1978 году
Потом включается и адаптивный иммунитет. Он формируется в течение жизни и зависит от того, с какими микроорганизмами человеку приходится сталкиваться. Адаптивный иммунитет специфичен. Прививки не ослабляют, а тренируют его: контакт с обезвреженными микроорганизмами помогает сформировать иммунитет до непосредственной угрозы заболевания.
Ротавирусная инфекция протекает
у детей особенно тяжело,
приводит к обезвоживанию
Эпидемии прошлого, уносившие множество жизней – яркий пример того, что без тренировки с помощью прививок иммунитет далеко не всегда может справиться с угрозой. Теперь многие болезни забыты. Так, последний случай оспы в Европе зарегистрирован в 1978 году. На 99% сократилась заболеваемость паротитом, почти побеждены дифтерия, полиомиелит.
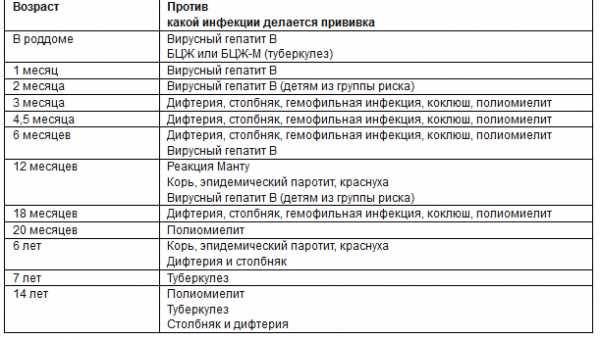
— Какие вакцины сейчас входят в национальный календарь прививок?
— До 2017 года в календарь входило 10 прививок. Это первичные прививки и ревакцинации от гепатита В, туберкулёза, пневмококковой инфекции, полиомиелита, комплексные вакцины АКДС (от коклюша, дифтерии и столбняка) и ККП (от кори, краснухи и эпидемического паротита). После 2017 года в национальный календарь добавили прививки от гемофильной и пневмококковой инфекции, вируса гриппа.
— На чём основаны даты в этом календаре?
— На заре эры прививок у учёных было мало данных, поэтому о составлении графика речи не шло. Но с развитием медицины получилось собрать данные о том, в какое время человек особенно уязвим для разных инфекций, когда происходит первый контакт с возбудителями болезней в естественной среде, как долго формируется иммунитет после той или иной прививки и как долго клетки сохраняют память о специфике антигена. Это позволило определить оптимальные сроки для вакцинации и ревакцинации и составить график.
Но с развитием медицины получилось собрать данные о том, в какое время человек особенно уязвим для разных инфекций, когда происходит первый контакт с возбудителями болезней в естественной среде, как долго формируется иммунитет после той или иной прививки и как долго клетки сохраняют память о специфике антигена. Это позволило определить оптимальные сроки для вакцинации и ревакцинации и составить график.
В 2011 году почти все штаты США не провели нужного числа вакцинаций от коклюша. В итоге на следующий год заболели 42 тысячи человек. Цитата из материала «Кто придумал прививки?»
— С какими последствиями можно столкнуться, если делать детям прививки не по графику?
— При отклонении от графика человек может оказаться беззащитен перед опасными болезнями именно в тот период, когда защита особенно необходима. Это повышает вероятность заболевания, грозит тяжёлым течением болезни и возникновением осложнений.
— Некоторые делают все прививки по графику, а помимо них ещё и ряд прививок, не включённых в график. Есть ли в этом смысл?
Есть ли в этом смысл?
— Обычно о дополнительных прививках задумываются ответственные, образованные родители, которые привыкли сами во всё вникать и анализировать информацию. Востребованы прививки от ротавируса, гепатита А, ветряной оспы. Безусловно, в этом есть смысл.
Как происходит заражение ротавирусной инфекцией? Узнать здесь
Ротавирусная инфекция протекает у детей особенно тяжело, приводит к обезвоживанию, нередко дело доходит до реанимации. Часто болеют дети в возрасте от года до пяти лет. Вакцина «Ротатек» применяется орально, вводится трёхкратно детям до года. Таким образом, к моменту контакта с вирусом в естественной среде ребёнок уже защищён.
Бельгийская вакцина «Хаврикс» и французская «Аваксим» позволяют защититься от вируса гепатита А. Гепатит А излечим, но может приводить к таким осложнениям, как холангит, печёночная недостаточность. Лучше защитить себя заранее.
— Расскажите, пожалуйста, про коллективный иммунитет?
— Коллективный (популяционный) иммунитет – это снижение вирусной нагрузки на популяцию в целом благодаря большому количеству переболевших (и выживших после болезни) или вакцинации. Формируется иммунная прослойка, вследствие чего люди, не обладающие специфическим иммунитетом к той или иной болезни, тоже не попадают в зону риска. Чтобы обезопасить общество от коклюша, иммунная прослойка должна составлять как минимум 80% от популяции. Для предотвращения гепатита В необходимо создать специфический иммунитет не менее чем у 90% населения.
Формируется иммунная прослойка, вследствие чего люди, не обладающие специфическим иммунитетом к той или иной болезни, тоже не попадают в зону риска. Чтобы обезопасить общество от коклюша, иммунная прослойка должна составлять как минимум 80% от популяции. Для предотвращения гепатита В необходимо создать специфический иммунитет не менее чем у 90% населения.
— Кому прививки действительно противопоказаны? На какую защиту могут надеяться эти люди?
— Есть люди с иммунодефицитом. Они не могут сформировать специфический ответ даже после вакцинации. Любые болезнетворные микроорганизмы, даже в ослабленных живых вакцинах, при иммунодефиците опасны. Контакт же с вирусами и бактериями в естественной среде для пациента с иммунодефицитом часто оказывается роковым. Причины иммунодефицита различны: врождённые нарушения, терапия при онкологических заболеваниях и трансплантации, ряд инфекционных и неинфекционных патологий.
Защитить этих людей можно. Чем выше коллективный иммунитет, тем ниже риск встретиться с болезнетворными микроорганизмами. Таким образом, человек, у которого нет противопоказаний, прививкой в первую очередь защищает себя, но также помогает выжить людям, не способным сформировать иммунный ответ.
Чем выше коллективный иммунитет, тем ниже риск встретиться с болезнетворными микроорганизмами. Таким образом, человек, у которого нет противопоказаний, прививкой в первую очередь защищает себя, но также помогает выжить людям, не способным сформировать иммунный ответ.
— Какие заблуждения по поводу прививок вы сами как врач встречали у пациентов?
— Есть две категории пациентов. В первую входят люди, отказывающиеся от прививок по религиозным, идеологическим и иным нерациональным мотивам. Их основной аргумент: «Это чужое, этого в организме быть не должно». Такие пациенты не думают о конкретном вреде или пользе. Переубедить их сложно.
Связи аутизма и расстройств
аутического спектра с прививками
обнаружить не удалось
Ко второй категории относятся люди, боящиеся того или иного вреда, прочитавшие что-то пугающее на антипрививочных сайтах. Если таким людям предоставить достоверную информацию, объяснить, как обстоят дела в действительности, они обычно отказываются от заблуждений.
— Среди мифов о прививках популярна версия о связи прививок и аутизма. Прокомментируйте, пожалуйста.
— Впервые о такой связи заговорил британский врач Эндрю Уэйкфилд в середине 90-х гг. ХХ века. Однако выяснилось, что достоверных исследований врач не проводил. Более того, у него был коммерческий интерес в том, чтобы общество опасалось действующих вакцин: он старался продвигать свой препарат.
Но, поскольку теорию уже выдвинули, стали проводить масштабные исследования. Какой-либо связи аутизма и расстройств аутического спектра с прививками обнаружить не удалось. Не подтвердилась и версия о роли тиомертиолятов (консервирующих средств для прививок) в возникновении подобных состояний.
К возможным осложнениям от прививок аутизм не относится.
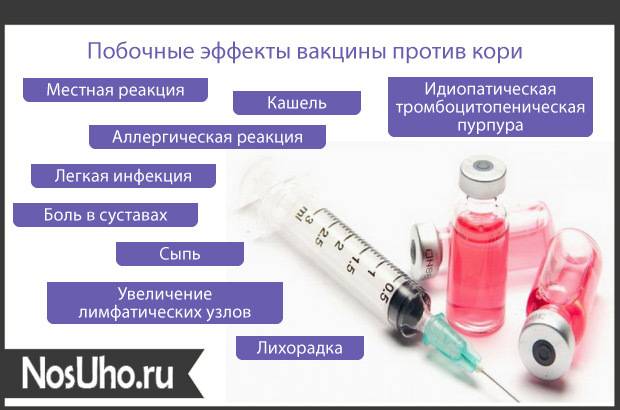
— Какие осложнения действительно могут вызвать прививки?
— В первую очередь стоит разграничить термин «осложнение» и «реакция». Реакция на прививку – нормальное явление. Пока формируется иммунный ответ, у пациента может наблюдаться изменение эмоционального фона (раздражительность и т. д.), временное ухудшение самочувствия, утомляемость, подъём температуры. При этом при нормальной реакции температура никогда не поднимается выше 40°. При прививках от кори и краснухи могут возникать высыпания. Реакция отличается от осложнений тем, что она кратковременна и не несёт угрозы жизни и здоровью.
Пока формируется иммунный ответ, у пациента может наблюдаться изменение эмоционального фона (раздражительность и т. д.), временное ухудшение самочувствия, утомляемость, подъём температуры. При этом при нормальной реакции температура никогда не поднимается выше 40°. При прививках от кори и краснухи могут возникать высыпания. Реакция отличается от осложнений тем, что она кратковременна и не несёт угрозы жизни и здоровью.
Пример подала сама императрица: начало прививочной кампании было положено 12 октября 1768 года. Цитата из материала «Екатерина Великая: организатор здравоохранения, педиатр и педагог»
Температура выше 40° считается осложнением, встречается редко. К осложнениям относится слишком выраженная местная реакция: гиперемия, папула более 10 сантиметров, судороги, высокая температура более 2 дней. Осложнение может стать следствием неправильной трактовки состояния ребенка перед прививкой (если вакцину вводят уже заболевшему ребенку в продромальном периоде).
Осложнения возникают в одном случае на нескольких сотен или тысяч прививок. Каждый случай подробно изучают, выясняют причины. Болезни у непривитых – гораздо более частое и опасное явление.
— Как правильно вести себя после прививки?
— В течение 40 минут следует оставаться рядом с процедурным кабинетом. В кабинете есть противошоковые средства, поэтому при возникновении анафилактического шока помощь будет оказана немедленно. В первый день не стоит мочить место укола, чтобы избежать инфицирования. Также не надо загорать, перегреваться, допускать иные перегрузки. Нельзя резко менять климат: такая нагрузка может оказаться для организма чрезмерной. Нужно следить, чтобы прививка не сочеталась с введением в рацион новых продуктов, приёмом не употреблявшихся ранее лекарств. Иначе при возникновении аллергической реакции невозможно будет понять, чем она вызвана.
После оральных вакцин на два часа следует отказаться от приёма пищи.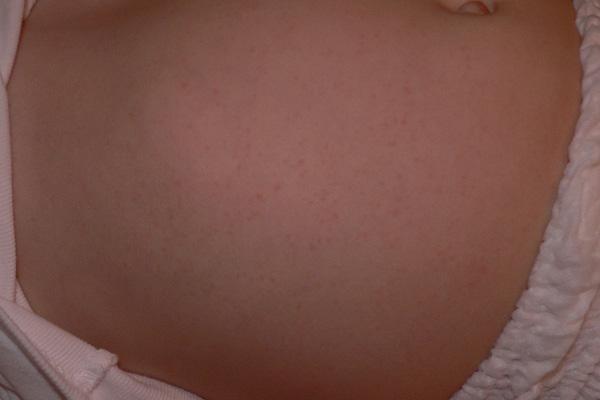
Желательно держать связь с лечащим врачом, сообщать о появлении тех или иных симптомов.
— Надо ли делать прививки взрослым?
— Надо. Вакцина АКДС требует ревакцинации каждые 7 – 9 лет. Если в детстве женщина пропустила прививку от краснухи, желательно сделать прививку до наступления репродуктивного периода (согласно клиническим рекомендациям, до 25 лет). Краснуха страшна не столько для взрослых людей, сколько для плода в период формирования. Вакцинацию от кори проводят до 35 лет, но лицам из группы риска до 55 лет. Существуют и другие показания (поездки в другие регионы и т. д.) о которых предупредит врач.
Беседовала Дарья Ушкова
Редакция рекомендует:
Иммунитет под контролем! Создаём крепкий тыл ребёнку
Детская ложь. Разбираемся с причинами
Непривитые дети – самые здоровые?
Для справки:
Чемова Ульяна Владимировна
В 2006 году окончила Смоленскую государственную медицинскую академию
В 2006-2007 годах прошла интернатуру по специальности «Педиатрия»
В 2013 – первичную переподготовку по специальности «Аллергология и иммунология»
С декабря 2016 года работает врачом-педиатром и аллергологом-иммунологом в ООО «Клиника Эксперт Смоленск»
Новые методы лечения с помощью вакцинотерапии почечно-клеточного рака
1. Wang X, Yu J, Sreekumar A, Varambally S, Shen R, Giacherio D, et al. Сигнатуры аутоантител при раке предстательной железы. N Engl J Med. 2005; 353:1224–35. [PubMed] [Google Scholar]
Wang X, Yu J, Sreekumar A, Varambally S, Shen R, Giacherio D, et al. Сигнатуры аутоантител при раке предстательной железы. N Engl J Med. 2005; 353:1224–35. [PubMed] [Google Scholar]
2. Chi N, Maranchie JK, Appleman LJ, Storkus WJ. Обновленная информация о разработке вакцины против почечно-клеточного рака. Дж Урол. 2010;2:125–41. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Coley WB. Лечение злокачественных опухолей повторными прививками рожистого воспаления: с отчетом о десяти оригинальных случаях. Am J Med Sci. 1893;5:487–511. [PubMed] [Google Scholar]
4. Schlom J. Терапевтические противораковые вакцины: Текущее состояние и движение вперед. J Natl Cancer Inst. 2012; 104: 599–613. [Статья бесплатно PMC] [PubMed] [Google Scholar]
5. Jäger D, Jäger E, Knuth A. Иммунные ответы на опухолевые антигены: значение для антигенспецифической иммунотерапии рака. Джей Клин Патол. 2001; 54: 669–74. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Шакалар С., Изги К., Канатан Х. Иммунотерапия рака и моноклональные антитела. Firat Health Sci J. 2013; 27:105–10. [Академия Google]
Шакалар С., Изги К., Канатан Х. Иммунотерапия рака и моноклональные антитела. Firat Health Sci J. 2013; 27:105–10. [Академия Google]
7. Оки Ю., Юнес А. Противораковые вакцины на основе белков теплового шока. Эксперт Rev Вакцины. 2004; 3: 403–11. [PubMed] [Google Scholar]
8. Гуида М., Колуччи Г. Иммунотерапия метастатического почечно-клеточного рака: это уже терапевтический вариант? Энн Онкол. 2007; 18 (Приложение 6): vi149–52. [PubMed] [Google Scholar]
9. Galligioni E, Quaia M, Merlo A, Carbone A, Spada A, Favaro D, et al. Адъювантная иммунотерапия пациентов с раком почки с аутологичными опухолевыми клетками и бациллой Кальметта-Герена: пятилетние результаты проспективного рандомизированного исследования. Рак. 1996;77:2560–6. [PubMed] [Google Scholar]
10. Jocham D, Richter A, Hoffmann L, Iwig K, Fahlenkamp D, Zakrzewski G, et al. Адъювантная аутологичная почечно-клеточная вакцина против опухоли и риск прогрессирования опухоли у пациентов с почечно-клеточной карциномой после радикальной нефрэктомии: Фаза III, рандомизированное контролируемое исследование. Ланцет. 2004; 363: 594–9. [PubMed] [Google Scholar]
Ланцет. 2004; 363: 594–9. [PubMed] [Google Scholar]
11. Doehn C, Richter A, Theodor RA, Jocham D. Адъювантная вакцинация Reniale продлевает выживаемость пациентов с ПКР после радикальной нефрэктомии: вторичный анализ многоцентрового исследования III фазы. Дж Урол. 2007;177:167С. Аннотация 500. [Google Scholar]
12. May M, Brookman-May S, Hoschke B, Gilfrich C, Kendel F, Baxmann S, et al. Анализ десятилетней выживаемости пациентов с карциномой почки, получавших аутологичную вакцину из лизата опухоли в адъювантных условиях. Рак Иммунол Иммунотер. 2010; 59: 687–95. [PubMed] [Google Scholar]
13. Kurth KH, Marquet R, Zwartendijk J, Warnaar SO. Аутологичный препарат противоракового антигена для специфической иммунотерапии при распространенном почечно-клеточном раке. Евр Урол. 1987; 13: 103–9. [PubMed] [Академия Google]
14. Schwaab T, Heaney JA, Schned AR, Harris RD, Cole BF, Noelle RJ, et al. Рандомизированное исследование фазы II, сравнивающее две различные комбинации последовательностей аутологичной вакцины и человеческого рекомбинантного интерферона гамма и человеческого рекомбинантного интерферона альфа2В у пациентов с метастатической почечно-клеточной карциномой: клинический результат и анализ иммунологических параметров. Дж Урол. 2000; 163:1322–7. [PubMed] [Google Scholar]
Дж Урол. 2000; 163:1322–7. [PubMed] [Google Scholar]
15. Dillman R, Barth N, Vandermolen L, Mahdavi K, Beutel L, de Leon C, et al. Вакцина, полученная из аутологичной линии опухолевых клеток, для индивидуального лечения распространенного почечно-клеточного рака. Рак Биотер Радиофарм. 2004;19: 570–80. [PubMed] [Google Scholar]
16. Dudek AZ, Mescher MF, Okazaki I, Math VT, Luo X, Curtsinger JM, et al. Аутологичная большая поливалентная иммуногенная вакцина у больных метастатической меланомой и почечно-клеточным раком. Am J Clin Oncol. 2008; 31: 173–81. [PubMed] [Google Scholar]
17. Yoshimura K, Uemura H. Роль вакцинотерапии почечно-клеточного рака в эпоху таргетной терапии. Int J Урол. 2013;20:744–55. [PubMed] [Google Scholar]
18. Obara W, Karashima T, Takeda K, Kato R, Kato Y, Kanehira M, et al. Эффективная индукция цитотоксических Т-клеток, распознающих эпитопный пептид, полученный из индуцируемого гипоксией белка 2 (HIG2), у пациентов с метастатической почечно-клеточной карциномой.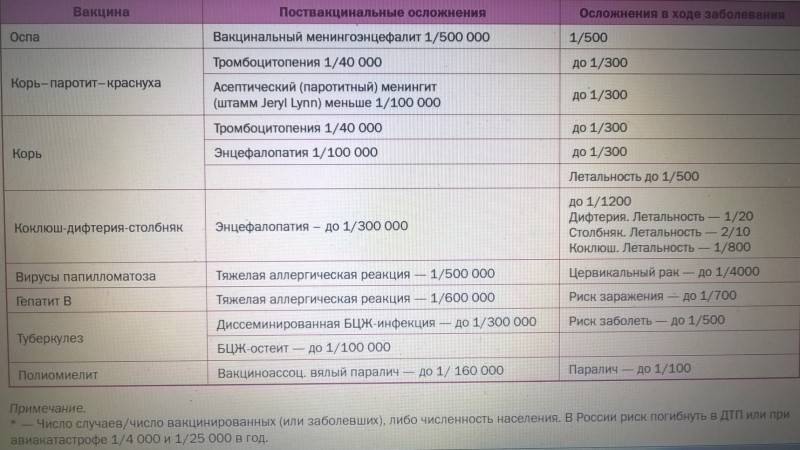 Рак Иммунол Иммунотер. 2017;66:17–24. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Рак Иммунол Иммунотер. 2017;66:17–24. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Simons JW, Jaffee EM, Weber CE, Levitsky HI, Nelson WG, Carducci MA, et al. Биоактивность аутологичных вакцин против облученной почечно-клеточной карциномы, полученных путем переноса гена ex vivo гранулоцитарно-макрофагального колониестимулирующего фактора. Рак рез. 1997; 57: 1537–46. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Antonia SJ, Seigne J, Diaz J, Muro-Cacho C, Extermann M, Farmelo MJ, et al. Испытание фазы I аутологичной вакцины опухолевых клеток с модифицированным геном B7-1 (CD80) в сочетании с системным интерлейкином-2 у пациентов с метастатической почечно-клеточной карциномой. Дж Урол. 2002;167:1995–2000. [PubMed] [Google Scholar]
21. Pizza G, De Vinci C, Lo Conte G, Mazzuca A, Di Maio V, Ratini S, et al. Аллогенные генно-модифицированные опухолевые клетки при метастатическом раке почки. Отчет II. Folia Biol (Прага) 2004; 50: 175–83. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
22. Fishman M, Hunter TB, Soliman H, Thompson P, Dunn M, Smilee R, et al. Испытание фазы II трансдуцированной культивируемой аутологичной опухолевой клеточной вакцины B7-1 (CD-86) плюс подкожный интерлейкин-2 для лечения почечно-клеточного рака стадии IV. J Иммунотер. 2008; 31:72–80. [PubMed] [Академия Google]
23. Oudard S, Rixe O, Beuselinck B, Linassier C, Banu E, Machiels JP, et al. Исследование фазы II противораковой вакцины TG4010 отдельно и в комбинации с цитокинами у пациентов с метастатической почечной светлоклеточной карциномой: клинические и иммунологические данные. Рак Иммунол Иммунотер. 2011;60:261–71. [PubMed] [Google Scholar]
24. Hillman GG, Reich LA, Rothstein SE, Abernathy LM, Fountain MD, Hankerd K, et al. Лучевая терапия и вакцина MVA-MUC1-IL-2 действуют синергически, вызывая специфический иммунитет к опухолевому антигену MUC-1. J Иммунный рак. 2017;5:4. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Buchner A, Pohla H, Baur A, Kopp J, Pezzutto A, Blankenstein T, et al. Аллогенная генетически модифицированная вакцина опухолевых клеток (RCC-26/CD80/IL-2) у пациентов с метастатической почечно-клеточной карциномой – исследование фазы I. Евр Урол Доп. 2007; 6:265. [PubMed] [Google Scholar]
Buchner A, Pohla H, Baur A, Kopp J, Pezzutto A, Blankenstein T, et al. Аллогенная генетически модифицированная вакцина опухолевых клеток (RCC-26/CD80/IL-2) у пациентов с метастатической почечно-клеточной карциномой – исследование фазы I. Евр Урол Доп. 2007; 6:265. [PubMed] [Google Scholar]
26. Berntsen A, Geertsen PF, Svane IM. Терапевтическая вакцинация дендритными клетками пациентов с почечно-клеточным раком. Евр Урол. 2006; 50:34–43. [PubMed] [Google Scholar]
27. Ван Поппель Х., Джониау С., Ван Гул С.В. Вакцинотерапия больных почечно-клеточным раком. Евр Урол. 2009 г.;55:1333–42. [PubMed] [Google Scholar]
28. Laurell A, Lönnemark M, Brekkan E, Magnusson A, Tolf A, Wallgren AC, et al. Внутриопухолевые инъекции провоспалительных аллогенных дендритных клеток в качестве усилителей иммунитета: первое исследование на людях у пациентов с неблагоприятным риском метастатической почечно-клеточной карциномы. J Иммунный рак. 2017;5:52. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Zhang XF, Weng DS, Pan K, Zhou ZQ, Pan QZ, Zhao JJ, et al. Иммунотерапия на основе дендритных клеток вызывает мощный противоопухолевый иммунный ответ в CD105+ стволовых клетках рака почки человека. Мол Карциног. 2017;56:2499–511. [PubMed] [Google Scholar]
Zhang XF, Weng DS, Pan K, Zhou ZQ, Pan QZ, Zhao JJ, et al. Иммунотерапия на основе дендритных клеток вызывает мощный противоопухолевый иммунный ответ в CD105+ стволовых клетках рака почки человека. Мол Карциног. 2017;56:2499–511. [PubMed] [Google Scholar]
30. Амин А., Дудек А.З., Логан Т.Ф., Лэнс Р.С., Хольцбайерляйн Дж.М., Нокс Дж.Дж. и соавт. Выживаемость с AGS-003, аутологичной иммунотерапией на основе дендритных клеток, в сочетании с сунитинибом у пациентов с неблагоприятным риском прогрессирующей почечно-клеточной карциномы (ПКР): результаты исследования фазы 2. J Иммунный рак. 2015;3:14. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Wei SM, Pan HL, Wang L, Yin GL, Zhong K, Zhou Y, et al. Комбинированная терапия вакциной на основе дендритных клеток и анти-CD69антитело усиливает противоопухолевую эффективность у мышей с почечно-клеточной карциномой. Терк J Med Sci. 2017; 47: 658–67. [PubMed] [Google Scholar]
32. Frankenberger B, Regn S, Geiger C, Noessner E, Falk CS, Pohla H, et al.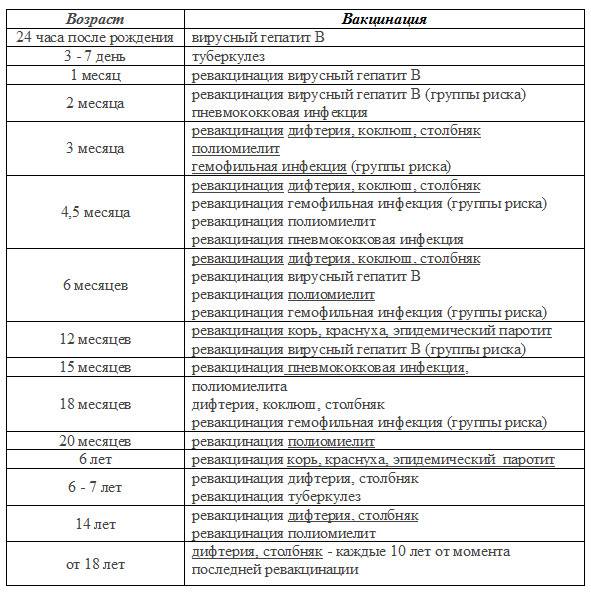 Клеточные вакцины против почечно-клеточного рака: генно-инженерные опухолевые клетки и дендритные клетки, полученные из моноцитов. Мир Дж. Урол. 2005; 23: 166–74. [PubMed] [Google Scholar]
Клеточные вакцины против почечно-клеточного рака: генно-инженерные опухолевые клетки и дендритные клетки, полученные из моноцитов. Мир Дж. Урол. 2005; 23: 166–74. [PubMed] [Google Scholar]
33. Gouttefangeas C, Stenzl A, Stevanović S, Rammensee HG. Иммунотерапия почечно-клеточного рака. Рак Иммунол Иммунотер. 2007; 56: 117–28. [PubMed] [Академия Google]
34. Уэмура Х., Фудзимото К., Танака М., Йошикава М., Хирао Ю., Уэдзима С. и др. Фаза I испытания вакцинации пептидами, производными CA9, для HLA-A24-положительных пациентов с цитокин-резистентной метастатической почечно-клеточной карциномой. Клин Рак Рез. 2006; 12:1768–75. [PubMed] [Google Scholar]
35. Bleumer I, Tiemessen DM, Oosterwijk-Wakka JC, Völler MC, De Weijer K, Mulders PF, et al. Предварительный анализ пациентов с прогрессирующей почечно-клеточной карциномой, вакцинированных зрелыми дендритными клетками с активированным пептидом СА9. J Иммунотер. 2007; 30:116–22. [PubMed] [Академия Google]
36. Iiyama T, Udaka K, Takeda S, Takeuchi T, Adachi YC, Ohtsuki Y, et al. Иммунотерапия пептидом WT1 (опухоль Вильмса 1) при почечно-клеточном раке. Микробиол Иммунол. 2007; 51: 519–30. [PubMed] [Google Scholar]
Iiyama T, Udaka K, Takeda S, Takeuchi T, Adachi YC, Ohtsuki Y, et al. Иммунотерапия пептидом WT1 (опухоль Вильмса 1) при почечно-клеточном раке. Микробиол Иммунол. 2007; 51: 519–30. [PubMed] [Google Scholar]
37. Patel PM, Sim S, O’Donnell DO, Protheroe A, Beirne D, Stanley A, et al. Оценка препарата Mycobacterium vaccae (SRL172) в качестве иммунотерапевтического средства при раке почки. Евр Джей Рак. 2008; 44: 216–23. [PubMed] [Google Scholar]
38. Rahma OE, Ashtar E, Ibrahim R, Toubaji A, Gause B, Herrin VE, et al. Пилотное клиническое испытание мутантного пептида фон Гиппель-Линдау в качестве нового иммунотерапевтического средства при метастатическом почечно-клеточном раке. J Transl Med. 2010;8:8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Ким Д.В., Кришнамурти В., Бинес С.Д., Кауфман Х.Л. TroVax, рекомбинантный модифицированный вирус осповакцины анкара, кодирующий 5T4: извлеченные уроки и будущее развитие. Гум Вакцина. 2010; 6: 784–91. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
40. Amato RJ, Hawkins RE, Kaufman HL, Thompson JA, Tomczak P, Szczylik C, et al. Вакцинация пациентов с метастатическим раком почки вакциной MVA-5T4: рандомизированное двойное слепое плацебо-контролируемое исследование фазы III. Клин Рак Рез. 2010;16:5539–47. [PubMed] [Академия Google]
41. Walter S, Weinschenk T, Stenzl A, Zdrojowy R, Pluzanska A, Szczylik C, et al. Полипептидный иммунный ответ на противораковую вакцину IMA901 после однократного введения циклофосфана ассоциируется с более длительной выживаемостью пациентов. Нат Мед. 2012;18:1254–61. [PubMed] [Google Scholar]
42. Rini BI, Stenzl A, Zdrojowy R, Kogan M, Shkolnik M, Oudard S, et al. IMA901, полипептидная противораковая вакцина плюс сунитиниб по сравнению с монотерапией сунитинибом в качестве терапии первой линии при прогрессирующем или метастатическом почечно-клеточном раке (IMPRINT): многоцентровое открытое рандомизированное контролируемое исследование фазы 3. Ланцет Онкол. 2016;17:1599–611. [PubMed] [Google Scholar]
Ланцет Онкол. 2016;17:1599–611. [PubMed] [Google Scholar]
43. Кирнер А., Майер-Моклер А., Рейнхардт С. IMA901: мультипептидная противораковая вакцина для лечения почечно-клеточного рака. Hum Вакцина Иммунотер. 2014;10:3179–89. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Wood C, Srivastava P, Bukowski R, Lacombe L, Gorelov AI, Gorelov S, et al. Адъювантная аутологическая терапевтическая вакцина (HSPPC-96; витеспен) в сравнении с наблюдением только у пациентов с высоким риском рецидива после нефрэктомии почечно-клеточного рака: многоцентровое открытое рандомизированное исследование фазы III. Ланцет. 2008; 372: 145–54. [PubMed] [Академия Google]
Вакцина против рака почки проявляет активность
Анна Азволински
пролонгированная общая выживаемость.
Первые пациенты с почечно-клеточным раком (ПКР) получали терапевтическую вакцину против ПКР на ранних стадиях клинических испытаний. Результаты испытаний опубликованы в Nature Medicine и продемонстрировали, что пациенты с ПКР, у которых наблюдается измеримый иммунный ответ на вакцину IMA901, имеют пролонгированную общую выживаемость.
Результаты испытаний опубликованы в Nature Medicine и продемонстрировали, что пациенты с ПКР, у которых наблюдается измеримый иммунный ответ на вакцину IMA901, имеют пролонгированную общую выживаемость.
«Эти исследования показывают, что пациенты достигают большего клинического эффекта, если они способны вызывать иммунный ответ на несколько пептидов в вакцине IMA901. Это подтверждает гипотезу о том, что широкая атака иммунной системы на несколько целей одновременно полезна», — сказал Харприт Сингх-Джасуджа, доктор медицинских наук, в переписке по электронной почте. Доктор Сингх-Джасуджа является одним из соавторов исследования и главным научным сотрудником Immatics Biotechnologies в Германии.
«Результаты исследования фазы I, безусловно, интригуют и подтверждают общую концепцию о том, что вакцинация против ПКР может быть осуществима», — сказал д-р Говард Л. Кауфман, директор Онкологического центра Университета Раш и профессор хирургии, иммунологии и микробиология.
В настоящее время проводится основное исследование фазы III, чтобы проверить, может ли IMA901 увеличить общую выживаемость среди пациентов с распространенным ПКР при добавлении к терапии первой линии сунитинибом (Сутент), широко используемым для лечения метастатического ПКР. Международное рандомизированное исследование планируется завершить к 2014 г.
IMA901 был разработан компанией Immatics Biotechnologies. Компания, базирующаяся в Тбингене, Германия, занимается разработкой терапевтических вакцин против рака. IMA901 — это самая передовая вакцина в разработке компании, которая включает в себя вакцины от колоректального рака, глиомы, рака желудка и немелкоклеточного рака легких, все из которых находятся на более ранних стадиях клинической разработки. Результаты фазы I/II испытаний вакцины, состоящей из 13 антигенов, обнаруженных в колоректальных опухолях, были представлены на собрании Американского общества клинической онкологии в июне этого года и продемонстрировали клиническую пользу.
IMA901, по данным Immatics, состоит из 10 ассоциированных с опухолью пептидов, присутствующих на опухолевых клетках пациентов с ПКР. Каждый пептид был выделен с использованием образцов тканей пациентов и подтвержден в клинических исследованиях как индуцирующий Т-клеточный ответ. Все пациенты также экспрессируют человеческий лейкоцитарный антиген на своих раковых клетках.
Результаты клинических испытаний
В исследование фазы I было включено 28 пациентов, ранее не получавших лечения и ранее получавших лечение. Пациенты получили последовательную IMA901 прививки дополнительно к иммуномодулятору, гранулоцитарно-макрофагальному колониестимулирующему фактору. У одного пациента был частичный ответ через 3 месяца наблюдения, а у 11 пациентов заболевание стабилизировалось. По словам Сингха-Джасуджи, ответы Т-клеток были связаны с лучшим контролем заболевания и более низким уровнем регуляторных Т-клеток. Те пациенты, у которых был иммуногенный ответ на несколько опухолеассоциированных пептидов, с большей вероятностью имели либо частичный ответ, либо стабилизацию заболевания по сравнению с пациентами, которые реагировали только на один антиген в вакцине. Считается, что регуляторные Т-клетки противодействуют противоопухолевому ответу противораковых вакцин.
Считается, что регуляторные Т-клетки противодействуют противоопухолевому ответу противораковых вакцин.
В исследование фазы II было включено 68 пациентов, рандомизированных один к одному либо в группу вакцины плюс циклофосфамид (иммуностимулятор), либо в группу только вакцины. Пациенты в группе циклофосфамида получали однократную инъекцию циклофосфамида перед первой инъекцией вакцины.
Вакцина, как правило, хорошо переносилась с местными кожными реакциями в обеих фазах испытаний I и II. Серьезных проблем с безопасностью в ходе первой фазы испытаний не было зарегистрировано. Два нежелательных явления в испытании фазы II включали системную аллергическую реакцию на 12-ю последовательную вакцинацию, вероятно, вызванную CM-CSF, согласно авторам, и еще одного пациента с локализованной аллергической реакцией 3-й степени после 11-й вакцинации. Второй пациент получил дополнительные прививки без каких-либо признаков аллергической реакции.
Один полный ответ и два частичных ответа наблюдались в исследовании фазы II. Уровень контроля заболевания составил 31%. Как и в фазе I, иммунный ответ в фазе II исследования составил 64%. Исследователи обнаружили, что время выживания было увеличено среди пациентов, которые ответили на множественные пептиды, ассоциированные с опухолью. Было обнаружено, что циклофосфамид продлевает выживаемость у пациентов с измеримым иммунным ответом на вакцину. Авторы связывают это влияние с ролью циклофосфамида в уменьшении регуляторных Т-клеток.
Уровень контроля заболевания составил 31%. Как и в фазе I, иммунный ответ в фазе II исследования составил 64%. Исследователи обнаружили, что время выживания было увеличено среди пациентов, которые ответили на множественные пептиды, ассоциированные с опухолью. Было обнаружено, что циклофосфамид продлевает выживаемость у пациентов с измеримым иммунным ответом на вакцину. Авторы связывают это влияние с ролью циклофосфамида в уменьшении регуляторных Т-клеток.
Однако Кауфман отметил, что ранее было показано, что циклофосфамид уменьшает Т-регуляторные клетки, и поскольку это не контролируемое исследование, нельзя исключать прямой противоопухолевый эффект циклофосфамида.
«Авторы сообщили о сильной корреляции между иммунным ответом на вакцину и выживаемостью, и это открытие поддерживает дальнейшее развитие концепции», — добавил Кауфман, добавив, что данные следует интерпретировать с осторожностью, поскольку исследование проводилось в конце больных ПКР в стадии.
На основе анализа более 300 потенциальных биомаркеров исследование также выявило два потенциальных исхода сывороточных биомаркеров, аполипопротеин A-1 (APOA1) и хемокиновый лиганд 17 (CCL17), которые могут предсказать, какие пациенты могут достичь как иммунного, так и клинического ответа, и таким образом, по мнению авторов, общее преимущество в выживаемости. Следует отметить, что все анализы биомаркеров проводились ретроспективно. Более низкие уровни APOA1 обнаруживаются при различных видах рака и связаны с окислительным стрессом. Продолжающееся испытание фазы III «направлено на подтверждение того, что эти два биомаркера позволяют прогнозировать улучшение общей выживаемости», — сказал Сингх-Джасуджа.
Следует отметить, что все анализы биомаркеров проводились ретроспективно. Более низкие уровни APOA1 обнаруживаются при различных видах рака и связаны с окислительным стрессом. Продолжающееся испытание фазы III «направлено на подтверждение того, что эти два биомаркера позволяют прогнозировать улучшение общей выживаемости», — сказал Сингх-Джасуджа.
Авторы также предполагают, что супрессорные клетки миелоидного происхождения, а также Т-регуляторные клетки могут играть роль в исходах ПКР. Этот эффект будет изучен в ходе продолжающегося исследования фазы III сунитиниба-ингибитора тирозинкиназы, который сам по себе снижает количество Т-регуляторных клеток, а также клеток-супрессоров миелоидного происхождения, что документировано у пациентов.
Вакцинный подход к лечению рака
«На наш взгляд, одной из основных проблем в области разработки противораковой вакцины является то, что ранее использовались антигены в недостаточном количестве и, возможно, также недостаточного качества», — пояснил Сингх-Джасуджа. «Мы считаем, что это также является причиной того, что так мало исследований показали убедительную связь обнаруженного иммунного ответа с вакциной и клинической пользой».
«Мы считаем, что это также является причиной того, что так мало исследований показали убедительную связь обнаруженного иммунного ответа с вакциной и клинической пользой».
IMA901 объединяет 10 антигенов в одной вакцине по сравнению с другими вакцинами, которые в настоящее время находятся на поздней стадии разработки и состоят из одного антигена. По словам Сингха-Джасуджи, это позволяет провести широкую атаку иммунной системы. Разработка вакцин против ПКР была затруднена, поскольку не были идентифицированы четко определенные антигены.
Иммунотерапия в последнее время рассматривается как один из наиболее многообещающих подходов к лечению рака, поскольку она может увеличить продолжительность жизни без возможности развития резистентности, характерной для таргетных агентов. Ипилимумаб (Yervoy) был одобрен в 2011 году для лечения метастатической меланомы, демонстрируя общее улучшение выживаемости, сипулеуцел-Т (Provenge) для лечения рака предстательной железы теперь доступен для пациентов, а иммунотерапия нового поколения, анти-PD1, в настоящее время проходит фазу II испытаний для лечения рака предстательной железы.