Содержание
Наиболее часто задаваемые вопросы по иммунизации против полиомиелита
Наиболее часто задаваемые вопросы по иммунизации против полиомиелита
Вопросы и ответы
25-04-2018
Наиболее часто задаваемые вопросы по иммунизации против полиомиелита
1. Вопрос: В Интернете очень много противоречивой информации о вреде и пользе прививок, в которой очень сложно разобраться неспециалисту. Какими распорядительными или нормативными документами определены мероприятия по профилактике полиомиелита?
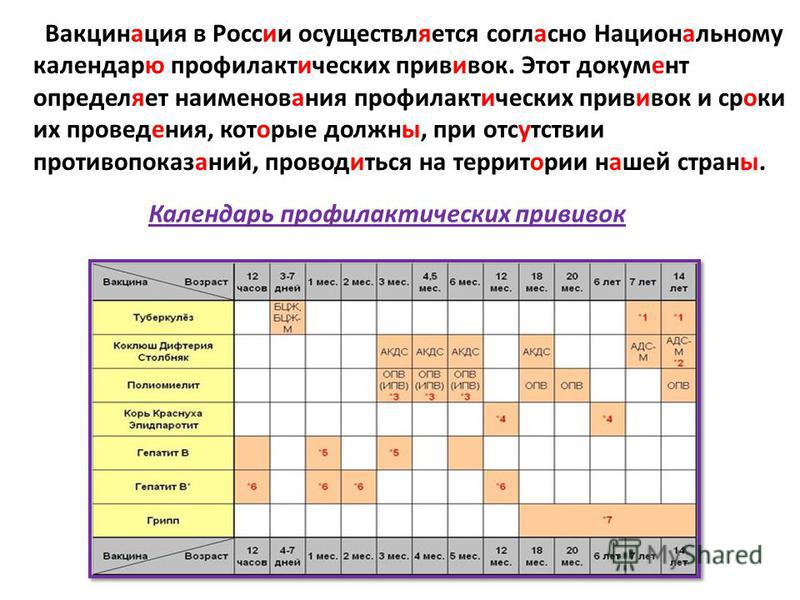
Ответ: по профилактике полиомиелита на сегодняшний день действуют 2 основных документа: Национальный календарь профилактических прививок и прививок по эпидемическим показаниям утвержденный Приказом МЗ РФ №125н от 21.03.2014года и Санитарно-эпидемиологические правила «Профилактика полиомиелита» СП 3. 1.2951-11. Каждая страна использует свой национальный календарь профилактических прививок, который принимается Министерством здравоохранения. Составляется таблица обязательных прививок. В России с 2002 года введен и действует национальный календарь профилактических прививок, который периодически дополняется и изменяется. На сегодняшний день действует Национальный календарь профилактических прививок и прививок по эпидемическим показаниям утвержденный Приказом МЗ РФ №125н от 21.03.2014года.
1.2951-11. Каждая страна использует свой национальный календарь профилактических прививок, который принимается Министерством здравоохранения. Составляется таблица обязательных прививок. В России с 2002 года введен и действует национальный календарь профилактических прививок, который периодически дополняется и изменяется. На сегодняшний день действует Национальный календарь профилактических прививок и прививок по эпидемическим показаниям утвержденный Приказом МЗ РФ №125н от 21.03.2014года.
Календарь профилактических прививок указывает на то, когда должна быть проведена та или иная вакцинация, ревакцинация по плану, сроки прививок. Существуют некоторые особенности внесения вакцин в календари, установления срока и схемы каждой отдельной прививки, к ним относят: степень заболеваемости, насколько тяжелое заболевание, риски распространения, возрастной показатель по формированию иммунитета, имеются ли противопоказания к прививкам, ряд побочных действий, влияние антител от матери, риск развития осложнений, наличие вакцин т. е. учитываются все возможные риски.
е. учитываются все возможные риски.
Российским национальным календарем профилактических прививок предусмотрено обязательное проведение иммунизации против 11 очень грозных заболеваний: вирусный гепатит В, туберкулез, дифтерия, столбняк, коклюш, полиомиелит, корь, краснуха, эпидемический паротит, грипп, пневмококковая инфекция. Национальные календари разных стран отличаются друг от друга, например, в нашей стране иммунизация против туберкулеза обязательна, так как очень высокий уровень заболеваемости в стране, а в развитых странах где низкий уровень заболеваемости в том числе и в США календарем не предусмотрена вакцинация против туберкулеза. В нашей стране не проводится иммунизация против гемофильной инфекции потому как вакцина не производится в нашей стране, а в США она включена в национальный календарь, в развитых странах иммунизация против полиомиелита проводится инактивированной вакциной, а в нашей стране используется комбинированная схема иммунизации (V1; V2 проводится вакциной ИПВ, RV1, RV2 и RV3 живой полиомиелитной вакциной).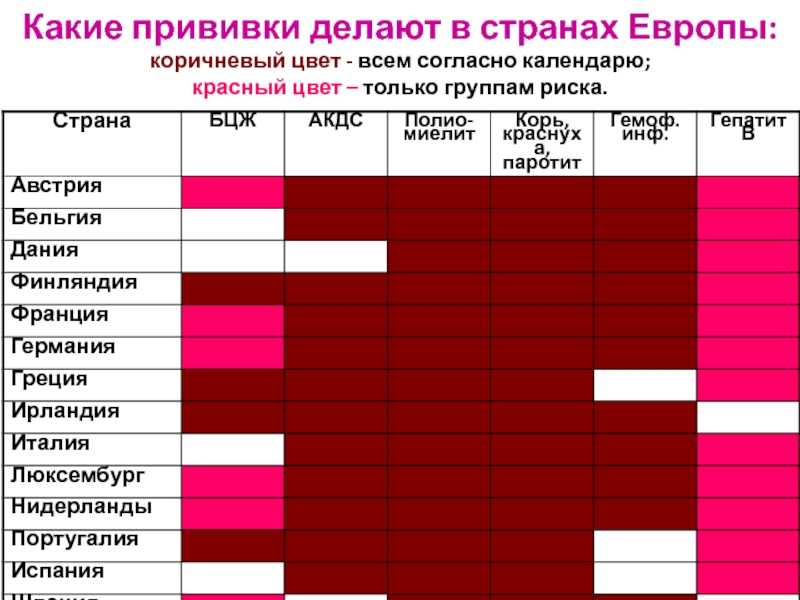 Это связано с тем, чтобы полностью исключить риск развития вакциноассоциированного полиомиелита, который возможен только на первое и в минимальном проценте случаев на второе введение. Соответственно, при наличии 2-х и более прививок от полиомиелита инактивированной вакциной, осложнения на живую полиовакцину исключены. Действительно, считалось и признается некоторыми специалистами, что оральная вакцина имеет преимущества, так как формирует местный иммунитет на слизистых кишечника в отличие от ИПВ. Однако сейчас стало известно, что инактивированная вакцина в меньшей степени, но также формирует местный иммунитет. Кроме того, 5 введений вакцины против полиомиелита как оральной живой, так и инактивированной вне зависимости от уровня местного иммунитета на слизистых оболочках кишечника, полностью защищают ребенка от паралитических форм полиомиелита.
Это связано с тем, чтобы полностью исключить риск развития вакциноассоциированного полиомиелита, который возможен только на первое и в минимальном проценте случаев на второе введение. Соответственно, при наличии 2-х и более прививок от полиомиелита инактивированной вакциной, осложнения на живую полиовакцину исключены. Действительно, считалось и признается некоторыми специалистами, что оральная вакцина имеет преимущества, так как формирует местный иммунитет на слизистых кишечника в отличие от ИПВ. Однако сейчас стало известно, что инактивированная вакцина в меньшей степени, но также формирует местный иммунитет. Кроме того, 5 введений вакцины против полиомиелита как оральной живой, так и инактивированной вне зависимости от уровня местного иммунитета на слизистых оболочках кишечника, полностью защищают ребенка от паралитических форм полиомиелита.
Согласно национального календаря РФ, иммунизация против полиомиелита начинается с 3-х месячного возраста, проводится 3-х кратная вакцинация с интервалом 45 дней (3мес, 4,5 мес, 6мес), через 1год после законченной вакцинации (из 3-х прививок), проводится 2-х кратная ревакцинация с интервалом 2 месяца (18 и 20 месяцев), в 14 лет проводится 3-я ревакцинация.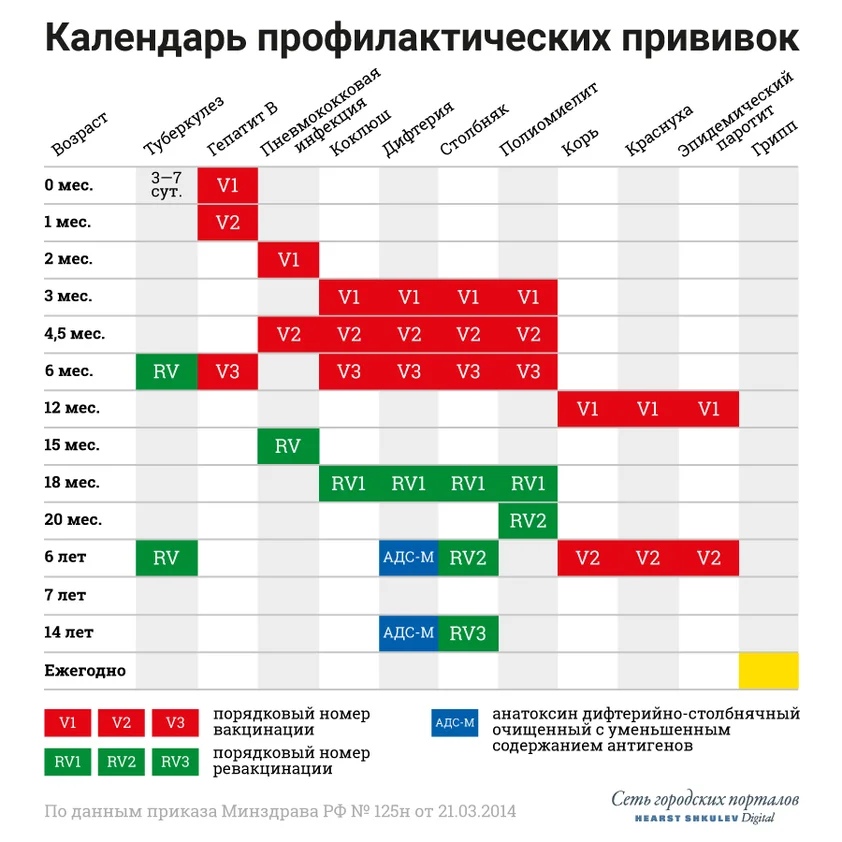
В Санитарно-эпидемиологических правилах «Профилактика полиомиелита» СП 3.1.2951-11, расписан весь комплекс организационных, лечебно-профилактических, санитарно-противоэпидемических (профилактических) мероприятий, направленных на предупреждение возникновения, распространения и ликвидацию заболеваний полиомиелитом.
Соблюдение санитарных правил является обязательным для граждан, юридических лиц и индивидуальных предпринимателей.
2. Вопрос: В соответствии с постановлением Главного санитарного врача ЧР (№ 1 от 17.01.2017 г.) в Чеченской Республике с 23.01.2017 г. по 29.01.2017 г. проводилась подчищающая иммунизация против полиомиелита, а с 30.01.2017 г. введены ограничительные мероприятия по полиомиелиту в детских дошкольных и медицинских учреждениях на территории Чеченской Республики. Чем было продиктовано данное постановление? Какова на сегодняшний день степень опасности распространения вируса полиомиелита в республике?
Ответ: Дело в том, что на территории Чеченской Республики на протяжении последних 3 — 5 лет отмечается низкий охват прививками среди детей, что создает высокие риски возникновения и распространения среди не привитых детей до 5 лет случаев паралитических форм полиомиелита, чтобы понять это нам нужно вернуться назад в 1995год, когда в Чеченской Республике началась в конце мая эпидемия паралитического полиомиелита, которая закончилась в ноябре того же года. Нормализация ситуации была связана с массовым применением вакцины на территории республики в том же году, а вспышке полиомиелита в Чечне предшествовало полное прекращение вакцинопрофилактики, продолжавшееся 3 года. Это свидетельствует о том, что нарушение плановой иммунизации в течение нескольких лет ведет к развитию эпидемий. Теперь по поводу ограничений в дошкольных организациях, как я уже сказала выше, для защиты от полиомиелита необходимо введение 5 доз вакцины, третья и последующие аппликации проводятся живой вакциной, в этой ситуации требуется разобщение привитых и не привитых против полиомиелита так как высоки риски развития вакциноассоциированного полиомиелита у не привитых детей, в связи с чем не привитые на период эпидемических рисков отстраняются от посещения организованных коллективов.
Нормализация ситуации была связана с массовым применением вакцины на территории республики в том же году, а вспышке полиомиелита в Чечне предшествовало полное прекращение вакцинопрофилактики, продолжавшееся 3 года. Это свидетельствует о том, что нарушение плановой иммунизации в течение нескольких лет ведет к развитию эпидемий. Теперь по поводу ограничений в дошкольных организациях, как я уже сказала выше, для защиты от полиомиелита необходимо введение 5 доз вакцины, третья и последующие аппликации проводятся живой вакциной, в этой ситуации требуется разобщение привитых и не привитых против полиомиелита так как высоки риски развития вакциноассоциированного полиомиелита у не привитых детей, в связи с чем не привитые на период эпидемических рисков отстраняются от посещения организованных коллективов.
Также хочу вернутся к периоду создания вакцины против полиомиелита, чтобы родители, отказывающиеся от прививок против полиомиелита очень хорошо подумали перед тем как подписать отказ, о степени риска, которому они подвергают своего ребенка отказываясь от прививок. Вакцина против полиомиелита Джонаса Солка была признана 12 апреля 1955 г. в США, когда успешно завершилось крупномасштабное исследование, подтвердившее эффективность первой вакцины против полиомиелита.
Вакцина против полиомиелита Джонаса Солка была признана 12 апреля 1955 г. в США, когда успешно завершилось крупномасштабное исследование, подтвердившее эффективность первой вакцины против полиомиелита.
Эксперименты по созданию противополиомиелитной вакцины Солк начал в 1947 году. Впервые полиомиелитная вакцина, прошла испытание в 1953-54 гг. (тогда ее тестировали добровольцы), а с 1955 года она получила уже широкое применение.
В исследовании приняло участие около 1 млн детей в возрасте 6-9 лет, из которых 440 тыс. получили вакцину Солка. По свидетельству очевидцев, родители с воодушевлением делали пожертвования на исследование и охотно записывали своих детей в ряды его участников. Сейчас это трудно представить, но в то время полиомиелит был самой грозной детской инфекцией, и родители со страхом ожидали прихода лета, когда регистрировался сезонный пик инфекции.
Результаты пятилетнего, с 1956 по 1961 год, массового применения вакцины превзошли все ожидания: среди детей в возрастных группах, особенно подверженных инфекции до 5 лет, заболеваемость снизилась на 96%.
В 1954 г. в США было зарегистрировано более 38 тыс. случаев полиомиелита, а спустя 10-летие применения вакцины Солка, в 1965 г., количество случаев полиомиелита в этой стране составило всего 61.
3. Вопрос: Если в семье несколько детей, не опасна ли для старших, не привитых детей, прививка, которую получил младший из них?
Ответ: Если в семье все дети не привиты против полиомиелита их надо одновременно прививать, вне зависимости от возраста первые 2 прививки проводятся инактивированной вакциной, а далее используется живая вакцина, но если по каким-то причинам в семье на момент использования живой вакцины, есть не привитые их необходимо разобщить на 60 дней или вести детей по индивидуальному графику иммунизации.
4. Вопрос: Если в семье новорожденный ребенок, не заразится ли он от старшего, которому сделали прививку?
Ответ: Возраст ребенка не имеет значения, первые 2 прививки проводятся инактивированной вакциной, а далее используется живая вакцина, но если по каким-то причинам в семье на момент использования живой вакцины, есть не привитые их необходимо разобщить на 60 дней или вести детей по индивидуальному графику иммунизации.
5. Вопрос: Чем прививают? Если не привитые дети могут заразиться от привитого живой вакциной ребенка, почему ее применяют?
Ответ: Как я уже говорила выше нашим Национальным календарем предусмотрено использование комбинированной схемы применения вакцины, что в первую очередь связано с отсутствием производства инактивированной вакцины в России, а также с тем что многие ученными РФ признается оральной вакцины, так как формирует местный иммунитет на слизистых кишечника в отличие от ИПВ.
6. Вопрос: Какие противопоказания к применению живой вакцины?
Ответ: Неврологические расстройства, сопровождавшие предыдущую вакцинацию пероральной полиомиелитной вакциной; иммунодефицитное состояние (первичное), злокачественные новообразования, иммуносупрессия (прививки проводят не ранее, чем через 3 месяца после окончания курса терапии, гиперчувствительность к любому компоненту вакцины, сильная реакция (температура выше 40 °С) или осложнение на предыдущее введение препарата, острые инфекционные или неинфекционные заболевания, обострение хронических заболеваний — прививки проводят через 2-4 недели после выздоровления или ремиссии, при нетяжелых ОРВИ, острых кишечных заболеваниях прививки проводят после нормализации температуры.
7. Вопрос: Должен ли прививаться ребенок, если он уже прививался по графику осенью?
Ответ: При иммунизации по национальному календарю нет понятия сезонности, за исключением прививок против гриппа, иммунизация против которого из-за постоянных мутаций вируса гриппа проводится ежегодно до сезонного подъема заболеваемости гриппа и ОРВИ, в конце лета, в начале осени. А в отношении остальных прививок используется понятие декретированный возраст по достижению которого ребенок должен получить свои календарные прививки.
8. Вопрос: Если ребенку делают плановую прививку по возрасту, а он ходит в садик, где есть не привитые дети, представляет ли он опасность для остальных детей? Какие рекомендации должны давать медицинские работники?
Ответ: Да если ребенок привит живой вакциной, высок риск развития вакциассоциированного полиомиелита у не привитых против полиомиелита детей, как в семье, так и в организованном коллективе, и медицинский работник проводящий прививку должен дать рекомендации о необходимости разобщения детей на 60 дней. В случае посещающих садик необходимо на 60 дней отстранить не привитых (из-за отсутствия возможности разобщения в условиях ДДО) так как привитой является законопослушным гражданином, а не привитой использовал всего лишь свое право на отказ от профилактической прививки и для него наступают ограничения в соответствии п. 2, ст. 5 ФЗ-157 от 17.09.1998года «Об иммунопрофилактике инфекционных болезней» отсутствие профилактических прививок влечет: запрет для граждан на выезд в страны, пребывание в которых в соответствии с международными медико-санитарными правилами либо международными договорами Российской Федерации требует конкретных профилактических прививок; временный отказ в приеме граждан в образовательные организации и оздоровительные учреждения в случае возникновения массовых инфекционных заболеваний или при угрозе возникновения эпидемий;
В случае посещающих садик необходимо на 60 дней отстранить не привитых (из-за отсутствия возможности разобщения в условиях ДДО) так как привитой является законопослушным гражданином, а не привитой использовал всего лишь свое право на отказ от профилактической прививки и для него наступают ограничения в соответствии п. 2, ст. 5 ФЗ-157 от 17.09.1998года «Об иммунопрофилактике инфекционных болезней» отсутствие профилактических прививок влечет: запрет для граждан на выезд в страны, пребывание в которых в соответствии с международными медико-санитарными правилами либо международными договорами Российской Федерации требует конкретных профилактических прививок; временный отказ в приеме граждан в образовательные организации и оздоровительные учреждения в случае возникновения массовых инфекционных заболеваний или при угрозе возникновения эпидемий;
9. Вопрос: Можно ли отказаться от прививки против полиомиелита?
Ответ: Да, ФЗ-157 от 17. 09.1998г. «Об иммунопрофилактике инфекционных болезней» п.1, ст. 5, предоставлено право на отказ.
09.1998г. «Об иммунопрофилактике инфекционных болезней» п.1, ст. 5, предоставлено право на отказ.
10. Вопрос: Требуется ли согласие родителя для того, чтобы привить его ребенка? В какой форме оно должно быть: в письменной или устной?
Ответ: да, требуется согласие родителя или законного представителя в письменной форме в соответствии приложения N 5 Утвержденного приказом ФМБА России от 30.03.2007 г. N 88 Информированное добровольное согласие на вакцинацию.
11. Вопрос: Обязаны ли проинформировать родителя, какая вакцина вводится его ребенку? Может ли родитель потребовать сертификат на вакцину?
Ответ: Да, родители имеют право задавать все интересующие их вопросы, и медицинский работник обязан дать информацию по каждому вопросу, в том числе и по сертификату.
12. Вопрос: Санитарными правилами не предусмотрен отказ в приеме в детские сады, почему же не привитым детям отказывают в посещении детского сада?
Ответ: Ограничения оговорены в Федеральном законе 157- ФЗ, п. 2, ст.5
2, ст.5
13. Вопрос: Каковы обязанности граждан при осуществлении иммунопрофилактики?
Ответ: В соответствии п. 3, ст. 5 Федерального закона 157-ФЗ граждане обязаны выполнять предписания медицинских работников;
в письменной форме подтверждать отказ от профилактических прививок.
14. Вопрос: Какие последствия могут быть при отказе от вакцинации от полиомиелита? Есть ли в республике случаи поствакцинальных осложнений?
Ответ: Высок риск возникновения вакцинассоциированного полиомиелита у не привитого или паралитического полиомиелита вызванного диким вирусом полиомиелита, при условии завоза в страну, в республику из неблагополучных стран или в случае выезда в неблагополучную по полиомиелиту страну. Ограничения в условиях эпидемиологического неблагополучия или при возникновении угрозы распространения при поступлении на учебу, в организованный коллектив, на стационарное лечение, санаторное лечение и т. д.
д.
Государственная программа иммунизации | ta.vaktsineeri.ee
Цель государственной программы иммунизации – обеспечить своевременный и всеобъемлющий охват вакцинацией детей и подростков. Для этого государство приобретает и поставляет все необходимые вакцины, предусмотренные данной программой.
Вакцинация новорожденных против туберкулеза, как правило, проводится в роддоме.
Вакцинацию детей дошкольного возраста проводят семейные врачи или семейные медсестры.
Вакцинацию детей и молодежи школьного возраста организует школьная медсестра.
В результате достаточной охваченности вакцинацией формируется коллективный иммунитет населения. Это означает, что инфекционное заболевание больше не может распространяться, поскольку среди населения нет достаточного числа людей, восприимчивых к данной инфекции. Формирование и поддержание иммунного фона населения необходимо до тех пор, пока заболевание не будет окончательно ликвидировано. Если охваченность населения иммунизацией является недостаточной либо неравномерной, сохраняется возможность дальнейшей циркуляции возбудителей болезни и возникновения её новых вспышек.
Если охваченность населения иммунизацией является недостаточной либо неравномерной, сохраняется возможность дальнейшей циркуляции возбудителей болезни и возникновения её новых вспышек.
Программы иммунизации в разных странах могут отличаться друг от друга. Причинами отличий являются различная эпидемиологическая ситуация в области инфекционных заболеваний и особенности организации здравоохранения в разных странах. Кроме того, одной из причин, без сомнения, можно назвать различные экономические возможности стран, а также их приоритеты в сфере здравоохранения.
Приоритетный характер носит вакцинация, способствующая профилактике инфекционных заболеваний с тяжелыми последствиями и предотвращению обусловленной ими нагрузки на больницы, включая осложнения и случаи летального исхода.
В Эстонии проводится вакцинация детей и молодежи против туберкулеза, вирусного гепатита В, ротавирусной инфекции, дифтерии, столбняка, коклюша, краснухи, кори, свинки, полиомиелита, ВПЧ и гемофильной инфекции типа b. Также проводится вакцинация взрослых против дифтерии и столбняка (каждые десять лет).
Также проводится вакцинация взрослых против дифтерии и столбняка (каждые десять лет).
ВОЗРАСТ | НАИМЕНОВАНИЕ ВАКЦИНЫ И КРАТНОСТЬ ВВЕДЕНИЯ |
| 12 часов | HepB 1* |
| 1–5 дней | BCG |
| 2 месяца | RV 1 |
| 3 месяца | DTaP-IPV-Hib-HepB 1 + RV 2 |
| 4,5 месяца | DTaP-IPV—Hib-HepB 2 + RV 3** |
| 6 месяца | DTaP-IPV -Hib-HepB 3 |
| 1 год | MMR 1 |
| 1,5-2 лет | DTaP-IPV-Hib-HepB 4 |
| 6–7 лет | DTaP-IPV |
| 12 лет | HPV 1,2*** |
| 13 лет | MMR 2 |
| 15–17 лет | dTaP |
| Взрослые, каждые 10 лет | dT 7 |
Пояснения к обозначениям:
HepB – вакцина против вирусного гепатита B
BCG – вакцина против туберкулеза
RV – ротавирусная вакцина
DTaP-IPV-Hib-HepB – вакцина против дифтерии, столбняка, ацеллюлярная коклюшная вакцина, инактивированная вакцина против полиомиелита и гемофильной инфекции типа b, вакцина против вирусного гепатита типа В (шестивалентная вакцина)
MMR – вакцина против кори, свинки и краснухи
DTaP-IPV – вакцина против дифтерии, столбняка, ацеллюлярная коклюшная вакцина, инактивированная вакцина против полиомиелита (четырехвалентная вакцина)
HPV — вакцина против вируса папилломы человека
dTpa – вакцина против дифтерии, столбняка, ацеллюлярная коклюшная вакцина
dT – вакцина против дифтерии и столбняка
* Только новорожденные, относящиеся к группе риска, если мать является HBsAg-положительной или не сдавала анализы на гепатит В во время беременности.
** Только в случае пятивалентной ротавирусной вакцины.
*** Только девочки. Минимальный интервал между первой и второй дозой составляет минимум 6 месяцев, но не больше 13 месяцев.
Подробнее: Государственная программа иммунизации
Plaanid reisida
Человеческая неонатальная ротавирусная вакцина (RV3-BB) нацелена на ротавирус от
рождения
1. Парашар У.Д., Джонсон Х., Стил А.Д., Тейт
Дж. Э. Воздействие ротавирусной вакцинации на здоровье в развивающихся странах: прогресс и
Путь вперед. Клинические инфекционные болезни: официальное издание
Американское общество инфекционистов. 2016;62 Приложение 2:S91-5. [PubMed] [Google Scholar]
2. Международный центр доступа к вакцинам
(ИВАК). Система управления информацией о вакцинах (VIMS) Global Rotavirus Vaccine
Отчет о доступе. Школа общественного здравоохранения Блумберга Джона Хопкинса; 2017 [Доступен
22 июля 2017 г., http://www.view-hub.org/).
[Академия Google]
3. Чериан Т., Ван С. С., Мантел С. Ротавирус
С., Мантел С. Ротавирус
вакцины в развивающихся странах: потенциальное воздействие, реализация
задачи и оставшиеся вопросы. вакцина. 2012;30:А3-А6. [PubMed] [Google Scholar]
4. Das JK, Bhutta ZA. Глобальные вызовы в
острая диарея. Курр Опин Гастроэнтерол. 2016;32(1):18-23. [PubMed] [Google Scholar]
5. Steele AD, Madhi SA, Cunliffe NA,
Весикари Т., Фуа К.Б., Лим Ф.С. и др. Заболеваемость ротавирусным гастроэнтеритом
возраст у африканских, азиатских и европейских детей: актуальность для определения времени ротавирусной инфекции
вакцинация. Вакцины для человека и иммунотерапевтические препараты.
2016;12(9):2406-12. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Кларк А., Сандерсон С. Сроки
прививки детям в 45 странах с низким и средним уровнем дохода:
анализ данных обследования. Ланцет. 2009;373(9674):1543-9. [PubMed] [Google Scholar]
7. Кэй Дж.Л. Обзор педиатрических
данные о физиологии желудочно-кишечного тракта, относящиеся к пероральной доставке лекарств. Международный
Международный
Журнал клинической фармации. 2011;33(1):20-4. [PubMed] [Google Scholar]
8. Прендергаст А.Дж., Келли П. Взаимодействия
между кишечными возбудителями, энтеропатией и недостаточностью питания в развивающихся
страны. Текущее мнение об инфекционных заболеваниях.
2016;29(3): 229-36. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. Lloyd-Johnsen C, Justice F, Donath S,
Байнс Дж. Э. Ретроспективное стационарное наблюдение инвагинации у
детей в дозорной педиатрической больнице: преимущества и недостатки использования в
постмаркетинговый надзор за ротавирусными вакцинами. вакцина.
2012;30С:А190-195. [PubMed] [Google Scholar]
10. Cameron DJ, Bishop RF, Veenstra AA,
Барнс Г.Л., Холмс И.Х., Рак Б.Дж. Схема выделения двух некультивируемых вирусов
в стуле новорожденных. Журнал медицинской вирусологии.
1978;2(1):7-13. [PubMed] [Google Scholar]
11. Епископ РФ, Барнс Г.Л., Сиприани Э., Лунд
JS. Клинический иммунитет после неонатальной ротавирусной инфекции. Перспективный
Перспективный
лонгитюдное исследование у детей раннего возраста. Медицинский журнал Новой Англии.
1983;309(2):72-6. [PubMed] [Google Scholar]
12. Епископ РФ, Ципори С.Р., Коулсон Б.С.,
Юникомб Л.Э., Альберт М.Дж., Барнс Г.Л. Гетерологическая защита от
Ротавирусное заболевание у гнотобиотических поросят. Журнал клинических
микробиология. 1986;24(6):1023-8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Кэмерон Д.Дж., Епископ РФ, Веенстра А.А.,
Барнс ГЛ. Некультивируемые вирусы и неонатальная диарея: пятнадцатимесячное исследование в
отделение особого ухода за новорожденными. Журнал клинической микробиологии.
1978;8(1):93-8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Байнс Дж. Э., Данчин М., Джексон П., Хэндли
А., Уоттс Э., Ли К.Дж. и др. Безопасность и иммуногенность RV3-BB у новорожденных
ротавирусная вакцина, вводимая при рождении или в младенчестве: рандомизированная,
двойное слепое плацебо-контролируемое исследование. Ланцет Инфекционные болезни.
2015;15(12):1389-97. [PubMed] [Google Scholar]
15. Статистический ежегодник Индонезии, 2016 г.;
BPS-Statistics Indonesia (по состоянию на 22 июля 2017 г., https://www.bps.go.id/index.php/publikasi/4238). [Google Scholar]
16. Коэффициент младенческой смертности (IMR) по провинциям
2012 г.; BPS-Statistics Indonesia (по состоянию на 22 июля 2017 г., https://www.bps.go.id/linkTabelStatis/view/id/1270). [Google Scholar]
17. Рид А., Саксена А., Баки А.Х., Бхан А., Байнс
J, Bouesseau MC, et al. Использование плацебо в испытаниях вакцин: рекомендации ВОЗ
панель экспертов. вакцина. 2014;32(37):4708-12. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Коулсон Б.С., Фаулер К.Дж., Бишоп РФ, Коттон
РГ. Нейтрализующие моноклональные антитела к ротавирусу человека и признаки
антигенный дрейф среди штаммов у новорожденных. Журнал вирусологии.
1985;54(1):14-20. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Clopper CJ PE. Использование уверенности или
доверительные пределы проиллюстрированы в случае бинома.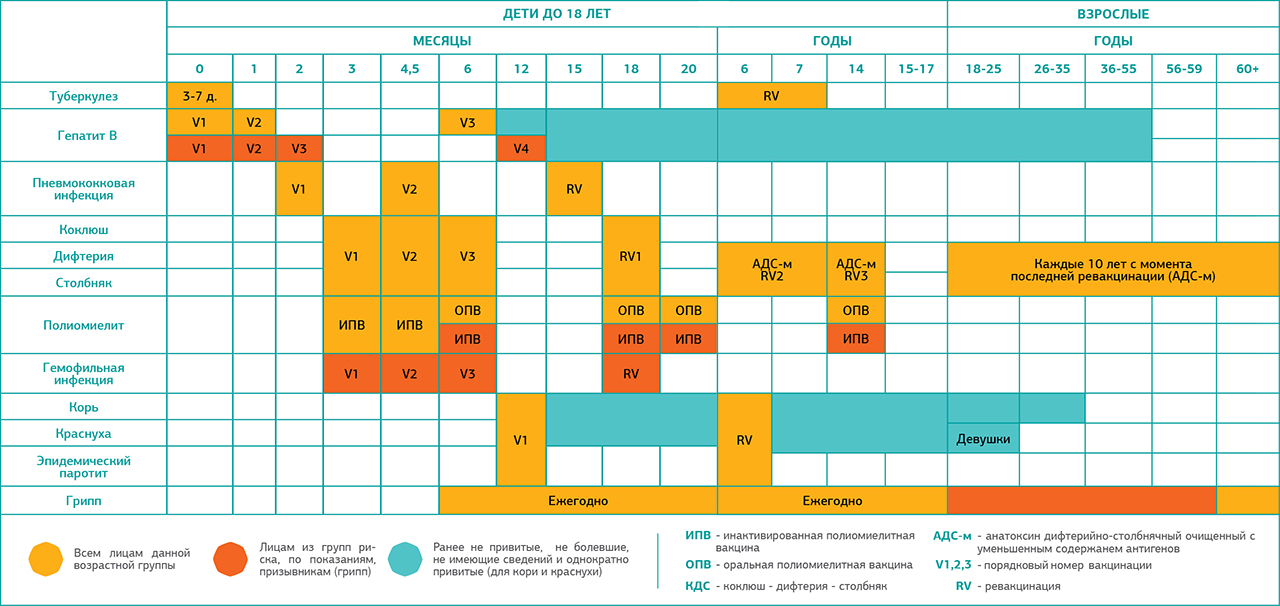 Биометрика.
Биометрика.
1934; 26(4):404-13. [Google Scholar]
20. Agtini MD, Soeharno R, Lesmana M, панджаби
NH, Simanjuntak C, Wangsasaputra F, et al. Бремя диареи, шигеллеза,
и холера в Северной Джакарте, Индонезия: результаты эпиднадзора за 24 месяца.
Инфекционные заболевания ВМС. 2005;5:89. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Nelson EAS, Bresee JS, Parashar UD,
Уиддоусон М.А., Гласс Р.И., Эпидемиология ротавируса в Азии N. Эпидемиология:
Азиатская сеть эпиднадзора за ротавирусом. вакцина.
2008;26(26):3192-6. [PubMed] [Google Scholar]
22. Канлифф Н.А., Витте Д., Нгвира Б.М., Тодд С.,
Босток, штат Нью-Джерси, Тернер А.М. и др. Эффективность ротавирусной вакцины человека против тяжелой
гастроэнтерит у малавийских детей в первые два года жизни:
рандомизированное, двойное слепое, плацебо-контролируемое исследование. вакцина. 2012;30 Приложение
1:А36-43. [Бесплатная статья PMC] [PubMed] [Google Scholar]
23. Заман К., Данг Д.А., Виктор Дж.С., Шин С. ,
,
Юнус М., Даллас М.Дж. и др. Эффективность пятивалентной ротавирусной вакцины против
тяжелый ротавирусный гастроэнтерит у младенцев в развивающихся странах Азии:
рандомизированное, двойное слепое, плацебо-контролируемое исследование. Ланцет (Лондон, Англия).
2010;376(9741):615-23. [PubMed] [Google Scholar]
24. Armah GE, Sow SO, Breiman RF, Dallas MJ,
Tapia MD, Feikin DR, et al. Эффективность пятивалентной ротавирусной вакцины против
тяжелый ротавирусный гастроэнтерит у младенцев в развивающихся странах в
Африка к югу от Сахары: рандомизированное двойное слепое плацебо-контролируемое исследование.
Ланцет. 2010;376(9741):606-14. [PubMed] [Google Scholar]
25. Бхандари Н., Ронгсен-Чандола Т., Бавдекар
А., Джон Дж., Энтони К., Танеджа С. и др. Эффективность моновалентного человека-бычьего
(116E) ротавирусная вакцина у индийских детей на втором году жизни. вакцина.
2014;32 Приложение 1:A110-6. [PubMed] [Google Scholar]
26. Исанака С., Гвиндо О., Лангендорф С., Сек
А.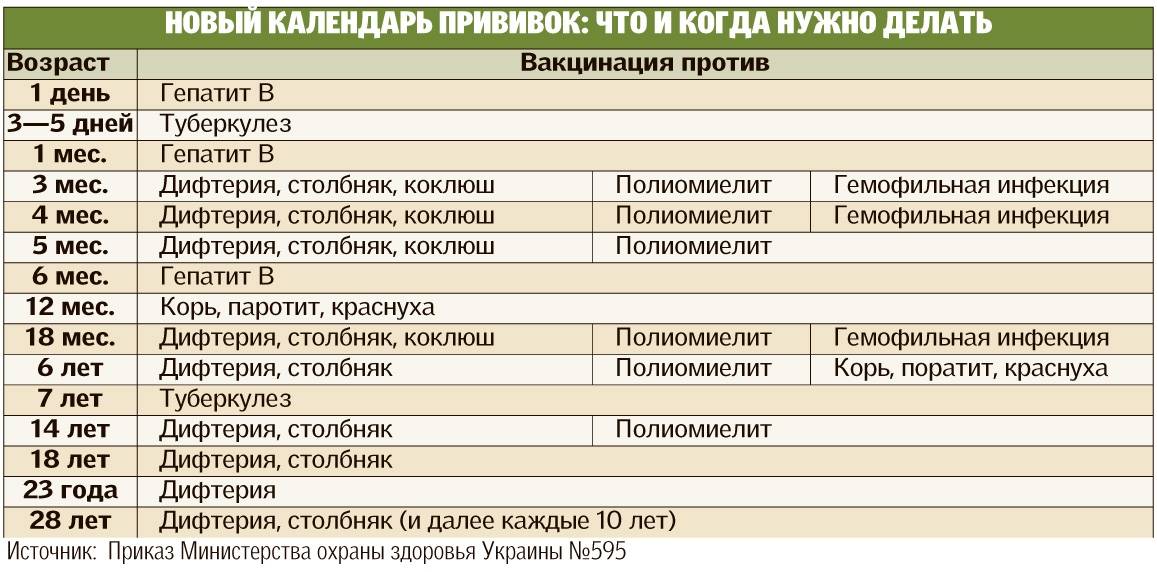 М., Пликайтис Б.Д., Сайинзога-Макомбе Н. и соавт. Эффективность низкой стоимости,
М., Пликайтис Б.Д., Сайинзога-Макомбе Н. и соавт. Эффективность низкой стоимости,
Термостабильная оральная ротавирусная вакцина в Нигере. Медицинский журнал Новой Англии.
2017;376(12):1121-30. [PubMed] [Академия Google]
27. Сувантика А.А., Ту ХАТ, Постма М.Ю.
Экономическая эффективность иммунизации против ротавируса в Индонезии: грудное вскармливание
узоры с учетом. вакцина. 2013;31(32):3300-7. [PubMed] [Google Scholar]
28. Весикари Т., Рууска Т., Делем А., Андре Ф.Е.
Вакцинация новорожденных против ротавирусной инфекции бычьей ротавирусной вакциной RIT 4237:
предварительный отчет. Журнал детских инфекционных болезней.
1987;6(2):164-9. [PubMed] [Google Scholar]
29. Даган Р., Кассис И., Саров Б., Мидтун К.,
Дэвидсон Б.Л., Весикари Т. и соавт. Безопасность и иммуногенность перорального четырехвалентного
Реассортантная ротавирусная вакцина человека-резус у новорожденных. Детская инфекционная
журнал болезней. 1992;11(12):991-6. [PubMed] [Google Scholar]
30. Флорес Дж., Перес-Шаэль И., Бланко М., Рохас
Флорес Дж., Перес-Шаэль И., Бланко М., Рохас
AM, Альфонсо Э., Креспо И. и др. Реактогенность и иммуногенность
Четырехвалентная ротавирусная вакцина на основе ротавируса-резуса с высоким титром. Журнал
клиническая микробиология. 1993;31(9):2439-45. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Rippinger CM, Patton JT, McDonald SM.
Полный анализ последовательности генома вакцинных штаммов-кандидатов против ротавируса человека
РВ3 и 116Е. Вирусология. 2010;405(1):201-13. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Нордгрен Дж., Шарма С., Букардо Ф., Насир В.,
Гунайдин Г., Уэрми Д. и др. Статус Льюиса и секретора опосредованы.
восприимчивость к ротавирусным инфекциям в зависимости от генотипа ротавируса.
Клинические инфекционные заболевания: официальное издание Инфекционной
Общество болезней Америки. 2014;59(11):1567-73. [Бесплатная статья PMC] [PubMed] [Google Scholar]
33. Sun X, Guo N, Li D, Jin M, Zhou Y, Xie G,
и другие. Специфичность связывания белков P 8 VP8* ротавирусных вакцинных штаммов
с антигенами гистологической группы крови. Вирусология. 2016;495:129-35. [PubMed] [Google Scholar]
Вирусология. 2016;495:129-35. [PubMed] [Google Scholar]
34. Nordgren J, Nitiema LW, Ouermi D, Simpore
Дж., Свенссон Л. Генетические факторы хозяина влияют на восприимчивость к норовирусу.
инфекций в Буркина-Фасо. ПлоС один. 2013;8(7):e69557. [Бесплатная статья PMC] [PubMed] [Google Scholar]
35. Ангел Дж., Стил А.Д., Франко М.А. коррелирует
защиты ротавирусных вакцин: возможные альтернативные конечные точки испытаний,
возможности и вызовы. Вакцины для человека и иммунотерапевтические препараты.
2014;10(12):3659-71. [Бесплатная статья PMC] [PubMed] [Google Scholar]
36. Кларк Э., Дессельбергер У. Корреляты
защита от ротавирусной болезни человека и факторы, влияющие
защиты в малообеспеченных условиях. Иммунология слизистых оболочек.
2015;8(1):1-17. [PubMed] [Google Scholar]
37. Cowley D, Donato CM, Roczo-Farkas S,
Кирквуд компакт-диск. Появление нового межгеногруппового реассортанта G3P 8, подобного лошадям
штамм ротавируса, связанный с гастроэнтеритом у австралийских детей.
Журнал общей вирусологии. 2016;97(2):403-10. [PubMed] [Академия Google]
Фаза I испытаний ротавирусной вакцины RV3-BB: вакцина против ротавируса новорожденных для человека
Клинические испытания
. 2013 28 мая; 31 (23): 2610-6.
doi: 10.1016/j.vaccine.2013.04.008.
Epub 2013 16 апр.
М Данчин
1
, С. Д. Кирквуд, К. Дж. Ли, Р. Ф. Бишоп, Э. Уоттс, Ф. А. Джастис, В. Клиффорд, Д. Коули, Дж. П. Баттери, Дж. Э. Байнс
Принадлежности
принадлежность
- 1 Программа вакцинации против ротавируса RV3, Детский научно-исследовательский институт Мердока, Парквилл, Виктория, Австралия. [email protected]
PMID:
23597719
DOI:
10.
 1016/j.vaccine.2013.04.008
1016/j.vaccine.2013.04.008
Клинические испытания
M Danchin et al.
вакцина.
.
. 2013 28 мая; 31 (23): 2610-6.
doi: 10.1016/j.vaccine.2013.04.008.
Epub 2013 16 апр.
Авторы
М Данчин
1
, С. Д. Кирквуд, К. Дж. Ли, Р. Ф. Бишоп, Э. Уоттс, Ф. А. Джастис, В. Клиффорд, Д. Коули, Дж. П. Баттери, Дж. Э. Байнс
принадлежность
- 1 Программа вакцинации против ротавируса RV3, Детский научно-исследовательский институт Мердока, Парквилл, Виктория, Австралия. [email protected].
 au
au
PMID:
23597719
DOI:
10.1016/j.vaccine.2013.04.008
Абстрактный
Введение:
RV3 представляет собой штамм неонатального ротавируса человека (G3P[6]), который ассоциируется с бессимптомной неонатальной инфекцией и хорошо размножается в кишечнике младенцев. Ротавирусная вакцина RV3-BB была разработана в качестве вакцины-кандидата для введения при рождении.
Методы:
Одноцентровое двойное слепое рандомизированное плацебо-контролируемое исследование фазы I оценивало безопасность и переносимость однократной пероральной дозы ротавирусной вакцины RV3-BB второго поколения (8,3×10(6) БОЕ/мл) у 20 взрослых, 20 детей и 20 младенцев (10 вакцин и 10 плацебо на возрастную группу). Прием вакцины определяли как сероконверсию (3-кратное увеличение сывороточного антиротавирусного IgA или сывороточного нейтрализующего антитела (SNA) по сравнению с исходным уровнем на 28-й день после введения дозы) или свидетельство репликации вируса RV3-BB в фекалиях с помощью анализа RT-PCR. 3-6 дней после вакцинации. Присутствие RV3-BB было подтверждено анализом последовательности.
Прием вакцины определяли как сероконверсию (3-кратное увеличение сывороточного антиротавирусного IgA или сывороточного нейтрализующего антитела (SNA) по сравнению с исходным уровнем на 28-й день после введения дозы) или свидетельство репликации вируса RV3-BB в фекалиях с помощью анализа RT-PCR. 3-6 дней после вакцинации. Присутствие RV3-BB было подтверждено анализом последовательности.
Полученные результаты:
Вакцина RV3-BB хорошо переносилась всеми участниками, при этом не было выявлено никаких нежелательных явлений, связанных с исследуемой вакциной. В когорте младенцев вакцинация была продемонстрирована у 8/9 младенцев после однократной дозы вакцины по сравнению с 2/7 получателей плацебо. В группе вакцинации младенцев у 5/9 младенцев наблюдалась сероконверсия IgA или SNA, а у 7/9 младенцев были признаки репликации RV3-BB на 3-6 дни по сравнению с 2/7 младенцев с сероконверсией и 0/10 младенцев с признаками сероконверсии. повторение в группе плацебо. У двух младенцев в группе плацебо были серологические признаки ротавирусной инфекции в течение 28-дневного периода исследования: у одного был обнаружен ответ IgA, а у другого — SNA, а у другого младенца была обнаружена репликация вируса дикого типа.
повторение в группе плацебо. У двух младенцев в группе плацебо были серологические признаки ротавирусной инфекции в течение 28-дневного периода исследования: у одного был обнаружен ответ IgA, а у другого — SNA, а у другого младенца была обнаружена репликация вируса дикого типа.
Вывод:
Однократная доза ротавирусной вакцины RV3-BB хорошо переносилась взрослыми, детьми и младенцами. Большинство младенцев (8/9), получивших RV3-BB, продемонстрировали вакцинацию после однократной дозы. Эти данные подтверждают продвижение RV3-BB к испытаниям иммуногенности и эффективности фазы II.
Copyright © 2013 Elsevier Ltd. Все права защищены.
Похожие статьи
Выделение ротавируса после введения неонатальной вакцины против ротавируса человека RV3-BB.
Коули Д., Бонифаций К.
 , Богданович-Сакран Н., Кирквуд К.Д., Байнс Дж.Е.
, Богданович-Сакран Н., Кирквуд К.Д., Байнс Дж.Е.
Коули Д. и др.
Hum Вакцина Иммунотер. 2017 3 августа; 13 (8): 1908-1915. дои: 10.1080/21645515.2017.1323591. Эпаб 2017 8 мая.
Hum Вакцина Иммунотер. 2017.PMID: 28481726
Бесплатная статья ЧВК.Клиническое испытание.
Безопасность и иммуногенность неонатальной ротавирусной вакцины человека RV3-BB, вводимой при рождении или в младенчестве: рандомизированное двойное слепое плацебо-контролируемое исследование.
Байнс Дж.Э., Данчин М., Джексон П., Хэндли А., Уоттс Э., Ли К.Дж., Уэст А., Коули Д., Чен М.Ю., Барнс Г.Л., Джастис Ф., Баттери Дж.П., Карлин Дж.Б., Бишоп Р.Ф., Тейлор Б., Кирквуд К.Д.; Программа ротавирусной вакцины RV3.
Байнс Дж. Э. и соавт.
Ланцет Infect Dis. 2015 Декабрь; 15 (12): 1389-97. дои: 10.1016/S1473-3099(15)00227-3. Epub 2015 26 августа.
Ланцет Infect Dis. 2015.
2015.PMID: 26318715
Клиническое испытание.
Ротавирус-специфические материнские антитела и иммунный ответ на неонатальную ротавирусную вакцину RV3-BB в Новой Зеландии.
Чен М.Ю., Кирквуд К.Д., Байнс Дж., Коули Д., Павлик Д., Ли К.Дж., Орсини Ф., Уоттс Э., Барнс Г., Данчин М.
Чен М.Ю. и соавт.
Hum Вакцина Иммунотер. 2017 4 мая; 13 (5): 1126-1135. дои: 10.1080/21645515.2016.1274474. Epub 2017 6 января.
Hum Вакцина Иммунотер. 2017.PMID: 28059609
Бесплатная статья ЧВК.Клиническое испытание.
Пентавалентная ротавирусная вакцина (RotaTeq): обзор ее использования для профилактики ротавирусного гастроэнтерита в Европе.
Плоскер ГЛ.
Плоскер ГЛ.
Наркотики. 2010 18 июня; 70 (9): 1165-88. doi: 10. 2165/11205030-000000000-00000.
2165/11205030-000000000-00000.
Наркотики. 2010.PMID: 20518582
Обзор.
Живая аттенуированная ротавирусная вакцина человека Ротарикс.
Бернштейн Д.И.
Бернштейн Д.И.
Семин Педиатр Инфект Дис. 2006 г., 17 октября (4): 188–94. doi: 10.1053/j.spid.2006.08.006.
Семин Педиатр Инфект Дис. 2006.PMID: 17055369
Обзор.
Посмотреть все похожие статьи
Цитируется
Разработка состава живой аттенуированной ротавирусной вакцины человека (RV3-BB)-кандидата для использования в странах с низким и средним уровнем дохода.
Кумар П., Шукла Р.С., Патель А., Пуллагурла С.Р., Берд С., Огун О., Кумру О.С., Хамиди А., Хуксема Ф., Яллоп С., Бинес Дж.Е., Джоши С.
 Б., Волкин Д.Б.
Б., Волкин Д.Б.
Кумар П. и др.
Hum Вакцина Иммунотер. 2021 3 июля; 17 (7): 2298-2310. дои: 10.1080/21645515.2021.1885279. Epub 2021 16 апр.
Hum Вакцина Иммунотер. 2021.PMID: 33861183
Бесплатная статья ЧВК.Разработка производственного процесса для производства экономически эффективной и стабильной жидкой ротавирусной вакцины человека.
Хамиди А., Хоексема Ф., Вельтхоф П., Лемкерт А., Гиллиссен Г., Луитженс А., Бинес Дж. Э., Пуллагурла С. Р., Кумар П., Волкин Д. Б., Джоши С. Б., Хавенга М., Баккер В. А., Яллоп К.
Хамиди А. и др.
вакцина. 2021 8 апреля; 39(15):2048-2059. doi: 10.1016/j.vaccine.2021.03.033. Epub 2021 18 марта.
вакцина. 2021.PMID: 33744044
Бесплатная статья ЧВК.Созданные и новые ротавирусные вакцины: всесторонний обзор для медицинских работников.

Веттер В., Гарднер Р.С., Дебрюс С., Беннингхофф Б., Перейра П.
Веттер В. и др.
Hum Вакцина Иммунотер. 2022 г., 31 декабря; 18 (1): 1870395. дои: 10.1080/21645515.2020.1870395. Epub 2021 19 фев.
Hum Вакцина Иммунотер. 2022.PMID: 33605839
Бесплатная статья ЧВК.Обзор.
Влияние переменных состава на стабильность живой вакцины-кандидата против ротавируса (RV3-BB) с использованием моделей пищеварения в желудке in vitro для имитации пероральной доставки.
Кумар П., Пуллагурла С.Р., Патель А., Шукла Р.С., Берд С., Кумру О.С., Хамиди А., Хуксема Ф., Яллоп С., Бинес Дж.Е., Джоши С.Б., Волкин Д.Б.
Кумар П. и др.
Дж. Фарм. 2021 фев; 110 (2): 760-770. doi: 10.1016/j.xphs.2020.09.047. Epub 2020 7 октября.
Дж. Фарм. 2021.PMID: 33035539
Бесплатная статья ЧВК.Эффективность лицензированных ротавирусных вакцин и разработка ротавирусных вакцин нового поколения: обзор.


 1016/j.vaccine.2013.04.008
1016/j.vaccine.2013.04.008 au
au , Богданович-Сакран Н., Кирквуд К.Д., Байнс Дж.Е.
, Богданович-Сакран Н., Кирквуд К.Д., Байнс Дж.Е. 2015.
2015. 2165/11205030-000000000-00000.
2165/11205030-000000000-00000.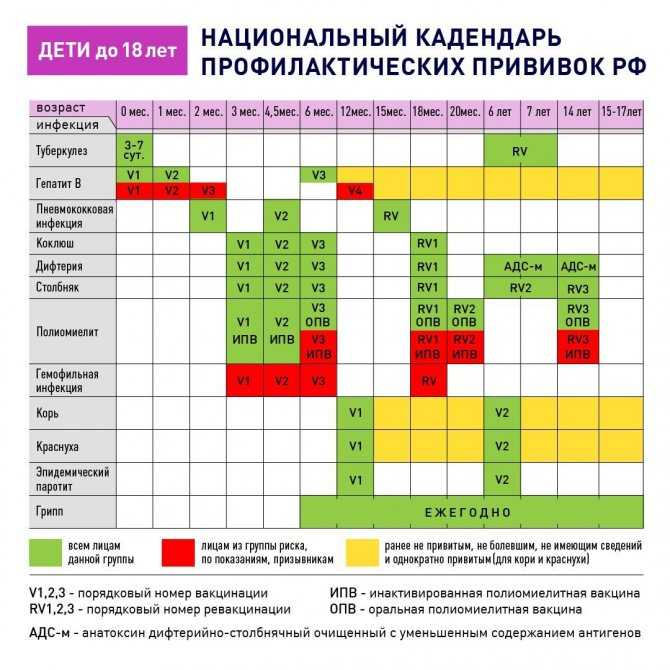 Б., Волкин Д.Б.
Б., Волкин Д.Б.