Содержание
FDA одобрило Превнар 13® для взрослых 50+
Первая пневмококковая конъюгированная вакцина для взрослых 50+ может помочь в борьбе с высокой заболеваемостью пневмококковой пневмонией
Компания Pfizer Inc. (NYSE:PFE) объявила сегодня о том, что Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США
Администрация (FDA) одобрила пневмококковый
конъюгированная вакцина Превнар 13 ® * (Пневмококковая 13-валентная
Конъюгированная вакцина [дифтерийный CRM 197 Белок]) в виде отдельного
доза для применения у взрослых. Превнар 13 показан взрослым старше 50 лет.
возраст и старше для активной иммунизации для профилактики пневмонии
и инвазивное заболевание, вызванное 13 Streptococcus pneumoniae ( S.
pneumoniae ) серотипов, содержащихся в вакцине.
«Пневмококковая инфекция, в том числе пневмония, у взрослых 50 лет и старше
представляет собой значительное личное и общественное бремя для здоровья в
Соединенные Штаты. Одобрение FDA Prevnar 13 для этих взрослых предлагает
Одобрение FDA Prevnar 13 для этих взрослых предлагает
возможность внести свой вклад в здоровье миллионов пожилых людей
американцы», — сказал Ян Рид, председатель и главный исполнительный директор Pfizer.
Inc. «Это одобрение свидетельствует о стремлении Pfizer
открытие и вывод на рынок изменяющих жизнь лекарств и вакцин».
Пневмококковая инфекция (ПЗ) является ведущей проблемой общественного здравоохранения у взрослых 50
лет и старше, население быстро растет в Соединенных
Состояния. В этой популяции насчитывается, по оценкам, сотни
тысяч инфекций S. pneumoniae в год, в том числе более
более 440 000 случаев пневмококковой пневмонии, что составляет
по оценкам, 200 000 посещений отделений неотложной помощи и 300 000
госпитализации.
«Очевидно, что сохраняется высокая заболеваемость пневмококковой пневмонией в
это взрослое население», — сказал Эмилио Эмини, доктор философии, главный научный
сотрудник отдела исследований вакцин, Pfizer Inc. «Prevnar 13 был лицензирован для
«Prevnar 13 был лицензирован для
взрослые 50 лет и старше, одобренные FDA в ускоренном порядке
путь из-за его потенциала, чтобы помочь решить эту важную
бремя болезни».
Заявка Pfizer в FDA США была основана на безопасности и
исследования иммуногенности с участием примерно 6000 взрослых в возрасте 50 лет.
возраст и старше. В этих испытаниях фазы 3 вакцинация Prevnar 13 была
показано, что он вызывает функциональный гуморальный ответ на 13 серотипов
содержащихся в вакцине у взрослых в возрасте 50 лет и старше, в том числе
лица, ранее привитые обычной пневмококковой
полисахаридная вакцина (PPSV) и лица, не получавшие пневмококковой вакцины.
Эффективность Prevnar 13, введенного менее чем через пять лет после
ППСВ не известен.
Расширенное показание, одобренное Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США, основано на
ответы, полученные Prevnar 13, и не было контролируемых
испытания у взрослых, демонстрирующие снижение заболеваемости пневмококковой пневмонией или
инвазивная пневмококковая инфекция после вакцинации Превнар 13.
Pfizer в настоящее время проводит исследование внебольничной пневмонии.
Испытание иммунизации у взрослых (CAPiTA) для выполнения требований
ускоренный путь одобрения. CAPiTA — это исследование эффективности, в котором участвуют более
более 84 000 испытуемых, предназначенных для оценки эффективности Prevnar 13.
эффективен в предотвращении первого эпизода внебольничной
пневмония (ВП), вызванная 13 пневмококковыми серотипами, содержащимися в
вакцина.
Кроме того, компания Pfizer согласилась в качестве постмаркетингового обязательства в
связи с одобрением FDA США на проведение исследования
оценивая одновременное использование Prevnar 13 и TIV (ежегодный трехвалентный
инактивированная вакцина против гриппа) у взрослых в возрасте 50 лет и старше,
были ранее иммунизированы PPSV.
«По мере того, как взрослые становятся старше, они становятся более восприимчивыми к инфекционным
заболеваний, таких как пневмококковая пневмония, из-за старения иммунных
систем», — сказал Томас М. Файл-младший, доктор медицины, магистр наук, избранный президент,
Файл-младший, доктор медицины, магистр наук, избранный президент,
Национальный фонд инфекционных заболеваний. «В качестве конъюгированной вакцины
Prevnar 13 предлагает новый важный вариант для взрослых в возрасте 50 лет и старше.
включить в свою профилактическую стратегию здорового старения».
Помимо США, компания Pfizer получила одобрение на
применение Превнар 13 по различным показаниям у взрослых в возрасте 50 лет и
старше в Европейском союзе, Австралии, Мексике и более чем в 10 других
страны. Превнар 13 был впервые одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США в феврале.
2010 г. для профилактики инвазивной пневмококковой инфекции у детей раннего возраста и
детей младшего возраста от 6 недель до 5 лет.
О Prevnar 13 и Conjugate Technology
Prevnar 13 использует разработанную Компанией технологию сопряжения, которая связывает
пневмококковые полисахаридные сахарные цепи, обнаруженные на поверхности каждого
бактериальный серотип с белком-носителем. Prevnar 13 использует носитель
Prevnar 13 использует носитель
белок CRM 197 , который имеет более чем 20-летний клинический и
коммерческое использование в вакцинах.
Пневмококковая инфекция
Пневмококковая инфекция – это группа инфекций, вызываемых бактерией 9.0014 Стрептококк
pneumoniae , также известный как пневмококк. Самый распространенный
проявления БП у взрослых в возрасте 50 лет и старше
небактериемная пневмококковая пневмония, неинвазивная форма
болезнь. Болезнь Паркинсона также вызывает инвазивные инфекции, такие как бактериемия и
менингит у взрослых.
Показания к применению Превнар 13 для взрослых в возрасте 50 лет и старше
- У взрослых в возрасте 50 лет и старше Превнар 13 показан для
активная иммунизация для профилактики пневмонии и инвазивных
заболевание, вызванное Streptococcus pneumoniae серотипы 1, 3, 4,
5, 6А, 6В, 7F, 9В, 14, 18С, 19А, 19F и 23F - Это показание основано на иммунных реакциях, вызванных Prevnar 13.

Не проводилось контролируемых исследований у взрослых, демонстрирующих
снижение инвазивной пневмококковой инфекции или пневмококковой пневмонии
после прививки Превнар 13 - Превнар 13 не защищает от болезней, вызванных стрептококком .
пневмония серотипов, которых нет в вакцине - Эффективность Prevnar 13 при введении менее пяти лет
после пневмококковой полисахаридной вакцины неизвестно
Показания к применению Превнар 13 для детей в возрасте от 6 недель до 5 лет
- У детей в возрасте от 6 недель до 5 лет (до 6-го
дня рождения), Превнар 13 показан для активной иммунизации
профилактика инвазионных заболеваний, вызванных Пневмококк
серотипы 1, 3, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19А, 19F и 23F - Превнар 13 не защищает от болезней, вызванных стрептококком .

pneumoniae серотипов, которых нет в вакцине
Важная информация по безопасности для Prevnar 13
- Тяжелая аллергическая реакция (например, анафилаксия) на любой компонент
Превнар 13, Превнар ® (пневмококковый 7-валентный конъюгат
Вакцина [Diphtheria CRM 197 Белок]), или любая дифтерийная
вакцина, содержащая анатоксин, является противопоказанием к применению Превнара.
13 - Превнар 13 не обеспечивает 100% защиты от вакцинных серотипов.
или защитить от невакцинных серотипов - Иммунодефицитные дети и взрослые или лица с ослабленным иммунитетом
реактивность вследствие применения иммуносупрессивной терапии может иметь
снижение ответа антител на активную иммунизацию - Апноэ после внутримышечной вакцинации наблюдалось у некоторых
младенцев, рожденных недоношенными. Решения о том, когда проводить
Решения о том, когда проводить
внутримышечная вакцина, в том числе Превнар 13, детям, рожденным
преждевременно должны основываться на рассмотрении индивидуальных
медицинский статус младенца и потенциальные преимущества и возможные риски
вакцинации - В педиатрических клинических исследованиях чаще всего сообщалось о серьезных
нежелательными явлениями были бронхиолит (0,9%, 1,1%), гастроэнтерит (0,9%,
0,9%) и пневмонии (0,9%, 0,5%) для Prevnar 13 и Prevnar,
соответственно - У младенцев и детей младшего возраста, вакцинированных в возрасте 2, 4, 6 и 12–15 месяцев.
в США клинических испытаний, о которых чаще всего сообщалось
предполагаемые побочные реакции: раздражительность (> 70%), место инъекции
болезненность (> 50%), снижение аппетита (> 40%), снижение сна (> 40%),
увеличение сна (> 40%), лихорадка (> 20%), покраснение места инъекции (> 20%),
и отек в месте инъекции (> 20%) - У взрослых в возрасте 50 лет и старше обычно сообщают о нежелательных
побочные реакции: боль в месте инъекции (> 50%), утомляемость.
(>30%), головная боль (>20%), мышечная боль (>20%), боль в суставах (>10%),
снижение аппетита (>10%), покраснение в месте инъекции (>10%), инъекция
припухлость участка (> 10%), ограничение движения руки (> 10%), озноб (> 5%)
или сыпь (> 5%)
Пожалуйста, ознакомьтесь с полной информацией о назначении здесь.
Pfizer Inc.: Совместная работа на благо здоровья
мир™
В Pfizer мы применяем науку и наши глобальные ресурсы для улучшения здоровья.
и благополучия на каждом этапе жизни. Мы стремимся установить стандарт для
качество, безопасность и ценность в открытии, разработке и
производство лекарственных средств для людей и животных. Наша диверсифицированная
глобальный портфель медицинских услуг включает в себя биологические и
низкомолекулярные лекарства и вакцины, а также пищевые продукты
и многие из самых известных в мире потребительских товаров. Каждый день, Пфайзер
Каждый день, Пфайзер
коллеги работают на развитых и развивающихся рынках, чтобы продвигаться вперед
оздоровление, профилактика, лечение и лечение, которые бросают вызов самым
страшные болезни нашего времени. В соответствии с нашей ответственностью как
ведущая мировая биофармацевтическая компания, мы также сотрудничаем с
поставщики медицинских услуг, правительства и местные сообщества для поддержки и
расширить доступ к надежному и недорогому медицинскому обслуживанию во всем мире. За
Более 150 лет Pfizer работает над тем, чтобы изменить ситуацию к лучшему для всех, кто
положиться на нас. Чтобы узнать больше о наших обязательствах, посетите наш сайт www.pfizer.com.
УВЕДОМЛЕНИЕ О РАСКРЫТИИ ИНФОРМАЦИИ. Информация, содержащаяся в этом выпуске, относится к
30 декабря 2011 г. Pfizer не берет на себя обязательств обновлять
прогнозные заявления, содержащиеся в этом выпуске, в результате
новая информация или будущие события или разработки.
Этот выпуск содержит прогнозную информацию, которая включает
существенные риски и неопределенности в отношении испытания CAPiTA в настоящее время
проводится, а также судебное разбирательство, которое будет проведено для оценки
одновременное применение Превнар 13 и ТИВ у взрослых в возрасте 50 лет и
старше, которые были ранее иммунизированы PPSV. Такие риски и
неопределенности включают в себя, среди прочего, неопределенности, присущие
исследования и разработки, включая неопределенность в отношении результатов
два испытания и их влияние на коммерческий потенциал
показания или показания для Превенара 13/Превнара 13, утвержденные в
США и другие страны для взрослых в возрасте 50 лет и старше;
и конкурентные разработки.
Дальнейшее описание рисков и неопределенностей можно найти в
Годовой отчет Pfizer по форме 10-K за финансовый год, закончившийся в декабре
31, 2010 г. и в своих отчетах по форме 10-Q и форме 8-K.
и в своих отчетах по форме 10-Q и форме 8-K.
*Prevnar 13 обозначается как Prevenar 13 в большинстве стран за пределами США.
Соединенные Штаты.
Устранение путаницы вокруг пневмококковых вакцин
Сьюзан Холленберг BSc MD MCFP (биография, не разглашается) Клинический доцент, семейная медицина, UBC; Руководитель отдела образования UBC Health Clinic
Чем я занимался до
В моем кабинете мы отвечаем на растущие вопросы пациентов о пневмококковых вакцинах, поскольку озабоченность по поводу пандемии COVID привлекает внимание к респираторным заболеваниям, которые можно предотвратить с помощью вакцин. Люди видят глянцевую рекламу пневмококковой конъюгированной вакцины (PCV-13), а фармацевты отмечают, что взрослым следует рассмотреть этот продукт. Я регулярно предлагал пневмококковую вакцину своим пациентам, когда им исполнялось 65 лет. С 19 лет97 в Британской Колумбии полисахаридная пневмококковая вакцина стала одноразовой вакциной, финансируемой общественным здравоохранением, для всех здоровых пожилых людей.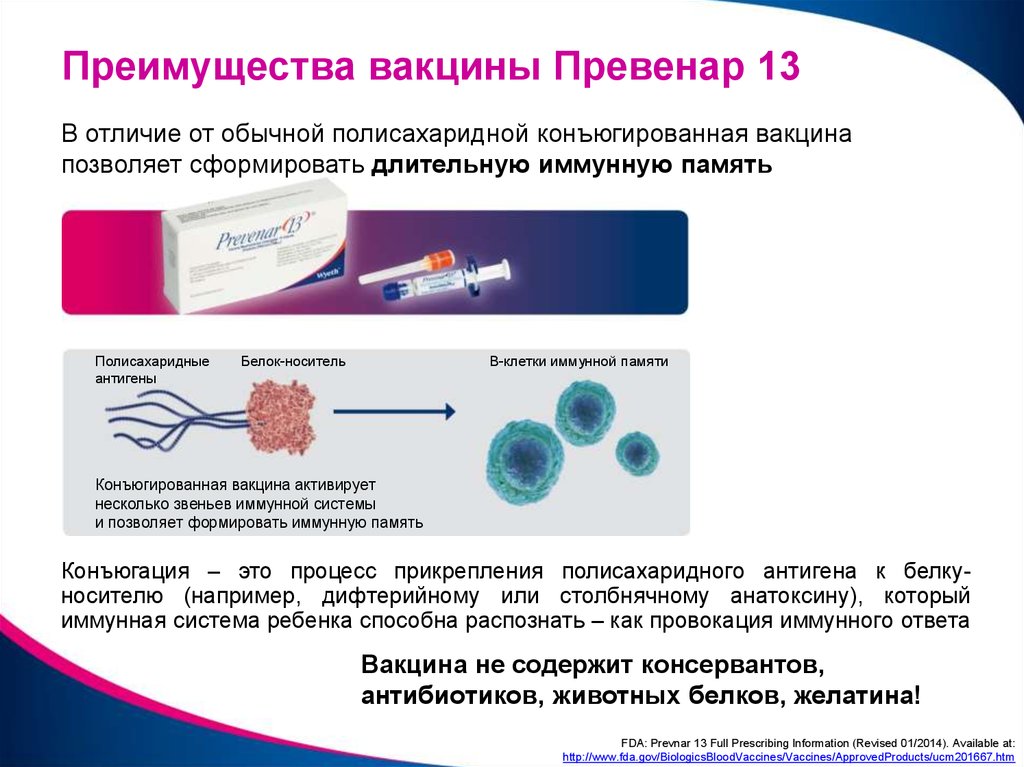 Пневмококковая вакцина становилась все более показанной для особых групп населения, и я добавил другие медицинские показания к своему предложению по иммунизации. Когда пожилые люди приходили на прививку от гриппа, это стало напоминанием спросить, получили ли они «вакцину против пневмонии». В начале 2000-х годов мы начали использовать другие типы пневмококковой вакцины для младенцев, и мне было трудно понять различия между продуктами. Я был в замешательстве относительно доказательной базы этих вакцин и того, как вести дискуссию с пациентами.
Пневмококковая вакцина становилась все более показанной для особых групп населения, и я добавил другие медицинские показания к своему предложению по иммунизации. Когда пожилые люди приходили на прививку от гриппа, это стало напоминанием спросить, получили ли они «вакцину против пневмонии». В начале 2000-х годов мы начали использовать другие типы пневмококковой вакцины для младенцев, и мне было трудно понять различия между продуктами. Я был в замешательстве относительно доказательной базы этих вакцин и того, как вести дискуссию с пациентами.
В Канаде для взрослых доступны два различных типа пневмококковой вакцины. Полисахаридные вакцины представляют собой инактивированные вакцины, состоящие из длинных цепей сахарных антигенов, образующих поверхностную капсулу бактерий. Они индуцируют в основном ответ IgM и низкий уровень IgG, обеспечивая защиту на 5-10 лет. Бустерные дозы могут вызвать парадоксальную гипореактивность и обычно не рекомендуются. Полисахаридная пневмококковая вакцина содержит 23 серотипа (PPV-23). Конъюгированные вакцины создаются путем присоединения молекулы полисахарида к белку-носителю (в данном случае дифтерийному анатоксину), что повышает иммуногенность антигена. Это процесс, зависимый от Т- и В-клеток, который индуцирует иммунологическую память. Пневмококковая конъюгированная вакцина (PCV-13) содержит 13 серотипов, 12 из которых включены в PPV-23 (2). При примировании конъюгированной вакциной последующий иммунологический ответ на полисахаридную вакцину намного сильнее.
Конъюгированные вакцины создаются путем присоединения молекулы полисахарида к белку-носителю (в данном случае дифтерийному анатоксину), что повышает иммуногенность антигена. Это процесс, зависимый от Т- и В-клеток, который индуцирует иммунологическую память. Пневмококковая конъюгированная вакцина (PCV-13) содержит 13 серотипов, 12 из которых включены в PPV-23 (2). При примировании конъюгированной вакциной последующий иммунологический ответ на полисахаридную вакцину намного сильнее.
Болезнь, вызванная Streptococcus pneumoniae широко распространен во всем мире и продолжает вызывать значительную заболеваемость и смертность. По оценкам ВОЗ, ежегодно около 500 000 детей в возрасте до 5 лет умирают от пневмококковой инфекции (2). Ежегодно в США происходит не менее 25 000 смертей взрослых от пневмококковой инфекции (11). В 2019 г. в Британской Колумбии BCCDC сообщил о 533 случаях инвазивной пневмококковой инфекции (IPD), при этом о росте заболеваемости сообщили органы здравоохранения острова Ванкувер и Северные органы здравоохранения (10). ИПД возникает, когда S.pneumoniae вторгается в кровоток или ЦНС и чаще всего встречается у очень молодых, пожилых людей и людей с ослабленным иммунитетом. У детей он часто проявляется бактериемией или менингитом. У взрослых типичным проявлением является бактериемическая пневмония, часто являющаяся осложнением гриппа или других заболеваний нижних дыхательных путей. Смертность составляет 5-7% и выше у лиц пожилого возраста. S.pneumoniae колонизирует носоглотку и распространяется воздушно-капельным путем, с выделениями из дыхательных путей или при прямом оральном контакте. Факторы риска, повышающие заболеваемость пневмококком у взрослых, включают сопутствующие заболевания, нарушение иммунитета и длительное пребывание под опекой. Особенно восприимчивы такие группы населения, как курильщики, бездомные, потребители незаконных наркотиков и люди, страдающие алкоголизмом. Учитывая эту мрачную статистику, было удивительно узнать, что в Канаде в 2014 году охват взрослых 65 лет и старше вакциной PPV-23 составлял всего 36,5%! Кроме того, учитывая тот факт, что увеличение респираторных и кровяных изолятов S.
ИПД возникает, когда S.pneumoniae вторгается в кровоток или ЦНС и чаще всего встречается у очень молодых, пожилых людей и людей с ослабленным иммунитетом. У детей он часто проявляется бактериемией или менингитом. У взрослых типичным проявлением является бактериемическая пневмония, часто являющаяся осложнением гриппа или других заболеваний нижних дыхательных путей. Смертность составляет 5-7% и выше у лиц пожилого возраста. S.pneumoniae колонизирует носоглотку и распространяется воздушно-капельным путем, с выделениями из дыхательных путей или при прямом оральном контакте. Факторы риска, повышающие заболеваемость пневмококком у взрослых, включают сопутствующие заболевания, нарушение иммунитета и длительное пребывание под опекой. Особенно восприимчивы такие группы населения, как курильщики, бездомные, потребители незаконных наркотиков и люди, страдающие алкоголизмом. Учитывая эту мрачную статистику, было удивительно узнать, что в Канаде в 2014 году охват взрослых 65 лет и старше вакциной PPV-23 составлял всего 36,5%! Кроме того, учитывая тот факт, что увеличение респираторных и кровяных изолятов S. pneumoniae устойчивы к пенициллину, первостепенное значение должно уделяться профилактическим стратегиям, включая проведение эффективной пневмококковой иммунизации. (1) (2) (5) (6)
pneumoniae устойчивы к пенициллину, первостепенное значение должно уделяться профилактическим стратегиям, включая проведение эффективной пневмококковой иммунизации. (1) (2) (5) (6)
Что изменило мою практику
В 2019 г. US ACIP (Консультативный комитет по практике иммунизации) опубликовал документ с изложением позиции в отношении пневмококковых вакцин, стремясь рассмотреть соображения относительно ПКВ- 13 использование среди взрослых > 65 лет. (5) (6) Это сыграло ключевую роль в моем нынешнем понимании и обсуждении этих вакцин, поскольку схема очень похожа на опыт использования продуктов пневмококковой вакцины в Канаде.
7-валентная конъюгированная вакцина против пневмонии была введена в обычные программы США для детей в 2000 году. взрослых популяций. Вакцина PCV-13 заменила PCV-7 в детских программах в 2010 году. В течение следующих 4 лет внебольничная пневмония (ВП) снизилась на 35% у взрослых в возрасте 65–74 лет и на 20% у взрослых 75 лет. Конъюгированная пневмококковая вакцина не была одобрена для использования у взрослых до 2014 года. В том же году ACIP рекомендовал PCV-13 для всех пожилых людей, а через 8 недель — PPV-23. К 2019 году, 47% взрослых в США принимали PCV-13. Однако в период с 2014 по 2019 год дальнейшего влияния на ВП или ИПЗ на уровне популяции не наблюдалось.
Конъюгированная пневмококковая вакцина не была одобрена для использования у взрослых до 2014 года. В том же году ACIP рекомендовал PCV-13 для всех пожилых людей, а через 8 недель — PPV-23. К 2019 году, 47% взрослых в США принимали PCV-13. Однако в период с 2014 по 2019 год дальнейшего влияния на ВП или ИПЗ на уровне популяции не наблюдалось.
Наибольшее влияние применения ПКВ-13 на взрослых, вероятно, связано с косвенным эффектом от применения у детей. Положительные эффекты детской пневмококковой вакцинации наблюдаются у взрослых всех возрастов, заболеваний, национальности и социально-экономических групп. Серотипы, отличные от PCV-13, в настоящее время составляют большую часть бремени внебольничной пневмонии. Пневмония, вызванная серотипами ЦВС-13, в 2014-2016 гг., по оценкам, составляла всего 4% пневмонии от всех причин. Эти результаты привели к изменению рекомендаций ACIP по использованию PCV-13 и pneu-23 у взрослых в июне 2019 года. В сводном заявлении рекомендуется, чтобы все взрослые в возрасте 65 лет получали однократную дозу PPV-23, поскольку она охватывает большее количество штаммов. Вакцина PCV-13 больше не рекомендуется для здоровых взрослых 65 в масштабах всего населения. Взрослым с определенными заболеваниями и ослабленным иммунитетом следует рассмотреть возможность получения вакцины PCV-13, а затем вакцины PPV-23 через 8 недель.
Вакцина PCV-13 больше не рекомендуется для здоровых взрослых 65 в масштабах всего населения. Взрослым с определенными заболеваниями и ослабленным иммунитетом следует рассмотреть возможность получения вакцины PCV-13, а затем вакцины PPV-23 через 8 недель.
Может быть полезно переосмыслить информацию о вакцинах с помощью концепции числа, необходимого для вакцинации (NNV), которое объединяет эффективность вакцины с частотой заболевания в популяции для предотвращения исхода (7). Для ЦВС-13 у здоровых взрослых ежегодная NNV составляет 26 000 взрослых в год для предотвращения одного случая инвазивной пневмококковой инфекции, 3000-14 000 для предотвращения одного случая стационарной пневмонии и 2600 для предотвращения одного случая амбулаторной пневмонии (5).
Чем я сейчас занимаюсь
Включив эти данные для информирования о практике пневмококковой вакцинации взрослых в Канаде, NACI (1) (2) рекомендует проводить вакцинацию PPV-23 среди взрослых, так как она на 50-80% эффективна для профилактики ИПЗ среди пожилые люди и группы риска.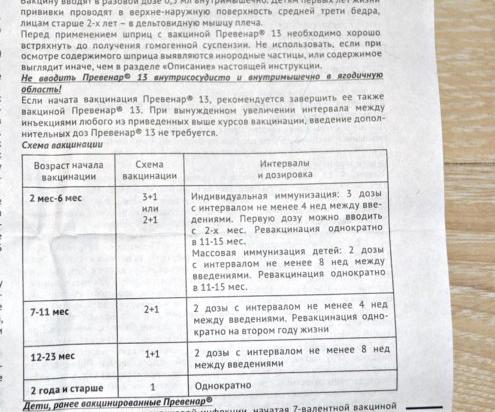 Штаммы, вызывающие большинство случаев ИПЗ у взрослых в Канаде, содержатся в PPV-23, а не в PCV-13. В Канаде ЦВС-7 была включена в программы плановой иммунизации детей в 2003 г., а ЦВС-13 заменила ее в 2010 г. (12). PCV-13 имеет расчетную эффективность 86-9.7% у детей младше 5 лет (2). Полисахаридная вакцина обычно не используется у младенцев или детей, поскольку она гораздо менее иммуногенна, чем конъюгированные продукты в этих возрастных группах.
Штаммы, вызывающие большинство случаев ИПЗ у взрослых в Канаде, содержатся в PPV-23, а не в PCV-13. В Канаде ЦВС-7 была включена в программы плановой иммунизации детей в 2003 г., а ЦВС-13 заменила ее в 2010 г. (12). PCV-13 имеет расчетную эффективность 86-9.7% у детей младше 5 лет (2). Полисахаридная вакцина обычно не используется у младенцев или детей, поскольку она гораздо менее иммуногенна, чем конъюгированные продукты в этих возрастных группах.
В Британской Колумбии существует государственное финансирование одноразовой дозы PPV-23 для всех здоровых пожилых людей в возрасте 65 лет. (3) (4) Для лиц с высоким риском рекомендуется ввести 1 дозу во время постановки диагноза. Рассмотрите возможность использования PCV-13 в индивидуальном порядке. Состояния высокого риска включают анатомическую или функциональную асплению, серповидно-клеточную анемию, иммуносупрессию, связанную с заболеванием или медикаментозной терапией, врожденные иммунодефицитные состояния, хронические заболевания сердца, легких, печени или почек, реципиентов солидных органов или ТГСК, диабет, алкоголизм, кистозный фиброз, хронические Утечка спинномозговой жидкости, кохлеарный имплант, бездомность, незаконное употребление наркотиков, хронические неврологические состояния, нарушающие клиренс выделений из ротовой полости, и лица, проживающие в учреждениях расширенного или промежуточного ухода. (BC Center for Disease Control. Пневмококковая полисахаридная вакцина . Ванкувер, Британская Колумбия: Центр контроля заболеваний Британской Колумбии; Октябрь 2018 г., вид)
(BC Center for Disease Control. Пневмококковая полисахаридная вакцина . Ванкувер, Британская Колумбия: Центр контроля заболеваний Британской Колумбии; Октябрь 2018 г., вид)
Имеются высококачественные доказательства использования вакцины PCV-13 у людей с ВИЧ и реципиентов трансплантации гемопоэтических стволовых клеток, и она финансируется Британской Колумбией для этих взрослых групп. Для других лиц вакцина PCV-13 является частной платной вакциной, доступной в аптеках и туристических клиниках. Для лиц с самым высоким риском, взрослых 19+ с иммунодефицитными состояниями, рекомендуется дать PCV-13, а затем PPV-23 через 8 недель. Однократная ревакцинация против PPV-23 должна быть предложена через 5 лет после первичной иммунизации. (BC Center for Disease Control. Пневмококковая конъюгированная вакцина . Ванкувер, Британская Колумбия: Центр контроля заболеваний Британской Колумбии; август 2018 г. (см.)
Справочная таблица рекомендаций по вакцинации против пневмококка для взрослых из Canadian Immunization Guide (2, см. )
)
| Возраст, основное заболевание | Тип вакцины | Количество доз и рекомендуемая схема приема |
| Иммунокомпетентные взрослые в возрасте от 18 до 65 лет с высоким риском ИПЗ из-за основного заболевания |
|
|
Иммунокомпетентные взрослые в возрасте от 18 до 65 лет, проживающие в учреждениях длительного ухода, курящие, страдающие алкоголизмом, бездомные
| ||
| Взрослые в возрасте 65 лет и старше, независимо от факторов риска или предшествующей пневмококковой вакцинации |
|
|
| Взрослые с иммунодефицитом (кроме ТГСК) |
|
|
| Взрослые реципиенты ТГСК |
|
|
Сноски к таблице Сноска 1 Некоторые эксперты предлагают дозу пневмококковой конъюгированной вакцины с последующей вакциной Pneu-P-23 для иммунокомпетентных взрослых с высоким риском ИПЗ из-за основного заболевания, поскольку это теоретически может улучшить реакцию антител и иммунологическую память. Сноска 2 Лица, употребляющие запрещенные наркотики, должны пройти вакцинацию против Pneu-P-23. Сноска 3 Иммунизация вакциной Pneu-C-13 в дополнение к вакцине Pneu-P-23 может быть рассмотрена для иммунокомпетентных лиц, не подвергавшихся вакцинации, на индивидуальной основе для профилактики ВП и ИПЗ, вызванных 13 пневмококковыми серотипами, включенными в вакцине. Сноска 4 По крайней мере, через 8 недель после любой предыдущей дозы вакцины Pneu-C-13 и по крайней мере через 5 лет после любой предыдущей дозы вакцины Pneu-P-23. Сноска 5 Доза вакцины Pneu-C-13 должна быть введена по крайней мере через 1 год после любой предыдущей дозы вакцины Pneu-P-23. Вернуться к сноске Сокращения: | ||
Побочные эффекты PPV-23 и PCV-13 включают типичные местные и легкие системные реакции, не усиливающиеся при их последовательном введении. В настоящее время нет рекомендаций по бустированию ЦВС-13 у взрослых. Важно помнить, что введение PCV-13 за 8 недель до PPV-23 может усилить иммунологический ответ на штаммы, содержащиеся в PPV-23. Реакция на конъюгированную вакцину притупляется, если сначала вводится PPV-23, и перед введением PCV-13 необходимо подождать 1 год.
Целесообразно снизить риск пневмококковой инфекции в период потенциально тяжелых респираторных последствий COVID-19, а недавно введенная поощрительная выплата BC Care Bundle (VIEW) направлена на обеспечение получения этой вакцины людьми, имеющими право на участие в программе. Файлы HealthlinkBC № 62a и № 62b содержат ключевую информацию для обсуждения с пациентами. В качестве дополнительного стимула для доставки респираторных вакцин в Британской Колумбии новый код платы MSP, введенный 1 октября 2020 г., позволяет выставлять счет за введение пневмококковой вакцины в дополнение к обычному посещению офиса для людей (T10040, Dx V05), или если основная цель посещения – только иммунизация (B00010, Dx V05). Мне до сих пор напоминают о необходимости предлагать пневмококковую вакцину своим пациентам, когда они приходят на прививку от гриппа. Я использую расширяющуюся доказательную базу для обоснования своего обсуждения с целью поддержки пациентов в их решениях по иммунизации для улучшения их здоровья.
Файлы HealthlinkBC № 62a и № 62b содержат ключевую информацию для обсуждения с пациентами. В качестве дополнительного стимула для доставки респираторных вакцин в Британской Колумбии новый код платы MSP, введенный 1 октября 2020 г., позволяет выставлять счет за введение пневмококковой вакцины в дополнение к обычному посещению офиса для людей (T10040, Dx V05), или если основная цель посещения – только иммунизация (B00010, Dx V05). Мне до сих пор напоминают о необходимости предлагать пневмококковую вакцину своим пациентам, когда они приходят на прививку от гриппа. Я использую расширяющуюся доказательную базу для обоснования своего обсуждения с целью поддержки пациентов в их решениях по иммунизации для улучшения их здоровья.
Информация для пациентов.
Ссылки и ресурсы
- Агентство общественного здравоохранения Канады.
 Обновленная информация об использовании пневмококковых вакцин у взрослых в возрасте 65 лет и старше – точка зрения общественного здравоохранения . Оттава, Онтарио: Агентство общественного здравоохранения Канады; ноябрь 2018 г. (ссылка)
Обновленная информация об использовании пневмококковых вакцин у взрослых в возрасте 65 лет и старше – точка зрения общественного здравоохранения . Оттава, Онтарио: Агентство общественного здравоохранения Канады; ноябрь 2018 г. (ссылка) - Правительство Канады. Пневмококковая вакцина: Канадское руководство по иммунизации . Оттава, Онтарио: правительство Канады; Декабрь 2016. (Ссылка)
- до н.э. Центр контроля заболеваний. Пневмококковая конъюгированная вакцина . Ванкувер, Британская Колумбия: Центр контроля заболеваний Британской Колумбии; Август 2018. (Ссылка)
- до н.э. Центр контроля заболеваний. Пневмококковая полисахаридная вакцина . Ванкувер, Британская Колумбия: Центр контроля заболеваний Британской Колумбии; Октябрь 2018. (Ссылка)
- Консультативный комитет по практике иммунизации. Сводный отчет 26-27 июня, 2019. Атланта, Джорджия: Департамент здравоохранения и социальных служб, Центры по контролю и профилактике заболеваний; Июнь 2019: 46-64.
 (ссылка)
(ссылка) - Matanock A, Lee G, Gierke R, Kobayashi M, Leidner A, Pilishvili T. Использование 13-валентной пневмококковой конъюгированной вакцины и 23-валентной пневмококковой полисахаридной вакцины среди взрослых в возрасте ≥65 лет: обновленные рекомендации Консультативного комитета по практике иммунизации . MMWR Morb Mortal Wkly Rep . 2019;68:1069–1075. DOI: 10.15585/mmwr.mm6846a5. (ссылка)
- Хашим А., Данг В., Болотин С., Кроукрофт Н.С. Как и почему исследователи используют число, необходимое для вакцинации, для принятия обоснованных решений — систематический обзор. Вакцина X. 2015;33(6):753-758. DOI: 10.1016/j.vaccine.2014.12.033. (ссылка)
- Bonten MJM, Huijts SM, Bolkenbass M, et al. Полисахаридная конъюгированная вакцина против пневмококковой пневмонии у взрослых. N Английский J Med . 2015;372:1114-1125. DOI: 10.1056/NEJMoa1408544. (ссылка)
- Рамджи Дж., Колбер М.Р. Вакцина против пневмонии для взрослых: эффективность так же эффективна, как и усилия? Инструменты для практики .




 Решения о том, когда проводить
Решения о том, когда проводить
 Если выбрана эта стратегия, сначала следует ввести вакцину Pneu-C-13, а затем, по крайней мере, через 8 недель, вакцину Pneu-P-23. Тем не менее, вакцина Pneu-P-23 является вакциной выбора для этих людей. Если можно предоставить только одну вакцину, это должна быть вакцина Pneu-P-23.
Если выбрана эта стратегия, сначала следует ввести вакцину Pneu-C-13, а затем, по крайней мере, через 8 недель, вакцину Pneu-P-23. Тем не менее, вакцина Pneu-P-23 является вакциной выбора для этих людей. Если можно предоставить только одну вакцину, это должна быть вакцина Pneu-P-23. 
 Обновленная информация об использовании пневмококковых вакцин у взрослых в возрасте 65 лет и старше – точка зрения общественного здравоохранения . Оттава, Онтарио: Агентство общественного здравоохранения Канады; ноябрь 2018 г. (ссылка)
Обновленная информация об использовании пневмококковых вакцин у взрослых в возрасте 65 лет и старше – точка зрения общественного здравоохранения . Оттава, Онтарио: Агентство общественного здравоохранения Канады; ноябрь 2018 г. (ссылка) (ссылка)
(ссылка)