Содержание
Вакцина «СИНФЛОРИКС» — Аква Доктор
«СИНФЛОРИКС» – прививка для профилактики пневмококковой инфекции и нетипированной гемофильной инфекции
Вакцина пневмококковая, антигемофильная, конъюгированная, адсорбированная
Производитель: «Глаксо Смит Кляйн Биолоджикалз С.А», Бельгия.
Защищает от заболеваний: вакцина для профилактики пневмококковой инфекции.
Примеряется: только у детей в возрасте с рождения (с 6 недель) до 5 лет.
Включена в национальный календарь прививок.
Преимущества вакцины «Синфлорикс»
- Вакцина содержит антигены 10 серотипов Streptococcus pneumoniae (1, 4, 5, 6В, 7F, 9V, 14, 18C, 19F и 23F), вызывающих наибольшее число случаев инвазивной пневмококковой инфекции – пневмонии (50-96%) у детей младше 5 лет в мире.
- Уже после первой прививки выработается иммунная защита к большинству классов пневмококка.
- В рамках клинических исследований подтверждена высокая иммуногенность вакцины Синфлорикс при применении двудозовой и трехдозовой схем первичной иммунизации у детей до 2 х лет и 2 – 5 лет жизни ребенка.

- Эффективность вакцины у детей младше 7 месяцев составляет 100% при вакцинации по схеме 3+1 и 91,8% при вакцинации по схеме 2+1.
Показания для вакцинации «Синфлорикс»
Активная иммунизация детей в возрасте от 6 недель до 5 лет с целью профилактики заболеваний, вызываемых серотипами 1, 4, 5, 6В, 7F, 9V, 14, 18С, 19F и 23F Streptococcus pneumoniae, включая профилактику серьезных и опасных для детей заболеваний: сепсис, бактериемию, пневмонию (инвазивную и неинвазивную), менингит и острый отит среднего уха.
Совместимость с другими вакцинами
Пневмококковую вакцину «Синфлорикс» можно вводить одновременно с другими вакцинами по Национальному календарю прививок: с вакцинами от дифтерии, коклюша, столбняка (бесклеточной и цельноклеточной), от инфекции, вызываемой Haemophilus influenzae, от полиомиелита, кори, ветрянки, свинки, краснухи, от ротавирусной инфекции и т. д. Вакцины вводятся в разные участки тела с использованием разных шприцев.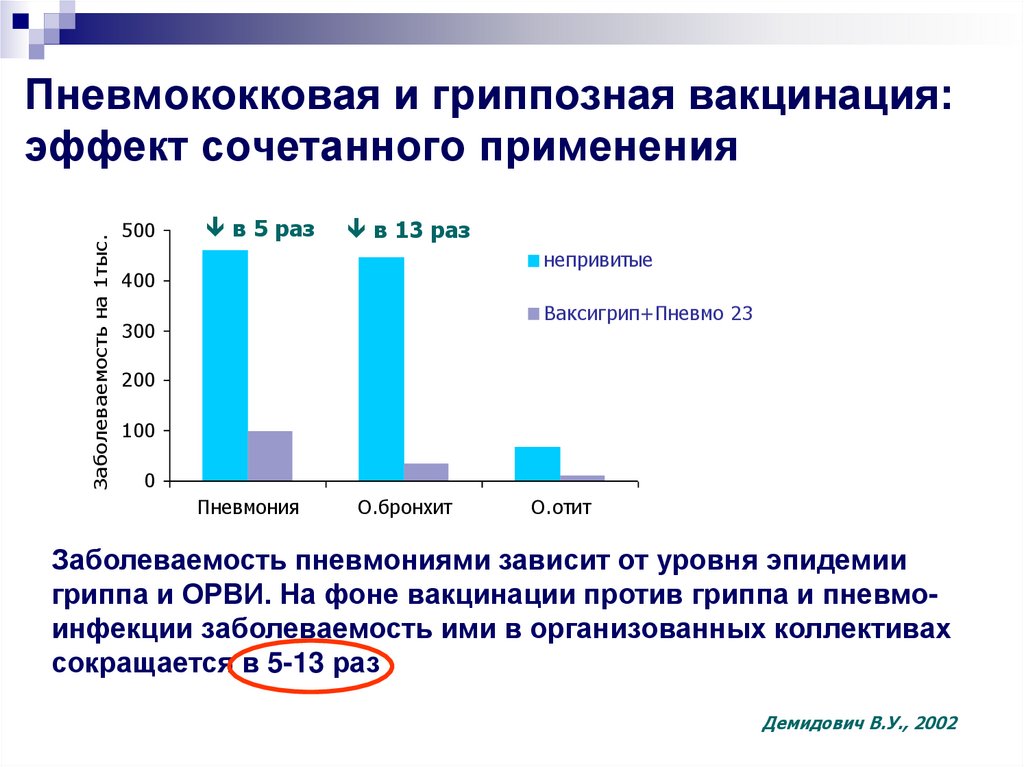
Предостережения: вакцина не предназначена для применения у взрослых!
Поскольку вакцина Синфлорикс не предназначена для применения у взрослых, исследования применения вакцины во время беременности или в период кормления грудью не проводились.
Противопоказания
Только врач может решить, подходит ли СИНФЛОРИКС для вакцинации
СИНФЛОРИКС противопоказан при наличии в анамнезе аллергической реакции на любой компонент вакцины.
Проведение вакцинации СИНФЛОРИКС противопоказано в следующих случаях:
- Гиперчувствительность к любому компоненту вакцины.
- Острые инфекционные и неинфекционные заболевания, обострение хронических заболеваний являются временными противопоказаниями для проведения прививок. Прививки проводятся через 2-4 недели после выздоровления или в период реконвалесценции или ремиссии. При нетяжелых ОРВИ, острых кишечных заболеваниях и др.
 прививки проводятся сразу после нормализации температуры. При наличии слабовыраженных симптомов простуды не следует откладывать вакцинацию.
прививки проводятся сразу после нормализации температуры. При наличии слабовыраженных симптомов простуды не следует откладывать вакцинацию.
Возможные побочные эффекты
Самыми частыми нежелательными реакциями при первичном курсе вакцинации были покраснение в месте введения, лихорадка, раздражительность ребенка, потеря аппетита. Также могут встречаться головная боль, сонливость, патологический плач, аллергические реакции, апноэ у недоношенных детей, уплотнения в месте инъекции.
Приходите на прививки в “Аква-Доктор”. Полный спектр вакцин для детей и взрослых, семейная вакцинация – по специальной цене!
←→
Применение пневмококковой вакцины серьезно изменило статистику заболеваемости и исходов пневмоний
До ХХ века инфекции являлись главной причиной высокой смертности и малой продолжительности жизни людей, а также многих смертоносных эпидемий. Вспомнить хотя бы пандемию чумы в XIV веке, прозванную «Черная смерть», которая стала причиной гибели около трети населения Азии и половины жителей Европы. Или пандемию гриппа в начале ХХ века, так называемую «испанку», которая унесла, по разным данным, жизни от 20 до 100 миллионов человек.
Или пандемию гриппа в начале ХХ века, так называемую «испанку», которая унесла, по разным данным, жизни от 20 до 100 миллионов человек.
Все изменилось с появлением вакцин — средств защиты от самых разных инфекций. Пройдя путь от вариоляции (древневосточного способа прививания от оспы) до высокотехнологичных субстанций, сложность разработки, производства и тестирования которых невозможно переоценить, вакцинопрофилактика позволила человечеству успешно бороться с наиболее опасными болезнями. По данным Всемирной организации здравоохранения, вакцины ежегодно спасают от преждевременной смерти от 2 до 3 миллионов человек.
Одной из последних в 2014 году в Национальный календарь профилактических прививок (НКПП) была внесена пневмококковая вакцина, применение которой серьезно изменило статистику заболеваемости и исходов пневмоний и ряда других опасных заболеваний. Этому решению, как и регистрации вакцины на территории страны, предшествовал длительный и сложный период клинических исследований (КИ).
— Так же, как для всех лекарств, они проводятся в 4 этапа (фазы), — пояснил «РГ» председатель координационного совета Лиги содействия клиническим исследованиям, кандидат медицинских наук Олег Мелихов. — Первая фаза — исследования различных доз препарата. Во второй фазе получают первые сведения о его эффективности и безопасности. Третья фаза — подтверждение эффективности и безопасности в объеме, необходимом для его регистрации. На второй фазе КИ в исследование включается когорта пациентов, которую планируется прививать (определенная группа по возрасту/состоянию здоровья). Подгруппы пациентов с особенностями (например, с хроническими заболеваниями, иммуносупрессиями и др.) более глубоко изучаются на третьей фазе.
— Только после получения данных о безопасности и эффективности вакцины у взрослых проводят КИ вакцин у детей, — дополняет руководитель отдела профилактики инфекционных заболеваний НИИ детских инфекций ФМБА, доктор медицинских наук Сусанна Харит. — Сначала в группе подростков 12-18 лет, потом в группе до 6 лет, потом в более младшей — 3-6 или 2-6 лет, последний этап — с двух месяцев до 2-3 лет. Первоначально оценивается иммунологическая эффективность, т.е. выработка антител и клеточного ответа, и безопасность — оценка побочных проявлений, которые возникают у привитых. Самые масштабные клинические исследования проводились в свое время в отношении инактивированной полиомиелитной вакцины и вакцин против ротавирусной инфекции, для оценки безопасности которых в исследование было включено более 50 тысяч детей.
Первоначально оценивается иммунологическая эффективность, т.е. выработка антител и клеточного ответа, и безопасность — оценка побочных проявлений, которые возникают у привитых. Самые масштабные клинические исследования проводились в свое время в отношении инактивированной полиомиелитной вакцины и вакцин против ротавирусной инфекции, для оценки безопасности которых в исследование было включено более 50 тысяч детей.
КИ пневмококковой вакцины были не только масштабны, но и отличались особой сложностью, так как проводились и на взрослых, и на всех группах детей от двух месяцев. После того как были получены доказательства безопасности и эффективности вакцины, результаты исследований передали в официальные инстанции для получения разрешения на ее медицинское применение. Когда вакцина зарегистрирована в стране, встает вопрос о ее включении в Национальный календарь профилактических прививок (НКПП). Основанием для этого решения являются, во-первых, эпидемиологические данные, предоставляемые Роспотребнадзором на основании результатов надзора за заболеваемостью и структурой циркулирующих возбудителей, поясняет Сусанна Харит. Эти данные получают от надзорных лабораторий Роспотребнадзора, а также вирусологических и микробиологических исследований. Они дополняются данными о тяжести заболевания, риске инвалидизации, смертности, группах риска, подверженных наиболее тяжелому течению инфекции. А также проводятся фармакоэкономические расчеты, в которых оцениваются прямые и непрямые затраты на лечение заболевания и его последствий, причем они сравниваются с затратами, необходимыми на проведение вакцинации.
Эти данные получают от надзорных лабораторий Роспотребнадзора, а также вирусологических и микробиологических исследований. Они дополняются данными о тяжести заболевания, риске инвалидизации, смертности, группах риска, подверженных наиболее тяжелому течению инфекции. А также проводятся фармакоэкономические расчеты, в которых оцениваются прямые и непрямые затраты на лечение заболевания и его последствий, причем они сравниваются с затратами, необходимыми на проведение вакцинации.
В отношении пневмококковой вакцины эксперты были единодушны: она, несомненно, сократит циркуляцию наиболее опасных пневмококков, вызывающих большую часть пневмоний, а также менингит, плеврит, сепсис, отит и другие тяжелые заболевания. Не последнюю роль в этом решении сыграли данные о том, что внедрение пневмококковой вакцины в иммунизационные программы для детей в других странах уже позволило предотвратить сотни тысяч случаев заболевания. По состоянию на 2022 год эта цифра уже превысила 175 миллионов по всему миру.
Пневмококковая вакцина серьезно изменила статистику заболеваемости и исходов пневмоний и ряда других опасных заболеваний
Специалисты Минздрава России с группой экспертов обсудили представленные данные и приняли консолидированное решение о целесообразности применения тринадцативалентной вакцины в рамках НКПП. Россия стала одной из 126 (на сегодня) стран, где вакцина применяется для обязательной иммунизации детей.
Такой сложный путь к пациентам проходят все новые вакцины. После этого начинается четвертая фаза КИ — дополнительные пострегистрационные исследования эффективности и безопасности после выхода лекарственного средства на рынок. Они нужны для того, чтобы понять, как работает препарат при широком медицинском применении. Здесь оценивают такие показатели, как эпидемиологическая эффективность (снижение заболеваемости у привитых по сравнению с непривитыми и формирование коллективного иммунитета, т.е. снижение заболеваемости у непривитых по сравнению с годами, предшествующими внедрению вакцины). Продолжается наблюдение за циркулирующими возбудителями, чтобы оценить, не произошло ли изменений, которые могут снизить эффективность вакцинации (все присутствующие в НКПП вакцины обязательно соответствуют текущей эпидемиологической обстановке в стране), а также ведется наблюдение за безопасностью препарата в реальной клинической практике.
Продолжается наблюдение за циркулирующими возбудителями, чтобы оценить, не произошло ли изменений, которые могут снизить эффективность вакцинации (все присутствующие в НКПП вакцины обязательно соответствуют текущей эпидемиологической обстановке в стране), а также ведется наблюдение за безопасностью препарата в реальной клинической практике.
— Это один из важнейших этапов, так как не все побочные проявления вакцинации можно выявить в КИ, — подчеркивает Сусанна Харит. — Это, например, такие редкие состояния, как анафилактический шок, частота которого составляет 1 случай на 100 тысяч доз, и подобные редкие ситуации.
— Во-первых, условия предрегистрационных КИ, даже масштабных, отличаются от условий использования вакцин в реальной практике, — поясняет Олег Мелихов. — Во-вторых, масштабное изучение на десятках и сотнях тысяч пациентов, получающих вакцину, позволяет выявить редко встречающиеся нежелательные реакции.
Отдельное исследование эффективности вакцины проводилось с участием представителей групп риска — пациентов с хроническими заболеваниями, у которых течение пневмококковой инфекции может вызвать жизнеугрожающие осложнения, увеличивающие вероятность летального исхода.
— Мы проводили исследования при сравнении конъюгированных и неконьюгированных вакцин против пневмококковой инфекции у нескольких групп пациентов, — рассказала «РГ» заведующая кафедрой терапии института дополнительного профессионального образования Южно-Уральского государственного медицинского университета, профессор Галина Игнатова. — Это были пациенты с хронической обструктивной болезнью легких (ХОБЛ), молодые пациенты с хроническим бронхитом, пациенты с бронхоэктазами, с ХОБЛ в сочетании с сердечной патологией, ХОБЛ с сахарным диабетом и пациенты с профессиональными заболеваниями легких. Некоторые исследования проводились 5 лет и более. Во всех была доказана эффективность вакцинации против пневмококка в уменьшении количества пневмоний, обострений ХОБЛ.
— До сих пор пневмококки ежегодно убивают до 1,2 миллиона человек в мире, — рассказал «РГ» ректор Смоленского государственного медуниверситета, президент Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии (МАКМАХ), профессор Роман Козлов. — После того как пневмококковая вакцина была включена в НКПП и уровень вакцинации стал превышать 80 процентов, снизилась циркуляция самых устойчивых к критически важным антибиотикам вариантов пневмококка, которые были включены в вакцину. Возник эффект их замещения другими — более чувствительными к современным препаратам. Это общемировой феномен, не только наш. Я не сомневаюсь, что этой вакциной надо прививать не только детей, но и подростков, и трудоспособных граждан. В особую когорту входят пожилые — это тоже группа риска. И чем больше людей будут вакцинированы, тем больше будет снижаться уровень потребления антибиотиков и резистентности к ним. И, конечно, снизятся показатели смертности от этой инфекции.
— После того как пневмококковая вакцина была включена в НКПП и уровень вакцинации стал превышать 80 процентов, снизилась циркуляция самых устойчивых к критически важным антибиотикам вариантов пневмококка, которые были включены в вакцину. Возник эффект их замещения другими — более чувствительными к современным препаратам. Это общемировой феномен, не только наш. Я не сомневаюсь, что этой вакциной надо прививать не только детей, но и подростков, и трудоспособных граждан. В особую когорту входят пожилые — это тоже группа риска. И чем больше людей будут вакцинированы, тем больше будет снижаться уровень потребления антибиотиков и резистентности к ним. И, конечно, снизятся показатели смертности от этой инфекции.
Эксперты солидарны: наличие в НКПП современной, проверенной и актуальной в текущей ситуации в стране пневмококковой вакцины позволяет защитить практически все группы населения «от мала до велика» и не только помогает справиться с бременем опасной инфекции сейчас, но и дает будущим поколениям эффективные антимикробные препараты.
Новая пневмококковая вакцина уже здесь! Почему это важно.
20 декабря 2019 г.
к
Марк Олдерсон, доктор философии (руководитель инициативы по бактериальным вакцинам, Центр доступа к вакцинам и инновациям, PATH)
и
Д-р Раджив Дере (исполнительный директор Индийского института сывороток, Pvt., Ltd.)
Африка
Америка
Азиатско-Тихоокеанский регион
Индия
Пневмония
Вакцины
Благодаря здоровому партнерству теперь доступна более доступная современная пневмококковая вакцина, которая поможет странам с недостаточным уровнем обслуживания получить доступ к защите от основной причины смертельной детской пневмонии.
Сотрудник Индийского института сывороток осматривает флаконы с вакцинами в подразделении компании по производству вакцин, где производятся PNEUMOSIL® и другие конъюгированные вакцины. Фото: PATH/Сатвир Малхотра.
Примечание редактора: эта статья была обновлена 1 ноября 2021 г., чтобы отразить новый прогресс в области пневмококковой вакцины.
Представьте, что сейчас 2008 год. Детская пневмококковая вакцина существует уже много лет и добилась невероятных успехов в борьбе с пневмонией и другими пневмококковыми заболеваниями (такими как менингит, сепсис и инвалидизирующие инфекции среднего уха). В Соединенных Штатах и других странах с высоким уровнем дохода, то есть.
Сотни тысяч детей по-прежнему без нужды умирают от пневмококковой инфекции в странах с низким и средним уровнем дохода. Такие барьеры, как цена и доступность вакцины, мешают им получить доступ к этому жизненно важному инструменту. Кроме того, вакцина еще не нацелена на некоторые из наиболее опасных видов (серотипов) пневмококковой бактерии для детей в этих частях мира.
Кроме того, вакцина еще не нацелена на некоторые из наиболее опасных видов (серотипов) пневмококковой бактерии для детей в этих частях мира.
В том же году Индийский институт сывороток, Pvt., Ltd. и PATH начали сотрудничество при финансовой поддержке Фонда Билла и Мелинды Гейтс, чтобы выполнить трудную работу по разработке пневмококковой вакцины, которая не только обеспечивает защиту детей в эти настройки необходимы, но разрушают внутренние ценовые барьеры для доступа.
Перейдем к сегодняшнему дню, и есть повод для волнения. Вакцина Института сывороток, которая была всего лишь амбициозной идеей более десяти лет назад, теперь прошла предварительную квалификацию Всемирной организации здравоохранения (ВОЗ) и доступна для использования в странах с низким и средним уровнем дохода всего за 2 доллара США за дозу, что является беспрецедентно низкой ценой для любой вакцины. пневмококковая вакцина. Он также разрешен для использования в Индии, и в других странах.
Каждый год более 300 000 детей в возрасте до пяти лет умирают во всем мире от пневмококковой инфекции, в основном в Африке и Азии. Предварительная квалификация ВОЗ открывает дверь для этой новейшей пневмококковой вакцины PNEUMOSIL®, чтобы укрепить инструментарий профилактики и выполнить свою задачу — спасти больше жизней, предоставив доступ, который страны в этих регионах могут себе позволить и поддерживать в долгосрочной перспективе.
Предварительная квалификация ВОЗ открывает дверь для этой новейшей пневмококковой вакцины PNEUMOSIL®, чтобы укрепить инструментарий профилактики и выполнить свою задачу — спасти больше жизней, предоставив доступ, который страны в этих регионах могут себе позволить и поддерживать в долгосрочной перспективе.
Почему цена так важна?
Пневмококковые вакцины, которые можно вводить детям, представляют собой конъюгированные вакцины, которые являются наиболее сложными в производстве видами вакцин и, как следствие, относительно дорогими. Например, в странах Панамериканской организации здравоохранения они стоили от 12,85 до 14,50 долларов США за дозу в зависимости от вакцины в 2020 году. И эти вакцины требуют как минимум трех доз для детей. Работая вместе через сложные механизмы финансирования, глобальные доноры здравоохранения и производители вакцин помогли пневмококковым конъюгированным вакцинам стать доступными для стран с низким уровнем дохода по значительно сниженным ценам, что позволило внедрить их в этих условиях с 2009 года. . Эта поддерживаемая цена сегодня составляет около 3 долларов США за дозу, которую страны оплачивают крупными взносами от Gavi, Альянса по вакцинам.
. Эта поддерживаемая цена сегодня составляет около 3 долларов США за дозу, которую страны оплачивают крупными взносами от Gavi, Альянса по вакцинам.
Несмотря на то, что такая поддержка обеспечила более широкий доступ и спасла бесчисленное количество жизней, многим странам с низким доходом по-прежнему трудно поддерживать программы вакцинации против пневмококка из-за их стоимости, и они подвергаются еще большему риску после того, как страны перестанут получать финансовую поддержку Гави. Другие страны, не имеющие права на финансовую поддержку (особенно страны со средним уровнем дохода), никогда даже не включали пневмококковые вакцины в свои национальные программы иммунизации, в том числе из-за непомерно высоких цен. На оплату пневмококковых вакцин также расходуется непропорционально большое количество донорских ресурсов по сравнению с другими вакцинами — например, почти половина финансирования Gavi на приобретение вакцины.
В целом, целевая цена PNEUMOSIL® в размере 2 долларов за дозу примерно на 30% ниже, чем цена Гави, и значительно ниже для стран с низким и средним уровнем дохода, не входящих в Гави. Для этой успешной вакцины Институт сывороток оптимизировал более эффективные процессы производства конъюгированных вакцин, которые, в свою очередь, также применили для снижения цены на PNEUMOSIL®. В целом, инновации в технологии конъюгации PNEUMOSIL® и разработка процесса для получения очень высоких выходов в значительной степени способствовали более быстрому производству больших объемов вакцины и помогли существенно снизить цены.
Для этой успешной вакцины Институт сывороток оптимизировал более эффективные процессы производства конъюгированных вакцин, которые, в свою очередь, также применили для снижения цены на PNEUMOSIL®. В целом, инновации в технологии конъюгации PNEUMOSIL® и разработка процесса для получения очень высоких выходов в значительной степени способствовали более быстрому производству больших объемов вакцины и помогли существенно снизить цены.
Выбор наиболее подходящих серотипов для применения PNEUMOSIL® также был ключом к минимизации затрат. Пневмококк имеет более 90 серотипов, которые варьируются в зависимости от региона, но конъюгированные вакцины могут охватывать лишь ограниченное их количество. Поскольку каждый серотип, добавленный в конъюгированную вакцину, увеличивает стоимость, те, которые включены в PNEUMOSIL®, входят в число 10 наиболее вероятно вызывающих заболевания и смерть детей в Африке, Азии и Латинской Америке. Это максимизирует охват там, где вакцина предназначена для распространения, без дополнительных затрат на ненужные серотипы. Таким образом, охват PNEUMOSIL® в этих регионах оценивается как сравнимый с другими прошедшими предварительную квалификацию пневмококковыми вакцинами, представленными на рынке.
Таким образом, охват PNEUMOSIL® в этих регионах оценивается как сравнимый с другими прошедшими предварительную квалификацию пневмококковыми вакцинами, представленными на рынке.
Преквалификация ВОЗ открывает двери для этой вакцины, чтобы спасти больше жизней, предоставляя доступ, который страны могут себе позволить и поддерживать в долгосрочной перспективе.
А затем было еще три
Две другие пневмококковые вакцины для детей в настоящее время прошли предварительную квалификацию ВОЗ и эффективны для предотвращения заболеваний, вызываемых серотипами пневмококка, от которых они предназначены. Однако достижение преквалификации ВОЗ для нового PCV не так просто. С момента первоначального лицензирования первой ПКВ несколько десятилетий назад только одному другому производителю вакцин удалось достичь этой цели. Чтобы пройти предварительную квалификацию ВОЗ, вакцина должна соответствовать международным стандартам качества производства и хорошо зарекомендовать себя в серии строгих доклинических и клинических испытаний, предназначенных для демонстрации безопасности и приемлемого иммунного ответа.
Соответственно, PNEUMOSIL® прошел необходимые программы клинических исследований, спонсируемые Институтом сывороток в Индии и PATH в Гамбии, при этом результаты исследования фазы 3 в Гамбии подтверждают безопасность вакцины и способность вызывать сопоставимые иммунные реакции младенцев на предварительно квалифицированную вакцину. Короче говоря, это означает, что вакцина, как ожидается, будет работать наравне с другими вакцинами в своем классе, расширяя набор вариантов, из которых могут выбирать страны.
После предварительной квалификации ВОЗ PNEUMOSIL® также получил разрешение на продажу в Индии в 2020 году, позволяющее продавать вакцину в стране. Вскоре после этого она присоединилась к предшествующим пневмококковым вакцинам, предлагаемым в рамках Обязательства по расширению рынка пневмококковой вакцины — инновационного механизма финансирования, который помогает производителям вакцин производить и поставлять подходящие и доступные вакцины для стран с низким уровнем дохода, отвечающих требованиям Гави.
Что теперь?
Выйдя на мировой рынок, пришло время приступить к дополнительной работе, которая поможет PNEUMOSIL® в полной мере реализовать свой потенциал и влияние на общественное здравоохранение. В этом ключе PATH и партнеры в Гамбии вносят последние штрихи в клиническое исследование для изучения дополнительной схемы дозирования, рекомендованной ВОЗ. Распространение информации об этом новом дополнении к инструментарию также важно для того, чтобы страны могли принимать обоснованные решения в отношении профилактики пневмококковой инфекции и других приоритетов общественного здравоохранения. Также потребуются дополнительные исследования для оценки эффективности вакцины после лицензирования и в реальной жизни для предотвращения пневмококковой инфекции после ее достаточного распространения среди населения.
Теперь, после более чем десятилетия напряженной работы, у нас наконец есть новый инструмент, который может помочь преодолеть некоторые из самых постоянных препятствий на пути профилактики пневмококковых заболеваний. Давайте позаботимся о том, чтобы использовать его с пользой.
Давайте позаботимся о том, чтобы использовать его с пользой.
1 ноября 2021 г.
Что пневмония может рассказать нам о COVID-19
10.11.2017
Кружка и миссия — защита детей от пневмонии
10 ноября 2017 г.
Пневмококковые вакцины, разработанные для стран, которые в них больше всего нуждаются
GSK приобретает биофармацевтическую компанию Affinivax, Inc., находящуюся на клинической стадии.
Только для инвесторов и СМИ
Выдано: 31 мая 2022 г., Лондон, Великобритания — объявление Лондонской фондовой биржи
- GSK выплатит 2,1 миллиарда долларов авансом и до 1,2 миллиарда долларов в качестве возможных этапов разработки
- Предлагаемое приобретение обеспечивает доступ к 24-валентной пневмококковой вакцине-кандидату следующего поколения, находящейся на этапе II разработки, и инновационной технологии MAPS TM
- Поддерживает разработку обширного портфеля инновационных вакцин и специальных лекарств
GSK plc (LSE/NYSE: GSK) сегодня объявила о заключении окончательного соглашения о приобретении Affinivax, Inc. (Affinivax), биофармацевтической компании клинической стадии, базирующейся в Кембридже, Бостон, Массачусетс, за 2,1 миллиарда долларов авансом. платеж и до 1,2 миллиарда долларов в виде потенциальных вех развития. Affinivax является пионером в разработке нового класса вакцин, наиболее передовой из которых является пневмококковая вакцина нового поколения.
(Affinivax), биофармацевтической компании клинической стадии, базирующейся в Кембридже, Бостон, Массачусетс, за 2,1 миллиарда долларов авансом. платеж и до 1,2 миллиарда долларов в виде потенциальных вех развития. Affinivax является пионером в разработке нового класса вакцин, наиболее передовой из которых является пневмококковая вакцина нового поколения.
Пневмококковая инфекция включает пневмонию, менингит, инфекции кровотока и более легкие заболевания, такие как синусит и средний отит, и остается серьезной неудовлетворенной медицинской потребностью, несмотря на доступность современных пневмококковых вакцин. Существует множество различных серотипов пневмококка. Количество серотипов в современных вакцинах ограничено из-за степени иммунологического вмешательства, наблюдаемого при использовании существующих технологий конъюгации.
Компания Affinivax разработала Систему представления множественных антигенов (MAPS), новую технологию, которая поддерживает более высокую валентность, чем традиционные технологии конъюгации, обеспечивая более широкий охват против распространенных серотипов пневмококка и потенциально обеспечивая более высокую иммуногенность, чем существующие вакцины. Самая передовая кандидатная вакцина Affinivax (AFX3772) включает 24 пневмококковых полисахарида плюс два консервативных пневмококковых белка (по сравнению с 20 серотипами в одобренных в настоящее время вакцинах). 30-валентная пневмококковая вакцина-кандидат также находится в стадии доклинической разработки.
Самая передовая кандидатная вакцина Affinivax (AFX3772) включает 24 пневмококковых полисахарида плюс два консервативных пневмококковых белка (по сравнению с 20 серотипами в одобренных в настоящее время вакцинах). 30-валентная пневмококковая вакцина-кандидат также находится в стадии доклинической разработки.
Доктор Хэл Бэррон, главный научный сотрудник и президент по исследованиям и разработкам GSK, сказал : «Предлагаемое приобретение еще больше укрепит нашу линию исследований и разработок вакцин, предоставит доступ к новой, потенциально революционной технологии и расширит существующее научное присутствие GSK в районе Бостона. . Мы рассчитываем на сотрудничество со многими талантливыми людьми в Affinivax, чтобы объединить наши ведущие в отрасли возможности разработки, производства и коммерциализации, чтобы сделать эту захватывающую новую технологию доступной для тех, кто в ней нуждается».
В клинических испытаниях фазы I/II у взрослых AFX3772 хорошо переносился участниками и продемонстрировал хороший иммунный ответ по сравнению с текущим стандартом лечения. В июле 2021 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США присвоило AFX3772 статус прорывной терапии для предотвращения инвазивного заболевания S. pneumoniae и пневмонии у взрослых в возрасте 50 лет и старше. Ожидается, что этап III начнется в ближайшее время. Клинические испытания фазы I/II для оценки использования вакцины в педиатрии планируется начать в конце этого года.
В июле 2021 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США присвоило AFX3772 статус прорывной терапии для предотвращения инвазивного заболевания S. pneumoniae и пневмонии у взрослых в возрасте 50 лет и старше. Ожидается, что этап III начнется в ближайшее время. Клинические испытания фазы I/II для оценки использования вакцины в педиатрии планируется начать в конце этого года.
«Компания Affinivax возникла благодаря научному и личному видению наших основателей, стремящихся продвигать инновации в области вакцин, чтобы оказывать существенное влияние на жизнь людей как в развитых, так и в развивающихся странах», — сказал Стивен Бруггер, генеральный директор Affinivax, Inc . «За последние восемь лет мы перенесли это видение с начальной разработки нашей вакцинной платформы MAPS ™ в Бостонской детской больнице до разработки новых вакцин с нашим ведущим кандидатом на вакцину на поздних стадиях клинических исследований. Мы гордимся тем, что GSK признала достижения нашей команды, и уверены, что GSK является идеальным новым домом для нашей платформы MAPS и команды, стоящей за ее успехом. Значительные возможности GSK позволят продолжить работу с MAPS для улучшения существующих вакцин — как в случае с нашей ведущей программой вакцины против Streptococcus pneumoniae — и разработать вакцины для борьбы с новыми и устойчивыми инфекционными заболеваниями, для которых сегодня нет эффективных стратегий иммунизации».
Значительные возможности GSK позволят продолжить работу с MAPS для улучшения существующих вакцин — как в случае с нашей ведущей программой вакцины против Streptococcus pneumoniae — и разработать вакцины для борьбы с новыми и устойчивыми инфекционными заболеваниями, для которых сегодня нет эффективных стратегий иммунизации».
Финансовые вопросы
По условиям соглашения GSK приобретет 100% находящихся в обращении акций Affinivax. Вознаграждение за приобретение включает в себя авансовый платеж в размере 2,1 миллиарда долларов США, который должен быть выплачен после закрытия сделки, и два потенциальных промежуточных платежа в размере 0,6 миллиарда долларов США, которые должны быть выплачены после достижения определенных этапов педиатрической клинической разработки. Сделка подлежит обычным условиям закрытия, включая истечение или досрочное прекращение периода ожидания в соответствии с Законом Харта-Скотта-Родино об улучшении антимонопольного законодательства от 1976. Ожидается, что сделка будет закрыта в третьем квартале 2022 года.
Ожидается, что сделка будет закрыта в третьем квартале 2022 года.
GSK будет учитывать сделку как объединение бизнеса.
Новый GSK подтверждает свой прогноз на весь 2022 год и среднесрочный прогноз на 2021–2026 годы, согласно которому продажи превысят 5 %, а скорректированная операционная прибыль составит 10 % CAGR* при CER**.
* CAGR: совокупный годовой темп роста; **CER: постоянный обменный курс
Пневмококковая инфекция
Бактерия Streptococcus pneumoniae вызывает пневмококковую инфекцию. Существует несколько типов пневмококковой инфекции, включая инфекции кровотока (сепсис), пневмонию, менингит и другие более легкие заболевания, такие как синусит и средний отит. Значительная неудовлетворенная медицинская потребность остается, несмотря на наличие современных вакцин. Пневмококковая пневмония ежегодно вызывает примерно 150 000 госпитализаций в Соединенных Штатах; пневмококковый менингит и бактериемия унесли жизни примерно 3250 человек в США в 2019 году. [1] .
[1] .
MAPS TM технологическая платформа
Мультиантигенпрезентирующая система (MAPS) — это новая и высокоэффективная технологическая платформа вакцин, белковых антигенов в одной вакцине. Иммунизация полученными комплексами полисахарид-белок индуцирует широкий и потенциально защитный В-клеточный (антитело) ответ на полисахариды и отдельный В-клеточный и Т-клеточный иммунный ответ на белки. Отличительная особенность MAPS по принципу «подключи и работай» позволяет нацеливаться на широкий спектр инфекционных заболеваний.
Первоначальное использование технологии было направлено главным образом на профилактику пневмококковой инфекции. Применимость технологии также была продемонстрирована для других возбудителей инфекционных заболеваний, в том числе тех, которые вызывают внутрибольничные инфекции.
О компании GSK
GSK — международная компания в области здравоохранения, основанная на науке.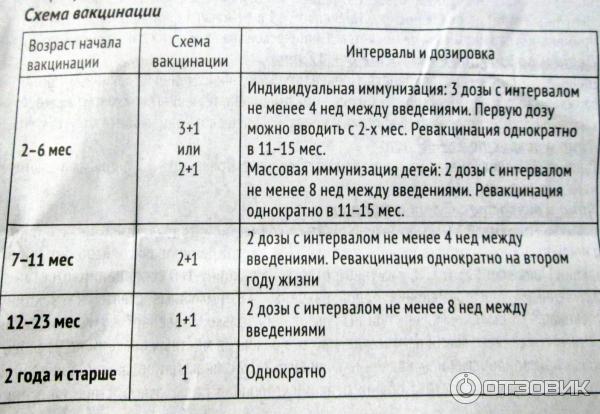

 прививки проводятся сразу после нормализации температуры. При наличии слабовыраженных симптомов простуды не следует откладывать вакцинацию.
прививки проводятся сразу после нормализации температуры. При наличии слабовыраженных симптомов простуды не следует откладывать вакцинацию.