Содержание
Зачем Moderna вакцина от ВИЧ, которая не поможет — Перспективы новых исследований
Зачем Moderna вакцина от ВИЧ, которая не поможет — Перспективы новых исследований
08.02.2022
27 января компания Moderna объявила о начале I фазы клинических исследований (КИ) связки вакцины/усилителя eOD-GT8 60mer (mRNA-1644)/Core-g28v2 (mRNA-1644v2-Core).
Если не вдаваться в детали, то эта та же технология, что применена при создании мРНК вакцины Moderna (и Pfizer) против COVID-19. eOD-GT8 60mer — РНК репликон иммуногена, инкапсулированный в липидную наночастицу. Данная конструкция запускает каскад событий, в которых участвуют B-лимфоциты человека, и итогом становится продукция gp120-специфические антител широкого спектра, которые, в свою очередь, способны блокировать ВИЧ. Core-g28v2 — абсолютно аналогичная структура, но в финале воздействие должно запускать продукцию антител широкого спектра к другому белку ВИЧ, что, по задумке исследователей, должно усилить качество иммунного ответа.
История открытия антител широкого спектра (bNAbs) против ВИЧ начинается в 1990 году. Первое активное антитело было описано уже в 1994, с тех пор счет идет на десятки, а обобщены данные о нейтрализующих антителах против ВИЧ на ресурсе bNAber.
Попытки использовать такие антитела как терапевтическую вакцину происходили не раз, но особым успехом не увенчались — антитела довольно быстро исчезали, они «накрывали» далеко не все варианты ВИЧ, а их эффективность также была недостаточной — классические подходы явно не работали в полной мере. Рекомбинантные вакцины первой волны точно так же «не взлетели» как и векторные технологии: лучшее, что удалось получить тут — векторная вакцина RV144, чей «недолет» был все же невероятно вдохновляющим.
Разработка eOD-GT8 60mer была закончена еще в 2018 году в некоммерческой исследовательской компании Scripps Research, в их Центре нейтрализующих антител IAVI под руководством William Schief. Идея eOD-GT8 60mer не нова — получить в крови bNAbs против ВИЧ, антитела широкого спектра, однако реализация в этот раз иная — доставить предельно точные и окончательные инструкции B-клеткам, чтобы они сами, огромной массой, производили эти антитела, и ровно в том виде, как задумано создателями, а не по своему «разумению». И идея разработки именно в создании терапевтической вакцины, а не профилактический, и тем более не средства для окончательного решения проблемы ВИЧ-инфекции.
И идея разработки именно в создании терапевтической вакцины, а не профилактический, и тем более не средства для окончательного решения проблемы ВИЧ-инфекции.
Почему же данная разработка лежала в столе несколько лет? Окно возможностей открыла пандемия COVID. Произошел слом скепсиса и настороженности в отношении мРНК-вакцин, данный подход стал своего рода мейнстримом, открыв путь к запуску вакцин на данной технологии от гриппа, малярии, онкологических заболеваний, ВИЧ и так далее. Moderna, и многие другие компании, не замедлили воспользоваться такой возможностью.
Момент выбран верно, ресурсы, накопленные за время пандемии, колоссальные — время делать задел на будущее.
Что тут может смущать? Некоторая революционность, а не эволюционный характер процесса: довольно очевидно, что если бы не пандемия, технологии на базе мРНК шли бы к практическому применению медленно, годы, и, скорее пришли бы в более продвинутом виде. Не вызывает большого оптимизма и сама механика: подход с использованием антител широкого спектра действия в текущем виде имеет довольно понятные ограничения — любые антитела не будут воздействовать на покоящиеся клетки и провирусную ДНК ВИЧ, антитела не попадут за гистогематические барьеры, то есть нет никаких сомнений в том, что текущий технологический уровень не даст окончательного решения. Лучшее, на что мы можем рассчитывать, — новый терапевтический подход с периодическими инъекциями, который в сочетании с антиретровирусными препаратами позволит осуществлять подавление ВИЧ.
Лучшее, на что мы можем рассчитывать, — новый терапевтический подход с периодическими инъекциями, который в сочетании с антиретровирусными препаратами позволит осуществлять подавление ВИЧ.
Почему это важно? Это важно для акционеров Moderna — такая передовая разработка в портфеле будет увеличивать капитализацию компании не один год. Это важно для развития технологии и фундаментальных изысканий — это очень новая сфера, острие прогресса науки, где есть неиллюзорные шансы на великие открытия. Да, мы осознаем, что вакцина Moderna от ВИЧ почти наверняка не станет прорывом и не изменит «правил игры» в проблеме ВИЧ.
Весьма вероятно, что разработка вовсе не увенчается продуктом, однако в процессе будут точно получены ценнейшие знания в одной из самых важных сфер биотехнологии, и это не может не вдохновлять — еще один шаг на пути поиска Святого Грааля биотеха.
Источники:
-
IAVI Announces Clinical Trial of Next-Generation HIV Vaccine Candidate Designed to Induce Antibodies to Block HIV Infection. October 8, 2018, iavi.org. https://www.iavi.org/news-resources/press-releases/2018/iavi-announces-clinical-trial-of-next-genera…;
October 8, 2018, iavi.org. https://www.iavi.org/news-resources/press-releases/2018/iavi-announces-clinical-trial-of-next-genera…; -
Eroshkin AM, LeBlanc A, Weekes D, et al. bNAber: database of broadly neutralizing HIV antibodies. Nucleic Acids Res. 2014;42(Database issue):D1133-D1139. doi:10.1093/nar/gkt1083; -
J&J vaccine fails to protect women against HIV infection, September 1, 2021. pharmaphorum.com. https://pharmaphorum.com/news/jj-vaccine-fails-to-protect-women-against-hiv-infection/; -
Gray GE, Bekker LG, Laher F, et al. Vaccine Efficacy of ALVAC-HIV and Bivalent Subtype C gp120-MF59 in Adults. N Engl J Med. 2021;384(12):1089-1100. doi:10.1056/NEJMoa2031499; -
IAVI (https://www.iavi.org/news-resources/press-releases/2018/iavi-announces-clinical-trial-of-next-genera…; -
eOD-GT8 60mer – IAVI; -
eOD-GT8 60mer — IAVI. Phase I trial to evaluate safety and immunogenicity of vaccine candidate engineered to elicit targeted immune response against HIV.
Автор:
Врач-психиатр, редактор проекта hiv.plus Илья Антипин.
Возврат к списку
Далеко ли до вакцины от ВИЧ?
about hiv
Какие бывают вакцины. Как работает иммунный ответ. Разработки вакцины. Почему до сих пор не создали вакцину от ВИЧ-инфекции.
Перед тем как говорить о вакцине против ВИЧ, стоит начать с более общего вопроса: что мы понимаем под прививками и вакцинами с научной точки зрения?
По механизму возникновения иммунитет делится на два вида: врожденный и приобретенный. Первый есть у каждого человека с рождения, он выработан эволюционно. Благодаря нему человек не болеет многими болезнями, которыми, например, страдают животные.
Второй возникает в течение жизни и у каждого может отличаться в зависимости от того, с какими возбудителями человеку довелось встретиться.
Приобретенный иммунитет может быть активным (он возникает вследствие реакции организма на перенесенную болезнь, присутствие возбудителя в организме), а может быть пассивным, когда антитела, например, передаются от матери ребенку во время беременности.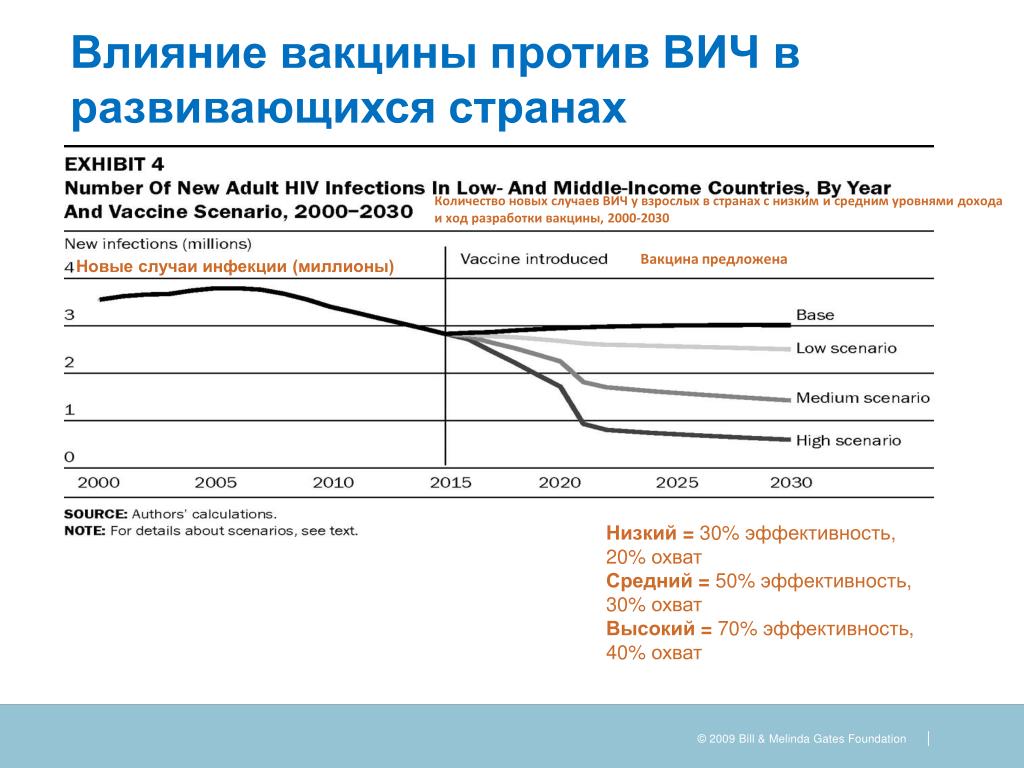
Пока мы не знаем точно, как возникает приобретенный активный иммунитет к ВИЧ-инфекции и сколько он держится, но знаем, что антитела к ней вырабатываются (даже несмотря на то, что организм самостоятельно не в силах справиться с ВИЧ).
Именно по этим антителам, как правило, и ставится диагноз, если мы пользуемся экспресс-тестами. В случае с ВИЧ существует и пассивный иммунитет. Но при передаче вируса от матери ребенку, к сожалению, он не обладает достаточным защитным эффектом.
Еще одно направление — это искусственный иммунитет. Он тоже бывает активным и пассивным. Пассивный — это иммуноглобулины, выработанные либо у лабораторных животных, либо у других иммунизированных лиц, и сыворотки. Активный же достигается собственно путем вакцинации.
Какие бывают вакцины?
Вакцина — это биологический препарат, как правило, либо «убитый», либо живой, но ослабленный возбудитель болезни. Основная цель его введения в организм — и есть создание искусственного активного иммунитета.
Вакцины бывают профилактические (защитные) и лечебные. Они различаются по типу воздействия на организм и по своим результатам.
Пассивный иммунитет возникает быстрее, сразу после того, как в организм ввели чужие антитела. Однако он бывает совсем недолговременным. Активный иммунитет держится долго, чаще — пожизненно, но и возникает не сразу.
Иммунный ответ: как это все работает?
Чтобы понять, как работает наш естественный иммунитет и почему организм сам не может справиться с ВИЧ-инфекцией, необходимо разобраться с тем, что такое иммунный ответ.
Ученые обычно говорят о гуморальном и клеточном иммунитете. Принцип работы гуморального заключается в следующем: в нашем организме есть специальные клетки — лимфоциты. Они постоянно циркулируют в крови и проверяют все, что попадается им на пути, по принципу свой/чужой.
Как правило, организм знает заранее, как свои клетки отличить от чужеродных. Делает он это, ориентируясь по так называемым «антигенам» — белкам с поверхности вируса. Когда лимфоциты, а вернее их подтип, известный как В-клетки, встречают вирус, соединившись с ним, они передают информацию, что в крови обнаружен какой-то чужеродный остальным клеткам агент, и превращаются либо в «плазматические клетки», вырабатывающие антитела, которые потом соединятся с возбудителем-вирусом и убьют его, либо в «клетки памяти». Они остаются в организме, даже когда мы выздоравливаем, и играют роль своеобразной «библиотеки».
Когда лимфоциты, а вернее их подтип, известный как В-клетки, встречают вирус, соединившись с ним, они передают информацию, что в крови обнаружен какой-то чужеродный остальным клеткам агент, и превращаются либо в «плазматические клетки», вырабатывающие антитела, которые потом соединятся с возбудителем-вирусом и убьют его, либо в «клетки памяти». Они остаются в организме, даже когда мы выздоравливаем, и играют роль своеобразной «библиотеки».
Если организм успешно справился с болезнью, благодаря этим клеткам он запоминает «врага», и при новой встрече с ним реагирует гораздо быстрее. Обычно на весь процесс — от встречи до выработки антител — уходит от нескольких недель до месяцев.
Например, антитела к ВИЧ-инфекции появляются где-то через месяц после заражения, соответственно, все это время вирус может циркулировать в организме. Почему они неэффективны? Во-первых, потому что появляются слишком поздно.
Во-вторых, потому что вирус, с которым мы имеем дело, очень изменчив. Если даже В-клетки обнаружили его антиген, выработали к нему антитела, способные нейтрализовать заразу, то за время, которое ушло на все это, сам вирус успевает мутировать и оказаться неуязвимым для выработанного организмом оружия.
Когда мы говорим о клеточном иммунитете, речь идет об уничтожении тех вирусов, которые преодолели гуморальный барьер и успели забраться в саму клетку.
В нем участвуют уже другие клетки: Т-лимфоциты, к ним относятся в том числе известные CD4 и CD8. Они действуют не против возбудителей, циркулирующих в крови, а распознают «измененную», то есть зараженную вирусом клетку, и разрушают ее.
Клетки CD4 частично регулируют весь процесс и выполняют функцию клеток памяти. Их принято называть хелперами. CD8 — собственно занимаются уничтожением, за это их зовут киллерами.
ВИЧ — единственный вирус, который поражает не просто клетки организма, а собственно клетки иммунной системы. Той самой, которая с вирусом должна, по идее, бороться.
Несмотря на то, что ВИЧ поражает не киллеры, а клетки CD4, то есть хелперы, в случае с ВИЧ-инфекцией возникает порочный круг. При попытке избавиться от «врага» самостоятельно организм активирует систему уничтожения вирусов, в том числе и CD4-клетки, а вместе с тем, стало быть, активирует и дупликацию вируса.
Именно поэтому против ВИЧ-инфекции иммунитет не может сработать так, как это было бы с любым другим вирусом.
Какие возникают трудности при создании вакцины против ВИЧ?
На данный момент в рамках более ста испытаний уже протестировано более сорока видов вакцин с участием тысяч добровольцев, и есть целая система, в которой регистрируются все исследования по вакцинации от ВИЧ.
Последнее время в разного рода СМИ регулярно появляется информация, что той или иной компанией разрабатывается новая вакцина против ВИЧ. Однако обнадеживающих результатов не так уж и много. Почему?
Лучшая из существующих вакцин, которая дошла до третьей фазы исследований, показала свою защитную эффективность только в 60 % случаев в течение одного года, а в течение уже трех лет — только в 30 %. Это очень мало для вакцины. Она должна давать до 90 % эффективности.
И связано это с тем, что существует ряд препятствий для создания вакцины от ВИЧ-инфекции. Во-первых, такая вакцина не может состоять из ослабленного или живого вируса, как многие другие. Если ввести даже одну-две частицы ВИЧ в организм, это вызовет не иммунный ответ, а инфицирование организма.
Во-первых, такая вакцина не может состоять из ослабленного или живого вируса, как многие другие. Если ввести даже одну-две частицы ВИЧ в организм, это вызовет не иммунный ответ, а инфицирование организма.
Во-вторых, и мы об этом уже сказали, вирус находится внутри CD4-лимфоцитов. Мы пока не научились извлекать вирус из клетки, не повреждая ее саму. И на данный момент до конца не понимаем, какие именно механизмы могли бы обеспечить полную защиту от ВИЧ-инфекции.
В-третьих, многие вакцины пока разрабатываются, испытываются на подопытных животных: мышах, свиньях. В случае с ВИЧ кроме обезьян, на которых можно было бы воспроизвести инфекцию, у нас нет подходящих подопытных животных, результаты работы с которыми можно было бы легко перенести на человека.
Исследования на людях дороги и имеют ряд этических ограничений. Можно было бы привить группу здоровых добровольцев, но инфицировать их, чтобы проверить, как работает вакцина, врачи не могут. Ни один подопытный на такое не согласится. А вдруг вакцина не сработает?
А вдруг вакцина не сработает?
Более того, врачи не имеют права провоцировать рискованное поведение своих пациентов: дать вакцину и рекомендовать прекратить пользоваться презервативами, или попросить использовать по возможности нестерильные инструменты. «Вы попробуйте, а мы посмотрим!»
Разработки вакцины. Дорожная карта
Тем не менее ученым уже удалось выработать основные направления в иммунотерапии ВИЧ-инфекции. С одной стороны — это попытка активации специфического иммунитета, который не срабатывает при естественном течении ВИЧ-инфекции. С другой стороны — профилактическая пассивная иммунизация.
Что значит пассивная? Мы подозреваем, что существуют люди, которые не инфицируются ВИЧ даже при достаточно частом контакте с вирусом. Видимо, у них возникает хороший иммунный ответ, и иммунная система справляется с вирусом самостоятельно. А значит, мы можем попытаться либо взять у уже иммунизированных лиц готовые антитела, либо создать их генно-инженерным путем, чтобы потом ввести в организм.
Клинические исследования в области ВИЧ-инфекции по пассивной иммунизации начались еще в начале 80-х годов, то есть одновременно с обнаружением самого вируса.
И самые большие ставки в случае с пассивным иммунитетом сейчас делаются на так называемые «нейтрализующие антитела широкого спектра действия». Это антитела, которые были впервые обнаружены и описаны в 2001 году.
Они встречаются как раз у того типа пациентов, который мы только что назвали. В эксперименте на животных было показано: если у организма есть эти антитела, даже в случае нарочного введения вируса заражения не происходит.
Интересно, что эти антитела не убивают вирус, но они могут с ним соединяться, блокируя его рецепторы, как бы окружая и покрывая вирус, не давая ему обычным способом проникнуть в клетку. Через какое-то время вирус, не найдя клетки, где он может размножиться, погибает.
Предполагается, что, если именно эти антитела удастся искусственно синтезировать либо «вырастить» в организме уже иммунизированных животных, а потом перевезти их или каким-то образом ввести здоровым людям, это может предотвратить развитие ВИЧ-инфекции.
Что касается «активного» иммунитета, в 2017 году было начато исследование, оно проводится в странах Африки, где самая высокая распространенность ВИЧ, и в его рамках в ближайшие годы предполагается привить около 2 600 сексуально активных женщин в возрасте от 16 до 35 лет.
Суть этой экспериментальной вакцины заключается в том, что состоит она из двух разных антигенов, синтезированных искусственно, но идентичных белкам настоящего вируса.
Искусственная комбинация белков не может сама по себе вызвать развитие инфекции, но, по идее, должна вызвать развитие антител — такое, каким бы оно было в норме при попадании вируса в организм.
В течение первых 12 месяцев исследования каждая из женщин, участвующих в нем, получит шесть инъекций: три инъекции — в течение первого месяца и по одной — каждый последующий.
Первые результаты ожидаются где-то к 2021 году. Однако здесь есть нюансы: белки, с которыми работают ученые в рамках указанного исследования, аналогичны для субтипа ВИЧ, распространенного в Африке, но редко встречающегося у нас, в России.
Когда человечество приступит к разработке подобной вакцины против «российского ВИЧ», пока сказать сложно. Однако очевидно, что не в ближайшие месяцы.
Итоги: ДКП, ПКП, АРВТ
Возвращаясь к поставленному вопросу: далеко ли нам до вакцины против ВИЧ? То есть «прививки»? Далеко.
В настоящее время есть некоторые инфекции, которые человечество эффективно научилась контролировать с помощью вакцинации, а некоторые и вовсе победить, как оспу. Но рассчитывать на скорый результат в случае с ВИЧ пока не приходится.
Возможно, комбинация всех перечисленных подходов, пассивного и активного иммунитета, одновременно сможет стать эффективной, чтобы оказывать профилактическое воздействие.
Однако пока в контексте ВИЧ-инфекции действовать нам придется на популяционном уровне — традиционными способами профилактики распространения заболевания. В первую очередь это: практики более безопасного сексуального поведения, использование стерильных инструментов во всех медицинских сферах, доконтактная профилактика, постконтактная профилактика и эффективная антиретровирусная терапия.
Вернуться к оглавлению раздела
let’s become friends?
- footer.viber
- read
- join
- read
read also
АРВТ и гормональные контрацептивы
Как правильно сочетать контрацептивы и лекарства от ВИЧ?
Что нужно знать о «химсексе»?
Химсекс и гепатит С. Метамфетамин, мефедрон и бутират. ВИЧ и факторы риска для МСМ.
Исследователи из Медицинской школы Дьюка получают грант в размере 25,9 млн долларов на исследования вакцины против ВИЧ
Институт человеческих вакцин Дьюка борется с эпидемией, которая унесла 40,1 миллиона жизней и продолжает поражать еще десятки миллионов людей по всему миру.
Гвидо Феррари, профессор хирургии и профессор-исследователь молекулярной генетики и микробиологии, и Уилтон Брайан Уильямс, адъюнкт-профессор хирургии и медицины и доцент иммунологии, в настоящее время возглавляют исследовательский проект между Дьюком и несколькими другими университетами, известный как Консорциум для инновационных исследований вакцины и лечения ВИЧ / СПИДа (CIAVCR). Пара тестировала вакцины-кандидаты на макаках-резусах, инфицированных обезьяньим вирусом иммунодефицита человека, и недавно помогла DHVI получить 25,9 долларов.миллионный грант на проект из-за того, что один из кандидатов на вакцину показал потенциал.
Пара тестировала вакцины-кандидаты на макаках-резусах, инфицированных обезьяньим вирусом иммунодефицита человека, и недавно помогла DHVI получить 25,9 долларов.миллионный грант на проект из-за того, что один из кандидатов на вакцину показал потенциал.
Уильямс надеется, что вакцины-кандидаты могут привести к клиническим результатам, но также отметил, что потребуется время, чтобы перенести существующие результаты с животных моделей на людей.
«В конечном счете мы и другие хотим положить конец пандемии ВИЧ, потому что эта пандемия продолжается уже много лет, — сказал Уильямс. «Но нам бы очень хотелось увидеть доказательство того, что одна эффективная вакцина может предотвратить заражение людей».
В настоящее время около 38,4 миллиона человек во всем мире живут с ВИЧ, но возможности лечения ограничены, и большинство жертв принимают антиретровирусное лечение (АРТ) или прививки от ВИЧ. АРТ требует, чтобы пациенты ежедневно принимали лекарства для подавления вирулентности в организме и замедления разрушения ВИЧ Т-лимфоцитов CD4.
По данным CDC, люди могут перейти на прививки от ВИЧ только в том случае, если в их организме содержится неопределяемая вирусная нагрузка. Но в то время как прививки могут временно помочь уменьшить побочные эффекты, профилактические вакцины уменьшат потребность в прививках, в первую очередь предотвратив инфекцию.
В 1984 году, через три года после сообщения о первом случае СПИДа, было объявлено, что вакцина против ВИЧ будет готова для испытаний через два года.
Несмотря на глобальные усилия с тех пор, такая профилактическая вакцина не была разработана. В глобальном масштабе один из самых многообещающих результатов испытаний вакцины против ВИЧ был получен в Таиланде с RV144 в 2009 году, в котором приняли участие 16 000 человек, и на его завершение ушло три года. Эффективность вакцины составила около 31%, она не соответствовала стандартам для использования вне испытаний, но по-прежнему первой продемонстрировала признаки защиты от ВИЧ.
С тех пор, как было проведено испытание RV144, исследователи работали над созданием профилактической вакцины и усовершенствованием потенциальных методов лечения. Исследователи из Duke участвовали в разработке вакцины против ВИЧ на протяжении десятилетий, например, Центр иммунологии вакцины против ВИЧ/СПИДа, открытый в 2005 году. . Феррари сказал, что они смогли получить средства в основном потому, что продемонстрировали, что один из их кандидатов на вакцину показал себя многообещающе и что им нужны средства для улучшения их дизайна вакцины.
Исследователи из Duke участвовали в разработке вакцины против ВИЧ на протяжении десятилетий, например, Центр иммунологии вакцины против ВИЧ/СПИДа, открытый в 2005 году. . Феррари сказал, что они смогли получить средства в основном потому, что продемонстрировали, что один из их кандидатов на вакцину показал себя многообещающе и что им нужны средства для улучшения их дизайна вакцины.
Пара сказала, что теперь они будут выделять грантовые средства для достижения двух основных целей. Первый, называемый вакцинным подразделением, разрабатывает вакцину, в которой используются антитела для предотвращения заражения ВИЧ-1. Вторая группа, известная как лечение, занимается разработкой терапевтических средств для устранения латентной ВИЧ-инфекции, поскольку существующие АРТ не могут распознавать и уничтожать клетки с латентным ВИЧ.
Для группы лечения они будут использовать средства для приобретения агентов, которые, как известно, активируют латентный ВИЧ от ViiV, фармацевтической компании, занимающейся исследованиями ВИЧ, и используют ретровирусную терапию для уничтожения вируса. Что касается вакцины, они планируют использовать деньги гранта для изучения различных способов вакцинации, таких как вакцины на основе белка или более новые вакцины на основе мРНК, такие как те, которые используются в ответ на COVID-19.пандемии, чтобы предотвратить заражение от вирусного воздействия.
Что касается вакцины, они планируют использовать деньги гранта для изучения различных способов вакцинации, таких как вакцины на основе белка или более новые вакцины на основе мРНК, такие как те, которые используются в ответ на COVID-19.пандемии, чтобы предотвратить заражение от вирусного воздействия.
Хотя они понимают, что их исследование вряд ли станет окончательным решением проблемы пандемии ВИЧ, оба врача по-прежнему с оптимизмом смотрят на то, как их работа повлияет на будущее разработки вакцины против ВИЧ.
«Результаты этого исследования предоставят некоторое принципиальное доказательство того, возможно ли это. Потому что, если это сработает в этой животной модели, это даст нам надежду», — сказал Уильямс.
Получите «Хронику» прямо в свой почтовый ящик
Подпишитесь на нашу еженедельную рассылку новостей. Отменить в любое время.
Трехдозовая схема вакцинации против гепатита В защищает людей с ВИЧ
Открытие является частью продолжающегося клинического испытания.
What
Курс из трех доз вакцины против гепатита В HEPLISAV-B полностью защищает взрослых, живущих с ВИЧ, которые никогда не были вакцинированы или инфицированы вирусом гепатита В (ВГВ), согласно результатам исследования, представленным сегодня на IDWeek конференция в Вашингтоне, округ Колумбия. Национальный институт аллергии и инфекционных заболеваний (NIAID), входящий в состав Национальных институтов здравоохранения, спонсирует текущую фазу 3 ACTG A5379.клиническое исследование.
HBV распространяется главным образом половым путем и при совместном использовании зараженных игл. Он вызывает хроническую инфекцию гепатита В и может привести к прогрессирующему заболеванию печени. Люди, живущие с ВИЧ, в том числе получающие антиретровирусную терапию, подвергаются большему риску заболевания печени и смерти при коинфекции ВГВ. По данным Центров по контролю и профилактике заболеваний, 10% взрослых людей с ВИЧ в США также больны гепатитом В. Люди, живущие с ВИЧ, с меньшей вероятностью вырабатывают защитный иммунологический ответ на вакцинацию против ВГВ. Вакцина HEPLISAV-B, производимая корпорацией Dynavax Technologies Corp., базирующейся в Эмеривилле, Калифорния, была одобрена в 2017 году Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США в качестве двухдозовой схемы вакцинации для взрослых. Однако мало что было известно о его защитном действии на людей, живущих с ВИЧ.
Вакцина HEPLISAV-B, производимая корпорацией Dynavax Technologies Corp., базирующейся в Эмеривилле, Калифорния, была одобрена в 2017 году Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США в качестве двухдозовой схемы вакцинации для взрослых. Однако мало что было известно о его защитном действии на людей, живущих с ВИЧ.
Под руководством Кеннета Э. Шермана, доктора медицины, доктора философии, Медицинского колледжа Университета Цинциннати, и Кристен Маркс, доктора медицины, Медицинского колледжа Вейл Корнелл, Нью-Йорк, исследователи протестировали трехдозовый курс HEPLISAV-B среди 68 взрослых, живущих с ВИЧ, в 38 центрах в США, Южной Африке и Таиланде. Ни один из участников ранее не был вакцинирован против ВГВ или не имел признаков предшествующей инфекции ВГВ; все находились на антиретровирусной терапии. После начальной дозы вакцины HEPLISAV-B 0,5 миллилитра (мл) в виде внутримышечной инъекции участники исследования получили дополнительные дозы через четыре недели и 24 недели. Целью этой части исследования была оценка поверхностных антител к HBV (HBsAbs). ) больше или равно 10 миллимеждународным единицам на миллилитр (мМЕ/мл) на 28-й неделе (определяется как серопротекция от ВГВ) и для оценки безопасности вакцины.
Целью этой части исследования была оценка поверхностных антител к HBV (HBsAbs). ) больше или равно 10 миллимеждународным единицам на миллилитр (мМЕ/мл) на 28-й неделе (определяется как серопротекция от ВГВ) и для оценки безопасности вакцины.
Все участники достигли серопротекции, при этом 88% участников достигли уровня HbsAb выше 1000 мМЕ/мл согласно результатам, представленным сегодня. Считается, что высокие уровни антител связаны с долгосрочной устойчивостью вакцины. Через восемь недель после второй дозы 94,4% участников достигли серопротекции; этот процент увеличился до 98,5% к 24 неделе до третьей дозы. Наиболее частыми побочными эффектами, связанными с вакцинацией, были боль в месте инъекции, недомогание, утомляемость, мышечные и головные боли.
В рамках международного исследования будет продолжено изучение эффектов двух доз HEPLISAV-B, а также трех доз другой вакцины против гепатита В (ENGERIX-B, производства GSK) среди взрослых участников с ВИЧ, ранее вакцинированных против ВГВ, но не достигших адекватного иммунологического ответа. Ожидается, что клинические испытания вакцин будут завершены в марте 2023 года.) Высокая серопротекция HbsAb, достигнутая через 4 недели после введения 3 доз вакцины HepB-CpG у людей, живущих с ВИЧ (ЛЖВ) без предшествующей вакцинации против ВГВ (предварительные результаты ACTG A5379, группа B). Четверг, 20 октября 2022 г., во время сессии «Последние исследования вакцин» с 13:45 до 15:00. ЕТ.
Ожидается, что клинические испытания вакцин будут завершены в марте 2023 года.) Высокая серопротекция HbsAb, достигнутая через 4 недели после введения 3 доз вакцины HepB-CpG у людей, живущих с ВИЧ (ЛЖВ) без предшествующей вакцинации против ВГВ (предварительные результаты ACTG A5379, группа B). Четверг, 20 октября 2022 г., во время сессии «Последние исследования вакцин» с 13:45 до 15:00. ЕТ.
Кто
Карл Диффенбах, доктор философии, директор отдела СПИДа NIAID, и Беверли Л. Алстон-Смит, доктор медицинских наук, руководитель отдела исследований осложнений и коинфекций в отделе СПИДа NIAID, доступны для комментариев на этой презентации.
NIAID проводит и поддерживает исследования — в NIH, на всей территории Соединенных Штатов и во всем мире — для изучения причин инфекционных и иммуноопосредованных заболеваний, а также для разработки более эффективных средств профилактики, диагностики и лечения этих заболеваний. Пресс-релизы, информационные бюллетени и другие материалы, связанные с NIAID, доступны на веб-сайте NIAID.

 October 8, 2018, iavi.org. https://www.iavi.org/news-resources/press-releases/2018/iavi-announces-clinical-trial-of-next-genera…;
October 8, 2018, iavi.org. https://www.iavi.org/news-resources/press-releases/2018/iavi-announces-clinical-trial-of-next-genera…;