Содержание
Цитомегаловирус — причины, симптомы, лечение
Адреса медицинских центров
АВЕНЮ-Александровка
Пн — Пт 7:30 — 20:00
Сб, Вс 9:00 — 15:00
г. Ростов-на-Дону
пр. 40-летия Победы, 220. 2-й этаж.
8-938-120-44-00
АВЕНЮ-Вересаево
Новый!
Пн — Пт 7:30 — 20:00
Сб, Вс 9:00 — 15:00
Ростов-на-Дону
ул. Берберовская, д.2/101, ст 2
8-928-120-22-11
АВЕНЮ-Западный
Пн — Пт 7:30 — 20:00,
Сб, Вс 9:00 — 15:00
г. Ростов-на-Дону
ул. 2-я Краснодарская, 145 А. 2-й этаж.
8-900-122-11-03
АВЕНЮ-Комарова
Пн — Пт 7:30 — 20:00,
Сб, Вс 9:00 — 18:00
г. Ростов-на-Дону
Ростов-на-Дону
б-р Комарова, д.11
8-928-120-67-67
АВЕНЮ-Красный Аксай
Пн — Пт 7:30 — 20:00
Сб, Вс 9:00 — 15:00
г. Ростов-на-Дону
ул. Богданова, 85 (литер 8).
8-928-111-22-11
АВЕНЮ-Левенцовка
Пн — Пт 7:30 — 20:00,
Сб, Вс 9:00 — 15:00
г. Ростов-на-Дону
пр. Маршала Жукова, д.23.
8-900-120-03-11
АВЕНЮ-Нахичевань
Пн — Пт 7:30 — 20:00
Сб, 9:00 — 15:00
Воскресенье — выходной.
г. Ростов-на-Дону
ул. 1-я Майская, 5/9
8-928-120-24-24
АВЕНЮ-Стачки
Новый!
Пн — Пт 7:30 — 20:00
Сб, Вс 9:00 — 15:00
г. Ростов-на-Дону
Ростов-на-Дону
пр. Стачки, 31
8-928-120-03-30
АВЕНЮ-Стройгородок
Пн — Пт 7:30 — 20:00
Сб, Вс 9:00 — 15:00
г. Ростов-на-Дону
ул. Таганрогская, 112а
8 (928) 27-000-87
АВЕНЮ-Текучёва
Пн — Пт 7:30 — 20:00
Сб, Вс 9:00 — 15:00
г. Ростов-на-Дону
ул. Текучёва, 238 / Соборный 78. 2-й этаж.
Машину можно оставить на платной парковке около магазина Перекрёсток (ЖК Миллениум-1)
8-928-120-51-51
АВЕНЮ-Чкаловский
Пн — Пт 7:30 — 20:00,
Сб, Вс 9:00 — 15:00
г. Ростов-на-Дону
ул. Вятская, 45а. 2-й этаж.
8-928-77-000-75
Франшиза
COVID-2019
Записаться на приём
Выберите медицинский центр*
АВЕНЮ-Александровка
АВЕНЮ-Батайск Восточный
АВЕНЮ-Батайск Северный
АВЕНЮ-Вересаево
АВЕНЮ-Западный
АВЕНЮ-Комарова
АВЕНЮ-Красный Аксай
АВЕНЮ-Левенцовка
АВЕНЮ-Нахичевань
АВЕНЮ-Стачки
АВЕНЮ-Стройгородок
АВЕНЮ-Текучёва
АВЕНЮ-Чкаловский
Выберите специализацию*
Аллерголог-иммунолог
Аллерголог-иммунолог детский
Гастроэнтеролог
Гастроэнтеролог детский
Гинеколог
Гинеколог детский
Дерматовенеролог
Дерматовенеролог детский
Диетолог
Инфекционист
Кардиолог
Кардиолог детский
ЛОР
ЛОР детский
Маммолог
Невролог
Невролог детский
Проктолог
Сосудистый хирург
Терапевт
Травматолог-ортопед
Трихолог
УЗИ
Уролог-андролог
Хирург
Эндокринолог
Эндокринолог детский
Ваше ФИО*
Телефон*
Я подтверждаю, что обработка, проверка и хранение моих персональных данных произведены с моего согласия.
Ваша заявка принята
Наши специалисты свяжутся с Вами в ближайшее время.
Задать вопрос
Все поля обязательные для заполнения
Ваше ФИО *
Телефон *
E-mail *
Ваш вопрос *
Я подтверждаю, что обработка, проверка и хранение моих персональных данных произведены с моего согласия.
Благодарим за обратную связь
В ближайшее время ссылка на страницу с ответом будет направлена Вам на электронную почту.
Записаться на приём
Выберите медицинский центр*
АВЕНЮ-Александровка
АВЕНЮ-Батайск Восточный
АВЕНЮ-Батайск Северный
АВЕНЮ-Вересаево
АВЕНЮ-Западный
АВЕНЮ-Комарова
АВЕНЮ-Красный Аксай
АВЕНЮ-Левенцовка
АВЕНЮ-Нахичевань
АВЕНЮ-Стачки
АВЕНЮ-Стройгородок
АВЕНЮ-Текучёва
АВЕНЮ-Чкаловский
Выберите специализацию*
Инфекционист
Ваше ФИО*
Телефон*
Я подтверждаю, что обработка, проверка и хранение моих персональных данных произведены с моего согласия.
Ваша заявка принята
Наши специалисты свяжутся с Вами в ближайшее время.
Вакцина уничтожает вирус иммунодефицита у обезьян
Подпишитесь на нашу рассылку ”Контекст”: она поможет вам разобраться в событиях.
Подпись к фото,
Вирус SIV в 100 раз более патогенен, чем вирус HIV (ВИЧ)
Получена вакцина, которая успешно уничтожает вирус иммунодефицита среди обезьян.
Данные,
опубликованные в журнале Nature, свидетельствуют, что вакцинированные обезьяны могут полностью освободиться от возбудителей вируса SIV (ВИО — вирус иммунодефицита африканских обезьян).
Вакцина оказалась действенной в девяти из 16 случаев вакцинирования.
Американские ученые теперь намерены исследовать подобные вакцины для лечения людей, зараженных вирусом ВИЧ.
«Очень трудно говорить о полном уничтожении вируса, так как в организме всегда может оставаться клетка, которая имеет вирус. Но в этих обезьянах мы не сумели обнаружить оставшихся возбудителей», — говорит профессор Луис Пикер из Института вакцинации и генной терапии при университете штата Орегон.
Ослабленный герпес
Исследователи взяли в качестве объекта агрессивную форму вируса SIVmac239, который в 100 раз опаснее ВИЧ.
Подпись к фото,
Ученые намерены провести испытания новой вакцины, которая успешно уничтожает вирус иммунодефицита среди обезьян, на человеке
Инфицированные им обезьяны обычно погибают в течение двух лет, однако применение вакцины полностью изменило картину.
Вакцина основана на ослабленном цитомегаловирусе герпеса (ЦМВ). Она пользуется способностью этого вируса быстро заражать весь организм. Однако ослабленный вариант этого вируса стимулирует иммунную систему к борьбе с вирусом SIV.
«Эта вакцина содействует созданию антител, которые постоянно присутствуют в организме», — говорит профессор Пикер.
Исследователи сначала вакцинировали макак-резусов, а затем инфицировали их вирусом SIV.
Оказалось, что сначала инфекция закрепляется и распространяется. Однако вскоре включаются защитные механизмы, и возбудители болезни исчезают.
Обезьяны, положительно отреагировавшие на эту вакцину, оставались в живых и три года спустя.
Исследователи пока не знают, почему только половина подопытных животных отреагировала на вакцину.
«Возможно, вирус SIV настолько патогенный, что справиться с ним удается далеко не всегда», — говорит профессор Пикер.
Клинический этап — впереди
По его словам, исследователям удалось создать ослабленный вирус ЦМВ для испытаний на человеке. Если он получит одобрение контролирующих органов, клинические испытания на людях могут начаться в течение ближайших двух лет.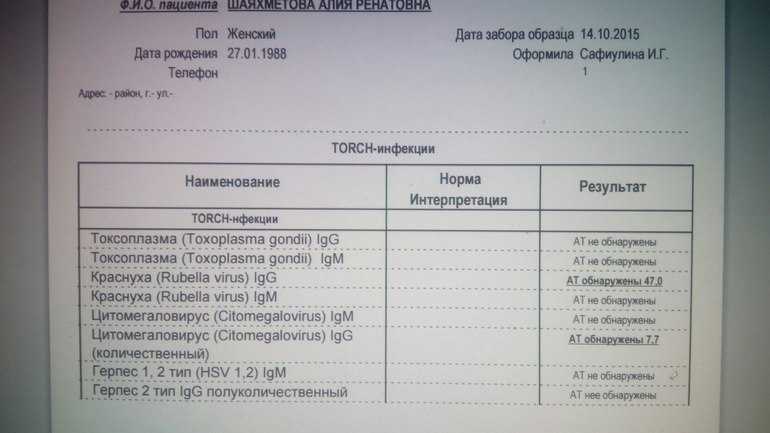
Комментируя результаты этого исследования, доктор Эндрю Фридман из Кардиффского университета говорит, что речь идет о так называемых профилактических вакцинах, которые основаны на использовании ослабленных вирусов герпеса.
«Такие вакцины не могут предотвращать первичной инфекции, но они могут уничтожать хроническую инфекцию и полностью освобождать организм от вируса», — считает он.
Вакцины ЦМВ и клинические испытания | National CMV Foundation
В настоящее время не существует вакцины против ЦМВ для профилактики врожденного цитомегаловируса (ЦМВ). Вакцины ЦМВ все еще находятся на стадии исследований и разработок, и есть надежда и ожидания, что они будут доступны в ближайшие 5-10 лет.
Многие эксперты считают, что вакцина против ЦМВ, предотвращающая передачу ЦМВ ребенку после инфицирования матери, значительно уменьшит долгосрочную инвалидность у младенцев. Вакцина против краснухи является примером сопоставимой вакцины, вводимой в детстве для устранения передачи вируса от матери к ребенку. Вакцина против краснухи устранила синдром врожденной краснухи как причину врожденных дефектов в странах, где применяется вакцина (искоренена в США в 2015 г.), и есть аналогичные надежды на вакцину ЦМВ.
Вакцина против краснухи устранила синдром врожденной краснухи как причину врожденных дефектов в странах, где применяется вакцина (искоренена в США в 2015 г.), и есть аналогичные надежды на вакцину ЦМВ.
Что важно для продвижения вперед? Спрос общественного здравоохранения и финансовая поддержка со стороны населения в целом, фармацевтической промышленности и федерального правительства.
Потенциальные целевые группы населения для вакцины против ЦМВ включают женщин детородного возраста, пациентов с ослабленным иммунитетом и детей. В связи с высокой частотой врожденной передачи ЦМВИ вакцины против ЦМВ, как правило, предназначены для девочек-подростков или женщин детородного возраста для предотвращения вертикальной передачи (пассаж возбудителя или возбудителя от матери к ребенку через плаценту, с грудным молоком, или через прямой контакт во время или после рождения) ЦМВ. Кроме того, пациенты с ослабленным иммунитетом, в том числе реципиенты трансплантированных органов, являются целевой группой, поскольку они подвержены риску заболевания, связанного с ЦМВ.
В будущем и для комплексной профилактики распространения ЦМВ-инфекции настоятельно рекомендуется включить ЦМВ-вакцину в план плановой вакцинации детей.
Испытания вакцины ЦМВ
Клинические испытания вакцины включают следующее:
- Испытания фазы I — стоимость менее 1 миллиона долларов
- Испытание фазы II — стоимость от 5 до 10 миллионов долларов
- Испытание фазы III — стоимость от 10 до 750 миллионов долларов
Многие глобальные фармацевтические компании, организации клинических исследований, компании, занимающиеся клиническими испытаниями, и академические исследовательские центры занимаются выпуском эффективной вакцины против ЦМВ. В частности, для врожденной вакцины против ЦМВ на сегодняшний день было проведено около 10 испытаний фазы I, 2 испытания фазы II и ни одного испытания фазы III.
Правительственные рекомендации
В 1999 г. Национальный институт медицины (IOM) проанализировал 26 заболеваний с потенциалом для вакцинопрофилактики и ранжировал различные вакцины-кандидаты по уровням I-IV (от самого высокого к самому низкому) на основе влияния на стоимость и сохраненного года с поправкой на качество жизни (QALY). Врожденная вакцина против ЦМВ, введенная 12-летним детям, была поставлена на первое место в группе уровня I как первоочередная из-за экономии средств, а также человеческих страданий, которые можно было бы облегчить, остановив ЦМВ.
Национальный институт медицины (IOM) проанализировал 26 заболеваний с потенциалом для вакцинопрофилактики и ранжировал различные вакцины-кандидаты по уровням I-IV (от самого высокого к самому низкому) на основе влияния на стоимость и сохраненного года с поправкой на качество жизни (QALY). Врожденная вакцина против ЦМВ, введенная 12-летним детям, была поставлена на первое место в группе уровня I как первоочередная из-за экономии средств, а также человеческих страданий, которые можно было бы облегчить, остановив ЦМВ.
В начале 1990-х ежегодные затраты на уход за детьми, рожденными с врожденным ЦМВ, только в США оценивались в 1–2 миллиарда долларов. Поскольку дети, рожденные с врожденным ЦМВ, часто требуют длительного ухода и обширных медицинских и хирургических вмешательств, средняя стоимость лечения одного ребенка оценивается в 300 000 долларов США.
В последнее время не проводилось исследований по переоценке влияния на стоимость врожденной ЦМВ.
Примите участие в кампании, став защитником вариантов профилактики и лечения ЦМВ.
Тернистый путь к вакцине против цитомегаловируса
Сказать, что цитомегаловирус (ЦМВ) распространен, было бы преуменьшением. Вирус, принадлежащий к семейству Herpesviridae, поражает большинство людей в течение жизни, что делает его одним из самых распространенных патогенов человека в мире (1, 2). И все же общая осведомленность о ЦМВ и его влиянии на здоровье человека (особенно о риске врожденной инфекции) относительно низкая.
CMV имеет один из самых больших вирусных геномов, известных человеку, и состоит из сотен белков (см. рис. 1). Он существует в виде множества взаимосвязанных штаммов как в окружающей среде, так и среди тех, кого он заражает (3).
Хотя у нас еще нет полной картины того, как передается ЦМВ, вирус, по-видимому, распространяется через ряд жидкостей организма человека, включая мочу, слюну, кровь и слезы. Оказавшись внутри тела, он вторгается в удивительно широкий спектр типов клеток, формируя клеточные функции, поддерживающие его репликацию. К счастью, иммунная система обычно реагирует быстро и переводит вирус в латентное состояние, где он остается в состоянии покоя на протяжении всей жизни человека и ждет более благоприятных условий (4). Учитывая естественную способность организма быстро реагировать на инфекцию, большинство инфицированных ЦМВ протекает бессимптомно, хотя у некоторых могут проявляться легкие симптомы, включая лихорадку, боль в горле и утомляемость.
К счастью, иммунная система обычно реагирует быстро и переводит вирус в латентное состояние, где он остается в состоянии покоя на протяжении всей жизни человека и ждет более благоприятных условий (4). Учитывая естественную способность организма быстро реагировать на инфекцию, большинство инфицированных ЦМВ протекает бессимптомно, хотя у некоторых могут проявляться легкие симптомы, включая лихорадку, боль в горле и утомляемость.
Рисунок 1. Схема вириона цитомегаловируса с помеченными ключевыми белками.
Хотя большинство ЦМВ-инфекций часто являются доброкачественными и не вызывают особого беспокойства, вирус представляет значительный риск для тех, кто борется за создание эффективного иммунного ответа — проблема, которая возникает преимущественно в двух группах:
Беременные матери и плод. Если во время беременности возникает новая или реактивированная ЦМВ-инфекция, вирус может передаваться через плаценту и вызывать врожденную инфекцию у развивающегося плода (цЦМВ). Здесь он может нанести ущерб развивающейся нервной системе младенца (5), вызывая необратимые дефекты, которые варьируются от потери слуха до нарушения роста органов и неспособности к обучению (6). Масштабы cCMV значительны, поражая примерно в два раза больше детей, живущих с более известными детскими расстройствами, такими как синдром Дауна (5), и занимает первое место по инфекционной потере слуха у детей во всем мире (7).
Здесь он может нанести ущерб развивающейся нервной системе младенца (5), вызывая необратимые дефекты, которые варьируются от потери слуха до нарушения роста органов и неспособности к обучению (6). Масштабы cCMV значительны, поражая примерно в два раза больше детей, живущих с более известными детскими расстройствами, такими как синдром Дауна (5), и занимает первое место по инфекционной потере слуха у детей во всем мире (7).
Реципиенты донорских органов и трансплантатов стволовых клеток. ЦМВ также представляет угрозу для реципиентов паренхиматозных органов или гемопоэтических стволовых клеток во время иммуносупрессивной терапии. Эти инфекции могут возникать из-за присутствия ЦМВ в пересаженном органе, реактивации вируса в ткани реципиента или первичной инфекции у серонегативных реципиентов. Трансплантационные инфекции могут вызывать такие состояния, как гепатит, пневмония и виремия (1), которые повышают вероятность отторжения трансплантата и реакции «трансплантат против хозяина». Заболеваемость ЦМВ-инфекцией среди реципиентов трансплантатов чрезвычайно распространена: 20–70% реципиентов заражаются в течение первого года после трансплантации (1), что делает ее одним из наиболее распространенных осложнений, влияющих на выживаемость реципиентов трансплантатов во всем мире (8). ).
Заболеваемость ЦМВ-инфекцией среди реципиентов трансплантатов чрезвычайно распространена: 20–70% реципиентов заражаются в течение первого года после трансплантации (1), что делает ее одним из наиболее распространенных осложнений, влияющих на выживаемость реципиентов трансплантатов во всем мире (8). ).
Несмотря на значительное бремя, в настоящее время не существует эффективных контрмер для защиты тех, кто подвергается риску, доступны только базовые меры скрининга или поведенческие меры, такие как гигиена рук (7). И хотя противовирусная терапия бесценна, она ограничена токсичностью и постоянным появлением вирусной резистентности.
Подобно вакцине против краснухи, новая вакцина против ЦМВ может защитить матерей и их развивающихся детей от ЦМВ. Точно так же вакцина для реципиентов трансплантата позволит избежать необходимости в дорогостоящем противовирусном лечении, которое ограничено по эффективности и продолжительности, резко улучшив выживаемость пациентов и показатели успешности процедур.
Лицензированных вакцин в настоящее время нет, но исследователи не сидели без дела; разработка вакцин против ЦМВ продолжается уже почти 50 лет (9). Основные препятствия на пути разработки подходящей вакцины, вероятно, были связаны с плохой общей осведомленностью о вирусе и его иммунологической сложности. Однако признание клинической значимости ЦМВ в последние годы стимулировало всплеск финансирования и исследовательского интереса.
Аттенуированные вакцины
Аттенуированные вакцины создаются путем снижения вирулентности патогена при сохранении его жизнеспособности. Они могут стать одним из наиболее эффективных способов вакцинации против ЦМВ, поскольку они могут имитировать естественную инфекцию (10). В 1990-е годы были разработаны первые аттенуированные вакцины – новое поколение так называемых трансгенных инвалидизированных инфекционных однократных штаммов (DISC) (см. рис. 2) (11). Это живые вирусы с селективными генными делециями в их мембранных белках, которые позволили им собраться после первого цикла заражения, но не смогли заразить последующие клетки (12). Экспрессируя только ограниченное подмножество вирусного протеома, DISC могут размножаться в контролируемых условиях, позволяющих их продукцию in vitro, но не могут реплицироваться in vivo, предотвращая латентную инфекцию (13).
Экспрессируя только ограниченное подмножество вирусного протеома, DISC могут размножаться в контролируемых условиях, позволяющих их продукцию in vitro, но не могут реплицироваться in vivo, предотвращая латентную инфекцию (13).
Текущим лидером DISC является штамм Merck V160, который включает вставку рапамицин-связывающего белка (RBP). In vivo RBP быстро разрушаются, чтобы предотвратить репликацию вируса. Штаммы DISC, такие как эти, эффективно уменьшают проблемы, связанные с репликацией и латентностью вируса, и теоретически могут вызывать полный репертуар антител и Т-клеточных ответов естественной инфекции. Однако, учитывая, что естественные ЦМВ-инфекции могут не обеспечить иммунитет, необходимый для предотвращения вторичной инфекции, остается неясным, обеспечивают ли эти вакцины достаточную защиту. Недавние испытания фазы I компании Merck показали хорошую переносимость (14), и в настоящее время проводится исследование фазы II с участием 2100 женщин в возрасте от 16 до 35 лет, результаты которого ожидаются в 2021 году (15).
Диаграмма, иллюстрирующая DISC, субъединичные и мРНК-вакцины. 1) In vitro (слева) лиганд Shield-1 добавляют в культуру клеток вместе с составом V160. Это стабилизирует репликационный комплекс и позволяет вирусу размножаться; in vivo (справа) лиганд Shield-1 отсутствует, что вызывает дестабилизацию репликационного комплекса и препятствует сборке вируса. 2) Адъювант MF59 состоит из сквалена, окруженного поверхностно-активными веществами и составленного из субъединичных антигенов. 3) Липидная наночастица сливается с клеточными мембранами, высвобождая 6 мРНК в цитоплазму клетки-мишени. мРНК транслируются механизмом клетки-хозяина с образованием антигенов, которые могут быть обнаружены иммунной системой.
Субъединичные вакцины
Субъединичные вакцины (см. рис. 2) создаются с использованием фрагментов патогенов (обычно для их развития используются поверхностные белки) и используются для запуска иммунного ответа и стимуляции приобретенного иммунитета против патогенов, из которых они получены. Белком, ответственным за опосредование проникновения ЦМВ в клетки человека и доминирующей мишенью гуморального ответа организма, является гликопротеин В (gB) — гомотримерный оболочечный белок, который претерпел значительные разработки в качестве антигена в субъединичных вакцинах. Содержит запатентованный Novartis MF59.адъювант, gB продемонстрировал многообещающие ранние результаты ряда разработчиков вакцин и, возможно, продвинулся дальше всех на сегодняшний день в клинических испытаниях (16).
Белком, ответственным за опосредование проникновения ЦМВ в клетки человека и доминирующей мишенью гуморального ответа организма, является гликопротеин В (gB) — гомотримерный оболочечный белок, который претерпел значительные разработки в качестве антигена в субъединичных вакцинах. Содержит запатентованный Novartis MF59.адъювант, gB продемонстрировал многообещающие ранние результаты ряда разработчиков вакцин и, возможно, продвинулся дальше всех на сегодняшний день в клинических испытаниях (16).
В ходе II фазы исследования 2007–2010 гг. с участием женщин в послеродовом периоде препарат Санофи Пастер gB/MF59 продемонстрировал 50-процентную эффективность против первичной ЦМВ-инфекции у серонегативных женщин, вакцинированных в течение одного года после родов, с приемлемыми побочными эффектами (17). Это знаменательное исследование было первым, продемонстрировавшим эффективность в предотвращении первичной ЦМВ-инфекции, а через три месяца за ним последовала фаза II у реципиентов трансплантата, которая показала значительное снижение виремии и продолжительность необходимой противовирусной терапии (18).
Беглый взгляд на литературу показывает, что с тех пор не произошло никаких серьезных прорывов в области вакцин на основе gB-субъединиц. Вероятной причиной этого было осознание того, что пентамерный комплекс ЦМВ также является ключевой мишенью для нейтрализующих антител и потребуется в препаратах (19). В сочетании с тем фактом, что gB достиг только 50-процентной эффективности и что иммунный ответ на gB и пентамер стимулирует защиту в различных типах клеток, вполне вероятно, что эффективная вакцина должна будет состоять из обоих белков (20).
Немного смущает тот факт, что мы до сих пор не до конца понимаем, как защитный иммунитет возникает при естественном заражении ЦМВ. Хотя в прошлом из-за этого разработка вакцины казалась исследователям чем-то вроде выстрела в темноте, новые данные теперь начинают рисовать более подробную картину.
РНК-вакцины
Компания Moderna, недавно участвовавшая в гонке CMV, занимается разработкой новых технологий матричной РНК с момента своего основания в 2010 году./70-1.jpg) для производства антигенов на месте, что значительно упрощает производство и введение (21). Состав включает липидную наночастицу, содержащую шесть отдельных мРНК, в совокупности кодирующих пять субъединиц пентамерного комплекса и gB.
для производства антигенов на месте, что значительно упрощает производство и введение (21). Состав включает липидную наночастицу, содержащую шесть отдельных мРНК, в совокупности кодирующих пять субъединиц пентамерного комплекса и gB.
Ранее в этом году Moderna опубликовала некоторые многообещающие данные испытаний фазы I (22). Результаты показали хорошую переносимость и отсутствие серьезных побочных эффектов после трехдозового режима, а также повышение титров нейтрализующих антител как у серонегативных, так и у серопозитивных участников; в 10 и 20–40 раз соответственно (23). В настоящее время Moderna развивает свою вакцину, что делает ее первой мРНК-вакциной против инфекционного заболевания, прошедшей фазу II клинических испытаний. Кроме того, уже существуют планы для фазы III в 2021 году, в ходе которой будет оценена эффективность до 8000 женщин детородного возраста.
Несмотря на то, что аттенуированные, субъединичные и РНК-вакцины демонстрируют различные уровни успеха в клинических условиях, существует широкий спектр других вакцинных стратегий, выходящих за рамки этой статьи, включая пептидные, ДНК- и векторные вакцины, каждая из которых представляет собой жизнеспособные варианты для борьба с ЦМВ.
Очевидно, что за последние годы отрасль добилась значительного прогресса в нашем понимании CMV благодаря целому ряду новых технологий, которые вскоре могут стать прорывом. Однако для разработки эффективной вакцины, способной предотвратить как внутриутробные инфекции, так и инфекции, связанные с трансплантацией, необходимо решить некоторые ключевые проблемы.
Немного смущает тот факт, что мы до сих пор не до конца понимаем, как при естественном заражении ЦМВ возникает защитный иммунитет (13). Хотя это, должно быть, заставляло исследователей в прошлом чувствовать себя как выстрел в темноте, новые данные теперь начинают рисовать более подробную картину. Вакцина должна будет стимулировать как гуморальный, так и клеточно-опосредованный иммунный ответ, поскольку было показано, что антитела против ЦМВ предотвращают передачу и минимизируют клинические проявления, в то время как Т-клетки, вероятно, участвуют в подавлении репликации вируса и предотвращении реактивации инфекции (2). , 23). Необходимы дальнейшие исследования, чтобы получить более четкую картину, определяющую корреляты защиты.
, 23). Необходимы дальнейшие исследования, чтобы получить более четкую картину, определяющую корреляты защиты.
Иммунизация также затруднена тем фактом, что естественная инфекция ЦМВ только частично защищает и не предотвращает плацентарную передачу вируса (24, 25). А это означает, что вакцины-кандидаты должны будут обеспечивать защиту, превосходящую защиту естественной инфекции (8), и могут несколько ограничить перспективы традиционных вакцин (26).
Постоянной проблемой в производстве биологических препаратов является необходимость поддерживать однородные клеточные линии, которые можно масштабировать для получения вакцин достаточно высокой чистоты для использования на людях. Технологии мРНК, такие как технология Moderna, полностью бесклеточны и не требуют сложных производственных процессов, что сделало бы эти стратегии гораздо более практичными для использования в реальных условиях. Однако еще предстоит выяснить, способны ли мРНК-вакцины последовательно вызывать мощные и длительные иммунные ответы на ЦМВ.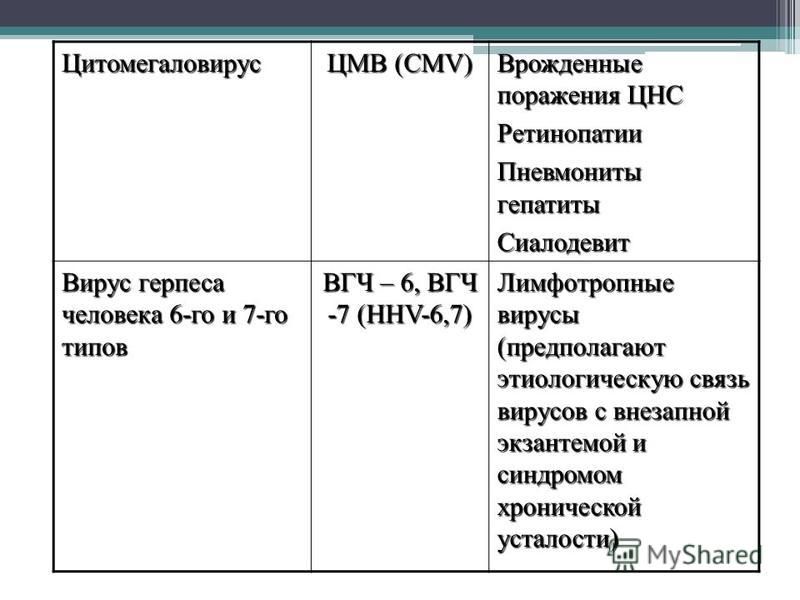
Еще одно серьезное соображение: как практически оценить эффективность в испытаниях. cCMV довольно редко встречается на популяционном уровне (около 1 из 150 беременностей) и встречается в основном у уязвимых групп пациентов. На практике для этого требуются большие выборки пациентов в популяциях с ограниченными ресурсами, что может отпугнуть более склонных к риску разработчиков. Точно так же определение практических конечных точек может быть головной болью, если учесть, что передача вируса, профилактика материнской инфекции, блокирование трансплацентарной передачи, снижение врожденной инфекции у младенцев, выживаемость трансплантата и сокращение противовирусного лечения являются клинически значимыми (27). .
Несмотря на эти проблемы, отрасль сохраняет оптимизм. Успешные испытания фазы III вакцин-лидеров, таких как V160 и mRNA-1647, могут расчистить путь на рынок в ближайшие годы. И хотя путь к вакцине против ЦМВ был долгим и ухабистым, обнадеживающие результаты широкого спектра типов вакцин говорят о том, что мы приближаемся к будущему, в котором ЦМВ представляет меньший риск для тех, кто наиболее уязвим к инфекции.
