Содержание
Почему привитые люди тоже болеют туберкулёзом
Согласитесь, что это достаточно хороший уровень защиты. Что касается тяжелых форм туберкулёза, от которых можно умереть (иногда они протекают столь молниеносно, что не успевают даже поставить верный диагноз), то здесь уровень защиты БЦЖ еще выше: 90-92%.
Также советскими исследователями было отмечено, что после внедрения всеобщей вакцинации БЦЖ в 60-х годах прошлого века, течение туберкулёза легких стало менее тяжелым и осложненным — реже стала встречаться вторичная генерализация процесса по разным органам, туберкулёзные плевриты и распад легочной ткани.
Тем не менее, вакцина БЦЖ не идеальна — во-первых, ее защита длится всего несколько лет и, соответственно, не действует на взрослых. Во-вторых, защитный эффект от заболевания не максимальный. Много десятилетий подряд ведутся работы по созданию новых вакцин, однако ни одна из них еще не зарегистрирована, поскольку не удается создать преимущественно лучший вариант, чем БЦЖ. В настоящее время основные вакцины-кандидаты являются бустерными. То есть, предполагается, что они будут усиливать и продлевать эффект БЦЖ, но не заменят ее полностью».
В настоящее время основные вакцины-кандидаты являются бустерными. То есть, предполагается, что они будут усиливать и продлевать эффект БЦЖ, но не заменят ее полностью».
Вакцинация БЦЖ в Казахстане
Для профилактики тяжелых форм туберкулёза все здоровые новорожденные дети, согласно Национальному календарю прививок, получают свою первую вакцину БЦЖ на 2-4 сутки после рождения. Весь список противопоказаний к вакцинации описан в Приказе №214 о профилактике туберкулёза. До вакцинации все матери новорожденных должны пройти флюорографию в роддоме, чтобы исключить туберкулёз. Также пройти флюорографию обязаны все, кто будет проживать в одном доме с новорожденным, если ребенок не получил БЦЖ вакцину по медицинским противопоказаниям или родители подписали отказ от прививки. Только после предоставления необходимых справок маму с ребенком могут выписать из роддома.
Защиты вакцины БЦЖ хватает, в среднем, на 5-6 лет — все зависит от иммунитета каждого ребенка. Именно поэтому казахстанским детям в 6-летнем возрасте ставится вторая прививка БЦЖ. Ревакцинация проводится только после отрицательной пробы Манту и не позднее двух недель после нее. В случае, если проба Манту дала сомнительную реакцию, то она повторяется через 3 месяца. Если реакция Манту положительная, то вероятность инфицирования ребенка проверяется с помощью Диаскинтеста (АТР – прим. V). Если ребенок до 6 лет переболел туберкулёзом, вторая прививка ему уже не ставится. По статистике до ревакцинации доходят менее ⅔ тех, кто получил прививку БЦЖ в роддоме. По данным за 2020 год в роддоме БЦЖ получили 92,8% новорожденных, а охват ревакцинацией среди 6-летних детей в этом же году составил 58,7%.
Ревакцинация проводится только после отрицательной пробы Манту и не позднее двух недель после нее. В случае, если проба Манту дала сомнительную реакцию, то она повторяется через 3 месяца. Если реакция Манту положительная, то вероятность инфицирования ребенка проверяется с помощью Диаскинтеста (АТР – прим. V). Если ребенок до 6 лет переболел туберкулёзом, вторая прививка ему уже не ставится. По статистике до ревакцинации доходят менее ⅔ тех, кто получил прививку БЦЖ в роддоме. По данным за 2020 год в роддоме БЦЖ получили 92,8% новорожденных, а охват ревакцинацией среди 6-летних детей в этом же году составил 58,7%.
По итогам исследований, опубликованных в 2018 году, ревакцинация не приводит к какому-либо видимому эффекту, но специалисты в области вакцинопрофилактики не исключают, что, возможно, не все факторы еще до конца изучены. В большинстве стран СНГ, где туберкулёз не сдает своих позиций, дети по-прежнему получают вторую прививку в 6-7 лет. Российским опытом ревакцинации с нами поделилась Ольга Винокурова, а также тем, насколько, по ее мнению, имеет смысл вторая прививка:
«Ревакцинация БЦЖ действительно имеет достаточно слабый защитный эффект. Количество ревакцинированных детей с каждым годом уменьшается и мы планомерно движемся к отмене ревакцинации как малоэффективной меры, как и рекомендует ВОЗ. В моей практике никаких показательных случаев на эту тему не было, и я отношусь к этому вопросу спокойно — я не против ревакцинации, если родители желают дополнительно защитить ребенка, но предсказать, насколько действенна будет эта защита — трудно, поэтому мы честно говорим о том, что не стоит многого от нее ожидать».
Количество ревакцинированных детей с каждым годом уменьшается и мы планомерно движемся к отмене ревакцинации как малоэффективной меры, как и рекомендует ВОЗ. В моей практике никаких показательных случаев на эту тему не было, и я отношусь к этому вопросу спокойно — я не против ревакцинации, если родители желают дополнительно защитить ребенка, но предсказать, насколько действенна будет эта защита — трудно, поэтому мы честно говорим о том, что не стоит многого от нее ожидать».
В Казахстане вакцинация БЦЖ проводится только в роддомах и государственных поликлиниках. Частные медицинские и прививочные центры вакцину БЦЖ не ставят. Техника вакцинации БЦЖ отличается от других прививок и, по правилам, требуется отдельный прививочный кабинет. В 2021 году в Казахстане используется вакцина индийского производителя Serum Institute of India Pvt.Ltd., прошедшая преквалификацию ВОЗ.
В следующем материале мы разберем вопросы, связанные с поствакцинальными осложнениями после БЦЖ и диагностику туберкулёза у детей с помощью проб Манту и АТР.
Прививка от туберкулеза \ Акты, образцы, формы, договоры \ КонсультантПлюс
- Главная
- Правовые ресурсы
- Подборки материалов
- Прививка от туберкулеза
Подборка наиболее важных документов по запросу Прививка от туберкулеза (нормативно–правовые акты, формы, статьи, консультации экспертов и многое другое).
- Прививки:
- Вакцина
- Вакцинопрофилактика
- Иммунопрофилактика
- Календарь прививок
- Национальный календарь прививок
- Ещё…
Статьи, комментарии, ответы на вопросы: Прививка от туберкулеза
Зарегистрируйтесь и получите пробный доступ к системе КонсультантПлюс бесплатно на 2 дня
Открыть документ в вашей системе КонсультантПлюс:
Статья: Проблемы возмещения вреда при возникновении поствакцинальных осложнений
(Мотина Е.А.)
(«Гражданское право», 2022, N 2)В тех случаях, когда поствакцинальные осложнения соответствуют статистически подтвержденным последствиям, вина медицинской организации может не являться предметом обсуждения. Так, в решении Советского районного суда г. Брянска от 18 декабря 2009 г. было отмечено, что при современном развитии медицины невозможно полностью проконтролировать реакцию организма на введенную вакцину БЦЖ, а осложнения вследствие вакцинации возможны и в случае надлежащего качества вакцины, соблюдения технологии ее введения и отсутствия противопоказаний к вакцинации, что следует из нормативных документов Минздрава России. Из этого был сделан вывод о том, что вакцинация против туберкулеза полностью соответствует признакам источника повышенной опасности как деятельность, осуществление которой создает повышенную вероятность причинения вреда из-за невозможности полного контроля за ней со стороны медицинских работников, а также как деятельность по использованию веществ (вакцин, т.е. штаммов живых микобактерий), обладающих такими же свойствами. При таких обстоятельствах доводы представителя ответчика об отсутствии вины в причинении вреда здоровью несовершеннолетнего Б. не были приняты во внимание, т.
Так, в решении Советского районного суда г. Брянска от 18 декабря 2009 г. было отмечено, что при современном развитии медицины невозможно полностью проконтролировать реакцию организма на введенную вакцину БЦЖ, а осложнения вследствие вакцинации возможны и в случае надлежащего качества вакцины, соблюдения технологии ее введения и отсутствия противопоказаний к вакцинации, что следует из нормативных документов Минздрава России. Из этого был сделан вывод о том, что вакцинация против туберкулеза полностью соответствует признакам источника повышенной опасности как деятельность, осуществление которой создает повышенную вероятность причинения вреда из-за невозможности полного контроля за ней со стороны медицинских работников, а также как деятельность по использованию веществ (вакцин, т.е. штаммов живых микобактерий), обладающих такими же свойствами. При таких обстоятельствах доводы представителя ответчика об отсутствии вины в причинении вреда здоровью несовершеннолетнего Б. не были приняты во внимание, т. е. в данном случае отсутствие вины не является основанием для освобождения от ответственности за причиненный вред.
е. в данном случае отсутствие вины не является основанием для освобождения от ответственности за причиненный вред.
Зарегистрируйтесь и получите пробный доступ к системе КонсультантПлюс бесплатно на 2 дня
Открыть документ в вашей системе КонсультантПлюс:
Статья: Правовые аспекты иммунодиагностики и иммунопрофилактики некоторых заболеваний
(Иванова О.А.)
(«Вестник Пермского университета. Юридические науки», 2020, N 4)В ходе рассмотрения дела истцы изменили основание иска, ссылаясь на то, что вакцинация против туберкулеза полностью соответствует признакам источника повышенной опасности как деятельность, осуществление которой создает повышенную вероятность причинения вреда из-за невозможности полного контроля со стороны медицинских работников, а также как деятельность по использованию веществ (вакцин, т.е. штаммов живых микобактерий), обладающих такими же свойствами.
Нормативные акты: Прививка от туберкулеза
Новые стратегии вакцинации против туберкулеза
- org/Person»> Peter Andersen1 и
- Стефан Х.Э. Кауфманн2
- 1 Statens Serum Institut, DK-2300 Copenhagen S, Дания
- 2 Институт биологии инфекций им. Макса Планка, 10117 Берлин, Германия
- Корреспонденция: pa{at}ssi.dk
Пандемия туберкулеза (ТБ) продолжает свирепствовать, несмотря на широкое использование вакцины БЦЖ (бацилла Кальметта-Герена).
Срочно необходимы новые стратегии вакцинации, чтобы остановить глобальную передачу и предотвратить неконтролируемое развитие
полирезистентные формы Mycobacterium tuberculosis . За последние два десятилетия был достигнут значительный прогресс в области разработки вакцин с многочисленными инновационными разработками.
доклинических кандидатов и более дюжины вакцин в клинических испытаниях. Эти вакцины разрабатываются либо как бустеры
текущей вакцины БЦЖ или в качестве новых первичных вакцин для замены БЦЖ. Учитывая огромную распространенность латентной туберкулезной инфекции,
вакцины, защищающие от уже установленной инфекции, остаются высокоприоритетными и важными научными исследованиями.
вызов. Здесь мы обсуждаем текущее состояние исследований и разработок противотуберкулезных вакцин, наше понимание лежащей в их основе иммунологии,
и требования к эффективной противотуберкулезной вакцине.
« Предыдущая | Следующая статья »
Содержание
Эта статья
дои:
10.1101/cshperspect.a018523
Perspect Med Колд Спринг Харб
2014.
4:
Copyright © 2014 Издательство Лаборатории Колд-Спринг-Харбор; все права защищены
- » Реферат
- Полный текст
- Полный текст (PDF)
- Перспектива
- Ссылка на PubMed
- Статьи Андерсена, стр.
- Статьи Kaufmann, S.H.
- Туберкулез
youtube.com/embed/i2lRm_Civ7c» allowfullscreen=»allowfullscreen»>
Текущий выпуск
- 12 (11)
ноября 2022 г.
Молекулярное клонирование
Новое издание
Купите сейчас и сэкономьте 30%
Только в мягкой обложке
(предложение ограничено по времени)
| Молекулярное клонирование: лабораторное руководство (четвертое издание) |
Роль антител в вакциноопосредованной защите от туберкулеза
Разработка эффективной профилактической противотуберкулезной (ТБ) вакцины была наиболее целенаправленной задачей в исследованиях ТБ, так как используемая в настоящее время вакцина Bacillus Calmette-Guerin (BCG) эффективен только против первичного детского заболевания, но не против наиболее распространенной формы, болезни легких. В течение последних примерно пяти десятилетий считалось, что защитный иммунитет опосредуется Т-клетками, но в результате обширного тестирования клеточных субпопуляций (т. е. клеток CD4, CD8, Th2/2, γδ и Treg) и их цитокиновых продуктов не удалось идентифицировать надежный тест, который коррелировал с защитой после заражения Mycobacterium tuberculosis ( Mtb ) или вакцинация. Эта неудача может быть связана с иммунорегуляторными цитокинами и патогенными «ложными» иммунными механизмами, индуцированными антигенами, которые были выработаны патогеном для уклонения от резистентности хозяина [1].
В течение последних примерно пяти десятилетий считалось, что защитный иммунитет опосредуется Т-клетками, но в результате обширного тестирования клеточных субпопуляций (т. е. клеток CD4, CD8, Th2/2, γδ и Treg) и их цитокиновых продуктов не удалось идентифицировать надежный тест, который коррелировал с защитой после заражения Mycobacterium tuberculosis ( Mtb ) или вакцинация. Эта неудача может быть связана с иммунорегуляторными цитокинами и патогенными «ложными» иммунными механизмами, индуцированными антигенами, которые были выработаны патогеном для уклонения от резистентности хозяина [1].
В исследовании, опубликованном в выпуске Nature Immunology за декабрь 2021 г., Irvine et al. [2] сообщили, что БЦЖ индуцирует более сильный ответ антител после внутривенного (в/в) введения, чем внутрикожного (в/к) введения у макак-резусов. Уровни антител IgM в плазме и жидкости бронхоальвеолярного лаважа (БАЛ) были лучшими показателями защиты от 9Заражение 0115 Mtb , поскольку нагрузка Mtb в легких отрицательно ассоциировалась с титрами плазмы против антигенов липоарабиноманнана (LAM) и PstS1 как через 8, так и через 24 недели после вакцинации. Однако репертуары антител изотипов IgG1 и IgA в жидкости БАЛ были шире и включали антигенную специфичность Apa. Защищенные и восприимчивые макаки были выделены с использованием сложной модели частичного дискриминантного анализа методом наименьших квадратов. Высоко сбалансированная точность перекрестной проверки была основана на трех характеристиках антител: анти-HspX/Acr1 IgM БАЛ на 4-й неделе, анти-LAM IgG1 в плазме на 8-й неделе и анти-LAM IgM в плазме на 24-й неделе. и результаты, связанные с изотипом Ig, способствуют недавней тенденции исследований участия антител в защитном иммунитете и разработке вакцинации или иммунотерапии против ТБ.
Однако репертуары антител изотипов IgG1 и IgA в жидкости БАЛ были шире и включали антигенную специфичность Apa. Защищенные и восприимчивые макаки были выделены с использованием сложной модели частичного дискриминантного анализа методом наименьших квадратов. Высоко сбалансированная точность перекрестной проверки была основана на трех характеристиках антител: анти-HspX/Acr1 IgM БАЛ на 4-й неделе, анти-LAM IgG1 в плазме на 8-й неделе и анти-LAM IgM в плазме на 24-й неделе. и результаты, связанные с изотипом Ig, способствуют недавней тенденции исследований участия антител в защитном иммунитете и разработке вакцинации или иммунотерапии против ТБ.
Сложность Т-клеточного ответа при ТБ, а также знание того, что выдающийся успех вакцинации против других инфекционных патогенов (например, оспы, полиомиелита и столбняка) опосредуется антителами, стимулировали недавние исследования роли антитела при противотуберкулезной вакцинации. Этот подход был подтвержден результатами исследований на мышах, в результате чего истощение В-клеток, особенно продуцентов IgA [3], усугубляло туберкулезную инфекцию, а также наблюдением пассивной защиты моноклональными антителами IgA от первичной инфекции, а также рецидива после химиотерапии. с потенциальным применением для иммунотерапии лекарственно-устойчивого ТБ [4,5,6]. Ранее серологические исследования пациентов с активной ТБ-ассоциированной антигенной специфичностью с локализацией органа, бактериальной нагрузкой и HLA-ассоциацией подчеркивали благотворное иммунодоминирование и Mtb специфичность антигенов PstS1, Acr1/HspX и LAM для потенциального серодиагностического применения, но без какой-либо атрибуции потенциала вакцинации [7]. В свете этих серологических исследований на людях удивительно, что у макак повышенные уровни антител IgM после внутривенной вакцинации БЦЖ наиболее тесно связаны со снижением легочной инфекции Mtb [2].
с потенциальным применением для иммунотерапии лекарственно-устойчивого ТБ [4,5,6]. Ранее серологические исследования пациентов с активной ТБ-ассоциированной антигенной специфичностью с локализацией органа, бактериальной нагрузкой и HLA-ассоциацией подчеркивали благотворное иммунодоминирование и Mtb специфичность антигенов PstS1, Acr1/HspX и LAM для потенциального серодиагностического применения, но без какой-либо атрибуции потенциала вакцинации [7]. В свете этих серологических исследований на людях удивительно, что у макак повышенные уровни антител IgM после внутривенной вакцинации БЦЖ наиболее тесно связаны со снижением легочной инфекции Mtb [2].
Предыдущие исследования слизистых оболочек или в/в Вакцинация БЦЖ у макак показала почти стерилизующий иммунитет к 9Инфекционная нагрузка 0115 Mtb , которая коррелировала с повышенными уровнями антител IgG, IgA и IgM, специфичных к Mtb , в плазме и жидкости БАЛ. У людей пероральное введение БЦЖ у небольшой группы добровольцев приводило к увеличению титров анти-LAM IgA в слезах. Идентификатор. Вакцинация БЦЖ повышала уровни LAM-специфических IgG в сыворотке, что коррелировало с опсонизацией и бактерицидным действием макрофагов и повышенными уровнями антител IgG к гликолипидам Mtb у вакцинированных медицинских работников (обзор в [8]).
Идентификатор. Вакцинация БЦЖ повышала уровни LAM-специфических IgG в сыворотке, что коррелировало с опсонизацией и бактерицидным действием макрофагов и повышенными уровнями антител IgG к гликолипидам Mtb у вакцинированных медицинских работников (обзор в [8]).
Несмотря на вышеупомянутые исследования, до сих пор неясно, в какой степени различные классы антител способствуют защите хозяина. В последнем исследовании, проведенном Irvine et al., было показано, что антитела IgG и IgM, выделенные из ЖБАЛ макак, вакцинированных БЦЖ, опсонизируют Mtb и усиливают поглощение бактерий макрофагами in vitro [2]. Интересно, что они обнаружили, что высокоаффинные LAM-специфические IgM-антитела ограничивали рост Mtb в цельной крови, но не только в макрофагах [2], вероятно, отражая вклад активации комплемента в опсонизацию и внутриклеточное уничтожение (рис. 1).
Рис. 1
Предполагаемые механизмы действия Mtb -специфических IgM-антител, продукция которых индуцируется вакцинацией БЦЖ. Вакцина БЦЖ, введенная внутривенно. индуцирует выработку антител IgM, специфичных ко многим различным антигенам Mtb , включая LAM. B Mtb антиген-специфические IgM-антитела опсонизируют бациллы Mtb и активируют классический путь комплемента, что приводит к опсонизации с C3b. С Mtb бациллы, которые в достаточной степени покрыты этими лигандами, полученными из сыворотки, связываются с CR1, и D впоследствии подвергаются фагоцитозу макрофагами в мембраносвязанных фагосомах для внутриклеточного уничтожения
Вакцина БЦЖ, введенная внутривенно. индуцирует выработку антител IgM, специфичных ко многим различным антигенам Mtb , включая LAM. B Mtb антиген-специфические IgM-антитела опсонизируют бациллы Mtb и активируют классический путь комплемента, что приводит к опсонизации с C3b. С Mtb бациллы, которые в достаточной степени покрыты этими лигандами, полученными из сыворотки, связываются с CR1, и D впоследствии подвергаются фагоцитозу макрофагами в мембраносвязанных фагосомах для внутриклеточного уничтожения
Изображение полного размера
мышиных моноклональных антител выявили эффективность анти-Acr1 IgA, но не анти-PstS1-антител [4]. Предлагаемые механизмы учитывали внеклеточное взаимодействие с Mtb с последующим FcαR-опосредованным внутриклеточным бактерицидным действием в фагосомах макрофагов, возможно, с участием галектина 3, а не блокадой инфекции. Эта интерпретация также подтверждается наблюдаемым иммуномодулирующим влиянием цитокинов из разных субпопуляций Т-клеток, т. е. синергическим действием рекомбинантного интерферона-γ и анти-ИЛ-4 [5]. Примечательно, что было обнаружено, что пассивная защита моноклональным IgA ограничивается легкими, не влияет на распространение инфекции в селезенку и не может быть коррелирована с его активностью при инфицировании изолированных макрофагов. Однако в других исследованиях с использованием анализов инфекции in vitro пассивная защита мышей поликлональными сывороточными антителами от латентно инфицированных медицинских работников была связана с различными профилями гликозилирования антител [9].]. Возможная роль антиген-специфических антител Acr1, по-видимому, также связана с их избирательным присутствием при латентном ТБ [7] и их повышенными уровнями при внутривенном введении. Вакцинированные БЦЖ макаки [2].
е. синергическим действием рекомбинантного интерферона-γ и анти-ИЛ-4 [5]. Примечательно, что было обнаружено, что пассивная защита моноклональным IgA ограничивается легкими, не влияет на распространение инфекции в селезенку и не может быть коррелирована с его активностью при инфицировании изолированных макрофагов. Однако в других исследованиях с использованием анализов инфекции in vitro пассивная защита мышей поликлональными сывороточными антителами от латентно инфицированных медицинских работников была связана с различными профилями гликозилирования антител [9].]. Возможная роль антиген-специфических антител Acr1, по-видимому, также связана с их избирательным присутствием при латентном ТБ [7] и их повышенными уровнями при внутривенном введении. Вакцинированные БЦЖ макаки [2].
Поскольку легкие являются местом проникновения инфекции Mtb и реактивации заболевания у взрослых, особое внимание уделяется вакцинации против иммунитета слизистой оболочки легких. Защита путем интраназальной (интраназальной) вакцинации с использованием рекомбинантных генных конструкций была приписана IgA или IL-10, секретируемым клетками Th27 [10]. Обнаружение более высоких уровней антител в жидкости БАЛ после эндобронхиального или внутривенного введения. введение вакцины предполагало, что глубокая легочная, а не интраназальная (интраназальная) или внутрикожная. локализация доставки антигена необходима для эффективной противотуберкулезной вакцинации. Локализованный в легких защитный иммунитет был приписан клеткам Th27 после и.н. введение конструкций рекомбинантной ДНК или рекрутирование и удержание защитных Т-клеток CD8. Защита по и.н. пассивная вакцинация моноклональными антителами IgA включала провоспалительный CD89Рецептор IgA на макрофагах, который может передавать бактерицидные сигналы против внутриклеточного Mtb [11]. Интересно, однако, что бактерицидный эффект полученных из БАЛ FcγR2A-связывающих и активирующих NK-клетки антител при в/в. Макаки, вакцинированные БЦЖ, были продемонстрированы при использовании макрофагов, полученных из жидкости БАЛ, но не полученных из моноцитов Mtb , инфицированных in vitro [2].
Обнаружение более высоких уровней антител в жидкости БАЛ после эндобронхиального или внутривенного введения. введение вакцины предполагало, что глубокая легочная, а не интраназальная (интраназальная) или внутрикожная. локализация доставки антигена необходима для эффективной противотуберкулезной вакцинации. Локализованный в легких защитный иммунитет был приписан клеткам Th27 после и.н. введение конструкций рекомбинантной ДНК или рекрутирование и удержание защитных Т-клеток CD8. Защита по и.н. пассивная вакцинация моноклональными антителами IgA включала провоспалительный CD89Рецептор IgA на макрофагах, который может передавать бактерицидные сигналы против внутриклеточного Mtb [11]. Интересно, однако, что бактерицидный эффект полученных из БАЛ FcγR2A-связывающих и активирующих NK-клетки антител при в/в. Макаки, вакцинированные БЦЖ, были продемонстрированы при использовании макрофагов, полученных из жидкости БАЛ, но не полученных из моноцитов Mtb , инфицированных in vitro [2].
Новый подход к иммунотерапии туберкулеза антителами основан на лигандах моноклональных однодоменных антител со специфичностью, подобной Т-клеточному рецептору (TCR). В отличие от комбинированной сайт-специфичности обычных антител, имитация распознавания TCR пептидных эпитопов в комплексе с молекулами HLA класса I нацелена на поверхность Mtb — инфицированные клетки. Выбор таких реагентов основывался на предварительном знании иммунодоминантных эпитопов репертуара T-клеток CD8 человека. С использованием технологий библиотеки фагового дисплея были отобраны однодоменные клоны (нанотела), узнающие эпитопы на антигенах Acr1 и Ag85B [12,13,14,15]. Эти лиганды антител все еще нуждаются в модификации в «иммунотоксины» после конъюгации, например, с подходящими лигандами, индуцирующими апоптоз, чтобы стать микобактерицидными, с возможностью разработки в качестве дополнения к химиотерапии ТБ или для предотвращения реактивации спящих в активные. ТБ. Опыт работы с технологиями, связанными с легким производством этих стабильных лигандов небольшого размера (15 кДа) с низкой иммуногенностью, также получен из недавних исследований рака, вирусных инфекций и других заболеваний.
В заключение мы считаем, что будущие исследования туберкулеза человека должны учитывать следующие два аспекта. Во-первых, ввиду иммунорегуляторного влияния цитокинов на пассивную IgA-иммунотерапию эффекторные действия тех же антител после активной вакцинации могут быть отрицательно модулированы цитокинами, секретируемыми Th3-клетками, что способствует индукции соответствующего В-клеточного ответа. Это представляет собой существенный аспект, основанный на интерпретации данных исследований пассивной и активной вакцинации. Во-вторых, поскольку активный туберкулез легких у взрослых людей возникает в виде реактивации у меньшинства (~ 5%) латентно инфицированных субъектов, необходимо проверить эффективность любых вакцин-кандидатов для защиты на животных моделях, оценивая реактивацию дремлющей инфекции, а не просто бактериальная нагрузка первичного 9Инфекция 0115 Mtb . Это приведет к значительному увеличению стоимости, рабочей нагрузки и продолжительности исследований, что, вероятно, способствовало отказу от такого тестирования в подавляющем большинстве прошлых исследований по разработке вакцин.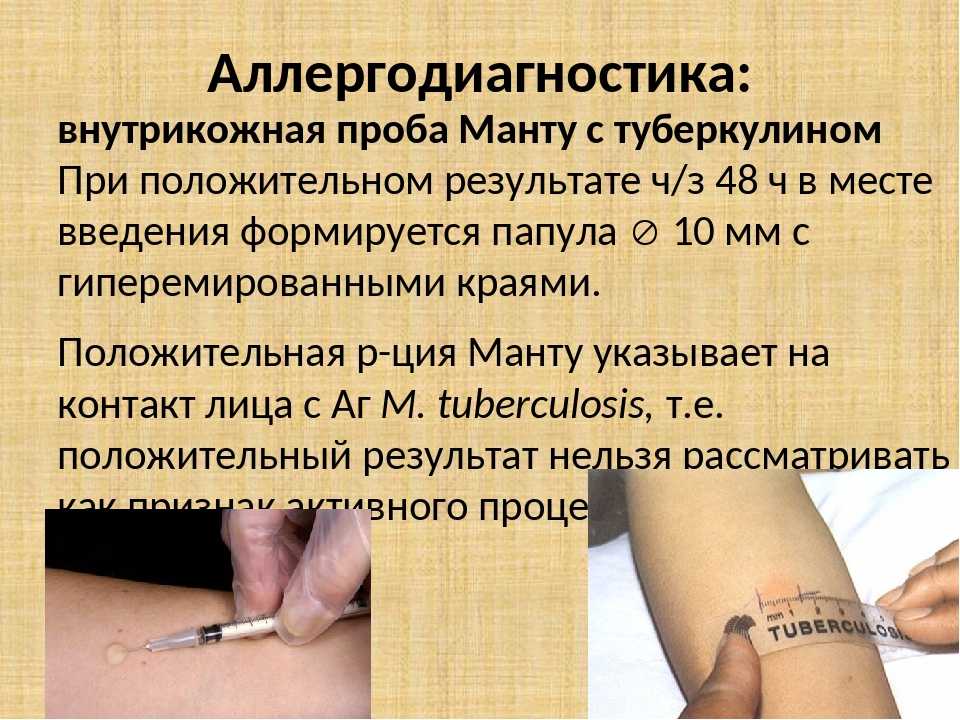
Ссылки
Ivanyi J. Вакцинация против туберкулеза необходима, чтобы избежать ложных иммунных реакций. Туберкулез (Эдинб). 2021;126:102021. https://doi.org/10.1016/j.tube.2020.102021
Статья
КАСGoogle ученый
Ирвин Э.Б., О’Нил А., Дарра П.А., Шин С., Чоудхари А., Ли В. и др. Устойчивый ответ IgM после внутривенной вакцинации бациллой Кальметта-Герена ассоциируется с предотвращением заражения микобактериями туберкулеза у макак. Нат Иммунол. 2021; 22: 1515–23. https://doi.org/10.1038/s41590-021-01066-1
Статья
КАС
пабмед
ПабМед ЦентральныйGoogle ученый
Родригес А., Тьярнлунд А., Ивани Дж., Сингх М., Гарсия И., Уильямс А. и др. Роль IgA в защите от респираторных инфекций. Мыши с дефицитом IgA проявляли повышенную восприимчивость к интраназальным инфекциям с помощью Mycobacterium bovis БЦЖ.
 вакцина. 2005; 23: 2565–72.
вакцина. 2005; 23: 2565–72.Артикул
Google ученый
Релич Р., Иваний Ю. Случай пассивной иммунопрофилактики туберкулеза. Ланцет Infect Dis. 2006; 6: 813–818. https://doi.org/10.1016/S1473-3099(06)70658-2
Статья
пабмедGoogle ученый
Буккери С., Релич Р., Каккамо Н., Меравилья Н., Ивани Дж., Салерно А. и др. Профилактика постхимиотерапевтического рецидива туберкулезной инфекции комбинированной иммунотерапией. Туберкулез (Эдинб). 2009 г.;89:91–94. https://doi.org/10.1016/j.tube.2008.09.001
Статья
КАСGoogle ученый
Tran AC, Diogo GR, Paul MJ, Copland A, Hart P, Mehta N, et al. Мукозальная терапия туберкулеза с множественной лекарственной устойчивостью с помощью IgA и интерферона-γ. Фронт Иммунол. 2020;11:582833. https://doi.
 org/10.3389/fimmu. 2020. 582833
org/10.3389/fimmu. 2020. 582833Артикул
КАС
пабмед
ПабМед ЦентральныйGoogle ученый
Ботамли Г.Х., Радд Р., Фестенштейн Ф., Ивани Дж. Клиническое значение измерения M. tuberculosis -специфического антитела при туберкулезе легких. грудная клетка. 1992; 47: 270–75. https://doi.org/10.1136/thx.47.4.270
Статья
КАС
пабмед
ПабМед ЦентральныйGoogle ученый
Герман С, Кинг К.Г. Туберкулёз или не быть: какие особенности и влияние имеют антитела при туберкулёзе? Оксф Опен Иммунол. 2021; 2:1–10. https://doi.org/10.1093/oxfimm/iqab015
Артикул
Google ученый
Li H, Wang XX, Wang B, Fu L, Liu G, Lu Y и др. Латентно и неинфицированные медицинские работники, подвергшиеся воздействию туберкулеза, вырабатывают защитные антитела против Mycobacterium tuberculosis .
 Proc Natl Acad Sci USA. 2017;114:5023–8. https://doi.org/10.1073/pnas.1611776114
Proc Natl Acad Sci USA. 2017;114:5023–8. https://doi.org/10.1073/pnas.1611776114Статья
КАС
пабмед
ПабМед ЦентральныйGoogle ученый
Дейкман К., Сомбрук К.С., Вервенн Р.А.В., Хофман С.О., Бут С., Ремарк Э.Дж. и др. Профилактика туберкулезной инфекции и заболевания местной БЦЖ у многократно контактировавших с макаками резусов. Нат Мед. 2019;25:255–62. https://doi.org/10.1038/s41591-018-0319-9
Статья
КАС
пабмедGoogle ученый
Balu S, Reljic R, Lewis MJ, Pleass RJ, McIntosh R, van Kooten C, et al. Новое моноклональное антитело IgA человека защищает от туберкулеза. Дж Иммунол. 2011; 186:3113–19. https://doi.org/10.4049/jimmunol.1003189
Статья
КАС
пабмедGoogle ученый
Дасс С.А., Норазми М.Н., Домингес А.
 А., Сармьенто Гарсия Сан Мигель М.Е., Тай Г.Дж. Получение Т-клеточного рецептора (TCR)-подобного однодоменного антитела (sDAb) против белка теплового шока (HSP) Mycobacterium tuberculosis (Mtb) 16 кДа, представленного антигеном лейкоцитов человека (HLA)-A*02. Мол Иммунол. 2018;101:189–96. https://doi.org/10.1016/j.molimm.2018.07.001
А., Сармьенто Гарсия Сан Мигель М.Е., Тай Г.Дж. Получение Т-клеточного рецептора (TCR)-подобного однодоменного антитела (sDAb) против белка теплового шока (HSP) Mycobacterium tuberculosis (Mtb) 16 кДа, представленного антигеном лейкоцитов человека (HLA)-A*02. Мол Иммунол. 2018;101:189–96. https://doi.org/10.1016/j.molimm.2018.07.001Артикул
КАС
пабмедGoogle ученый
Дасс С.А., Норазми М.Н., Акоста А., Сармиенто М.Е., Тай Г.Дж. Антитело с TCR-подобным доменом против антигена белка теплового шока Mycobacterium tuberculosis (Mtb), представленного HLA-A*11 и HLA-A*24. Int J Биол Макромоль. 2020;155:305–14. https://doi.org/10.1016/j.ijbiomac.2020.03.229
Статья
КАС
пабмедGoogle ученый
Дасс С., Балакришнан В., Арифин Н., Лим CSY, Нордин Ф., Тай Г.Дж. Синдемия COVID-19/туберкулеза и потенциальная терапия антителами для лечения туберкулеза на основе уроков, извлеченных из пандемии.
 Фронт Иммунол. 2022;13:833715. https://doi.org/10.3389/fimmu.2022.833715.
Фронт Иммунол. 2022;13:833715. https://doi.org/10.3389/fimmu.2022.833715.Артикул
КАСGoogle ученый
Ortega PA, Silva-Miranda M, Torres-Larios A, Campos-Chávez E, Franken KCLCM, Ottenhoff THM, et al. Выбор однодоменного антитела, специфичного к HLA-связанному эпитопу микобактериального антигена Ag85B. Фронт Иммунол. 2020;11:577815. https://doi.org/10.3389/fimmu.2020.577815
Артикул
КАС
пабмед
ПабМед ЦентральныйGoogle ученый
Скачать ссылки
Благодарности
Это исследование было поддержано институциональными фондами Университета Палермо.
Информация об авторе
Авторы и организации
Центральная лаборатория расширенной диагностики и биомедицинских исследований (CLADIBIOR), Университет Палермо, Палермо, Италия
Francesco Dieli
Факультет биомедицины, неврологии и расширенной диагностики Университета Палермо, Палермо, Италия
Francesco Dieli
Center for Host-Microbiome Interactions, UK 9028 Campus of Kings of Juraj Ivanyi
Авторы
- Francesco Dieli
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Академия - Юрай Иваны
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar
Авторы, переписывающиеся
Переписка с
Франческо Диели или Юрай Ивани.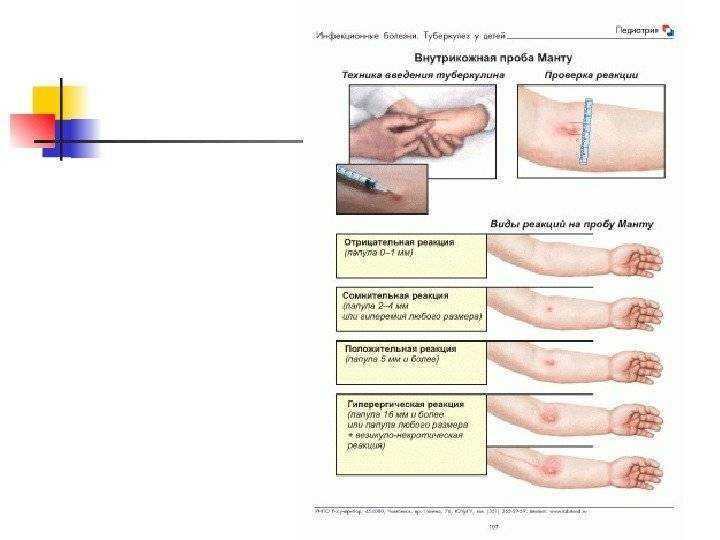


 вакцина. 2005; 23: 2565–72.
вакцина. 2005; 23: 2565–72.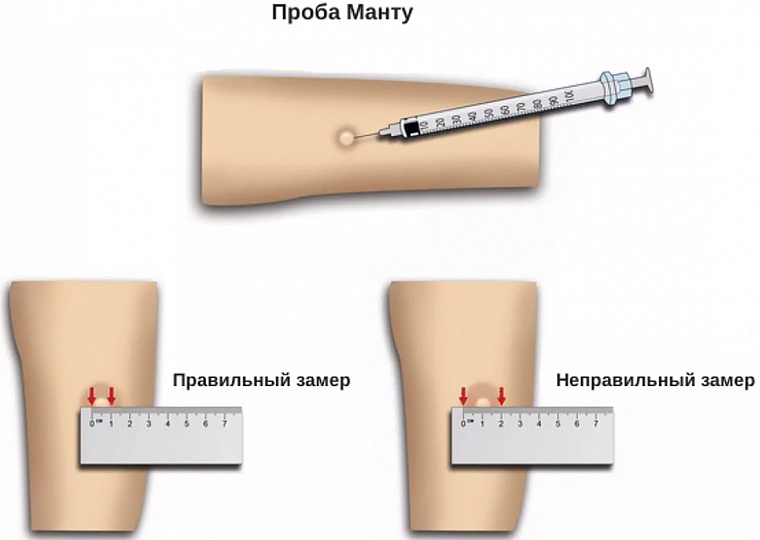 org/10.3389/fimmu. 2020. 582833
org/10.3389/fimmu. 2020. 582833 Proc Natl Acad Sci USA. 2017;114:5023–8. https://doi.org/10.1073/pnas.1611776114
Proc Natl Acad Sci USA. 2017;114:5023–8. https://doi.org/10.1073/pnas.1611776114 А., Сармьенто Гарсия Сан Мигель М.Е., Тай Г.Дж. Получение Т-клеточного рецептора (TCR)-подобного однодоменного антитела (sDAb) против белка теплового шока (HSP) Mycobacterium tuberculosis (Mtb) 16 кДа, представленного антигеном лейкоцитов человека (HLA)-A*02. Мол Иммунол. 2018;101:189–96. https://doi.org/10.1016/j.molimm.2018.07.001
А., Сармьенто Гарсия Сан Мигель М.Е., Тай Г.Дж. Получение Т-клеточного рецептора (TCR)-подобного однодоменного антитела (sDAb) против белка теплового шока (HSP) Mycobacterium tuberculosis (Mtb) 16 кДа, представленного антигеном лейкоцитов человека (HLA)-A*02. Мол Иммунол. 2018;101:189–96. https://doi.org/10.1016/j.molimm.2018.07.001 Фронт Иммунол. 2022;13:833715. https://doi.org/10.3389/fimmu.2022.833715.
Фронт Иммунол. 2022;13:833715. https://doi.org/10.3389/fimmu.2022.833715.